Клиническая фармакология и фармакотерапия в реальной врачебной практике : мастер-класс : учебник / В. И. Петров. - 2011. - 880 с. : ил.
|
|
|
|
Глава 2. ДОКАЗАТЕЛЬНАЯ МЕДИЦИНА В СИСТЕМЕ ПОДГОТОВКИ ВРАЧА-СПЕЦИАЛИСТА. БАЗИСНЫЕ ПРИНЦИПЫ И МЕТОДОЛОГИЯ
Клиническая фармакология, на мой взгляд - царица всех медицинских наук не только потому, что я сам являюсь клиническим фармакологом, но и потому, что она вбирает в себя самые важные достижения современной медицины. Одним из таких достижений служит методология сбора, оценки и применения доказательств - доказательной медицины. И, разумеется, эта методология должна занимать свое достойное место в преподавании нашей дисциплины.
Согласно одному из распространенных определений, доказательная медицина - это добросовестное, точное и осмысленное использование лучших результатов клинических исследований для выбора лечения конкретного больного (Sackett D.L. et al, 1996).
Интересно отметить, что потребность в профессиональной медицинской информации возникает у врача до 60 раз в неделю (или дважды на каждых трех пациентов) и может влиять на принятие как минимум восьми решений ежедневно.
Реальная клиническая практика всегда испытывает некоторое затруднение в ответе на вопрос: что важнее для принятия клинического решения - рекомендации, составленные по результатам клинических исследований или врачебное мышление и опыт применительно к каждому конкретному пациенту? Ответ на этот вопрос многим критикам концепции ДМ покажется противоречивым (рис. 2).
Однако, как ни парадоксально, именно представленная на рисунке «триада» наиболее полно характеризует современный взгляд на доказательную медицину.
Грамотный клиницист всегда использует и личный клинический опыт и наиболее современные, доказательные данные медицинской науки одновременно и никогда порознь.
Совершенно очевидно, что ориентация только на данные доказательной медицины, без учета личного опыта и особенностей конкрет-
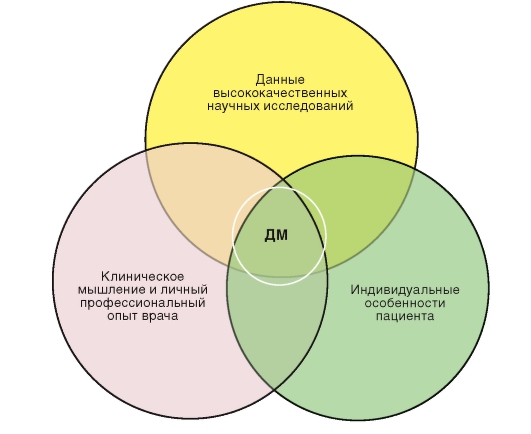
Рис. 2. «Триада» медицины, основанной на доказательствах
ного пациента, может стать причиной ошибок в ведении больного. В то же время, ориентация сугубо на личный опыт приводит к тому, что пациент перестает получать наиболее современное и эффективное лечение, что также наносит вред его здоровью.
Внедрение и грамотное использование принципов доказательной медицины несет в себе ряд вполне объективных преимуществ (рис. 3).
Согласно современным квалификационным характеристикам, правильно обученный врач обязан, во-первых, уметь отличить доказательную информацию от информации описательной или попросту рекламной. Во-вторых, он должен стремиться использовать в своей повседневной практике только те медицинские вмешательства, которые имеют хорошую доказательную базу.
Решение этих задач невозможно без знания алгоритма поиска качественной медицинской информации, а также навыков ее последующей
экстраполяции применительно к конкретной клинической ситуации (рис. 4).
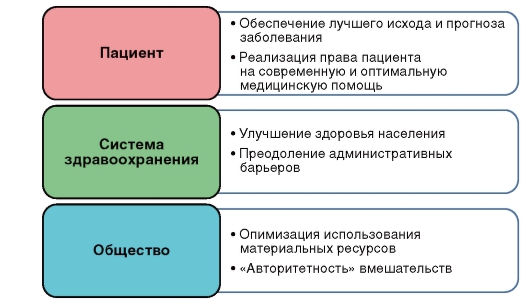
Рис. 3. Задачи медицины, основанной на доказательствах
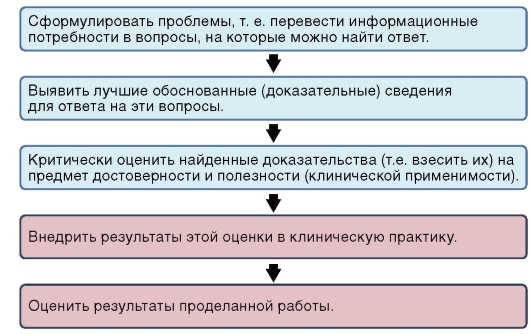
Рис. 4. Этапы поиска и применения научно обоснованной информации. При этом последние два пункта считаются наиболее трудно реализуемыми
Таким образом, успех этого поиска во многом будет зависеть от способности врача четко формулировать вопрос, ответ на который он стремиться найти. Кроме того, выявление наиболее ценных сведений невозможно без наличия доступа к современным источникам медицинской информации, ведущим журналам и электронным базам данных. К счастью, более легкий путь существует. Значительно сократить время поиска и помочь практикующим врачам быть в курсе наиболее важных тенденций мировой медицины призваны клинические рекомендации, создаваемые профессиональными сообществами.
Клинические руководства (рекомендации) (Clinical Guidelines) - систематически разрабатываемые положения, помогающие принимать правильные решения относительно врачебной тактики при определенных клинических обстоятельствах.
В 2002 году методология разработки клинических руководств разработана ВОЗ, тогда же была образована Международная сеть разработчиков клинических руководств - Guidelines International Network (GIN), в которую вошли 42 организации из 23 стран. Основная цель рекомендаций ясна - повысить качество лечения пациентов. Однако они могут приносить пациентам не только пользу, но и вред. Происходить это может по ряду причин:
1) доказательства того, что именно необходимо рекомендовать, часто недостаточны;
2) полученные на основании исследований данные могут интерпретироваться неправильно;
3) у разработчиков может оказаться недостаточно возможностей и опыта, чтобы проверить все доказательства;
4) рекомендации могут быть подвержены влиянию мнений, опыта и состава группы разработчиков.
В связи с этим возникла необходимость создания унифицированной системы оценки качества клинических рекомендаций. Для составления объективного представления о качестве клинических рекомендаций был предложен структурированный международный Опросник по экспертизе и аттестации - AGREE (Appraisal of Guidelines Research and Evaluation), состоящий из шести разделов (рис. 5).
Опросник AGREE позволяет оценить:
• открытость и прозрачность процесса разработки рекомендаций;
• согласованность интересов и возможностей потребителей, покупателей и производителей медицинских услуг;
• степень соответствия рекомендованных лечебно-диагностических и профилактических методов и технологий современному состоянию медицинской науки;

Рис. 5. Разделы опросника AGREE
• объективность и надежность сведений;
• выбор наиболее эффективных медицинских технологий с точки зрения затрат.
Главное свойство клинических рекомендаций высокого методологического качества - связь между каждым утверждением и научными фактами. Каждой рекомендации присваивают определенный уровень доказательности, чтобы можно было отличить более надежные от менее надежных утверждений. Важно понять, что уровень доказательности рекомендации не отражает ее ценность для практики, а лишь подчеркивает надежность лежащих в ее основе научных фактов, т.е. вероятность достижения желаемого результата в случае применения рекомендации. Уровень доказательности рекомендации определяется следующими факторами:
1) тип (структура) исследования (чаще всего оптимальной структурой является РКИ);
2) число исследований и общее количество включенных больных (часто нужен мета-анализ);
3) однородность результатов (оптимально, когда все результаты однонаправленные);
4) клиническая значимость эффекта и его вариации (оптимально, когда доверительный интервал узок);
5) применимость (экстраполируемость) результатов исследования к интересующей популяции.
На рисунке 6 представлена упрощенная шкала уровней доказательности, разработанная Оксфордским Центром доказательной медицины (Oxford Centre for Evidence-Based Medicine).
А на рисунке 7 - соотношение уровней доказательности и градаций рекомендаций.
Определено следующее разделение рекомендаций по градациям доказательности (рис. 8).
В настоящее время не достигнуто согласия между различными разработчиками КР относительно единой универсальной шкалы дока-

Рис. 6. Уровни доказательности
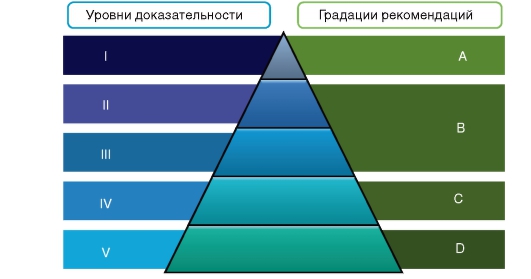
Рис. 7. Соотношение уровней доказательности и градаций рекомендаций (Oxford Centre for Evidence-Based Medicine)
зательности. Каждый из существующих подходов имеет свои преимущества и недостатки. В нашей стране получила распространение более расширенная шкала оценки уровня доказательств, разработанная шотландской межколлегиальной сетью разработчиков клинических руководств SIGN (Scottish Intercollegiate Guidelines Network) (рис. 9).
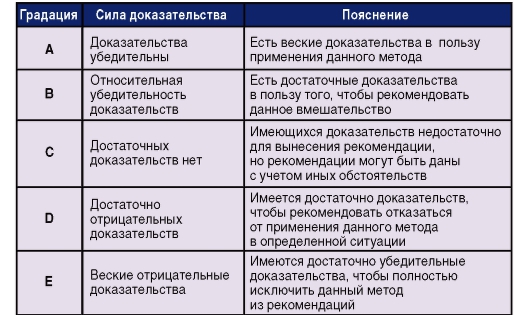
Рис. 8. Градации доказательности рекомендаций
Оценка возможного вклада конкретного исследования в развитие медицинской науки требует значительных усилий, нежели это необходимо согласно приведенной иерархии доказательств. Следует помнить, что невысокий уровень доказательности - не всегда является свидетельством ненадежности рекомендации. При ранжировании исследований и оценке их относительного вклада в принятии решений необходимо использовать не только иерархию типов исследований, но и суждения, основанные на здравом смысле.
Распространенное заблуждение не самых грамотных врачей о том, что доказательная медицина способна заменить собой клиническое мышление (а порою и вовсе необходимость думать!) позволим себе проиллюстрировать поучительным анекдотом.
Врач звонит в Центр доказательной медицины с вопросом: «Насколько эффективны парашюты при спасении из самолета, терпящего крушение?». После долгих дискуссий из Центра ДМ пришел ответ: «Мы не знаем! РКИ, в которых бы сравнивались прыжки с парашютом и прыжки без него еще не проводились.»
Важно запомнить. Клинические рекомендации предназначены для того, чтобы оказать помощь в формировании клинического суждения, а не для его замены. Они не предоставляют готовые ответы на все клинические вопросы и не гарантируют успешный клинический
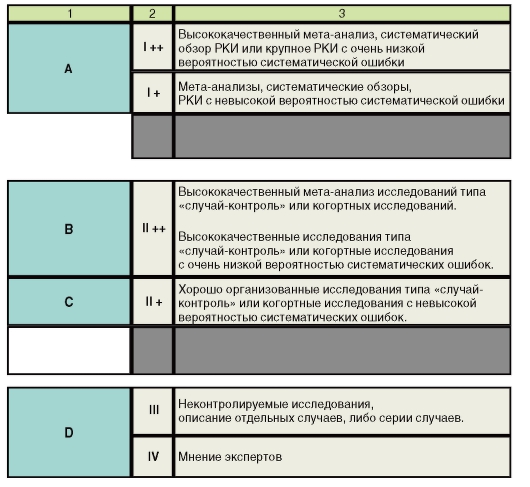
Примечание.
1 - градация рекомендации;
2 - уровень доказательности с указанием методологического качества;
3 - тип исследований.
* Исследования с высокой вероятностью систематической вообще не должны рассматриваться в качестве доказательсва рекомендации любого уровня.
Рис. 9. Шкала доказательности рекомендаций SIGN
исход в каждом случае. Кроме того, одно из самых частых заблуждений врачей заключается в отнесении данных шкал только к лекарственной терапии. Это не так! Критерии доказательности могут быть применены к любым видам медицинских вмешательств (хирургическим, физиотерапевтическим, диагностическим, профилактическим и т.д.).
Систематические обзоры и мета-анализы. Другим важным помощников врачей являются систематические обзоры и, в частности, наиболее распространенный их тип - мета-анализ. Рассмотрим их более подробно.
Систематический обзор - это обобщение анных по одной частной четко сформулироанной проблеме с использованием систематиеских и точных методов поиска, отбора и криической оценки исследований, относящихся к теме обзора, а также дальнейшим анализом ведений в него включенных.
Систематические обзоры являются одной из наиболее важных инструментов доказательной медицины, позволяя практикующему врачу разобраться в беспрерывном и нарастающем потоке медицинской информации. Для анализа и обобщения результатов исследований, вклюенных в обзор, могут, как использоваться, так и не использоваться статистические методы.

Арчи Кокран (Archy Cochrane, рис. 10), английский врач-эпидемиолог впервые предложил широко использовать мета-анализ как основу алгоритма поиска и обобщения результатов публикуемых клинических исследований.
В 1992 г. организовано Кокрановское сотрудничество - международная некоммерческая организация, целью которой является помощь в принятии основанных на достоверной информации клинических решений путем разработки высококачественных систематических обзоров о пользе и риске медицинских вмешательств. Основной продукт работы сотрудничества - Кокрановская библиотека, содержащая крупнейшую базу данных систематических обзоров.
Преимущества систематических обзоров
• Объединение информации о нескольких исследованиях позволяет получить более объективное представление о клиническом эффекте анализируемого вмешательства по сравнению с отдельно взятым клиническим исследованием.
• Точные методы ограничивают вероятность систематической ошибки при поиске и исключении статей, что делает получаемые выводы более надежными.
• Медицинские работники, исследователи и организаторы легко получают доступ к большим объемам информации.
• Устраняется временной разрыв между научным открытием и внедрением эффективного диагностического или лечебного вмешательства.
• Количественные систематические обзоры (мета-анализы) повышают точность результата.
Мета-анализ - статистический анализ количественных результатов нескольких исследований, посвященных одному и тому же вопросу (количественный систематический обзор).
Результаты мета-анализа могут быть представлены в относительных и абсолютных показателях (рис. 11).
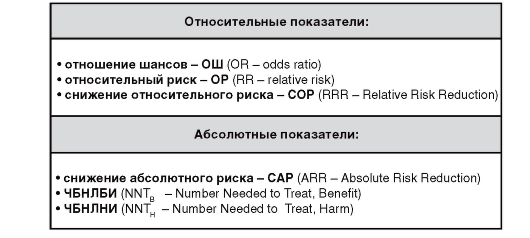
Рис. 11. Показатели, позволяющие оценить результаты мета-анализа
Дадим пояснения для каждого их них.
1. Отношение шансов (ОШ)
Шанс события - это вероятность того, что оно произойдет, в сравнении с вероятностью того, что оно не произойдет. Если принять вероятность события за P, то шанс того, что событие произойдет равен P/(1 - P). Чем ближе значение ОШ к 1, тем меньше различий в эффективности (безопасности) сравниваемых вмешательств.
2. Относительный риск (ОР)
Отношение частоты развития определенного исхода в группах сравнения. При ОР > 1 частота развития изучаемого исхода выше в основной группе, чем в контрольной. При ОР < 1 - ниже. При низкой частоте развития исхода этот показатель близок к отношению шансов.
3. Снижение относительного риска (СОР)
Снижение частоты событий в исследуемой группе (ЧСИГ) по сравнению с частотой событий в контрольной группе (ЧСКГ):

4. Снижение абсолютного риска (САР)
Абсолютная арифметическая разность между частоты событий в группах сравнения:

5. ЧБНЛБИ (равнозначно ЧБНЛ)
Число Больных, которых Нужно Лечить определенным методом в течение определенного времени, чтобы достичь Благоприятного Исхода или предотвратить неблагоприятный исход. Показатель всегда предполагает существование группы сравнения (референтной группы), в которой больные получают плацебо, либо другое лечение, либо вообще не получают его.
ЧБНЛ для определенного вмешательства является величиной, обратной САP при этом вмешательстве. Простота расчета позволяет использовать ЧБНЛ в качестве основного цифрового показателя эффективности (или потенциального вреда) анализируемого вмешательства.
6. ЧБНЛНИ
Число Больных, которых Нужно Лечить определенным методом в течение определенного времени для выявления дополнительного Неблагоприятного Исхода. Знание этого показателя позволяет более полно оценить степень риска вмешательства у конкретного пациента. Особую важность этот показатель приобретает при оценке целесообразности профилактического вмешательства.
Графическое представление результатов мета-анализа (блобограмма).
На рисунке 12 приведен пример мета-анализа, рассматривающего побочные эффекты со стороны печени при интенсивной терапии статинами по сравнению со стандартной схемой назначения у пациентов, перенесших острый коронарный синдром и пациентов со стабильной стенокардией. В качестве регистрируемого события было принято трехкратное (и более) повышение активности печеночных трансаминаз.
Результаты, полученные в каждом из исследований показаны на блобограмме (рис. 13) в виде квадратов. От каждого квадрата отходит горизонтальная линия, показывающая доверительный интервал (в данном случае он равен 95%) для зафиксированного в этом исследовании исхода.
Вертикальная линия по центру рисунка - линия «отсутствия различий», которая в данном случае соответствует отношению шансов 1,0 (рис. 13 - пояснения к блобограмме).
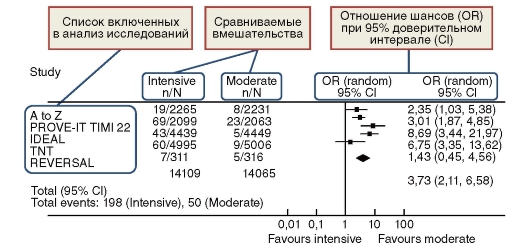
Рис. 12. Пример построение блобограмммы (J. Afilalo et al. Intensive statin therapy in acute coronary syndromes and stable coronary heart disease: a comparative meta-analysis of randomised controlled trials/ Heart. - 2007, V. 93. - P. 914-921, c изменениями)
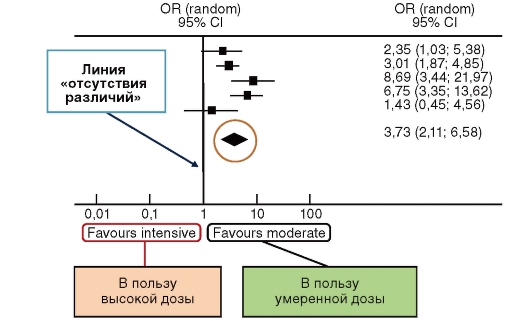
Рис. 13. Пример блобограммы
Если горизонтальная линия (доверительный интервал) результатов исследования не пересекает линию «отсутствия различий», то существует 95% вероятность того, что различия между сравниваемыми группами действительно существуют. Если же доверительный интервал результата пересекает вертикальную линию, это означает что:
1) либо нет достоверных различий между изучаемыми вмешательствами;
2) либо размер выборки недостаточен для определения истинного результата;
3) ромб отображает обобщенный результат всех анализируемых исследований. Ширина ромба отображает доверительный интервал для обобщенного результата;
4) поскольку ромб не пересекает линию «отсутствие различий», результат можно считать статистически значимым, т.е. назначение высоких доз статинов достоверно сопровождается повышенным риском развития побочных эффектов со стороны печени по сравнению с умеренными дозами.
Важно помнить, что в результате применения любого статистического метода мы получаем не истину в последней инстанции, а всего лишь оценку вероятности того или иного предположения! Целью мета-анализа является не только оценка эффективности/безопасности изучаемого вмешательства, но также выявление, изучение и объяснение неоднородности (гетерогенности) в результатах исследований и подгруппах пациентов. Для этого обязательным является проведение теста на статистическую гетерогенность χ2 (Хи-квадрат). Значение χ2 много большее, чем число испытаний в мета-анализе свительствует о том, что испытания отличаются друг от друга. При обнаружении существенных различий между исследованиями выводы мета-анализа можно поставить под сомнение.
Результаты мета-анализа имеют важное научное и практическое значение:
• являются источником объективной информации о современных методах диагностики, профилактики и лечения;
• служат основой при разработке формулярной систем, стандартов диагностики и лечения, научно-обоснованных рекомендаций;
• стимулируют проведение конкретных клинических исследований, так как формируют научную гипотезу и позволяют более точно определить объем планируемой выборки пациентов.
Представления об эффективности препаратов может изменяться по мере появления дополнительных данных после завершения крупных
рандомизированных контролируемых испытаний. Появляются новые данные и меняются результаты систематических обзоров. Поэтому в практической работе чрезвычайно важно использовать наиболее свежие из них. Систематические обзоры могут предоставлять объективную информацию, позволяющую пациенту и врачу прогнозировать эффективность и возможные последствия от конкретного вмешательства еще до начала лечения. При экстраполяции данных систематических обзоров врач прежде всего должен оценить степень его соответствия той группе пациентов, для которой выявлен положительный эффект вмешательства. Несомненно, что личный опыт врача и существующие стандарты лечения должны быть учтены при принятии окончательного решения.
Итак, доказательная медицина - это:
1) прикладная методология, возникшая в результате стремительного прогресса медицинской науки, нарастания объема знаний и информационного взрыва;
2) органичный синтез индивидуального опыта практикующего врача с результатами лучших научных исследований по оценке эффективности медицинских вмешательств.
При этом доказательная медицина не заменяет собой искусство врачевания и клиническое мышление врача, а наоборот улучшает качество и эффективность врачебной практики.
Завершая разговор о доказательной медицине, мы не имеем права не сказать, что всякая медаль имеет две стороны. Перефразируя известное выражение, уделим внимание «блеску и нищете современной доказательной медицины».
Международные клинические рекомендации, построенные на данных доказательной медицины, представляют собой основу клинической практики в большинстве государств мира. Без доказательств эффективности и безопасности ни одно лекарственное средство не может быть допущено к продаже на территории большинства современных государств. Клинические испытания лекарств в современном мире проводятся по согласованным общепринятым протоколам, обеспечивающим достаточный уровень доказательств эффективности и безопасности. Казалось бы, все работает как часы - о чем беспокоиться? Тем не менее, есть и другое лицо доказательной медицины.
Так, например, контроль над качеством проводимых клинических исследований - новая отдельная мировая проблема. Единство производителей и контролеров - не источник ли опасности и возможности
сговора? При прочтении некоторых медицинских статей иногда возникает ощущение, что доказать можно все, было бы знание правил сбора доказательств, хорошее финансирование, да достаточно большая выборка пациентов...
Клинические рекомендации и значимые решения в медицинской сфере принимаются на основании результатов, оплаченных производителями лекарств и оборудования. Мы с Вами постоянно сталкиваемся с противоречиями между тем, как лечить правильно, и как это предписывают различные методические рекомендации, а порой и национальные, законодательно утвержденные стандарты. Причина этого кроется в различиях интересов фармбизнеса и системы здравоохранения. Так что, конфликт интересов возможен? Да. Обязателен? Нет однозначного ответа.
Другая проблема. В клинической практике ряда государств применяются методы, не получившие однозначных доказательств в результате клинических исследований и последующих метаанализов (например, иглорефлексотерапия, мануальная терапия и т.д.). Надо ли отказаться от этих методов? Мировая практика знает негативные результаты некоторых поспешных решений.
Кроме того, известно, что ряд ЛС, не получивших определенных однозначных доказательств в результате клинических исследований (например, венотоники, препараты метаболического воздействия и другие), составляют основу лечения некоторых заболеваний. Надо ли отказаться от этих лекарств?
Сам по себе сбор доказательств сегодня - дорогостоящее мероприятие, доступное только крупному капиталу и, кстати, практически малодоступное государственному сектору.
Необходимо также отметить, что доказательная база сегодня - один из способов защиты коммерческих интересов одних структур (государств, национальных рынков) от других. Все очень сложно устроено, труднопреодолимо, очень дорого и, зачастую, представляет собой специально созданный барьер на пути новых лекарств. К слову, трудность преодоления этого барьера особо значима для наших собственных научных разработок в этой сфере, что озвучивается сегодня на самом высоком государственном уровне. (На рисунке 14 одна из московских развязок, понятных постоянно ездящим по ней москвичам и ставящая в тупик тех приезжих, кто не в курсе, как попасть на нужную дорогу).
Рис. 14. «Путь лекарств на рынок»