Клиническая фармакология и фармакотерапия в реальной врачебной практике : мастер-класс : учебник / В. И. Петров. - 2011. - 880 с. : ил.
|
|
|
|
Глава 1. КЛИНИКО-ФАРМАКОЛОГИЧЕСКИЕ ПОДХОДЫ К ВЫБОРУ И ПРИМЕНЕНИЮ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРИ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА
Ведущий симптом ИБС - это характерный болевой синдром. Чтобы успешно проводить дифференциальную диагностику и лечение болевого синдрома, врачу нужно хорошо знать патофизиологию боли и клиническую фармакологию препаратов для купирования болевого синдрома. Давайте вспомним.
1.1. КЛИНИКО-ФАРМАКОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА АНАЛЬГЕТИКОВ
Характеристика этих препаратов подробно описана в Национальном руководстве по клинической фармакологии профессором В.А. Батуриным и при изложении данного материала будет частично цитироваться данное руководство.
Ноцицептивная система
Боль или ноцицепция - неприятное сенсорное и эмоциональное ощущение, опосредованное воздействием опасного (потенциально опасного) повреждающего фактора. Основные причины острого болевого синдрома - это: повреждение кожи, слизистых оболочек, опорнодвигательного аппарата, внутренних органов; воспалительные реакции, реже - повреждение нервных волокон.
Характер и интенсивность боли определяются природой патологического процесса и совокупностью реакций между ноцицептивной и антиноцицептивной системами индивидуума. Согласно современной точке зрения, восприятие боли начинается с болевого воздействия на периферические болевые рецепторы (ноцицепторы). Выделяют мономодальные А-8 (механосенситивные, термосенситивные) и поли-
модальные С-ноцицепторы, реагирующие на механические, тепловые и химические раздражители, так называемые спящие ноцицепторы, которые активизируются только во время воспаления.
Болевой сигнал передается по чувствительным волокнам, которые представлены основными типами: А- и С-волокнами. А-волокна миелинизированные, импульсация в них опосредует восприятие первичной (коротколатентной, хорошо локализованной, качественно детерминированной) боли. В отличие от этого С-волокна включают тонкие немиелинизированные волокна с низкой скоростью проведения и отвечают за передачу вторичной (длиннолатентной, плохо локализованной, тягостной, тупой) боли, имеющей четкие негативные эмоциональные и вегетативные проявления.
С периферических ноцицепторов боль передается через ядра периферических афферентов, расположенных в спинномозговых ганглиях, далее через задние корешки в задний рог спинного мозга, где формируют латеральную и медиальную системы. Заднему рогу спинного мозга принадлежит роль нейрональной системы, регулирующей сенсорный вход и болевую чувствительность на сегментарном уровне.
Главной зоной восприятия, анализа и интеграции болевой чувствительности служит ретикулярная формация ствола мозга. Ноцицептивная импульсация, достигая ретикулярной формации, обеспечивает проявление эмоциональных и нейроэндокринных проявлений боли за счет функциональной связи с таламусом, гипоталамусом, базальными ядрами и лимбической системой. Окончательная переработка ноцицептивной импульсации в виде первичного восприятия, сенсорной дискриминации, формирования мотивационных и психодинамических ответных реакций на боль происходит в коре головного мозга.
В передаче ноцицептивного импульса принимают участие некоторые нейропептиды и активирующие (возбуждающие) кислоты, которые служат нейротрансмиттерами боли. К нейропептидам относятся: субстанция Р; пептид, ассоциированный с геном кальцитонина; вазоинтестинальный пептид, холецистокинин, ангиотензин. Наиболее важные возбуждающие аминокислоты - это глутаминовая и аспарагиновая.
Важнейший нейропептид - субстанция Р - синтезируется и высвобождается в периферических тканях и в задних рогах спинного мозга; при этом активируются рецепторы NK-1, что облегчает передачу болевого импульса. Субстанция Р вызывает сенситизацию ноцицепторов. Сенситизация рецепторов сопровождается снижением порога возбуждения, увеличением частоты импульсации, спонтанной активацией после прекращения стимуляции. При повреждении тканей происходит сенсити-
зация ноцицепторов за счет выброса гистамина, серотонина, брадикинина. Кроме того, фосфолипаза А2, воздействуя на фосфолипиды мембран клеток, приводит к образованию арахидоновой кислоты с трансформацией последней в простациклины, простагландин Е2 и лейкотриены.
Возбуждающие аминокислоты активируют NMDA- и неNMDA- рецепторные механизмы и вызывают центральную сенситизацию ноцицепторов. Такой вид сенситизации возникает за счет увеличения содержания простагландинов и оксида азота.
Антиноцицептивная система
Финальное ноцицептивное ощущение в коре головного мозга формируется под воздействием антиноцицептивной системы. Антиноцицептивная система начинает активизироваться, когда болевой импульс достигает ствола мозга и таламуса. При активации околоводопроводного серого вещества происходит угнетение восходящего ноцицептивного сигнала на сегментарном уровне. В спинном мозге передача ноцицептивного сигнала угнетается ретикулярной формацией ствола головного мозга при ее болевой стимуляции. Кроме этого также в угнетении болевой передачи участвует locus coeruleus. В настоящее время есть сведения о гипоталамоспинальной антиноцицептивной системе и системе зрительного бугра, однако контроль антиноцицептивных систем разного уровня осуществляется в соматосенсорной области коры головного мозга.
При проведении сигнала по ноцицептивной или нисходящей антиноцицептивной системам происходит стимулирование высвобождения эндогенных нейропептидов, которые взаимодействуют со специфическими опиоидными рецепторами и обеспечивают ограничение боли. Опиоидные рецепторы расположены на окончаниях С-волокон в заднем роге спинного мозга, в нисходящих ингибирующих путях от головного к спинному мозгу и в участках головного мозга, которые передают болевые сигналы. Существует три типа основных опиоидных рецепторов: μ-, κ- и δ-рецепторы. Основные типы опиоидных рецепторов подразделяются на подтипы, на каждый из которых действуют различные эндогенные и экзогенные опиаты.
Идентифицированы три основных типа нейропептидов, обладающих морфиноподобным действием: энкефалины, эндорфины и динорфины. Энкефалины обладают высоким аффинитетом к δ-рецепторам; β-эндорфины обладают тропностью к μ-и δ-опиатным рецепторам; динорфины А и В имеют высокий аффинитет к κ-рецепторам. В последнее время были открыты два новых эндогенных соединения: эндомор-
фин-1 и эндоморфин-2. Кроме того, в ограничении боли могут участвовать серотонин, норадреналин, γ-аминомасляная кислота (ГАМК), глицин, которые способны модулировать активность центральной нервной системы (ЦНС) и ингибировать ноцицептивный ответ.
Классификация боли
В зависимости от локализации источника боли, ее интенсивности, причины, длительности раздражения ноцицепторов, функционального состояния ноцицептивной и антиноцицептивной системы выделяют различные типы боли.
I. Транзиторная боль возникает при отсутствии значимого повреждения тканей (внутримышечная, внутривенная инъекция), быстро наступает и исчезает, четко локализована, интенсивность варьирует.
II. Острая боль - результат ноцицептивного воздействия (травма, заболевания, дисфункция мышц и внутренних органов). Острая боль представляет собой приспособительный сигнал о возможном, начинающемся или случившемся повреждении и предназначена для локализации источника боли и уменьшения повреждения тканей.
Острую боль разделяют на соматическую и висцеральную . Известны два типа соматической боли: поверхностная соматическая боль (возникает в результате повреждения кожи, подкожной клетчатки, слизистых оболочек, она четко локализована и хорошо описывается больным), глубокая соматическая боль (передается из мышц, сухожилий, суставов и костей; такая боль обычно хуже локализована и ощущается как тупая боль). Висцеральная боль возникает в результате заболеваний и повреждений внутренних органов и их оболочек. Известны 4 подтипа этого вида боли:
- истинная локализованная висцеральная;
- локализованная париетальная;
- иррадиирующая висцеральная;
- иррадиирующая париетальная.
III. Хроническая боль отличается сохранением ощущения боли по истечении времени, необходимого для нормального периода заживления. Хроническая боль возникает в результате периферического или центрального ноцицептивного воздействия. Основная причина возникновения хронической боли - это психологические механизмы, которые достаточно часто формируются на фоне недостаточной аналгезии в периоперационном периоде.
Для характеристики феноменов, связанных с контролем боли, в частности в анестезиологии, принят ряд терминов.
• Аналгезия - полное или частичное прекращение болезненных ощущений в результате фармакологического разрыва центростремительных путей боли. При аналгезии одновременно устраняются боль и болевое восприятие.
• Анестезия предполагает утрату всех видов чувствительности (в том числе и болевой). Так как боль может испытывать только человек, находящийся в сознании, то его выключение любым анестетиком избавляет пациента от ощущения боли, но не исключает ноцицептивную импульсацию и альгогенные реакции.
• Общая анестезия (наркоз, общее обезболивание) - выключение центральных механизмов восприятия различных раздражителей, в том числе устранение чувства боли и неприятного ощущения, вызванного болью, но не самой боли.
• Атараксия - отсутствие душевного беспокойства, состояние безразличия без потери сознания.
• Нейролепсия - состояние успокоенности, психоэмоциональной индифферентности к окружающей среде без потери сознания.
• Местная анестезия - локальное отсутствие ощущений и реакций на раздражение в области оперативного вмешательства или другой инвазивной манипуляции.
• Комбинированное обезболивание - последовательное использование двух средств для наркоза или более.
• Смешанное обезболивание - одновременное использование двух средств для наркоза или более.
• Многокомпонентный наркоз - использование в схеме анестезии, кроме средств для наркоза, мышечных релаксантов, анальгетиков, ганглиоблокирующих препаратов и др.
• Премедикация - этап анестезиологического пособия, создающий наиболее благоприятный фон для его проведения, предполагающий введение лекарственных средств непосредственно перед операцией.
• Вводный наркоз (индукция в наркоз) - этап анестезиологического пособия для достижения основных компонентов анестезиологического пособия.
• Основной наркоз (поддерживающий, главный) - этап анестезиологического пособия, проводимый на протяжении выполнения всей операции.
• Потенцированный наркоз - усиление действия основного компонента наркоза другим (например, местная анестезия + парентеральное введение наркотических анальгетиков).
• Ингаляционный наркоз - достигается путем вдыхания, ингаляции паров ингаляционных анестетиков и газов.
• Неингаляционный наркоз - достигается путем введения в организм нелетучих веществ. Выделяют внутривенный и внутримышечный наркоз.
Наркотические анальгетики
Препараты опия - наркотические анальгетики , издавна известны человечеству как обезболивающие средства. Сегодня группа опиоидных анальгетиков довольно многочисленна, механизмы их действия сравнительно хорошо изучены, фармакокинетика подробно исследована. В 70-е годы прошлого века были обнаружены опиоидные рецепторы и их эндогенные агонисты, что позволило раскрыть механизмы действия наркотических анальгетиков, по-новому классифицировать эти лекарственные средства.
Классификация
Выделяют агонисты, частичные агонисты и агонисты-антагонисты. При этом часть препаратов получают из опия, другие - синтетическим путем.
Фармакодинамика наркотических анальгетиков
Механизм действия наркотических анальгетиков связан с их способностью взаимодействовать с опиоидными рецепторами, подобно эндогенным лигандам. Выделяют несколько типов опиатных рецепторов: μ, δ, κ. Каждый из типов рецепторов может иметь подтипы (μ1, μ2, δ1, δ2). Рецепторы располагаются в отделах ЦНС, имеющих непосредственное отношение к передаче и анализу болевых сигналов. Высокая плотность рецепторов установлена в боковых рогах спинного мозга, таламусе, околоводопроводном сером веществе среднего мозга, в продолговатом мозге, некоторых ядрах гипоталамуса.
Были выделены эндогенные соединения, пептиды, с опиатоподобными свойствами, способные воздействовать на специфические рецепторы, они получили название эндорфины - эндогенные морфины. Наиболее близок к морфину по фармакологическим характеристикам р-эндорфин. Выделены также короткие пептиды: метэнкефалин и лейэнкефалин. Содержание этих соединений в различных отделах мозга увеличивается при болевом стрессе. Эндогенные опиоиды и лекарственные средства из группы наркотических анальгетиков
способны оказывать антиноцицептивное действие, заметно повышая порог восприятия боли за счет влияния на μ-, δ-, κ-рецепторы. При этом в действие этих соединений вовлекаются нейроны околоводопроводного серого вещества и вентральных отделов продолговатого мозга, которые оказывают тормозное нисходящее воздействие на пути передачи болевых сигналов на спинальном уровне.
Влияние наркотических анальгетиков на эмоциональную сферу связано с их действием на опиоидные рецепторы в лимбических структурах головного мозга.
Ведущий фармакологический эффект наркотических анальгетиков - их противоболевое действие, при этом длительно существующая хроническая боль ослабляется лучше, чем острое болевое воздействие. Понижается не только восприятие болевых воздействий, но и изменяется эмоциональная реакция на боль. Болевые ощущения могут не устраняться полностью, но оцениваются как менее актуальные.
При использовании морфина и других наркотических анальгетиков развивается эйфория, характеризующаяся чувством эмоциональной удовлетворенности, устранением страха, тревоги. Впрочем, у некоторых пациентов после введения морфина возможно развитие дисфории в виде страха, возбуждения, дискомфорта.
Для наркотических анальгетиков характерен седативный эффект в виде сонливости, снижения двигательной активности, ослабления концентрации внимания, безразличия. Выполнение мыслительных задач затрудняется. При увеличении дозы наступает глубокий сон.
Препараты угнетают функцию внешнего дыхания за счет прямого тормозного влияния на дыхательный центр и в результате снижения чувствительности нейронов дыхательного центра к повышению концентрации углекислого газа в крови. Именно высокое содержание СО2 обусловливает компенсаторное обеспечение функции дыхания, что особенно важно, например, при введении высоких доз морфина. Оксигенотерапия в этой ситуации, устраняя стимулирующее действие СО2, лишь углубляет положение, вплоть до развития апноэ. Умеренное снижение функции дыхания при введении терапевтических доз наркотических анальгетиков вполне компенсируется у большинства пациентов, однако у больных с патологией органов дыхания, хронической сердечной недостаточностью, повышенным внутричерепным давлением может развиваться тяжелая дыхательная недостаточность.
Влияние на кашлевой центр - хорошо известное свойство наркотических анальгетиков. Морфин, кодеин и некоторые другие препараты угнетают кашлевой рефлекс.
Влияние на рвотный центр связано с воздействием наркотических анальгетиков на хеморецепторную триггерную зону дна IV желудочка и имеют дозозависимый эффект: терапевтические дозы вызывают тошноту и рвоту, а избыточные - угнетают рвотный рефлекс.
Влияние на глаз в виде сужения зрачка регистрируется при введении всех агонистов опиоидных рецепторов. Миоз связан с влиянием наркотических анальгетиков на ядра III пары черепных нервов. При этом миоз относится к эффектам, к которым толерантность практически не развивается. При интоксикации морфином зрачки резко сужаются, становятся точечными и не реагируют на свет.
Морфин оказывает стимулирующее влияние на ядра блуждающего нерва, в связи с чем может развиваться брадикардия.
При использовании ряда наркотических анальгетиков (преимущественно фентанила) повышается рефлекторная возбудимость моторных нейронов спинного мозга, что проявляется увеличением тонуса скелетной мускулатуры. Ригидность дыхательных мышц может ухудшить функцию внешнего дыхания.
Морфин повышает тонус гладкой мускулатуры желудочнокишечного тракта, развивается спазм гладкомышечных сфинктеров, замедляется и ослабляется перистальтика, возможно развитие запора. Спазм сфинктера Одди вызывает резкое повышение давления в желчном пузыре, нарушение оттока желчи и панкреатического секрета.
Аналогичным образом усиливается тонус мочевыводящих путей, что ведет к острой задержке мочи у больных гиперплазией предстательной железы. Кроме того, наркотические анальгетики, вследствие активации образования антидиуретического гормона и уменьшения почечного кровотока, могут снижать диурез.
Большинство наркотических анальгетиков в терапевтических дозах существенно не влияют на сердечный ритм и артериальное давление, однако при введении морфина могут наблюдаться умеренная брадикардия и гипотензия.
Толерантность к наркотическим анальгетикам развивается при повторяющемся введении терапевтических доз препаратов. Наблюдается постепенное ослабление эффективности, и для достижения прежнего результата требуются все более высокие дозы. Клиническую значимость толерантность приобретает обычно через 2-3 нед ежедневного применения терапевтических доз препаратов. Она имеет перекрестный характер, впрочем, перекрестной толерантности не отмечается между агонистами и агонистами-антагонистами опиатных рецепторов.
Повторное использование наркотических анальгетиков приводит к развитию лекарственной зависимости. Скорость ее формирования и выра-
женность неодинаковы у различных препаратов. На первых этапах появляется психическая зависимость. Причина ее формирования - эйфория и седативный эффект. Постепенно развивается физическая зависимость. Она проявляется возникновением синдрома отмены (абстинентного синдрома) при прекращении введения наркотических анальгетиков.
Фармакокинетика наркотических анальгетиков
Наркотические анальгетики - алкалоиды опия (морфин и кодеин) сравнительно хорошо всасываются из места введения, однако проникновение в системный кровоток определяется не только всасыванием в желудочно-кишечном тракте, но и особенностями пресистемной элиминации. При первичном прохождении через печень препараты подвергаются метаболизму с образованием глюкуронидов, поэтому биологическая доступность при приеме внутрь может быть сравнительно низкой. Пресистемный метаболизм менее всего выражен у кодеина. Биодоступность морфина при приеме внутрь составляет 20%. При циррозе печени пресистемный метаболизм морфина нарушается.
Опиаты довольно слабо связываются с белками плазмы крови. Так, морфин связан на 35%, кодеин - всего на 7%. Морфин и кодеин сравнительно быстро распределяются из системного кровотока и поступают в ткани с хорошим кровотоком. Наибольшие концентрации отмечаются в легких, печени, почках, значительное количество препаратов может накапливаться в скелетной мускулатуре. Опиаты хорошо проходят через плацентарный барьер и выделяются с материнским молоком.
Наркотические анальгетики в печени подвергаются метаболизму с образованием парных соединений с глюкуроновой кислотой. Уже через 20 мин после введения морфина в крови обнаруживаются его глюкурониды.
Около 10% препарата выводится с мочой после клубочковой фильтрации в неизмененном виде. В моче следы морфина могут обнаруживаться в течение 48 ч, хотя 90% дозы препарата экскретируется в первые сутки. При нарушении выделительной функции почек активные метаболиты морфина, накапливаясь в организме, пролонгируют его эффекты у таких больных. Часть препарата вовлекается в гепатокишечную рециркуляцию.
Кодеин частично (10% от введенной дозы) превращается в ходе метаболизма в печени в морфин; неактивные метаболиты выводятся почками.
Тримеперидин (промедол) отличается хорошей биодоступностью, что обеспечивает анальгетический эффект как при приеме внутрь, так и при парентеральном введении. До 40% препарата связывается с бел-
ками плазмы крови. Большая часть подвергается метаболизму в печени путем гидролиза с последующей конъюгацией. Незначительное количество препарата выводится почками в неизмененном виде.
Фентанил имеет сравнительно малый период полувыведения - 2-4 ч. Препарат быстро перераспределяется из крови и мозга в мышечную и жировую ткань, что обеспечивает кратковременность эффекта. С белками плазмы крови связывается до 79% препарата. В печени происходит биотрансформация путем N-дезалкилирования и гидроксилирования. Несмотря на кратковременность действия, фентанил довольно медленно выводится из организма (за 3-4 сут с мочой выводится около 67% введенного препарата).
Буторфанол быстро проникает из места внутримышечного введения в системный кровоток. Наиболее высокая концентрация в крови достигается через 20-40 мин после инъекции. Подвергается метаболизму в печени и выводится с мочой в виде метаболитов. В неизмененном виде почками выделяется только 5% препарата. Проникает в грудное молоко. Период полувыведения буторфанола у лиц среднего возраста - 4,7 ч, а у пожилых пациентов - 6,6 ч. При нарушении выделительной функции почек период полувыведения увеличивается до 10 ч.
Трамадол при приеме внутрь хорошо всасывается - до 90% введенного количества. Биодоступность составляет 68% и увеличивается при повторных приемах препарата внутрь. Биодоступность несколько выше при использовании ректальных свечей - 80%. С белками плазмы крови трамадол связывается сравнительно слабо - около 20%. Препарат быстро и хорошо проникает в органы и ткани, проходит через плацентарный барьер, выделяется с грудным молоком. В печени трамадол подвергается биотрансформации путем деметилирования и конъюгации. При этом из 11 образующихся метаболитов только один обладает активностью. С мочой выводится около 90% введенного препарата, преимущественно в виде метаболитов, с калом - 10%.
Основные показания к применению наркотических
анальгетиков
Наркотические анальгетики, и в частности морфин, находят широкое применение как компонент анестезиологического пособия, для устранения интенсивной и постоянной боли в послеоперационном периоде, а также при таких состояниях, как инфаркт миокарда, переломы костей, ожоги. Морфин и фентанил могут быть использованы для спинномозговой и эпидуральной анестезии. Обезболивание имеет
сегментарный характер, системные побочные реакции сравнительно редки. Большинство наркотических анальгетиков используются в качестве средств, предупреждающих развитие болевого шока при травмах, остром инфаркте миокарда. Морфин находит применение для неотложного воздействия при острой левожелудочковой сердечной недостаточности. Его терапевтическое действие объясняется снижением возбуждения и подавлением патологической одышки.
Наркотические анальгетики необходимы для паллиативного воздействия у неоперабельных больных со злокачественными опухолями. В связи с появлением новых лекарственных форм морфина и других наркотических анальгетиков отдают предпочтение неинвазивным методам введения препаратов, пролонгированным формам кодеина и морфина. При умеренной боли рекомендуется дигидрокодеин, а при сильной боли - морфин (морфина сульфат) (таблетки с системой контролируемого высвобождения активного вещества).
Хороший обезболивающий эффект дает трансдермальная терапевтическая система, содержащая фентанил - дюрогезик матрикс. После ее аппликации достигается аналгезия длительностью до 72 ч. При прекращении приема препарата дюрогезик матрикс* следует помнить, что содержание фентанила в организме снижается постепенно, на 50% за 17 ч, поэтому переход к другим опиоидам должен быть осторожным, с постепенным повышением их дозы. При этом следует учитывать эквивалентность обезболивающих доз различных препаратов. Так, при внутримышечном введении 10 мг морфина эквивалентны 75 мг тримеперидина (промедол*), 130 мг кодеина, 0,3 мг бупренорфина, 100 мг трамадола.
Используется и противокашлевое действие наркотических анальгетиков. Обычно для этих целей применяют кодеин. Опиоидные анальгетики могут купировать диарею любого происхождения, однако сегодня для этих целей применяют иные препараты, например лоперамид.
Взаимодействие с лекарственными средствами
Наркотические анальгетики широко комбинируют с другими лекарственными средствами с целью усиления обезболивающего эффекта. Наиболее часто применяют комбинацию с нейролептическими средствами, например фентанил с дроперидолом, тримеперидин с дроперидолом. Анальгетический эффект наркотических анальгетиков усиливают бензодиазепиновые транквилизаторы. В последние годы обнаружено потенцирующее действие трициклических антидепрессантов в отношении противоболевого эффекта анальгетиков.
Сочетание тримеперидина с амитриптилином или имипрамином обеспечивает устранение боли у больных в послеоперационном периоде на 9-12 ч. Показана хорошая эффективность комбинации фентанила с трициклическими антидепрессантами у больных с длительным болевым синдромом при инфаркте миокарда. Важно, что гемодинамические расстройства при антидепраналгезии наблюдаются у таких пациентов реже, чем, например, при нейролептаналгезии.
Характеристика отдельных препаратов
Морфин
Фармакологические свойства
Морфин - агонист опиоидных рецепторов с преимущественным воздействием на рецепторы. Препарат оказывает антиноцицептивное, противошоковое, а также сильное противокашлевое действие. Возбуждает центр блуждающего нерва, повышает тонус гладкой мускулатуры внутренних органов (в том числе сфинктеров желчевыводящих путей, бронхов, сфинктеров мочевого пузыря). Ослабляет перистальтику желудочно-кишечного тракта (ЖКТ), угнетает дыхательный центр. Эффект при подкожном введении препарата развивается через 10-15 мин и продолжается 3-5 ч. Пролонгированная форма морфина (морфилонг*) при внутримышечном введении оказывает противоболевое действие до 22-24 ч.
Показания
Выраженный болевой синдром (инфаркт миокарда, травмы, злокачественные новообразования, послеоперационный период и др.). Предоперационная премедикация. Компонент анестезиологического пособия. Лечебный наркоз при продленной искусственной вентиляции легких, черепно-мозговой и сочетанной травме. Гидростатический отек легких. Кашель при неэффективности других противокашлевых средств.
Противопоказания
Повышенная чувствительность к препарату. Дыхательная недостаточность (если план лечения не предполагает проведения искусственной вентиляции легких). Абдоминальные боли неясного происхождения. Алкогольная интоксикация. Психоз. Детский возраст до 5 лет. Период лактации. Лечение ингибиторами моноаминоксидазы. С осторожностью у пожилых пациентов при аденоме предстательной железы.
Режим дозирования
Внутрь, внутримышечно, внутривенно - разовая доза 10-20 мг, высшая суточная доза - 50 мг. При приеме таблеток-депо - разовая доза 10-100 мг 2 раза в сутки. При злокачественных новообразованиях таблетки-депо из расчета 0,2-0,8 мг/кг каждые 12 ч.
Формы выпуска
• Морфин (морфина гидрохлорид) - раствор для инъекций, ампулы по 1 мл 1% раствора.
• Морфин (морфина гидрохлорид) - таблетки по 10 мг.
• Морфин (морфина сульфат) - раствор для инъекций, ампулы по 10, 15, 30 и 40 мг/мл.
• Морфин (морфилонг) - ампулы по 2 мл, содержит морфина гидрохлорид - 5,5 мг, поливинилпирролидон, раствор кислоты хлористо-водородной.
• Морфин (МСТ континус) - таблетки с системой контролируемого высвобождения активного вещества, в упаковке 60 таблеток. Каждая таблетка содержит морфина сульфат в количестве 10, 30, 60, 100 или 200 мг.
Тримеперидин (промедол)
Фармакологические свойства
Синтетический заменитель морфина, но слабее его по анальгетическому действию в 2-4 раза. Расслабляет гладкую мускулатуру внутренних органов, однако повышает тонус и усиливает сокращения матки. Слабее, чем морфин, угнетает дыхательный центр, не вызывает рвоты.
Режим дозирования
Парентерально по 1-2 мл 1-2% раствора.
Показания
Выраженный болевой синдром (инфаркт миокарда, травмы, злокачественные новообразования, послеоперационный период и др.). Предоперационная премедикация. Компонент анестезиологического пособия. Лечебный наркоз при продленной искусственной вентиляции легких, черепно-мозговой и сочетанной травме. Обезболивание родов. Кишечная, почечная, печеночная колики.
Форма выпуска
Таблетки по 0,025 в упаковке 10 шт.; ампулы по 1 мл 1 и 2% раствора.
Фентанил
Фармакологические свойства
По анальгетической активности в 100 раз превосходит морфин. Обладает коротким действием. Эффект развивается через 2-3 мин после внутривенного введения и продолжается 20-30 мин. Угнетает дыхательный центр, замедляет сердечный ритм, на артериальное давление не влияет. Вызывает мышечную ригидность дыхательной мускулатуры.
Показания
Применяется как компонент анестезиологического пособия для обеспечения анальгетического эффекта. В виде трансдермальной системы (фентанил) - для обезболивания у больных с хроническим болевым синдромом при онкологических заболеваниях.
Режим дозирования
Для премедикации вводят парентерально 0,05-0,1 мг фентанила. В составе анестезиологического пособия доза насыщения - 0,4-0,6 мг, а для его поддержания - 0,05-0,2 мг каждые 20-30 мин. Трансдермальная система применяется в виде пластыря, обеспечивающего поступление фентанила в течение 72 ч. Начинают применение с системы, обеспечивающей скорость поступления препарата 25 мкг/ч.
Формы выпуска
Ампулы с 0,005% раствором для инъекций по 1 или 2 мл.
Бупренорфин
Фармакологические свойства
Бупренорфин относится к частичным агонистам опиатных рецепторов. Эффективно влияет на μ- и κ-рецепторы. Обладает более продолжительным эффектом, вместе с тем слабее угнетает дыхание, чем морфин. Менее опасен в плане развития лекарственной зависимости. При внутривенном введении эффект формируется через 15 мин, а после внутримышечного или сублингвального введения - через 30 мин. Длительность обезболивающего действия - 6-8 ч.
Показания
Болевой синдром высокой интенсивности. Сублингвальные таблетки бупренорфина могут быть применены при оказании неотложной помощи в случае массового поражения пострадавших в экстремальной медицине.
Режимы дозирования
Применяется внутримышечно или внутривенно в дозе по 0,3- 0,6 мг каждые 6-8 ч, сублингвально - по 0,2-0,4 мг каждые 6-8 ч. Максимальная суточная доза - 1,8 мг.
Формы выпуска
Таблетки сублингвальные по 20 мг, ампулы по 1 мл 1% раствора. Буторфанол
Фармакологические свойства
Буторфанол относится к агонистам-антагонистам опиатных рецепторов (стимулирует κ- и блокирует μ-рецепторы). По противоболевой активности превосходит морфин, но дыхание угнетает в меньшей степени. Эффект развивается через 10-15 мин после внутримышечного введения. Продолжительность действия - 3-4 ч. Буторфанол вызывает лекарственную зависимость в меньшей степени, чем морфин. Не оказывает влияния на моторику ЖКТ и тонус сфинктеров. Повышает системное артериальное давление и давление в легочной артерии.
Показания
Болевой синдром различного происхождения. Показан для премедикации перед оперативными вмешательствами. Может использоваться в качестве компонента анестезиологического пособия. В послеоперационный период вводится с целью обезболивания, особенно после применения в ходе анестезии фентанила, так как буторфанол ослабляет остаточные эффекты фентанила в виде угнетения дыхания.
Буторфанол не используют при инфаркте миокарда и легочной гипертензии.
Режимы дозирования
При болевом синдроме парентерально - 1-2 мг каждые 3-4 ч. У пожилых пациентов и больных с нарушениями функций печени дозу снижают в 2 раза, а интервал между инъекциями увеличивают до 6 ч. Для премедикации - внутримышечно в дозе 2 мг.
Формы выпуска
Раствор для инъекций 2 мг, 1 мл.
Трамадол
Фармакологические свойства
Наркотический анальгетик со смешанным механизмом действия. В терапевтических дозах не влияет на моторику кишечника и дыхание.
Анальгетическое действие развивается через 15-30 мин после введения и продолжается 3-5 ч.
Показания
Болевой синдром, в том числе воспалительного, травматического и сосудистого происхождения. Проведение болезненных медицинских манипуляций.
Режим дозирования
Для приема внутрь по 0,05 г, ректально - по 0,1 г. Парентерально - в дозах 0,05-0,1 г. Суммарная суточная доза - 0,4 г.
Формы выпуска
Таблетки по 50 мг. Капсулы по 50 мг. Ректальные свечи по 100 мг. Раствор для инъекций по 1 мл (50 мг) или 2 мл (100 мг) в ампуле. Капли для приема внутрь 10 мл во флаконе с содержанием 100 мг в 1 мл.
Местные анестетики
Местные анестетики - это лекарственные средства, которые обратимо снижают возбудимость чувствительных нервных окончаний и блокируют проведение импульсов в нервных проводниках в зоне непосредственного применения; используются для устранения боли.
Классификация местных анестетиков
Существует клиническая классификация местных анестетиков, в основу которой положены показания применения препаратов для определенного вида анестезии.
1. Средства, применяемые для поверхностной анестезии: кокаин, тетракаин, бензокаин (анестезин*), бумекаин.
2. Средства, применяемые преимущественно для инфильтрационной и проводниковой анестезии: прокаин (новокаин*), тримекаин, ропивакаин, артикаин.
3. Средства, применяемые для спинно-мозговой и перидуральной анестезии: бупивакаин, ропивакаин.
4. Средства, применяемые для всех видов анестезии: лидокаин.
Фармакодинамика местных анестетиков
Все местноанестезирующие средства содержат гидрофильную аминогруппу и липофильную ароматическую группу. Они представляют
собой основания, и при соединении с кислотами образуют растворимые соли. При введении в ткани со слабощелочной средой (рН 7,4) происходит освобождение основания, которое и оказывает влияние на нервные окончания и проводники, поэтому в кислой среде (при воспалении) обезболивающее действие местных анестетиков ослабляется.
Местные анестетики изменяют функцию клеточных мембран, блокируя натриевые каналы. Растворяясь в липидах мембран нервных клеток, препараты проникают к внутренней поверхности мембраны. Здесь они превращаются в ионизированную форму и взаимодействуют с S6-сегментом IV домена внутриклеточной части натриевого канала. В результате продлевается неактивное состояние натриевого канала, что задерживает развитие следующего потенциала действия.
Особенно подвержены действию местных анестетиков чувствительные нервные окончания афферентных нервов и безмиелиновые волокна. На миелиновые волокна анестетики действуют в области перехватов Ранвье. При этом более чувствительными оказываются тонкие нервные проводники. Поскольку последние отвечают за проведение болевых и температурных сигналов, то в первую очередь нарушаются восприятие боли и температурная чувствительность, а тактильная чувствительность и функция двигательных нервов блокируются несколько позднее. Восстановление функций происходит в обратном порядке.
Следует помнить о наличии у местноанестезирующих средств и резорбтивных эффектов, которые развиваются при их проникновении в системный кровоток и при распределении в органах и тканях. Препараты стимулируют ЦНС, вызывая беспокойство, тремор, возможно развитие судорог. Вслед за фазой возбуждения следует фаза торможения с сонливостью, угнетением сознания и депрессией дыхательного центра. В токсических дозах препараты, оказывая угнетающее действие на ЦНС, вызывают паралич дыхания.
Влияя на мембраны клеток миокарда, местные анестетики повышают порог возбудимости и увеличивают рефрактерный период. Эти свойства объясняют применение некоторых препаратов в качестве антиаритмических средств [лидокаин, тримекаин, бумекаин (пиромекаин)]. В избыточных дозах местные анестетики оказывают кардиодепрессивное действие, замедляют внутрисердечную проводимость. Может наблюдаться блокада нервно-мышечной передачи.
Местные анестетики понижают сосудистый тонус и вызывают системную гипотонию, а также снижают тонус гладкой мускулатуры бронхов и кишечника.
Фармакокинетика местных анестетиков
Всасывание местных анестетиков зависит от васкуляризации области, в которую их вводят. В хорошо кровоснабжаемых регионах возможно проникновение препаратов в системный кровоток с последующим развитием резорбтивных эффектов. Более того, сосудорасширяющее действие препаратов еще более усиливает их всасывание.
Производные амидов подвергаются биотрансформации в печени. Эфиры в основном гидролизуются эстеразами крови и тканей. Метаболиты выводятся почками.
Местные анестетики проникают через плацентарный барьер и могут оказывать токсическое влияние на плод.
Применение местных анестетиков
В зависимости от места и способа введения анестетиков выделяют несколько видов местной анестезии, при которых применяются различные препараты (табл. 3). Таблица 3. Препараты местных анестетиков
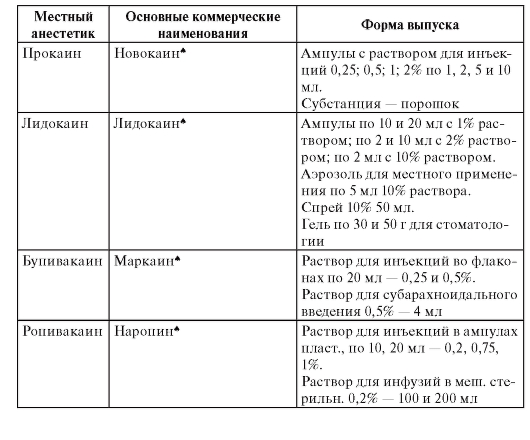
Окончание табл. 3

Терминальная (поверхностная) анестезия достигается нанесением препаратов на слизистые оболочки и на раны. В этом случае блокируются чувствительные нервные окончания. Для такого вида анестезии применяют бупивакаин, бумекаин, тетракаин, бензокаин, лидокаин, тримекаин. Для поверхностной анестезии конъюнктивы и роговицы используют тетракаин (0,25-0,5% раствор), лидокаин (1-4% раствор, гель, спрей), бумекаин (0,5% раствор). Слизистые оболочки носа, ротоглотки обезболивают лидокаином (1-4% раствор, гель, 10% раствор в виде аэрозоля или спрея), бумекаином (0,5% раствор).
Инфильтрационную анестезию выполняют путем пропитывания тканей местным анестетиком. Этот вид обезболивания используют в хирургической практике для выполнения небольших хирургических операций. Чтобы продлить эффект анестетиков к ним добавляют сосудосуживающие средства [эпинефрин, фенилэфрин (мезатон)]. Обычно применяют 0,5-0,25% раствор прокаина, 0,25-0,5% раствор лидокаина, 0,125-0,25% раствор тримекаина, 0,2% раствор ропивакаина. В стоматологии для инфильтрационной анестезии применяют 0,5-1% растворы прокаина, лидокаина, артикаина.
Проводниковая анестезия достигается введением местного анестетика в околоневральное пространство с целью блокады проведения импульсов по нерву. В хирургической практике для этих целей используют прокаин, лидокаин, тримекаин (1-2% растворы), артикаин (2% раствор), бупивакаин (0,25-0,5% раствор), ропивакаин (0,2% раствор). С целью блокады крупных нервных сплетений можно применять 0,75% раствор ропивакаина. В стоматологии проводниковую анестезию выполняют прокаином, лидокаином, тримекаином (1-2% растворы), артикаином (2-4% раствор).
Вариантами проводниковой анестезии являются эпидуральная анестезия (применяются лидокаин, ропивакаин, тримекаин, артикаин) и спинномозговая анестезия (применяются лидокаин, тримекаин, артикаин, бупивакаин). Эпидуральная и проводниковая анестезии выполняются при оперативных вмешательствах на органах малого таза, промежности, нижних конечностях.
Побочные действия
Осложнения при использовании местных анестетиков обусловлены в основном их резорбтивным действием на ЦНС, сердечно-сосудистую систему. Достаточно часто наблюдаются аллергические реакции, в первую очередь при использовании эфиров. Следует помнить о возможности перекрестной аллергии между представителями одной химической группы. В ряде случаев есть риск возникновения нежелательных реакций на адреномиметики, добавляемые для усиления эффекта анестетиков, в виде тахикардии, повышения артериального давления.
Ненаркотические анальгетики
Показание для применения ненаркотических анальгетиков - различные патологические состояния, сопровождающиеся острой и хронической болью. Данные препараты выделены из большой группы нестероидных противовоспалительных средств (НПВС) в связи с наличием у них определенных достоинств в качестве средств обезболивания. В настоящее время эти средства все чаще используются в качестве компонента периоперационной аналгезии.
В действительности назначение препаратов этой группы более обширно, так как они, кроме противоболевого эффекта, обладают противовоспалительным и антипиретическим свойствами.
К ненаркотическим анальгетикам относят парацетамол, метамизол натрия, кетопрофен, кеторолак, лорноксикам. Все эти средства могут быть отнесены и к НПВС, однако отчетливое противоболевое действие позволило рассматривать эти средства как отдельную группу.
По сравнению с наркотическими анальгетиками данные средства выгодно отличает отсутствие угнетающего действия на жизненно важные функции организма (ЦНС, дыхательная и сердечно-сосудистая системы). Отдельно следует отметить отсутствие влияния на моторику ЖКТ и тонус сфинктеров. Принципиальное преимущество ненаркотических анальгетиков - отсутствие формирования физической и психической зависимости, поэтому применение данных препаратов
оказалось перспективным для купирования острой боли, в том числе и для периоперационного обезболивания. Учитывая отсутствие указанных побочных эффектов по сравнению с опиатами, для ненаркотических анальгетиков расширены показания к применению при сочетанной и термической травме, остром инфаркте миокарда.
Они также находят применение и для лечения хронического болевого синдрома, в том числе при паллиативном лечении онкологических больных.
Фармакодинамика
Один из основных механизмов действия этой группы лекарственных средств - подавление синтеза простагландинов, которые представляются наиболее важными медиаторами боли и модуляторами воспаления. Угнетение биосинтеза простагландинов осуществляется за счет ингибирования циклооксигеназы (ЦОГ), ключевого фермента превращения арахидоновой кислоты в простагландины.
Основные эффекты
Аналгезирующий эффект
Болеутоляющее действие обусловлено блокированием синтеза простагландинов Е2 и F26, повышающих чувствительность ноцицепторов и влияющих на таламические центры болевой чувствительности. Противоболевое действие проявляется при болях слабой и средней интенсивности. При сильных висцеральных болях ненаркотические анальгетики менее эффективны.
Жаропонижающий эффект
Антипиретическое действие наступает за счет блокады простагландина E1 и уменьшения концентрации циклического аденозинмонофосфата (цАМФ) в клетке, что приводит к уменьшению теплопродукции и увеличению теплоотдачи. Ненаркотические анальгетики обладают значительным антипиретическим эффектом и действуют только при лихорадке.
Противовоспалительный эффект
Один из важнейших эффектов обсуждаемых препаратов - их противовоспалительное действие.
Показания к применению
Болевой синдром различной этиологии. Почечная, печеночная колика. Лихорадка (как правило, при температуре тела выше 38,5 °С).
Противопоказания Общие с НПВС.
Побочные действия
В первую очередь при использовании данных препаратов следует помнить о возможности осложнений со стороны ЖКТ - ульцирогенное действие. Возможны многообразные аллергические проявления.
При использовании ненаркотических анальгетиков могут развиваться нарушения функций почек. Возможны ишемические изменения со снижением клубочковой фильтрации и объема диуреза или развиться острый интерстициальный нефрит.
Также встречаются разнообразные гематологические синдромы. Самые грозные, впрочем, редкие осложнения - это апластическая анемия и агранулоцитоз (метамизол натрия). Возможна коагулопатия, проявляющаяся кровотечениями.
Гепатотоксическое действие развивается по иммуноаллергическому, токсическому или смешанному механизмам и приводит к изменениям активности трансаминаз и других ферментов, гипербилирубинемии.
Лекарственные взаимодействия
Обсуждаемые средства могут усиливать действие непрямых антикоагулянтов и пероральных гипогликемических средств. Они ослабляют эффект антигипертензивных препаратов, повышают токсичность антибиотиков-аминогликозидов, дигоксина и некоторых других лекарственных средств. По возможности следует избегать одновременного назначения с диуретиками. Алюминийсодержащие антациды (алмагель*, маалокс* и др.) ослабляют всасывание анальгетиков в желудочно-кишечном тракте. Болеутоляющий эффект усиливают наркотические анальгетики и седативные препараты.
Характеристика отдельных препаратов
Кетопрофен (кетонал*)
Фармакологические свойства
Обладает выраженным аналгезирующим и противовоспалительным действием. Быстро и хорошо всасывается при различных путях введения. Максимальная концентрация в крови наблюдается через 1-2 ч после приема внутрь, через 2,4-4 ч после ректального и спустя 15-20
мин после внутримышечного введения. Период полувыведения составляет 1,6-1,9 ч.
Показания
Болевой синдром (дисменорея, почечная колика, боли при онкологических заболеваниях). Применяют для купирования болевого синдрома различной локализации: почечной колики, болей при травмах, при неврологических заболеваниях, у онкологических больных (особенно при метастазах в костях), при послеоперационных и посттравматических болях, в послеродовом периоде.
Режимы дозирования
Внутрь и ректально 100-300 мг/сут в 2-3 приема, причем прием таблеток или капсул можно сочетать с использованием свечей, например 1 капсула (50 мг) утром и днем и 1 свеча (100 мг) вечером; внутримышечно - по 100 мг 1-2 раза в сутки; внутривенно - кратковременная инфузия - 100-200 мг в 100 мл изотонического раствора натрия хлорида в течение 0,5-1 ч каждые 8 ч; длительная инфузия - 100-200 мг в 500 мл изотонического раствора натрия хлорида (или раствора глюкозы) в течение 8 ч с 8-часовыми интервалами.
Форма выпуска
Таблетки по 50, 100 и 150 («ретард») мг; капсулы по 50 мг; свечи по 100 мг; ампулы по 2 мл (100 мг); гель 5%.
Взаимодействие с лекарственными средствами
При сочетании с опиоидными анальгетиками болеутоляющий эффект усиливается, что дает возможность применять более низкие дозы.
Кеторолак (кетанов, кеторол)
Фармакологические свойства
Практически полностью и быстро всасывается в желудочнокишечном тракте, биодоступность при приеме внутрь составляет 80-100%. Максимальная концентрация в крови достигается через 35 мин после приема внутрь и через 50 мин после введения внутримышечно. Выводится почками. Продолжительность действия - 4-6 ч.
Показания
Применяют для купирования болевого синдрома различной локализации: почечной колики, болей при травмах, при неврологических
заболеваниях, у онкологических больных, при послеоперационных и посттравматических болях, в послеродовом периоде.
Режимы дозирования
Внутрь 10 мг каждые 4-6 ч; высшая суточная доза - 40 мг; продолжительность применения - не более 7 дней. Внутримышечно и внутривенно - 10-30 мг; высшая суточная доза - 90 мг; продолжительность применения - не более 2 дней.
Форма выпуска
Таблетки по 10 мг; ампулы по 1 мл.
Взаимодействие с лекарственными средствами
Наркотические анальгетики и местные анестетики потенцируют болеутоляющее действие препарата.
Лорноксикам (ксефокам)
Фармакологические свойства
В одинаковой степени блокирует ЦОГ-1 и ЦОГ-2. Обладает выраженным аналгезирующим и противовоспалительным действием. Аналгезирующий эффект лорноксикама складывается из нарушения генерации болевых импульсов и ослабления восприятия боли (особенно при хронических болях). При внутривенном введении препарат способен повышать уровень эндогенных опиоидов, активируя тем самым физиологическую антиноцицептивную систему организма.
Хорошо всасывается в ЖКТ, пища несколько снижает биодоступность. Максимальные концентрации в плазме крови отмечаются через 1-2 ч. При внутримышечном введении максимальный уровень в плазме наступает через 15 мин. Хорошо проникает в синовиальную жидкость, где его концентрация достигает 50% концентрации в плазме крови и длительно там сохраняется (до 10-12 ч). Метаболизируется в печени, выводится (преимущественно) через кишечник и почки. Период полувыведения - 3-5 ч.
Показания
Используется для купирования болевого синдрома различной локализации: почечной колики, болей при травмах, при неврологических заболеваниях, у онкологических больных, при послеоперационных и посттравматических болях, в послеродовом периоде.
Режимы дозирования
При болевом синдроме - внутрь 8 мг 2 раза в сутки; возможен прием ударной дозы 16 мг; внутримышечно или внутривенно - 8-16 мг (1-2 дозы с интервалом 8-12 ч); в ревматологии - внутрь 4-8 мг 2 раза в сутки.
Форма выпуска
Таблетки по 4 и 8 мг; флаконы по 8 мг (для приготовления инъекционного раствора).
Взаимодействие с лекарственными средствами
Наркотические анальгетики и местные анестетики потенцируют болеутоляющее действие препарата.
Метамизол натрия (анальгин)
Фармакологические свойства
Оказывает умеренное противовоспалительное действие и обладает выраженным аналгезирующим эффектом, который обусловлен преимущественно центральными механизмами, в частности нарушением проведения болевых импульсов в спинном мозге. В отличие от других НПВС обладает спазмолитической активностью. Быстро и практически полностью всасывается. Максимальная концентрация в крови развивается через 1-2 ч. Период полувыведения - 2,5 ч.
Показания
Используется для купирования болевого синдрома различной локализации: почечной колики, болей при травмах, при неврологических заболеваниях, при послеоперационных и посттравматических болях, в послеродовом периоде.
Противопоказания
Применение препарата связано с риском гематологических осложнений (лейкопения, агранулоцитоз, анемия), что оказывается поводом для ограничения использования и даже запрета к назначению в некоторых странах.
Режимы дозирования
Внутрь по 0,5-1 г 3-4 раза в сутки, внутримышечно или внутривенно по 2-5 мл 50% раствора 2-4 раза в сутки.
Форма выпуска
Таблетки по 100 и 500 мг; ампулы по 1 мл 25% раствора, 1 и 2 мл 50% раствора; капли, сироп, свечи.
Взаимодействие с лекарственными средствами
Наркотические анальгетики и местные анестетики потенцируют болеутоляющее действие препарата.
1.2. БОЛЬ В ГРУДИ
Мы с вами подробно остановились на вопросах патофизиологии болевого синдрома, разобрались с принципиальными моментами фармакотерапии боли. Теперь можем двигаться далее. Итак, боль в груди. Что важно не упустить, на что обратить внимание при осмотре пациента с болью в груди?
Клиническая картина
При сборе анамнеза у пациента выясняют следующие сведения. 1. Наличие боли, особое внимание уделяют:
• локализации:
- загрудинная боль или боли в левой руке (при подозрении на инфаркт миокарда);
- миграция болей (при подозрении на расслаивающую аневризму аорты);
• продолжительности:
- боль в грудной клетке, возникшая >48 ч назад (при подозрении на инфаркт миокарда);
- постоянная боль (при подозрении на инфаркт миокарда);
• характеру, отмечая, нет ли:
- давящей боли (при подозрении на инфаркт миокарда или нестабильную стенокардию);
- острой или колющей боли (при подозрении на инфаркт миокарда или нестабильную стенокардию);
- плевритической боли (ее присутствие повышает вероятность тромбоэмболии легочной артерии (ТЭЛА) и уменьшает вероятность инфаркта миокарда или нестабильной стенокардии);
- позиционной боли (при подозрении на инфаркт миокарда или нестабильную стенокардию);
- любое сходство с предыдущими инфарктами миокарда или приступами стенокардии.
2. Любые факторы, вызывающие усиление или ослабление болей, особенно:
• возникновение болей при нагрузке;
• ослабление болей при приеме нитратов или в покое.
3. Наличие сопутствующих симптомов:
• тошноты или рвоты (при подозрении на инфаркт миокарда);
• повышенного потоотделения (при подозрении на инфаркт миокарда);
• кровохарканья (при подозрении на ТЭЛА);
• одышки или ухудшения хронической одышки (при подозрении
на ТЭЛА).
4. Наличие в анамнезе:
• стенокардии или инфаркта миокарда (при подозрении на инфаркт миокарда или нестабильную стенокардию);
• АГ (при подозрении на расслаивающую аневризму аорты);
• бронхиальной астмы;
• деменции (при подозрении на пневмонию);
• иммунодефицита (при подозрении на пневмонию);
• синдрома Марфана (при подозрении на расслаивающую аневризму аорты);
• факторов риска заболеваний сердечно-сосудистой системы:
- АГ;
- курение;
- сахарный диабет;
- повышенная концентрация в сыворотке крови общего холестерина или триглицеридов;
- возникновение стенокардии или инфаркта миокарда до 60 лет у родителей (при подозрении на инфаркт миокарда);
• факторы риска венозной тромбоэмболии:
- иммобилизация в последнее время;
- паралич нижних конечностей;
- оперативное вмешательство или перелом нижних конечностей, сопровождающиеся иммобилизацией, в течение последних 12 нед; вынужденное пребывание в постели более 3 дней в течение последних 4 нед;
- предшествующая венозная тромбоэмболия (объективный диагноз);
- положительный семейный анамнез в отношении развития тромбоза глубоких вен или ТЭЛА;
- объективно доказанные случаи заболевания как минимум у двух членов семьи больного;
- наличие родственника первой степени родства с наследственной тромбофилией;
- онкологическое заболевание с высокой активностью (больной проходит лечение, диагностика в течение последних 6 мес, паллиативное лечение);
- послеродовой период.
При боли в груди в первую очередь исключают стенокардию, а если боль длится более 15 мин, то инфаркт миокарда.
Частые причины боли в груди - психические нарушения и поражения опорно-двигательного аппарата. К последним относятся синдром Титце, воспаление реберных хрящей, травмы мышц, остеоартроз грудинореберных суставов, остеохондроз и остеоартроз нижнешейного и верхнегрудного отделов позвоночника. Болезни мышц, костей и суставов часто остаются нераспознанными (ошибочно ставят диагноз фибромиалгии или межреберной невралгии).
• При жалобах на боль в груди в первую очередь исключают инфаркт миокарда.
• Угрожающие состояния, сопровождающиеся болью в груди: инфаркт миокарда, ТЭЛА, расслаивающая аневризма аорты, напряженный пневмоторакс.
• Инфаркт миокарда дифференцируют от стенокардии, расслаивающей аневризмы аорты, перикардита, эзофагоспазма, рефлюксэзофагита, гипервентиляционного синдрома.
• В диагностике ИБС большую роль играет анамнез. Особенно важно установить воспроизводимость симптомов: так, для стенокардии напряжения характерно то, что приступы возникают при одном и том же уровне нагрузки.
Наиболее распространенные причины болей в грудной клетке
• Инфаркт миокарда.
• Тромбоэмболия легочной артерии.
• Инфекции грудной клетки.
• Заболевания мышц и костей.
• Перикардит.
Менее распространенные причины
• Расслаивающая аневризма аорты.
• Спазм пищевода.
• Разрыв пищевода.
• Боли в животе:
- камни в желчном пузыре;
- гастрит.
• Опоясывающий герпес.
Дифференциальная диагностика при боли в груди
В первую очередь исключают инфаркт миокарда. Самая частая причина боли в груди:
- заболевания мышц, суставов, ребер;
- психогенная боль;
- стенокардия.
Наиболее опасные заболевания (обратить внимание!)
Сердечно-сосудистые
1. Инфаркт миокарда.
2. Расслаивающая аневризма аорты.
3. Тромбоэмболия легочной артерии.
Злокачественные новообразования
1. Рак легкого.
2. Опухоли спинного мозга.
Инфекции
1. Плеврит.
2. Пневмония.
3. Медиастинит.
4. Перикардит.
Пневмоторакс
Источники неверного диагноза
• Пролапс митрального клапана.
• Эзофагоспазм.
• Рефлюкс-эзофагит.
• Опоясывающий лишай.
• Кашлевой перелом ребер.
• Остеохондроз и остеоартроз позвоночника.
Редкие причины
1. Эпидемическая миалгия (плевродиния).
2. Употребление кокаина.
Семь главных притворщиков
1. Депрессия.
2. Сахарный диабет.
3. Побочное действие лекарственных средств и интоксикация.
4. Анемия.
5. Болезни щитовидной железы.
6. Болезни позвоночника.
7. Инфекция мочевыводящих путей.
Психические нарушения и симуляция
Возможны тревожные расстройства.
Основные причины ошибок
• Незнание эпидемиологии ИБС.
• Неумение диагностировать остеохондроз и остеоартроз позвоночника, особенно нижнешейного отдела.
• Гипердиагностика неврозов при сочетании тревожности, страха и острой боли в груди.
• Мнение, что любая боль в груди, иррадиирующая по внутренней поверхности левой руки, это стенокардия.
• Незнание того, что ТЭЛА и инфаркт миокарда в 20% случаев, особенно у пожилых, протекают бессимптомно.
Причины плевритической боли в грудной клетке
• ТЭЛА.
• Вирусные инфекции.
• Пневмония.
• Травма грудной клетки.
• Онкологические заболевания.
При объективном обследовании обращают внимание на наличие следующих признаков:
Общие симптомы:
1) лихорадка (при подозрении на пневмонию);
2) частота дыхательных движений (ЧДД) более 30 в минуту (при подозрении на пневмонию);
3) тахикардия (при подозрении на пневмонию);
4) обильное потоотделение (при подозрении на инфаркт миокарда).
Симптомы поражения сердечно-сосудистой системы:
1) АГ или артериальная гипотензия (при подозрении на расслаивающую аневризму аорты);
2) отсутствие или снижение пульса (при подозрении на расслаивающую аневризму аорты);
3) появление III тона сердца (при подозрении на инфаркт миокарда);
4) боли в грудной клетке, усиливающиеся при пальпации (при подозрении на инфаркт миокарда или нестабильную стенокардию).
Симптомы поражения дыхательной системы:
1) кашель (при подозрении на пневмонию);
2) SаО2 менее 92% при дыхании комнатным воздухом, которая нормализуется при дыхании 40% кислородом (при подозрении на ТЭЛА);
3) неравномерное участие грудной клетки в акте дыхания (при подозрении на пневмонию);
4) притупление перкуторного звука (при подозрении на пневмонию);
5) ослабление дыхательных шумов (при подозрении на пневмонию);
6) бронхиальное дыхание (при подозрении на пневмонию);
7) хрипы (при подозрении на пневмонию);
8) эгофония (при подозрении на пневмонию);
9) шум трения плевры (при подозрении на ТЭЛА). Неврологические симптомы
Очевидные признаки инсульта или паралича (при подозрении на расслаивающую аневризму аорты).
Оценивают риск значительного поражения коронарных артерий (стеноз более 50% по меньшей мере одной из основных коронарных артерий), учитывая возраст пациента и наличие следующих симптомов:
- загрудинной боли;
- боли, возникающей при нагрузке;
- облегчения боли в течение менее 10 мин в покое или приеме нитроглицерина.
Стандарт физикального обследования при боли в груди включает следующее:
1. Выявляют внешние признаки атеросклероза: старческую дугу роговицы, уплотнение и утолщение артерий.
2. Выясняют, нет ли характерной для опоясывающего лишая сыпи.
3. Исследуют пульс на лучевых и бедренных артериях (пульс отсутствует при атеросклерозе, расслаивающей аневризме аорты).
4. Измеряют артериальное давление (АД) и температуру тела.
5. Пальпируют грудную клетку, грудные мышцы, остистые отростки позвонков.
6. Выявляют локальную болезненность, переломы, симптомы болезней позвоночника.
7. Перкутируют грудную клетку: при пневмотораксе - тимпанический звук.
8. Пальпируют живот. Боль в эпигастрии наблюдается при болезнях желчного пузыря, желудка, двенадцатиперстной кишки.
9. Осматривают ноги: исключают тромбоз глубоких вен.
10. Проводят аускультацию сердца и легких:
- отсутствие дыхания и голосового дрожания - пневмоторакс;
- шум трения плевры (перикарда) - плеврит (перикардит);
- влажные хрипы в нижних отделах легких - сердечная недостаточность;
- систолический шум на верхушке - пролапс митрального клапана;
- диастолический шум над аортой - расслоение восходящей аорты;
- глухость сердечных тонов, ритм галопа - инфаркт миокарда.
Исследования
1. Подсчет форменных элементов крови.
2. Определение:
- концентрации электролитов, мочевины и креатинина в сыворотке крови;
- концентрации глюкозы в крови.
3. Исследование уровня кардиоспецифических ферментов в динамике (при диагностике инфаркта миокарда):
- МВ-фракция креатинфосфокиназы (КФК) через 24 ч;
- тропонин Т;
- КФК через 48 ч в сочетании с лактатдегидрогеназой (ЛДГ).
4. Определение концентрации липидов в сыворотке крови.
5. Исследование газового состава артериальной крови (при наличии одышки).
6. Электрокардиография (ЭКГ) в 12 отведениях с последующей ЭКГ в динамике.
7. Рентгенография органов грудной клетки.
Кардиоспецифические ферменты
• Раннее повышение активности МВ-фракции КФК позволяет диагностировать инфаркт миокарда, нормальные показатели через 20 ч позволяют исключить его.
• При нормальной концентрации тропонина T или тропонина I через 20 ч наличие инфаркта миокарда маловероятно.
• Повышенная концентрация КФК или миоглобина позволяет диагностировать инфаркт миокарда.
• Исследование концентрации КФК, аспартиламинотрансферазы (ACT) или ЛДГ при поступлении не позволяет достоверно диагностировать или исключить инфаркт миокарда.
Электрокардиография
1. Признаки, при которых следует подозревать ишемию миокарда:
- повышение сегмента ST как минимум в двух отведениях;
- депрессия сегмента ST;
- патологический зубец Q;
- инверсия зубца Т;
- нарушения проводимости.
2. Все вышеперечисленные изменения более значимы, если присутствуют как минимум в двух отведениях, или известно, что они появились недавно.
3. При нормальной ЭКГ наличие угрожающих жизни осложнений маловероятно.
Рентгенография органов грудной клетки
Обращают внимание на наличие:
- долевого инфильтрата (при подозрении на пневмонию);
- расширения аорты (особенно шарообразного) или средостения (при подозрении на расслаивающую аневризму аорты);
- плеврального выпота (при подозрении на расслаивающую аневризму аорты);
- отклонения трахеи (при подозрении на расслаивающую аневризму аорты).
Состояние пациентов с низким риском инфаркта миокарда можно быстро оценить в диагностическом отделении с помощью:
- определения концентрации МВ-фракции КФК через 0, 4, 8 и 12 ч;
- ЭКГ в динамике в 12 отведениях;
- клинического обследования через 6 и 12 ч;
- ЭКГ с нагрузкой (если результаты всех перечисленных исследований отрицательны).
Я предлагаю вам для оценки риска развития инфаркта миокарда у пациента с болевым синдромом в груди пользоваться следующей таблицей (табл. 4). Просматривают первый столбец таблицы сверху вниз, пока не обнаруживают клинический признак, присутствующий у конкретного пациента. После этого переходят во второй столбец и продолжают поиск, пока не обнаруживают клинический признак, имеющийся у пациента. Соответствующее найденному пункту число в третьей колонке означает риск инфаркта миокарда у пациента.
Таблица 4. Определение риска развития инфаркта миокарда у пациента с болью в груди

Тесты с нагрузкой
Тесты с нагрузкой проводят перед выпиской или амбулаторно с использованием:
- симптом-лимитированного теста на толерантность к физическим нагрузкам;
- перфузионной сцинтиграфии миокарда для выявления обратимых дефектов перфузии;
- однофотонной эмиссионной компьютерной томографии при нагрузке;
- эхокардиографии (ЭхоКГ) при нагрузке.
Всех пациентов направляют на коронароангиографию (с последующей чрескожной транслюминальной коронарной ангиопластикой или при необходимости коронарным шунтированием) при наличии у них:
- спонтанной стенокардии, возникающей более чем через 36 ч после госпитализации;
- продолжительной стенокардии с ишемическими изменениями
на ЭКГ;
- патологических результатов нагрузочных проб;
- умеренной или тяжелой стенокардии после выписки, несмотря на интенсивную антиишемическую терапию.
Электрокардиография с нагрузкой
Обращают внимание на наличие:
- горизонтального или нисходящего отклонения сегмента ST и его депрессии на 1 мм и более в любом отведении;
- приступа стенокардии во время теста;
- ограничения продолжительности переносимости нагрузки;
- изменения систолического АД;
- признаков плохого функционирования желудочков: фракция выброса (ФВ) менее 40%.
Для определения риска летального исхода используют следующую формулу:
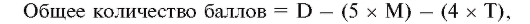
где D - продолжительность нагрузки, мин; М - максимальное отклонение сегмента ST во время или после нагрузки, мм; Т - тредмиловый индекс стенокардии.
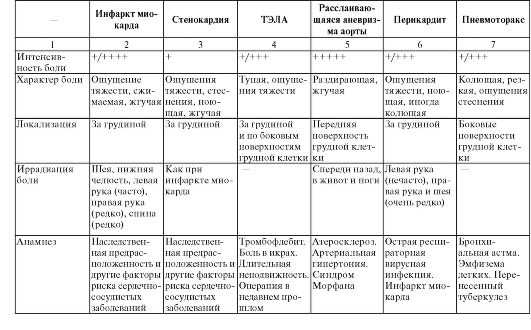
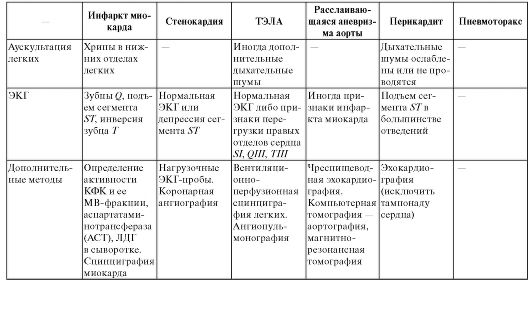
Для дифференциальной диагностики состояний, сопровождающихся болевым синдромом в груди, можно пользоваться табл. 5.
Таблица 5. Дифференциальная диагностика наиболее опасных состояний, сопровождающихся болью в груди
Продолжение табл. 5
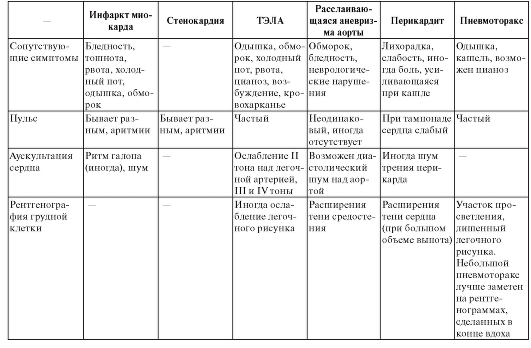
Окончание табл. 5
Необходимо использовать в своей практической работе стандарт алгоритма диагностики при боли в груди.
АЛГОРИТМ ДИАГНОСТИКИ Первый этап
Оценка жизненно важных функций организма (сознания, показателей дыхания, гемодинамики).
Второй этап
Исключение неотложных причин острых болей в грудной клетке
1. Выявление факторов риска ИБС. При наличии стенокардитического рисунка боли - прием нитроглицерина под язык с регистрацией эффекта.
2. Выявление факторов риска ТЭЛА.
3. Регистрация ЭКГ (ишемические изменения, поворот электрической оси сердца вправо, снижение вольтажа зубцов и пр.).
4. Рентгенография органов грудной клетки - при подозрении на пневмоторакс.
5. Должна быть произведена немедленная госпитализация (!) при подозрении на:
- острый коронарный синдром;
- ТЭЛА;
- расслаивающую аневризму аорты;
- тампонаду перикарда;
- пневмоторакс.
Типичные признаки болей при остром коронарном синдроме
• Продолжаются более 20 мин.
• Локализуются в загрудинной области, иногда иррадиируют в руки (наиболее часто - в левое плечо и руку), спину, шею, нижнюю челюсть.
• Носят сжимающий или давящий характер; дыхание или изменение положения тела практически не влияют на интенсивность боли.
• Длительные, постоянные, сильные.
• Возможно сходство с симптомами «острого живота» (появление боли в верхней части живота, тошнота).
• Тошнота и рвота иногда представляют собой основные симптомы, особенно при ишемии задненижней стенки сердца.
• При ишемии задненижней стенки сердца и раздражении блуждающего нерва могут возникнуть брадикардия и артериальная гипотензия, проявляющиеся головокружением и слабостью.
• У каждого больного с острой болью в грудной клетке следует оценивать факторы риска ИБС (семейный анамнез, курение, артериальная гипертензия, ожирение, возраст, пол, гиперхолестеринемия).
• При отсутствии факторов риска - исследовать электрокардиограмму, что позволяет определить не только ишемические, но и многие другие изменения. При их отсутствии на ЭКГ нужно перейти к исключению прочих причин боли в грудной клетке.
• При наличии факторов риска и отсутствии изменений на ЭКГ в покое у больного с проявлениями острого коронарного синдрома необходимо исследовать активность КФК, концентрацию тропонинов сыворотки крови, а также наблюдать больного в стационаре не менее 2-3 сут.
• При стабильном состоянии и отсутствии характерных для инфаркта миокарда изменений возможно проведение стресс-ЭКГ.
• При наличии факторов риска ИБС и ишемических изменений на ЭКГ больного госпитализируют и ведут в соответствии со стандартами лечения острого коронарного синдрома с подъемом (или без подъема) сегмента ST.
• При наличии болей в грудной клетке, соответствующих стабильной ИБС, исследуют ЭКГ (правильнее - в динамике со сравнением с прошлыми ЭКГ), проводят суточный мониторинг ЭКГ для исключения безболевой ишемии миокарда.
Болевой синдром при тромбоэмболии легочной артерии
• Обязательный шаг в диагностике - выявление факторов риска (иммобилизация, послеоперационный период, прием эстрогенов, длительный авиаперелет).
• При подозрении на ТЭЛА, но с отсутствием факторов риска, исследуют D-димеры в плазме крови или проводят вентиляционноперфузионную сцинтиграфию легких.
• Отрицательный результат свидетельствует против ТЭЛА.
• Положительный или неоднозначный результат - показание к дальнейшему наблюдению и допплеровскому ультразвуковому исследованию (УЗИ) глубоких вен нижних конечностей.
• Если у больного, наряду с клиническими подозрениями, имеются факторы риска, обследование рекомендуется начать с вентиляционно-перфузионной сцинтиграфии легких.
• Результаты сцинтиграфии легких, соответствующие норме, исключают диагноз ТЭЛА.
• При неинформативности сцинтиграфии легких или невозможности ее проведения исследуют D-димер и применяют допплеровское УЗИ глубоких вен нижних конечностей.
• У больного, имеющего четкую клиническую картину ТЭЛА и факторы риска ТЭЛА, рекомендуется проводить сцинтиграфию легких, а при ее неинформативности или невозможности - допплерэхографию глубоких вен нижних конечностей.
• Если эти исследования не приносят однозначной информации, проводят ангиографию легких.
• Лечение антикоагулянтами у этой группы больных начинают незамедлительно.
Болевой синдром при расслаивающейся аневризме аорты
• Появление у больного острых болей в грудной клетке, распространяющихся по ходу аорты, а также острой перемежающейся хромоты требует проведения комплекса исследований.
• Рентгенография органов грудной клетки: расширение тени средостения связано с наличием аневризмы крупного размера.
• Чреспищеводное УЗИ аорты: визуализация аневризмы.
• Магнитно-резонансная томография (МРТ): визуализация аневризмы.
• При подтверждении диагноза расслаивающейся аневризмы показано хирургическое лечение.
Болевой синдром при пневмотораксе
• Боли в грудной клетке, обусловленные заболеваниями плевры, имеют связь с актом дыхания. Боли сопряжены с одышкой.
• Перкуторно определяется тимпанический звук на стороне поражения; дыхание не прослушивается.
• Требуется экстренная рентгенография органов грудной клетки.
• Основное лечебное мероприятие - пункция плевральной полости (в ней не нуждаются только небольшие, до 20% объема легкого, пневмотораксы).
Боль в груди при тампонаде перикарда
• Понятие «тампонада» связано не только с накоплением жидкости в полости перикарда, но и с высокой скоростью ее поступления.
• Исследуют парадоксальный пульс (он положителен при тампонаде перикарда).
• ЭхоКГ способствует визуализации жидкости в полости перикарда.
• Подтверждение диагноза тампонады перикарда служит показанием к пункции перикардиальной полости.
Третий этап
Распознавание других причин болей в грудной клетке, связанных с острыми состояниями
• Боли, связанные с дыханием:
1. Проводят аускультацию легких. При выявлении дыхательных шумов (хрипы, шум трения плевры) показана рентгенография органов грудной клетки (пневмония, плеврит).
2. Проводят пальпацию ребер, остистых отростков позвонков, грудинореберных сочленений, участков большой и малой грудных мышц.
3. Наличие локальной болезненности в ребрах - показание к рентгенологическому исследованию для исключения перелома.
4. Выявление болезненности в местах сочленения ребер с грудиной, в местах перехода хрящевой части ребер в костную говорит о наличии синдрома Титце.
5. Выявление болезненных мышечных уплотнений свидетельствует о наличии синдрома фибромиалгии, первичного или вторичного.
• Боли, связанные с приемом пищи:
1. При наличии изжоги или симптомов дисфагии следует провести эзофагоскопию (гастроэзофагеальная рефлюксная болезнь, дивертикулы, опухоли пищевода, грыжа пищеводного отверстия диафрагмы).
2. При сочетании болей в груди с болями в правом подреберье или в эпигастральной области (если они не соответствуют заболеваниям первого этапа) проводят фиброэзофагогастродуоденоскопию (ФЭГДС) и УЗИ брюшной полости.
• Боли, сопряженные с интоксикацией, подъемом температуры тела:
1. Осмотр грудной клетки (опоясывающий лишай).
2. Аускультация легких: при выявлении патологических дыхательных шумов - рентгенография органов грудной клетки (пневмония).
Четвертый этап
Распознавание причин хронических болей в грудной клетке, не относящихся к предыдущим этапам
• Расспрос или анкетирование больного на предмет обнаружения у него депрессии и (или) тревожных расстройств.
• Активное установление типичных триггерных зон первичной фибромиалгии (с двух сторон):
1) в области затылка у подзатылочной мышцы;
2) в области шеи у V-VII шейных позвонков;
3) посередине верхней границы трапециевидной мышцы;
4) над лопаткой у медиального края;
5) у костно-хрящевого сочленения II ребра.
• Активное выявление типичных триггерных зон первичной фибромиалгии (с двух сторон):
1) на 2 см дистальнее латерального надмыщелка плеча;
2) в верхненаружном квадранте ягодиц;
3) кзади от большого вертела;
4) проксимально от коленного сустава.
Положительным симптомом считают боль, а не появление чувствительности.
Диагностически значимой (в соответствии с критериями Американской ревматологической ассоциации, 1990) считается боль в 11 из 18 точек при пальпации (давление пальцем, соответствующее 4 кг).
Лечение
• Универсального средства лечения боли в грудной клетке нет (учитывая также нитроглицерин!).
• Лечение зависит от причины боли в грудной клетке. В неотложных ситуациях исход случая напрямую зависит от времени начала лечения и его адекватности.
• При связи болей в грудной клетке с едой до выяснения причины возможно применение антацидов.
• При лечении первичной фибромиалгии возможно применение НПВС (но они малоэффективны), антидепрессантов, а также местной аналгезии болевых точек 1-2 мл 1% раствора лидокаина [можно вместе с 40 мг гидрокортизона (гидрокортизона ацетат)]. Эффект нестойкий.
1.3. ВНЕЗАПНАЯ СЕРДЕЧНАЯ СМЕРТЬ
После дифференциальной диагностики болевого синдрома в груди мы с вами остановимся на основных нозологических формах ИБС. Начнем с внезапной сердечной смерти.
Внезапная сердечная смерть (ВСС) - это смерть, не связанная с травмой или отравлением; смерть, наступившая в течение 24 ч с момента появления симптомов заболевания; в присутствии свидетелей; смерть, наступившая у больного, не страдавшего тяжелой сердечной недостаточностью или тяжелой цереброваскулярной болезнью
(Ковалева Н.Н., 2005).
Вне стационара в стране в 2003-2005 гг. умерли 1,8 млн человек, 11% из них - внезапно (200 тыс. человек). Это и есть ориентировочное число внезапных смертей в России; 80 тыс. (42% - Ковалева Н.Н., 2005) из них умирают мгновенно, остальным 120 тыс. человек могла быть оказана самоили взаимопомощь.
ВСС - неожидаемая смерть от сердечных причин, произошедшая в течение 1 ч от появления симптомов у пациента с известной сердечной болезнью или без нее.
• Код МКБ-10. I46.1 Внезапная сердечная смерть.
Эпидемиология
Частота ВСС составляет от 0,36 до 1,28 на 1000 населения в год. У мужчин в возрасте от 60 до 69 лет, страдающих заболеванием сердца, частота ВСС достигает 8 на 1000 человек в год. В США ежегодно наблюдают около 325 000 случаев ВСС. Пик распространенности ВСС приходится на возраст 45-75 лет.
Распространенность ВСС пропорциональна заболеваемости ИБС. Соответственно до 65 лет случаи ВСС чаще регистрируют у мужчин, после 65 лет половых различий нет. Всего внезапно умирают 21% мужчин и 14,5% женщин, 40% случаев ВСС происходит без свидетелей.
Этиология
Непосредственным механизмом смерти при ВСС у 80-85% больных служит фибрилляция желудочков, в остальных случаях наблюдаются брадиаритмии и асистолия. Большинство больных (около 80%) ВСС страдают ИБС и переносили инфаркт миокарда. Другие причины - кардиомиопатии (дилатационная, гипертрофическая, аритмогенная кардиомиопатия правого желудочка). Генетические заболевания ионных каналов: синдром удлиненного интервала Q-T, синдром Бругада, клапанные пороки сердца: аортальный стеноз, пролапс митрального клапана; синдром предвозбуждения [синдром Вольфа-Паркинсона- Уайта (WPW-синдром)]; ТЭЛА.
Профилактика
• Группа высокого риска: перенесшие инфаркт миокарда, имеющие признаки дисфункции левого желудочка, а также угрожающие жизни желудочковые аритмии в анамнезе.
• Группа среднего риска: лица с множественными факторами риска коронарного атеросклероза, клиническими проявлениями ИБС.
Внезапная сердечная смерть при инфаркте миокарда и сердечной недостаточности
У больных с инфарктом миокарда ВСС становится результатом фибрилляции желудочков, блокады сердца или асистолии. В течение 2,5 лет после инфаркта миокарда (если в острую фазу инфаркта миокарда тромболитическое лечение не проводилось) 75% случаев смерти связаны с аритмиями. У 60% больных, умерших от аритмии, смерти предшествовали симптомы ишемии миокарда.
Стратификация риска ВСС у больных после инфаркта миокарда с наличием сердечной недостаточности или без нее представлена ниже.
Ведущие факторы риска внезапной сердечной смерти
• Предшествующие эпизоды остановки сердца.
• Синкопальные состояния, предшествующий инфаркт миокарда (особенно в течение 6 мес).
• ФВ левого желудочка <30-35%.
• Частая желудочковая экстрасистолия.
• Неустойчивая желудочковая тахикардия.
Другие факторы риска
• Непроходимость инфарктсвязанной артерии.
• Низкая вариабельность сердечного ритма.
• Увеличенный объем левого желудочка.
• Тахикардия в покое.
• Поздние потенциалы желудочков.
Первичная профилактика внезапной сердечной смерти после инфаркта миокарда
• Лекарственное лечение - β-адреноблокаторы, ИАПФ, ацетилсалициловая кислота, гиполипидемические средства (статины). Менее доказано применение полиненасыщенных жирных кислот, амиодарона.
• Имплантация кардиовертера-дефибриллятора показана больным после инфаркта миокарда с дисфункцией левого желудочка и ФВ менее 30% или сочетанием дисфункции левого желудочка с ФВ менее 40% и пароксизмов желудочковой тахикардии, а также при тяжело переносимых пароксизмах желудочковой тахикардии, особенно при отсутствии эффекта антиаритмического лечения; при устойчивой желудочковой тахикардии, индуцируемой программированной электрической стимуляцией.
• Амиодарон и β-адреноблокаторы показаны больным с гемодинамически хорошо переносимой желудочковой тахикардией. В этом же случае можно рассматривать имплантацию кардиовертера-дефибриллятора, радиочастотную аблацию, хирургическое лечение.
• Блокаторы рецепторов альдостерона для больных с дисфункцией левого желудочка.
• Реваскуляризация - транслюминальная баллонная коронарная ангиопластика (ТБКА) или аортокоронарное шунтирование (АКШ) у больных с клиническими или инструментальными признаками ишемии, особенно при отсутствии эффекта лекарственного лечения.
Вторичная профилактика внезапной сердечной смерти после инфаркта миокарда
Частота применения антиаритмических препаратов с целью вторичной профилактики ВСС в последнее время в развитых странах значительно уменьшилась в связи с применением имплантируемых кардиовертеров-дефибрилляторов.
• Фибрилляция желудочков - имплантация кардиовертерадефибриллятора.
• Гемодинамически непереносимая устойчивая желудочковая тахикардия:
- имплантация кардиовертера-дефибриллятора;
- амиодарон и β-адреноблокаторы.
Внезапная сердечная смерть при гипертрофической кардиомиопатии
ВСС при гипертрофической кардиомиопатии (ГКМП) - ведущий механизм смерти, частота - 2-6% в год. ВСС может возникнуть в любом возрасте, часто у бессимптомных пациентов.
Ведущие факторы риска:
- предшествующие эпизоды остановки сердца;
- устойчивые и неустойчивые пароксизмы желудочковой тахикардии;
- синкопальные состояния;
- семейная история ГКМП;
- симптомы сердечной недостаточности;
- толщина межжелудочковой перегородки (МЖП) более 3 см;
- снижение АД во время нагрузочного теста. Другие факторы риска - мутации высокого риска.
Первичная профилактика:
- имплантация кардиовертера-дефибриллятора;
- амиодарон.
Вторичная профилактика - имплантация кардиовертера-дефибриллятора.
Внезапная сердечная смерть при дилатационной кардиомиопатии
ВСС при дилатационной кардиомиопатии (ДКМП) - главная причина смерти больных. Основные лекарственные средства для профилактики ВСС у больных ДКМП - ИАПФ, β-адреноблокаторы, антагонисты альдостерона, в меньшей степени - амиодарон.
Ведущие факторы риска:
- предшествующие эпизоды остановки сердца;
- устойчивая желудочковая тахикардия;
- фибрилляция желудочков, синкопальные состояния.
Другие факторы риска:
- ФВ левого желудочка <30%;
- неустойчивые пароксизмы желудочковой тахикардии.
Первичная профилактика:
- ИАПФ, β-адреноблокаторы, блокаторы рецепторов альдостерона;
- менее доказаны применение амиодарона и имплантация кардиовертера-дефибриллятора.
Вторичная профилактика:
- имплантация кардиовертера-дефибриллятора, ИАПФ, β-адреноблокаторы, блокаторы рецепторов альдостерона;
- менее доказано применение амиодарона.
Внезапная сердечная смерть при аритмогенной кардиомиопатии правого желудочка
ВСС при этом редком заболевании - одна из основных причин смерти среди лиц молодого возраста. Основным вмешательством при этой патологии, направленным на первичную и вторичную профилактику ВСС, выступает имплантация кардиовертера-дефибриллятора.
Ведущие факторы риска:
- устойчивая желудочковая тахикардия или фибрилляция желудочков;
- дилатация правого желудочка, дисфункция правого желудочка;
- воспроизводимость аритмии при программированной электрической стимуляции.
Другие факторы риска:
- семейный анамнез ВСС;
- поздние потенциалы желудочков и дисфункция правого желудочка;
- желудочковая тахикардия Первичная профилактика:
- имплантация кардиовертера-дефибриллятора;
- антиаритмические препараты менее эффективны.
Вторичная профилактика - имплантация кардиовертера-дефибриллятора.
Внезапная сердечная смерть при синдроме удлиненного интервала Q-Т
Удлинение интервала Q-T ассоциируют с высоким риском развития ВСС. Основные меры по профилактике ВСС: осторожное применение препаратов, удлиняющих интервал Q-T (или исключение их применения); исключение значительных физических нагрузок, а также прием β-адреноблокаторов.
Ведущие факторы риска:
- желудочковая тахикардия типа «пируэт»;
- фибрилляция желудочков;
- остановка сердца;
- синкопальные эпизоды;
- наследственные синдромы:
- синдром Джервела-Нильсена;
- наследственные варианты синдрома удлиненного интервала Q-T.
Другие факторы риска:
- интервал Q-T >600 мс;
- сердечные приступы в детстве, синдактилия в сочетании с атриовентрикулярной блокадой (АВ-блокадой);
- альтернация зубца Т на ЭКГ;
- женский пол;
- семейный анамнез ВСС;
- увеличение дисперсии Q-T.
Первичная профилактика:
- исключение препаратов, удлиняющих интервал Q-T, запрет интенсивных нагрузок, β-адреноблокаторы;
- менее эффективны левосторонняя симпатическая денервация сердца, имплантация электрокардиостимулятора.
Вторичная профилактика:
- имплантация кардиовертера-дефибриллятора и назначение β-адреноблокаторов;
- исключение назначения препаратов, удлиняющих интервал Q- T. Запрет интенсивных нагрузок.
Внезапная сердечная смерть при синдроме Бругада
Синдром Бругада открыт в 1992 г. Критерии диагноза: спонтанный или индуцируемый подъем сегмента ST в отведениях V-V3 в сочетании с блокадой правой ножки пучка Гиса (или без нее). ВСС - основное клиническое проявление этого синдрома, что обусловлено высоким риском развития фибрилляции желудочков. Основное вмешательство при синдроме Бругада - установка кардиовертера-дефибриллятора.
Основные факторы риска:
- желудочковая тахикардия или фибрилляция желудочков;
- синкопальные эпизоды;
- семейный анамнез ВСС.
Другие факторы риска - индуцируемая устойчивая желудочковая тахикардия или фибрилляция желудочков.
Первичная профилактика:
- имплантация кардиовертера-дефибриллятора больным с синкопальными эпизодами и желудочковой тахикардией;
- менее доказано - имплантация кардиовертера-дефибриллятора бессимптомным больным желудочковой тахикардией, индуцируемой программированной электрической стимуляцией.
Вторичная профилактика - имплантация кардиовертера-дефибриллятора.
Внезапная сердечная смерть при нарушениях атриовентрикулярной проводимости и дисфункции синусового узла
Брадиаритмии связаны с ВСС в 15-20% случаев. У многих больных с нарушением проводимости и брадиаритмиями непосредственной причиной ВСС служат желудочковые нарушения ритма. В основе профилактики ВСС у данных больных лежит постановка электрокардиостимулятора (ЭКС).
Основные факторы риска:
- при приобретенных АВ-блокадах: блокады II и III степени типа 2, синкопальные состояния, сопутствующие болезни сердца, сердечная недостаточность;
- при врожденных блокадах: синкопальные состояния, врожденные пороки сердца, удлиненный интервал Q-T;
- при внутрижелудочковых блокадах: сопутствующие болезни сердца, сердечная недостаточность, синкопальные состояния, интервал HV >100 мс (по данным электрофизиологического исследования);
- индуцируемая устойчивая желудочковая тахикардия / фибрилляция желудочков.
Первичная и вторичная профилактика:
- установка ЭКС;
- лечение основного заболевания.
Внезапная сердечная смерть при катехоламинергической полиморфной желудочковой тахикардии
Основные факторы риска:
- фибрилляция желудочков;
- семейный анамнез ВСС;
- неустойчивые пароксизмы желудочковой тахикардии;
- синкопальные состояния в молодом возрасте. Другие факторы риска - синкопальные состояния.
Прогноз при этом заболевании плохо определен в связи с отсутствием крупных исследований. При этом синдроме отмечают высокий риск развития ВСС в молодом возрасте.
Внезапная сердечная смерть
при аортальном стенозе
У 20% больных, умерших в связи с аортальным стенозом, смерть возникает внезапно. Основное вмешательство для первичной профилактики ВСС при аортальном стенозе - своевременное хирургическое лечение данного порока сердца.
Основные факторы риска:
- синкопальные эпизоды в анамнезе;
- стенокардия;
- желудочковые аритмии: спонтанные и индуцируемые программированной электрической стимуляцией;
- низкая толерантность к нагрузкам.
Другие факторы риска - выраженность стеноза.
Первичная профилактика - хирургическое лечение, амиодарон.
Вторичная профилактика:
- имплантация кардиовертера-дефибриллятора;
- хирургическое лечение.
Внезапная сердечная смерть при пролапсе
митрального клапана
Течение митрального пролапса обычно доброкачественное. Предполагается связь данного заболевания с ВСС, но убедительных данных по этому поводу нет.
Основные факторы риска:
- устойчивая желудочковая тахикардия;
- фибрилляция желудочков, семейный анамнез ВСС;
- удлиненные миксоматозные створки митрального клапана.
Другие факторы риска:
- удлиненный интервал Q-T;
- частые / сложные желудочковые экстрасистолы;
- индуцируемость программированной электрической стимуляцией;
- выраженная митральная регургитация, поздние потенциалы желудочков.
Первичная профилактика - отсутствует.
Вторичная профилактика - имплантация кардиовертера-дефибриллятора.
Внезапная сердечная смерть
при миокардиальных мостиках
Миокардиальные мостики - пучки мышечных волокон, сдавливающие коронарные артерии в различных участках. В большинстве случаев мостики перекрывают левую коронарную артерию. Долгосрочный прогноз при изолированных миокардиальных мостиках обычно благоприятный, однако в редких случаях развиваются желудочковые тахиаритмии и ВСС. Основное вмешательство для предупреждения ВСС при данной патологии - хирургическое лечение при наличии симптомов ишемии миокарда.
Основные факторы риска:
- фибрилляция желудочков;
- желудочковая тахикардия с симптомами ишемии миокарда.
Первичная профилактика:
- хирургическое лечение при наличии симптомов ишемии миокарда;
- β-адреноблокаторы.
Вторичная профилактика - хирургическое лечение при наличии симптомов ишемии миокарда.
Внезапная сердечная смерть при аномальном отхождении коронарной артерии
Из врожденной аномалии коронарных артерий чаще встречают отхождение левой коронарной артерии от правой или синуса Вальсальвы. Основное лечение - хирургическое.
Основные факторы риска:
- фибрилляция желудочков;
- стенокардия и положительный нагрузочный тест у молодых пациентов.
Первичная профилактика - хирургическое лечение. Вторичная профилактика - хирургическое лечение.
Внезапная сердечная смерть при синдроме предвозбуждения WPW (Вольфа-Паркинсона-Уайта)
При WPW-синдроме у 0,15% больных в год в результате развития фибрилляции предсердий с быстрым ответом желудочков и ее перехода в фибрилляцию желудочков развивается ВСС. Основное вмешательство для профилактики ВСС у больных WPW-синдромом при возникновении фибрилляции предсердий - аблация дополнительных проводящих путей.
Основные факторы риска:
- длина цикла при фибрилляции предсердий <250 мс;
- антеградный рефрактерный период дополнительного пути проведения <270 мс.
Первичная профилактика:
- аблация дополнительного пути проведения при фибрилляции предсердий, аблация дополнительного пути проведения у бессимптомных пациентов с семейным анамнезом ВСС, у спортсменов;
- менее доказано: амиодарон, антиаритмики Iа-, Ic-классов. Вторичная профилактика - аблация дополнительного пути проведения.
Внезапная сердечная смерть при тромбоэмболии легочных артерий
ТЭЛА часто наблюдают у лиц пожилого возраста, с заболеваниями вен нижних конечностей, у больных сахарным диабетом, после больших полостных и ортопедических операций. Особенности клинической картины представлены в разделе «Инфаркт миокарда», подраздел «Дифференциальная диагностика». Массивные тромбоэмболии часто манифестируют с ВСС.
Основные факторы риска:
- массивная ТЭЛА;
- сопутствующие заболевания сердца;
- пожилой возраст.
Первичная и вторичная профилактика:
- лечение приводящих к тромбозу заболеваний вен нижних конечностей;
- установка кава-фильтров больным с выявленными венозными тромбами и высоким риском ТЭЛА;
- превентивное назначение гепаринов, непрямых антикоагулянтов перед обширными полостными, ортопедическими операциями;
- назначение непрямых антикоагулянтов, ацетилсалициловой кислоты больным тромбозами вен нижних конечностей.
Диагностика внезапной сердечной смерти
Неотложные мероприятия по диагностике и лечению внезапной сердечной смерти
Все больные, пережившие ВСС, т.е. после успешной сердечнолегочной реанимации, нуждаются в детальном обследовании в стационаре для выяснения причин развития ВСС и определения тактики вторичной профилактики. Особенно тщательное обследование требуется, если ВСС произошла не в стационаре.
Анамнез и физикальное обследование
Необходимо выяснить наличие сердечно-сосудистых заболеваний, прежде всего ИБС, нарушений ритма и проводимости сердца, пороков сердца. Надо внимательно изучить медицинскую документацию, предыдущие ЭКГ (при их наличии). Следует сконцентрировать внимание на состоянии больного в предшествующие ВСС дни, особенностях лекарственного лечения, уточнить, были ли в нем за последнее время изменения. Далее проводят физикальное обследование:
- наличие самостоятельного дыхания, проходимость дыхательных путей, пульсацию на периферических артериях;
- внешний вид: цвет кожных покровов, бледность, цианоз, набухание, пульсацию яремных вен, отеки;
- аускультацию: частоту сердечных сокращений (ЧСС), ритмичность, дополнительные тоны, шумы в сердце;
- одышку, кашель, хрипы в легких, кровохарканье;
- измеряют АД;
- оценивают наличие неврологических симптомов.
Лабораторные исследования
• Маркеры повреждения миокарда (тропонин, МВ-КФК) для исключения инфаркта миокарда.
• Уровень электролитов, кальция, магния для выявления тяжелых метаболических нарушений, ацидоза. Гипокалиемия, гиперкалиемия, гипомагниемия, гипокальциемия могут способствовать развитию опасных нарушений ритма.
• При подозрении на передозировку лекарственных препаратов, обладающих проаритмическим эффектом, следует определить их концентрацию в крови. К ним относят дигоксин, антиаритмики 1 класса, трициклические антидепрессанты и т.д.
• Определение уровня тиреоидных гормонов. При гипертиреозе возможны тяжелые нарушения ритма.
• Повышение уровня предсердного натрийуретического пептида (BNP) говорит о высоком риске ВСС у больных сердечной недостаточностью, особенно у перенесших инфаркт миокарда.
• Генетические исследования - часть диагностики синдрома длинного Q-T, ГКМП.
Инструментальное обследование
• ЭКГ для выявления признаков инфаркта миокарда, синдрома длинного Q-T, WPW, синдрома Бругада и т.д. Иногда регистрируют сигнал-усредненную ЭКГ - обнаружение поздних потенциалов свидетельствует о высоком риске ВСС.
• Рентгенография грудной клетки может выявить признаки сердечной недостаточности, дилатации сердца, гипертрофии левого желудочка, легочной гипертензии, ТЭЛА.
• ЭхоКГ помогает диагностировать инфаркт миокарда, пороки сердца. Изотопная сцинтиграфия определяет признаки инфаркта миокарда, преходящей ишемии миокарда.
• Коронарная ангиография и вентрикулография способствуют уточнению характера поражения коронарных артерий, оценке функции левого желудочка. Иногда ангиография помогает обнаружить врожденные аномалии артерий.
• Электрофизиологическое исследование для выявления пациентов с воспроизводимыми желудочковыми аритмиями, подбора антиаритмического лечения.
Лечение внезапной сердечной смерти
ВСС представляет собой остановку сердечной деятельности, поэтому лечение заключается в осуществлении сердечно-легочной реанимации (СЛР). Сложность лечения ВСС заключается в том, что около 2/3 ее случаев происходит внегоспитально. Основной механизм ВСС - желудочковая тахикардия с большой частотой желудочкового ритма и фибрилляция желудочков. Именно поэтому существуют следующие возможности улучшить лечение и прогноз у больных ВСС.
• Обучение персонала всех лечебных учреждений, включая поликлиники, принципам проведения СЛР. Необходимо научить этой процедуре сотрудников служб быстрого реагирования: милиции, службы МЧС, пожарных. Надо, чтобы в общественных местах, поездах, самолетах и так далее постоянно находился персонал, обученный проводить СЛР. Следует пропагандировать обучение СЛР среди населения, организовывать бесплатные курсы при поликлиниках и больницах.
• Эффективность лечения ВСС резко повышается при оснащении общественных мест, самолетов, поездов автоматическими наружными дефибрилляторами и при обучении персонала работе с ними.
Лечение внезапной сердечной смерти оптимально, если:
1) время от остановки сердца до кардиоверсии в госпитале не превышает 3 мин;
2) внегоспитально - не более 5 мин:
- следует максимально сократить время прибытия бригад скорой медицинской помощи. Безусловно, все бригады, включая фельдшерские, должны быть оснащены дефибрилляторами;
- все больные после успешной СЛР должны быть доставлены в отделение кардиореанимации.
Как уже было сказано, успех СЛР во многом определяется практическим навыком применения дефибрилляции. Важно уметь использовать автоматические наружные дефибрилляторы. Остановимся подробнее на этом важном вопросе.
Применение автоматического внешнего дефибриллятора
• Фибрилляция желудочков - самая частая причина остановки кровообращения. Такое расстройство ритма приводит к потере насосной функции сердца.
• Аналогичная ситуация может сложиться при желудочковой тахикардии.
• Фибрилляция желудочков и желудочковая тахикардия возникают не только как осложнение ишемии и инфаркта миокарда, но и как исход большинства других критических ситуаций, тяжелых травм, гипоксии миокарда (все случаи асфиксических состояний), различных отравлений и т.п.
• Затянувшаяся фибрилляция желудочков неизбежно переходит в асистолию. При асистолии вернуться к эффективной работе сердца очень сложно.
• Единственно надежный метод устранения фибрилляции желудочков / желудочковой тахикардии - дефибриляции, причем время до фибрилляции - это самый важный определяющий фактор выживания при остановке кровообращения.
• При асистолии дефибрилляция не имеет смысла. Современные автоматические внешние дефибрилляторы - это
совершенные приборы с элементами компьютеризации, надежные и простые в обращении, объединяющие в себе систему для анализа ритма и устройство, способное сигнализировать о необходимости нанести разряд.
Автоматический внешний дефибриллятор «рекомендует» провести дефибрилляцию, а человек, работающий с прибором, принимает окончательное решение [нажимает «РАЗРЯД» («SHOCK»)].
Автоматический внешний дефибриллятор позволяет даже неспециалисту, прошедшему минимальный курс по подготовке, выполнить вмешательство, которое может спасти человеческую жизнь.
Взрослые люди во многих случаях могут выжить без развития неврологических осложнений, даже если дефибрилляция выполнена по прошествии 6-10 мин с момента остановки кровообращения, особенно если в течение этого времени проводилась СЛР.
Осуществление СЛР в процессе ожидания доставки автоматического внешнего дефибриллятора пролонгирует период фибрилляции желудочков, поддерживая функции сердца и головного мозга.
Однако следует иметь в виду, что базовые мероприятия в рамках СЛР вряд ли способны перевести фибрилляцию желудочков в нормальный ритм.
При фибрилляции желудочков шансы выжить у человека сокращаются за каждую минуту примерно на 7-10%. Известно, что вероятность удачной реанимации:
- превышает 90%, если фибрилляцию выполняют в течение первой минуты после остановки сердца;
- на 5-й мин шансы сокращаются примерно до 50%;
- на 7-й мин - до 30%;
- на 9-11-й мин - до 10%;
- при превышении 12-минутного предела - до 2-5%. Следовательно, восстановление адекватного ритма, обеспечивающего перфузию, требует проведения дефибрилляции в течение первых минут с момента прекращения сердечной деятельности.
Появление «умных» дефибрилляторов расширило круг лиц, способных осуществить дефибрилляцию, что в конечном итоге уменьшило
интервал с момента наступления клинической смерти до проведения дефибрилляции. Появилась реальная перспектива интегрировать данное вмешательство в базисное реанимационное пособие, соединить воедино СЛР и дефибрилляцию.
Использование двухфазного разряда позволило уменьшить размер и массу прибора - на свет появились имплантируемые кардиовертерные дефибрилляторы, спасающие жизнь людям, страдающим состояниями, характеризующимися электрической нестабильностью миокарда (синдром укороченного P-Q или удлиненного Q-T и др.).
Автоматический анализ сердечного ритма
Представленные в настоящее время на рынке автоматические внешние дефибрилляторы представляют собой образцы высоких технологий, основанные на микропроцессорах, способные анализировать многочисленные параметры ЭКГ, включая частоту, амплитуду и некоторые интегрированные показатели частоты и амплитуды зубцов ЭКГ.
Автоматический внешний дефибриллятор применяют только у больных, у которых отсутствует реакция на раздражители, дыхание и кровообращение.
Оператор играет роль второй верификационной системы, и именно он должен подтвердить, что больной находится в состоянии клинической смерти.
Правила пользования автоматическим внешним дефибриллятором
Прежде чем приступить к использованию автоматического внешнего дефибриллятора, оператор должен определить, нет ли каких-либо препятствий для его применения, не нужны ли подготовительные действия.
Особые ситуации, требующие подготовительных действий
Существуют четыре вида особых ситуаций, при которых необходимо, чтобы спасатель изменил тактику при подготовке к применению внешнего дефибриллятора и в процессе проведения дефибрилляции.
1. Нахождение человека в воде.
2. Возраст пострадавшего менее 8 лет или масса тела менее 25 кг.
3. Применение пострадавшим трансдермальных препаратов в виде наклеек.
4. Наличие имплантированного водителя ритма или имплантированного кардиовертерного дефибриллятора.
Металлические предметы не включены в этот список, так как они не представляют опасности при нанесении разряда дефибриллятора.
Вода
При наличии воды может образоваться путь для распространения электрического тока от автоматического внешнего дефибриллятора к спасателю и его помощникам; возникает вероятность получить удар током или слабые ожоги. Вода на поверхности грудной клетки становится проводником, замыкающим цепь между электродами. Это приводит к снижению энергии разряда, воздействующего на сердце.
В перечисленных ситуациях, прежде чем взяться за автоматический внешний дефибриллятор, необходимо быстро удалить пострадавшего из воды и протереть насухо его грудную клетку.
Если подозревается повреждение шейного отдела позвоночника в результате ныряния, автоаварии и тому подобного, с пострадавшим обращаются крайне осторожно, обеспечив иммобилизацию позвоночника.
Дети
Остановка кровообращения у детей возникает реже, чем у взрослых, но причины ее более разнообразны.
• Самый частый вариант расстройства ритма у больных в возрасте до 17 лет включительно - асистолия или электрическая активность без пульса.
• Частота фибрилляции желудочков составляет от 7 до 15%. Имеющиеся на сегодняшний день данные позволяют утверждать,
что автоматические внешние дефибрилляторы могут четко выявлять фибрилляцию желудочков у детей в любом возрасте (высокая чувствительность метода). Не хватает информации, чтобы оценить способность автоматических внешних дефибрилляторов правильно идентифицировать у маленьких детей тахикардию, которая не требует лечения разрядом электрического тока (специфичность метода).
Современные автоматические внешние дефибрилляторы наносят разряды, превышающие уровни, рекомендованные в отношении детей младше 8 лет (2-4 Дж/кг при монофазной и бифазной волнах). Медиана массы тела детей старше 8 лет обычно составляет более 25 кг, поэтому наносим первоначальный разряд при моноили двухфазной волне (150-200 Дж), что будет для них составлять менее 10 Дж/кг.
• Сейчас с помощью автоматического внешнего дефибриллятора допустимо осуществление дефибрилляции желудочков или желудочковой тахикардии без пульса у детей старшего возраста (старше 8 лет с массой тела более 25 кг), особенно на догоспитальном этапе.
• В отношении самых маленьких и вообще детей в возрасте до 8 лет при прекращении сердечной деятельности приоритет, как прежде, отдается обеспечению проходимости дыхательных путей, оксигенации и вентиляции.
Лекарственные формы для трансдермального применения
Электроды автоматического внешнего дефибриллятора не следует накладывать непосредственно на приклеенные лечебные пластыри, высвобождающие лекарственные вещества (например, препараты нитроглицерина, никотина, анальгетиков, гормонов, антигипертензивных средств), так как наклейки могут заблокировать проведение тока от электродов к сердцу и привести к образованию ожогов кожи.
• Лекарственные наклейки перед наложением электрода необходимо удалять.
• Надо тщательно протереть кожу под ним.
Имплантированные водители ритма или имплантированные кардиовертерные дефибрилляторы
Некоторым больным, в прошлом пережившим эпизоды опасных аритмий, имплантируют дефибрилляторы, наносящие серию разрядов малой энергии непосредственно на миокард.
• Эти приборы можно обнаружить на ощупь - твердый предмет под кожей в верхней части грудной клетки или живота (обычно слева).
• Наложение электродов автоматического внешнего дефибриллятора непосредственно над имплантированным медицинским прибором может снизить эффективность разряда дефибриллятора.
• Если имплантированный кардиовертерный дефибриллятор в данный момент наносит собственные разряды (при этом мышцы больного сокращаются, так же как при нанесении разряда внешним дефибриллятором), нужно подождать 30-60 с, пока имплантируемый кардиовертерный дефибриллятор не закончит свой лечебный цикл.
• Конфликт возникает, когда автоматический внешний дефибриллятор производит анализ ритма, и в это время проявляет свою активность имплантируемый кардиовертерный дефибриллятор.
Общие этапы при работе со всеми видами автоматических внешних дефибрилляторов
Автоматический внешний дефибриллятор ставят у уха лежащего на спине пострадавшего.
Легче доставать ручки управления автоматического внешнего дефибриллятора и удобнее накладывать электроды, если расположиться слева от больного, тогда также освобождается место для второго спасателя, позволяет ему приступить к проведению СЛР.
Этап 1. Подключение автоматического внешнего дефибриллятора к питанию
Данный этап предусматривает включение питания автоматического внешнего дефибриллятора. В результате появляются голосовые подсказки, которые проводят оператора через все последующие этапы.
Чтобы включить автоматический внешний дефибриллятор, нужно нажать на тумблер питания или поднять крышку либо защитный экран прибора.
Этап 2. Наложение электродов
• Быстро вскрывают упаковку и прикрепляют самоклеящиеся электроды монитора-дефибриллятора к коже больного.
• В некоторых моделях электроды через соединительные кабели заранее подключены к автоматическому внешнему дефибриллятору, в других же придется подсоединить кабели к автоматическому внешнему дефибриллятору или электроды к кабелям.
• Один электрод накладывают на уровне верхней границы грудины непосредственно под правой ключицей, второй - сбоку от левого соска, верхний край электродной пластины должен располагаться примерно на 7 см ниже подмышечной ямки. Правильное расположение контактных пластин часто отображено непосредственно на электродах или на других частях автоматического внешнего дефибриллятора.
• Чтобы наложить электроды, приходится прекратить проведение
СЛР.
• Перед наложением, если тело больного влажное, нужно протереть кожу материалом, одеждой или полотенцем.
• Приемлемой альтернативой признается расположение «верхушечного» электрода спереди слева в предкардинальной зоне, а второго (обозначаемого «стернальный») - на задней поверхности туловища в области сердца под правой лопаткой.
• Необходимо позаботиться о том, чтобы электроды находились на достаточном расстоянии друг от друга, и чтобы на коже между электродами не было токопроводящего геля или крема, так как в противном случае ток пройдет по поверхности грудной клетки, не коснувшись сердца.
• За счет обильного волосяного покрова на груди электроды иногда плохо приклеиваются к коже. В этом случае нарушается контакт электрода с кожей и резко возрастает трансторакальный импеданс, поэтому прибор выдает сообщение: «проверьте электроды» или «убедитесь в хорошем прилегании электродов». В такой ситуации можно резким движением сорвать первоначально приклеенные (это приведет к удалению части волос под пластинами), и после этого наложить новую пару самоклеящихся электродов. Запасной вариант - обстригание волос как можно ближе к коже или сбривание их перед наложением новых электродов, что, однако, отнимает время. В случае использования не самоклеящихся, а прикладываемых пластин, поможет сильное надавливание на пластины.
• Проводя дефибрилляцию у больного с наличием постоянного водителя ритма или имплантируемого кардиовертерного дефибриллятора, не следует размещать электроды поблизости от места расположения прибора - генератора импульсов, так как дефибрилляция может вызвать сбои в его работе (после дефибрилляции важно проверить работоспособность имплантированного прибора). Водитель ритма или имплантируемый кардиовертерный дефибриллятор также может отвлекать на себя некоторое количество электрической энергии, которая предназначена для воздействия на миокард. В результате уменьшается ток, проходящий через сердце.
Этап 3. Анализ ритма
• Всех помощников и лиц, находящихся рядом, просят отдалиться. Необходимо убедиться, что никто из них не касается больного.
• Чтобы предотвратить возникновение артефактов, во время анализа ритма нельзя допускать шевеления и перемещения пострадавшего.
• В некоторых аппаратах оператор должен нажать на кнопку «АНАЛИЗ» («ANALYZE»). Другие приборы автоматически приступают к анализу, как только пластины электродов коснутся грудной клетки.
• Анализ ритма, в зависимости от марки автоматического внешнего дефибриллятора, занимает 5-15 с.
• Если выявлена фибрилляция желудочков, то прибор заявит об этом надписью на дисплее, посредством визуального, звукового оповещения или с помощью голосового синтезатора. Поступающая информация укажет на необходимость нанесения разряда.
Этап 4. Всех просят отстраниться от больного и нажимают кнопку «РАЗРЯД» («SHOCK»)
• Перед тем как нажать на кнопку «РАЗРЯД» («SHOCK»), необходимо убедиться, что никто не касается тела пострадавшего. Обязательно громко произносят предупреждающую фразу: «Я не касаюсь, вы не касаетесь, никто не касается» или кратко: «Все от больного!» Еще раз нужно проконтролировать, что никто не касается тела человека.
• В большинстве приборов, если регистрируется ритм, требующий дефибрилляции, конденсаторы заряжаются автоматически. Появление тона, сообщения голосового синтезатора или световая индикация сигнализируют о начале зарядки.
• Разряд можно наносить только тогда, когда все удалены из зоны действия дефибриллятора. Прохождение тока приводит к резкому сокращению мускулатуры больного.
• После первого разряда не нужно сразу приступать к СЛР. В некоторых автоматических внешних дефибрилляторах предусмотрено, что спасатель самостоятельно нажмет кнопку «АНАЛИЗ» («ANALYZE»). В других моделях после нанесения разряда немедленно автоматически начинается анализ ритма. Если фибрилляция желудочков продолжается, автоматический внешний дефибриллятор указывает на это, появляется сообщение «нанесение разряда показано» («shock indicated»), и цикл «зарядки» («charging») повторяется во второй, а если необходимо, то и в третий раз. Автоматический внешний дефибриллятор запрограммирован на повторение анализа ритма больного и способен максимально быстро осуществить серию циклов (до трех).
• Нанесение серии разрядов предусмотрено с той целью, чтобы идентифицировать и устранить те нарушения ритма, которые поддаются электроимпульсивному воздействию, причем максимально быстро, поэтому в процесс работы автоматического внешнего дефибриллятора спасатель вмешиваться не должен.
• Автоматические внешние дефибрилляторы запрограммированы на паузу после нанесения трех разрядов, что позволяет проводить СЛР. Таким образом, после троекратной дефибрилляции необходимо проверить наличие циркуляции и быть готовым приступить
к СЛР, продолжать выполнять компрессию и искусственное дыхание в течение 1 мин (см. ниже).
Уровни энергии разряда
1. Традиционно рекомендуемая мощность первого однофазного разряда составляет 200 Дж.
2. Мощность второго и третьего разрядов может либо оставаться прежней (200 Дж), либо повышаться до 360 Дж.
3. Неудача при нанесении разряда с одной энергией не означает, что не удастся достичь эффекта, если попытку просто повторить. С клинической точки зрения нет оснований наращивать мощность только по причине отсутствия результата от первого разряда. При любом уровне энергии вероятность достижения дефибрилляции остается стабильной.
4. Поскольку трансторакальное сопротивление току при повторении разрядов снижается, при последовательно наносимых разрядах, даже если они одинаковой мощности, через тело будет проходить больший ток. Еще большего нарастания тока можно добиться, увеличивая энергию разряда, - аргумент в пользу повышения мощности второго разряда. Компромиссом явилось указание не на конкретную величину, а на определенный интервал величин мощности (от 200 до 300 Дж) при нанесении второго однофазного разряда.
5. Если два предыдущих однофазных разряда не привели к дефибрилляции, при нанесении третьего разряда следует немедленно повысить мощность до 360 Дж.
6. В случае возобновления фибрилляции желудочков после первоначально успешной дефибрилляции попытку повторяют с разрядом такой же мощности, как и в тот раз, когда удалось достичь эффекта.
7. Пока нет возможности дать конкретную рекомендацию в отношении энергии первого и последующих разрядов без наращивания мощности при дефибрилляции двухфазным дефибриллятором. На сегодняшний день двухфазные разряды без наращивания мощности дают равную или более высокую частоту устранения фибрилляции желудочков, чем однофазные с прогрессивным увеличением мощности.
8. Наиболее важный фактор, определяющий шансы на выживание при фибрилляции желудочков у взрослых, - оперативность проведения дефибрилляции. К дефибрилляции следует приступить сразу же, как только дефибриллятор окажется в руках спасателя.
9. Если первыми тремя разрядами купировать приступ не удалось, необходимо продолжить проведение СЛР, обеспечить внутривенный доступ, по возможности заинтубировать трахею, ввести эпинефрин.
10. Затем, если фибрилляция желудочков продолжается, еще раз осуществляют дефибрилляцию и решают вопрос о применении амиодарона или лидокаина.
Исходы дефибрилляции и первые действия после ее завершения
«Нанесение разряда показано» («shock indicadet»). Сообщение на экране монитора - «рецидив фибрилляции желудочков» («recurrent vf»)
1. Если после нанесения трех разрядов циркуляция не восстановилась, до приезда бригады службы экстренной медицинской помощи спасатели должны продолжать проведение СЛР в течение следующих 60 с. В большинстве случаев по прошествии этого времени прибор укажет на необходимость проверить наличие признаков кровообращения.
2. Если фибрилляция желудочков продолжается, то после анализа ритма далее следует дополнительная серия из трех разрядов, включенных в единую последовательность.
3. После этого вновь приступают к СЛР, проводят ее в течение 1 мин, до тех пор пока на экране автоматического внешнего дефибриллятора не появится сообщение о том, что «нанесение разрядов не показано» («no shock indicated»).
4. Нельзя проверять, появились ли признаки циркуляции, в процессе нанесения серии разрядов, т.е. после нанесения первого и второго разрядов, четвертого и пятого, седьмого и восьмого и т.д. Такая проверка между разрядами при стойкой фибрилляции желудочков замедлит процесс идентификации ритма и нанесение последовательных разрядов. Быстрая череда разрядов дает дополнительное преимущество в виде небольшого снижения трансторакального импеданса. Это наращивает эффективность высвобождаемой энергии.
Сообщение на экране монитора «нанесение разряда не показано» («no shock indicated»)
Признаков наличия кровообращения нет
1. Когда автоматический внешний дефибриллятор выдает сообщение «нанесение разряда не показано» («no shock indicated»), проверяют, не появилось ли кровообращение.
2. В случае его отсутствия возобновляют СЛР.
3. Три сообщения «нанесение разряда не показано» («no shock indicated») позволяют говорить о том, что вероятность восстановления
ритма мала. В связи с этим анализ ритма повторяют только с наблюдением 1-2-минутных пауз для проведения СЛР.
4. Во время анализа ритма СЛР необходимо прервать. В этот период никто не должен касаться больного.
Признаки кровообращения есть
1. В случае восстановления циркуляции проверяют, есть ли самостоятельное дыхание.
2. Если больной не дышит, приступают к искусственному дыханию с частотой 10-12 вдуваний в минуту.
3. При наличии адекватного дыхания пострадавшему придают устойчивое (восстановительное) положение на боку.
4. Автоматический внешний дефибриллятор нужно оставить подключенным. Возобновление фибрилляции желудочков заставит автоматический внешний дефибриллятор подсказать спасателю, чтобы он еще раз проверил «признаки наличия кровообращения», аппарат выдаст сообщение «проверь состояние больного» («check patient»).
5. Прибор при этом зарядится автоматически и порекомендует спасателю нанести дополнительную серию разрядов.
Применение автоматического внешнего дефибриллятора в машине скорой помощи
1. В процессе транспортировки больного в движущейся санитарной машине автоматический внешний дефибриллятор можно оставить подключенным, однако, пока больной не удален из транспортного средства, ни в коем случае не следует нажимать кнопку «АНАЛИЗ» («ANALYZE»), так как движение машины может повлиять на оценку ритма, а артефакты - симулировать фибрилляцию желудочков.
2. Некоторые приборы позволяют постоянно контролировать состояние больного.
3. Если в процессе транспортировки возникает необходимость в оценке ритма или нанесение разряда, следует остановить машину, а затем повторить анализ ритма.
Применение внешнего дефибриллятора одним спасателем
В некоторых ситуациях при остановке кровообращения у пострадавшего спасателю приходится работать с автоматическим внешним дефибриллятором одному. Он должен быстро сообщить о чрезвычай-
ном происшествии службе, оказывающей экстренную помощь на данной территории, чтобы обеспечить возможность предоставления специализированной кардиореанимационной помощи. Действия спасателя в рамках базового реанимационного пособия в отношении взрослого человека выстраиваются в следующую последовательность.
1. Убедиться в том, что пострадавший не отвечает на раздражители.
2. Как только появится возможность, связаться со службой экстренной медицинской помощи и проинформировать ее о случившемся.
3. Обеспечить проходимость дыхательных путей, проверить наличие или отсутствие самостоятельного дыхания.
4. Если дыхание отсутствует, сделать первые два вдувания воздуха или более.
5. Определить «признаки наличия кровообращения» или пульсацию на сонной артерии. Если кровообращения нет, то подключают автоматический внешний дефибриллятор и следуют алгоритму применения.
Допускается внесение разумных изменений в предложенную схему.
Тактика ведения больного после успешной реанимации
1. Когда обнаружены признаки возобновления циркуляции и дыхания, больному придают устойчивое (восстановительное) положение на боку.
2. Многие дефибрилляторы снабжены функцией продолжительного мониторирования ритма больного, они просигнализируют, если фибрилляция возобновилась.
3. Важно часто контролировать состояние больного с остановкой кровообращения и наличие самостоятельного дыхания.
В алгоритме применения автоматического внешнего дефибриллятора кратко отражен подход к ведению больного с остановкой кровообращения, когда в распоряжении спасателей имеется автоматический внешний дефибриллятор.
Прогноз при внезапной сердечной смерти
• Выживаемость после ВСС составляет от 5 до 60%, в зависимости от этиологии, места и времени проведения СЛР.
• Клиническое течение после СЛР зависит от продолжительности реанимации, характера основного заболевания, наличия неврологических симптомов.
• Выжившие после ВСС переживают повторные случаи ВСС в 20-25% в год. Частота рецидивов заметно снизилась после начала широкого использования кардиовертеров-дефибрилляторов.
1.4. БАЗОВОЕ РЕАНИМАЦИОННОЕ ПОСОБИЕ
Прежде чем мы перейдем к обсуждению следующих нозологических форм ИБС (острый коронарный синдром, инфаркт миокарда, стенокардия), я считаю важным остановиться на стандарте проведения базового реанимационного пособия. Знания и практические навыки в этой области - неотъемлемая часть успеха лечения больных ИБС. Мы рассмотрим оказание базового реанимационного пособия не только при неотложных состояниях, связанных с течением ИБС, но и при утоплении, травме, электротравме. Мой опыт участия в итоговой государственной аттестации выпускников показывает, что, к сожалению, они имеют недостаточные знания в области оказания базового реанимационного пособия, а без них молодой врач не может приступать к работе.
Под термином «базовое реанимационное пособие» подразумевают комплекс мер, направленных на спасение жизни при первом контакте с пострадавшим или заболевшим. К ним относят:
1) быстрое распознавание ситуации и выполнение мероприятий, направленных на предотвращение аспирации и остановки кровообращения;
2) обеспечение вентиляции легких (искусственное дыхание), если произошла остановка дыхания;
3) выполнение наружного массажа сердца и искусственного дыхания, т.е. СЛР, в случае наступления клинической смерти;
4) проведение дефибрилляции больному с фибрилляцией желудочков или желудочковой тахикардией автоматическим внешним дефибриллятором;
5) выявление и устранение обструкции дыхательных путей инородным телом.
К базовому реанимационному пособию должен приступить любой человек, оказавшийся рядом с пострадавшим или внезапно заболевшим, в том числе медицинский работник. Действия последнего могут быть дополнены специальными приемами, которые входят в арсенал специализированной кардиореаниматологической помощи.
Показания к проведению базового
реаниматологического пособия и сердечно-легочной реанимации
Остановка дыхания
Причиной остановки дыхания могут стать асфиксия, инсульт, отравление продуктами горения, отеки гортани, передозировка лекарств или наркотиков, поражение электрическим током, тяжелая травма, кома любого происхождения и многое другое. Если возникает первичная остановка дыхания, то сердце и легкие в течение нескольких минут способны поддерживать оксигенацию и циркуляцию крови, и кислород не перестанет поступать в головной мозг и другие жизненно важные органы.
Остановка кровообращения
Остановка кровообращения возникает, когда сердце прекращает выполнение своей насосной функции. Это наблюдается при асистолии, фибрилляции желудочков, желудочковой тахикардии, состоянии, которое характеризуется электрической активностью без пульса. При внезапной остановке кровообращения спонтанное дыхание может некоторое время продолжаться.
Оценка состояния жизненно важных функций
организма
Обеспечив безопасность, приступают к оценке состояния пострадавшего. В первую очередь обращают внимание на жизненно важные функции организма: сознание, дыхание, кровообращение, которые оценивают по предельно упрощенной, но весьма эффективной схеме.
Сначала устанавливают, в сознании ли пострадавший: отвечает ли он на обращение, громкий оклик. Если сознание, реакция на раздражители отсутствуют, необходимо:
1) проверить, проходимы ли дыхательные пути, обеспечить их проходимость;
2) удостовериться в наличии самостоятельного дыхания; определить, совершает ли движения грудная клетка, ощущается ли выдыхаемый изо рта и носа воздух, слышно ли, как дышит человек;
3) постараться определить пульс на сонных артериях (прощупывают сонную артерию с одной стороны). Не следует заниматься подсчетом пульса, поскольку в рассматриваемой ситуации важно лишь выяснить
наличие или отсутствие пульсации: пульсация есть - кровообращение сохранено, пульсации нет - кровообращение прекратилось.
На прощупывание каротидного пульса отводится 5-10 с, и этот этап выполняют только в случаях, когда помощь оказывает медицинский работник. Поскольку даже врачи обычно затрачивают на это более 24 с, на сегодняшний день решено проверку пульса заменить выявлением признаков наличия сердечной деятельности: появление нормального дыхания, кашля или активных движений в ответ на первые 1-2 вдувания воздуха в легкие пострадавшему.
Если нет полной уверенности в сохранности кровообращения, то немедленно приступают к проведению наружного массажа сердца.
Проверку пульса у пострадавшего старше 1 года осуществляют на сонной артерии. Альтернатива - пальпация бедренной артерии, ее прощупывают у маленьких детей. Пульс этих артерий не исчезает, даже если на фоне гипотензии или малой перфузии пульсация периферических артерий не определяется.
Сердечно-легочная реанимация
Мероприятия, обеспечивающие проходимость дыхательных путей
СЛР подразумевает проведение мероприятий, направленных в первую очередь на поддержание жизнедеятельности организма - восстановление дыхания и кровообращения. Цель СЛР состоит в обеспечении хотя бы на минимальном уровне снабжения кислородом головного мозга, кора которого погибает в условиях кислородного голодания уже через несколько минут (не более 5 мин).
В ситуации, когда отсутствует сознание, а дыхание не определяется, необходимо думать о нарушении проходимости дыхательных путей. К числу возможных причин относят:
1) западение языка (рис. 67), задняя часть которого, опускаясь (если пострадавший лежит лицом вверх), способна перекрыть вход в гортань;
2) присутствие инородного тела в дыхательных путях.
Западение языка устраняют, запрокинув голову пострадавшего и выдвинув его нижнюю челюсть. При запрокидывании головы задняя стенка глотки отдаляется от языка, и между ними появляется пространство. Сложности возникают только в случае подозрения на перелом шейного отдела позвоночника (необходимо иметь в виду, что при повреждении шейного отдела позвоночника особенно опасны движения с поворотом головы и наклонами в стороны).
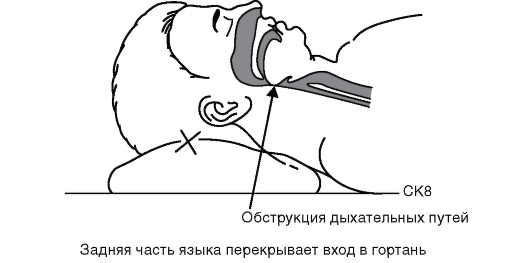
Рис. 67. Неправильное положение больного при реанимации (западение языка)
Добиться отведения головы назад очень легко. Человеку, лежащему на спине, под лопатки подкладывают что-то мягкое (сложенная одежда, домашние тапочки или другой предмет). Если основание шеи при этом немного приподнимается, то голова автоматически окажется запрокинутой.
Выполнить обратное действие - приподнять корень языка - позволяет выдвижение вперед нижней челюсти (рис. 68). Такой прием особенно выгоден, когда не исключено повреждение шейного отдела позвоночника, а чрезмерное отведение головы назад способно привести к смещению отломков. Для осуществления приема помощник, двумя руками охватив голову с обеих сторон и надавливая пальцами на углы нижней челюсти, должен выдвинуть челюсть вперед относительно пострадавшего. Пространство для прохождения воздуха еще более расширится, если выполнить данную манипуляцию одновременно с небольшим запрокидыванием головы.
Инородные тела, в том числе пища, съемные зубные протезы, земля и песок, рвотные массы, могут присутствовать в полости рта и препятствовать прохождению воздуха. Их удаляют из полости рта и глотки пальцем (если они располагаются в зоне досягаемости). Рвотные массы вытекают, если быстро перевернуть человека на бок. Отсосы облегчают данную манипуляцию. Небольшие ручные отсосы можно иметь в укладке для оказания первой медицинской помощи. Ситуация, когда инородное тело полностью перекрывает дыхательные пути, требует особого внимания (см. ниже).
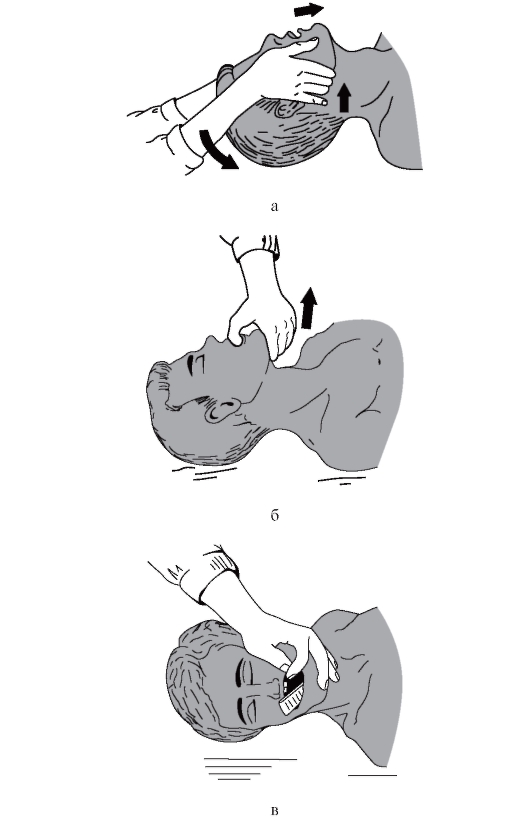
Рис. 68. Восстановление проходимости дыхательных путей: а - выдвижен верхней челюсти; б - выдвижение нижней челюсти; в - устранение запад ния языка
Осуществление искусственного дыхания
Искусственное дыхание проводят методом изо рта в рот (рис. 69) или изо рта в нос непосредственно или через барьерные принадлежности, маску. Возможно использование мешка Амбу с маской.
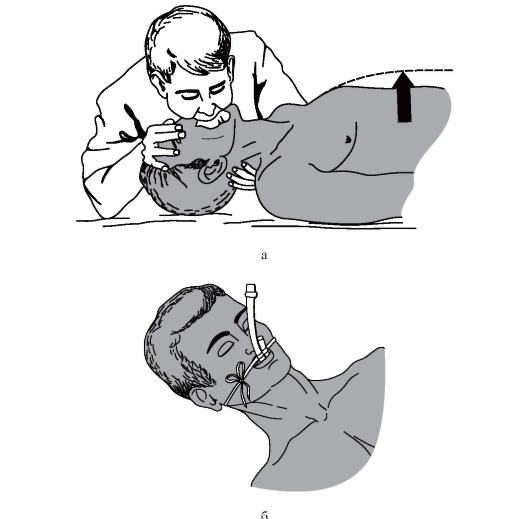
Рис. 69. Искусственное дыхание: а - изо рта в рот; б - установлена дыхательная трубка
Искусственное дыхание изо рта в рот
Приступая к проведению искусственного дыхания, нужно обеспечить проходимость дыхательных путей, зажать нос пострадавшему и охватить его рот своим ртом.
Для этого:
1) одну ладонь кладут на лоб пострадавшего, зажимают его нос указательным и большим пальцами, что исключает утечку воздуха через нос;
2) делают глубокий вдох и плотно охватывают своим ртом губы пострадавшего;
3) производят медленно (в течение 2 с) вдувания воздуха, следя за тем, чтобы грудная клетка поднималась при каждом вдувании.
При проведении искусственного дыхания изо рта в рот желудок часто наполняется воздухом. Переполнение желудка резко осложняет реанимацию: возможны регургитация и аспирация. За счет нарастания внутрижелудочного давления приподнимается диафрагма, ограничивается подвижность легких и уменьшаются резервы системы дыхания. В состоянии клинической смерти, в связи с расслаблением нижнего пищеводного сфинктера, вероятность раздувания желудка возрастает.
Чтобы снизить риск переполнения желудка во время искусственного дыхания изо рта в рот, необходимо вдувать воздух медленно, стараясь не наращивать его объем, но добиваясь подъема грудной клетки. В отношении взрослого человека при вентиляции методом изо рта в рот этот объем, как правило, составляет приблизительно 10 мл/кг (от 700 до 1000 мл), его вдувают за 2 с.
Если первоначальные (и последующие) попытки вдувания воздуха в легкие пострадавшего оказались безуспешными, и воздух не проходит, следует изменить положение головы и повторить попытку. Если вновь не удается осуществить вдувание воздуха, медицинский работник должен прибегнуть к манипуляциям по устранению обструкции дыхательных путей инородным телом (см. ниже).
Искусственное дыхание изо рта в нос
Метод выполнения искусственного дыхания изо рта в нос рекомендуют применять в ситуациях, когда рот не удается открыть (тризм), имеются тяжелые повреждения в области рта или не удается достигнуть герметичного соединения губ спасателя с губами пострадавшего.
1. Одной рукой голову человека запрокидывают назад (рука лежит на лбу), другой поджимают нижнюю челюсть (как при выполнении приема с запрокидыванием головы и приподниманием подбородка) и закрывают рот пострадавшего.
2. Делают глубокий вдох, охватывают ртом нос пострадавшего и вдувают воздух в его нос.
3. Затем, отстранившись от лица пострадавшего, выдерживают паузу для пассивного выдоха.
4. Чтобы выход воздуха был более свободным, можно периодически открывать рот пострадавшего, раздвигая его губы большим пальцем. Это особенно необходимо, если имеется частичная обструкция носовых ходов.
Искусственное дыхание изо рта в трахеостому
Трахеостома - постоянно открытое отверстие на передней поверхности шеи, которое образует сообщение между внешней средой и полостью трахеи. Если возникает необходимость в проведении искусственного дыхания человеку с трахеостомой, вентиляцию осуществляют непосредственно через стому. Нужно охватить ртом шею в месте расположения трахеостомы, обеспечив при этом герметичность, и вдувать воздух в стому, контролируя ситуацию по движению передней грудной стенки. Затем, отстранившись, дают возможность воздуху выйти наружу.
В стоме может находиться трахеостомическая трубка, она должна быть проходима. Если просвет трубки перекрыт и не удается его освободить (от секрета и тому подобного), трубку удаляют и заменяют на новую (лучше, если она будет снабжена раздуваемой манжеткой).
Искусственное дыхание изо рта в накладной клапан
Накладные клапаны представляют собой пластмассовую или силиконовую пленку, которая отделяет спасателя от пострадавшего.
1. Отверстие клапана размещается надо ртом пострадавшего. В некоторых моделях предусмотрена короткая (2,5-5 см) трубка. Если она присутствует, то при введении в рот пострадавшему ее нужно расположить над языком. Зажимают нос пострадавшего и герметично прижимаются ртом к месту, где располагается центральное отверстие. Одновременно необходимо выполнить прием с запрокидыванием головы и выдвижением подбородка. Таким образом, осуществляют вдувание воздуха.
2. Накладной клапан должен оставаться на лице во время всего реанимационного цикла, состоящего из наружного массажа сердца и искусственного дыхания. Если у пострадавшего возникает рвота, следует удалить клапан, немедленно повернуть человека на бок и прочистить дыхательные пути.
3. Эффективность накладных клапанов документально пока никем не подтверждена, в связи с этим медицинские работники должны относиться к ним только как к замене метода изо рта в рот и при первой же
возможности переходить на искусственное дыхание изо рта в маску или вентиляцию мешком Амбу с маской.
Искусственное дыхание изо рта в маску
Для выполнения такой процедуры необходима прозрачная маска с однопроходным пневмораспределителем или без него. Клапан призван пропускать воздух в направлении пострадавшего и отводить его во время выдоха. Некоторые устройства имеют в своем составе канюлю для подключения кислорода, что позволяет обогащать воздух чистым кислородом.
Вентиляция легких методом изо рта в маску особенно эффективна, так как позволяет спасателю использовать обе руки для прижимания маски и обеспечения герметичности. Разработано две методики проведения искусственного дыхания через маску. Согласно первой из них спасатель располагается со стороны головы пострадавшего (подхода со стороны головы). Такой подход удобен для оказания помощи одним спасателем при отсутствии у пациента дыхания (но при сохраненном кровообращении) или при выполнении СЛР двумя спасателями. Одновременно используется прием с выдвижением нижней челюсти. Расположение спасателя дает преимущество: хорошо видна грудь пострадавшего для контроля эффективности вдувания воздуха.
1. Ориентируясь по переносице, правильно располагают маску на лице пострадавшего.
2. Прижимают маску двумя руками с обеих сторон той частью ладони, которая соответствует большому пальцу и тенару.
3. Указательные пальцы располагают у угла нижней челюсти пострадавшего, приподнимают ее, одновременно прижимая маску и запрокидывая голову назад. Остальные пальцы размещают в области угла нижней челюсти.
4. Одновременно с подниманием нижней челюсти прижимают маску большими пальцами и тенарами, чтобы обеспечить герметичность.
5. Медленно (в течение 2 с) вдувают воздух в легкие, одновременно наблюдая за тем, как приподнимается грудная клетка.
Альтернативный вариант подхода со стороны головы заключается в обеспечении герметичности придавливанием краем маски к лицу с обеих сторон большим и указательными пальцами. Остальные пальцы должны приподнимать угол нижней челюсти и вытягивать шею. При обоих вариантах методики спасатель использует обе руки, чтобы удерживать маску и обеспечивать проходимость дыхательных путей. У пострадавшего с подозрением на повреждение головы
или шеи (с возможным повреждением шейного отдела позвоночника) следует выдвинуть нижнюю челюсть за углы, но нельзя запрокидывать голову.
При второй методике, подходе сбоку, спасатель располагается сбоку от пострадавшего и пользуется приемом с запрокидыванием головы и приподниманием подбородка. Подход сбоку идеален для выполнения СЛР одним спасателем, так как у него в этом случае есть возможность, почти не меняя положения, переходить от искусственного дыхания к наружному массажу сердца.
1. Ориентируясь по переносице, правильно располагают маску на лице пострадавшего.
2. Плотно прижимают маску указательным и большим пальцами, расположив их по краю маски со стороны лба пострадавшего; большой палец другой руки - по нижнему краю маски.
3. Плотно прижимают маску, чтобы обеспечить герметичность.
4. Медленно вдувают воздух, наблюдая за тем, как приподнимается грудная клетка.
Для эффективного использования маски необходима тщательная отработка навыков. При наличии двух спасателей маску можно использовать различными способами. Выбор самого приемлемого метода зависит от опыта персонала и наличия оборудования. При осуществлении искусственного дыхания изо рта в маску можно одновременно применять воздуховоды, надавливание на перстневидный хрящ и выполнять другие вспомогательные приемы.
Если имеется возможность подведения к маске кислорода, можно вдувать меньший объем: за 1-2 с 6-7 мл/кг или 400-600 мл. Меньший объем снижает риск нагнетания воздуха в желудок.
Искусственное дыхание мешком Амбу с маской
Мешок Амбу с маской - удобный инструмент для оказания реанимационной помощи на догоспитальном этапе. Он представляет собой саморасправляющийся мешок с присоединенной к нему маской. Комплект из мешка и маски наиболее эффективен, если помощь оказывают два грамотных и натренированных спасателя.
1. Спасатель, располагающийся со стороны головы пострадавшего, указательными и большими пальцами плотно прижимает маску к лицу, охватив ее по краям. Остальные его пальцы приподнимают нижнюю челюсть и распрямляют шею. При этом он наблюдает за грудной клеткой.
2. Другой спасатель не слишком быстро сдавливает мешок (в течение 2 с), одновременно контролируя движения передней грудной стенки.
Если возможно подведение кислорода с потоком не менее 8-12 л/мин (при этом концентрация кислорода повышается до 40% и более), спасатель, имеющий навык использования мешка с маской, должен стараться вдувать воздух в количестве 6-7 мл/кг или 400-600 мл в течение 1-2 с.
Методика проведения искусственного дыхания с помощью мешка с маской требует тщательной отработки навыков. Спасатель должен уметь эффективно использовать устройство в любых ситуациях.
Если спасатель действует один, ему следует занять позицию со стороны головы пострадавшего. Одной рукой на лице пострадавшего удерживают маску (для выбора правильного положения маски ориентируются по переносице). Третий, четвертый и пятый пальцы этой руки должны располагаться вдоль основания нижней челюсти, а большой и указательный пальцы - на маске. Голову удерживают в запрокинутом состоянии, а нижнюю челюсть - выдвинутой, чтобы обеспечивать проходимость дыхательных путей и надежно удерживать маску.
Второй рукой сдавливают мешок. Вдувают воздух в течение 2 с (этот промежуток можно сократить до времени в интервале от 1 до 2 с, если вводится меньший объем воздуха в смеси с кислородом). Крайне важно следить за герметичностью прилегания маски.
Эффективна вентиляция, когда работают два спасателя: один удерживает маску в правильном положении, а второй сжимает мешок. Техника фиксации маски такая же, как описанная выше при проведении искусственного дыхания изо рта в маску. При наличии дополнительного спасателя ему можно поручить надавливание на перстневидный хрящ (см. ниже).
Осуществление наружного массажа сердца
Наружный массаж сердца заключается в ритмичных надавливаниях на грудную клетку в нижней части грудины. Ритмическая компрессия сердца создает кровоток как за счет повышения внутригрудного давления, так и за счет прямого сдавления органа. Перемещение крови в легочных сосудах, возникающее благодаря компрессиям грудной клетки, и газообмен в результате искусственной вентиляции легких (ИВЛ) обеспечивают мозг и другие жизненно важные органы достаточным количеством кислорода до тех пор, пока не будет восстановлено самостоятельное кровообращение.
1. Рекомендованная частота компрессий составляет 100 в минуту. Указанная величина определяет скорость выполнения компрессий, а не точное число компрессий в 1 мин. При скорости компрессий 100 в минуту на самом деле за минуту будет выполнено меньшее число компрессий, поскольку часть времени уйдет на вдувание воздуха в легкие пострадавшего.
2. При соотношении 15:2 число компрессий грудной клетки в минуту больше, чем при соотношении 5:1 (приблизительно 64 против 50). Доказано, что взрослых пострадавших удается спасать чаще, если во время СЛР выполняют большее число компрессий, даже если это происходит в ущерб количеству вдувания воздуха.
3. Исходя из этих соображений, теперь при оказании помощи как одним, так и двумя спасателями рекомендуют до момента интубации придерживаться соотношения компрессий и вентиляций, равного 15:2. Это положение применимо для базового реанимационного пособия взрослому человеку вне зависимости от того, кто оказывает помощь.
4. Как только воздухоносные пути становятся защищенными, т.е. с момента введения интубационной трубки с манжетой, непрямой массаж сердца и вентиляцию легких можно продолжать в отношении 5:1 без синхронизации.
При проведении наружного массажа сердца пострадавший должен лежать на спине, на твердой поверхности. Если пострадавшего нельзя снять с кровати, то под него подкладывают твердый щит (желательно на всю ширину кровати).
Для выполнения наружного массажа сердца (рис. 70) одну ладонь помещают на границе между средней и нижней третями грудины; вторую ладонь кладут на первую и делают энергичные толчки в переднезаднем направлении. Пауза для вдувания воздуха в легкие - возможность частично расслабить руки.
Важны ритм искусственного дыхания и ритм выполнения массажных движений. Сначала производят два не слишком быстрых (в течение 2 с) нефорсированных вдувания воздуха (необходимо, чтобы грудная клетка при этом приподнималась, а воздух не встречал препятствий), затем делают 15 надавливаний на грудную клетку. Этот цикл повторяют. Присутствие напарника значительно облегчает работу.
Нельзя начинать надавливание на грудную клетку до окончания процесса вдувания воздуха изо рта в рот или изо рта в нос. Недостаточная скоординированность приводит к нагнетанию воздуха в желудок, что создает значительную помеху.
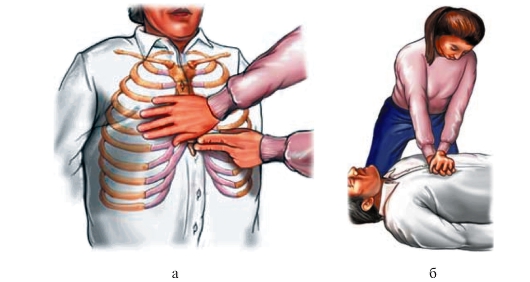
Рис. 70. Выполнение непрямого массажа сердца: а - определение точки для выполнения непрямого массажа сердца; б - положение рук при проведении непрямого массажа сердца
Полезный прием - надавливание кончиком указательного пальца на перстневидный хрящ. Это предотвращает попадание воздуха в желудок и заброс содержимого желудка в полость рта и глотки в процессе проведения искусственного дыхания и наружного массажа сердца. Чтобы воспользоваться данным приемом, нужно иметь хотя бы одного помощника.
После повторений циклов искусственного дыхания и наружного массажа сердца необходимо проконтролировать наличие или отсутствие самостоятельных дыхания и пульса. Если появился пульс, а дыхания нет, то продолжают дышать за больного. Если восстановилось и то, и другое, можно реанимацию считать удачной. В противном случае реанимационные мероприятия продолжают выполнять, но не более 40-60 мин.
Устойчивое (восстановительное) положение
на боку
В случае успешной реанимации состояние пострадавшего будет оставаться тяжелым. Ему следует придать устойчивое (восстановительное) положение на боку (рис. 71).
Такое положение удобно для наблюдения за больным и для транспортировки, оно предотвращает западение языка и попадание рвотных масс в дыхательные пути. Самый приемлемый вариант: положение на боку с подложенной под голову ладонью верхней (относительно

Рис. 71. Устойчивое (восстановительное) положение
лежащего человека) согнутой руки. Нижняя рука вытянута вперед и согнута под углом 90° в локтевом суставе (голова при этом должна быть опущена, чтобы жидкость из полости рта свободно вытекала). Нижняя нога выпрямлена, верхняя согнута под прямым углом в тазобедренном и коленном суставах. Пострадавшего нужно повернуть на другой бок, если данное положение сохраняется более 30 мин.
Периодическая оценка состояния при проведении сердечно-легочной реанимации
Одна из задач спасателей - мониторинг состояния пострадавшего и оценка эффективности проводимых мероприятий. После нескольких повторений циклов с чередованием искусственного дыхания и наружного массажа сердца (например, через каждые 4-6 циклов) следует проверить, не появились ли признаки наличия кровообращения или пульсация на сонных артериях (не допуская при этом потери времени, превышающей 10 с). Если признаков нет, продолжают СЛР, начиная с наружного массажа сердца. Если признаки наличия кровообращения выявляются, то проверяют, нет ли самостоятельного дыхания.
1. При наличии дыхания пострадавшему придают устойчивое положение на боку и контролируют его дыхание и кровообращение.
2. Если дыхание отсутствует, но признаки наличия кровообращения или пульсации на сонных артериях появились, продолжают искусственное дыхание с частотой 10-12 в минуту (одно вдувание через каждые 4-5 с).
3. Если их нет, то продолжают выполнение наружного массажа сердца и ИВЛ в соотношении 15:2.
4. Никогда, за исключением особых обстоятельств, не следует прерывать осуществление СЛР.
Если восстановилось достаточное активное спонтанное дыхание и появились признаки кровообращения, продолжают следить за проходимостью дыхательных путей и придают телу пострадавшего устойчивое (восстановительное) положение на боку.
Прекращение реанимационных мероприятий
Критерии неэффективности реанимационных мероприятий и сигнал к прекращению попыток вернуть человека к жизни - появление безусловных признаков биологической смерти.
1. Один из самых ранних и наглядных таких признаков (по прошествии 40 мин с момента наступления смерти) - трупные пятна. Они выглядят как синюшные или синюшно-багровые разлитые пятна на нижерасположенных поверхностях тела (область спины, ягодицы, задняя поверхность ног, если человек лежит на спине).
2. Ориентироваться по диаметру зрачка не следует, так как при наступлении биологической смерти зрачок останавливается в произвольном положении.
3. У мертвого человека при надавливании на глазное яблоко меняется форма зрачка, чего никогда не бывает у живого.
1.5. ОСТРЫЙ КОРОНАРНЫЙ СИНДРОМ
Острый коронарный синдром (ОКС) - временный «рабочий» диагноз, необходимый для первичной оценки, стратификации риска, выбора тактики лечения у больных с обострением ИБС. После непродолжительного наблюдения и диагностики (обычно не более 24 ч) вариант обострения ИБС уточняют (нестабильная стенокардия, инфаркт миокарда без подъема сегмента ST, инфаркт миокарда с подъемом сегмента ST) либо исключают коронарную природу болей. Термин возник для того, чтобы иметь возможность оперативно выбирать лечебную тактику до установления окончательного диагноза.
Классификация острого коронарного синдрома
Классификация острого коронарного синдрома приведена на рис. 72.
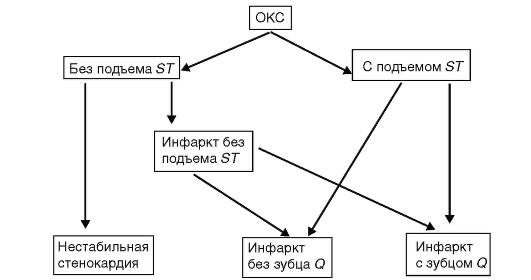
Рис. 72. Классификация острого коронарного синдрома
Острый коронарный синдром без подъема сегмента ST
Острый коронарный синдром без подъема сегмента ST (ОКСБП ST) характеризуется наличием ангинозных приступов и отсутствием подъема сегмента ST на ЭКГ. К ОКСБП ST относят нестабильную стенокардию и инфаркт миокарда без подъема сегмента ST.
Нестабильная стенокардия - это ухудшение клинической картины стенокардии, выражающееся в увеличении частоты и продолжительности приступов, снижении толерантности к нагрузкам, уменьшении эффективности антиангинального лечения. К нестабильной стенокардии относят любые варианты впервые возникшей стенокардии (последние 2 мес). Тяжесть и продолжительность приступа при нестабильной стенокардии недостаточны для развития некроза миокарда. Обычно на ЭКГ нет подъемов ST. Отсутствует выброс в кровоток биомаркеров некроза миокарда в количествах, достаточных для диагноза «инфаркт миокарда».
Инфаркт миокарда без подъемов сегмента ST (ИМБП ST) - острая ишемия миокарда, приводящая к его некротическому повреждению. На исходной ЭКГ нет подъемов ST. У большинства больных, болезнь которых начинается как ИМБП ST, зубцы Q не появляются, и, в конце концов, им ставят диагноз «мелкоочагового инфаркта миокарда без зубца Q на ЭКГ». ИМБП ST отличается от нестабильной стенокардии наличием (повышением уровней) маркеров некроза миокарда, которые при нестабильной стенокардии отсутствуют.
Этиология
В основе патогенеза ОКСБП ST в большинстве случаев лежит неокклюзирующий пристеночный тромбоз на поверхности поврежденной атеросклеротической бляшки. Иногда к ОКСБП ST приводят другие факторы: спазм коронарных артерий, механическая обструкция (быстрый рост) бляшки, воспаление и (или) инфекция. При вторичных формах нестабильной стенокардии причины экстракардиальные.
Классификация
Клинические формы нестабильной стенокардии:
1) впервые возникшая стенокардия в течение 2 последних месяцев;
2) прогрессирующая стенокардия - частота и (или) продолжительность ангинозных приступов увеличивается, толерантность к нагрузкам снижается, появляются приступы в покое, а также снижается эффективность антиангинальных препаратов; при развитии нестабильной стенокардии больной переходит не менее чем на один класс вверх согласно функциональной классификации;
3) стенокардия покоя - приступы в покое продолжительностью более 20 мин в течение 2 мес.
Общепринята клинико-функциональная классификация нестабильной стенокардии по Браунвальду (1989) (табл. 6). • По тяжести.
- Класс I. Впервые возникшая или прогрессирующая стенокардия напряжения .
Впервые возникшая (продолжительностью менее 2 мес) стенокардия с тяжелыми или частыми (>3 в сутки) приступами или стабильная стенокардия с прогрессирующим течением (приступы становятся более частыми, тяжелыми, продолжительными и провоцируются меньшей нагрузкой, чем ранее). В этот класс не входит стенокардия покоя в течение последних 2 мес.
Таблица 6. Классификация нестабильной стенокардии (C. W. Hamm, E. Braunwald)
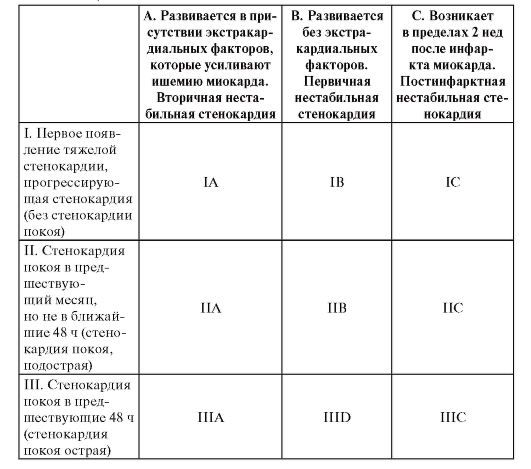
- Класс II. Подострая стенокардия покоя.
Не менее одного приступа стенокардии покоя на протяжении предшествующего месяца. В этот класс не входит стенокардия покоя за последние 48 ч.
- Класс III. Острая стенокардия покоя.
Не менее одного приступа стенокардии покоя за последние 48 ч. • По причинам возникновения:
- Класс А. Вторичная нестабильная стенокардия. Вызвана точно установленными внешними причинами, не связанными с поражением коронарного русла: анемией, инфекцией, лихорадкой, гипотонией, тахиаритмией, тиреотоксикозом, дыхательной недостаточностью с гипоксией.
- Класс В. Первичная нестабильная стенокардия. Развивается при отсутствии внесердечных причин, перечисленных в классе А.
- Класс С. Постинфарктная нестабильная стенокардия. Развивается в течение 2 нед после документированного инфаркта миокарда.
• По интенсивности лечения:
1. Нестабильная стенокардия развивается при отсутствии лечения или при недостаточном (минимальном) антиангинальном воздействии.
2. Нестабильная стенокардия развивается на фоне соответствующего (оптимального) антиангинального лечения: β-адреноблокаторы, длительно действующие нитраты, блокаторы медленных кальциевых каналов.
3. Нестабильная стенокардия развивается на фоне применения максимально переносимых доз выше указанных трех групп препаратов, включая нитроглицерин внутривенно.
Диагностика
При оценке состояния больного необходимо выяснить:
1) вероятность взаимосвязи симптомов больного с обострением ИБС;
2) риск неблагоприятных исходов, включая смерть, инфаркт миокарда, острую сердечную недостаточность, опасные нарушения ритма сердца.
Внимание! При подозрении на ОКС нельзя ограничиваться контактом по телефону. Необходимы осмотр врача и регистрация ЭКГ в 12 отведениях.
Лабораторные исследования
Маркеры повреждения миокарда
Всем пациентам с подозрением на ОКС необходимо определить уровень биохимических маркеров некроза миокарда (сердечные тропонины I или Т, КФК и МВ-КФК) сразу и через 6-12 ч. Сердечные тропонины Т и I в качестве маркеров некроза миокарда предпочтительнее традиционно определяемых КФК и ее МВ-изоформы из-за их большей специфичности и надежности. Следует повторить анализ через 6-12 ч в случае отрицательного результата при первом исследовании или если с момента начала болевого приступа до взятия крови прошло менее 6 ч. Другие маркеры повреждения (миоглобин, ЛДГ) редко применяют в клинической практике.
Внимание! Повышенный уровень тропонинов Т или I свидетельствует о некрозе клеток миокарда и по современной классификации при наличии ангинозного приступа считается достаточным основанием для постановки диагноза ИМБП ST.
Для каждого маркера повреждения существуют характерное время появления в периферической крови, пик концентрации, а также продолжительность повышения уровня (рис. 73).
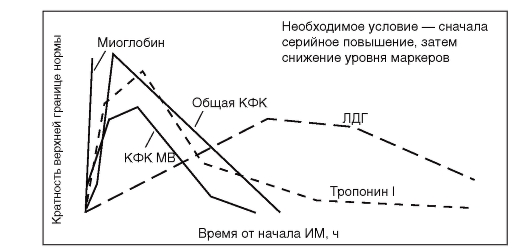
Рис. 73. Динамика маркеров повреждения миокарда
Общий и биохимический анализы крови
Всем пациентам с подозрением на ОКС следует провести стандартный общий и биохимический анализы крови для исключения альтернативных диагнозов, факторов, усугубляющих течение стенокардии, скрининг на сахарный диабет, гиперлипидемии, оценку состояния функций печени и почек.
Маркеры воспаления
В последнее время воспалению как причине дестабилизации атеросклеротической бляшки уделяют большое внимание. В этой связи широко изучают так называемые маркеры воспаления, в частности С-реактивный белок. Больных, у которых биохимические маркеры некроза миокарда отсутствуют, но повышен уровень С-реактивного белка, относят к группе высокого риска коронарных осложнений.
Инструментальные исследования
Электрокардиография
Всем пациентам с подозрением на ОКС обязательно снимают ЭКГ в 12 стандартных отведениях. Необходимо обратить внимание на следующие изменения:
- транзиторная депрессия или подъем сегмента ST;
- динамические изменения зубца T в виде инверсии, увеличения амплитуды острого положительного зубца Т;
- впервые появившиеся блокады ножек пучка Гиса.
Внимание! Следует выяснить, есть ли у больного ранее зарегистрированные ЭКГ, так как наиболее точный диагностический критерий ишемии миокарда - динамика ЭКГ, т.е. разница в положении конечной части желудочкового комплекса (ST-T) при сравнении с предыдущими ЭКГ. При ряде состояний, например гипертрофии левого желудочка, электролитных нарушениях, внутрижелудочковых блокадах, на ЭКГ могут постоянно присутствовать изменения, имитирующие ишемию (снижение сегмента ST).
Эхокардиография
Обнаружение во время ангинозного приступа транзиторного нарушения локальной сократимости левого желудочка не представляет собой безусловное доказательство ишемической природы болей. ЭхоКГ показана при необходимости дифференциальной диагностики с расслаивающейся аневризмой аорты, гипертрофической кардиомиопатией, аортальным стенозом.
Рентгенография органов грудной клетки
Этот метод позволяет обнаружить признаки сердечной недостаточности, а также исключить другие возможные причины болей в грудной клетке (аневризма грудного отдела аорты, заболевания легких).
Сцинтиграфия миокарда
Пациентам с малоинформативными результатами ЭКГ и ЭхоКГ можно провести сцинтиграфию миокарда с 99тТс-пирофосфатом. У больных с острым повреждением миокарда наблюдают дефект накопления радиофармпрепарата в зоне повреждения.
На основании данных обследования можно оценить вероятность ОКС у больного и стратифицировать риск (табл. 7-10).
После установления диагноза ОКС следует идентифицировать группу риска развития фатального и нефатального инфаркта миокарда в ближайший период (см. табл. 11, 12).
Если больной жалуется на боль в грудной клетке, предположительно связанную с ОКС, после первичной диагностики возможны следующие варианты:
- ОКС;
- возможный ОКС;
- стабильная стенокардия;
- внесердечные причины.
Таблица 7. Вероятность развития острого коронарного синдрома без подъема сегмента ST (анамнез, физикальное обследование)

Таблица 8. Вероятность развития острого коронарного синдрома без подъема сегмента ST (ЭКГ, лабораторная диагностика)

Таблица 9. Стратификация риска острого коронарного синдрома без подъема сегмента ST (анамнез, жалобы)
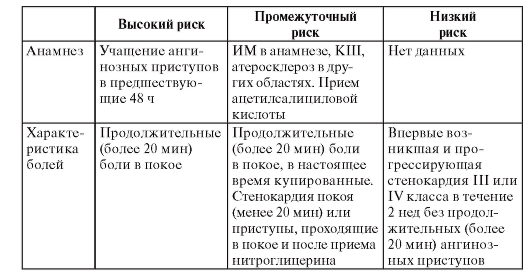
Таблица 10. Стратификация риска острого коронарного синдрома без подъема сегмента ST (обследование)
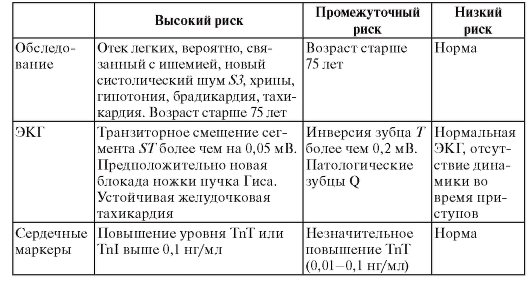
Алгоритм обследования и лечения больных с подозрением на острый коронарный синдром
Алгоритм ведения больных представлен на рис. 74.
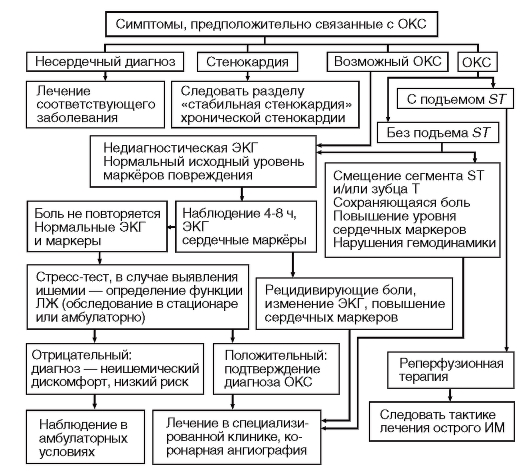
Рис. 74. Алгоритм ведения больных при подозрении на острый коронарный синдром
Дифференциальная диагностика
В первую очередь следует исключать другие причины болевого синдрома, требующие немедленной помощи и госпитализации.
• Острое расслоение аорты.
• Тромбоэмболия легочной артерии.
• Кровотечение из верхних отделов ЖКТ.
Для упрощения дифференциальной диагностики ниже представлены жалобы больного, которые должны заставить врача начать поиск экстракардиальных причин болей:
- плевритическая боль (острая, «прокол ножом», связанная с дыханием и кашлем);
- первичная локализация боли в мезо- и гипогастральной области;
- боль, которая по площади не превышает кончика пальца (точечная), особенно в области верхушки сердца;
- боль, вызываемая движением или пальпацией грудной клетки или рук;
- постоянная боль в течение нескольких часов;
- очень короткие эпизоды болей (несколько секунд);
- боль, иррадиирующая в ноги.
Лечение
Цели лечения
• Восстановление / улучшение кровотока в пораженной коронарной артерии.
• Профилактика окклюзии артерии (инфаркт миокарда).
• Уменьшение или устранение симптомов.
• Профилактика и лечение осложнений.
• Улучшение прогноза и увеличение продолжительности жизни (предупреждение инфаркта миокарда и ВСС).
Показания к госпитализации
1. Больных с подозрением на ОКС с продолжающимся дискомфортом в груди в покое, нестабильностью гемодинамики, признаками недостаточности кровообращения, синкопальными состояниями, ишемическими изменениями на ЭКГ следует немедленно госпитализировать в кардиологические блоки интенсивной терапии.
2. При высокой вероятности осложнений ОКС также показана экстренная госпитализация в кардиологический блок интенсивной терапии.
3. При промежуточной вероятности ОКС показана госпитализация в кардиологическое или терапевтическое отделение для уточнения диагноза.
4. При низкой вероятности ОКС можно продолжать обследования в амбулаторных условиях: нагрузочная проба, суточное ЭКГмониторирование, ЭхоКГ, определение уровня липидов и т.д.
Догоспитальный этап
Внимание! Всех пациентов с малейшим подозрением на ОКС следует рассматривать и вести как больных с ОКС до уточнения диагноза.
1. На догоспитальном этапе при первом контакте пациента с врачом (участковым, кардиологом поликлиники) следует провести клиническую оценку состояния больного, определить причину болевого синдрома, оценить индивидуальный риск ОКС.
2. Необходимо вызвать бригаду скорой помощи и экстренно госпитализировать в лечебное учреждение, имеющее блоки интенсивной терапии для кардиологических больных или хотя бы специализированное кардиологическое отделение. При низкой вероятности ОКС (по мнению врача-кардиолога) возможны обследование и уточнение диагноза в амбулаторных условиях, однако даже в этом случае нельзя рекомендовать больному на следующий день записаться на прием к кардиологу. При невозможности пройти амбулаторное обследование в тот же день необходимо госпитализировать больного.
3. Больного по возможности следует госпитализировать в медицинское учреждение, где проводят коронароангиографию.
4. Больному нужно обеспечить соблюдение постельного режима.
5. Ацетилсалициловая кислота показана всем больным с подозрением на ОКС при отсутствии противопоказаний. Если больной не принимал ее раньше, первая доза составляет 250-500 мг препарата, не покрытого оболочкой, который следует разжевать для ускорения эффекта.
6. При продолжающейся боли - нитроглицерин под язык. Его можно принимать повторно с интервалом 5 мин при условии постоянного контроля уровня АД. При развитии гипотонии следует занять горизонтальное положение с приподнятыми ногами.
7. Больному следует принять β-адреноблокатор короткого действия внутрь при отсутствии явных клинических противопоказаний (выраженные гипотония, брадикардия, тяжелая застойная сердечная недостаточность, бронхиальная астма и т.д.). Наиболее оптимален прием 20-40 мг пропранолола.
8. Важно замечать и устранять факторы, способствующие усугублению ишемии: повышение АД, сердечная недостаточность, аритмии.
9. Тактика при наличии данных, подтверждающих ОКС (впервые возникшая или прогрессирующая стенокардия), но в ближайшие 48 ч без сильного приступа стенокардии, следующая:
• направление на обследование и лечение в специализированное кардиологическое учреждение, но не обязательно в экстренном порядке;
• ацетилсалициловая кислота, если больной ее еще не получает.
Действия во время транспортировки
1. Обеспечить внутривенный доступ.
2. Купировать болевой синдром. При недостаточном эффекте нитроглицерина использовать наркотические анальгетики: морфин внутривенно 5-10 мг. По возможности начать внутривенное введение нитроглицерина.
3. Ацетилсалициловая кислота (разжевать 250-500 мг препарата, не покрытого оболочкой), если больной ее еще не принимает.
4. При наличии технической возможности зарегистрировать ЭКГ.
5. Ввести внутривенно струйно нефракционированный гепарин в дозе 70 ЕД/кг (не более 5000 ЕД) или низкомолекулярный гепарин (эноксапарин натрия 1 мг/кг подкожно).
6. Оценить выраженность факторов, способствующих усугублению ишемии: гипертонии, сердечной недостаточности, аритмии. Принять меры к их устранению.
7. Ингаляция O2 при сохраняющемся приступе.
Оценить риск осложнений у данной группы больных поможет табл. 11.
Таблица 11. Критерии высокого риска осложнений у больных острого коронарного синдрома без подъема сегмента ST

Варианты лечения больных с острым коронарным синдромом с подъемом сегмента ST
Существует два подхода лечения верифицированного острого коронарного синдрома с подъемом сегмента ST (ОКССП ST) (рис. 75): «агрессивный» (ранний инвазивный) и консервативный. Выбор тактики зависит от оснащенности учреждения, принятой в нем тактики, опыта врачей, предпочтения пациента.
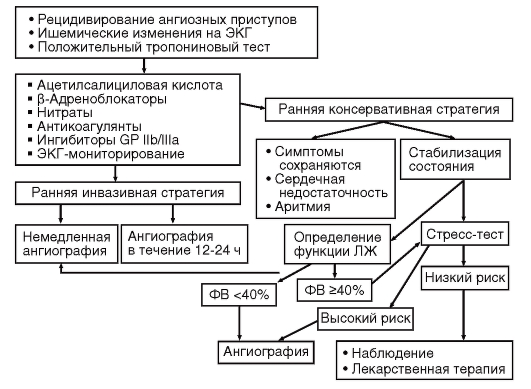
Рис. 75. Варианты лечения больных с острым коронарным синдромом с подъемом сегмента ST
Немедикаментозное лечение
1. Обеспечение покоя (строгий постельный режим) в 1-е сутки.
2. Отказ от курения.
3. Антигиперлипидемическая диета. Медикаментозное лечение
1. Ацетилсалициловая кислота в дозе 160-325 мг.
2. Клопидогрел - нагрузочная доза 300 мг внутрь, затем по 75 мг/сут. Противопоказания: подтвержденная гиперчувствительность, активное кровотечение, обострение язвенной болезни, кровоизлияние в мозг.
3. Блокаторы гликопротеиновых IIb/IIIa рецепторов при планируемом вмешательстве на коронарных артериях.
4. Гепарин нефракционированный в дозе 80 ЕД/кг внутривенно болюсом, затем внутривенная инфузия со скоростью 12-18 ЕД/кг в час (1250 ЕД/кг в час) либо низкомолекулярный гепарин (эноксапарин натрия в дозе 1 мг/кг подкожно каждые 12 ч).
5. Внутривенная инфузия нитроглицерина. Начальная скорость введения - 10 мкг/мин, затем ее увеличивают на 10 мкг/мин каждые 3-5 мин до появления реакции АД или улучшения клинической картины. Не следует снижать АД менее 100 мм рт.ст. у нормотоника или более чем на 25% исходного уровня у пациента с гипертонией. Максимальная доза (скорость введения) нитроглицерина 200 мкг/мин.
6. β-Адреноблокаторы. При нестабильной гемодинамике, признаках сердечной недостаточности начинают введение β-адреноблокаторов парентерально. При отсутствии указанных признаков препараты назначают сразу внутрь:
• метопролол в дозе 5 мг внутривенно медленно каждые 5 мин до достижения максимальной дозы 15 мг или желаемой ЧСС (около 60); затем 25-50 мг внутрь каждые 8 ч;
• атенолол в дозе 5 мг внутривенно, затем 50-100 мг 1 раз в сутки;
• пропранолол в дозе 0,5-1 мг внутривенно, затем 40-80 мг каждые
6-8 ч;
• эсмолол в дозе 0,1 мг/кг в минуту внутривенно с увеличением скорости введения на 0,05 мг/кг в минуту до общей дозы 0,2 мг/кг в минуту.
7. В случае непереносимости или недостаточном эффекте β-адреноблокаторов пациентам с нормальной сократительной способностью миокарда левого желудочка можно назначить недигидропиридиновые блокаторы кальциевых каналов (дилтиазем, верапамил).
Показания к консультации других специалистов
Если есть подозрения на заболевания, которые могут имитировать стенокардию или усугублять ее течение, необходимы консультации соответствующих специалистов: невропатолога, эндокринолога, пульмонолога, гастроэнтеролога, гематолога и т.д.
Если у пациента наблюдаются признаки декомпенсации углеводного обмена, необходима консультация эндокринолога.
1.6. ОСТРЫЙ ИНФАРКТ МИОКАРДА
В редких случаях к инфаркту миокарда приводят следующие забол вания, не связанные с коронарным атеросклерозом (табл. 12).
Таблица 12. Этиология острого инфаркта миокарда

Коды МКБ-10
• I21 Острый инфаркт миокарда.
• I21.0 Острый трансмуральный инфаркт передней стенки миокарда.
• I21.1 Острый трансмуральный инфаркт нижней стенки миокарда.
• I21.2 Острый трансмуральный инфаркт миокарда других уточненных локализаций.
• I21.3 Острый трансмуральный инфаркт миокарда неуточненной локализации.
• I21.4 Острый субэндокардиальный инфаркт миокарда.
• I21.9 Острый инфаркт миокарда неуточненный.
• I22 Повторный инфаркт миокарда.
Критерии инфаркта миокарда, разработанные экспертами Европейского общества кардиологов и Американской коллегии кардиологов (2000)
Критерии острого, развивающегося или недавнего инфаркта миокарда (один из перечисленных ниже)
1. Типичное повышение и снижение активности биохимических маркеров некроза миокарда в сочетании не менее чем с одним из следующих признаков:
• клинические проявления ишемии миокарда;
• наличие патологических зубцов Q;
• изменения на ЭКГ ишемического характера;
• вмешательства на коронарных артериях.
2. Патоморфологические признаки острого инфаркта миокарда.
Критерии установленного инфаркта миокарда (один из перечисленных ниже)
• Появление новых патологических зубцов Q на серии ЭКГ.
• Патоморфологические признаки старого или заживающего инфаркта миокарда.
Факторы риска развития инфаркта миокарда представлены в табл. 13.
Классификация
В зависимости от исходных изменений на электрокардиограмме
1. Инфаркт миокарда с подъемом сегмента ST (сюда относят также остро возникшую блокаду левой ножки пучка Гиса).
2. Инфаркт миокарда без подъема сегмента ST. В зависимости от сформировавшихся изменений на ЭКГ:
• инфаркт миокарда с формированием патологических зубцов Q;
• инфаркт миокарда без формирования патологических зубцов Q.
Обычно инфаркту миокарда с подъемом сегмента ST соответствует развивающийся крупноочаговый инфаркт миокарда с эволюцией в инфаркт миокарда с формированием патологических зубцов Q.
В зависимости от очага некроза
1. Крупноочаговый (трансмуральный) инфаркт миокарда.
2. Мелкоочаговый инфаркт миокарда.
Таблица 13. Факторы риска развития инфаркта миокарда
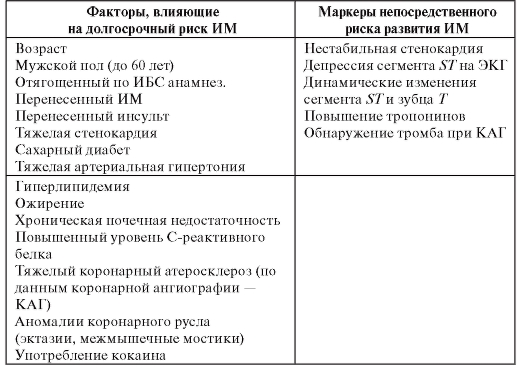
В зависимости от локализации очага некроза выделяют:
1) инфаркт миокарда передней стенки левого желудочка (передний инфаркт миокарда);
2) инфаркт миокарда боковой стенки левого желудочка (боковой инфаркт миокарда);
3) изолированный инфаркт миокарда верхушки сердца;
4) инфаркт миокарда нижней стенки левого желудочка (нижний инфаркт миокарда);
5) инфаркт миокарда задней стенки левого желудочка;
6) инфаркт миокарда межжелудочковой перегородки;
7) инфаркт миокарда правого желудочка;
8) инфаркт миокарда предсердий;
9) возможны сочетанные локализации: задненижний, переднебоковой и т.д.
В зависимости от временных характеристик выделяют:
1) первичный инфаркт миокарда;
2) повторный инфаркт миокарда;
3) рецидивирующий инфаркт миокарда.
В течение инфаркта миокарда выделяют несколько периодов:
1) острейший период: от начала болевого приступа до формирования очага некроза (первые 4-6 ч);
2) острый период: окончательное формирование очага некроза (до 2 нед);
3) подострый период: формирование рубца (до 1-2 мес);
4) постинфарктный период: полное рубцевание и консолидация рубца (после 1-2 мес).
Жалобы
Основным клиническим признаком инфаркта миокарда служит интенсивный болевой синдром в грудной клетке. Сила болевого приступа настолько велика, что часто наблюдают вегетативные реакции вплоть до потери сознания, страх смерти. При оценке состояния больного необходимо уточнить характер болевых ощущений, интенсивность, локализацию, продолжительность, наличие иррадиации, провоцирующие и облегчающие боль факторы.
1. Болевой приступ обычно продолжается более 30 мин.
2. В большинстве случаев прием нитроглицерина и покой не купируют болевой приступ либо облегчают его не полностью.
3. Ангинозный приступ нередко развивается в предутренние часы без наличия четкого провоцирующего фактора.
4. Боль, усиливающаяся при дыхании, изменении положения тела или пальпации грудной клетки, уменьшает вероятность диагноза «инфаркт миокарда».
Сердечный приступ может сопровождаться:
- слабостью, обмороками;
- потливостью;
- перебоями в работе сердца;
- сердцебиением;
- эмоциональным возбуждением, страхом;
- одышкой, кашлем;
- отсутствием сознания.
В ряде случаев инфаркт миокарда начинается с нетипичной боли
в грудной клетке.
Следует обратить внимание на наличие других жалоб:
1. Около половины случаев инфаркта миокарда диагностируют
ретроспективно, из них половина безболевые. Чаще бессимптомные
или малосимптомные формы инфаркта миокарда наблюдают у пожилых (особенно женщин), у больных сахарным диабетом.
2. У пациентов пожилого возраста основным клиническим проявлением инфаркта миокарда может быть остро возникшая одышка.
3. Среди других симптомов следует обратить внимание на учащенное сердцебиение, ощущение перебоев в работе сердца, абдоминальный дискомфорт, тошноту, рвоту, предобморочное состояние, выраженную слабость, избыточное потоотделение, тревогу, страх.
В зависимости от течения заболевания, в острейшем периоде выделяют несколько клинических вариантов:
- ангинозный (status anginosus);
- абдоминальный (status gastralgicus);
- астматический (status asthmaticus);
- аритмический;
- церебральный;
- безболевой (малосимптомный).
Варианты нетипичного начала инфаркта миокарда представлены на рис. 76.
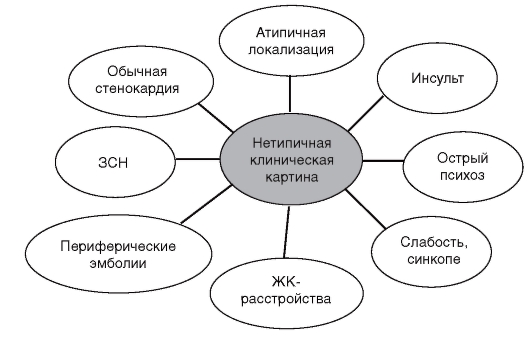
Рис. 76. «Маски» острого инфаркта миокарда
Физикальное обследование
При неосложненном течении инфаркта миокарда физикальное исследование обычно не выявляет отклонений от нормы. Основная задача клинического обследования - ранняя диагностика осложнений. Важны следующие симптомы:
- наличие самостоятельного дыхания, проходимость дыхательных путей, пульсация на периферических артериях;
- внешний вид: тревога, страх, беспокойство, бледность, цианоз, избыточное потоотделение (холодный липкий пот);
- тахикардия или брадикардия, экстрасистолия;
- набухание, пульсация яремных вен;
- ослабление тонов, S3 или S4, шум митральной и трикуспидальной регургитации, шум трения перикарда, грубый шум при разрыве МЖП;
- одышка, кашель, хрипы в легких, кровохарканье;
- повышение или снижение АД;
- неврологические симптомы.
При осмотре больного с подозрением на инфаркт миокарда врач должен, прежде всего, оценить параметры гемодинамики (АД, пульс), частоту дыхания. При отсутствии сознания, пульса, самостоятельного дыхания следует немедленно начать СЛР.
Резорбционно-некротический синдром
После развития инфаркта миокарда продукты распада миокарда попадают в кровоток, вызывая системный воспалительный ответ, который принято называть резорбционно-некротическим синдромом. Он характеризуется следующими признаками:
1) лихорадкой до 38 °С не более 1 нед; если лихорадка превышает 38 °С и (или) продолжается более недели, следует искать другие причины повышения температуры;
2) лейкоцитозом - обычно не больше 15х109/л, к концу 1-й нед возвращается к нормальному уровню;
3) повышением скорости оседания эритроцитов (СОЭ) - начинается к концу 1-й нед и продолжается несколько недель;
4) анэозинофилией - до нескольких недель. Оценка степени левожелудочковой недостаточности, в соответствии с классификацией Т. Killip:
• Killip I: признаков левожелудочковой недостаточности нет;
• Killip II: умеренная левожелудочковая недостаточность (влажные хрипы не более чем над 50% поверхности легких);
• Killip III: клиническая картина отека легких;
• Killip IV: шок.
Лабораторные исследования
Определение биохимических маркеров некроза миокарда составляет основу диагностики инфаркта миокарда, однако оно не должно быть причиной задержки реперфузионного лечения.
В клинической практике используют следующие маркеры повреждения (табл. 14).
Таблица 14. Динамика основных маркеров повреждения после инфаркта миокарда
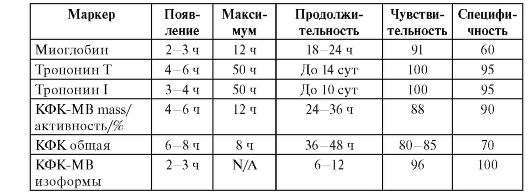
1. Внутриклеточные ферменты:
• КФК;
• КФК-МВ (активность, mass);
• КФК-МВ изоформы;
• ЛДГ;
• ЛДГ изоформы;
• аспартатаминотрансфераза.
2. Внутриклеточные белки:
• сердечные тропонины I и Т;
• миоглобин.
Сердечные тропонины I и Т
Преимущества
• Чувствительность и специфичность выше, чем у КФК-МВ.
• Возможна поздняя диагностика инфаркта миокарда в течение 2 нед. Недостатки
• Низкая чувствительность в ранние сроки инфаркта миокарда (<4-6 ч от начала симптомов).
• Ограниченная возможность выявлять небольшие повторные инфаркты миокарда.
Возможно повышение уровня тропонинов при других заболеваниях:
- острая ТЭЛА;
- острый перикардит;
- острая сердечная недостаточность;
- миокардит;
- почечная недостаточность;
- электрическая кардиоверсия;
- электрическая аблация;
- сепсис;
- ложноположительные реакции (гетерофильные антитела, ревматоидный фактор, сгустки фибрина, нарушение работы анализатора).
МВ-креатинфосфокиназа остается наиболее доступным маркером некроза миокарда
Преимущества
• Быстрый, дешевый, точный анализ.
• Возможность выявить ранний повторный инфаркт. Недостатки
• Низкая специфичность.
• Низкая чувствительность в ранние сроки инфаркта миокарда (меньше 6 ч от начала симптомов и больше 36 ч от начала инфаркта миокарда).
• Низкая чувствительность при небольших повреждениях миокарда (определяемых тропонином).
При отсутствии возможности измерения содержания тропонинов или КФК-МВ определяют активность общей КФК, которая должна превышать нормальный уровень в 2 раза и более (низкая специфичность).
Необходимо серийное определение содержания биохимических маркеров через 6-8 ч в течение первых суток, далее ежедневно до нормализации.
Причины повышения креатинфосфокиназы и креатинфосфокиназы-МВ
1. Внутримышечные инъекции.
2. Лекарственные препараты: статины, фибраты, никотиновая кислота.
3. Прием алкоголя.
4. Воспалительные миопатии (системные заболевания).
5. Инфекционные болезни.
6. Миодистрофии.
7. Рабдомиолиз.
8. Периодический паралич.
9. Болезни ЦНС (амиотрофический латеральный склероз).
10. Эндокринные миопатии (гипотиреоз, акромегалия). Всем больным с инфарктом миокарда необходимо исходно определять следующие лабораторные показатели (а в случае отклонения от нормы - контролировать в динамике):
- общий анализ крови с подсчетом тромбоцитов;
- международное нормализованное отношение (MHO);
- активированное частичное тромбопластиновое время;
- креатинин;
- глюкоза;
- липиды;
- общий анализ мочи.
Инструментальная диагностика
Основной метод инструментальной диагностики - ЭКГ (табл. 15
16).
Таблица 15. Локализация инфаркта миокарда на основании электрокардиограммы (часть 1)
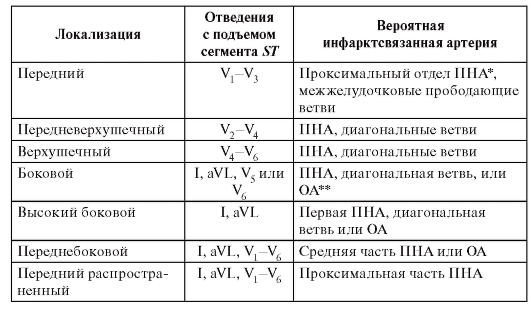
*ПНА - передняя нисходящая артерия; **ОА - огибающая артерия ***ПКА - правая коронарная артерия.
Таблица 16. Локализация инфаркта миокарда на основании электрокардиограммы (часть 2)

*ПНА - передняя нисходящая артерия; **ОА - огибающая артерия; ***ПКА - правая коронарная артерия.
Дифференциальная диагностика
• Болезни сердца:
- миокардит;
- перикардит;
- расслоение аорты;
- вазоспастическая стенокардия;
- аортальный стеноз;
- ГКМП;
- WPW-синдром;
- синдром ранней реполяризации;
- синдром Бругада.
• Желудочно-кишечные:
- язвенная болезнь желудка и двенадцатиперстной кишки;
- панкреатит;
- спазм пищевода;
- эзофагит;
- гастрит;
- холецистит;
- холелитиаз.
• Легочные:
- легочная эмболия;
- пневмоторакс;
- плеврит. • Другие:
- корешковый синдром;
- плексит, миозит;
- субарахноидальное кровоизлияние;
- Herpes Zoster;
- паническая атака.
Лечение
Цели лечения
1. Главная цель лечения - восстановление нарушенного коронарного кровотока и поддержание проходимости пораженной коронарной артерии.
2. Обезболивание.
3. Ограничение размеров очага поражения (некроза).
4. Профилактика и лечение угрожающих жизни осложнений.
Медикаментозное лечение
До приезда бригады скорой медицинской помощи необходимы следующие мероприятия.
1. Обеспечить соблюдение постельного режима.
2. Ацетилсалициловая кислота при отсутствии противопоказаний назначается всем больным с подозрением на инфаркт миокарда. Если больной раньше ее не принимал, то первая доза составляет 250- 500 мг препарата, не покрытого оболочкой, который следует разжевать для ускорения начала действия.
3. При продолжающейся боли дать нитроглицерин под язык. Его можно принимать повторно с интервалом 5 мин при условии постоянного контроля уровня АД. При развитии гипотонии следует, сохраняя горизонтальное положение больного, приподнять ему ноги.
4. Применить β-адреноблокатор короткого действия внутрь при отсутствии явных клинических противопоказаний (выраженные гипотония, брадикардия, тяжелая застойная сердечная недостаточность, бронхиальная астма и т.д.). Наиболее оптимально дать больному 20-40 мг пропранолола.
5. Если больной на момент приступа находится в поликлинике, целесообразно зарегистрировать ЭКГ в 12 отведениях.
Лечение бригадой скорой медицинской помощи
1. Ацетилсалициловая кислота (250-500 мг) в случае, если не назначена раньше.
2. Обеспечить мониторное наблюдение за сердечной деятельностью.
3. Наладить внутривенный доступ. Следует избегать пункции некомпрессируемых вен (подключичная вена), учитывая повышенный риск кровотечений, связанный с тромболитическим лечением.
4. Нитраты - нитроглицерин или изосорбида динитрат (сублингвально или спрей каждые 5 мин до трех приемов) или внутривенная инфузия с начальной скоростью 10 мкг/мин. При сохраняющемся болевом синдроме дозу повышают до снижения среднего АД на 10-15% от исходного, но не ниже 100 мм рт.ст., при гипертонической болезни необходимо снижать систолическое АД на 20-25%.
5. Ингаляция кислорода со скоростью потока 2-4 л/мин.
6. Для купирования болевого синдрома - морфин внутривенно 2-4 мг каждые 5 мин по потребности.
7. Оптимально начинать тромболитическое лечение специализированными бригадами СМП догоспитально (см. дальше ЭКГ-показания и выше).
8. При тахикардии, повышенном АД в случае отсутствия противопоказаний - внутривенно пропранолол по 1 мг дробно из расчета 0,1 мг/кг.
9. Пациенты с инфарктом миокарда должны быть госпитализированы в блок интенсивной терапии.
Лечение в стационаре
Порядок ведения больного в блоке интенсивной терапии:
1) обеспечивают постоянный внутривенный доступ;
2) проводят постоянное ЭКГ-мониторирование;
3) всем пациентам назначают строгий постельный режим в течение 12-24 ч, сидеть разрешают через 24 ч, на 3-й день режим может быть расширен до палатного;
4) в первые 12 ч диета состоит только из жидкой пищи, затем рацион расширяют до обычной диеты для кардиологических больных;
5) следует оценить состояние отправления естественных физиологических потребностей и при необходимости назначить препараты, размягчающие каловые массы.
Лекарственное лечение
Тромболитическое лечение
Тромболитическое воздействие - главный патогенетический метод лечения инфаркта миокарда с подъемом сегмента ST. Оно показано пациентам с клинической картиной острого коронарного синдрома (боль или дискомфорт в грудной клетке продолжительностью более 30 мин, не устраняющиеся после приема нитропрепаратов или покоя) при давности начала заболевания менее 12 ч и наличии на ЭКГ одного из перечисленных признаков.
• Остро возникшая (или предположительно остро возникшая) элевация сегмента ST в точке J в двух или более смежных отведениях более 0,2 мВ (2 мм) в отведениях V1, V2 или V3 и более 0,1 мВ (1 мм) в остальных отведениях.
• Остро возникшая блокада левой ножки пучка Гиса (или предположительно остро возникшая, затрудняющая анализ сегмента S).
• Депрессия сегмента ST в передних прекардиальных отведениях в сочетании с высоким зубцом R, предполагающая наличие истинного заднего инфаркта миокарда. В таких случаях показана регистрация ЭКГ в дополнительных прекардиальных отведениях V7-V9.
Важно знать и оперативно оценить наличие противопоказаний к проведению тромболитического лечения.
Тромболитические препараты приведены в табл. 17, 18).
Максимальный положительный эффект от тромболитического воздействия можно ожидать в первые 3 ч от начала болезни, а особенно в течение первого, «золотого», часа.
При наличии стандартных показаний к проведению тромболизиса возможно назначение любого из тромболитических препаратов. Выбор препарата для проведения тромболизиса определяется его доступностью и стоимостью. Всегда предпочтительней применение фибринспецифичных препаратов.
Основные побочные эффекты при использовании тромболизисного воздействия:
- кровотечение;
- лихорадка;
- артериальная гипотония;
- сыпь;
- анафилаксия;
- реперфузионные аритмии.
Таблица 17. Сравнительная характеристика тромболитических препаратов (1)
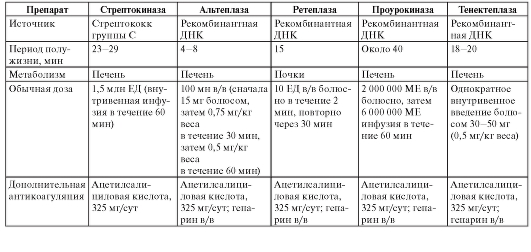
Таблица 18. Сравнительная характеристика тромболитических препаратов (2)
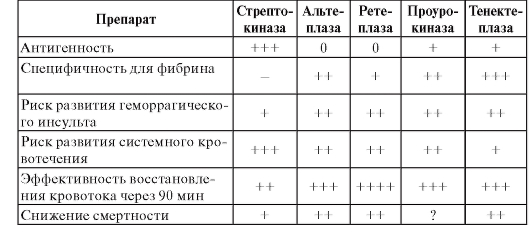
Антикоагулянты
Показаны при совместном использовании с фибринспецифичными тромболитиками. При применении стрептокиназы антикоагулянты не используют. Продолжительность лечения 1-2 сут. При наличии специальных показаний (внутрисердечный тромбоз, тяжелая сердечная недостаточность, венозные тромбозы, ТЭЛА) продолжительность антикоагулянтного лечения можно увеличить.
1. Гепарин нефракционированный в дозе 80 ЕД/кг внутривенно болюсом, затем внутривенная инфузия со скоростью 12-18 ЕД/кг в час (1250 ЕД/кг в час).
2. Или низкомолекулярный гепарин (эноксапарин натрия в дозе 1 мг/кг подкожно каждые 12 ч).
Дезагреганты
• Ацетилсалициловая кислота (250-500 мг) в случае, если не назначена раньше. Поддерживающая доза 75-150 мг/сут.
• Клопидогрел - нагрузочная доза 300 мг внутрь, затем по 75 мг/сут. Противопоказания: подтвержденная гиперчувствительность, активное кровотечение, обострение язвенной болезни, кровоизлияние в мозг. В настоящее время доказана эффективность применения клопидогрела в течение периода госпитализации. После ТБКА со стентированием клопидогрел назначают в течение года.
• Блокаторы гликопротеиновых IIb/IIIa рецепторов (эптифибатид (интегрилин), тирофибан) показаны больным при планируемой
ТБКА.
Нитроглицерин
Внутривенная инфузия нитроглицерина. Начальная скорость введения - 10 мкг/мин, затем она увеличивается на 10 мкг/мин каждые 3-5 мин до появления реакции АД или улучшения клинической картины. Не следует снижать АД ниже 100 мм рт.ст. у нормотоника или более чем на 25% от исходного у пациента с гипертонией. Максимальная доза (скорость введения) нитроглицерина - 200 мкг/мин.
Продолжительность инфузии нитроглицерина при неосложненном течении инфаркта миокарда - 12-24 ч. В случае рецидива ангинозных приступов, неконтролируемой артериальной гипертензии, левожелудочковой недостаточности продолжительность лечения увеличивают.
β-Адреноблокаторы
Учитывая выраженные гемодинамические эффекты β-адреноблокаторов, надо начинать введение с применения препаратов короткого действия парентерально (эсмолол, пропранолол). Далее переходят на пролонгированные препараты.
Необходимо обращать внимание на противопоказания: гипотонию, брадиаритмию, бронхиальную астму и т.д.
Ингибиторы ангиотензинпревращающего фермента
Показаны в ранние сроки инфаркта миокарда всем больным передним инфарктом миокарда, ФВ левого желудочка <40%, артериальной гипертензией, сахарным диабетом.
Начинают лечение с препаратов короткого действия (каптоприл по 6-12 мг 2-3 раза в сутки).
Блокаторы рецепторов ангиотензина II
Назначают при непереносимости ИАПФ. Показания те же, что для ИАПФ.
Хирургическое лечение
Первичная коронарная ангиопластика
Данный метод лечения инфаркта миокарда применяют в качестве альтернативы тромболизисного воздействия для восстановления коронарного кровотока (табл. 19).
Преимущества первичной чрескожной баллонной коронарной ангиопластики
• Вероятность восстановления коронарного кровотока более 95% .
• Одномоментное устранение инфарктсвязанного стеноза коронарной артерии с помощью имплантации стента.
• Снижение риска геморрагических осложнений, связанных с тромболизисным воздействием.
Таблица 19. Сравнение тромболизисного воздействия и первичной чрескожной баллонной коронарной ангиопластики при инфаркте миокарда
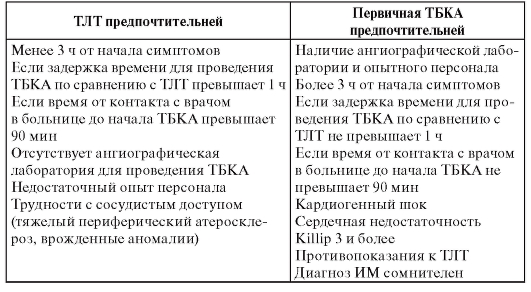
Недостатки первичной чрескожной баллонной коронарной ангиопластики
• Большая стоимость лечения на начальном этапе .
• Необходимость наличия дорогостоящего оборудования и круглосуточного дежурства опытной бригады специалистов.
• Осложнения, связанные с пункцией артерии.
Отсроченная чрескожная баллонная коронарная ангиопластика Показания
Инвазивные стратегии лечения инфаркта миокарда:
- сохранение ангинозного приступа после тромболизисного воздействия и (или) отсутствие косвенных признаков реперфузии на ЭКГ (быстрое снижение сегмента ST более 50% через 3 ч в наиболее информативных отведениях);
- рецидив инфаркта миокарда;
- постинфарктная стенокардия;
- нестабильность гемодинамики: тяжелая сердечная недостаточность, артериальная гипотензия, кардиогенный шок;
- рецидивирующая желудочковая тахикардия и фибрилляция желудочков.
В вышеперечисленных случаях может возникнуть необходимость перевода пациента в стационар, в котором существует возможность проведения ТБКА.
Аортокоронарное шунтирование
В связи с высоким риском осложнений коронарное шунтирование в острый период инфаркта миокарда проводят редко. Показаниями могут быть:
- неэффективная или осложненная ТБКА;
- проведение ТБКА сопряжено с высоким риском (стеноз ствола левой коронарной артерии);
- механические осложнения инфаркта миокарда: разрыв свободной стенки левого желудочка, разрыв межжелудочковой перегородки, дисфункция папиллярных мышц с тяжелой митральной регургитацией, отрыв хорд митрального клапана.
В таких случаях наряду с коррекцией дефекта проводят коронарное шунтирование.
Выявление и лечение осложнений инфаркта миокарда
Отек легких
Для раннего выявления отека легких необходимо внимательно контролировать общее состояние больного, частоту дыхания, уровень АД, диурез, проводить аускультацию легких. При обширных передних инфарктах миокарда оправдано превентивное введение фуросемида (лазикс) 20-40 мг. Всем больным надо провести рентгенографию легких, которая выявляет признаки венозного легочного застоя на ранних стадиях.
1. Ингаляция кислорода.
2. Фуросемид внутривенно 0,5-1 мг/кг.
3. Морфин 2-4 мг.
4. Нитроглицерин внутривенно при АД >100 мм рт.ст.
5. Допамин 5-15 мкг/кг в минуту при АД 70-100 мм рт.ст. и признаках развивающегося шока.
6. Добутамин 2-20 мкг/кг в минуту при АД 70-100 мм рт.ст. и отсутствии признаков шока.
7. ИАПФ короткого действия (каптоприл) при АД >100 мм рт.ст.
8. При отсутствии реакции на лечение и при гипотонии - внутриаортальная баллонная контрпульсация.
9. При некупируемом отеке легких показаны экстренная коронарография и попытка восстановления кровотока.
Рецидив инфаркта миокарда
• Экстренное реперфузионное лечение: тромболизисное воздействие или ТБКА.
• Повторное введение стрептокиназы противопоказано.
Кардиогенный шок
Кардиогенный шок обусловлен резким снижением сократительной функции миокарда левого желудочка и клинически определяется как состояние, сопровождающееся стойкой артериальной гипотензией (систолическое АД <90 мм рт. ст. в течение более 30 мин) и признаками гипоперфузии периферических тканей (нарушение сознания, похолодание конечностей, цианоз, олигурия). Сердечный индекс <2,2 л/ (мин-м2).
1. Лечение осуществляют на фоне мониторирования показателей центральной гемодинамики.
2. Прессорные амины: допамин 5-15 мкг/(кг мин), добутамин 2-20 мкг/(кг-мин), норэпинефрин 0,5-30 мкг/мин.
3. Ингаляция кислорода, при необходимости - ИВЛ.
4. При отсутствии реакции на прессорные амины - внутриаортальная баллонная контрпульсация.
5. Экстренная реваскуляризация - самый эффективный способ лечения кардиогенного шока.
Гиповолемия
• Введение плазмозамещающих растворов, чаще под контролем показателей центральной гемодинамики.
• Иногда - прессорные амины.
• Лечение причины, приведшей к гиповолемии. Например, восстановление кровотока при инфаркте правого желудочка.
Нарушения сердечного ритма у больных с инфарктом миокарда
Желудочковые аритмии (тахикардия, экстрасистолия, фибрилляция)
У всех больных с инфарктом миокарда необходимо поддерживать нормальный уровень электролитов в крови (калий, магний).
Желудочковая экстрасистолия обычно не требует лечения, она проходит самостоятельно или после коррекции уровня электролитов. При ранних экстрасистолах R-на- T, являющихся предвестником опасных аритмий, возможно назначение антиаритмического лечения.
При пароксизмах устойчивой желудочковой тахикардии с нарушением гемодинамики или фибрилляции желудочков показана экстренная электроимпульсная терапия.
Профилактическое введение лидокаина не показано. Его применяют в качестве неотложной меры при устойчивой или рецидивирующей неустойчивой желудочковой тахикардии с нарушениями гемодинами-
ки, а также после фибрилляции желудочков. Лидокаин вводят болюсом 1 мг/кг, затем по половине этой дозы каждые 8-10 мин максимально до 4 мг/кг, далее инфузия 1-3 мг/мин.
Другими препаратами выбора для лечения желудочковых нарушений ритма служат β-адреноблокаторы и амиодарон. Его применяют по схеме: 5 мг/кг в течение часа, далее 900-1200 мг в течение суток.
При рецидивировании фибрилляции желудочков, желудочковой тахикардии, особенно после двух суток от начала инфаркта миокарда, следует ставить вопрос об установке кардиовертера-дефибриллятора.
Применение препаратов I класса для лечения желудочковых нарушений ритма у больных с инфарктом миокарда сопровождается увеличением смертности и не рекомендуется.
Наджелудочковые аритмии
Мерцание предсердий. Во многих случаях желудочковый ритм не высокий, переносимость хорошая, и специального лечения не требуется. При частом ритме вводят β-адреноблокаторы, купируют с помощью прокаинамида, амиодарона, нитрофенилдиэтиламинопентилбензамида. При неконтролируемом сердечном ритме, развитии ангинозного приступа, появлении и (или) прогрессировании сердечной недостаточности проводят кардиоверсию.
Встречаются и другие виды суправентрикулярной тахикардии, обычно они купируются самостоятельно. Для восстановления ритма используют β-адреноблокаторы, иногда верапамил. При АВ-узловой тахикардии возможно применение трифосаденина под строгим контролем ритма и АД. При нестабильной гемодинамике - кардиоверсия.
Брадиаритмии
При синусовой брадикардии, синоатриальных блокадах или АВ-блокаде II степени типа Мобитц-1, сопровождающихся артериальной гипотензией, ишемией миокарда, развитием или утяжелением сердечной недостаточности, а также выскальзывающими желудочковыми аритмиями начальная тактика заключается в назначении атропина (внутривенно 0,3-0,5 мг, при необходимости повторно с интервалами 5-10 мин - до суммарной дозы 1,5-2 мг).
Электрокардиостимуляция показана при асистолии, клинически выраженной брадикардии (в том числе включая АВ-блокаду II степени типа Мобитц-1 с артериальной гипотензией), двухили трехпучковой блокаде, АВ-блокаде II степени типа Мобитц-2, полной
поперечной блокаде. При обширном переднем инфаркте миокарда даже при АВ-блокаде I степени, появлении блокады левой ножки пучка Гиса показана превентивная установка зонда-электрода в связи с высоким риском развития полной поперечной блокады с гемодинамически неэффективным замещающим ритмом.
Постинфарктная стенокардия
Всегда рассматривается как нестабильная, с высокой вероятностью развития инфаркта миокарда.
• Антиангинальное лечение.
• Не используют блокаторы медленных кальциевых каналов из группы дигидропиридинов короткого действия.
• Коронарография и реваскуляризация. При выраженной ишемической динамике ЭКГ коронарографию проводят экстренно.
Разрыв межжелудочковой перегородки
Опасное осложнение, начинающееся обычно с боли в груди, одышки, гипотонии. Могут быстро прогрессировать левожелудочковая недостаточность, развиться кардиогенный шок. Выслушивают грубый систолический шум. Диагноз подтверждают с помощью ЭхоКГ.
Лечение хирургическое. Иногда устанавливают окклюдер в место дефекта с помощью внутрисосудистой техники. На период подготовки к операции лечение симптоматическое.
Разрыв свободной стенки левого желудочка
Проявляется потерей сознания и электромеханической диссоциацией. Диагноз подтверждают с помощью ЭхоКГ. Лечение только хирургическое. Во время подготовки к операции - реанимационные мероприятия с эвакуацией крови из полости перикарда.
Отрыв папиллярных мышц
Начинается с внезапной быстро прогрессирующей одышки, гипотонии. Обычно быстро развивается отек легких. Диагноз подтверждают с помощью ЭхоКГ. Лечение только хирургическое. На период подготовки к операции лечение симптоматическое.
Эпистенокардитический перикардит
Развивается в первые дни инфаркта миокарда. Проявляется болью в прекардиальной области, связанной с дыханием, положением тела. Может выслушиваться шум трения перикарда. На ЭКГ - появление
или увеличение элевации сегмента ST как в стандартных, так и грудных отведениях (не всегда). Для лечения применяют нестероидные противовоспалительные препараты, в тяжелых случаях - глюкокортикоиды.
Синдром Дресслера
Развивается начиная со 2-й нед инфаркта миокарда . Проявляется в виде перикардита, плеврита, иногда полиартрита. Возможна лихорадка. Лечение: глюкокортикоиды.
Внутриполостной тромбоз левого желудочка
Чаще развивается при обширных инфарктах. Выявляют с помощью ЭхоКГ. При обнаружении тромба с признаками неоднородной структуры, фрагментации, флотации существует высокий риск тромбоэмболических осложнений. В таких случаях показано применение непрямых антикоагулянтов (варфарин) с поддержанием международного нормализованного отношения (MHO) в интервале 2-3. Через 3-4 нед ЭхоКГ повторяют для оценки динамики тромба. Небольшие плоские тромбы обычно не требуют лечения.
Тактика ведения больных с инфарктом миокарда в стационаре
При ежедневных осмотрах оценивают общее состояние больного, наличие жалоб, обращают внимание на цвет кожных покровов, состояние вен шеи, наличие отеков, частоту дыхания, пульса, уровень АД. Внимательно проводить аускультацию сердца и легких.
У больных с признаками сердечной недостаточности необходимо контролировать диурез, массу тела, строго ограничивать количество потребляемой жидкости.
Повторная регистрация ЭКГ.
В первые сутки инфаркта миокарда - определить уровень липидов крови
При неосложненном течении инфаркта миокарда на 5-7-е сут проводят нагрузочную пробу для выявления ишемии миокарда. В случае неспособности больного выдержать физическую нагрузку осуществляют фармакологические пробы (добутаминовая с ЭхоКГ) или сцинтиграфию миокарда.
ЭхоКГ желательно провести в первые сутки и перед выпиской из стационара для оценки сократительной функции левого желудочка и характера ремоделирования полости левого желудочка после инфаркта миокарда в динамике.
Показания к коронарной ангиографии:
- постинфарктная стенокардия;
- обширный инфаркт миокарда с ФВ <40%;
- тяжелая сердечная недостаточность;
- рецидивирующая желудочковая тахикардия и фибрилляция желудочков;
- признаки ишемии миокарда по данным нагрузочных проб, суточного мониторирования ЭКГ;
- следует отметить, что в последнее время становится все больше сторонников концепции, согласно которой коронарная ангиография показана всем больным, перенесшим инфаркт миокарда.
Особые ситуации
Инфаркт миокарда правого желудочка
Инфаркт миокарда нижней стенки в 20-50% случаев сочетается с инфарктом миокарда правого желудочка.
Клинические проявления, характерные для инфаркта миокарда правого желудочка:
- набухание вен шеи;
- артериальная гипотензия;
- парадоксальный пульс;
- олигурия;
- отсутствие клинических признаков застоя по малому кругу;
- шум трикуспидальной регургитации.
Во всех случаях нижнего инфаркта миокарда следует зарегистрировать ЭКГ в дополнительных правых грудных отведениях.
Особенности лечения больных с инфарктом миокарда правого желудочка :
1) следует избегать назначения нитратов, вазодилататоров, диуретиков в связи с риском тяжелой гипотонии;
2) тактика ведения пациентов с инфарктом миокарда правого желудочка включает применение следующих препаратов:
- плазмозамещающих растворов до 2-4 л внутривенно;
- добутамина (2,5-5 мкг/кгхмин) при отсутствии положительного эффекта от введения растворов.
Дальнейшее ведение
Лекарственное лечение
1. Антиагреганты:
- ацетилсалициловая кислота (аспирин) 75-150 мг постоянно;
- клопидогрел 75 мг в течение года, если проводилась ТБКА.
2. β-Адреноблокаторы.
3. Липидснижающее лечение: статины (цель - холестерин липопротеинов низкой плотности (ЛПНП) менее 2,6 ммоль/л или 100 мг/дл), фибраты - если уровень триглицеридов на фоне применения статинов 200-499 мг/дл, при уровне триглицеридов более 500 мг/дл начинают сразу с фибратов.
4. ИАПФ - особенно пациентам с обширным инфарктом миокарда (ФВ <40%), повышенным АД, с сахарным диабетом.
5. Блокаторы рецепторов ангиотензина-2 - при непереносимости
ИАПФ.
6. Лечение сердечной недостаточности, нарушений ритма, повышенного АД - см. соответствующие разделы.
Артериальная гипертензия
Поддержание АД на целевом уровне ниже 140 и 90 мм рт.ст., при почечной недостаточности и сахарном диабете - ниже 130 и 80 мм рт.ст.
Курение
Прекращение (при необходимости - фармакотерапия, психотерапия). Рекомендовать прекратить курить на каждом визите.
Масса тела
Целевой уровень индекса массы тела 18,5-24,9 кг/м2. Диета
Средиземноморская диета. Увеличение содержания ω-3-жирных кислот.
Физическая реабилитация
Индивидуальные программы физической реабилитации. Минимальная нагрузка - прогулки по 30-60 мин 3-4 раза в неделю.
Психическая реабилитация
Лечение тревоги и депрессии. Обсуждение вопросов социальной реабилитации, сексуальной активности и т.д.
Сахарный диабет
Оптимизация гликемического контроля совместно с эндокринологом. Цель: гликозилированный гемоглобин HbA1c <7%.
Внимание! При сохранении или появлении стенокардии после инфаркта миокарда, особенно при недостаточной эффективности
антиангинального лечения, рекомендовать больным проведение коронарной ангиографии.
Больных с повышенным риском внезапной смерти следует направлять в специализированные лечебные учреждения для установки дефибриллятора-кардиовертера. Риск внезапной смерти высокий при следующих состояниях:
- не связанные с реперфузией (т.е. более поздние) желудочковые аритмии: рецидивирующая тахикардия, фибрилляция;
- резкое снижение сократимости миокарда левого желудочка - ФВ <30%.
Прогноз
Критерии неблагоприятного прогноза
1. Клинические: пожилой возраст, сахарный диабет, артериальная гипотензия, ЧСС >100 в минуту, хроническая сердечная недостаточность, обширный инфаркт миокарда с ФВ <40%, частая желудочковая экстрасистолия или желудочковая тахикардия спустя первые 48 ч от начала инфаркта миокарда.
2. Инструментальное обследование:
- признаки ишемии по данным нагрузочных проб;
- желудочковые нарушения ритма (частая экстрасистолия, пароксизмы тахикардии) по данным суточного мониторирования ЭКГ;
- ЭхоКГ: обширные зоны нарушенной сократимости, ФВ <40%; аневризма левого желудочка.
3. Ангиографические: многососудистое поражение коронарных артерий, сохраняющаяся окклюзия или плохой кровоток в сосуде, снабжающем зону инфаркта миокарда, ФВ левого желудочка <40%, аневризма левого желудочка.
1.7. СТАБИЛЬНАЯ СТЕНОКАРДИЯ НАПРЯЖЕНИЯ
Эффективная фармакотерапия стабильной стенокардии - очень важный аспект клинической фармакологии в кардиологии. Причины развития стенокардии приведены в табл. 20.
Коды МКБ-10
• I20 Стенокардия (грудная жаба).
• I20.1 Стенокардия с документально подтвержденным спазмом.
• I20.8 Другие формы стенокардии.
• I20.9 Стенокардия неуточненная.
Таблица 20. Причины стенокардии

Основные направления профилактики ишемической болезни сердца
1. Всем больным, пришедшим на прием, нужно рекомендовать диету с пониженным содержанием животных жиров, поддерживать регулярную физическую активность.
2. Необходимо выявлять и лечить АГ:
- АД нужно измерять у любого пациента, пришедшего на прием;
- антигипертензивное лечение назначают на основании общей величины сердечно-сосудистого риска, определяемой величиной АД, наличием факторов риска, поражения органов-мишеней и ассоциированных клинических состояний. Целевой уровень АД для пациентов без сахарного диабета - менее 140/90 мм рт.ст., для пациентов с сахарным диабетом и поражениями почек - менее 130/80 мм рт.ст.;
- всем больным с АГ рекомендуют изменение образа жизни и модификацию питания.
3. Следует настоятельно рекомендовать пациентам отказаться от курения, подчеркивая резкое увеличение риска сердечно-сосудистых
и онкологических заболеваний. На фоне массового отказа от курения во многих западных странах и в России обратная тенденция: курят более 60% мужчин и около 40% женщин:
- у всех пациентов нужно выяснять, курят ли они;
- при каждом визите необходимо оценивать количество выкуриваемых сигарет, рекомендовать отказ от курения, обеспечивая медикаментозную и немедикаментозную поддержку всем пациентам, пытающимся бросить курить;
- необходимо помочь пациентам разработать план отказа от курения. При отсутствии противопоказаний следует рекомендовать использование никотинсодержащих препаратов.
4. Всех мужчин старше 40 лет и женщин после менопаузы, а также молодых пациентов с повышенным риском развития ИБС периодически необходимо обследовать на наличие дислипидемии:
- скрининг на гиперлипидемию необходимо повторять каждые 5 лет;
- следует использовать диету, гиполипидемическое лечение по показаниям для бессимптомных пациентов без ИБС, имеющих гиперлипидемию;
- следует рекомендовать сбалансированную диету с низким содержанием холестерина и жиров;
- следует оценить наличие факторов риска ИБС с использованием системы оценки риска SCORE, рекомендованной Европейским обществом кардиологов. На основании этого определяют целевые значения холестерина ЛПНП и пороговые значения холестерина ЛПНП для начала медикаментозного воздействия;
- в рекомендуемое лечение вносят коррективы в зависимости от наличия сопутствующих заболеваний, данных о переносимости гиполипидемических препаратов.
5. У пациентов с множеством факторов риска необходимо проводить первичную профилактику с помощью ацетилсалициловой кислоты:
- при отсутствии противопоказаний пациентам с множеством факторов риска ацетилсалициловую кислоту назначают в дозе 75-325 мг/сут;
- ацетилсалициловая кислота показана пациентам старше 50 лет с АГ на фоне адекватного антигипертензивного лечения (систолическое АД менее 140 мм рт.ст.) в случаях высокого риска сердечно-сосудистых осложнений (>20%), предшествующих сердечно-сосудистых осложнений и при умеренном повышении уровня креатинина крови;
- не следует рекомендовать прием ацетилсалициловой кислоты лицам без симптомов ИБС, имеющим низкий или средний уровень риска.
6. Сахарный диабет 2-го типа - наиболее агрессивный фактор риска ИБС. Так, вероятность развития инфаркта миокарда у больных сахарным диабетом соответствует группе больных, уже перенесших инфаркт миокарда. Необходимо активно модифицировать факторы риска у пациентов с сахарным диабетом:
- у пациентов с отягощенной наследственностью по сахарному диабету 2-го типа следует не реже 1 раза в год определять уровень глюкозы. Указанным лицам рекомендуют свести к минимуму потребление легкоусвояемых углеводов;
- у всех пациентов со стенокардией проводят скрининг на сахарный диабет;
- у пациентов с сахарным диабетом необходимо более агрессивно воздействовать на факторы риска. Целевое АД - 130 и 80 мм рт.ст;
- пациентам с сахарным диабетом, наличием альбуминурии и (или) одним фактором риска и более назначают ИАПФ.
Внимание! Не рекомендовано проводить гормональную заместительную терапию с целью уменьшения сердечно-сосудистого риска у женщин в постменопаузе, не имеющих симптомов ИБС. Обсудите с пациенткой вопрос о прекращении ранее начатой гормональной заместительной терапии, если она была назначена для снижения сердечно-сосудистого риска.
Антиоксидантные витамины (витамины С, Е и β-каротин) для снижения сердечно-сосудистого риска не показаны даже пациентам с высоким уровнем риска.
Скрининг
Скрининг ИБС показан бессимптомным пациентам, занятым профессиональной деятельностью, связанной с безопасностью людей или сопряженной с тяжелыми физическими нагрузками. Лицам таких профессий, как пилоты самолетов, авиадиспетчеры, работники милиции, пожарные и так далее, назначают ЭКГ в покое и нагрузочные тесты.
Скрининг ИБС также показан тем, у кого родственники первой степени родства (родители, братья, сестры) заболели ИБС в молодом возрасте - до 35-40 лет.
Классификация
Наиболее распространена функциональная Классификация стенокардии Канадского сердечно-сосудистого общества.
I функциональный класс - обычная физическая активность не вызывает дискомфорта. Приступ провоцирует лишь продолжительная либо интенсивная нагрузка.
II функциональный класс - небольшое ограничение обычной физической активности. Стенокардия возникает в результате быстрой ходьбы или быстрого подъема по лестнице, после еды, или на холоде, или в ветреную погоду, или под влиянием эмоционального стресса, или в первые несколько часов после подъема с постели; во время ходьбы на расстояние больше 200 м (двух кварталов) по ровной местности или во время подъема по лестнице более чем на один пролет в обычном темпе, при нормальных условиях.
III функциональный класс - выраженное ограничение обычной физической активности. Приступ стенокардии возникает в результате ходьбы на расстояние от одного до двух кварталов (100-200 м) по ровной местности или при подъеме по лестнице на один пролет в обычном темпе при нормальных условиях.
IV функциональный класс - невозможность выполнять любой вид физической деятельности без возникновения неприятных ощущений.
Приступ стенокардии может возникнуть и в покое. Принята также клиническая классификация стенокардии:
1. Типичная стенокардия:
- загрудинная боль или дискомфорт характерного качества и продолжительности;
- возникает при физической нагрузке или эмоциональном стрессе;
- проходит в покое или после приема нитроглицерина.
2. Атипичная стенокардия - два из вышеперечисленных признаков.
3. Несердечная боль - один или ни одного из вышеперечисленных признаков.
Классификация преходящей ишемии миокарда:
- стабильная стенокардия;
- вариантная стенокардия (спастическая или стенокардия Принцметала);
- безболевая ишемия миокарда.
Диагностика
Каждый больной с подозрением на стенокардию нуждается в быстрой квалифицированной оценке состояния, постановке точного диагноза, стратификации риска (табл. 21).
Таблица 21. Клинические характеристики ангинозного приступа
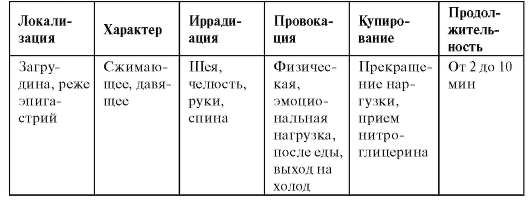
Основа первичного диагноза на амбулаторном этапе - тщательный сбор анамнеза с акцентированием внимания на факторах риска, физикальное обследование, регистрация ЭКГ в покое.
Постановка диагноза «нестабильная стенокардия» должна означать немедленную госпитализацию в кардиологическое отделение.
Физикальное обследование
1. При осмотре обратить внимание на признаки нарушения липидного обмена: ксантомы, ксантелазмы, краевое помутнение роговицы («старческая дуга»).
2. Признаки сердечной недостаточности: одышка, цианоз, набухание вен шеи, отеки, патологическая пульсация в области сердца (аневризма).
3. Необходимо оценить показатели жизненно важных функций (АД, ЧСС, ЧДД).
4. Аускультация сердца: III и IV тоны, систолический шум на верхушке как проявление ишемической дисфункции папиллярных мышц для выявления шумов, характерных для аортального стеноза или гипертрофической обструктивной кардиомиопатии (могут обусловливать проявления стенокардии).
5. Пульсация и шумы на периферических артериях.
6. Следует активно выявлять симптомы состояний, которые могут провоцировать ишемию или усугублять ее течение.
Лабораторные исследования
• Всем больным: - общий анализ крови;
- концентрация глюкозы в крови натощак;
- развернутый липидный профиль (общий холестерин (ОХС), холестерин липопротеинов высокой плотности (ЛПВП), холестерин ЛПНП, триглицериды) натощак;
- концентрация креатинина.
• При наличии специальных показаний:
- маркеры повреждения миокарда (сердечный тропонин);
- тиреоидные гормоны.
Инструментальные исследования
ЭКГ в покое необходимо проводить всем пациентам с болью в грудной клетке. Желательно записать ЭКГ в момент приступа болей за грудиной.
Признаки ишемии: депрессия или элевация сегмента ST (1 мВ) на расстоянии, большем или равном 0,06-0,08 с от комплекса QRS, высокий остроконечный «коронарный» зубец Т, инверсия зубца Т, патологический зубец Q.
Вне ангинозного приступа на ЭКГ могут не определяться патологические изменения.
Рентгенография органов грудной клетки не представляет собой средство диагностики стенокардии, однако она показана в случаях, когда есть основания выявить хроническую сердечную недостаточность, поражения клапанов сердца, перикарда или расслаивающую аневризму аорты, заболевания легких. Выполнение рентгенографии грудной клетки в иных случаях не обязательно.
ЭхоКГ показана:
1) пациентам с подозрением на перенесенный инфаркт миокарда, поражение клапанов сердца, с симптомами хронической сердечной недостаточности;
2) пациентам с систолическим шумом, указывающим на аортальный стеноз или гипертрофическую кардиомиопатию.
Нет необходимости в назначении ЭхоКГ пациентам с подозрением на стенокардию при нормальной ЭКГ, отсутствии в анамнезе инфаркта миокарда и симптомов хронической сердечной недостаточности.
Проба с физической нагрузкой
• Показания к проведению:
- дифференциальная диагностика ИБС;
- определение индивидуальной толерантности к физической нагрузке;
- оценка эффективности лечебных мероприятий: антиангинального воздействия и (или) реваскуляризации;
- экспертиза трудоспособности;
- оценка прогноза.
• Противопоказания:
- острая стадия инфаркта миокарда (2-7 дней от начала);
- нестабильная стенокардия;
- нарушение мозгового кровообращения;
- острый тромбофлебит;
- ТЭЛА;
- сердечная недостаточность III-IV класса по NYHA;
- желудочковые аритмии высоких градаций (тахикардия), провоцируемые нагрузкой;
- выраженная дыхательная недостаточность;
- лихорадка;
- нарушения опорно-двигательного аппарата;
- пожилой возраст, астения.
• Нагрузочный тест малоинформативен в следующих случаях:
- при тахиаритмиях;
- при полной блокаде левой ножки пучка Гиса;
- при синоатриальной и атриовентрикулярной блокаде высокой степени.
• Нагрузочные визуализирующие исследования.
К нагрузочным визуализирующим методам относятся:
1) нагрузочная ЭхоКГ, цель которой - обнаружить нарушения локальной сократимости миокарда левого желудочка, вызванные ишемией миокарда;
2) перфузионная двухмерная сцинтиграфия миокарда с изотопом таллия [201Tl];
3) однофотонная эмиссионная компьютерная томография - выявление участков гипоперфузии миокарда левого желудочка.
Показаниями для нагрузочных визуализирующих исследований служат:
- полная блокада левой ножки пучка Гиса, ритм электрокардиостимулятора, синдром WPW и другие изменения ЭКГ, связанные с нарушениями проводимости;
- снижение сегмента ST >1 мм на ЭКГ покоя, в том числе обусловленное гипертрофией левого желудочка, приемом медикаментов (сердечные гликозиды);
- сомнительный результат нагрузочной пробы: нетипичная боль, незначительная динамика ЭКГ;
- неспособность больных к выполнению достаточно интенсивной функциональной нагрузки;
- приступы стенокардии после коронарной реваскуляризации (АКШ и ТБКА) для уточнения локализации ишемии;
- необходимость определения жизнеспособности миокарда для решения вопроса о реваскуляризации.
Чреспищеводная предсердная электрическая стимуляция
Показаниями к проведению чреспищеводной предсердной электрической стимуляции (ЧПЭС) служат:
- невозможность выполнения проб с функциональной нагрузкой (ВЭМ-тест, тредмил) в связи с наличием сопутствующих заболеваний или противопоказаний к нагрузочным тестам;
- неинформативность пробы с функциональной нагрузкой вследствие того, что она не доведена до диагностических критериев по ЭКГ или до субмаксимальной возрастной ЧСС.
Признаки ишемии на ЭКГ при ЧПЭС такие же, как и при пробе с функциональной нагрузкой, только во внимание принимают снижение сегмента ST в первых спонтанных комплексах после прекращения стимуляции сердца.
Фармакологические тесты
Пациентам, не способным переносить функциональную нагрузку, например, при тяжелом артрите, можно рекомендовать фармакологические «нагрузочные» пробы с использованием добутамина, который повышает потребность миокарда в кислороде за счет увеличения ЧСС и усиления сократимости, или дипиридамола, вызывающего «синдром обкрадывания».
Коронарная ангиография
Коронарная ангиография (КАГ) - метод прямой визуализации коронарных артерий, представляющий золотой стандарт диагностики стенозирующих поражений коронарных артерий, служит ключевым методом для принятия решения о необходимости и способе реваскуляризации.
Степень сужения сосуда определяется уменьшением диаметра его просвета по сравнению с должным и выражается в процентах. До настоящего времени используют визуальную оценку со следующей характеристикой: нормальная коронарная артерия, измененный контур артерии без определения степени стеноза, сужение менее 50%, сужение на 51-75%, 76-95%, 95-99% (субтотальное), 100% (окклюзия). Гемодинамически незначимым считают сужение просвета сосуда менее 50%. Помимо локализации поражения и его степени при КАГ могут
быть обнаружены другие характеристики поражения артерии, такие, как наличие тромба, надрыва (диссекция), спазма или миокардиального мостика. Принимая решение о назначении КАГ, необходимо оценить не только целесообразность, но и риск этого вмешательства.
Показания для назначения больному КАГ при стабильной стенокардии для решения вопроса о возможности выполнения транскоронарной ангиопластики или коронарного шунтирования:
1. Тяжелая стенокардия III-IV функциональных классов (ФК), сохраняющаяся при оптимальном антиангинальном лечении.
2. Признаки выраженной ишемии миокарда по результатам неинвазивных методов.
3. Наличие у больного в анамнезе эпизодов внезапной смерти или опасных желудочковых нарушений ритма.
4. Больные со стенокардией, которым проводилась реваскуляризация (АКШ, ТБКА).
5. Прогрессирование заболевания по данным динамики неинвазивных тестов.
6. Сомнительные результаты неинвазивных тестов, особенно у лиц с социально значимыми профессиями (водители общественного транспорта, летчики и др.).
Противопоказания к проведению КАГ приведены в табл. 22.
Таблица 22. Относительные противопоказания к коронарной ангиографии
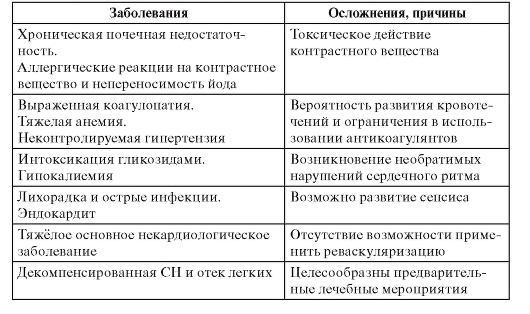
Безболевая (немая) ишемия миокарда
По данным Фремингемского исследования, до 25% случаев инфаркта миокарда впервые диагностируются только при ретроспективном анализе серии ЭКГ, причем в половине из них эти инфаркты миокарда полностью бессимптомны. Выраженный атеросклероз коронарных артерий может не иметь проявлений и обнаруживаться только на аутопсии у лиц, умерших внезапно.
В рамках стабильной ИБС выделяют два типа безболевой ишемии миокарда (ББИМ) :
- I тип - полностью ББИМ;
- II тип - сочетание ББИМ и болевых эпизодов ишемии миокарда.
Эпизоды ББИМ обычно диагностируются во время проб с функциональной нагрузкой и при суточном мониторировании ЭКГ, а также при плановых регистрациях ЭКГ. При диагностике и оценке тяжести ББИМ нагрузочные пробы и суточное мониторирование ЭКГ дополняют друг друга. Тредмил-тест, ВЭМ-проба, ЧПЭС позволяют обнаружить ББИМ и охарактеризовать ее связь с АД, ЧСС, функциональной нагрузкой. Одновременное выполнение перфузионной сцинтиграфии миокарда и нагрузочной ЭхоКГ помогает оценить возникающие гипоперфузию и нарушение сократительной функции миокарда. Суточное мониторирование ЭКГ фиксирует общее количество и длительность эпизодов ББИМ, а также случаи ББИМ в ночные часы и вне связи с функциональной нагрузкой.
ББИМ - неблагоприятный прогностический признак. Повреждающее действие ишемии на миокард определяется не наличием боли, а выраженностью и продолжительностью нарушения его перфузии. Негативное прогностическое значение имеют также значительные количество, выраженность и продолжительность эпизодов ишемии миокарда вне зависимости от того, оказываются они болевыми или безболевыми.
Синдром X
Состояние, по-видимому, обусловленное изменением коронарных артерий на уровне мелких сосудов, чаще встречающееся у больных артериальной гипертензией и гипертрофией миокарда левого желудочка.
Диагностические критерии:
- типичные приступы стенокардии, провоцируемые физическими нагрузками;
- положительный нагрузочный тест;
- нормальные коронарные артерии.
Дифференциальная диагностика болей в грудной клетке при диагностике стабильной стенокардии
Причины болей в грудной клетке приведены в табл. 23.
• Аритмии: тахикардии с высокой частотой ритма. Могут вызывать типичные стенокардитические боли вследствие повышения потребности миокарда в кислороде и (или) снижения коронарного кровотока в диастолу.
• Поражения клапанов сердца или гипертрофическая обструктивная кардиомиопатия. Могут вызвать типичные стенокардитические боли вследствие обструкции выносящего тракта левого желудочка и увеличения миокардиального напряжения.
• Расслаивающая аневризма аорты. Классически проявляется острой режущей болью в грудной клетке с иррадиацией в спину.
• Перикардит. Боль часто плевритического характера, но может напоминать стенокардию. В классических случаях боль ослабевает в положении сидя и при наклоне вперед, усиливается при дыхании, кашле, глотании.
• ТЭЛА. Боль часто острая, плевритического характера и сопровождается одышкой. При рентгенографии органов грудной клетки застойных явлений не выявляют.
• Пневмоторакс. Острое начало, сопровождается одышкой, болью плевритического характера; тимпанический перкуторный звук на пораженной стороне и отсутствие дыхательных шумов при аускультации.
• Пневмония. Часто сопровождается лихорадкой, болями плевритического характера и продуктивным кашлем.
• Плеврит. Боль в грудной клетке плевритического характера.
• Поражения пищевода (рефлюкс, спазм, эзофагит). Боль часто связана с приемом пищи; может быть неотличима от стенокардитической.
• Поражения желчевыводящих путей (холецистит, холелитиаз, холангит, желчная колика). Боль в правом верхнем квадранте живота, иррадиирующая в правую часть спины или правую лопатку.
• Язвенная болезнь. Боль в эпигастрии, часто связана с приемом пищи, может быть неотличима от стенокардитической.
• Панкреатит. Обычно боль локализуется в эпигастрии и иррадиирует в спину.
• Реберно-грудинный хондрит (синдром Титце). Характерна боль при пальпации ребер или движениях.
• Перелом ребер. Движения грудной клетки, дыхание могут усиливать боли. Характерен симптом крепитации при пальпации.
Таблица 23. Причины возникновения болей в грудной клетке
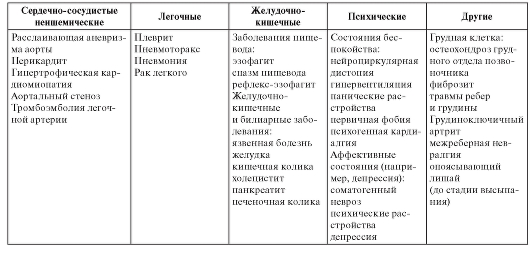
• Опоясывающий лишай. Интенсивная боль по типу невралгии. Характерные пузырьковые высыпания, в начальной стадии кожные проявления могут отсутствовать.
• Тревожные расстройства. Клинически могут быть неотличимы от стенокардии. Часто боли сопровождаются возбуждением, потливостью, ощущением сердцебиения.
• Депрессивные расстройства. Продолжительные ощущения тяжести в грудной клетке, не связанные с физической нагрузкой и не сопровождающиеся изменениями на ЭКГ.
Показания к консультации других специалистов
• Больных с предположительным или верифицированным диагнозом стенокардии желательно консультировать у кардиолога.
• При подозрении на острый коронарный синдром (инфаркт миокарда, нестабильная стенокардия) показана немедленная госпитализация в кардиологическое отделение.
• Если у врача есть основания проводить дифференциальную диагностику с заболеваниями, которые могут имитировать стенокардию либо усугублять ее течение, необходимы консультации соответствующих специалистов: невропатолога, эндокринолога, пульмонолога, гастроэнтеролога, гематолога и т.д.
Лечение
Цели лечения
1. Улучшение прогноза и увеличение продолжительности жизни (предупреждение инфаркта миокарда и внезапной сердечной смерти).
2. Уменьшение или устранение симптомов.
Если различные терапевтические стратегии равноэффективны в облегчении симптомов, следует предпочесть лечение с доказанным или очень вероятным преимуществом в улучшении прогноза.
Показания к госпитализации
Госпитализация показана при подозрении на острый коронарный синдром; при неясном диагнозе, если невозможно провести соответствующее обследование на амбулаторном этапе; при неэффективности медикаментозного воздействия; для определения или уточнения показаний к хирургическому лечению.
Немедикаментозное лечение
• Следует комплексно воздействовать на модифицируемые факторы риска для снижения величины общего сердечно-сосудистого риска.
• Надо информировать пациента о характере заболевания, объяснить алгоритм действий в случае развития ангинозного приступа.
• Пациент должен избегать физических нагрузок, вызывающих приступ.
Медикаментозное лечение
Медикаментозное воздействие необходимо для снижения вероятности развития инфаркта миокарда и внезапной смерти (т.е. увеличения продолжительности жизни) и уменьшения выраженности симптомов стенокардии (улучшение качества жизни).
Лечение, направленное на улучшение прогноза
Дезагреганты
1. Ацетилсалициловую кислоту назначают в дозе 75-150 мг/сут всем пациентам со стенокардией, за исключением тех, у кого в анамнезе имеются указания на желудочно-кишечное кровотечение, острую язву, обострение хронической язвы, геморрагический синдром или аллергию к препарату.
2. При непереносимости или противопоказаниях к назначению ацетилсалициловой кислоты применяют клопидогрел в дозе 75 мг/сут.
3. Больным, перенесшим ТБКА со стентированием, в течение года назначают клопидогрел 75 мг/сут + ацетилсалициловую кислоту.
Если на фоне приема ацетилсалициловой кислоты или клопидогрела у пациента развиваются тромботические осложнения (инфаркт миокарда, инсульт), следует определить уровень агрегации тромбоцитов для исключения развития резистентности к дезагрегантам. В случае обнаружения резистентности возможно увеличение дозы препарата с повторным контролем уровня агрегации либо замена на препарат с другим механизмом действия, например непрямой антикоагулянт.
Липидоснижающее лечение
Всем пациентам с ИБС показан прием статинов (табл. 24) независимо от исходного уровня холестерина.
Обычно статины хорошо переносятся, однако возможно развитие побочных эффектов: рабдомиолиз и повышение активности печеноч-
ных ферментов - аминотрансфераз. Необходимо определять уровни креатинфосфокиназы и аланиновой аминотрансферазы первый раз через 1-1,5 мес, далее 1 раз в 6 мес.
Противопоказаниями к назначению статинов служат активные гепатиты, беременность и отмеченная выше индивидуальная непереносимость препаратов.
Таблица 24. Статины (ингибиторы 3-ГМГ-КоА-редуктазы)
Лечение статинами нужно проводить постоянно, так как уже через месяц после прекращения приема препарата уровень липидов крови возвращается к исходному.
Повышать дозу любого из статинов следует, соблюдая интервал в 1 мес, так как за этот период достигается наибольший эффект препарата.
Целевой уровень холестерина ЛПНП при стенокардии - меньше 100 мг/дл (<2,6 ммоль/л).
В случае непереносимости статинов назначают альтернативные препараты: фибраты, пролонгированные препараты никотиновой кислоты или секвестранты желчных кислот.
Пациентам со стенокардией, низким уровнем холестерина ЛПВП, близким к нормальному уровню холестерина ЛПНП, и высоким уровнем триглицеридов показано назначение фибратов как препаратов первой линии.
Никотиновая кислота - активный гиполипидемический препарат, однако часто развивающиеся побочные эффекты (покраснение, зуд и сыпь на коже, боли в животе, тошнота) ограничивают ее широкое использование. Никотиновую кислоту назначают по 2-4 г 2-3 раза
в сутки, а форму с замедленным высвобождением - по 0,5 г 3 раза в сутки.
Фибраты
Гиполипидемический эффект производных фиброевой кислоты (фибратов) (табл. 25) проявляется главным образом в снижении содержания триглицеридов и повышении концентрации антиатерогенного холестерина ЛПВП; уменьшение уровня общего холестерина менее выражено. Фенофибрат и ципрофибрат снижают концентрацию холестерина ЛПНП в большей степени, чем гемфиброзил. Противопоказаниями к назначению фибратов служат желчно-каменная болезнь, гепатит, беременность.
Таблица 25. Фибраты (производные фиброевой кислоты)
Секвестранты желчных кислот (анионообменные смолы)
Эта группа лекарственных средств представлена двумя основными препаратами - колестирамином® и колестиполом®. Показанием к назначению анионообменных смол служит тяжелая гиперхолестеринемия, рефрактерная к статинам и фибратам. Колестирамин® назначают в дозе 8-24 г, колестипол® - 5-30 г/сут в виде порошка, который растворяют в жидкости. Препараты иногда субъективно плохо переносятся из-за неприятного вкуса. Побочные эффекты проявляются в виде запора, тошноты, вздутия живота; при длительном приеме возможно возникновение дефицита жирорастворимых витаминов.
β-Адреноблокаторы
Показаны всем больным с ИБС, перенесшим инфаркт миокарда и (или) с признаками сердечной недостаточности.
Рекомендуется назначение β-адреноблокаторов без внутренней симпатомиметической активности: метопролола, бисопролола, пропранолола, атенолола.
Ингибиторы ангиотензинпревращающего фермента
Показаны всем больным с ИБС, перенесшим инфаркт миокарда, с признаками сердечной недостаточности, артериальной гипертонией, сахарным диабетом.
Принимая во внимание данные крупных исследований (HOPE, EUROPA), ряд экспертов рекомендуют назначать ИАПФ (рамиприл, периндоприл) всем больным с ИБС.
Антиангинальное лечение
Нитраты
Основной механизм действия нитратов (табл. 26, 27) - венодилатация, в результате чего уменьшается венозный возврат к сердцу, снижаются преднагрузка и потребность миокарда в кислороде. Кроме дилатации вен, нитраты умеренно расширяют артериолы в большом и малом круге кровообращения, что снижает посленагрузку на оба желудочка сердца. Наконец, нитраты уменьшают степень вазоконстрикции и устраняют спазм коронарных артерий.
Таблица 26. Нитраты и нитратоподобные (часть 1)
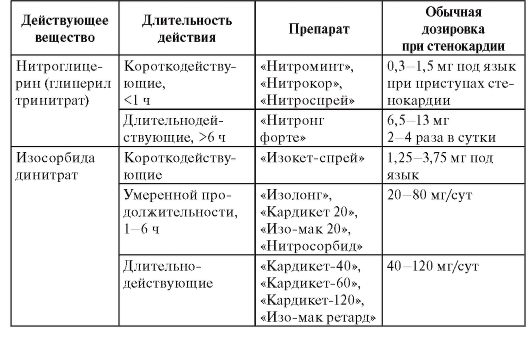
Таблица 27. Нитраты и нитратоподобные (часть 2)
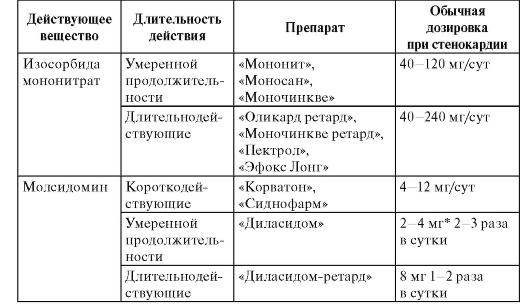
* - рекомендуемые дозы.
Нитраты классифицируют по лекарственным формам:
1) всасывающиеся через слизистую оболочку рта: таблетки нитроглицерина для приема под язык, аэрозоли нитроглицерина и изосорбида динитрата;
2) всасывающиеся в ЖКТ: таблетки и капсулы изосорбида динитрата, изосорбида-5-мононитрата>, нитроглицерина пролонгированного действия;
3) для накожного применения: мази, пластыри с нитроглицерином;
4) для внутривенного введения: растворы нитроглицерина и изосорбида динитрата.
Рекомендации по применению нитратов
• Все больные ИБС должны быть обеспечены нитроглицерином короткого действия в форме таблеток или спрея для купирования приступа и профилактики в ситуациях, где предполагается высокая физическая или эмоциональная нагрузка.
• Для предотвращения риска развития привыкания к нитратам их назначают прерывисто с целью создать в течение суток период, свободный от действия нитрата. Продолжительность такого периода должна быть не менее 10-12 ч.
• Пролонгированные нитраты назначают в виде монотерапии либо в комбинации с β-адреноблокаторами или блокаторами кальциевых каналов.
• Недостатки нитратов: сравнительно частое появление побочных эффектов, в первую очередь головной боли; развитие привыкания (толерантности) к ним при регулярном приеме; возможность возникновения синдрома рикошета при резком прекращении поступления препарата в организм.
• При стенокардии напряжения I ФК нитраты назначают только прерывисто в лекарственных формах короткого действия, обеспечивающих короткий и выраженный эффект, - буккальные таблетки, пластинки, аэрозоли нитроглицерина и изосорбида динитрата. Такие формы следует применять за 5-10 мин до предполагаемой функциональной нагрузки, вызывающей обычно приступ стенокардии.
• При стенокардии напряжения II ФК нитраты также назначают прерывисто, перед предполагаемыми функциональными нагрузками. Наряду с формами короткого эффекта можно использовать формы умеренно пролонгированного действия.
• При стенокардии III ФК нитраты принимают постоянно в течение дня - асимметричный прием с безнитратным периодом в 10-12 ч. Для этого используют современные 5-мононитраты пролонгированного действия.
• При стенокардии IV ФК, когда приступы стенокардии могут возникать и в ночное время, нитраты следует назначать так, чтобы обеспечить их круглосуточный эффект и, как правило, в комбинации с другими антиангинальными препаратами, в первую очередь β-адреноблокаторами.
• Нитратоподобным действием и, следовательно, антиангинальным эффектом обладает молсидомин. Препарат может быть использован для профилактики приступов стенокардии.
β-Адреноблокаторы
β-Адреноблокаторы (табл. 28, 29) назначают в качестве препаратов первого ряда большинству пациентов со стабильной стенокардией. Они уменьшают адренергическое влияние на сердце, благодаря чему снижаются ЧСС, систолическое артериальное давление (САД), реакция сердечно-сосудистой системы на физическую нагрузку и эмоциональный стресс.
Таблица 28. β-Адреноблокаторы (часть 1)
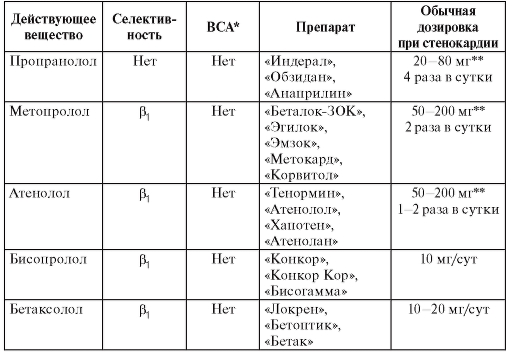
Таблица 29. β-Адреноблокаторы (часть 2)
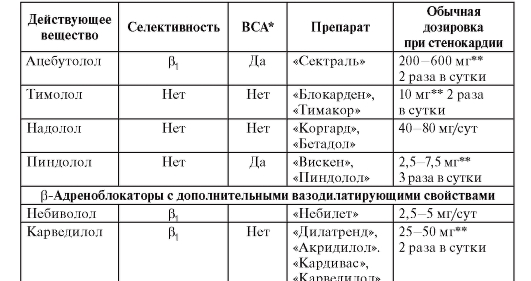
* ВСА - внутренняя симпатомиметическая активность; ** - разовая доза.
β-Адреноблокаторы различаются по селективности действия в отношении β1-адренорецепторов, расположенных в сердце; по наличию или отсутствию дополнительных свойств, в первую очередь способности вызывать вазодилатацию; наличию или отсутствию собственной симпатомиметической активности; по продолжительности действия. Предпочтение при лечении больных ИБС следует отдавать селективным β-адреноблокаторам, не имеющим собственной симпатомиметической активности, обладающим значительным периодом полувыведения.
β-Адреноблокаторы надо назначать в дозах, обеспечивающих отчетливое урежение ЧСС в покое и предотвращающих чрезмерную тахикардию во время нагрузок. Дозу β-адреноблокатора подбирают таким образом, чтобы достигнуть уменьшения ЧСС в покое до 55-60 в минуту и примерно до 75% ЧСС при нагрузке, провоцирующей приступ стенокардии.
При стенокардии, устойчивой к монотерапии, используют комбинацию β-адреноблокатора с блокатором кальциевых каналов (с длительно действующим дигидропиридином), пролонгированными нитратами или триметазидином.
Самые распространенные побочные эффекты при терапии β-адреноблокаторами: синусовая брадикардия, различные блокады сердца, артериальная гипотония, слабость, ухудшение переносимости функциональной нагрузки, нарушения сна, снижение эректильной функции, кошмарные сновидения.
Противопоказания к назначению β-адреноблокаторов: брадикардия, атриовентрикулярные блокады, синдром слабости синусового узла, бронхиальная астма, хроническая обструктивная болезнь легких (ХОБЛ).
Блокаторы медленных кальциевых каналов
Классификация антагонистов медленных кальциевых каналов приведена в табл. 30, 31.
Таблица 30. Дигидропиридиновые блокаторы медленных кальциевых каналов
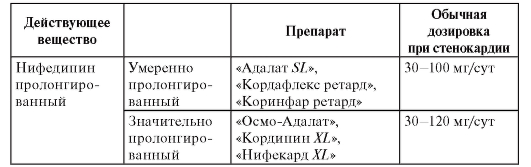
Окончание табл. 30
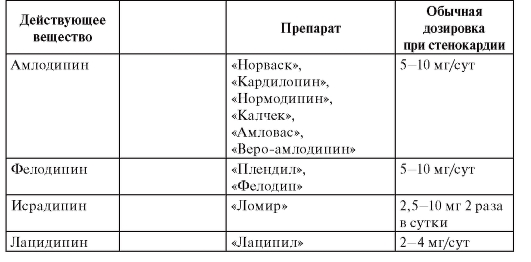
Таблица 31. Недигидропиридиновые блокаторы медленных кальциевых каналов

Пациентам со стабильной стенокардией не следует назначать короткодействующие блокаторы кальциевых каналов - их можно рассматривать лишь как средства купирования приступа стенокардии в случае непереносимости нитратов.
Миокардиальные цитопротекторы
Из известных в настоящее время миокардиальных цитопротекторов наиболее изучен препарат триметазидин с доказанными антиангинальным и антиишемическим свойствами. Механизм действия триметазидина связан с подавлением β-окисления жирных кислот и усилением окисления пирувата в условиях ишемии, что помогает сохранить в кардиомиоцитах необходимый уровень аденозинтрифосфата (АТФ), снизить внутриклеточный ацидоз и избыточное накопление ионов кальция. Триметазидин модифицированного высвобождения (триметазидин MB)
может быть назначен в дозе 35 мг 2 раза в сутки на любом этапе лечения стабильной стенокардии для усиления антиангинальной эффективности β-адреноблокаторов, блокаторов кальциевых каналов, нитратов.
Ингибиторы f-каналов
Эти препараты могут быть рекомендованы в случае непереносимости β-адреноблокаторов больным хронической сердечной недостаточностью (ХСН). В настоящее время на рынке присутствует препарат ивабрадин. Его средняя суточная доза - 10 мг. Целевое ЧСС - 58-64 в минуту.
Лечение вазоспастической стенокардии
Назначают блокаторы медленных кальциевых каналов дигидропиридинового ряда. При недостаточном эффекте - нитраты. Лечение синдрома X
• Назначение нитратов, β-адреноблокаторов, блокаторов кальциевых каналов в качестве монотерапии или в комбинации.
• Статины у больных гиперлипидемией.
• ИАПФ у больных артериальной гипертонией.
У большинства пациентов стенокардия протекает на фоне других сердечно-сосудистых и несердечных заболеваний; лечение приведено в табл. 32-36.
Таблица 32. Рекомендованное лечение при сочетании стенокардии и других заболеваний (часть 1)
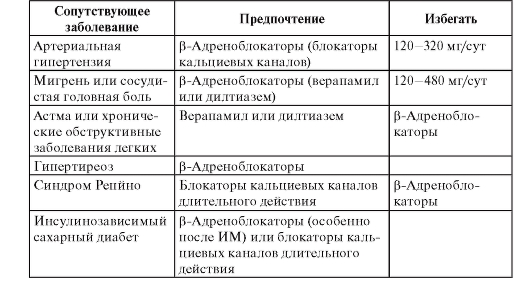
Таблица 33. Рекомендованное лечение при сочетании стенокардии и других заболеваний (часть 2)
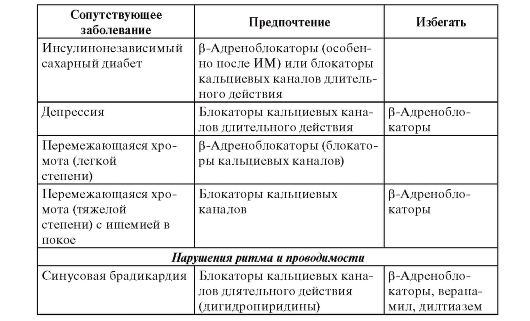
Таблица 34. Рекомендованное лечение при сочетании стенокардии и других заболеваний (часть 3)
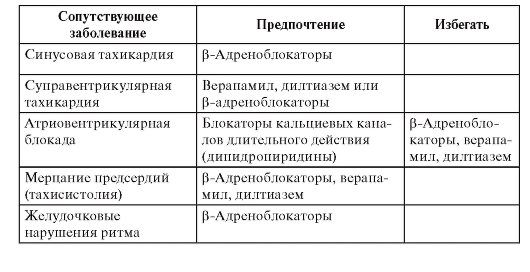
Таблица 35. Рекомендованное лечение при сочетании стенокардии и других заболеваний (часть 4)
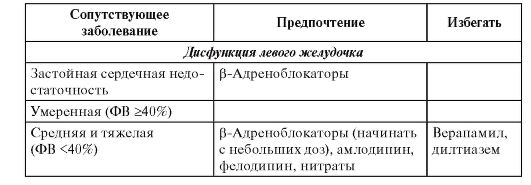
Таблица 36. Рекомендованное лечение при сочетании стенокардии и других заболеваний (часть 5)
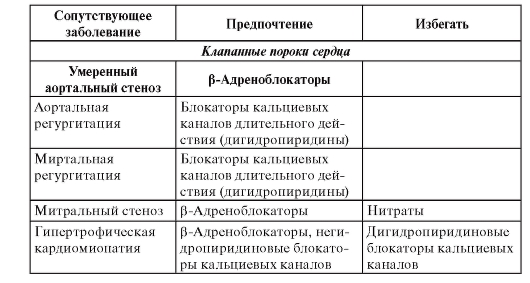
1.8. КЛИНИКО-ФАРМАКОЛОГИЧЕСКИЕ ПОДХОДЫ К ВЫБОРУ И ПРИМЕНЕНИЮ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРИ ГИПЕРЛИПИДЕМИЯХ
Как мы с вами уже обсуждали, один из важнейших этиологических факторов ИБС - атеросклероз (рис. 77), поэтому грамотное применение гипохолестеринемических средств - залог успешного лечения этих больных. Классификация гиперлипидемий приведена в табл. 37.
Таблица 37. Классификация гиперлипидемий (ВОЗ)
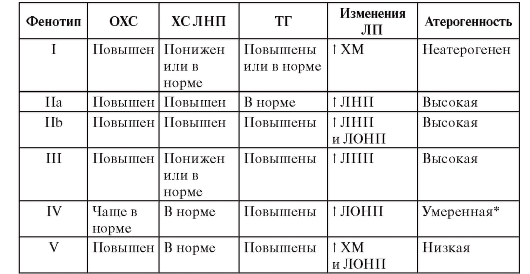
Примечание. повышение концентрации; * - IV фенотип является атерогенным, если ему сопутствует низкая концентрация ХС ЛВП, а также другие метаболические нарушения (гипергликемия, инсулинорезистентность, нарушенная толерантность к глюкозе)
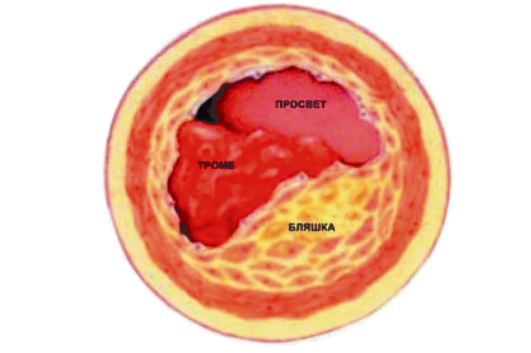
Рис. 77. Сосуд, пораженный атеросклеротическим процессом
При ИБС, атеросклерозе мозговых и периферических артерий чаще всего имеют место фенотипы IIa и IIb. При метаболическом синдроме и сахарном диабете 2 типа чаще наблюдается повышение уровня триглицеридов на фоне высокого уровня общего холестерина, поэтому у них часто встречаются IIb и (или) IV фенотипы. Все эти фенотипы свидетельствуют о необходимости немедленного медикаментозного лечения.
Помимо идентификации типа гиперлипидемии практический врач должен оценить наличие других факторов риска у пациента (табл. 38).
Таблица 38. Факторы риска развития и прогрессирования ишемической болезни сердца (Европейские рекомендации, 1988 г.)
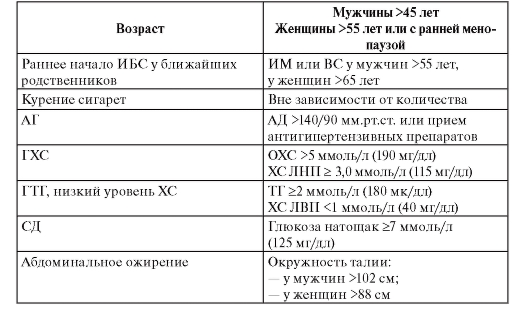
Категории риска развития фатальных осложнений
Первая категория - высокого риска
• Больные с любыми клиническими проявлениями ИБС, периферического атеросклероза и атеросклероза мозговых артерий.
• Лица без клинических проявлений перечисленных выше заболеваний, но имеющие несколько факторов риска, при оценке которых по таблице SCORE 10-летний риск фатального исхода заболевания >5%.
• Больные, страдающие сахарным диабетом 1-2 типов, особенно в комбинации с микроальбуминурией.
Вторая категория - умеренного риска
Лица, у которых отсутствуют клинические проявления ССЗ, но существует риск развития атеросклероза сосудов вследствие:
- наличия нескольких факторов риска (>2), даже если при оценке по таблице SCORE 10-летний риск фатального исхода заболевания не <5%;
- выраженного повышения одного из факторов риска, например - ОХС >8 ммоль/л (320 мг/дл), или холестерин ЛПНП >6 моль/л (240 мг/дл), или АД >180/110 мм рт. ст.
Третья категория - низкого риска
• Лица без клинических проявлений ССЗ с одним умеренно выраженным фактором риска, например - ОХС >5 ммоль/л (190 мг/ дл), но <8 ммоль/л (320 мг/дл) или холестерин ЛПНП >3 ммоль/л (115 мг/дл), но <6 ммоль/л (240 мг/дл) - в пределах 140/90- 160/100 мм рт.ст.
• Лица с отягощенным семейным анамнезом; начало ИБС или другого сосудистого заболевания у ближайших родственников больного по мужской линии <55 лет, по женской - <65 лет.
Обследование пациента с гиперлипидемией должно закончиться определением индивидуального фатального риска развития ССЗ по таблицам SCORE (Systemic Coronary Risk Evaluation). Эта таблица была разработана и проверена на российской популяции. Риск считается очень высоким при проекции в зону более 10%, высоким - 5-10% и низким - <5%. Чем выше риск, тем агрессивнее должно быть лечение.
Инструкция по применению шкалы SCORE
Чтобы оценить суммарный риск смерти от сердечно-сосудистых заболеваний в течение 10 лет, необходимо выбрать таблицу, соответствующую полу, возрасту и статусу курения. В этой таблице нужно найти клетку, соответствующую данным систолического АД и общего холестерина пациента.
Шкала помогает оценить результат профилактических мероприятий. Так, пациент, бросивший курить, перейдет из категории более высокого риска в категорию менее высокого.
Для расчета суммарного риска сердечно-сосудистых заболеваний
можно пользоваться интернет-версией шкалы SCORE, опубликованной на сайте www.klinrek.ru. Оценку риска по шкале SCORE (рис. 78) можно использовать при разработке плана профилактических мероприятий (выбор диеты, программа физических тренировок, определение медикаментозного лечения). Окончательные решения не следует принимать на основании оценки лишь одного фактора риска - требуется комплексный подход.
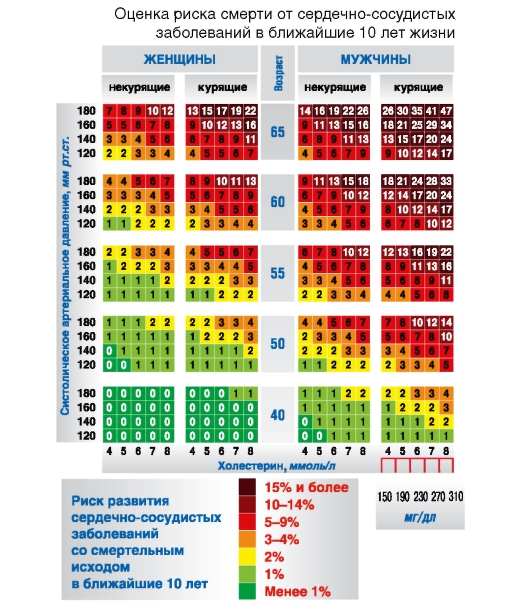
Рис. 78. Оценка риска смерти от сердечно-сосудистых заболеваний (шкала
SCORE)
На практике достижение целевого уровня липидов (табл. 39, 40) часто представляет собой трудновыполнимую задачу даже при использовании комбинированного лечения. В этом случае необходимо добиться снижения холестерина ЛПНП на 30-40% исходного значения.
Таблица 39. Оптимальные значения липидов крови (Европейские рекомендации)
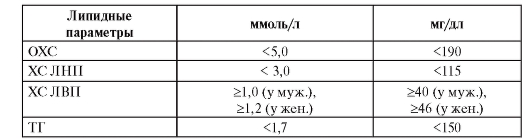
Таблица 40. Целевые уровни липидов в зависимости от риска по SCORE
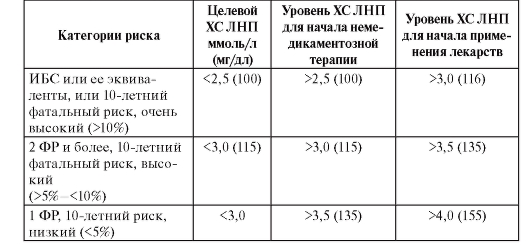
Принципы выбора лекарственных средств и их режимов дозирования
Для нормализации липидного обмена в настоящее время используют следующие группы лекарственных средств:
- ингибиторы фермента ГМК-КоА-редуктазы (статины);
- производные фиброевой кислоты (фибраты);
- никотиновая кислота (ниацин, эндурацин);
- ω-3-полиненасыщенные жирные кислоты;
- секвестранты желчных кислот (смолы);
- ингибитор абсорбции холестерина в кишечнике (эзетимиб). Приведенная выше последовательность соответствует существующей доказательной базе применения этих групп лекарственных препаратов, в которой лидируют статины.
Ингибиторы фермента ГМГ-КоА-редуктазы (статины)
Статины наиболее эффективны при лечении гиперлипидемий IIa и IIb фенотипов. Они наиболее эффективно снижают ОХС и холестерин ЛПНП, что сопровождается снижением общей смертности и различных ССЗ на 25-40%.
В настоящее время в России в клинической практике используются симвастатин, аторвастатин, розувастатин, правастатин, флувастатин, ловастатин. Симвастатин, правастатин и ловастатин были выделены из культуры пенициллиновых грибов и грибов Aspergillus terrens, а флувастатин и аторвастатин полностью синтетические препараты. Существует два возможных объяснения различной клинической эффективности статинов:
- длительность действия: период полувыведения аторвастатина и розувастатина более 14 ч, а всех других статинов - не более 2 ч;
- различия по гидрофильности: симвастатин и ловастатин липофильны; аторвастатин, розувастатин и правастатин гидрофильны; флувастатин - относительно гидрофилен.
Отличительная особенность статинов - наличие доказанных плейотропных эффектов (способности улучшать функцию эндотелия, снижать содержание С-реактивного белка и гомоцистеина, подавлять агрегацию тромбоцитов и пролиферацию гладкомышечных клеток).
Необходимо обратить внимание на то, что статины назначаются (табл. 41, 42) однократно, в вечернее время, после ужина, так как синтез холестерина наиболее интенсивно происходит в ночные часы.
Таблица 41. Среднетерапевтические дозы статинов
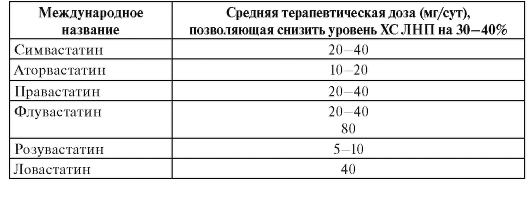
Таблица 42. Эффективность различных доз статинов
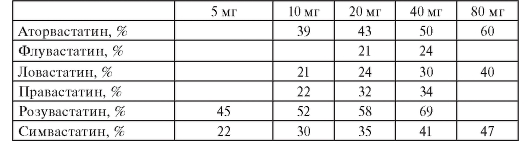
В целом удвоение дозы статина приводит к дополнительному снижению ЛПНП на 6% (G. Gau, Mayo Clinic Cardiovascular Review).
Несомненно, что алгоритм выбора должен быть максимально объективным, поэтому он должен учитывать следующие характеристики препаратов:
- эффективность;
- доказательную базу;
- безопасность;
- наличие клинически значимых лекарственных взаимодействий;
- стоимость.
Для воспроизведенных (генерических) препаратов также необходимо принимать во внимание данные об их клинической эффективности в российских исследованиях и соотношении цена / эффективность в сравнении с другими генериками.
Данные последних метаанализов показывают, что наиболее эффективные препараты для лечения выраженных нарушений липидного обмена - это синтетические статины (аторвастатин в суточной дозе 10 мг снижает уровень ЛПНП в среднем на 39%, ловастатин и правастатин в дозе 40 мг - на 31%, симвастатин в дозе 40 мг - на 35-41%, флувастатин в дозе 40-80 мг - на 25-35%, розувастатин в дозе 10 мг - на 39-45%), а именно аторвастатин, клиническое изучение которого началось с 1995 г. Сегодня это один из немногих препаратов, который позволяет добиться выраженного снижения общего холестерина и холестерина ЛПНП у больных с семейной гиперхолестеринемией.
Особо интересна для клиницистов возможность статинов не только предотвращать или замедлять развитие, но и уменьшать размер уже существующей атеросклеротической бляшки. Способность аторвастатина замедлять рост и способствовать регрессу атеросклеротической бляшки доказана как минимум в двух крупных исследованиях с использованием внутрисосудистой ультразвуковой методики REVERSAL и ESTABLISH. При этом очень интересно сравнение результатов
исследований ESTABLISH (аторвастатин) и ASTEROID (розувастатин). Шестимесячное лечение аторвастатином в дозе 20 мг/сут приводило к уменьшению размера атеромы на 13,1%, в то время как 24-месячное применение розувастатина в дозе 40 мг/сут сопровождалось уменьшением размера атеромы на 6,8%.
Для реализации синергетического взаимодействия наиболее оптимально сочетание амлодипина и аторвастатина. В одном из исследований было показано, что именно комбинация амлодипина и аторвастатина в наибольшей степени обеспечивает не только достижение целевого уровня липидов, но и АД.
В настоящее время доказана целесообразность применения статинов у женщин, лиц пожилого возраста, пациентов с метаболическим синдромом, сахарным диабетом, артериальной гипертензией (аторвастатин) и ОКС. Обнаружены их положительные эффекты при ХСН и снижении функций почек.
Производные фиброевой кислоты (фибраты)
Группа фибратов в настоящее время представлена ципрофибратом, фенофибратом и гемфиброзилом. Они наиболее эффективны при лечении изолированной гипертриглицеридемии (фенотипы IV) в сочетании с низким уровнем холестерина ЛПВП и при комбинированной гиперлипопротеидемии (фенотип IIb, III). Кроме этого они достаточно широко применяются в комбинированном лечении гиперлипидемий.
В клинической практике используется способность фибратов усиливать действие гипогликемических средств, что актуально для пациентов с сахарным диабетом и метаболическим синдромом. Результаты клинических исследований показывают, что применение фибратов сопровождается снижением общего холестерина на 20-25%, ЛПНП - на 10-15%, триглицеридов на 40-50% и повышением ЛПВП на 10-20%. В исследовании у пациентов с нарушенной толерантностью к глюкозе и ИБС было показано, что применение безафибрата на 30% снижает риск развития сахарного диабета, а при ожирении - на 41%. Фибраты способны снижать уровень липопротеина А и фибриногена, которые представляют собой независимые предикторы риска развития сердечно-сосудистых осложнений.
В отличие от статинов, фибраты рекомендуется принимать в утренние часы во время еды, так как в это время синтез триглицеридов максимально интенсивен. Режим дозирования фибратов следующий: ципрофибрат - 100 мг 1-2 раза в сутки, гемфиброзил - 600 мг 2 раза в сутки.
Никотиновая кислота
Никотиновая кислота (ниацин *), будучи одним из витаминов группы В, в дозах 2-4 г/сут оказывает выраженное гиполипидемическое действие. По своему спектру эффектов (выраженное снижение холестерина на 20-30% и триглицеридов - на 30-40% на фоне повышения ЛПВП на 20-30%) она могла бы быть почти «идеальным» гиполипидемическим средством, но обычные формы никотиновой кислоты больными переносятся плохо. Используется в комбинированном лечении гиперлипидемий IIb-фенотипа.
Никотиновую кислоту назначают в дозе 2-4 г/сут в 2-3 приема вместе с едой, но переносимость такого варианта лечения плохая. Лучше переносится пролонгированная форма никотиновой кислоты - эндурацин* , в которой активное вещество фиксировано на восковой матрице, обеспечивающей медленное высвобождение препарата в кровь. Препарат не вызывает ощущение «приливов» и в меньшей степени оказывает раздражающее действие на слизистую оболочку.
Помимо указанных выше побочных эффектов, наиболее серьезное осложнение при ее приеме - печеночная недостаточность. Клинически она проявляется симптомами печеночной комы, выраженным повышением активности печеночных ферментов на фоне резкого и внезапного снижения уровня общего холестерина. В связи с этим необходим ежемесячный контроль функций печени.
Полиненасыщенные ω-3-жирные кислоты
Полиненасыщенные ω-3-жирные кислоты в дозах 2-4 г/сут эффективны при IIb-V фенотипах гиперлипидемии. Они снижают уровень триглицеридов на 40-45% и также рекомендованы для вторичной профилактики инфаркта миокарда, так как в исследовании GISSI Prevenzione было показано, что на фоне стандартного лечения использование высокоочищенных ω-3-полиненасыщенных жирных кислот (омакор) в дозе 1000 мг приводит к снижению общей смертности и внезапной смерти соответственно на 21 и 45% у постинфарктных пациентов при сравнении с плацебо.
В состав многих биологически активных добавок входят ω-3- полиненасыщенные жирные кислоты, но они должны назначаться врачом, так как есть «проблемные» с точки зрения безопасности группы пациентов (страдающие стеатогепатозом или применяющие дезагреганты и пероральные антикоагулянты).
Ингибиторы абсорбции холестерина (эзетимиб)
Эзетимиб (эзетрол) является представителем нового класса гиполипидемических средств, избирательно блокирующих процесс абсорбции холестерина в эпителии тонкой кишки. Для монотерапии практически не применяется, а широко используется в комбинации с невысокими дозами статинов у пациентов с фенотипами IIа и IIb. Эффективность такой комбинации сопоставима с эффективностью монотерапии с использованием статинов в высоких дозах, но ее безопасность выше. В настоящее время проходит несколько длительных клинических исследований по влиянию препарата на жесткие конечные точки.
Эзетимиб назначают в дозе 10 мг один раз в сутки вне зависимости от приема пищи.
При сочетании со статинами необходим мониторинг активности трансаминаз. При исходном их повышении в 3 раза и более от верхней границы нормы применение препарата необходимо прекратить.
Секвестранты желчных кислот
Секвестранты желчных кислот (ионообменные смолы) в качестве гиполипидемических средств стали использоваться очень давно. Они хорошо снижают уровень ОХС и ЛПНП, но при этом могут существенно повышать уровень триглицеридов. В настоящее время в реальной клинической практике не применяются, хотя и доказано их положительное воздействие на конечные точки. Они имеют многочисленные побочные эффекты и при одновременном приеме с дигоксином, варфарином, тиазидными диуретиками и β-адреноблокаторами существенно снижают их эффективность. Выбор гиполипидемических препаратов в зависимости от вида гиперлипидемий приведен в табл. 43.
Методы контроля эффективности
Помимо контроля уровня липидов необходим мониторинг активности печеночных ферментом и креатининфосфокиназы. Если при двух последовательных измерениях уровень активности хотя бы одной из трансаминаз превышает в 3 раза верхние пределы нормальных значений, то статины необходимо отменить. При более умеренном их повышении целесообразно снижение дозы препарата или переход на аторвастатин. При повышении уровня КФК более чем в 5 раз также требуется отмена статинов. При монотерапии первый контроль активности ферментов назначают через 3 мес от начала лечения, а затем каждые 6 мес.
Таблица 43. Выбор гиполипидемических препаратов и комбинированное лечение в зависимости от вида гиперлипидемий (рекомендации ВНОК)
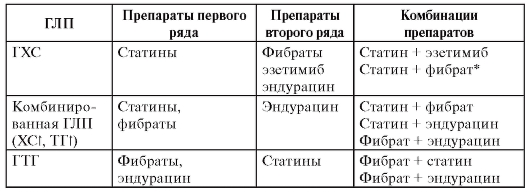
* Комбинация статинов с фибратами повышает риск миопатии. Комбинация статинов с эндурацином* повышает риск миопатии и печеночной недостаточности. Комбинация фибрата и эндурацина* может вызвать выраженное нарушение печеночной функции.
При появлении миопатии, миалгии необходимо исключить рабдомиолиз с поражением почек, о котором будут свидетельствовать повышение уровня КФК более чем в 10 раз и потемнение мочи (миоглобинурия). В этих случаях гиполипидемическое лечение отменяется. Риск рабдомиолиза повышен при одновременном назначении статинов с фибратами, цитостатиками и макролидными антибиотиками.
КЛИНИЧЕСКИЙ РАЗБОР
Консультируя тяжелых больных в клинике нашей кафедры, я встречаю интересные неоднозначные клинические случаи. В своем мастерклассе я буду знакомить вас с необычными, на мой взгляд, клиническими ситуациями. В этой главе мы обсуждаем актуальные аспекты лечения ИБС. Представляю вам случай острой аневризмы и тампонады сердца у больной палаты интенсивной терапии (ПИТ) кардиологического отделения нашей клиники.
Больная Т., 77 лет, поступила в ПИТ кардиологического отделения 27.11.2007 в 11.05.
Из анамнеза жизни: сахарный диабет, тип 2, принимала глибенкламид (манинил 3,5*), простудные заболевания, на учете у кардиолога не состояла. У больной впервые в жизни эпизод интенсивной одышки, болей в загрудинной области, тяжести в груди, от 23.11.2007 (за 4 дня до госпитализации) после значительной физической нагрузки. Она
дважды вызывала карету скорой помощи без регистрации ЭКГ (больная в это время находилась в Морозовском районе Ростовской области). Затем самостоятельно обратилась в поликлинику №1 за консультацией, где было проведено ЭКГ-обследование. Во время нахождения в поликлинике неоднократно возникали эпизоды интенсивной одышки.
Электрокардиография в поликлинике
На ЭКГ - признаки острого периода инфаркта миокарда нижней стенки левого желудочка (рис. 79). Больная направлена по экстренным показаниям в кардиологическое отделение нашей клиники. Добралась до больницы своим транспортом (в это время возникли интенсивные боли в левой половине грудной клетки).
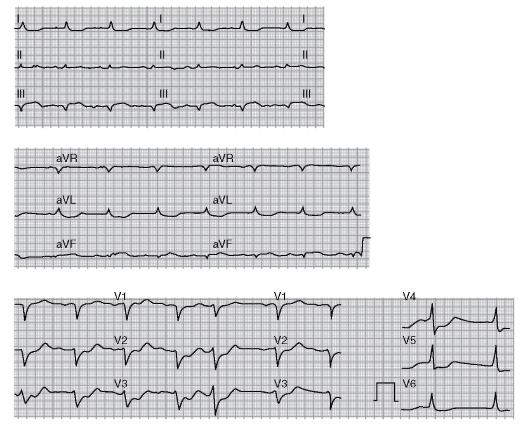
Рис. 79. Электрокардиограмма, полученная в поликлинике
Жалобы при поступлении
Чувство нехватки воздуха. Выраженные боли жгучего характера в области сердца. Перебои в работе сердца.
Объективное исследование
Состояние тяжелое за счет выраженной левожелудочковой недостаточности и начинающегося отека легких. Кожные покровы бледные, цианоз губ.
Дыхательная система: грудная клетка правильной формы. Дыхание глубокое, равномерное, ритмичное. ЧДД - 32 в минуту. Перкуторно звук ясный, легочный. Аускультативно выслушиваются разнокалиберные влажные хрипы по передней поверхности грудной клетки.
Сердечно-сосудистая система: границы относительной сердечной тупости расширены кнаружи на 1 см от левой средней ключичной линии. Тоны сердца аритмичные, приглушены. ЧСС - 100 в минуту. Пульс слабый, 62 в минуту. АД - 110/70 мм рт.ст.
Электрокардиография при поступлении
Ритм синусовый, желудочковая экстрасистолия. Подъем сегмента ST во II, III, aVF-отведениях на 2 мм. Снижение сегмента ST в V2-V4 до 1,5 мм. Признаки острого инфаркта миокарда с зубцом Q нижней стенки левого желудочка.
1.50. ПИТ. Рентгенография органов грудной клетки (ОГК) в задней проекции, лежа на спине (рис. 80).
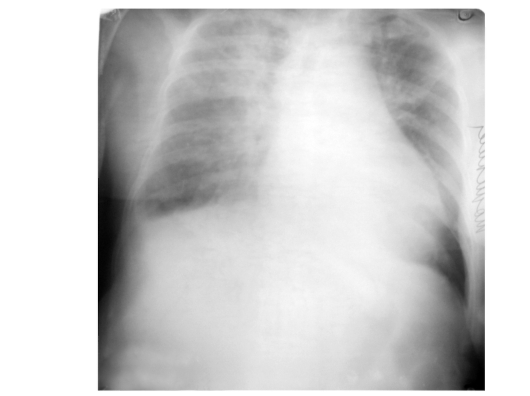
Рис. 80. Рентгенограмма легких, полученная в палате интенсивной терапии
Отмечается двустороннее симметричное затемнение в области корней легких. Корни легких расширены, мелкоструктурные, легочный рисунок усилен в прикорневой зоне. Сердце без особенностей. Синусы плевры прозрачные. Заключение: альвеолярный отек легких.
Общий анализ крови
Эритроциты 4,1х1012/л; гемоглобин-128 г/л; лейкоциты - 8,9х109/л; цветной показатель - 0,94; тромбоциты - 190х109/л; лейкоцитарная формула: базофилы - 0%; палочкоядерные - 2%; сегментоядерные - 76%; лимфоциты - 17%; моноциты - 5%; гематокрит - 0,39; СОЭ - 45 мм/ч.
Общий анализ мочи
Цвет соломенно-желтый, мутная; реакция - кислая; плотность - мало мочи; белок не обнаружен; сахар не обнаружен; слизь - много; лейкоциты - единичные в поле зрения; эритроциты - 1-2 в поле зрения; эпителий плоский - 1-2 в поле зрения; оксалаты - много.
Биохимическое исследование крови
Тропонин крови положительный; сахар крови - 9,0 ммоль/л; холестерин - 3,0 ммоль/л; β-липопротеиды - 34 ед.; креатинин - 168 мкмоль/л; мочевина - 12,0 ммоль/л; Na+ - 136 ммоль/л; K+ - 3,1 моль/л; Ca2+ - 0,6 ммоль/л; pH - 7,4; билирубин общий - 15,1 мкмоль/л; тимоловая проба - 2 ЕД; аланинаминотрансфераза (АЛТ) - 0,22 Мккат/л; (АСТ) - 0,39 Мккат/л; общий белок - 62 г/л.
Коагулограмма
Протромбиновое время - 14,1 с; время рекальцификации - 102 с; активированное частичное тромбопластиновое время (АЧТВ) - 23; фибриноген - 3,75 г/л; фибриназа - 54; этаноловый тест - 0; нафталовый тест - 0; международное нормализованное отношение (МНО) -
0,90.
Учитывая клиническую картину, ЭКГ, лабораторные показатели, больной проводилось тромболитическое лечение:
• Раствор стрептокиназы - 1 500 000 ЕД +;
• Раствор хлорида натрия 0,9% - 200,0 внутривенно капельно. 14.15 Палата интенсивной терапии
Во время инфузии возникли реперфузионные осложнения в виде частых желудочковых и суправентрикулярных экстрасистолий, коротких пароксизмов тахисистолии, фибрилляции предсердий.
Давайте немного прервем разбор данного клинического случая и вспомним возможные осложнения тромболитического лечения.
1. Реперфузионные аритмии - самое частое осложнение тромболитического лечения и одновременно косвенное свидетельство восстановления коронарного кровотока, отмечается у 20-60% больных. Чаще всего встречаются ускоренный идиовентрикулярный ритм, желудочковые экстрасистолы, пароксизмы неустойчивой желудочковой тахикардии, преходящая АВ-блокада, фибрилляция желудочков.
2. Феномен «оглушенного миокарда».
3. Реокклюзия коронарной артерии.
4. Кровотечения.
5. Артериальная гипотензия.
6. Аллергические реакции.
7. Геморрагический инсульт встречается при использовании стрептокиназы менее чем в 0,2% случаев.
Что наблюдалось у нашей пациентки?
У больной в конце введения стрептокиназы развилась острая левожелудочковая недостаточность, сопровождающаяся ангинозными болями, психомоторным возбуждением, фибрилляцией предсердий по монитору.
Объективно: состояние крайне тяжелое, в легких аускультативно дыхание клокочущее; ЧДД - 38-42 в минуту; тоны сердца аритмичные, глухие; ЧСС - 70-130 в минуту; АД - 100/60 мм рт.ст. Олигоанурия.
С целью купирования отека легких введено:
• Морфин 1% - 1,0 внутривенно струйно;
• Лазикс 60 мг внутривенно струйно;
• Преднизолон 60 мг внутривенно струйно;
• Преднизолон 60 мг + раствор NaCl 0,9% - 100,0 внутривенно капельно;
• Ацетилсалициловая кислота 0,25 разжевать;
• Изокет 0,1% - 20,0 + раствор NaCl 0,9% - 200,0 внутривенно капельно со скоростью 6 капель в минуту;
• ингаляции кислорода с парами спирта;
• Кордарон 450 мг + раствор NaCl 0,9% - 200,0 внутривенно капельно;
• Карвердиол 6,25 мг внутрь. 14.50 Палата интенсивной терапии
Состояние стабилизировалось, больная успокоилась, одышка уменьшилась. Кожные покровы бледные, нормальной влажности. В легких по передней поверхности хрипов нет, ЧДД - 22в минуту. Тоны сердца глухие, ритмичные. АД - 90/60 мм рт.ст. ЧСС - 80 в минуту.
Живот мягкий, безболезненный во всех отделах. Медикаментозный сон. Выполнено ЭхоКГ.
Эхокардиография
Левый желудочек: конечный диастолический размер (КДР) - 55 мм, конечный систолический размер (КСР) - 40 мм, МЖП 10,4 мм, задняя стенка левого желудочка (ЗСЛЖ) - 10,8 мм, сократимость левого желудочка нарушена - акинез, выбухание среднего сегмента задней перегородочной области, нижней стенки, истончение до 3 мм, аневризма 20x10 мм. Правый желудочек: размер полости 38 мм на уровне выносящего тракта. Левое предсердие: КСР 38 мм, апикально 41 x57 мм. Правое предсердие: КСР 43x53 мм. Митральный клапан: изменен, кальциноз створок, митральная регургитация 2 степени, площадь отверстия - 3,6 см2. Трансмитральный кровоток - 4,5 м/с. Аорта: d = 27 мм. Аортальный клапан: кальциноз створок. Аортальный кровоток 1,3 м/с, аортальная регургитация 3 степени. Трикуспидальный клапан: изменен, трикуспидальная регургитация 2 степени. Клапан легочной артерии: d = 22 мм, 3,5 м/с. Гемодинамические показатели: ФВ - 52,9%, масса левого желудочка 273,6 г, индекс массы 152,8 г/м2, ударный объем - 78,3 мл. Перикард: обнаружено расслоение по задней стенке левого желудочка 1 мм (вариант нормы).
Заключение: ультразвуковые признаки - аневризмы, истончение средних сегментов задней перегородочной области, задненижней стенки. Трикуспидальная регургитация 2 степени. Выраженная легочная гипертензия (расчетное давление на клапане легочной артерии - 65 мм рт.ст.). Кальциноз створки митрального клапана. Митральная регургитация 2 степени. Дилатация правого желудочка, пролапс обоих клапанов 1 степени. Стеноз митрального клапана 1 степени.
Немного информации о постинфарктной аневризме
1. Постинфарктная аневризма осложняет 10-35% трансмуральных инфарктов миокарда.
2. По данным патолого-анатомических исследований, частота выявления постинфарктной аневризмы составляет 8,5-34%.
3. У мужчин аневризмы сердца формируются в 5-7 раз чаще, чем у женщин.
4. В возрасте до 40 лет постинфарктную аневризму встречают у 13% людей, а среди лиц старше 60 лет - у 5,5%, что обусловлено большей частотой обширных трансмуральных инфарктов миокарда в относительно молодом возрасте.
5. Частота формирования постинфарктных аневризм имеет явную зависимость от стратегии ранней реваскуляризации в отдельных клиниках.
Этиология постинфарктной аневризмы
Острая постинфарктная аневризма (формируется во время острого трансмурального инфаркта миокарда) представлена некротической тканью.
Хроническая постинфарктная аневризма (формируется не менее 6-8 нед, если не было рецидива инфаркта миокарда) представлена рубцовой тканью.
Формированию аневризм способствуют артериальная гипертензия, применение глюкокортикоидов, несоблюдение пациентом режима в остром периоде инфаркта миокарда.
Классификация постинфарктных аневризм
Истинные аневризмы:
1) диффузная;
2) мешковидная (с узким основанием);
3) расслаивающая.
Ложные аневризмы - формирующиеся при разрыве стенки миокарда и ограниченные перикардиальными сращениями.
Функциональные аневризмы - зоны жизнеспособного (так называемого гибернирующего) миокарда, утратившего сократительную способность и выбухающего при систоле желудочков. На рисунке 81 представлены аневризмы левого желудочка.
Патогенез
1. Нарушения сократительной способности в области аневризмы представлены акинезией (отсутствием сократительной активности) и дискинезией (выбуханием стенки желудочка в систолу и ее западением в диастолу).
2. Нарушения гемодинамики обусловлены следующими механизмами:
- снижением систолической функции (при выключении из сокращения более 20-22% площади левого желудочка);
- нарушением диастолической функции (нарушение взаимоотношения «давление - объем» ведет к непропорциональному увеличению конечного диастолического давления;
- митральной регургитацией (в связи с дилатацией фиброзного кольца или повреждением папиллярных мышц);
- тромбозом полости желудочка (наблюдают в 40% случаев).
Рис. 81. Аневризмы левого желудочка
3. Компенсаторные механизмы в виде гипертрофии миокарда, изменения конфигурации полости левого желудочка и его дилатация (ремоделирование) приводят к прогрессированию сердечной недостаточности.
4. У 2-5% пациентов развиваются тромбоэмболии, у большинства больных - те или иные желудочковые нарушения ритма.
Рекомендуемая инструментальная диагностика постинфарктной аневризмы
• Электрокардиография.
• Эхокардиография.
1. Визуализация полости аневризмы, измерение ее размера, оценка конфигурации аневризмы и диагностика тромбоза полости левого желудочка.
2. Вычисление индекса нарушений локальной сократимости.
3. Стресс-тест для выявления жизнеспособного миокарда в зоне аневризмы.
4. Дифференцировка истинных и ложных аневризм (высокоспецифичный метод).
5. Выявление и функциональная оценка митральной регургитации.
• Рентгенография органов грудной клетки.
• Радиоизотопная вентрикулография.
• Магнитно-резонансная томография позволяет получать ту же информацию, что и рентгеноконтрастная вентрикулография.
• Перфузионная сцинтиграфия или однофотонная эмиссионная компьютерная томография миокарда.
• Рентгеноконтрастная левая вентрикулография.
• Катетеризация левого предсердия и левого желудочка.
• Коронарная ангиография.
• Электрофизиологическое исследование.
Рис. 82. Острая аневризма сердца с тромбом
Стенка аневризмы представлена некротизированным миокардом (рис. 82).
Стенка представлена некротизированной тканью (рис. 83 - показано стрелками). Полость аневризмы выполнена слоистым тромбом.
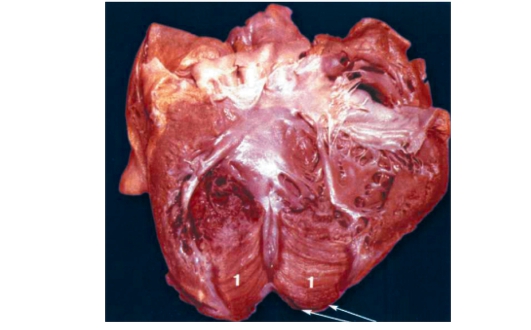
Рис. 83. Хроническая аневризма сердца: 1 - стенки хронической аневризмы сердца
Мы немного отвлеклись на обсуждение теоретических вопросов. Вернемся к нашему клиническому случаю.
18.00 Палата интенсивной терапии. Состояние больной:
• АД 90/60 мм рт.ст., ЧСС - 82 в минуту.
• Сахар крови 13,2 ммоль/л.
• Инсулин 4 Ед подкожно.
• Отключено внутривенное введение изосорбида динитрата (изокет).
• Раствор хлорида калия 4% - 10,0 ml + Sol. NaCl 0,9% - 200,0 внутривенно капельно.
• Цефотаксим 1,0 внутривенно струйно 1 раз в сутки. 18.35 Палата интенсивной терапии. Электрокардиография Электрокардиограмма пациентки представлена на рис. 84.
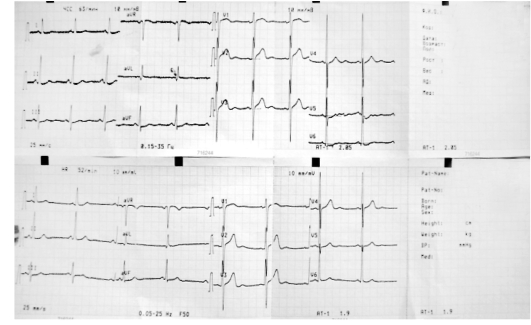
Рис. 84. Электрокардиограмма больной
Ритм синусовый, 98 в минуту. Горизонтальная электрическая ось сердца (ЭОС). Умеренная синусовая тахикардия. Острый инфаркт миокарда нижней стенки левого желудочка. Острый период. Ишемия боковой стенки левого желудочка. Гипертрофия левого желудочка (ГЛЖ). Предсердная и желудочковая экстрасистолия.
22.00 Палата интенсивной терапии
• АЧТВ - 43 с.
• Начата инфузия Раствор гепарина 500 Ед/ч.
• Возобновлена инфузия изосорбида динитрата.
28.11.2007 0.2.00 Палата интенсивной терапии
• Состояние стабильное, тяжелое.
• Продолжается введение изосорбида динитрата, гепарина. 0.5.45 Палата интенсивной терапии
На фоне относительно стабильного состояния больная внезапно вскрикнула, захрипела. Состояние крайне тяжелое. По монитору ЭКГ ЧСС в течение 3-5 с упало до 0. АД - 0 мм рт.ст., ЧСС - 0, пульс -
0, ЧДД - 0.
Объективный статус
Кожные покровы бледные, акроцианоз. Кома. Рефлексы отсутствуют. Аускультативно дыхание спорадическое. По монитору ЭКГ - асистолия. Cito! Раствор адреналина 0,1% - 1,0 внутривенно струйно. Электрический разряд дефибриллятором 90 кДж. Начат комплекс основных сердечно-легочных реанимационных мероприятий.
05.50 Палата интенсивной терапии
Проводимые мероприятия без эффекта. Раствор адреналина 0,1% - 1,0 внутривенно струйно. Электрический разряд дефибриллятором 130 кДж. Искусственная вентиляция легких мешком Амбу, непрямой массаж сердца. Проводимые мероприятия без эффекта.
• Атропин 0,1% - 1,0 внутривенно струйно.
• Адреналин 0,1% - 1,0 внутривенно струйно.
Электрический разряд дефибриллятором 180 кДж. Проводимые мероприятия без эффекта. На ЭКГ-мониторе стойкая асистолия, слабоотвечающая на проведение непрямого массажа сердца. Через 40 мин (06.30) проведения реанимационных мероприятий, оказавшихся неэффективными, зарегистрирована биологическая смерть.
У больной произошли разрыв и тампонада миокарда.
Разрыв свободной стенки левого желудочка
Частота возникновения - 0,8-10%. Фибринолитическое лечение не снижает риск развития. Время возникновения: в течение первых 14 дней после развития инфаркта миокарда. Наибольшая частота осложнений наблюдается в течение первых 24 ч и на 3-5 день от начала инфаркта миокарда.
Диагноз заключительный
Основной: острый инфаркт миокарда с зубцом Q нижней стенки левого желудочка, рецидивирующее течение, от 23.11.2007 (по анамнезу), рецидив от 27.11.2007.
Осложнение основного: реперфузионные осложнения тромболитического лечения от 27.11.2007. Предсердная и желудочковая политопная экстрасистолия. Пароксизмальная форма фибрилляции предсердий. Острая аневризма левого желудочка. ХСН IIА. ФК IV. Сердечная астма. Отек легких от 27.11.2007. Двусторонний гидроторакс. Разрыв миокарда. Гемоперикард.
Сопутствующий: сахарный диабет, тип 2, средней степени тяжести, субкомпенсация.
Патолого-анатомический диагноз
Основной: острый трансмуральный инфаркт миокарда, распространенный в задней стенке левого желудочка до 3-дневной давности. Стенозирующий атеросклероз левой нисходящей артерии до 75%.
Осложнение основного: разрыв, внутренний, задней стенки левого желудочка. Острая аневризма с последующим разрывом миоэпикарда. Гемоперикардиум 500 мл. Тампонада сердечной сорочки. Острая сердечно-сосудистая недостаточность. Гидроторакс - 900 мл жидкости в плевральных полостях. Коллапс нижних долей легких. Неравномерное кровенаполнение легких, печени, почек. Отек легких (альвеолярный).
Сопутствующий: первично-множественная злокачественная карциноидная опухоль желудка антрально-пилорического отдела. Сахарный диабет 2-го типа (клинически).
После того как мы с вами шаг за шагом разобрали этот клинический случай, все стало очевидным и понятным. Врачами было сделано все правильно и все возможное для спасения жизни данной больной. Но тем и отличается реальная клиническая практика от чтения книг по специальности, что всегда все неоднозначно. Всегда остаются вопросы. Вот попробуйте самостоятельно найти ответ на вопрос: «Можно ли рассматривать развитие в данном клиническом случае аневризмы как исход реперфузионных осложнений?» Будем считать ваш ответ на этот вопрос как самостоятельную работу после изучения темы этой главы.