Клиническая фармакология и фармакотерапия в реальной врачебной практике : мастер-класс : учебник / В. И. Петров. - 2011. - 880 с. : ил.
|
|
|
|
Глава 3. КЛИНИКО-ФАРМАКОЛОГИЧЕСКИЕ ПОДХОДЫ К ВЫБОРУ И ПРИМЕНЕНИЮ АНТИАРИТМИЧЕСКИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Основной механизм действия антиаритмических препаратов (ААП) определяется их способностью связываться с ионными каналами или рецепторами клеток миокарда, модулировать трансмембранный ионный транспорт и электрофизиологические процессы в миокарде.
ААП обладают способностью влиять на электрофизиологические механизмы развития аритмий или на условия, необходимые для возникновения аритмий.
Аритмии, обусловленные патологическим автоматизмом, чаще всего представляют собой аритмии острых состояний и развиваются в условиях:
- высокого симпатического тонуса;
- ишемии миокарда;
- электролитного дисбаланса;
- нарушения кислотно-щелочного равновесия. Эффективность ААП при автоматических аритмиях, как правило,
невысокая.
Основная задача при лечении автоматических аритмий - адекватное устранение факторов, индуцирующих их развитие. ААП способны влиять на электрофизиологические механизмы, лежащие в основе развития патологического автоматизма:
1) β -адреноблокаторы и блокаторы медленных кальциевых каналов снижают скорость спонтанной диастолической деполяризации;
2) блокаторы натриевых каналов повышают уровень порогового потенциала;
3) блокаторы калиевых каналов увеличивают продолжительность потенциала действия (ППД).
Все вышеуказанные изменения электрофизиологических свойств пейсмекерных клеток в очагах патологического автоматизма снижают частоту или блокируют образование импульсов.
Для успешной терапии аритмий, возникающих по механизму повторного входа (re-entry) и циркуляции импульсов, необходимо изменить электрофизиологические характеристики отдельных компонентов петли, по которой циркулирует импульс.
Блокаторы натриевых каналов, блокаторы калиевых каналов, β-адреноблокаторы и блокаторы медленных кальциевых каналов (БМКК) изменяют скорость проведения импульса и рефрактерность отдельных участков петли циркуляции таким образом, что повторный вход и (или) движение возбуждения по петле циркуляции становится невозможным.
Основной момент в лечении триггерных аритмий - это устранение факторов, приводящих к возникновению следовых деполяризаций. К этим факторам относятся:
- препараты, способные удлинять Q-T-интервал (в том числе ААП, сердечные гликозиды);
- ситуации, приводящие к выраженной активации симпатоадреналовой системы - интенсивные физические или психоэмоциональные нагрузки.
Основные НЛР, которые необходимо учитывать при использовании ААП, включают:
- развитие аритмий;
- депрессию функции синусового и атриовентрикулярного узлов;
- замедление внутрижелудочкового проведения;
- отрицательный инотропный эффект;
- системные токсические эффекты.
Основные ААП для лечения триггерных аритмий - β-адреноблокаторы и БМКК.
β-Адреноблокаторы способны устранять следовые деполяризации, индуцированные катехоламинами.
Фаза потенциала действия кардиомицита приведены на рис. 94.
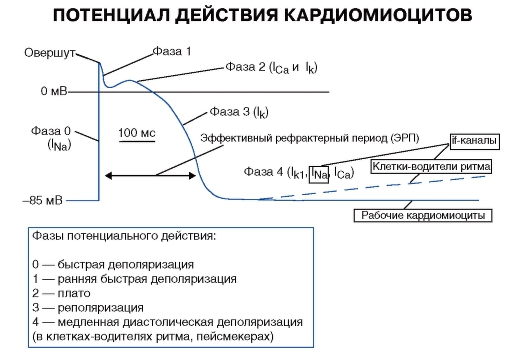
Рис. 94. Потенциал действия кардиомиоцитов
КЛАССИФИКАЦИЯ АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ
Классификация антиаритмиков приведена в табл. 53. Таблица 53. Классификация антиаритмических препаратов по Vaughan Williams

Окончание табл. 53

Для четкого представления механизма антиаритмического действия антиаритмических препаратов я рекомендую пользоваться следующей простой схемой, на которой представлены все изменения потенциала действия, вызываемые этими препаратами (рис. 95-97).
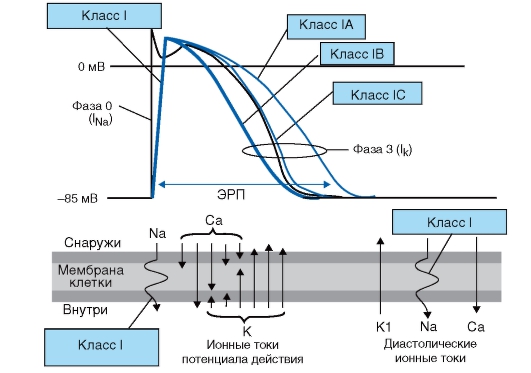
Рис. 95. Механизм действия антиаритмических препаратов класса I
АНТИАРИТМИЧЕСКИЕ ПРЕПАРАТЫ I КЛАССА (БЛОКАТОРЫ НАТРИЕВЫХ КАНАЛОВ)
Общие свойства ААП I класса - это:
1) блокада натриевых каналов;
2) снижение скорости натриевого тока;
3) уменьшение максимальной скорости деполяризации;
4) увеличение порога возбудимости;
5) снижение скорости распространения возбуждения в миокарде.
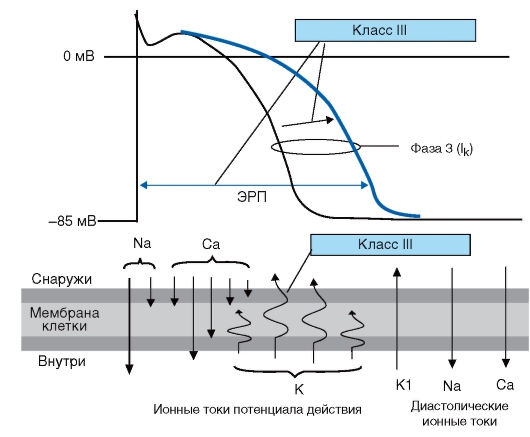
Рис. 96. Механизм действия антиаритмических препаратов классов II, III
По влиянию на кинетику взаимодействия с натриевыми каналами и на процесс реполяризации ААП I класса подразделяются на три подкласса:
- ААП IA класса блокируют натриевые каналы, увеличивают ППД и эффективного рефрактерного периода (ЭРП) клеток проводящей системы, миокарда предсердий и желудочков;
- ААП IB класса характеризуются «быстрой» кинетикой взаимодействия с натриевыми каналами и укорачивают ППД и ЭРП в основном в миокарде желудочков;
- ААП IC класса характеризуются «медленной» кинетикой взаимодействия с натриевыми каналами и практически не влияют
на ППД и ЭРП.
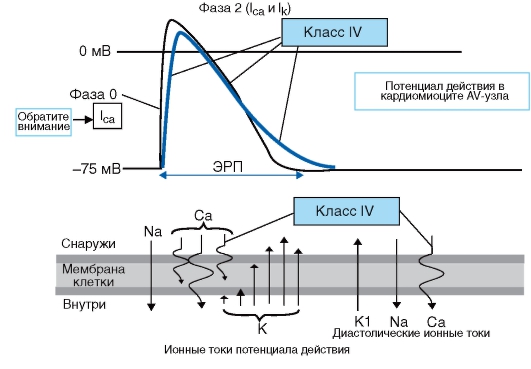
Рис. 97. Механизм действия антиаритмических препаратов класса IV
Хинидин
Хинидин обладает всеми электрофизиологическими свойствами ААП IA класса.
Другие фармакологические эффекты хинидина:
1) блокада α-адренорецепторов;
2) блокада холинергических рецепторов;
3) отрицательный инотропный эффект.
Фармакокинетика
Абсорбция хинидина составляет 80-90%. Время наступления максимальной концентрации препарата в плазме (Тmах) достигается в преде-
лах 3-4 ч. Терапевтическая концентрация в крови 3-6 мкг/мл, токсические эффекты развиваются при концентрациях выше 8 мкг/мл. Связь с белками плазмы крови - 70-90%, имеет большой объем распределения. Проницаемость через гематоэнцефалический (ГЭБ) и плацентарный барьер низкая. Период полувыведения (Т1/2) препарата составляет 5-8 ч. Выводится почками, 10-50% в неизменном виде.
Применение
• Восстановление синусового ритма у пациентов с мерцательной аритмией (уровень рекомендаций (УР) IIB/С).
• Поддержание синусового ритма при рецидивирующей мерцательной аритмии у пациентов без органических заболеваний сердца.
• У пациентов с АГ и ИБС.
Хинидин рассматривается как препарат второй линии, применяющийся при неэффективности других, более активных и безопасных препаратов. Для купирования пароксизма мерцательной аритмии используется нагрузочная доза 0,2-0,4 г, с последующим приемом 0,2 г каждый час до достижения суммарной дозы 1 г. Для длительного лечения используются пролонгированные формы - 0,3-0,6 г через 8-12 ч.
Противопоказания к применению
1. Гиперчувствительность.
2. АВ-блокада II-III степени.
3. Гликозидная интоксикация.
4. Нарушения внутрижелудочковой проводимости.
Особую осторожность следует соблюдать, применяя хинидин при следующих состояниях:
- бронхиальной астме;
- нарушении функции печени или почек;
- гипертиреозе;
- гипокалиемии;
- миастении;
- псориазе;
- тромбоцитопении.
НЛР хинидина регистрируются у 30-50% пациентов и включают:
- желудочковые тахиаритмии;
- системные токсические эффекты:
- желудочно-кишечные расстройства;
- симптомы неврологических нарушений;
- реакции гиперчувствительности в виде гемолитический анемии и тромбоцитопении.
К относительно редким НЛР относится развитие волчаночного синдрома и гепатита.
Методы контроля безопасности
• Определение АД.
• Мониторирование ЭКГ.
• Анализы крови.
• Определение функций печени и почек.
• Определение сывороточной концентрации К+.
• Определение концентрации хинидина в сыворотке крови.
Взаимодействия
• Хинидин увеличивает эффект непрямых антикоагулянтов, миорелаксантов, сердечных гликозидов.
• Риск аритмогенных эффектов хинидина увеличивается при применении с трициклическими антидепрессантами, галоперидолом и эритромицином.
• Антациды и противодиарейные препараты замедляют абсорбцию и выведение хинидина.
• Ингибиторы печеночного метаболизма удлиняют, а стимуляторы печеночного метаболизма укорачивают Т1/2 хинидина.
• Исследований по применению хинидина при беременности у человека не проводилось.
• Близкий по структуре хинин вызывал врожденные пороки развития ЦНС и конечностей, оказывал ототоксическое действие.
• Хинидин проникает в грудное молоко, однако связанных с этим осложнений не зарегистрировано.
• Специальных исследований по применению хинидина у детей не проводилось, не рекомендуется использование пролонгированных форм.
• У пожилых пациентов исследований не проводилось. Специфических проблем, связанных с применением хинидина, не предполагается.
• Вероятные возрастные изменения функций печени и почек могут потребовать коррекции дозы хинидина.
Прокаинамид
Прокаинамид обладает свойствами ААП IA класса. Другие фармакологические эффекты прокаинамида:
1) ганглиоблокирующая активность;
2) умеренная блокада холинорецепторов;
3) умеренный отрицательный инотропный эффект.
Фармакокинетика
При внутривенном введении прокаинамид начинает действовать почти немедленно. При приеме внутрь абсорбция составляет 70-90%. Связь с белками плазмы низкая (10-20%). Проникает через ГЭБ и плацентарный барьер. Тmах - 1-2 ч. Терапевтическая концентрация - 4-10 мг/л. Т1/2 - 2,5-4,5 ч, при нарушении функций почек - 11-20 ч. Прокаинамид подвергается печеночной трансформации с образованием N-ацетилпрокаинамида (до 25%) - активного метаболита со свойствами ААП III класса. Прокаинамид выводится почками (до 50-60% в неизменном виде).
Применение
Существующие рекомендации поддерживают использование прокаинамида только для купирования пароксизмальных аритмий. Применение прокаинамида (внутривенно) показано для:
1) лечения резистентной к электроимпульсной терапии желудочковой тахикардии или фибрилляции желудочков (УР ПВ/С);
2) купирования устойчивой желудочковой тахикардии без существенных гемодинамических нарушений (УР IIB/С);
3) лечения непрерывно рецидивирующей желудочковой тахикардии в комбинации с β-адреноблокаторами (УР I/C) у пациентов с острым коронарным синдромом или инфарктом миокарда;
4) для купирования мономорфной устойчивой или рецидивирующей желудочковой тахикардии (УР IIA/С);
5) высокоэффективен (УР I/B) для купирования ширококомплексной тахиаритмии неизвестного генеза [либо желудочковой тахикардии, либо суправентрикулярной тахикардии с участием дополнительных путей проведения (ДПП)];
6) может применяться для купирования пароксизмов мерцательной аритмии (УР IIB/С).
Прокаинамид вводят внутривенно со скоростью не более 50 мг/мин до купирования пароксизма аритмии или достижения суммарной дозы
1000 мг.
Противопоказания
• Гиперчувствительность.
• АВ-блокада степени).
Особую осторожность надо соблюдать, применяя прокаинамид при следующих состояниях:
- при блокаде ножек пучка Гиса;
- передозировке сердечных гликозидов;
- бронхиальной астме;
- хронической сердечной недостаточности;
- нарушении функций печени или почек;
- системной красной волчанке в анамнезе;
- миастении.
Нежелательные лекарственные реакции
1. Желудочковые аритмии (ЖА), фибрилляции желудочков или асистолия при быстром внутривенном введении или передозировке.
2. Токсическое влияние на кроветворение (агранулоцитоз, нейтропения, тромбоцитопения, апластическая анемия).
3. Гипотония (особенно при быстром внутривенном введении).
4. Аллергические реакции.
5. Волчаночноподобный синдром.
6. Токсическое действие на ЦНС (спутанность сознания, галлюцинации, депрессия).
Методы контроля безопасности
• Мониторирование АД и ритма сердца, включая анализ ЭКГ.
• Определение сывороточной концентрации прокаинамида и N-аце- тилпрокаинамида.
• Определение титров антиядерных антител.
• Общий анализ крови.
Применение прокаинамида
• Увеличивает риск развития аритмий в комбинации с другими ААП.
• Усиливает действие гипотензивных, антигистаминных, холиноблокирующих и цитостатических средств, миорелаксантов.
• Снижает активность антимиастенических средств. Прокаинамид проникает через плацентарный барьер. Несмотря
на выявление прокаинамида и метаболитов в сыворотке крови плода, какого-либо неблагоприятного действия на плод и новорожденного не отмечено.
Существует потенциальный риск развития гипотензии у матери и маточно-плацентарной недостаточности.
В педиатрической практике каких-либо специфических проблем, ограничивающих применение прокаинамида, не обнаружено. Для достижения терапевтического эффекта могут требоваться более высокие дозы, чем у взрослых.
У пожилых пациентов в большей степени возможно развитие гипотензии. Вероятные возрастные изменения функций почек могут потребовать применения более низких доз прокаинамида.
Дизопирамид
Дизопирамид® обладает электрофизиологическими свойствами ААП IA класса.
Другие фармакологические эффекты дизопирамида:
1. Блокада холинорецепторов.
2. Отрицательный инотропный эффект.
Фармакокинетика
Всасывание быстрое и почти полное (95%). Связывание с белками умеренное (50%), зависит от концентрации препарата и может колебаться от 35 до 95%. Проницаемость через ГЭБ и плацентарный барьер низкая. Тmах - 0,5-3 ч. Терапевтическая концентрация в сыворотке крови - 2-4 мкг/мл. Биотрансформация в печени, метаболиты обладают антиаритмической и антихолинергической активностью. Т1/2 - 4-10 ч. Выведение преимущественно почками (около 50% в неизменном виде и 30% - в виде метаболитов), с желчью - около 15%.
Применение
Существующие рекомендации поддерживают применение дизопирамида лишь для лечения рецидивирующей фокальной предсердной тахикардии и только в комбинации с препаратами, замедляющими АВ-проводимость (УР ПА/В).
Дизопирамид® используется в нагрузочной дозе 300 мг, с последующим приемом 100-200 мг 4 раза в сутки.
Противопоказание к применению дизопирамида: АВ-блокада II-III степени.
Осторожность необходимо соблюдать при следующих состояниях:
1) при кардиомиопатии;
2) хронической сердечной недостаточности;
3) сахарном диабете;
4) закрытоугольной глаукоме;
5) нарушении функций печени или почек;
6) гиперили гипокалиемии;
7) миастении;
8) гипертрофии предстательной железы.
Нежелательные лекарственные реакции
• Желудочковые тахиаритмии.
• Антихолинергические эффекты: сухость во рту, запор, задержка мочи, ухудшение течения глаукомы.
• Развитие или прогрессирование симптомов сердечной недостаточности.
• Гипотензия.
• Мышечная слабость.
• Агранулоцитоз.
• Обострение глаукомы.
• Холестаз.
• Гипогликемия.
• Депрессия.
Методы контроля безопасности
1. Контроль АД.
2. Мониторирование ЭКГ (уширение QRS, удлинение Q-T).
3. Определение функций печени и почек, уровня К+, внутриглазного давления.
Взаимодействия
• С алкоголем (развитие гипотензии и гипогликемии).
• С другими ААП (повышение риска развития аритмий), с β-адреноблокаторами (усиление симптомов ХСН).
• С антикоагулянтами (усиление действия).
• С пероральными противодиабетическими средствами и инсулином, с индукторами ферментов печени (снижение концентрации).
Дизопирамид® обнаруживается в крови плода, но без каких-либо клинических последствий. Он проникает в грудное молоко, но в достаточно низких концентрациях. Каких-либо специфических проблем, связанных с применением дизопирамида® в педиатрии, не выявлено.
У пожилых пациентов может проявляться повышенная чувствительность к антихолинергическим эффектам дизопирамида®. Возрастные изменения функций почек могут потребовать коррекции дозы дизопирамида®.
Лидокаин
Фармакокинетика
Связывание с белками плазмы варьирует от умеренного до высокого (60-80%) и зависит от концентрации препарата. Терапевтическая концентрация в плазме - 1,5-5 мкг/мл. Проникает через ГЭБ, плацентарный барьер и в грудное молоко. Лидокаин в основном подвер-
гается печеночной трансформации (до 90%), в основном с участием микросомальных ферментов. Т1/2 после болюсного введения - 1,5-2 ч, при длительной инфузии Т1/2 возрастает до 3 ч. На период полувыведения также влияет концентрация белков плазмы, особенно белков острой фазы. Лидокаин выводится почками (до 10% в неизменном виде) и с желчью. При ХСН возможна кумуляция метаболитов.
Применение
Существующие рекомендации поддерживают применение лидокаина для купирования:
- желудочковых аритмий - мономорфной и полиморфной, ассоциированных с острым инфарктом миокарда (ОИМ) или ОКС (УР IIB/С);
- устойчивой и рецидивирующей мономорфной желудочковой тахикардии и желудочковой тахикардии типа пируэт (уровень рекомендаций IIB/С);
- ширококомплексной тахикардии неуточненного генеза (УР IIB/C).
Лидокаин применяют внутривенно в виде болюса 1 мг/кг (50- 120 мг) со скоростью 25-50 мг/мин, при необходимости введение дозы повторяют через 5 мин.
При заболеваниях печени и ХСН дозу снижают на 30-40%.
Противопоказание к применению лидокаина: выраженная АВ- и внутрижелудочковая блокада.
С осторожностью лидокаин необходимо применять при следующих состояниях:
1) при хронической сердечной недостаточности;
2) нарушении функций печени;
3) нарушении функций почек;
4) гиповолемии или шоке;
5) синусовой брадикардии;
6) синдроме WPW;
7) повышенной чувствительности к лидокаину.
Нежелательные лекарственные реакции
• Гипотония.
• Брадикардия.
• Риск развития асистолии.
• Остановка дыхания при передозировке.
• Симптомы нейротоксичности.
• Аллергические реакции.
Методы контроля безопасности
• Мониторирование АД и ЭКГ.
• Определение сывороточной концентрации К+.
• Определение концентрации лидокаина в сыворотке.
Взаимодействия
• С β-адреноблокаторами - риск развития брадикардии.
• При применении с другими ААП - негативное влияние на проводимость и сократимость.
• При совместном применении с барбитуратами внутривенно возрастает риск остановки дыхания.
• Индукторы микросомальных ферментов печени могут уменьшать Т1/2 лидокаина.
Мексилетин
Фармакокинетика
Мексилетин® хорошо всасывается из верхних отделов ЖКТ (до 90%). Связывание с белками плазмы крови умеренное (60-75%). Проникает через плацентарный барьер и в грудное молоко. Биотрансформация преимущественно в печени (до 85%) с участием ферментной системы CYP1A2 с образованием неактивных метаболитов. Начало действия - через 0,5-2 ч, Ттах - 2-3 ч. Терапевтическая концентрация - 0,5- 2,0 мкг/кг. Т1/2 - 10-12 ч, может увеличиваться до 25 ч при заболеваниях печени и почек, снижении минутного объема крови. Выводится с желчью и почками (до 10% в неизменном виде).
Применение
Существующие рекомендации поддерживают применение мексилетина® для лечения желудочковой тахикардии типа пируэт у пациентов с синдромом удлиненного QT (УР IIB/С).
Дозирование мексилетина: пероральная нагрузочная доза 400 мг с последующим назначением 200 мг через 8 ч.
Мексилетин® противопоказан при АВ-блокадах высокой степени и кардиогенном шоке.
Применение мексилетина требует осторожности при следующих состояниях.
1. Хроническая сердечная недостаточность.
2. Нарушения функций печени.
3. Гипотензия.
4. Синдром слабости синусового узла (СССУ).
5. Эпилепсия.
6. Повышенная чувствительность к мексилетину®.
Нежелательные лекарственные реакции
• Боль в грудной клетке.
• Одышка.
• Лейкопения.
• Агранулоцитоз.
• Тромбоцитопения.
• Судороги.
• Симптомы нейротоксичности.
• Нарушения со стороны ЖКТ - нарушения вкуса, тошнота, запор или диарея.
Методы контроля безопасности
1. Мониторирование ЭКГ.
2. Определение активности печеночных ферментов.
3. Определение концентрации препарата в крови.
Взаимодействия
• Хинидин, β-адреноблокаторы и амиодарон усиливают антиаритмический эффект мексилетина®.
• Индукторы печеночного метаболизма могут снижать концентрацию мексилетина® в плазме крови.
• Стимуляторы моторики ЖКТ, наркотические анальгетики, блокаторы Н2-гистаминовых рецепторов снижают всасывание мексилетина®.
• Метоклопрамид усиливает всасывание мексилетина®.
• Натрия гидрокарбонат и диуретики, ощелачивающие мочу, снижают выведение мексилетина®.
Пропафенон
Пропафенон обладает электрофизиологическими эффектами ААП IC класса.
Другие фармакологические эффекты:
1) умеренная блокада β-адренорецепторов, а также медленных кальциевых каналов;
2) отрицательный инотропный эффект.
Фармакокинетика
Пропафенон быстро и хорошо всасывается в ЖКТ (до 90%). Эффект первичного прохождения через печень определяет системную биодоступность - 5-50%. Системную биодоступность увеличивают прием пищи и повышение дозы препарата. Связывание с белками очень высокая (до 97%). Проницаемость через ГЭБ и плацентарный барьер низкая. Ттах = 1-3,5 ч. Концентрация в плазме крови - 500-1500 мкг/л. Метаболизируется преимущественно в печени.
Применение
• Купирование гемодинамически стабильной фокальной предсердной тахикардии (УР IIA/С).
• Профилактика рецидивов фокальной предсердной тахикардии (УР IIA/С).
• Купирование гемодинамически нестабильной атриовентрикулярной реципрокной тахикардии (УР IIA/С).
• Длительное лечение атриовентрикулярной реципрокной тахикардии (АВРТ), резистентной к β-адреноблокаторам и верапамилу, и при невозможности выполнения аблации (УР IIA/В).
• Лечение АВРТ у пациентов с ДПП (УР IIA/С).
• Лечение фокальной тахикардии АВ-соединения (УР ПА/С).
Применение пропафенона рекомендуется для купирования пароксизма мерцательной аритмии давностью до 7 дней (УР I/A) и в качестве препарата выбора для поддержания синусового ритма у пациентов с «идиопатической» мерцательной аритмией или у пациентов с АГ без выраженной гипертрофии левого желудочка.
Для купирования аритмий нагрузочная доза 600 мг внутрь или 1,5- 3,0 мг/кг внутривенно в течение 10-20 мин.
При длительном приеме стартовая доза 150 мг через 8 ч (450 мг/сут) с постепенным увеличением дозы до 300 мг через 8 ч (900 мг/сут).
Противопоказания
АВ-блокада высокой степени или «двухпучковые» внутрижелудочковые блокады у пациентов без ЭКС.
Применение пропафенона требует осторожности:
1) при бронхообструктивных заболеваниях;
2) синусовой брадикардии и СССУ;
3) хронической сердечной недостаточности;
4) нарушении функций печени;
5) гипоили гиперкалиемии;
6) гипотензии;
7) нарушении функций почек;
8) повышенной чувствительности к пропафенону.
Нежелательные лекарственные реакции
• Аритмогенные эффекты.
• Развитие АВ-блокады.
• Прогрессирование ХСН.
• Гипотония.
• Агранулоцитоз.
• Тромбоцитопения.
• Появление антинуклеарных антител.
• Симптомы нейротоксичности (головокружение, атаксия).
• Аллергические реакции.
• Артралгии.
• Бронхоспазм.
Взаимодействия
• С дигоксином - повышение концентрации дигоксина в плазме крови.
• С варфарином - повышение плазменной концентрации варфарина.
• С β-адреноблокаторами - усиление антиаритмического эффекта, а также повышение концентрации пропранолола и метопролола.
АНТИАРИТМИЧЕСКИЕ ПРЕПАРАТЫ II КЛАССА
β-АДРЕНОБЛОКАТОРЫ
ААП II класса (β-адреноблокаторы) обладают способностью блокировать воздействие катехоламинов на скорость спонтанной диастолической деполяризации клеток-водителей ритма синусового узла, что приводит к снижению частоты сердечных сокращений. β-Адреноблокаторы замедляют проведение импульса и увеличивают рефрактерный период атриовентрикулярного узла. β-Адреноблокаторы подавляют патологический автоматизм и следовые деполяризации. Эффективность β-адреноблокаторов при желудочковых аритмиях обусловлена их способностью устранять и предотвращать ишемию - существенный фактор индукции желудочковых аритмий. β-Адреноблокаторы активно изменяют базовые патологические процессы, лежащие в основе
структурно-функционального ремоделирования миокарда. Некоторые β-адреноблокаторы (карведилол) обладают антиоксидантными свойствами. β-Адреноблокаторы блокируют апоптоз кардиомиоцитов, опосредованный катехоламинами. Таким образом, они способны модифицировать процессы, влияющие на формирование кругов re-entry в ткани желудочков, а также блокировать механизмы, которые могут приводить к их активации. В отличие от ААП других классов, β-адреноблокаторы не обладают аритмогенным эффектом. β-Адреноблокаторы также обладают антиангинальной и гипотензивной активностью. Эффективность и безопасность делает их препаратами выбора при различных типах аритмий, как при суправентрикулярных (СВА), так и при желудочковых.
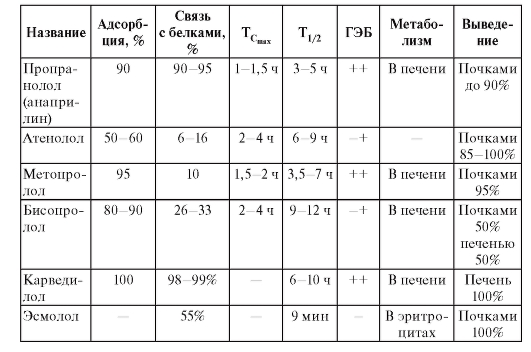
Особенности фармакокинетики
Основные фармакокинетические показатели антиаритмических препаратов приведены в табл. 54.
Таблица 54. Фармакокинетические показатели антиаритмиков
Применение
1. Симптоматическая синусовая тахикардия на фоне психоэмоцио нального стресса, тревожности или панических атак, а также при тирео токсикозе (УР I/C).
2. Пароксизмальная синоатриальная реципрокная тахикардия (УР
I/C).
3. Фокальная предсердная тахикардия (УР I-IIA/C).
4. Атриовентрикулярная реципрокная тахикардия (УР IIA/С).
5. Реципрокная аритмия у пациентов с ДПП (при отсутствии аномально быстрых путей) (УР IIA/С).
6. Фокальная тахикардия АВ-соединения (УР ПА/С).
7. Контроль ЧСС у пациентов с постоянной формой мерцательной аритмии (УР I/C).
8. Профилактическое применение при наличии желудочковой экстрасистолии (ЖЭ) и неустойчивой желудочковой тахикардии у пациентов с ОКС или ОИМ (УР I/A).
9. Лечение желудочковых тахикардий, не связанных с ОКС, - рецидивирующей мономорфной желудочковой тахикардии (УР IIA/С), полиморфной желудочковой тахикардии (УР I/B).
10. Желудочковая тахикардия типа пируэт (совместно с ЭКС) (УР
I/B).
11. Непрерывно рецидивирующая желудочковая тахикардия (УР IIB/С).
12. β-Адреноблокаторы (метопролол, бисопролол, карведилол) рекомендуются пациентам, перенесшим инфаркт миокарда, для первичной профилактики ВСС (УР I/A).
13. Применение β-адреноблокаторов также рекомендуется пациентам, перенесшим инфаркт миокарда, у которых были эпизоды фибрилляции желудочков, устойчивой желудочковой тахикардии с выраженными нарушениями гемодинамики или эпизоды устойчивой желудочковой тахикардии без значимых гемодинамических нарушений (УР ПА/С).
14. Профилактика ВСС у пациентов с ДКМП, особенно при наличии факторов риска - перенесенной фибрилляции желудочков или эпизода устойчивой желудочковой тахикардии (УР I/B).
15. У пациентов с синдромом врожденного удлинения Q-T для профилактики желудочковых аритмий как при бессимптомном течении заболевания (УР IIA/С).
16. У пациентов, перенесших эпизод тахикардии типа пируэт (УР
I-IIA/C).
17. Первичная (УР I/C) и вторичная (УР IIA/С) профилактика.
18. У пациентов с катехолзависимой полиморфной желудочковой тахикардией.
19. Лечение желудочковых аритмий у пациентов без органического поражения миокарда (идиопатическая левожелудочковая тахикардия
или желудочковая тахикардия из выносящего тракта правого желудочка) (УР IIA/С).
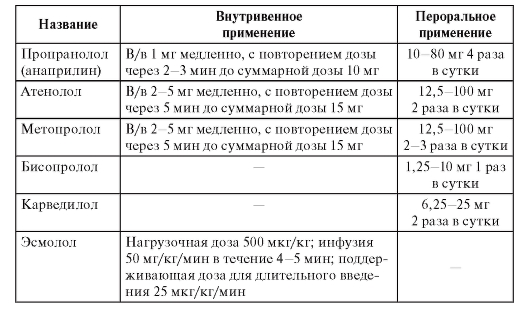
Режимы дозирования
Режимы дозирования антиаритмических препаратов приведены в табл. 55.
Таблица 55. Режимы дозирования антиаритмиков
Противопоказания
1. Синдром слабости синусового узла.
2. АВ-блокада II-III степени.
3. Бронхиальная астма тяжелого течения.
Применение β-адреноблокаторов требует осторожности при:
- бронхообструктивных заболеваниях;
- декомпенсации ХСН;
- сахарном диабете;
- периферических артериопатиях.
Нежелательные лекарственные реакции
• Брадиаритмии.
• Нарушения АВ-проведения.
• Бронхоспазм.
• Обострение периферических артериопатий.
• Сексуальная дисфункция.
• Депрессия.
Взаимодействия
С БМКК, амиодароном, дигоксином - увеличение риска брадиаритмии и нарушений АВ-проведения.
АНТИАРИТМИЧЕСКИЕ ПРЕПАРАТЫ III КЛАССА
(БЛОКАТОРЫ КАЛИЕВЫХ КАНАЛОВ)
Основным электрофизиологическим свойством ААП III класса являются блокада калиевых каналов и замедление калиевого тока, что приводит к увеличению ППД и ЭРП в ткани предсердий и желудочков. ААП III класса подавляют автоматизм.
Амиодарон
Амиодарон обладает эффектами ААП III класса. Кроме того, он незначительно блокирует натриевые каналы, медленные кальциевые каналы, а также проявляет умеренно выраженные свойства блокатора β- и α-адренорецепторов. Амиодарон влияет на метаболизм гормонов щитовидной железы.
Фармакокинетика
Всасывание амиодарона из ЖКТ медленное и вариабельное (20- 55%). Связь с белками высокая (до 96%). Проникает через ГЭБ и плацентарный барьер, секретируется с грудным молоком. Для амиодарона характерен большой и вариабельный объем распределения в результате интенсивного накопления в жировой ткани и в органах с хорошим кровоснабжением. Особенности фармакокинетики амиодарона требуют применения высоких нагрузочных доз. Время достижения максимальной концентрации в плазме крови - 3-7 ч. Начало действия колеблется от 2-3 дней до 2-3 мес даже при использовании нагрузочных доз. Терапевтическая концентрация - 1-2,5 мкг/мл. Амиодарон метаболизируется в печени, возможно, путем дейодирования с образованием активного метаболита - десэтиламиодарона. Период полувыведения амиодарона составляет в среднем около
40 дней. Выводится в основном с желчью (80-95%), почками удаляется менее 1%.
Дозировка
Для госпитализированных пациентов при пероральном насыщении 1,2-1,8 г/сут до суммарной дозы 10 г и последующим приемом поддерживающей дозы 200-400 мг/сут.
При комбинированном насыщении стартовая доза составляет 7-5 мг/кг внутривенно в течение 30-60 мин, затем 1,2-1,8 г/сут внутривенно в виде постоянной инфузии или внутрь до достижения дозы 10 г и последующим приемом поддерживающей дозы 200-400 мг/сут.
Для амбулаторных пациентов - 600-800 мг/сут внутрь до суммарной дозы 10 г и последующим приемом поддерживающей дозы
200-400 мг/сут.
Применение
1. Лечение пациентов с АВРТ, особенно при наличии плохо переносимых пароксизмов, сопровождающихся нарушениями гемодинамики (УР IIA/С).
2. Лечение суправентрикулярных аритмий у пациентов с ДПП - АВРТ или мерцательной аритмией (УР IIA/С).
3. Лечение фокальной предсердной тахикардии (УР IIA/С) и фокальной тахикардии АВ-соединения (УР IIA/С).
4. Восстановление синусового ритма при персистирующей мерцательной аритмией (УР IIA/А).
5. Поддержание синусового ритма у пациентов с сердечной недостаточностью, ИБС или выраженной ГЛЖ, и у пациентов без органического поражения сердца при неэффективности флекаинида, пропафенона или соталола.
Неотложное лечение желудочковых аритмий
1. У пациентов с ОКС / ОИМ - желудочковой тахикардией или фибрилляцией желудочков при неэффективности кардиоверсии (УР IIA/В).
2. Устойчивая желудочковая тахикардия без нарушений гемодинамики (УР I/B).
3. При желудочковых аритмиях, не связанных с ОКС / ОИМ, - желудочковой тахикардии или фибрилляцией желудочков при неэффективности кардиоверсии (УР I/B).
4. Устойчивая желудочковая тахикардия с гемодинамическими нарушениями или резистентной к другим ААП (УР IIA/С).
5. Рецидивирующая мономорфная желудочковая тахикардия (УР IIA/С).
6. Полиморфная желудочковая тахикардия (при отсутствии удлиненного QT) (УР I/C).
7. Непрерывно рецидивирующая желудочковая тахикардия (УР IIB/С).
Амиодарон рекомендуется использовать:
- у пациентов, перенесших инфаркт миокарда, для первичной профилактики ВСС (УР IIA/А);
- у пациентов, имевших эпизоды фибрилляции желудочков или желудочковой тахикардии (УР IIA/С);
- в случае рецидивов желудочковой тахикардии при лечении β-адреноблокаторами (УР IIA/В);
- у пациентов с дилатационной кардиомиопатией, перенесших эпизоды желудочковой тахикардии или фибрилляции желудочков (УР IIB/В);
- у пациентов с гипертрофической кардиомиопатией для первичной профилактики (УР IIB/В);
- после перенесенного эпизода желудочковой тахикардии или фибрилляции желудочков при невозможности применения имплантируемого кардиовертера-дефибриллятора (УР IIA/С);
- у пациентов с аритмогенной дисплазией правого желудочка после эпизода желудочковой тахикардии или фибрилляции желудочков при невозможности применения имплантируемого кардиовертера-дефибриллятора (УР IIA/С).
Амиодарон противопоказан при АВ-блокадах II-III степени, эпизодах синусовой брадикардии с развитием синкопальных состояний, СССУ при отсутствии ЭКС.
Применение амиодарона требует осторожности при следующих заболеваниях/состояниях:
1) при хронической сердечной недостаточности;
2) нарушениях функций печени;
3) гипокалиемии;
4) повышенной чувствительности к амиодарону;
5) нарушении функций щитовидной железы;
6) изменении морфологии щитовидной железы, выявленной при УЗИ.
Нежелательные лекарственные реакции
1. Симптоматическая брадикардия.
2. Аритмогенный эффект.
3. Симптомы нейротоксичности.
4. Фотосенсибилизация.
5. Фиброз легких.
6. Интерстициальный пневмонит или альвеолит.
7. Нарушения функций щитовидной железы.
8. Кератопатия.
9. Аллергические реакции.
10. Гепатит.
Методы контроля безопасности
1. Определение активности ACT и АЛТ.
2. Рентгенография грудной клетки.
3. Спирография.
4. Электрокардиография.
5. Офтальмологическое обследование.
6. Определение функционального состояния щитовидной железы.
7. Определение содержания амиодарона в плазме крови.
Взаимодействия
1. Другие ААП - риск развития желудочковых аритмий.
2. Антикоагулянты - торможение метаболизма и усиление эффекта антикоагулянтов.
3. Препараты дигиталиса - повышение концентрации дигоксина, угнетение синоартериального (СА-) узла и АВ-узла.
4. β-Адреноблокаторы - повышенный риск брадиаритмий и АВ-блокады.
5. Петлевые диуретики - риск аритмий, связанный с гипокалиемией. Специальных исследований по применению амиодарона у детей
не проводилось. У них начало действия амиодарона может быть более быстрым, а длительность действия - меньше. Было отмечено, что у детей наблюдается более выраженное взаимодействие амиодарона с препаратами дигиталиса.
У пожилых пациентов могут отмечаться большая чувствительность к влиянию амиодарона на функцию щитовидной железы, а также повышение частоты атаксии и других нейротоксических эффектов.
Соталол
Соталол обладает электрофизиологическими эффектами ААП III класса. Это достаточно активный β-адреноблокатор, обладающий антиангинальным и гипотензивным действиями.
Фармакокинетика
Соталол хорошо всасывается из ЖКТ (до 80%). Практически не связывается с белками плазмы. Проницаемость через ГЭБ и плацентарный барьер низкая. Метаболизируется в печени. Т1/2 - 7-18 ч, увеличивается при ХПН. Выводится почками, до 75% в неизменном виде.
Применение
Соталол применяют в стартовой дозе 80 мг 2 раза в сутки, максимальная суточная доза - 320 мг сут (дальнейшее увеличение дозы существенно увеличивает риск проаритмий).
При внутривенном применении общая максимальная доза 1,5 мг/кг, рекомендуется медленное введение (5-15 мин), под контролем ЭКГ
и АД.
Применяется для:
- купирования рецидивирующей мономорфной желудочковой тахикардии (УР IIA/С);
- лечения рецидивирующей желудочковой тахикардии, резистентной к β-адреноблокаторам, у пациентов, перенесших инфаркт миокарда (УР IIA/С);
- лечения и профилактики устойчивой желудочковой тахикардии у пациентов с аритмогенной дисплазией правого желудочка при невозможности имплантации кардиовертера-дефибриллятора (УР IIA/С);
- первичной профилактики ВСС (УР IIB/C);
- купирования пароксизма фибрилляции / трепетания предсердий (ФПТ) (УР IIA/С);
- лечения или профилактики рецидивирующей ФПТ (УР IIA/С);
- лечение рецидивирующей АВРТ, резистентной к β-адреноблокаторам и БМКК (УР IIA/С);
- лечения или профилактики АВРТ у пациентов с ДПП (УР IIA/С);
- лечения фокальной тахикардии АВ-соединения (УР IIA/С);
- в качестве препарата первого ряда для поддержания синусового ритма у пациентов с мерцательной аритмией, не имеющих органического поражения сердца, с АГ без выраженной ГЛЖ и пациентов с ИБС.
Противопоказания
1. АВ-блокада II-III степени.
2. СА-блокада и СССУ.
3. Артериальная гипотензия.
В связи с наличием неселективной β-блокирующей активности следует учитывать противопоказания и ограничения для β-адреноблокаторов.
Применение соталола требует осторожности при следующих заболеваниях или состояниях:
1) при хронической сердечной недостаточности;
2) почечной недостаточности;
3) гипокалиемии;
4) повышенной чувствительности к соталолу;
5) депрессии.
Нежелательные лекарственные реакции
1. Аритмогенный эффект (желудочковая тахикардия типа пируэт).
2. Симптомы нейротоксичности.
3. Побочные эффекты, характерные для β-адреноблокаторов.
4. Тромбоцитопения.
5. Агранулоцитоз.
6. Лейкопения.
7. Аллергические реакции.
Методы контроля безопасности
1. Контроль ЭКГ.
2. Контроль концентрации глюкозы у пациентов с сахарным диабетом.
3. Оценка функций почек, особенно у пожилых пациентов.
Взаимодействия
• Повышение риска аритмий при совместном назначении с ААП I класса.
• С йодсодержащими контрастными веществами - повышение риска анафилактических реакций.
• С ингаляционными анестетиками - риск гипотонии и кардиодепрессивного действия.
• При сочетании с гипотензивными препаратами - риск гипотонии.
• С петлевыми диуретиками - повышение риска развития аритмий.
Ибутилид
Ибутилид® блокирует выходящий калиевый ток и медленный входящий натриевый ток. Увеличивает ППД и ЭРП кардиомиоцитов предсердий, желудочков, АВ-узла, системы Гиса - Пуркинье, ДПП. Ибутилид® подавляет автоматизм.
Фармакокинетика
Ибутилид® применяют внутривенно. Связь с белками низкая (около 40%). Препарат активно метаболизируется в печени, около 80% выводится почками в виде метаболитов, приблизительно 10% - в неизменном виде. ТУ варьирует от 2 до 12 ч.
Применение
Существующие рекомендации поддерживают применение ибутилида® для купирования пароксизмальной или персистирующей мерцательной аритмии продолжительностью до 7 дней (УР I/A) и более 7 дней (УР IIA/А).
Ибутилид® вводят внутривенно в дозе 1 мг в течение 10 мин, при необходимости дозу вводят повторно.
Противопоказания
1. Гиперчувствительность.
2. Беременность.
3. Период лактации.
С осторожностью необходимо применять при следующих заболеваниях / состояниях:
1) при синдроме слабости синусового узла;
2) СА- и АВ-блокадах;
3) коллапсе;
4) гипокалиемии;
5) хронической сердечной недостаточности;
6) печеночной недостаточности.
Нежелательные лекарственные реакции
1. Полиморфная желудочковая тахикардия или тахикардия типа пируэт.
2. Брадиаритмии.
3. АВ-блокада.
4. Тошнота.
5. Головная боль.
6. Почечная недостаточность.
Методы контроля безопасности
• Мониторирование ЭКГ и АД.
Взаимодействия
• С другими ААП - повышение риска развития желудочковых аритмий.
• С β-адреноблокаторами, БМКК - повышение риска брадикардии и АВ-блокады.
АНТИАРИТМИЧЕСКИЕ ПРЕПАРАТЫ IV КЛАССА (БЛОКАТОРЫ МЕДЛЕННЫХ КАЛЬЦИЕВЫХ
КАНАЛОВ)
БМКК (верапамил и дилтиазем) блокируют медленные кальциевые каналы, которые в основном определяют скорость деполяризации - СА- и АВ-узлов. БМКК подавляют автоматизм, замедляют проведение и увеличивают рефрактерность СА- и АВ-узлов. Медленные кальциевые токи могут быть необходимым компонентом развития следовых деполяризаций. БМКК способны подавлять следовые деполяризации и могут быть эффективны при триггерных аритмиях. Они также обладают антиишемическим и гипотензивным свойствами.
Фармакокинетика
Верапамил хорошо абсорбируется в ЖКТ (до 90%). Печеночный метаболизм первого прохождения снижает биодоступность до 20-35%. До 90% верапамила связывается с белками плазмы. Метаболизируется в печени с участием ферментных систем CYP3A4, CYP3А5 и CYP3A7, известно до 11 метаболитов, наиболее значимый - норверапамил, обладающий умеренной гипотензивной активностью. Период полувыведения составляет 5-12 ч. Выводится в основном почками (до 70%). Дилтиазем хорошо реабсорбируется в ЖКТ (до 90%), но метаболизм первого прохождения снижает его биодоступность до 40%. С белками плазмы связывается до 70-80% препарата. Дилтиазем метаболизируется в печени с участием ферментных систем цитохрома CYP3A4, CYP3A5 и CYP3A7 с образованием дезацетилдилтиазема, который обладает гораздо меньшей фармакологической активностью, чем дилтиазем. Период полувыведения составляет около 3,5 ч. Выводится с желчью (около 65%) и почками (около 35%).
Применение
Существующие рекомендации поддерживают применение БМКК для лечения следующих аритмий:
- симптоматической синусовой тахикардии (УР IIA/С);
- для купирования и профилактического лечения АВРТ (УР IIA/С);
- для купирования (УР IIA/С) и профилактического лечения (УР
I/C) ФПТ.
БМКК рекомендуется использовать для контроля ЧСС у пациентов с постоянной формой мерцательной аритмии (УР I/A).
Кроме того, БМКК могут быть эффективны при лечении идиопатических (верапамилчувствительных) желудочковых тахикардий (УР IIA/С).
Для экстренного контроля ЧСС или купирования суправентрикулярной тахикардии верапамил вводят внутривенно 0,075-0,150 мг/кг в течение 2 мин, дилтиазем - 0,25 мг/кг в течение 2 мин.
При приеме внутрь доза верапамила составляет 120-480 мг/сут, дилтиазема - 60-360 мг/сут.
Противопоказания
1. Гиперчувствительность, гипотония.
2. САили АВ-блокада.
3. Синдром слабости синусового узла.
4. Мерцательная аритмия или трепетание предсердий у пациентов
с ДПП.
5. ХСН, обусловленная систолической дисфункцией левого желудочка.
С осторожностью следует использовать БМКК при следующих заболеваниях или состояниях:
1) АВ-блокаде I степени;
2) брадикардии;
3) печеночной или почечной недостаточности;
4) состоянии пожилого возраста.
Нежелательные лекарственные реакции
1. Брадикардия.
2. Гипотония.
3. Нарушения АВ-проводимости.
4. Симптомы нейротоксичности.
5. Запор.
6. Гиперплазия десен.
7. Аллергические реакции.
8. Претибиальные отеки.
Методы контроля безопасности
• Мониторирование АД и ЭКГ.
• Определение активности печеночных ферментов.
Взаимодействия
• С β-адреноблокаторами - потенциация развития брадикардии и нарушений проводимости.
• С ААП-препаратами IA и III классов - риск существенного удлинения QT.
• Препараты дигиталиса - нарушения АВ-проводимости.
• С индукторами печеночного метаболизма - ослабление эффектов БМКК вследствие снижения концентрации в плазме крови.
БМКК проходят через плаценту, однако исследований БМКК на развитие плода не проведено. Гипотония, вызываемая у матери быстрым внутривенным введением БМКК, может вызывать дисстресс-синдром плода. БМКК проникают в грудное молоко.
Специальные исследования по применению БМКК в педиатрии не проведены, специфических педиатрических проблем, ограничивающих их применение у детей, не предполагается. Имеются сообщения о существенных гемодинамических нарушениях у новорожденных и грудных детей при внутривенном введении верапамила.
У пожилых пациентов может увеличиваться период полувыведения БМКК в связи со снижением почечного клиренса.
АНТИАРИТМИЧЕСКИЕ ПРЕПАРАТЫ, НЕ ВОШЕДШИЕ В КЛАССИФИКАЦИЮ
М-холиноблокаторы (атропин) - применяют для увеличения ЧСС при брадикардиях.
Сердечные гликозиды (дигоксин) - применяют для контроля частоты желудочковых сокращений при предсердных аритмиях с высокой частотой предсердных сокращений за счет замедления проводимости в атриовентрикулярном узле.
Электролиты (растворы калия, магния, пероральные препараты калия и магния). Препараты магния применяют для лечения желудочковой тахикардии типа пируэт, возникающей по триггерному механизму. Кроме того, пероральные препараты магния могут с успехом применяться для симптоматического лечения желудочковой экстрасистолии у пациентов без органических заболеваний сердца.
Аденозин в основном используется для купирования пароксизмальной наджелудочковой тахикардии.
ПРЕПАРАТЫ, НЕ ОБЛАДАЮЩИЕ ПРЯМЫМИ ЭЛЕКТРОФИЗИОЛОГИЧЕСКИМИ СВОЙСТВАМИ
1. ИАПФ способны снизить риск фатальных желудочковых аритмий и ВСС у пациентов с инфарктом миокарда и ДКМП.
2. У пациентов, перенесших инфаркт миокарда, применение блокаторов альдостероновых рецепторов, а также статинов снижает риск фатальных желудочковых аритмий и ВСС.
По-видимому, препараты, не обладающие прямыми электрофизиологическими свойствами, способны влиять на ремоделирование миокарда. Эти препараты снижают вероятность образования субстрата для re-entry аритмий либо препятствуют активации существующих.
КЛИНИКО-ФАРМАКОЛОГИЧЕСКИЕ ПОДХОДЫ К ВЫБОРУ И ПРИМЕНЕНИЮ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРИ НАРУШЕНИЯХ РИТМА СЕРДЦА
ЖЕЛУДОЧКОВЫЕ АРИТМИИ
Основные виды желудочковых аритмий:
1) желудочковая экстрасистолия;
2) неустойчивая желудочковая тахикардия;
3) устойчивая мономорфная или полиморфная желудочковая тахикардия ;
4) фибрилляции желудочков.
Адекватное лечение желудочковых аритмий
Адекватное лечение связано с необходимостью понимания механизмов развития и этиологии аритмий, оценки сопутствующих заболеваний (состояний), которые могут вносить вклад в развитие или провоцирование аритмии, оценки риска, обусловленного аритмией, и сведений о соотношении польза / риск планируемого антиаритмического вмешательства.
Основной механизм развития желудочковых аритмий у пациентов со структурными поражениями сердца заключается в повторном входе и циркуляции возбуждения. Круги циркуляции импульса, как правило, формируются в пограничных зонах между нормальной и патологически измененной тканью в миокарде желудочков. Триггерная активность рассматривается в качестве основного механизма развития аритмий у пациентов без органического поражения миокарда (синдромы удлиненного QT, катехолзависимая полиморфная желудочковая тахикардия, идиопатическая желудочковая тахикардия из выносящего тракта правого желудочка). Патологический автоматизм может быть ответственным за развитие желудочковых аритмий при острой ишемии миокарда, а также, возможно, за идиопатическую левожелудочковую тахикардию. ЖЭ и неустойчивая желудочковая тахикардия у пациентов без органических заболеваний сердца не связаны с повышенным риском ВСС, поэтому при отсутствии симптомов не требует лечения. Оно необходимо только при наличии выраженных симптомов, существенно снижающих качество жизни.
Препаратами выбора являются β-адреноблокаторы, при их неэффективности можно использовать амиодарон, соталол или флекаинид.
Основная задача лечения желудочковых аритмий у пациентов с органическими заболеваниями сердца, а также с генетически детерминированными электрическими аномалиями (синдром удлиненного QT), это снижение риска ВСС, в основном обусловленной фатальной желудочковой тахикардией или фибрилляцией желудочков.
Первичная профилактика включает методы лечения, направленные на предотвращение фатальных аритмических эпизодов у пациентов без желудочковых аритмий или ВСС в анамнезе, но имеющих признаки высокого риска.
Вторичная профилактика используется у пациентов, перенесших эпизод желудочковой тахикардии или ВСС.
Ведение пациентов с желудочковыми аритмиями включает применение:
- антиаритмических препаратов;
- имплантируемых устройств (дефибрилляторы-кардиовертеры);
- различных вариантов аблации;
- хирургических вмешательств.
Основу фармакотерапии желудочковых аритмий составляют β-адреноблокаторы. Они эффективно подавляют желудочковые аритмии и снижают риск ВСС как у пациентов с органическими поражениями сердца, так и при отсутствии структурных изменений миокарда.
Данные об эффективности амиодарона противоречивы, хотя превалируют доказательства о подавлении желудочковых аритмий и сни-
жении риска ВСС у пациентов с перенесенным инфарктом миокарда и ДКМП. Длительное применение амиодарона может быть ограничено выраженной системной токсичностью.
Другие ААП оказались малоэффективными для профилактики ВСС и увеличения выживаемости. Доступные в настоящее время ААП могут использоваться в определенных клинических ситуациях, в основном для неотложной терапии желудочковых аритмий, однако должны применяться с осторожностью в связи с риском развития проаритмии.
Для профилактики ВСС у пациентов с органическим поражением сердца также эффективны препараты, не обладающие антиаритмической активностью. Они способны влиять на процессы, определяющие развитие субстрата для развития желудочковых аритмий: ишемию и патологическое ремоделирование желудочкового миокарда. Так, способность снижать риск ВСС доказана для антиагрегантов, статинов, ИАПФ, блокаторов альдостероновых рецепторов.
Рекомендации по применению антиаритмических препаратов (на основании принципов доказательной медицины)
Градации рекомендаций
Классы доказательств приведены в таблице 56.
Таблица 56. Классы доказательств

Уровни доказательности (табл. 57)
Таблица 57. Уровни доказательств

Применение антиаритмических препаратов для неотложной помощи при желудочковых аритмиях (табл. 58-73)
Таблица 58. Желудочковые аритмии у больных с острым инфарктом миокарда или острым коронарным синдромом (1)

Таблица 59. Желудочковые аритмии у больных с острым инфарктом миокарда или острым коронарным синдромом (2)

Таблица 60. Желудочковые аритмии у больных с острым инфарктом миокарда или острым коронарным синдромом (3)

Таблица 61. Желудочковые аритмии у больных с острым инфарктом миокарда или острым коронарным синдромом (4)

Таблица 62. Желудочковые аритмии, не ассоциированные с острым инфарктом миокарда (1)
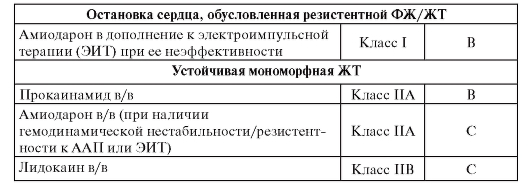
Таблица 63. Желудочковые аритмии, не ассоциированные с острым инфарктом миокарда (2)

Таблица 64. Желудочковые аритмии, не ассоциированные с острым инфарктом миокарда (3)

Таблица 65. Желудочковые аритмии, не ассоциированные с острым инфарктом миокарда (4)

Таблица 66. Применение антиаритмических препаратов для длительного лечения желудочковых аритмий (1)

Таблица 67. Применение антиаритмических препаратов для длительного лечения желудочковых аритмий (2)

Таблица 68. Применение антиаритмических препаратов для длительного лечения желудочковых аритмий (3)

Таблица 69. Применение антиаритмических препаратов для длительного лечения желудочковых аритмий (4)

Таблица 70. Применение антиаритмических препаратов для длительного лечения желудочковых аритмий (5)

Таблица 71. Применение антиаритмических препаратов для длительного лечения желудочковых аритмий (6)

Таблица 72. Применение антиаритмических препаратов для длительного лечения желудочковых аритмий (7)

Таблица 73. Применение антиаритмических препаратов для длительного лечения желудочковых аритмий (8)

СУПРАВЕНТРИКУЛЯРНЫЕ АРИТМИИ
Основные виды суправентрикулярных аритмий:
1) суправентрикулярная экстрасистолия;
2) синусовая реципрокная тахикардия;
3) атриальная реципрокная тахикардия;
4) атриовентрикулярная реципрокная тахикардия;
5) реципрокная тахикардия с участием дополнительных проводящих путей;
6) мультифокальная предсердная тахикардия;
7) фокальная тахикардия атриовентрикулярного соединения.
В отличие от желудочковых аритмий, СВА в подавляющем большинстве случаев не представляют угрозу для жизни. Их значение определяется достаточно широкой распространенностью, наличием симптомов, требующих экстренной госпитализации, а также снижением качества жизни в результате ограничения физической активности или развития симптомов сердечной недостаточности. Основной механизм развития реципрокных СВА - повторный вход и циркуляция возбуждения. Наиболее вероятный механизм развития фокальных СВА - патологический автоматизм.
Основная задача лечения СВА в большинстве случаев - это улучшение качества жизни пациента.
Бессимптомная предсердная экстрасистолия не требует лечения. Оно необходимо только при наличии выраженных симптомов, существенно снижающих качество жизни. При этом препаратами выбора являются β-адреноблокаторы или БМКК, при их неэффективности могут использоваться амиодарон, соталол или флекаинид. Лечение СВА предусматривает купирование пароксизма и применение профилактического антиаритмического воздействия для предотвращения рецидивов.
Основу современного лечения СВА составляют антиаритмические препараты различных классов (табл. 74-85) и различные варианты
аблации. В качестве препаратов первого ряда, как правило, используются препараты с низким аритмогенным потенциалом и низкой системной токсичностью - β-адреноблокаторы и БМКК.
Таблица 74. Применение антиаритмических препаратов для неотложной помощи при суправентрикулярной тахикардии (1)

Таблица 75. Применение антиаритмических препаратов для неотложной помощи при суправентрикулярной тахикардии (2)

Таблица 76. Применение антиаритмических препаратов для неотложной помощи при суправентрикулярной тахикардии (3)

Таблица 77. Применение антиаритмических препаратов для лечения супра вентрикулярной тахикардии (1)

Таблица 78. Применение антиаритмических препаратов для лечения суправентрикулярной тахикардии (2)
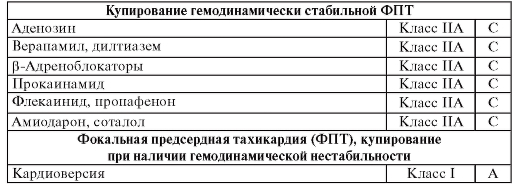
Таблица 79. Применение антиаритмических препаратов для лечения суправентрикулярной тахикардии (3)

Таблица 80. Применение антиаритмических препаратов для лечения суправентрикулярной тахикардии (4)

Таблица 81 . Применение антиаритмических препаратов для лечения суправентрикулярной тахикардии (5)

Таблица 82. Применение антиаритмических препаратов для лечения суправентрикулярной тахикардии (6)

Таблица 83. Применение антиаритмических препаратов для лечения суправентрикулярной тахикардии (7)
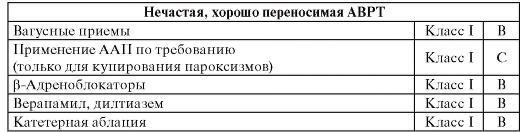
Таблица 84. Применение антиаритмических препаратов для лечения суправентрикулярной тахикардии (8)

Таблица 85. Применение антиаритмических препаратов для лечения суправентрикулярной тахикардии (9)

МЕРЦАТЕЛЬНАЯ АРИТМИЯ/ТРЕПЕТАНИЕ ПРЕДСЕРДИЙ
Мерцательная аритмия или трепетание предсердий - это широко распространенные аритмии. Мерцательная аритмия ассоциируется с повышенным риском сердечно-сосудистых осложнений, особенно инфаркта головного мозга. Возможно, сердечно-сосудистый риск, ассоциированный с мерцательной аритмией, обусловлен тяжестью фоновых (ассоциированных) заболеваний.
Основные задачи лечения мерцательной аритмии - это профилактика системных эмболических осложнений, профилактика гемодинамических нарушений, обусловленных неадекватно высокой частотой сердечных сокращений, и контроль симптомов.
В настоящее время существуют две тактики лечения мерцательной аритмии: восстановление и поддержание синусового ритма (тактика контроля ритма) и сохранение мерцательной аритмии с контролем частоты желудочковых сокращений (тактика контроля частоты сердечных сокращений). Результаты проведенных исследований показали, что тактика контроля ритма не имеет преимуществ перед тактикой контроля ЧСС с точки зрения снижения риска сердечно-сосудистых осложнений и смерти. Более того, для некоторых групп тактика контроля ЧСС, по-видимому, является предпочтительной.
Для пожилых пациентов с АГ или сердечно-сосудистыми заболеваниями в качестве начального лечения более приемлема тактика контроля ЧСС.
Для более молодых пациентов, особенно с идиопатической мерцательной аритмией, предпочтительна тактика восстановления и поддержание синусового ритма.
Рекомендации по фармакологической коррекции фибрилляции предсердий (мерцательной аритмии) приведены в табл. 86-90.
Таблица 86. Рекомендации по фармакологической кардиоверсии мерцательной аритмии (1)

Таблица 87. Рекомендации по фармакологической кардиоверсии мерцательной аритмии (2)

Таблица 88. Рекомендации по фармакологической кардиоверсии мерцательной аритмии (3)
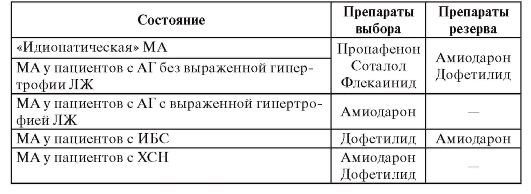
Таблица 89. Контроль частоты сердечных сокращений в экстренных ситуациях у больных с мерцательной аритмией

Таблица 90. Контроль частоты сердечных сокращений у больных с мерцательной аритмией

Окончание табл. 90

КЛИНИЧЕСКИЙ РАЗБОР
В мастер-классе я подбираю и представляю вам из своей практики неоднозначные и типичные «студенческие» клинические случаи. Реальная клиническая практика будет ставить перед вами непростые задачи, и надо быть готовым к самым неожиданным решениям. Итак.
Пациент Г., 69 лет, поступил в кардиологическое отделение клиники нашей кафедры 21 февраля 2007 г.
Анамнез жизни
С рождения до 12 лет - нарушение пигментации кожи по типу витилиго. В 23 года - аппендэктомия. С 40 лет - гипертоническая болезнь. В течение последних двух лет - ИБС, распространенная сыпь по типу васкулита. Болезнь Боткина, туберкулез, венерические заболевания, малярию отрицает, кровь переливали (в детстве), гормонами не лечился. Лекарственной непереносимости нет (неоднозначные данные были получены по поводу амиодарона). Курение, злоупотребление алкоголем отрицает.
21 февраля 2007
Внезапная потеря сознания на фоне сердцебиения, интенсивных давящих болей за грудиной с иррадиацией в левую руку.
Была вызвана бригада СМП, пациент доставлен в приемный покой больницы, где была снята ЭКГ, которая позволила установить синусовую тахикардию, гипоксический ишемический сегмент ST циркулярной верхушечной области, преходящую фибрилляцию предсердий.
Осмотр
Состояние средней степени тяжести. Сознание ясное. Кожные покровы бледные, с распространенными приподнимающимися геморрагическими высыпаниями красного цвета (рис. 98, 99).
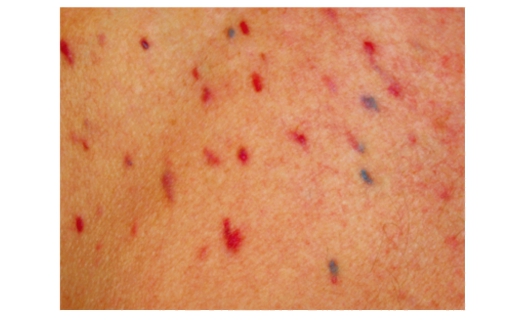
Рис. 98. Кожные высыпания на теле больного
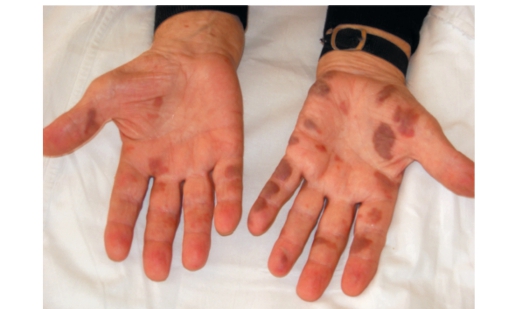
Рис. 99. Кожные высыпания на кистях рук пациента
Увеличение шейных лимфатических узлов справа до 2 см, подмышечных справа до 3 см, плотноэластической консистенции. Дыхание вазикулярное, хрипов нет. Граница относительной сердечной тупости расширена влево на 1,5 см кнаружи от левой среднеключичной линии. Тоны сердца аритмичны (периоды мерцания предсердий), приглушены. АД - 80/50 мм рт.ст. ЧСС - 100 в минуту. Увеличение селезенки на 2-3 см на высоте вдоха.
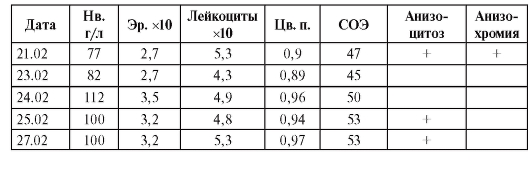
В общем анализе крови, взятом по CITO, обращало внимание снижение гемоглобина до 77 г/л, эр. до 2,7х1012/л, анизохромия, цветовой показатель - 0,9, СОЭ - 47 мм/ч.
Пациент госпитализирован в 10 ч 35 мин 21.02.2007 г. в ПИТ кардиологического отделения, где назначено лечение.
• Изокет 0,1% - 10,0 на физ. растворе со скоростью - 6 капель в минуту.
• Реополиглюкин - 200,0 в/в капельно.
• Эгилок 6,25 мг 2 раза в сутки.
• Преднизолон 120 мг в/в капельно.
• Анальгин 50% - 4,0 в/в медленно.
21.02.2007 г. в 18:00 восстановлен синусовый ритм, гемодинамика стабилизированная (АД - 120/80 мм рт.ст., ЧСС - 74 в минуту). Пациент переведен в общую палату. Лечение в отделении
• Метопролол (эгилок) 12,5-2 раза в сутки.
• Омепразол 40 мг - 2 раза в сутки.
• Сорбифер дурулес 1 таблетка в сутки.
• KCl 4% - 10 + Sol. Глюкоза 5% - 200 в/в капельно 1 раз в сутки.
• 23.02.07 однократно переливание одногрупной эритромассы 450 мл.
Консультации специалистов
21.02.07 Осмотр хирурга
Диагноз: анемия неясного генеза II степени.
На момент осмотра данных, свидетельствующих об острой хирургической патологии, не выявлено.
21.02.07 Осмотр уролога
При осмотре патологии урогенитальной сферы, объясняющей анемию у больного, не выявлено.
21.02.07 Осмотр аллерголога Диагноз: геморрагический васкулит? Рекомендовано: консультация гематолога. 26.02.07 Осмотр заведующего отделением гематологии
Необходимо обследование по протоколу лимфопролиферативных заболеваний с секрецией:
- трепанобиопсия дозы из подвздошной кости;
- аспирация костного мозга на лимфоцитоз;
- биопсия одной из «васкулитных» бляшек;
- биопсия шейного лимфатического узла;
- электрофорез белков;
- продолжение обследования гематолога в областном клиническом онкологическом диспансере (ОКОД).
Инструментальные исследования
1. Рентгенография ОГК: без патологии.
2. Протокол эзофагофиброгастродуоденоскопии: недостаточность кардии. Аксиальная грыжа пищеводного отверстия диафрагмы. Геморрагический эрозивный гастрит.
3. УЗИ брюшной полости: диффузные изменения в паренхиме поджелудочной железы. Правосторонний нефросклероз.
4. Динамика ЭКГ: 21.02.07 10 ч. 35 мин. Мерцательная аритмия тахиформа 100-150 в минуту. Ишемия верхушечной области. Гипертрофия левого желудочка.
21.02.07 18 ч. 00 Ритм синусовый - 89 в минуту. Ишемия верхушечной области. Гипертрофия левого желудочка.
26.02.07 Ритм синусовый - 66 в минуту. Неполная блокада правой ножки пучка Гиса. Наджелудочковая экстрасистолия.
Диагноз
Основной: ИБС. Кардиосклероз.
Осложнение: персистирующая фибрилляция предсердий, осложнившаяся аритмогенным шоком (от 21.02.07). ХСН IIA (ФК II).
Сопутствующий: гипертоническая болезнь III. Степень АГ 2. Гипертрофия левого желудочка. Риск 4 (очень высокий). Лимфопролиферативное заболевание с секрецией. Хроническая миелотоксическая анемия. Хронический эрозивный гастрит. Правосторонний нефроскле-
роз. ХПН - 0.
Лабораторные исследования (табл. 91)
Таблица 91. Лабораторные исследования
Динамика кожного синдрома
• При поступлении: длительно сохраняющиеся красновато-коричневые пятна.
• За 4 дня до выписки, на фоне проводимого лечения, появилась мелкоточечная сыпь сосудистого характера.
• За сутки до выписки, на фоне приема меда, апельсинов, появилась зудящая сыпь по типу острой крапивницы, с типичной локализацией, которая быстро купировалась приемом антигистаминных препаратов.
У больного наблюдалось 3 варианта сыпи, которые морфологически отличались друг от друга.
Давайте размышлять. Следует ли нам рассматривать кожные высыпания как аллергическую реакцию на многолетний прием амиодарона (кордарон) или это проявление лимфопролиферативного заболевания? Можно ли рассматривать у пациента кожный синдром как симптом саркомы Капоши на фоне иммунодефицитного состояния?
Кожные проявления онкологических заболеваний
Кожу могут поражать более 25 видов злокачественных опухолей лимфоидной ткани, способных развиваться в ней первично или в результате распространения нодальных или экстранодальных лимфом других локализаций. Первичные лимфомы кожи возникают в ней, и на момент постановки диагноза обследование пациента не обнаруживаются внекожные очаги роста опухоли. Несколько лимфопролиферативных заболеваний часто начинаются с поражения кожи: CD4+/CD56+ гематодермальная опухоль (так же известная, как бластная NK-клеточная лимфома) и Т-клеточная лейкемия или лимфома взрослых (табл. 92-94).
Таблица 92. Кожные проявления Т- и NK-клеточных лимфом (1)
Окончание табл. 92

Таблица 93. Кожные проявления Т- и NK-клеточных лимфом (2)
Таблица 94. Кожные проявления В-клеточных лимфом и гемодермий из клеток-предшественников

Окончание табл. 94

Саркома Капоши - это множественная злокачественная или доброкачественная опухоль из малодифференцированной сосудистой ткани, часто возникает у мужчин в возрасте старше 60 лет при синдроме приобретенного иммунодефицита (СПИД), иммуносупрессии (рис. 100).
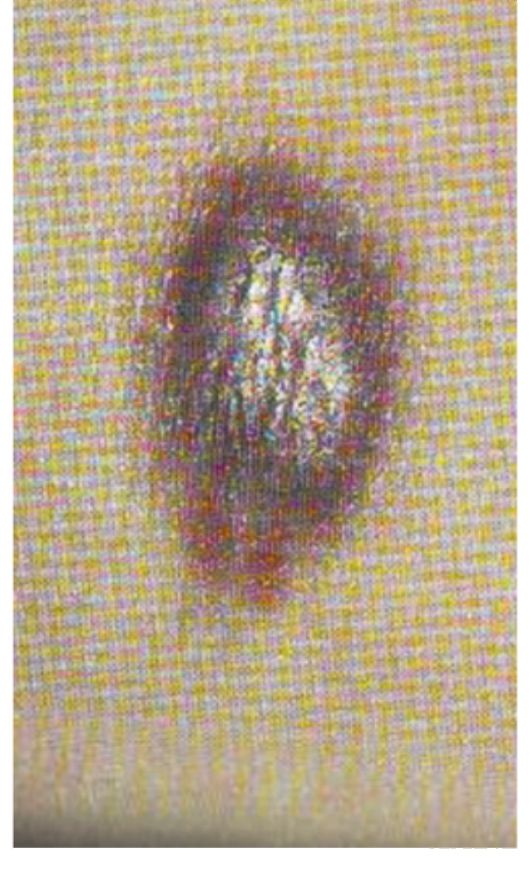
Рис. 100. Саркома Капоши
Клиническая картина
Безболевая саркома Капоши
Мультицентричные красновато-голубоватые или фиолетовые опухоли на коже. Опухоли мягкой консистенции. Возможен зуд в области поражения. У мужчин пожилого возраста сначала поражаются пальцы ног и голени.
Африканская (эндемичная) саркома Капоши
Характерны быстрый рост опухоли и агрессивность. Обычно поражается кожа, лимфатические узлы или внутренние органы.
ВИЧ-ассоциированная саркома Капоши
Обширные поражения кожи рук, лица, туловища, а также слизистых оболочек (высыпания в виде розовых или красных папул либо бляшек округлой и овальной формы). Поражение лимфатических узлов. Поражение внутренних органов.
Учитывая клиническую картину, результаты обследования и динамику кожных проявлений, больной был направлен на дальнейшее лечение и наблюдение у онколога по месту жительства.