Клиническая фармакология и фармакотерапия в реальной врачебной практике : мастер-класс : учебник / В. И. Петров. - 2011. - 880 с. : ил.
|
|
|
|
Раздел VI. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ В АЛЛЕРГОЛОГИИ И ИММУНОЛОГИИ. Глава 1. КЛИНИКО-ФАРМАКОЛОГИЧЕСКИЕ ПОДХОДЫ К ДИАГНОСТИКЕ И КОРРЕКЦИИ ИММУННОЙ НЕДОСТАТОЧНОСТИ
Иммунитет - это состояние защищенности или невосприимчивости организма к агентам, несущим признаки чужеродности. Иммунная система способна распознавать миллионы разнообразных веществ, выявляя тонкие различия даже между близкородственными молекулами.
Функции иммунной системы заключаются в защите организма от биологической агрессии путем распознавания антигена и иммунного ответа на него, кроме того, система обладает иммунной памятью, сохраняя информацию о предыдущих антигенных воздействиях.
Оптимальное функционирование системы обеспечивают тонкие механизмы взаимодействия клеток, осуществляемые как при прямых контактах, так и с участием растворимых посредников. Эффекторными компонентами иммунной системы являются:
- клетки (лимфоциты, макрофаги, NK-клетки (натуральные киллеры, «Natural killer cells»), тучные клетки, базофилы, дендритные клетки, эозинофилы) (клеточный иммунитет);
- гуморальные факторы (антитела, антимикробные пептиды, система комплемента) (гуморальный иммунитет).
Регуляция деятельности иммунной системы осуществляется путем межклеточных контактов и при помощи цитокинов.
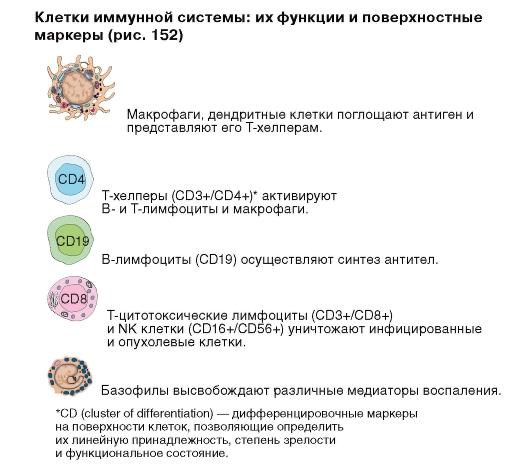
Рис. 152. Клетки иммунной системы, их функции и поверхностные маркеры
Факторы гуморальной защиты
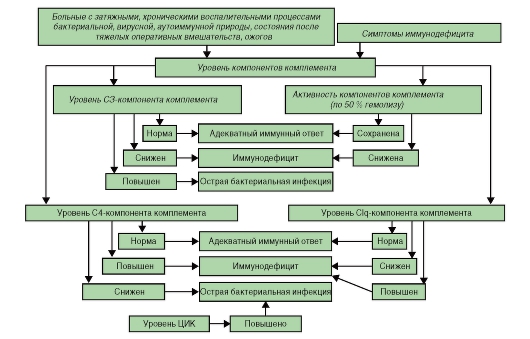
1. Комплемент - это система белковых молекул, осуществляющих лизис и опсонизацию инфекционных агентов, участвующая в иммунорегуляции и элиминации циркулирующих иммунных комплексов
(ЦИК).
2. Антитела (иммуноглобулины) - это белки, связывающиеся с антигеном и опосредующие эффекторные функции иммунной системы. Антитела, связавшие антиген, могут формировать ЦИК.
3. Эндогенные антимикробные пептиды (дефензины, кателицидины) - эффекторные молекулы, вызывающие лизис микроорганизмов.
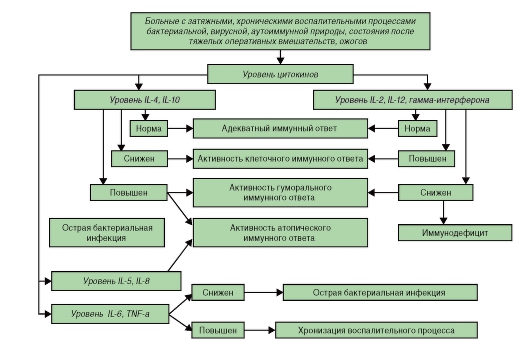
Цитокины и их функции:
- интерлейкины;
- интерфероны;
- тумор-некротический фактор;
- фактор, ингибирующий миграцию.
Функции:
- регуляция врожденного иммунитета (ИЛ-1, ИЛ-6, хемокины);
- регуляция активации, роста и дифференцировки В- и Т-лимфоцитов (ИЛ-2, ИЛ-4, ИЛ-21, TGF-β);
- регуляция иммунного воспаления [IFN-γ, фактор некроза опухоли (ФНО), ИЛ-5, ИЛ-10, ИЛ-12];
- стимуляция гематопоэза [ИЛ-3, ИЛ-7, колониестимулирующие факторы (КСФ)].
Упрощенная схема иммунного ответа
Иммунная система среди всех систем жизнеобеспечения организма относится к наиболее значимым, выполняя исключительно важные функции по защите организма от различных чужеродных веществ (рис. 153). К таким веществам относятся:
- инфекционные факторы, опасные для организма (бактерии, вирусы, грибы, простейшие);
- возникшие в организме модифицированные клетки (например, опухолевые);
- компоненты пересаженных органов и тканей;
- аллергены.
Нарушение функций иммунной системы приводит к различным заболеваниям - от рецидивирующих инфекций и аллергической патологии до ревматоидного артрита и злокачественных новообразований. В связи с этим представляется важным для врача любой специальности уметь распознавать и диагностировать возможные нарушения иммунного ответа и своевременно их корригировать.
Иммунодефицит - это количественная или функциональная недостаточность основных компонентов иммунной системы.
Международная классификация болезней (МКБ-10, 1992)
- иммунодефицит с преобладанием дефектов антител;
- комбинированные иммунодефицитные состояния;
- иммунодефицит в сочетании с другими значительными дефектами;
- дефекты в системе комплемента.
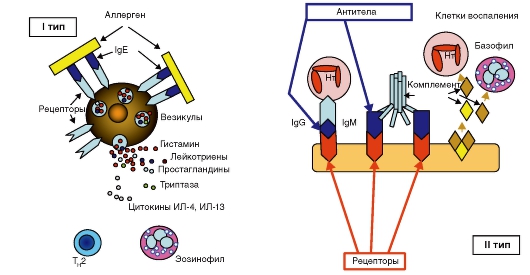
Рис. 153. Иммунный ответ
Клиническими признаками иммунодефицита могут быть:
- частые бактериальные, вирусные, микотические инфекции;
- различные поражения кожных покровов и видимых слизистых оболочек (высыпания, бородавки, остроконечные кондиломы, угревая сыпь и др.);
- похудание;
- избыточная масса тела;
- нарушения функций кишечника (понос, урчание, вздутие, кишечный дисбактериоз и др.);
- наличие хронических воспалительных заболеваний (хронические бронхит, тонзиллит, холецистит, простатит, цистит, уретрит, нефрит, гайморит).
Иммунная недостаточность может развиться в результате генетических дефектов или под воздействием каких-либо повреждающих факторов. По этому принципу выделяют первичные и вторичные иммунодефициты. Кроме того, в основу современной классификации иммунодефицитов положено преимущественное поражение того или иного звена иммунитета.
ПЕРВИЧНЫЕ ИММУНОДЕФИЦИТЫ
Первичные иммунодефициты (чаще врожденные) - редкие заболевания (1:10 000).
Возникновение первичных иммунодефицитов может быть связано:
1. С недостаточностью клеточного иммунитета:
• синдром Ди Джоржи (гипо-, аплазия тимуса);
• недостаточность CD3;
• синдром обнаженных лимфоцитов;
• недостаточность CD8 и др.;
2. С нарушениями гуморального иммунитета:
• Х-сцепленная агаммаглобулинемия;
• изолированный дефицит IgA;
• изолированный дефицит IgM;
3. С комбинированной недостаточностью гуморального и клеточного иммунитета:
• синдром Вискотта-Олдрича (мутация гена белка Х-хромосомы);
• Х-сцепленный тяжелый комбинированный иммунодефицит;
• синдром Гуда (веретеноклеточная тимома);
4. С метаболическими нарушениями:
• энтеропатический акродерматит (врожденное нарушение всасывания цинка);
5. С недостаточностью фагоцитов:
• недостаточность фагоцитов, обусловленная нарушением адгезии;
• синдром Чедиака-Хигаси;
6. С недостаточностью системы комплемента:
• наследственный ангионевротический отек.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ
Вторичные иммунодефициты - это количественные и качественные отклонения от физиологических функций в иммунной системе, снижающие надзор за структурным и функциональным гомеостазом организма, клинически проявляющиеся обострением и хронизацией заболеваний. Иммунодефициты являются фактором риска возникновения инфекционных, онкологических, аутоиммунных, аллергических и других заболеваний. Лекарственные средства, арсенал которых неуклонно растет, также могут быть причиной вторичного иммунодефицита. Это связано с тем, что они обладают модифицирующим влиянием на иммуногенез, включая супрессию и гиперстимуляцию. Такой эффект рассматривается как иммунотоксический и представляет собой разновидность неблагоприятных побочных реакций.
Классификация вторичных иммунодефицитов (основные группы) по Д.К. Новикову и В.И. Новикову (1994)
1. Комбинированные иммунодефициты.
2. Т-клеточные дефициты.
3. Преимущественно В-клеточные дефициты.
4. Дефекты естественных киллеров.
5. Дефициты макрофагов и гранулоцитов.
6. Дефициты системы комплемента.
7. Дефициты системы тромбоцитов.
Возникновение вторичных иммунодефицитов может быть связано со многими факторами
1. С хроническими рецидивирующими инфекционными заболеваниями (СПИД).
2. С вторичными иммунодефицитами при нарушениях гомеостаза:
- с сахарным диабетом;
- диализом или почечной недостаточностью;
- нефротическим синдромом;
- циррозом печени (печеночно-клеточная недостаточность);
- длительным, а также тяжелым дисбактериозом кишечника.
3. С вторичными иммунодефицитами при нарушениях питания:
- с хроническим дефицитом поступления белков, витаминов (B6, A, ВС) и микроэлементов (железо, цинк);
- реакцией вилочковой железы (тимуса) при голодании;
- повышением заболеваний и смертностью от инфекции при голодании (недоедание).
4. С вторичными иммунодефицитами при аутоиммунных заболеваниях:
- с системной красной волчанкой;
- ревматоидным артритом.
5. С вторичными иммунодефицитами, обусловленными средовыми воздействиями:
- с механической травмой;
- ожоговой травмой;
- ионизирующей радиацией (рентген и γ-излучения);
- ультрафиолетовым облучением;
- токсическими химическими соединениями;
- хроническими интоксикациями (алкоголизм, курение, наркомания).
6. С вторичными иммунодефицитами, обусловленными необоснованно длительным приемом препаратов, влияющих на иммунитет (гормональные препараты, иммуномодуляторы, цитостатики) и самолечением.
7. С вторичными иммунодефицитами, связанными с другими состояниями и заболеваниями:
- с кишечной лимфангиэктазией;
- аспленией или гипоспленизмом;
- аллогенным переливанием крови;
- беременностью;
- старением;
- стрессом.
Одна из важнейших задач врача, обследующего больных с вторичным иммунодефицитом, - установление возможных причин, способствовавших развитию данного патологического состояния. Это определяет выбор этиотропной терапии, как наиболее эффективного лечения любого патологического состояния. А назначение иммуномодуляторов служит лишь дополнительной составляющей комплексного воздействия.
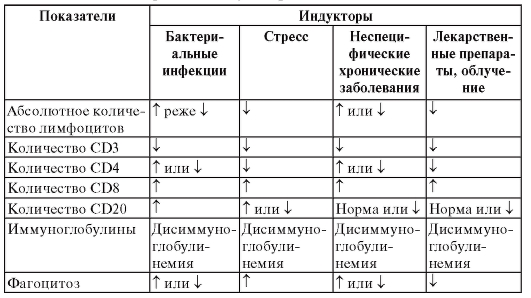
Характеристика вторичных иммунодефицитов приведена в табл. 171.
Характеристика вторичных иммунодефицитов
Таблица 171. Виды вторичных иммунодефицитов
Прогресс в области экспериментальной и клинической иммунологии способствовал разработке множества методов лабораторной диагностики нарушений иммунной системы. Полная оценка изменений иммунного статуса позволяет установить диагноз, выбрать адекватное лечение и осуществлять во время него динамический контроль. Ниже приведен перечень лабораторно-диагностических методов исследования иммунной системы, а также представлены подходы к оценке иммунограмм и выбору иммунотерапии.
ЛАБОРАТОРНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
ИММУННОЙ СИСТЕМЫ
Предварительное обследование
• Общий анализ крови.
• Определение в сыворотке крови содержания IgM, IgG. IgA, IgD и IgE.
Специализированное обследование
Подсчет моноцитов и лимфоцитов крови осуществляют с помощью моноклональных антител к следующим маркерам.
• Т-лимфоциты: CD3, CD4, CD8, антигенраспознающие рецепторы, состоящие из α- и β- или γ- и δ-цепей.
• β-Лимфоциты: CD19, СD20, CD21, мембранные IgM, IgG, IgA. IgD и IgE, α- и β-цепи, связанные с мембранными иммуноглобулинами.
• NK-лимфоциты: СD16.
• Моноциты: CD14.
• Маркеры активации лимфоцитов: HLA-DR, CD25, CD80.
Исследование функции Т-лимфоцитов
• Кожные пробы на аллергические реакции замедленного типа (с туберкулином, антигенами Candida albicans, гистоплазмином, столбнячным анатоксином).
• Оценка пролиферативного ответа на митогены (моноклональные антитела к CD3, фитогемаглютинин, конканавалин А) и аллогенные клетки (смешанная культура лимфоцитов).
• Оценка продукции цитокинов.
Исследование функции В-лимфоцитов
• Естественные антитела и антитела к широко распространенным антигенам: изогемагглютинины, антитела к вирусам (гриппа, краснухи, кори) и анатоксинам (дифтерийному и столбнячному).
• Оценка продукции антител к белковым (после иммунизации столбнячным анатоксином) и полисахаридным (после иммунизации пневмококковой вакциной и вакциной против Haemophilus influenzae типа В) антигенам.
• Определение концентрации подклассов IgG.
Исследование комплемента
• Оценка гемолитической активности комплемента и активации комплемента по альтернативному пути.
• Количественное определение С3, С4 и других компонентов комплемента.
Исследование функций фагоцитов
• Тест восстановления нитросинего тетразолия.
• Оценка хемотаксиса.
• Оценка бактерицидной активности.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА СОСТОЯНИЯ ИММУННОЙ СИСТЕМЫ ЧЕЛОВЕКА (СТАДИЙНЫЙ
ПОДХОД)
1. Оценка стадии распознавания антигена: изучение уровня Т-клеточного антиген-распознающего рецептора на лимфоцитах, процесса представления антигена, числа адгезивных молекул (интегрины, адгезины и др.) на клетках, смешанной культуры лимфоцитов, генного анализа аллотипов HLA (от Human leucocyte antigens - антигены тканевой совместимости), ТКР (Т-клеточные антигенраспознающие рецепторы).
2. Оценка стадии активации лимфоцитов: фенотипирование маркеров активации лимфоцитов (CD25, CD23, CD 69, HLA-DR) при стимуляции фагоцитарной активности, выявление вторичных мессенджеров [цАМФ, цГМФ, циклический аденозинтрифосфат (цАТФ)], изучение отвечаемости клеток иммунной системы на цитокины.
3. Оценка стадии пролиферации лимфоцитов: изучение ответа лимфоцитов на митогены, специфические антигены, факторы роста.
4. Оценка стадии дифференциации лимфоцитов (эффекторной функции): изучение продукции иммуноглобулинов, цитотоксической функции Т-лимфоцитов, натуральных киллеров, продукции цитокинов.
5. Оценка регуляции иммунного ответа: оценка хелперных и супрессорных функций лимфоидных клеток, анализ функциональных свойств Т-хелперов 1-го и 2-го типов и продуцируемых ими цитокинов.
ПРАВИЛА ОЦЕНКИ ИММУНОГРАММ КЛИНИЦИСТОМ (ЛЕБЕДЕВ К.А., ПОНЯКИНА И.Д., 1990)
1. Комплексный анализ иммунограммы более информативен, чем оценка каждого показателя в отдельности.
2. Полноценный анализ иммунограммы можно проводить лишь в комплексе с оценкой клинической картины у данного больного.
3. Реальную информацию в иммунограмме несут сильные сдвиги показателей; слабые сдвиги лишь позволяют повысить уверенность в правильности сделанного заключения.
4. Анализ иммунограммы в динамике как в диагностическом, так и в прогностическом отношении всегда более информативен, чем однократно полученная иммунограмма.
5. В подавляющем большинстве случаев анализ иммунограммы дает возможность делать ориентировочные, а не безусловные выводы диагностического и прогностического характера.
6. Первостепенную практическую значимость в иммунограмме имеют соотношения различных популяций и субпопуляций иммунокомпетентных клеток, а не их абсолютные значения.
7. Несоответствие сдвигов показателей иммунограммы клинической картине течения заболевания свидетельствует о тяжелом, неблагоприятном развитии процесса.
Основные точки приложения для иммуномодулирующих препаратов - это иммунокомпетентные клетки (макрофаги, естественные киллеры, нейтрофилы, Т- и В-лимфоциты), процессы взаимодействия таких клеток или их продуктов (антитела, цитокины) с соответствующими мишенями. Перед началом иммуномодулирующей терапии необходима оценка иммунного статуса пациента. Одна и та же клиническая картина у разных больных может быть обусловлена дефектами различных звеньев иммунитета. Иммунограмма служит основанием для начала иммунокоррекции и используется для оценки ее эффективности.
Назначение того или иного препарата, влияющего на иммунную систему, должно проводиться только врачом-специалистом. Необоснованное и бесконтрольное назначение ряда иммуномодуляторов часто и длительно болеющим пациентам может провоцировать развитие тяжелого аутоиммунного процесса или надолго «парализовать» иммунную систему, например продукцию собственных интерферонов, заблокировав противовирусную и противоопухолевую защиту.
ОБЩИЕ ПРИНЦИПЫ ПРИМЕНЕНИЯ ИММУНОМОДУЛЯТОРОВ
1. Иммуномодуляторы применяют как в сочетании с антибиотиками, противогрибковыми, противопротозойными или противовирусными средствами, тем самым нанося «двойной удар» по инфекционному агенту, так и в качестве монотерапии при иммунореабилитационных мероприятиях.
- Целесообразно раннее назначение иммуномодуляторов (с первого дня применения химиотерапевтического этиотропного средства).
- Выраженность эффекта иммуномодулирующей терапии при лечении в остром периоде заболевания больше, чем в стадию ремиссии.
- Действие любого иммуномодулятора многогранно: достаточно, например, активировать макрофаги, как выброс ими цитокинов приведет в движение всю иммунную систему.
2. Снижение одного какого-либо параметра иммунитета, выявленного при оценке иммунного статуса у практически здорового человека, не обязательно служит основанием для назначения ему иммуномодулирующего лечения. Показано динамическое наблюдение такого пациента.
КЛИНИКО-ФАРМАКОЛОГИЧЕСКИЕ ПОДХОДЫ
К ВЫБОРУ И ПРИМЕНЕНИЮ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРИ ВТОРИЧНЫХ ИММУНОДЕФИЦИТАХ
Цели лечения вторичных иммунодефицитов
• Восстановление физиологического функционирования иммунной системы.
• Устранение клинических проявлений заболевания.
• Достижение полного выздоровления или длительной клинической ремиссии.
• Уменьшение частоты рецидивов заболевания и профилактика обострений.
• Повышение качества жизни.
Принципы выбора лекарственных средств для лечения вторичных иммунодефицитов
• Первой группой выбора при вторичных иммунодефицитах служат лекарственные средства, обладающие этиотропным действием в отношении возбудителей инфекции, которые развились в результате утраты иммунной системой противоинфекционной и опухолевой защиты организма. Это антибактериальные, противовирусные и противоопухолевые препараты.
• Иммуномодуляторы представляют собой дополнительные средства в комплексном лечении вторичных иммунодефицитов. Их назначение оправдано в том случае, когда препараты первого выбора недостаточно эффективны вследствие неадекватного клинического состояния функционирования иммунной системы, при соблюде-
нии принципов назначения этиотропных противоинфекционных и противоопухолевых средств.
Основные принципы выбора иммуномодуляторов
• Выбор иммуномодулятора определяют результаты иммунологического исследования и клиническое состояние пациента.
• Целесообразно как можно раньше, с первого дня применения химиотерапевтического этиотропного средства, назначать иммуномодуляторы.
• Понижение какого-либо параметра иммунитета, выявленное при иммунодиагностическом исследовании у практически здорового человека, не обязательно служит основанием для назначения ему иммуномодулирующего воздействия.
• Эпидемиологически неблагоприятные ситуации какого-либо инфекционного заболевания служат показанием к широкому использованию иммуномодуляторов с профилактической целью без оценки иммунного статуса.
• Режим и доза иммуномодуляторов определяется индивидуально, адекватно клиническим проявлениям вторичного иммунодефицита и выявленному дефекту в иммунной системе.
• Иммуномодулирующее лечение должно проводиться курсами, количество которых и продолжительность интервалов определяются выраженностью клинических проявлений и степенью нарушения иммунитета.
• Контроль эффективности иммуномодулирующего лечения осуществляется лабораторно, по восстановлению показателей иммунитета, и клинически.
КЛИНИЧЕСКИЙ РАЗБОР
Больная В., 20 лет, обратилась с жалобами на рецидивирующие отеки голеней и стоп, кистей рук, лица и шеи, периодические боли в животе. Девушка страдает отеками с 12 лет - с периода полового созревания. Отеки провоцируют травмы, даже небольшие (тесная обувь), ОРВИ, стрессы. Посещение стоматолога всегда сопровождалось возникновением отека, который возникал и без введения местной анестезии, только при использовании медицинских инструментов. По материнской линии подобных отеков ни у кого не отмечалось, с отцом мать рассталась давно, и связь с ним и его родственниками утеряна. Отеки кистей рук и ног, лица и половых органов, а также эпизоды боли в животе повторялись до шести
раз в год: в течение нескольких часов нарастали, продолжались не более суток, и через 72 ч (после трех суток) исчезали. Четыре года назад пациентка была госпитализирована в хирургическое отделение с диагнозом «острый живот», проведена аппендэктомия, два года назад - прооперирована по поводу кисты яичника. После перенесенной 6 мес назад травмы головы отеки усилились, стали чаще возникать на лице, трансформируясь в отек гортани. Все случаи расценивались как рецидивирующая ангионевротическая реакция по типу отека Квинке, вводился эпинефрин, аминофиллин, хлоропирамин (супрастин), преднизолон, дексаметазон, фуросемид, клемастин (тавегил). Пациентка длительно планово получала, кетотифен, фексофенадин. Однако эффекта от проводимого лечения пациентка не отмечает. Улучшение наступало не ранее 72 ч при остром состоянии, а урежения частоты отеков при профилактическом приеме антигистаминных средств не наступали. После эпизода отека гортани было рекомендовано лечение преднизолоном 10 мг ежедневно в утренние часы. За 4 месяца его применения пациентка не отмечает значимого улучшения своего состояния. Комплексное обследование не выявило каких-либо отклонений в состоянии здоровья. Проводилось аллергологическое обследование: кожные тесты с бытовыми, пыльцевыми, пищевыми аллергенами отрицательны, IgE - в пределах нормы (10 МЕ/мл).
Пациентка замечает, что отеки никогда не сопровождаются покраснением и зудом, всегда плотной консистенции, болезненные, проявлений крапивницы никогда не было.
Данные анамнеза, отсутствие эффекта от проводимого лечения позволили заподозрить наследственный ангионевротический отек, и пациентка была обследована на содержание компонентов комплемента и ингибитора С1-эстеразы. Результаты иммунологического обследования: С3-0,2 г/л (норма 0,7-1,8 г/л), С4-0,05 г/л (норма 0,15-0,4 г/л); С1-ингибитор - 25% (норма 66-166%) подтвердили предположение. Больной назначен профилактический курс аминокапроновой кислоты в форме порошка в течение 6 мес по 1500 мг дважды в сутки под контролем свертывания крови с дальнейшим снижением дозы до 500 мг/сут. Преднизолон отменен. Даны письменные рекомендации о назначении свежезамороженной плазмы (200-300 мл) в острой ситуации при развитии выраженных отеков. На фоне лечения уменьшилась частота приступов, повысилось качество жизни пациентки. Из-за отсутствия информации по отцовской линии проследить наследственный характер заболевания и составить генеалогическое древо не удалось.
Алгоритмы оценки различных показателей при иммунодефицитах представлены на рис. 154-158).
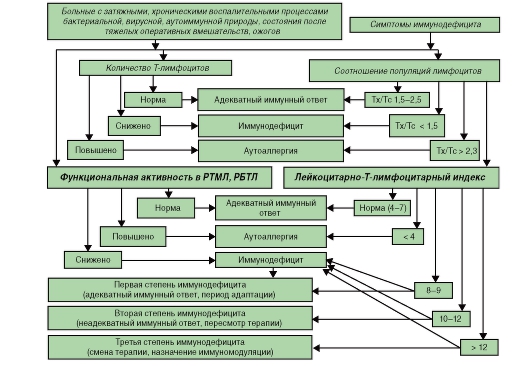
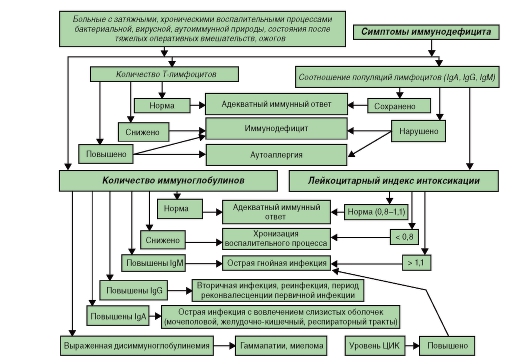
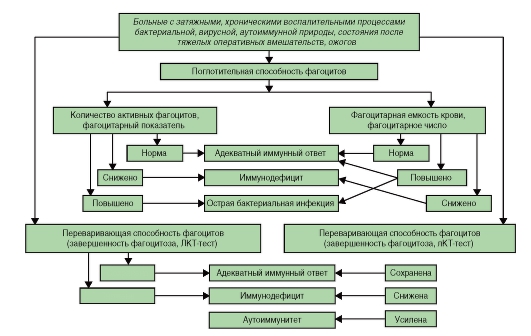
Рис. 156. Алгоритм оценки системы фагоцитоза при иммунодефицитах