Клиническая фармакология и фармакотерапия в реальной врачебной практике : мастер-класс : учебник / В. И. Петров. - 2011. - 880 с. : ил.
|
|
|
|
Глава 7. ОСОБЕННОСТИ СТАНОВЛЕНИЯ НАЦИОНАЛЬНОЙ СИСТЕМЫ МОНИТОРИРОВАНИЯ НЕБЛАГОПРИЯТНЫХ (ПОБОЧНЫХ) РЕАКЦИЙ ПРИ ПРИМЕНЕНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Разрешенные для применения препараты порой скрывают в себе новые неожиданные особенности, оборачивающиеся новыми нежелательными реакциями.
Тема мониторирования неблагоприятных (побочных) реакций при применении лекарственных средств на российских просторах в нашем национальном ее варианте весьма сложна и неоднозначна. Попытки создания и реформирования системы обратной связи в плане безопасности ЛС предпринимались неоднократно. Отдельные проекты возникали в недрах ряда государственных и общественных организаций, затухая и исчезая со временем по ряду причин. Слепое копирование существующих западных подходов и попытки идти своим собственным «уникальным» путем, работая на заграничные деньги и находясь на скудном государственном обеспечении.
Одно из известных определений неблагоприятной (побочной) реакции при применении ЛС (побочного эффекта ЛС) звучит как «вредный и непреднамеренный ответ на прием лекарственного средства, назначенного в обычных дозах человеку для профилактики, диагностики или терапии либо для изменения физиологических функций».
Причина необходимости контроля неблагоприятных (побочных) лекарственных реакций понятна и не вызывает сомнений. Они могут приводить к:
1) возникновению временной или стойкой нетрудоспособности;
2) госпитализации или продлению ее сроков;
3) необходимости дополнительной фармакотерапии;
4) росту материальных затрат на лечение;
5) гибели пациента.
Существуют хорошо известные в профессиональных кругах сообщения зарубежной статистики о том, сколько пациентов попадает на больничную койку из-за НЛР, и в какую сумму это обходится налогоплательщикам.
Проведенный исследователями анализ результатов амбулаторной фармакотерапии свидетельствует о высокой частоте развития неблагоприятных (побочных) реакций при применении ЛС. Единодушной позиции в этом вопросе нет, и результаты разных авторов имеют значительные отличия. Тем не менее многие исследователи показывают, что при развитии неблагоприятных (побочных) реакций при применении лекарственных средств лишь небольшая часть пациентов обращается за врачебной помощью.
В большинстве случаев это заканчивается временной нетрудоспособностью, а в худшем случае приводит к стойкой утрате трудоспособности или даже к смерти (рис. 55).
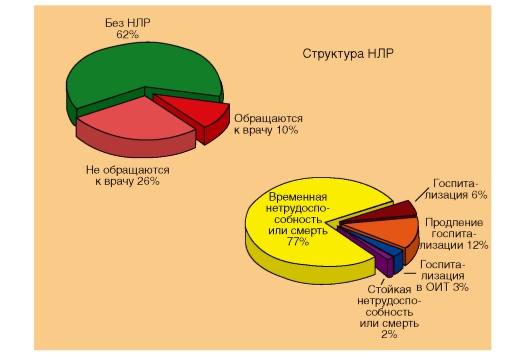
Рис. 55. Структура неблагоприятных (побочных) реакций при применении лекарственных средств
Почему мы нуждаемся в мониторинге лекарств, прошедших надлежащие клинические испытания?
Ответ ясен - данных самых скрупулезно выполненных клинических исследований недостаточно, чтобы оценить безопасность препарата: с печальной регулярностью серьезные и редкие нежелательные реакции многих медикаментов, внедряемых в клиническую практику, выявляют только после их широкого применения.
Следует заметить, что абсолютно безопасными на сегодняшний день могут быть только абсолютно неэффективные ЛС. Если учесть неблагоприятные (побочные) реакции, которые дают пациенты на плацебо, таких лекарств вообще просто не может быть.
Какова же цель мониторинга безопасности лекарственных средств? Это:
1) выявление новых, ранее неизвестных нежелательных реакций
ЛС;
2) внесение изменений в действующие инструкции по медицинскому применению ЛС;
3) сбор и анализ информации об особенностях развития, течения и лечения НЛР;
4) формирование и предоставление объективной информации вниманию медицинской общественности.
Последний пункт имеет принципиальное значение, поскольку объективная информация не всегда выгодна производителям лекарств, сокрытие ее части - одна из проблем современного фармацевтического бизнеса и фармацевтической науки.
Откуда берется информация о НЛР?
• Прежде всего, это данные клинических исследований. Они, как это положено, должны выявляться и обнародоваться производителем.
• Следующий этапный источник информации - данные постмаркетинговых клинических исследований. Они могут иметь разное происхождение, цели и заказчиков.
• Постоянный мониторинг (действующая в обществе система регистрации и учета НЛР - клинические фармакологи, аптечные работники, лечащие врачи).
• Ситуационный мониторинг (после появления предварительной информации о НЛР).
• Данные общественных и профессиональных организаций. Врачи, работающие в ЛПУ или самостоятельно (поскольку все
сегодня работают в едином правовом поле), собирают информацию в процессе лечебной практики (рис. 56).
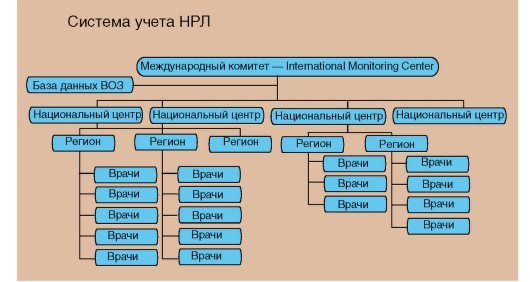
Рис. 56. Система учета неблагоприятных (побочных) реакций при применении лекарственных средств
Как в целом можно охарактеризовать систему учета НЛР?
• Прежде всего, она по-разному сформирована в государствах мира.
• Далеко не везде функционирует эффективно.
• Подвержена искажению информации со стороны производителей ЛС (речь идет об укрытии информации).
• Непрерывно совершенствуется - усилия ВОЗ (международный центр мониторинга безопасности ЛС) и отдельных национальных центров учета обработки данных о НЛР (FDA).
Для этого совершенствования существует причина: повсеместно отмечается рост частоты НЛР. Почему это происходит? Причин несколько.
1. В практику внедряются все новые препараты.
2. Мы, клинические фармакологи, боремся с полипрагмазией и нерациональным использованием ЛС, но эти проблемы по-прежнему присутствуют в лечебном процессе.
3. Медицинские ошибки.
4. Распространение некачественных и фальсифицированных ЛС.
5. Растущая сенсибилизация населения к биологически активным и химическим веществам.
6. Взаимодействие с другими ЛС и продуктами питания.
Надо отметить, что существующая кризисная ситуация с фармпроизводством в РФ имеет свое отражение в рассматриваемой проблеме:
1) в Российской Федерации до 90% ЛС - воспроизведенные; их регистрация осуществлялась на основании ограниченного числа клинических данных;
2) фрагментарно поступающая информация по вопросам безопасности ЛС касается только тех препаратов, которые применяются за рубежом;
3) вне поля действия системы остается весь спектр отечественных препаратов, доля которых на рынке превышает 64%;
4) данные о побочных эффектах зарубежных ЛС заимствуются из банка данных Центра ВОЗ;
5) фактически мы собираем информацию со всего мира, но только не в своей стране.
Особенность текущего момента состоит в том, что уже введен в действие Административный регламент Росздравнадзора, связанный с исполнением функции государственной регистрации ЛС - предусмотрено оформление бессрочных регистрационных удостоверений на ЛС.
Именно поэтому остро встала проблема создания условий для обеспечения эффективной работы по контролю безопасности ЛС с действующей регистрацией на территории РФ.
Обратимся к мировому опыту. Одной из веских причин создания системы мониторинга послужила талидомидовая трагедия. Данный препарат использовался на ранних сроках беременности в качестве успокаивающего и противорвотного средства. Его назначение, как выяснилось позднее, приводило к развитию врожденных аномалий, с которыми появились на свет около 10 тыс. детей. В 1962 г. медицинское применение талидомида было запрещено.
Обусловленная его использованием трагедия послужила серьезным толчком для создания системы мониторинга НЛР, способной предотвратить или хотя бы уменьшить масштабы подобных катастроф. В период с 1961 по 1965 г. во многих странах были основаны структуры для систематического сбора информации о неспецифических побочных реакциях лекарственных препаратов. Эти системы, основанные на посылаемых врачами спонтанных сообщениях, появились в Австралии, Канаде, Чехословакии, Ирландии, Нидерландах, Новой Зеландии, Швеции, Англии, США и Восточной Германии. Подобные системы сегодня действуют более чем в 60 государствах.
В 1968 г. в рамках ВОЗ был сформирован Центр мониторинга использования лекарственных средств. Его основными задачами были выявление частоты наиболее серьезных реакций и их раннее предупреждение.
С 1978 г. Центр мониторинга использования лекарственных средств перемещается в Швецию. Руководство и координацию программы по мониторингу лекарственных осложнений продолжает осуществлять центральное представительство ВОЗ в Женеве. Сегодня 56 стран участвуют в программе как полноценные члены и 67 - как временные.
В СССР реакцией на талидомидовую трагедию стало создание в 1969 г. Минздравом СССР Отдела учета, систематизации и экспрессинформации о побочном действии лекарственных средств. В 1973 г. отдел был преобразован во Всесоюзный организационно-методический центр по изучению побочных действий лекарственных средств. Он просуществовал до 1991 г., когда был упразднен вместе с Минздравом СССР. Таким образом, возможность получения достоверной и всесторонней информации о безопасности лекарств была утрачена. Этим в ряде случаев воспользовались, мягко говоря, недобросовестные фармацевтические фирмы, которые в рамках проведения агрессивной маркетинговой политики практически ничего не сообщали о возможных побочных реакциях продвигаемых ими препаратов.
В образовавшемся информационном вакууме в 1992-1995 гг. по инициативе Международного фонда по эффективным и безопасным лекарствам начал издаваться информационный бюллетень «Безопасность лекарств».
Позитивные изменения в сложившейся ситуации произошли в 1997 г., когда был создан Федеральный центр по изучению побочных действий лекарств Министерства здравоохранения РФ. Благодаря своей активности и большому объему проделанной работы деятельность этого центра получила высокую оценку международного медицинского сообщества, в результате чего Россия была принята в международную программу ВОЗ по мониторингу лекарств.
Как известно, 90-е годы были периодом, когда активной реорганизации подвергалась не только жизнь общества, но и органы управления, в том числе и в здравоохранении. В результате административных реорганизаций с 1999 г. роль Федерального центра РФ по изучению побочного действия лекарств стала играть лаборатория №2 Отдела токсикологии и изучения побочных действий лекарств Института доклинической и клинической экспертизы лекарств Научного центра экспертизы и государственного контроля лекарственных средств.
Работа этого отдела опирается на деятельность региональных центров по изучению побочного действия ЛС, которые начали создаваться с 1998 г. инициативными группами в ведущих региональных клиниках, на кафедрах клинической фармакологии и в административных органах.
Важным событием в становлении системы мониторинга побочного действия ЛС явилось принятие в 1998 г. Закона «О лекарственных средствах», который в статье 41 предписывает «субъектам обращения лекарственных средств» сообщать «...о всех случаях побочного действия лекарственных средств, которые не соответствуют сведениям о лекарственных средствах, содержащимся в инструкциях по их применению».
И снова реорганизация. В 2007 г. на базе подведомственной экспертной организации ФГУ «Научный центр экспертизы средств медицинского применения» был создан Российский федеральный центр мониторинга безопасности лекарственных средств.
Правильность выбранных приоритетов была подтверждена в ноябре 2007 г. решением ВОЗ о продолжении участия России в Программе ВОЗ по международному мониторингу лекарств. При этом Российский федеральный центр мониторинга лекарств был приглашен к активному сотрудничеству, что дало доступ к международной базе данных, содержащей более 4 млн сообщений о неблагоприятных побочных реакциях ЛС.
На прошедшей в конце 2007 г. коллегии было отмечено, что одной из важнейших задач по достижению качественной работы системы лекарственного мониторинга является создание региональных центров мониторинга безопасности. В самое ближайшее время планируется организация сети таких центров по всей России.
Обсуждая вопрос мониторинга НЛР в Российской Федерации, необходимо понимать важность применения в этой области фармакоэпидемиологических стандартов.
Одно из определений фармакоэпидемиологии звучит как «наука, изучающая эффективность, безопасность и использование лекарственных средств в реальных условиях на уровне популяции или больших групп людей, способствуя при этом рациональному и приемлемому с точки зрения соотношения «затраты / эффективность» применению наиболее эффективных и безопасных лекарственных средств». Только в РЕАЛЬНЫХ условиях, на УРОВНЕ ПОПУЛЯЦИИ ИЛИ БОЛЬШИХ ГРУПП, применяя ЕДИНЫЕ ПОДХОДЫ И СТАНДАРТЫ, ДОКАЗАВШИЕ СВОЮ ПРИМЕНИМОСТЬ, ФАРМАКОЭПИДЕМИОЛОГИЧЕСКИЕ МЕТОДЫ.
Каким же образом можно собирать информацию о НЛР? Существует несколько способов.
Постмаркетинговые исследования
Проводят по инициативе фирм-производителей. Изучение безопасности, как правило, не представляет собой основную задачу. Главное
достоинство метода - возможность определения частоты встречаемости побочных реакций, однако это возможно только при большом количестве испытуемых и правомерно для лекарственных осложнений, имеющих высокую частоту. Метод позволяет выявлять редкие побочные реакции лишь эпизодически, однако повышение качества лекарственного мониторинга связывают именно с более широким использованием этого метода.
Метод спонтанных сообщений
В России, как и в других странах, основной источник информации о НЛР - спонтанные сообщения. Метод заключается в добровольном информировании соответствующих структур практическими врачами или пациентами о предполагаемом побочном действии лекарства. Учитываются любые побочные реакции любых препаратов у всех групп больных. Как показывает практика, данный метод имеет низкий показатель регистрации побочных реакций. Кроме того, из-за отсутствия возможности квалифицированной оценки побочных эффектов ЛС, а также в связи с установлением достоверной связи между приемом препарата и развитием неблагоприятной реакции, результаты, полученные с помощью этого метода, носят преимущественно субъективный характер, хотя позволяют предположить масштаб проблемы, обусловленный приемом конкретного препарата.
Активный мониторинг стационара
Активный мониторинг стационара применяется в форме ретроспективного и проспективного анализа. Его, как правило, осуществляет врач - клинический фармаколог. Ретроспективный мониторинг (работа с архивом) позволяет изучить частоту и структуру НЛР. С помощью проспективного мониторинга (работа с лечащими врачами) можно получать информацию о группах риска развития тех или иных НЛР. Результаты мониторинга из-за специфики лекарственного обеспечения (определенный набор ЛС) наиболее актуальны лишь для того стационара, где он проводился.
Рецептурный мониторинг
Рецептурный мониторинг основан на сопоставлении количественной и качественной характеристик развившейся побочной реакции с количеством назначений ЛС в соответствии с выписанными рецептами. Чаще всего его используют для выявления НЛР у новых ЛС.
Мониторинг нежелательных лекарственных реакций в России
Законодательными актами предписаны мониторинг изменения состава, технологии, условий производства, выявления побочных действий, противопоказаний и наличия других изменений; мониторинг безопасности зарегистрированного ЛС, включающий как сбор спонтанных сообщений, так и предоставление держателем регистрационного удостоверения сведений, уточняющих режим дозирования и противопоказания на зарегистрированное ЛС. Мониторинг качества ЛС, находящихся в обращении: отчеты по новым ЛС необходимо предоставлять 2 раза в год в первые 2 года исследования, 1 раз в год в последующие 3 года и далее 1 раз в 5 лет, т.е. каждый раз при проведении повторной экспертизы.
Служба фармаконадзора предусматривала, наряду с федеральным центром мониторинга НЛР, организацию региональных центров во всех субъектах Федерации. Руководителям органов здравоохранения было поручено организовать учреждения, ответственные за сбор информации о побочных эффектах ЛС и за подготовку соответствующих рекомендаций. Однако на местах у многих руководителей еще нет понимания важности поставленной задачи: на данный момент центры созданы только в 30 из 89 регионов.
Система регистрации нежелательных лекарственных реакций в Российской Федерации: отдельно от всего мира
В советское время Всесоюзный центр по изучению побочных действий лекарств Минздрава СССР в период его работы получал ежегодно более 1000 сообщений о НЛР.
В настоящее время в банке данных Центра ВОЗ, куда ежегодно поступает более 200 тыс. сообщений о побочных реакциях лекарств, ассоциировано более 4 млн сообщений о НЛР.
Тем не менее система регистрации НЛР в РФ не работает в полном объеме, полностью не гармонизирована с международной системой мониторинга НЛР. Сама работа ведется разрозненно и без системного финансирования, отсюда независимые фармакоэпидемиологические исследования затруднены и носят локальный характер.
Отметим явные причины слабости отечественной системы регистрации НЛР, разделив их на федеральный и региональный уровни, отдельные ЛПУ и уровень лечащего врача.
Итак, прежде всего, федеральный уровень:
1. Участие в системе регистрации НЛР практически добровольно.
2. Нет объединения усилий регионов и отдельных центров и специалистов.
3. Важность темы недооценивается.
4. Принимаемые решения носят рекомендательный характер.
5. Нет согласительного национального документа по проблеме НЛР.
6. Нет единой информационной системы, базы данных НЛР зарегистрированных ЛС.
7. Невозможна аналитическая обработка информации с мест в режиме реального времени.
Теперь упомянем о причинах слабости системы регистрации НЛР на региональном уровне:
1. Учет НЛР не является обязательным.
2. Не влияет на основные показатели отчетности региона.
3. Не финансируется.
4. Есть много других важных задач.
5. По-разному представлены и обучены клинические фармакологи в регионах.
Похожи причины на уровне отдельного ЛПУ:
1. Учет НЛР не является обязательным.
2. Не влияет на основные показатели отчетности.
3. Не финансируется.
4. Как правило, нет специалиста - клинического фармаколога.
5. Сложившийся стереотип («наше дело - сторона»).
И последний «эшелон обороны» - наш многострадальный лечащий врач первичного или специализированного звена медицинской помощи:
1. Врач загружен избыточными формами отчетности.
2. Знания его о НЛР недостаточны (он забыл основы клинической фармакологии).
3. Он не обучен регистрации НЛР.
4. Не заинтересован материально и морально.
5. Всегда есть опасения о наказании (27,4% НЛР - по вине врача), т.е. система организована со значимой негативной обратной связью.
6. Отсутствие доступа к сборщику извещений.
7. Мало информирован об опыте коллег.
Какие же позиции из международного опыта можно перенять?
Мировой опыт выявления и оценки НЛР показывает, что на этапе доклинического и клинического исследования ЛС невозможно обнаружить и убедительно доказать наличие всех потенциально возможных побочных реакций. Жесткие критерии проведения мониторинга существуют во многих странах мира, при этом фармацевтические фирмы осуществляют тщательное наблюдение за своими препаратами и регулярно сообщают в экспертные органы данные об эффективности (постмаркетинговые исследования, наблюдения врачей, научные
статьи) и переносимости (частота и характер обнаруженных побочных реакций). Большое значение придается клиническим исследованиям ЛС IV фазы. В США по требованию FDA должны предоставляться результаты постмаркетинговых исследований по следующим разделам: клиническая безопасность, клиническая эффективность, клиническая фармакология (фармакокинетические и фармакодинамические исследования), неклинические (токсикологические) исследования, эпидемиологические исследования.
В Европе ответственность за предоставление полной и достоверной информации целиком возложена на юридическое лицо, ответственное за размещение ЛС на рынке. Периодичность предоставления отчета, резюме по безопасности зависит от времени пребывания ЛС в обращении. Так, в Европейском союзе (ЕС) необходимо представлять отчеты с периодичностью 1 раз в 6 мес в течение первых 2 лет, 1 раз в год в течение 3 последующих лет, а затем 1 раз в 5 лет одновременно с подачей заявки на перерегистрацию.
Сроки и требования к формату данных о неожиданных побочных эффектах ЛС уже гармонизированы и описаны в руководствах ICH GCP