Клиническая фармакология и фармакотерапия: учебник. - 3-е изд., перераб. и доп. / под ред. В. Г. Кукеса, А. К. Стародубцева. - 2012. - 840 с.: ил.
|
|
|
|
Глава 29. ФАРМАКОТЕРАПИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ
29.1. ВИДЫ ИНФЕКЦИЙ И СИМПТОМЫ ИНФЕКЦИОННОГО ПРОЦЕССА
При всех инфекционных заболеваниях можно выделить несколько групп признаков и симптомов, которые позволяют установить диагноз.
Общие симптомы, характерные для большинства случаев инфекций:
- повышение температуры тела, озноб;
- симптомы интоксикации (недомогание, общая слабость, потливость, потеря аппетита, тошнота, рвота, мышечные боли).
Выраженность общих симптомов может существенно изменяться в зависимости от тяжести инфекции. При ограниченной инфекции общие симптомы отсутствуют.
Местные симптомы, появление которых зависит от локализации инфекции, например: боль в грудной клетке, кашель с мокротой, одышка - при пневмонии; боль в поясничной области, частые позывы на мочеиспускание - при пиелонефрите.
Лабораторные симптомы: при бактериальной инфекции - обычно лейкоцитоз, нейтрофилез, сдвиг лейкоцитарной формулы влево, увеличение скорости оседания эритроцитов, резкое повышение концентрации С-реактивного белка в крови1.
О развитии инфекции свидетельствуют также результаты ряда инструментальных исследований. Например, рентгенография органов грудной клетки дает ценную информацию при диагностике
1 Лейкоцитоз - увеличение общего количества лейкоцитов в крови; нейтрофилез - увеличение числа нейтрофилов (подвида лейкоцитов, принимающих участие в защите организма от бактериальных инфекций); сдвиг формулы влево - появление в крови незрелых форм нейтрофилов, что свидетельствует об активной продукции этих клеток в костном мозге; лейкопения - снижение количества лейкоцитов (характерна для тяжелого течения бактериальной инфекции и ряда вирусных инфекций), увеличение СОЭ может косвенно указывать на активный воспалительный процесс.
пневмонии или туберкулеза, результаты микроскопического исследования мочи позволяют поставить диагноз мочевой инфекции.
Для каждого инфекционного заболевания существуют свои критерии, по которым устанавливают диагноз. Например, для пневмонии решающее значение имеют результаты дополнительных методов исследования: диагноз этого заболевания может быть установлен только при наличии специфической инфильтрации (затемнения) на рентгеновском снимке. Однако для установления диагноза целого ряда инфекций достаточно клинических симптомов. Окончательным признаком, свидетельствующим об инфекционном процессе, считают выделение возбудителя в тканях и физиологических жидкостях организма, а также результаты серологического исследования - выявление в крови больного антител к микроорганизмам.
Понятие нозокомиальной инфекции
В зависимости от места возникновения все инфекции можно разделить на внебольничные и нозокомиальные (внутрибольничные, госпитальные). К нозокомиальной инфекции относят заболевания, возникавшие в условиях лечебного учреждения (через 48 ч после госпитализации больного или позже). Выделение нозокомиальной инфекции в отдельную группу обусловлено особым характером возбудителей. Например, обычную (внебольничную) пневмонию, как правило, вызывают пневмококки, чувствительные к пенициллину и другим бета-лактамным препаратам. Нозокомиальную пневмонию чаще вызывают другие микроорганизмы - стафилоккоки, синегнойная палочка, клебсиеллы, причем в большинстве случаев эти микроорганизмы устойчивы к целому ряду антибиотиков. Нозокомиальная инфекция передается в стационарах от одного больного к другому, при этом выживают только штаммы1, обладающие природной или приобретенной устойчивостью к антибиотикам. Это обстоятельство требует особого подхода к этиологическому лечению нозокомиальных инфекций, кроме того, нозокомиальная инфекция, как правило, протекает тяжелее и имеет более серьезный прогноз.
1 Штамм - культура микроорганизмов одного вида, выделенная из общего источника и обладающая определенными общими свойствами (способность возбуждать инфекционный процесс, резистентность к антибиотикам).
Виды антибактериальной терапии
Специфические возбудители вызывают заболевания со строго определенной клинической картиной: бледная трепонема - сифилис, мико-бактерия туберкулеза - туберкулез, но есть заболевания, которые могут быть вызваны целым рядом различных неспецифических возбудителей: пневмония, пиелонефрит, отит (оппортунистические инфекции).
Антимикробная терапия, в свою очередь, бывает двух видов: этио-тропная и эмпирическая. Этиотропная терапия - целенаправленное применение антимикробных препаратов против установленного возбудителя инфекционного процесса. Этот вид лечения считают наиболее рациональным. Эмпирическая терапии - применение антимикробных препаратов до получения сведений о возбудителе и его чувствительности к этим препаратам. В большинстве случаев острой инфекции врач вынужден прибегать к эмпирической терапии из-за того, что идентификация возбудителя требует нескольких суток и не всегда возможна. Выбор препарата для эмпирической терапии проводят с учетом наиболее вероятных возбудителей данной инфекции, например наиболее частый возбудитель пневмонии - пневмококк.
Общие принципы эмпирической терапии
Для повышения эффективности эмпирической терапии следует придерживаться определенных принципов применения антибактериальных препаратов.
• Выбор препарата должен быть основан на точном диагнозе. Знание диагноза позволяет определить предполагаемого возбудителя.
• Следует избегать необоснованного назначения антибактериальных препаратов, например, при вирусной инфекции.
• Предпочтение следует отдавать препаратам с более узким спектром действия, направленным на предполагаемый возбудитель.
• Антибактериальные препараты необходимо назначать с учетом особенностей их фармакокинетики (биодоступность, распределение, проникновение через физиологические барьеры, концентрация в жидкостях и тканях организма, метаболизм, скорость выведения).
Фармакокинетика и фармакодинамика антибактериальных препаратов
В микробиологии выделяют понятие минимальной ингибирую-щей концентрации (МИК) - минимальная концентрация антибио-
тика, способная подавить видимый рост микроорганизмов in vitro. Чем меньше значение МИК, тем больше чувствительность микроорганизма к препарату. Антимикробное действие антибиотиков зависит от создания и поддержания определенной концентрации препарата в очаге инфекции, при этом эффективная концентрация препарата должна превышать величину МИК.
Эффективность антибактериальных препаратов зависит от следующих факторов (рис. 29-1):
- T >МИК - время, в течение которого концентрация препарата в тканях превышает величину МИК;
- величина пиковой концентрации (ПК) - максимальная концентрация антибиотика в крови;
- величина площади под кривой «время - концентрация» (AUC - area under curve).
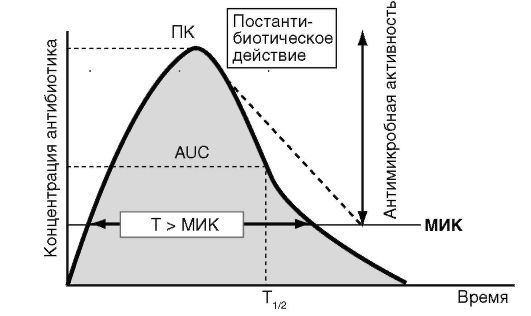
Рис. 29-1. Фармакокинетические/фармакодинамические параметры антимикробных препаратов
Ряд препаратов эффективны только при T >МИК больше 50% от интервала между очередными дозами препарата. Другие препараты обладают постантибиотическим действием - способностью подавлять размножение организмов даже после того, как концентрация препаратов в организме снижается. Для таких антибиотиков критерием эффективности считают отношение ПК/МИК или АиС/МИК. Таким образом, по антимикробной активности все антибактериальные препараты можно разделить на три основные группы.
• Эффективность зависит от дозы. Препараты, имеющие выраженный постантибиотический эффект. Антимикробная активность определяется созданием высокой пиковой концентрации (например, аминогликозиды). Эффективность этих ЛС в основном зависит от величины соотношений AUC/МИК или ПК/МИК. Эти препараты, как правило, имеют большой интервал дозирования.
• Эффективность зависит от продолжительности действия. Препараты, эффективность которых зависит от продолжительности действия и имеющие минимальное постантибиотическое действие (β-лактамы). В этом случае основным параметром эффективности считают отношение T >МИК. Для таких препаратов необходимо постоянное превышение МИК, следовательно, их необходимо вводить чаще. К таким препаратам относят большинство β-лактамных антибиотиков и макролиды (кроме азитромицина).
• Эффективность зависит и от дозы, и от продолжительности действия. В третьей группе эффективность определяется как продолжительностью действия, так и концентрацией (фторхинолоны, тетрациклины). Таким образом, основным фармакокинетиче-ским/фармакодинамическим параметром эффективности можно считать соотношение AUC/МИК.
Еще одним важным параметром, определяющим эффективность антимикробных средств, считают их способность проникать в очаг инфекции, т.е. преодолевать гистогематические барьеры (гематоэн-цефалический и пр.), проникать в ткани (например, в костную ткань хорошо проникают линкозамиды), клетки (на внутриклеточных возбудителей воздействуют макролиды), а также не терять активность в кислой среде, возникающей в воспалительном очаге.
Контроль эффективности антибактериальной
терапии
К критериям клинической эффективности относят нормализацию температуры тела, исчезновение общих и местных симптомов инфекции. Из лабораторных показателей об эффективности лечения свидетельствует снижение количества лейкоцитов (в первую очередь нейтрофилов), уменьшение концентрации С-реактивного белка и уменьшение СОЭ. При ряде инфекций важную информацию об эффективности лечения можно получить при рентгенологическом исследовании пораженных органов или с помощью других методов
визуализации (УЗИ, компьютерной томографии, эндоскопического исследования).
При оценке микробиологической эффективности необходимо учитывать возможность:
- эрадикации возбудителя - исчезновения первоначального возбудителя;
- суперинфекции - появления в ходе лечения нового возбудителя;
- рецидива - повторного появления возбудителя;
- реинфекции - появления нового вида, нового серотипа или нового биотипа возбудителя после эрадикации первоначального;
- колонизации - присутствия микроорганизмов в месте локализации инфекции без признаков активного инфекционного процесса.
Контроль безопасности антибактериальной
терапии
Для оценки безопасности применения любого антимикробного препарата существуют клинические и лабораторные методы обнаружения НЛР, т.е. любых неблагоприятных событий, возникших в период приема препарата.
Кроме клинического контроля развития НЛР необходимо проводить лабораторный контроль, при этом метод зависит от имеющихся сведений о препарате и имеющегося опыта работы с ним. Соответственно при применении препаратов, обладающих нефро-токсическим действием, необходимо контролировать функцию почек (по концентрации креатинина в крови), например выявление нефро-токсического действия аминогликозидов по повышению концентрации креатинина более чем на 50% от первоначальных данных, на фоне приема препарата. Для выявления гепатотоксического действия определяют активность печеночных ферментов (АЛТ, АСТ), например выявление гепатотоксического действия пефлоксацина при увеличении активности печеночных ферментов (АЛТ, АСТ) более чем в 2,5-3 раза.
Одним из методов оценки безопасности фармакотерапии также считают терапевтический лекарственный мониторинг - контроль концентрации ЛС в плазме крови с целью подбора индивидуального
режима дозирования препарата. Этот метод используют при приеме аминогликозидов, ванкомицина.
Регистрация НЛР может потребовать прекращения проводимого лечения или нет. Тактика зависит от тяжести зарегистрированных
НЛР.
29.2. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
ПЕНИЦИЛЛИНОВ
Класс β-лактамов включает в себя пенициллины, цефалоспори-ны, монобактамы и карбапенемы. Все эти препараты объединяет наличие в структуре молекулы β-лактамного кольца, что объясняет одинаковый механизм действия, сходные механизмы резистентности, а также целый ряд общих свойств данных препаратов (бактерицидное действие, синергизм с аминогликозидами, низкую токсичность, возможность перекрестной аллергии).
Пенициллин был открыт Александром Флемингом в 1928 г., но коммерческое производство бензилпенициллина (пенициллина G) стало доступным только в 1940-е годы. После идентификации 6-аминопеницилланового ядра было создано большое количество производных, обладающих различными преимуществами в сравнении с бензилпенициллином: по спектру активности, стабильности к действию β-лактамаз, фармакокинетике.
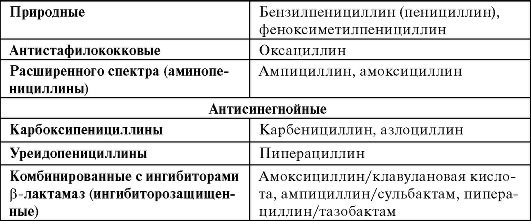
Пенициллины разделяют на группы в зависимости от спектра активности (табл. 29-1).
Механизм действия β-лактамных препаратов заключается в нарушении образования клеточной стенки бактерий путем необратимого связывания с пенициллиносвязывающими белками (ПСБ). Эти белки по своей природе - ферменты, обеспечивающие синтез клеточной стенки бактерий. Нарушение их функции вызывает гибель микробной клетки. Таким образом, пенициллины обладают бактерицидными свойствами. Особенно чувствительны к пенициллинам грамположительные бактерии с толстой клеточной стенкой.
Таблица 29-1. Классификация пенициллинов
Резистентность к β-лактамам возможна у большинства микроорганизмов и обусловлена разнообразными механизмами.
Первый механизм - в большей степени бактерии защищаются от действия антибиотиков путем продукции ферментов - β-лактамаз. Эти ферменты нарушают целостность β-лактамного кольца, что приводит к инактивации антибиотиков. β-Лактамазы часто вырабатывают такие микроорганизмы, как стафилококки, кишечная палочка, гонококки, анаэробы.
β-лактамазы разделяют:
- по субстратному профилю - пенициллиназы, цефалоспорина-зы, карбапенемазы;
- по локализации в микробной клетке генов, кодирующих продукцию β-лактамаз: хромосомные и плазмидные.
Из всех β-лактамных препаратов только карбапенемы отличаются высокой стабильностью к гидролизу всеми хромосомными и плаз-мидными β-лактамазами, в том числе β-лактамазы расширенного спектра действия.
Для преодоления резистентности, связанной с продукцией β-лактамаз, были разработаны соединения, способные подавлять активность этих ферментов, так называемые ингибиторы β-лактамаз, - кла-вулановую кислоту, сульбактам и тазобактам. Их используют при создании комбинированных (ингибиторозащищенных) пенициллинов (амоксициллин/клавулановая кислота, ампициллин/сульбактам и др.), а также цефалоспоринов (цефоперазон/сульбактам), но сами по себе антимикробной активностью они не обладают.
Второй механизм - изменение ПСБ участка микробной клетки, на которую действует антибиотик (модификация мишени). Это ведет
к тому, что антибиотик не может связаться с мишенью, на которую направлена его активность. Примером таких микроорганизмов можно считать пенициллинорезистентный пневмококк.
Третий механизм - синтез дополнительного ПСБ (механизм «обходного пути»). При этом, несмотря на действие антибиотика, жизнедеятельность микроорганизма не нарушается. Такой механизм характерен для стафилококков, устойчивых к метициллину®, оксацил-лину и другим пенициллинам и цефалоспоринам.
Четвертый механизм - нарушение проницаемости клеточной стенки для β-лактамов. Такой механизм обеспечивает устойчивость синегнойной палочки к β-лактамам.
Фармакокинетика
Основные фармакокинетические свойства пенициллинов следующие:
• сохраняют активность в очаге воспаления (при низком рН, концентрации О2, высокой концентрации белка, большом количестве лейкоцитов);
• плохо проникают в моноциты и через гематоэнцефалический барьер при отсутствии воспалительного процесса;
• менее активны в отношении колоний с высокой концентрацией бактерий;
• как правило, безопасны при беременности.
Наиболее высокой биодоступностью (93%) обладают специальные растворимые таблетки амоксициллина - флемоксин солютаб*.
Бензилпенициллин, карбокси- и уреидопенициллины в значительной степени разрушаются в желудке, из-за этого их вводят только парентерально. Феноксиметилпенициллин, оксациллин и аминопенициллины более кислотоустойчивы, их можно назначать внутрь. Наилучшее всасывание из ЖКТ характерно для амок-сициллина - 75-93%, в то же время его биодоступность не зависит от пищи. Всасывание феноксиметилпенициллина составляет 40-60% (при приеме натощак концентрация в крови несколько выше). Хуже всасываются ампициллин (35-40%) и оксациллин (25-30%), причем пища значительно снижает их биодоступность. Всасывание ингибитора β-лактамаз - клавулановой кислоты - составляет 75%.
Бензилпенициллина новокаиновую соль* и бензатина бензил-пенициллин вводят только внутримышечно. Медленно всасыва-
ясь из места инъекции, они создают более низкие, по сравнению с натриевой и калиевой солями бензилпенициллина, концентрации в сыворотке крови. Обладают пролонгированным действием, их иногда называют «депо-пенициллины». Терапевтическая концентрация бензилпенициллина новокаиновой соли* в крови сохраняется на протяжении 18-24 ч, а бензатина бензилпеницил-лина - 3-4 нед.
Пенициллины распределяются во многих органах, тканях и биологических жидкостях. Создают высокие концентрации в легких, почках, слизистой оболочке кишечника, репродуктивных органах, костях, плевральной и перитонеальной жидкости. Наиболее высокая концентрация в желчи характерна для уреидопенициллинов. проникают через плаценту и в грудное молоко. Плохо проходят через гематоэнцефалический и гематоофтальмический барьер, а также в предстательную железу. При менингите проницаемость гематоэн-цефалического барьера увеличивается.
Клинически значимой биотрансформации в печени могут подвергаться оксациллин (до 45%) и уреидопенициллины (до 30%). Другие пенициллины практически не подвергаются метаболизму и выводятся из организма в неизмененном виде. Среди ингибиторов β-лактамаз наиболее интенсивно биотрансформируется клавулановая кислота (около 50%), в меньшей степени - сульбактам (около 25%), еще слабее - тазобактам.
Большинство пенициллинов экскретируется почками. Их Т1 / 2 составляет в среднем около 1 ч (кроме «депо-пенициллинов») и значительно возрастает при почечной недостаточности. Оксациллин и уреидопенициллины выводятся двумя путями - через почки и желчевыводящие пути. Их Т1 / 2 в меньшей степени изменяется при нарушении функций почек.
Почти все пенициллины полностью удаляются при гемодиализе. Концентрация пиперациллин/тазобактама снижается при проведении гемодиализа на 30-40%.
Спектр активности пенициллинов
Природные пенициллины
Все препараты из группы природных пенициллинов обладают идентичным спектром активности против следующих микроорганизмов. • Грамположительные аэробные кокки (кроме стафилококков) и палочки:
- стрептококки (за исключением пневмококка и некоторых штаммов зеленящих стрептококков) - возбудители фарингита, тонзиллита, флегмоны, рожистого воспаления, эндокардита, синусита, отита;
- энтерококки - возбудители инфекций мочевых путей, сепсиса, эндокардита (встречаются резистентные штаммы);
- Corynebacterium diphteriae - возбудитель дифтерии;
- Bacillus antracis - возбудитель сибирской язвы;
- листерии.
• Грамотрицательные микроорганизмы:
- менингококки;
- некоторые штаммы гонококков;
- большинство бактерий рода Leptospira;
- спирохеты (Treponema pallidum - возбудитель сифилиса, Borrelia burgdorferi - возбудитель болезни Лайма);
- анаэробные микроорганизмы (кроме Bacteroides spp.).
• Actinomices israelii - возбудитель актиномикоза.
• Клостридии - возбудители газовой гангрены, столбняка.
Антистафилококковые пенициллины
Основной антибиотик этой группы - оксациллин. По антимикробному спектру он близок к природным пенициллинам, но уступает им по активности в отношении большинства микроорганизмов. Оксациллин устойчив к действию стафилококковой пенициллиназы, следовательно, активен в отношении пенициллинорезистентных стафилококков. Исходя из этого стафилококковые инфекции (абсцессы, эндокардит, остеомиелит, флегмона) считают основным показанием к назначению данного препарата. Однако необходимо помнить о наличии так называемых метициллиноустойчивых штаммов стафилококков (MRSA - meticillin resistant staphylococcus aureus), устойчивых как к пенициллинам, так и цефалоспоринам.
Аминопенициллины
В начале применения в клинической практике аминопенициллины имели преимущество по сравнению с природными пенициллинами, в основном благодаря действию на грамотрицательные палочки - представители семейства Enterobacteriacea (возбудителей кишечных инфекций): E. mli, шигелл, сальмонелл, а также энтерококков, P. mirabilis, H. pylori (только амоксициллин), листерий. Однако в настоящее время все больше видов приобретают устойчивость к аминопенициллинам.
К ампициллину устойчивы большинство штаммов шигелл, клебси-елл, 30-50% E. coli, значительная часть P. mirabilis, разной степенью устойчивости обладает H. influenza, встречаются резистентные штаммы сальмонелл. Следует помнить, что аминопенициллины разрушаются всеми β-лактамазами, и применение комбинации с β-лактамазами значительно расширяет спектр действия аминопенициллинов.
Ингибиторозащищенные аминопенициллины
Антимикробный спектр ингибиторозащищенных аминопеницил-линов (амоксициллин/клавулановая кислота, ампициллин/сульбак-там) расширен за счет микроорганизмов, резистентность которых к аминопенициллинам обусловлена выработкой некоторых видов β-лактамаз - стафилококков, гонококков, гемофилов, E. coli, P. mirabilis, клебсиелл, P. vulgaris, C. diversus, а также некоторых анаэробов (в том числе группы B. fragilis).
Карбоксипенициллины
Спектр действия карбенициллина и в отношении грамположи-тельных бактерий в целом совпадает с таковым других пеницилли-нов, но уровень активности ниже. Карбоксипенициллины действуют на некоторые штаммы P. aeruginosa и Proteus spp. Следует учитывать, что многие штаммы P. aeruginosa уже устойчивы к антибиотикам этой группы. Эффективность карбоксипенициллинов ограничена способностью многих бактерий к выработке β-лактамаз, разрушающих эти антибиотики.
Ингибиторозащищенные карбоксипенициллины
Тикарциллин/клавулановая кислота имеет более широкий антимикробный спектр в сравнении с тикарциллином за счет стафилококков, клебсиелл, протеев, анаэробов. Однако необходимо иметь в виду, что тикарциллин/клавулановая кислота не имеет преимуществ перед тикарциллином по действию на P. aeruginosa.
Уреидопенициллины
Азлоциллин и пиперациллин обладают сходным спектром и практически равноценным уровнем антибактериальной активности. По действию на грамположительные бактерии они существенно превосходят карбоксипенициллины и приближаются к природным пенициллинам и аминопенициллинам. Уреидопенициллины высокоактивны в отношении многих грамотрицательных бакте-
рий семейства Enterobacteriaceae, не вырабатывающих β-лактамаз, большинства штаммов Citrobacter spp., Klebsiella spp., Enterobacter spp., P. aeruginosa и других неферментирующих бактерий (Burkholderia cepacia, Stenotrophomonas maltophilia).
Ингибиторозащищенные уреидопенициллины
Самостоятельное клиническое значение уреидопенициллинов достаточно ограничено, что объясняется их лабильностью к действию большинства β-лактамаз как стафилококков, так и грамотри-цательных бактерий.
Этот недостаток в значительной степени компенсирован у инги-биторозащищенного препарата - пиперациллин/тазобактам, обладающего наиболее широким спектром (все анаэробные бактерии) и высоким уровнем антибактериальной активности среди всех пени-циллинов. Однако штаммы, вырабатывающие β-лактамазы расширенного спектра действия, устойчивы к пиперациллину/тазобактаму.
Показания к применению
Природные пенициллины
В зависимости от особенностей и тяжести течения инфекции возможно применение природных пенициллинов для парентерального введения (обычных или пролонгированных) или приема внутрь при следующих состояниях.
• Инфекции, вызванные стрептококками, и их последствия (тон-зиллофарингит, скарлатина, рожистое воспаление), а также для круглогодичной профилактики ревматизма.
• Менингококковая инфекция.
• Сифилис.
• Лептоспироз.
• Клещевой боррелиоз.
• Газовая гангрена.
• Актиномикоз.
• Профилактика бактериального эндокардита перед стоматологическими процедурами.
Поскольку пролонгированные пенициллины не создают высоких концентраций в крови и практически не проникают через гемато-энцефалический барьер, они не применяются для лечения тяжелых инфекций. Показания к их применению включают в себя только
лечение сифилиса (кроме нейросифилиса), длительную профилактику ревматической лихорадки, рожистого воспаления, скарлатины.
Феноксиметилпенициллин применяют для лечения легких и среднетяжелых стрептококковых инфекций (тонзиллофарингит, рожистое воспаление).
Из-за нарастания устойчивости гонококков к пенициллину его эмпирическое применение при гонорее не оправдано.
Оксациллин
Показан при подтвержденных или предполагаемых стафилококковых инфекциях различной локализации: кожи, мягких тканей, костей и суставов; пневмонии, инфекционном эндокардите, сепсисе.
Аминопенициллины и ингибиторозащищенные аминопенициллины
Основные показания к применению этих препаратов совпадают. Назначение аминопенициллинов более обосновано при легких и неосложненных инфекциях, а их ингибиторозащищенных производных - при более тяжелых или рецидивирующих формах, а также наличии данных о высокой частоте распространения β-лактамазапродуцирующих бактерий. Путь введения (парентерально или внутрь) выбирают в зависимости от тяжести инфекции. Для приема внутрь более целесообразно назначать амоксициллин или амоксициллин/клавулановая кислота.
Препараты данной группы применяют для лечения внебольнич-ных бактериальных инфекций:
- верхних и нижних дыхательных путей (средний отит, синусит, обострение хронического бронхита, внебольничная пневмония);
- внебольничных инфекций мочевыводящих путей, вызванных энтерококком (острый цистит, пиелонефрит);
- менингита, вызванного гемофильной палочкой или Listeria monocytogenes (ампициллин в высокой дозе внутривенно);
- эндокардита (ампициллин в сочетании с гентамицином или стрептомицином) и его профилактики;
- кишечных инфекций - шигеллеза, сальмонеллеза (ампициллин в больших дозах); эрадикации H. pylori (амоксициллин).
Дополнительными показаниями считают инфекции кожи и мягких тканей, органов малого таза, интраабдоминальные инфекции, периоперационную профилактику в хирургии.
Карбоксипенициллины,уреидопенициллины и их ингибиторозащищенные соединения
Карбоксипенициллины в настоящее время потеряли клиническое значение и практически полностью вытеснены пиперацил-лином или комбинированными препаратами (тикарциллин/клаву-лановая кислота, пиперациллин/тазобактам). Уреидопенициллины (азлоциллин, пиперациллин) в сочетании с аминогликозидами применяют при синегнойной инфекции (в случае чувствительности P. aeruginosa).
Пиперациллин/тазобактам назначают при лечении тяжелых, преимущественно нозокомиальных, смешанных (аэробно-анаэробных) инфекций различной локализации, например дыхательных путей (нозокомиальные пневмонии, включая вентиляционную; эмпиема плевры, абсцесс легкого); кожи и мягких тканей (включая диабетическую стопу); интраабдоминальных и тазовых инфекций; послеродовых гнойно-септических осложнений; инфекций желчевыводя-щих путей, желчного перитонита, абсцессов печени; осложненных инфекций мочевыводящих путей; инфекций на фоне нейтропении; раневых и ожоговых инфекций.
Нежелательные лекарственные реакции
Обычно пенициллины хорошо переносятся. Наиболее частыми НЛР пенициллинов считают аллергические реакции: крапивницу, сыпь, отек Квинке, лихорадку, эозинофилию, бронхоспазм, анафилактический шок (чаще при введении бензилпенициллина). Аллергия имеет перекрестный характер ко всем антибиотикам пенициллино-вой группы. У некоторых пациентов с аллергией на цефалоспорины может отмечаться аллергия и на пенициллины. Необходимо учитывать данные аллергологического анамнеза, в сомнительных случаях проводить кожные пробы со специальными аллергенами, приготовленными на основе метаболитов пенициллина. Пациентам с аллергией на прокаин (новокаин*) нельзя назначать бензилпенициллина новокаиновую соль*. При появлении признаков аллергической реакции (сыпи) во время лечения пенициллинами следует немедленно отменить антибиотик.
При применении аминопенициллинов иногда отмечается неаллергическая «ампициллиновая» макулопапулезная сыпь, которая не сопровождается зудом и может исчезнуть без отмены препарата. «Ампициллиновая» сыпь отмечается у 75-100% пациентов
с инфекционным мононуклеозом, получающих аминопеницил-лины.
Могут появляться неврологические симптомы: головная боль, тремор, судороги (чаще у детей и у пациентов с почечной недостаточностью при применении карбенициллина или очень высоких доз бензилпенициллина); психические расстройства (при введении высоких доз бензилпенициллина новокаиновой соли*).
Со стороны ЖКТ иногда отмечают боли в животе, тошноту, рвоту, диарею, псевдомембранозный колит (чаще при применении ампициллина и ингибиторозащищенных пенициллинов). При приеме оксациллина в дозах более 6 г/сут или ингибиторозащищенных пенициллинов могут появляться НЛР со стороны печени.
При применении высоких доз калиевой соли бензилпенициллина у пациентов с почечной недостаточностью, а также при ее сочетании с калийсберегающими диуретиками, препаратами калия или ИАПФ может развиваться гиперкалиемия. При назначении карбеницилли-на, высоких доз натриевой соли бензилпенициллина может развиться гипернатриемия, что сопровождается появлением или усилением отеков у пациентов с сердечной недостаточностью, повышением АД.
При парентеральном введении пенициллинов возможны местные реакции: болезненность и инфильтраты при внутримышечном введении (особенно калиевой соли бензилпенициллина), флебиты при внутривенном введении (чаще при применении карбеницилли-на).
Введение «депо-пенициллинов» (бензилпенициллина новокаино-вая соль* и бензатина бензилпенициллин) может приводить к развитию сосудистых осложнений: синдрома Онэ (ишемия и гангрена конечностей при введении в артерию), синдрома Николау (эмболия сосудов легких и головного мозга при введении в вену). Для предотвращения подобных осложнений следует соблюдать правила введения «депо-пенициллинов»: препараты вводят строго внутримышечно в верхний наружный квадрант ягодицы; пациент во время инъекции должен находиться в горизонтальном положении; непосредственно перед введением препарата необходимо потянуть поршень шприца на себя для предотвращения попадания в сосуд.
Возможны гематологические реакции: анемия, нейтропения (чаще при введении оксациллина); нарушение агрегации тромбоцитов, иногда - тромбоцитопения (при применении карбенициллина, реже - уреидопенициллинов).
Очень редко отмечается транзиторная гематурия (оксациллин); интерстициальный нефрит.
Взаимодействие с другими препаратами
Пенициллины нельзя смешивать в одном шприце или в одной инфузионной системе с аминогликозидами из-за их физико-химической несовместимости.
При сочетании ампициллина с аллопуринолом возрастает риск развития «ампициллиновой» сыпи. Оксациллин проявляет антагонизм к рифампицину.
Применение высоких доз калиевой соли бензилпенициллина в сочетании с калийсберегающими диуретиками, препаратами калия или ИАПФ повышает риск развития гиперкалиемии. Необходимо соблюдать осторожность при сочетании антисинегнойных пеницил-линов с антикоагулянтами и антиагрегантами из-за потенциального риска повышения кровоточивости. Не рекомендовано сочетание с тромболитиками.
29.3. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ЦЕФАЛОСПОРИНОВ
Цефалоспорины - один из самых обширных классов антибиотиков. Наиболее распространена классификация цефалоспоринов по поколениям (табл. 29-2), внутри каждого поколения выделяют препараты для парентерального применения и приема внутрь.
Механизм действия такой же, как и других β-лактамных препаратов.
Таблица 29-2. Классификация цефалоспоринов

Окончание табл. 29.2
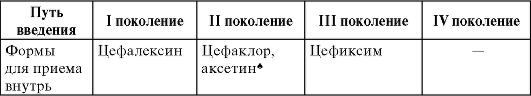
* Препараты с антисинегнойной активностью.
** Сочетание цефоперазона с ингибитором β-лактамаз - сульбактамом, обладает антисинегнойной и антианаэробной активностью.
Фармакокинетика
Цефалоспорины для парентерального применения и приема внутрь значительно различаются по своим фармакокинетическим характеристикам.
Цефалоспорины для приема внутрь быстро и хорошо всасываются из ЖКТ, биодоступность составляет от 40-50% (цефиксим) до 95% (цефалексин, цефаклор). Одновременный прием с пищей замедляет скорость всасывания цефаклора, цефиксима и цефтибутена, но не снижает биодоступность этих препаратов. Аксетин* представляет собой пролекарство, гидролизуется в ЖКТ с высвобождением активного цефуроксима, причем пища способствует этому процессу.
Цефалоспорины распределяются во многих органах, тканях и биологических жидкостях (легкие, почки, печень, мышцы, кожа и мягкие ткани, кости, синовиальная, плевральная, перикардиаль-ная и перитонеальная жидкость). Цефалоспорины III (цефотаксим, цефтриаксон и цефтазидим), а также IV поколения (цефепим) хорошо проникают через гематоэнцефалический барьер и подходят для лечения менингитов. Цефалоспорин II поколения цефу-роксим проникает через ГЭБ только при воспалении мозговых оболочек.
Большинство цефалоспоринов не подвергаются метаболизму. Исключением считают цефотаксим, 50% введенной дозы которого подвергается биотрансформации с образованием активного метаболита - дезацетилцефотаксима, обладающего антимикробной активностью и более длительным (по сравнению с цефотаксимом)
Т1 / 2 (1,5 ч).
Т1 / 2 большинства цефалоспоринов составляет 1-2 ч, что определяет необходимость назначения антибиотиков этой группы 3-4 раза в сутки. Больший Т1 / 2 (3-4 ч) характерен для цефалоспоринов III поколения - цефиксима и цефтибутена и их принимают 1 раз
в сутки. Наибольшим Т1/2 обладает препарат III поколения цефтри-аксон (до 5-7 ч), который при большинстве инфекций назначают 1 раз в сутки, а при менингите - 1-2 раза в сутки.
Большинство цефалоспоринов выделяются почками в неизмененном виде, создавая высокие концентрации в моче. Цефтриаксон и цефоперазон имеют двойной путь выведения (печень и почки).
Спектр активности
Следует отметить «пробелы» в спектре активности, характерные для всех цефалоспоринов. Они не активны в отношении MRSA, энтерококков, листерий, микобактерий, внутриклеточных возбудителей (легионелл, хламидий, микоплазм).
По активности против анаэробов большинство цефалоспори-нов обладают умеренным действием на фузобактерии, пептококки, пептстрептококки и не действуют на неспорообразующие анаэробы группы В. fragilis.
Цефалоспорины I поколения (ЦС-I) имеют узкий спектр антимикробной активности, напоминающий спектр аммиопеницил-линов.
Цефалоспорины II поколения (ЦС-II) отличаются от ЦС-I более высокой активностью против грамотрицательных микроорганизмов (гонококков, менингококков, H. influenzae, M. catarrhalis, E. coli, P. mirabilis, P. vulgaris, Klebsiella spp.), S. pneumoniae, по действию на стафилококков и стрептококков близки к ЦС-I. Следует отметить, что ЦС-II для приема внутрь - цефаклор менее активен против гемо-фил и пневмококков, чем цефуроксим. Несмотря на хорошую активность in vitro, ЦС-II не применяют для лечения кишечных инфекций и менингита вследствие большей эффективности цефалоспоринов III поколения (цефотаксима и цефтриаксона).
Цефалоспорины III поколения (ЦС-III) обладают более высокой, чем ЦС-I-II поколения, активностью в отношении грамотрица-тельных микроорганизмов (гонококков, менингококков, гемофил, M. catarrhalis, представителей семейства Enterobacteriaceae), пневмококков (в том числе пенициллинорезистентных штаммов), высоко активны против других стрептококков, но несколько уступают ЦС-I-II поколения по антистафилококковой активности.
Необходимо отметить, что все ЦС-III не действуют на представителей семейства Enterobacteriaceae, имеющих механизмы приобретенной резистентности: продуцирующие β-лактамазу расширенного
спектра действия штаммы E. coli и K. pneumoniae, штаммы энтеробак-тера, цитробактера, серрации и провиденции, являющиеся гиперпродуцентами хромосомных β-лактамаз класса AmpC.
Среди ЦС-III поколения два препарата - цефоперазон и особенно цефтазидим обладают клинически значимой антисинегнойной активностью. Однако по активности против стрептококков и пневмококков антисинегнойные цефалоспорины уступают цефуроксиму, цефотаксиму и цефтриаксону.
Цефоперазон/сульбактам (сочетание антисинегнойного ЦС-III - цефоперазона с ингибитором β-лактамаз - сульбактамом) отличается высокой активностью против β-лактамазапродуцирующих микроорганизмов: грамотрицательных бактерий семейства Enterobacteriaceae, ацинетобактера, B. fragilis и других неспороо-бразующих анаэробов.
ЦС-III для приема внутрь (цефиксим и цефтибутен) обладают более узким спектром активности, чем парентеральные препараты того же поколения. Прежде всего это касается активности против пенициллинорезистентных пневмококков и связано с относительно невысокой биодоступностью и меньшей степенью аффинности этих препаратов к ПСБ.
Цефалоспорины IV поколения (ЦС-IV) (цефепим) более активны в сравнении с ЦС-III в отношении штаммов Enterobacteriaceae, особенно против энтеробактера, цитробактера, серрации и провиден-ции, продуцирующих хромосомные AmpC β-лактамазы; P. aeruginosa и стафилококков. По действию на пневмококки, другие стрептококки, анаэробы, ЦС-IV близки к ЦС-III. Обладают большей устойчивостью к β-лактамазам по сравнению с ЦС-III.
Показания к применению
Принимая во внимание различия в спектре антимикробной активности и фармакокинетических показателей цефалоспоринов разных поколений, а также препаратов одного поколения для парентерального применения и приема внутрь можно выделить следующие основные показания к их назначению.
ЦС-I в настоящее время применяют для лечения инфекций, вызванных стрептококками (но не пневмококками и энтерококками) и метициллиночувствительными стафилококками. Так, цефазолин применяют для лечения внебольничных инфекций кожи и мягких
тканей, костей и суставов, а также для периоперационной профилактики в хирургии.
Основные показания для назначения ЦС-I для приема внутрь:
- стрептококковый тонзиллофарингит;
- внебольничные инфекции кожи и мягких тканей, костей и суставов легкой и средней степени тяжести, вызванные чувствительными к ним стрептококками и стафилококками.
Применение ЦС-I при инфекциях мочевыводящих и дыхательных путей в настоящее время нельзя считать рациональным, что обусловлено узким спектром активности, распространением устойчивости среди наиболее вероятных возбудителей и появлением в клинической практике более эффективных антибактериальных препаратов.
ЦС-II можно назначать при всех состояниях, перечисленных для ЦС-I, а также при следующих заболеваниях:
- инфекциях верхних дыхательных путей (остром среднем отите, остром синусите);
- инфекциях нижних дыхательных путей (обострении хронического бронхита, внебольничной пневмонии);
- инфекциях мочевыводящих путей (остром цистите, пиелонефрите).
Цефуроксим считают альтернативой цефазолину в качестве анти-биотикопрофилактики в хирургии. Цефуроксим и аксетин* успешно назначают при проведении ступенчатой терапии.
Цефаклор уступает аксетину* по активности в отношении респираторных возбудителей (пневмококков и гемофилов), недостаточно хорошо проникает в жидкость среднего уха и не рекомендован для лечения острых средних отитов.
ЦС-III назначают для лечения тяжелых внебольничных и нозоко-миальных инфекций по следующим показаниям.
• Тяжелые инфекции верхних дыхательных путей (острый и хронический синусит - при необходимости парентерального введения).
• Тяжелые инфекции нижних дыхательных путей (внебольничная и нозокомиальная пневмония).
• Абсцесс легкого и эмпиема плевры (в сочетании с антианаэробными препаратами).
• Инфекции желчевыводящих путей.
• Тяжелые внебольничные и нозокомиальные инфекции мочевы-водящих путей.
• Интраабдоминальные и тазовые инфекции (в сочетании с антианаэробными препаратами).
• Кишечные инфекции (шигеллез, сальмонеллез).
• Тяжелые инфекции кожи, мягких тканей, костей и суставов.
• Бактериальный менингит (вызванный гемофилами, пневмококком, энтерококками, менингококками).
• Сепсис.
• Гонорея.
Эти препараты можно назначать для лечения некоторых инфекций в амбулаторной практике, например при острой гонорее (цеф-триаксон), а также остром среднем отите у детей (цефтриаксон 1 раз в сутки внутримышечно курсом на 3 сут).
ЦС-III с антисинегнойной активностью (цефоперазон, цеф-тазидим) применяют при инфекциях, вызванных P. aeruginosa. Антисинегнойные ЦС-III обычно становятся одним из обязательных компонентов комбинированной антибиотикотерапии инфекций на фоне нейтропении. Данные препараты обладают более низкой активностью против S. pneumoniae, из-за чего не рекомендованы для лечения пневмококковых инфекций.
Цефоперазон/сульбактам назначают при тех же показаниях, что и цефоперазон, однако он имеет преимущества при лечении абсцессов легких, эмпиемы плевры, интраабдоминальных и тазовых, а также вызванных бактериями рода ацинетобактер инфекций благодаря высокой антианаэробной активности.
Назначение ЦС-III-IV для периоперационной профилактики в хирургии нерационально прежде всего вследствие их недостаточной активности против S. aureus.
Показания к назначению ЦС-III для приема внутрь (цефиксима и цефтибутена) ограничены и включают в себя случаи ступенчатой терапии после применения парентеральных ЦС-III, инфекции мочевыводящих путей (особенно у детей, беременных и кормящих), дыхательных путей (цефтибутен не рекомендован при возможной пневмококковой этиологии).
ЦС-IV применяют для лечения тяжелых, преимущественно нозо-комиальных инфекций, вызванных резистентными возбудителями (энтеробактериями - энтеробактером, цитробактером, серрацией и провиденцией, резистентными к ЦС-II-III из-за гиперпродукции хромосомных AmpC β-лактамаз; а также Р. aeruginosa), в том числе пневмонии, осложненных инфекций мочевыводящих путей, кожи, мягких тканей, костей, суставов, интраабдоминальных и тазо-
вых инфекций (в сочетании с антианаэробными препаратами), при менингите, сепсисе и нейтропенической лихорадке.
Нежелательные лекарственные реакции
В целом цефалоспорины хорошо переносятся. Наиболее частая НЛР цефалоспоринов - аллергия (крапивница, кореподобная сыпь, лекарственная лихорадка, эозинофилия, сывороточная болезнь, анафилактический шок). Возможна перекрестная аллергия между цефа-лоспоринами и пенициллинами.
При приеме цефалоспоринов возможны гематологические реакции (лейкопения, гемолитическая анемия). Цефоперазон может вызывать гипопротромбинемию со склонностью к кровотечениям и дисульфирамоподобный синдром (повышение чувствительности к алкоголю).
Со стороны ЖКТ могут отмечаться боли в животе, тошнота, рвота, диарея, описаны случаи развития псевдомембранозного колита, со стороны печени возможно обратимое повышение активности трансаминаз, возникновение холестаза и псевдохолелитиаза (при применении цефтриаксона).
При назначении цефалоспоринов парентерально могут возникать местные реакции: болезненность и инфильтраты при внутримышечном, флебиты - при внутривенном введении.
Взаимодействие с другими препаратами
Цефалоспорины не рекомендуют смешивать с другими препаратами в одном шприце или инфузионной системе, необходимо четко следовать инструкциям производителя по использованию определенных растворителей. На всасывание цефалоспоринов для приема внутрь в кишечнике может влиять пища; одновременный прием антацидов снижает их всасывание, интервалы между приемом этих препаратов должны быть не менее 2 ч.
При сочетании ЦС с аминогликозидами или петлевыми диуретиками, особенно у пациентов с нарушениями функций почек, возможно повышение риска нефротоксичности.
При сочетании цефоперазона с антикоагулянтами, антиагреган-тами и тромболитиками увеличивается риск развития кровотечений.
Цефоперазон обладает дисульфирамоподобным эффектом, следовательно, недопустимо принимать алкоголь во время приема этого препарата.
29.4. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ АЗТРЕОНАМА
Единственный представитель монобактамов (моноциклических β-лактамов), применяемый в клинической практике, - азтреонам.
Фармакокинетика
Азтреонам вводят только парентерально. Он хорошо проникает в различные биологические жидкости, органы и ткани. Не подвергается метаболизму, выводится преимущественно почками (55-74%), Т1/2 составляет 1,5-2 ч, практически не изменяется при циррозе печени, а при почечной недостаточности увеличивается до 6-8 ч.
Азтреонам хорошо переносится. При применении азтреонама не отмечено аллергических реакций у пациентов с гиперчувствительностью немедленного типа к пенициллинам, но описаны редкие случаи перекрестной аллергии с цефтазидимом.
При почечной недостаточности необходима коррекция дозы азтре-онама.
Спектр активности
Азтреонам обладает узким спектром антимикробной активности - действует только на грамотрицательные аэробные бактерии: нейссерии, гемофилы, M. catarrhalis, энтеробактерии (E. coli, энтеробактеры, протей, клебсиеллы, серрации, провиденции и др.) и P. aeruginosa. Азтреонам не действует на грамположительные бактерии и анаэробы.
Показания к применению
Азтреонам применяют для лечения инфекций, вызванных аэробными грамотрицательными бактериями, как альтернативу аминогликозидам. Его можно назначать в сочетании с пеницилли-нами и цефалоспоринами (кроме имипенема), аминогликозидами, фторхинолонами, линкозамидами, ванкомицином, метронидазо-лом.
29.5. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ КАРБАПЕНЕМОВ
Карбапенемы, как пенициллины и цефалоспорины, содержат в своей структуре β-лактамное кольцо и благодаря этому входят в семейство β-лактамов. В России применяют два антибиотика из группы карбапенемов: имипенем и меропенем.
Фармакокинетика
Карбапенемы не всасываются при приеме внутрь. После парентерального введения быстро и в высокой концентрации распределяются в жидкостях и тканях организма, включая ликвор. Выделяются почками путем гломерулярной фильтрации. Одной из особенностей имипенема считают его гидролиз в почках ферментом дегидропепти-дазой I, разрушающей 60-95% введенной дозы препарата. При этом концентрация активного препарата в моче недостаточна для эради-кации возбудителей при инфекциях мочевыводящих путей. Для снижения метаболизма имипенема в почках применяют ингибитор дегидропептидазы I - циластатин, обладающий сходным с имипене-мом фармакокинетическим профилем. В настоящее время имипенем назначают в сочетании с циластатином (1:1) под торговым названием тиенам*. В отличие от имипенема меропенем стабилен к действию дегидропептидазы I.
Спектр активности
Карбапенемы обладают целым рядом микробиологических особенностей, выгодно отличающих их от других β-лактамов: наиболее широким спектром активности из всех β-лактамов; устойчивостью к действию плазмидных и хромосомных β-лактамаз; низкой частотой приобретенной резистентности; отсутствием перекрестной резистентности с пенициллинами и цефалоспоринами.
Имипенем и меропенем обладают самым широким спектром активности из всех известных антибактериальных препаратов, который включает в себя подавляющее большинство клинически значимых аэробных и анаэробных бактериальных возбудителей.
В отношении грамотрицательных микроорганизмов меропенем более активен по сравнению с имипенемом. Однако меропенем менее активен, чем имипенем, в отношении грамположительных микроор-
ганизмов. Карбапенемы высокоактивны в отношении пневмококков, в том числе пенициллинорезистентных штаммов, анаэробов, включая возбудителей интраабдоминальных инфекций.
Показания к применению
Широкий спектр антимикробной активности карбапенемов в отношении грамположительных и грамотрицательных, аэробных и анаэробных микроорганизмов делает их препаратами для эмпирической монотерапии тяжелых, угрожающих жизни инфекций.
• Нозокомиальные инфекции.
• Тяжелые инфекции полимикробной этиологии (особенно вызванные ассоциациями аэробов и анаэробов) мягких тканей, костей.
• Инфекции дыхательных путей.
• Инфекции брюшной полости и малого таза.
• Осложненные инфекции мочевыводящих путей, при невозможности назначения фторхинолонов.
• Инфекции у пациентов с нейтропениями.
• Бактериальный менингит (только меропенем).
• При неэффективной эмпирической терапии тяжелых инфекций у пациентов, получавших другие антибиотики.
Имипенем и меропенем при назначении в одинаковых дозах обладают равной клинической эффективностью. Монотерапию карба-пенемами считают такой же действенной, а в ряде случаев превосходящей по эффективности традиционно применяемые препараты и их сочетания.
Нежелательные лекарственные реакции
Карбапенемы характеризуются хорошей переносимостью и низкой частотой развития НЛР. Наиболее часто отмечают реакции в месте введения препаратов и со стороны ЖКТ: диарею, тошноту и рвоту. Диспепсические явления чаще возникают при назначении имипене-ма, следовательно, его следует вводить в виде длительной внутривенной капельной инфузии (0,5 г в течение 20-30 мин). При применении меропенема тошнота и рвота отмечаются реже, что позволяет вводить его внутривенно струйно.
У пациентов с аллергией на β-лактамы возможно развитие перекрестной аллергической реакции немедленного типа (анафилактический шок, отек Квинке, крапивница) к карбапенемам.
В очень редких случаях при назначении имипенема отмечают повышение судорожной готовности, что может приводить к возникновению судорог у 0,2-1,5% тех пациентов, которые имеют определенные факторы риска (черепно-мозговая травма, нарушение мозгового кровообращения, эпилепсия; почечная недостаточность; пожилой возраст; превышение рекомендованных доз имипенема). Меропенем не влияет на порог судорожной готовности, что позволяет применять его для лечения менингита.
Взаимодействие с другими препаратами
При приготовлении растворов карбапенемов для парентерального введения следует использовать только рекомендованные производителями растворители. Недопустимо смешивать карбапенемы с другими препаратами в одной инфузионной системе.
Карбапенемы нельзя сочетать с другими β-лактамами (пеницил-линами, цефалоспоринами и азтреонамом) из-за антагонизма.
При одновременном применении имипенема/циластатина с циклоспорином или теофиллином увеличивается риск развития судорог, особенно у лиц пожилого возраста и пациентов со значительными нарушениями функций почек.
29.6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ АМИНОГЛИКОЗИДОВ
Аминогликозиды - один из классов антибиотиков, давно применяемых в клинической практике. Несмотря на появление новых антибактериальных препаратов, они незаменимы при лечении ряда инфекций. Аминогликозиды имеют бактерицидные свойства. В настоящее время выделяют три поколения аминогликозидов (табл. 29-3).
Таблица 29-3. Классификация аминогликозидов

Механизм действия
Аминогликозиды - бактерицидные антибиотики. Проникая через цитоплазматическую мембрану бактериальной клетки и связываясь с 30S и 50S субъедицами бактериальных рибосом, аминогликози-ды нарушают синтез белка бактериальной клетки. Таким образом, для развития антибактериального эффекта необходимо проникновение аминогликозидов внутрь бактерии. Этот процесс может нарушаться в анаэробной среде или при уменьшении рН, а назначение антибиотиков, нарушающих синтез клеточной стенки, наоборот, усиливает антимикробный эффект аминогликозидов.
Фармакокинетика
К характерным особенностям фармакокинетики аминогликози-дов относят:
- плохое всасывание из ЖКТ;
- быстрое достижение пиковой концентрации после внутривенного и внутримышечного введения;
- плохое проникновение в клетки (кроме внутреннего уха и коркового вещества почек);
- плохое проникновение в ЦНС и ткани глаза;
- хорошее распределение во внеклеточной жидкости, проникновение в полости и серозные жидкости организма;
- выраженный постантибиотический эффект, что позволяет назначать аминогликозиды один раз в сутки (кроме эндокардита, асцита, беременности);
- необходимость терапевтического лекарственного мониторинга;
- при беременности назначают только по строгим показаниям в случае невозможности применения других антибиотиков.
При приеме внутрь аминогликозиды практически не всасываются, поэтому их вводят только парентерально (кроме неомицина). После внутримышечного введения препараты этой группы всасываются быстро и полностью. Максимальные (пиковые) концентрации достигаются через 30 мин после окончания внутривенной инфузии и через 0,5-1,5 ч после внутримышечного введения. Аминогликозиды не подвергаются биотрансформации.
Пиковые концентрации аминогликозидов индивидуальны у различных пациентов, поскольку зависят от объема распределения. Объем распределения, в свою очередь, зависит от массы тела, объема
жидкости и жировой ткани, состояния больного. Например, у пациентов с обширными ожогами, асцитом объем распределения ами-ногликозидов повышен. Однако при дегидратации или мышечной дистрофии он уменьшается.
Аминогликозиды распределяются во внеклеточной жидкости, включая сыворотку крови, экссудат абсцессов, асцитическую, пери-кардиальную, плевральную, синовиальную, лимфатическую и пери-тонеальную жидкость. Способны создавать высокие концентрации в органах с хорошим кровоснабжением: печени, легких, почках (где они накапливаются в корковом веществе). Низкие концентрации отмечаются в мокроте, бронхиальном секрете, желчи, грудном молоке. Препараты этой группы плохо проходят через гематоэнцефалический барьер. Проницаемость мозговых оболочек при воспалении несколько увеличивается. У новорожденных в ликворе достигаются более высокие концентрации, чем у взрослых. Аминогликозиды выводятся почками путем клубочковой фильтрации в неизмененном виде, создавая высокие концентрации в моче. Скорость экскреции зависит от возраста, функций почек и сопутствующей патологии. У пациентов с лихорадкой она может увеличиваться, при снижении скорости фильтрации значительно замедляется. У пожилых пациентов в результате возрастного снижения клубочковой фильтрации экскреция также может замедляться. Период полувыведения всех аминогликозидов у взрослых с нормальными функциями почек составляет 2-4 ч, у новорожденных - 5-8 ч, у детей - 2,5-4 ч. При почечной недостаточности период полувыведения может возрастать до 70 ч и более.
Правила дозирования аминогликозидов
Для взрослых пациентов существует два режима парентерального назначения аминогликозидов: традиционный, когда их вводят 2-3 раза в сутки, и однократное введение всей суточной дозы.
Однократное введение всей суточной дозы аминогликозида позволяет оптимизировать лечение препаратами этой группы. По данным многочисленных клинических исследований, эффективность лечения при однократном режиме назначения аминогликозидов соответствует таковой при традиционном, а нефротоксичность выражена в меньшей степени. К тому же при однократном введении суточной дозы снижаются экономические затраты. Однако такой режим назначения аминогликозидов нельзя использовать при лечении бактериального эндокардита.
На выбор дозы аминогликозидов оказывают влияние такие факторы, как масса тела пациента, локализация и тяжесть инфекции, состояние почек.
При парентеральном введении дозы всех аминогликозидов необходимо рассчитывать на килограмм долженствующей массы тела. Учитывая, что аминогликозиды плохо распределяются в жировой ткани, пациентам с массой тела, превышающей идеальную более чем на 25%, необходимо скорректировать дозу. При этом рассчитанную на фактическую массу тела суточную дозу следует эмпирически снизить на 25%. В то же время у истощенных пациентов дозу увеличивают на 25%.
При менингите, сепсисе, пневмонии и других тяжелых инфекциях назначают максимальные дозы аминогликозидов, при инфекциях мочевыводящих путей - минимальные или средние дозы. Максимальные дозы не следует назначать пожилым пациентам.
У больных почечной недостаточностью дозы аминогликозидов должны быть снижены. Это достигают либо снижением разовой дозы, либо увеличением интервалов между введениями.
Поскольку фармакокинетика аминогликозидов нестабильна и зависит от целого ряда факторов, для достижения максимального клинического эффекта при одновременном снижении риска развития нежелательных реакций проводят терапевтический лекарственный мониторинг.
Спектр активности
Для аминогликозидов II и III поколения характерна дозозависи-мая бактерицидная активность против следующих возбудителей.
• Аэробные грамотрицательные микроорганизмы:
- представители семейства Enterobacteriaceae (E. coli, Proteus spp., Klebsiella spp., Enterobacter spp., Serratia spp);
- неферментирующие грамотрицательные палочки (P. aeruginosa, Acinetobacter spp).
• Стафилококки, кроме метициллинорезистентных штаммов.
• Возбудители микобактериальных инфекций. Стрептомицин действует на M. tuberculosis, в то время как амикацин более активен против M. avium и других атипичных микобактерий.
• Стрептомицин и гентамицин действуют на некоторые штаммы энтерококков и стрептококков (обычно в сочетании с ингибиторами клеточной стенки).
• Стрептомицин активен против возбудителей особо опасных инфекций: чумы, туляремии, а также бруцеллеза.
Аминогликозиды не активны в отношении S. pneumoniae, S. malto-philia, B. cepacia, облигатных анаэробов (Bacteroides spp., Clostridium spp.). Более того, резистентность S. pneumoniae, S. maltophilia и B. cepacia к аминогликозидам можно использовать при идентификации этих микроорганизмов.
Несмотря на то, что аминогликозиды in vitro активны против гемо-фил, шигелл сальмонелл, легионелл, клиническая эффективность при лечении инфекций, вызванных этими возбудителями, не была установлена.
Показания к применению
Основное клиническое значение аминогликозиды имеют при лечении нозокомиальных инфекций, вызванных аэробными грамотри-цательными возбудителями, а также при лечении бактериального эндокардита. Показаниями к назначению аминогликозидов считают следующие состояния.
• Нозокомиальные пневмонии.
• Сепсис.
• Перитонит.
• Бактериальный эндокардит.
• Тяжелый пиелонефрит до идентификации возбудителя.
• Менингит, вызванный устойчивыми к β-лактамным антибиотикам грамотрицательными бактериями.
• Микобактериальные инфекции (туберкулез).
• Чума, туляремия (стрептомицин).
• Ожоги, язвы, дерматозы (местно).
Неомицин как наиболее токсичный среди аминогликозидов применяют только внутрь и местно.
Аминогликозиды нельзя назначать при лечении внебольничных пневмоний как в амбулаторных, так и в стационарных условиях. Это связано с отсутствием активности этой группы антибиотиков против основного возбудителя - пневмококка.
Применение аминогликозидов при лечении шигеллезов и сальмо-неллезов (как внутрь, так и парентерально) неэффективно, что обусловлено отсутствием действия против возбудителей, локализованных внутриклеточно.
Аминогликозиды не рекомендуют применять для лечения стафилококковых инфекций, поскольку существуют другие более эффективные, но менее токсичные антистафилококковые препараты.
Аминогликозиды не подходят для лечения неосложненных инфекций мочевыводящих путей, за исключением случаев, когда возбудитель устойчив к другим, менее токсичным антибиотикам.
Нежелательные лекарственные реакции
К основным потенциальным НЛР аминогликозидов относят:
- нефротоксичность;
- ототоксичность и вестибулотоксичность;
- блокаду нервно-мышечного проведения.
Учет факторов риска, однократное введение всей суточной дозы и короткие курсы лечения могут уменьшить степень проявления нежелательных реакций.
Нефротоксический эффект может проявляться жаждой, значительным увеличением или уменьшением частоты мочеиспускания или количества мочи, снижением клубочковой фильтрации и увеличением концентрации креатинина в сыворотке крови. Факторами риска нефротоксичности считают исходное нарушение функций почек, пожилой возраст, высокие дозы или длительные курсы лечения, одновременное применение других нефротоксичных препаратов (амфотерицина В, полимиксина В, ванкомицина, петлевых диуретиков, циклоспорина).
Ототоксичность проявляется снижением слуха, шумом, звоном или ощущением «заложенности» в ушах. Факторами риска считают пожилой возраст, исходные нарушения слуха, высокие дозы или длительные курсы лечения, одновременное назначение других ототок-сичных препаратов.
Вестибулотоксичность проявляется нарушением координации движений, головокружением. Чаще развивается у пациентов пожилого возраста, при исходных вестибулярных расстройствах, назначении высоких доз, длительных курсах лечения.
Нервно-мышечная блокада проявляется угнетением дыхания вплоть до полного паралича дыхательных мышц. Факторы риска: исходные неврологические заболевания (паркинсонизм, миастения), ботулизм, одновременное или предшествующее применение миорелаксантов, нарушение функций почек. Первая помощь: вну-
тривенное введение кальция хлорида или антихолинэстеразных препаратов.
Взаимодействие с другими препаратами
Аминогликозиды нельзя смешивать в одном шприце или одной инфузионной системе с β-лактамными антибиотиками и гепарином натрия, что обусловлено физико-химической несовместимостью этих препаратов.
Индометацин, фенилбутазон и другие НПВС, нарушающие почечный кровоток, могут замедлять скорость экскреции аминогликози-дов.
Аминогликозиды обладают синергичным действием с β-лактам-ными антибиотиками. Усиление токсических эффектов отмечается при одновременном назначении двух аминогликозидов или при их сочетании с другими нефро- и ототоксичными препаратами: полимиксином В, амфотерицином В, этакриновой кислотой, фуросемидом, ванкомицином.
Усиление нервно-мышечной блокады при одновременном применении средств для ингаляционного наркоза, опиоидных анальгетиков, магния сульфата и переливании большого объема препаратов крови с цитратными консервантами.
Контроль безопасности применения аминогликозидов
Аминогликозиды относят к препаратам, требующим проведения терапевтического лекарственного мониторинга, что обусловлено их высокой потенциальной токсичностью. НЛР обычно развиваются в том случае, когда минимальная сывороточная концентрация препарата в плазме длительно превышает порог токсического действия.
Нефротоксичность оценивают по клиническим и лабораторным признакам снижения функций почек.
• Уменьшение или увеличение количества мочи (проводят контроль суточного диуреза) или учащение мочеиспускания.
• Оценка концентрации креатинина и мочевины в плазме (по биохимическому анализу крови).
• Оценка скорости клубочковой фильтрации.
Ототоксичность и вестибулотоксичность оценивают по характерным жалобам на снижение слуха, шум, звон или ощущение
«заложенности» в ушах, головокружение, а также при проведении аудиометрии.
29.7. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
ГЛИКОПЕПТИДОВ
Группа гликопептидов включает в себя два природных антибиотика - ванкомицин и тейкопланин. Возрастание интереса к гликопеп-тидам обусловлено увеличением частоты нозокомиальных инфекций, вызванных грамположительными микроорганизмами. При инфекциях, вызванных MRSA, а также энтерококками, резистентными к ампициллину и аминогликозидам, гликопептиды считают препаратами выбора.
Механизм действия
Гликопептиды обладают преимущественно бактериостатическим действием, механизм которого заключается в нарушении синтеза клеточной стенки бактерий.
Фармакокинетика
Гликопептиды вводят только парентерально. Это обусловлено тем, что они практически не всасываются из ЖКТ. Биодоступность тейкопла-нина при внутримышечном введении - около 90%. Длительный период полувыведения тейкопланина (40-70 ч) позволяет назначать его 1 раз в сутки. Период полувыведения ванкомицина - 6-8 ч. Гликопептиды не подвергаются биотрансформации. Выводятся почками в неизмененном виде; при почечной недостаточности необходима коррекция дозы. Препараты этой группы не удаляются при гемодиализе.
Спектр активности
Гликопептиды активны в отношении грамположительных аэробных и анаэробных микроорганизмов: стафилококки (включая MRSA), стрептококки, пневмококки (включая штаммы, резистентные к пенициллину), энтерококки, пептострептококки, листерии, коринебакте-рии, клостридии (включая С. difficile). Грамотрицательные микроорганизмы резистентны к препаратам данной группы.
При исследовании in vitro выявлены некоторые различия в уровне природной активности и приобретенной резистентности между препаратами: более высокая активность тейкопланина в отношении S. aureus (в том числе MRSA), стрептококков (включая S. pneumoniae) и энтерококков; а ванкомицина - в отношении коагулазонегативных стафилококков.
В последние годы в нескольких странах выделены S. aureus со сниженной чувствительностью к ванкомицину (VISA, VRSA) или к ван-комицину и тейкопланину (GISA).
В отделениях интенсивной терапии США в настоящее время вырос уровень резистентности E. faecium (VRE) к ванкомицину. Некоторые ванкомицинорезистентные штаммы энтерококков сохраняют чувствительность к тейкопланину.
Показания к применению гликопептидов
• Инфекции, вызванные MRSA.
• Стафилококковые инфекции при аллергии к β-лактамам.
• Тяжелые инфекции, вызванные Enterococcus spp., C. jeikeium,
B. cereus, F. meningosepticum.
• Инфекционный эндокардит, вызванный зеленящими стрептококками и s. bovis при аллергии к β-лактамам.
• Инфекционный эндокардит, вызванный E. faecalis (в сочетании с гентамицином).
• Менингит, вызванный S. pneumoniae со сниженной чувствительностью к пенициллинам.
• Эмпирическая терапия угрожающих жизни инфекций при подозрении на стафилококковую этиологию:
- инфекционный эндокардит трехстворчатого клапана или протезированного клапана (в сочетании с гентамицином);
- катетерассоциированный сепсис;
- посттравматический или послеоперационный менингит (в сочетании с цефалоспоринами III поколения или фторхинолонами);
- перитонит при перитонеальном диализе;
- фебрильная нейтропения (при неэффективности стартовой терапии).
• Внутрь - при антибиотикоассоциированной диарее, вызванной
C. difficile.
• Профилактическое применение:
- периоперационная профилактика при ортопедических и кар-диохирургических операциях с высокой частотой распространения MRSA или при аллергии на β-лактамы;
- профилактика эндокардита у пациентов, относящихся к группе высокого риска.
Нежелательные лекарственные реакции
К основным НЛР гликопептидов относят:
- нефротоксичность (как правило, обратимую);
- ототоксичность;
- специфическое покраснение лица и верхней части туловища («синдром красного человека»);
- нейротоксичность;
- аллергические реакции.
Для контроля безопасности применения гликопептидов наряду с другими методами проводят терапевтический лекарственный мониторинг.
Абсолютным противопоказанием к применению гликопептидов считают гиперчувствительность.
Взаимодействия с другими препаратами
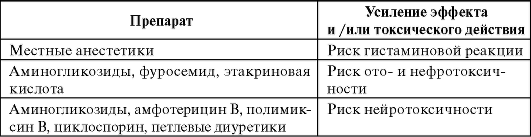
Приведены в табл. 29-4.
Таблица 29-4. Лекарственные взаимодействия гликопептидов
29.8. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МАКРОЛИДОВ
Макролиды представляют собой класс антибиотиков, основу химической структуры которых составляет макроциклическое лак-тонное кольцо. В клинической практике применяют три группы макролидов: 14-, 15- и 16-членные (в зависимости от числа атомов углерода в кольце) - табл. 29-5.
Таблица 29-5. Классификация макролидов

Механизм действия
Антимикробное действие макролидов обусловлено нарушением синтеза белка на рибосомах микробной клетки путем обратимого связывания с 50S субъединицей рибосом. Макролиды обладают преимущественно бактериостатическим действием. Однако в высоких концентрациях они могут действовать бактерицидно на β-гемолитический стрептококк группы А, пневмококк, возбудителей коклюша и дифтерии.
Резистентность микрофлоры к макролидам
Приобретенная резистентность к макролидам может развиваться при модификации мишени на рибосомах, а также с помощью активного выталкивания (эффлюкс) препаратов из микробной клетки или бактериальной инактивации. При этом полная резистентность микроорганизмов к макролидам, как правило, носит перекрестный к 14- и 15-членным макролидам характер, исключение составляют 16-членные препараты.
Фармакокинетика
Характерные особенности фармакокинетики макролидов:
- влияние пищи на всасывание некоторых макролидов;
- достаточно высокая степень связывания с белками;
- хорошее проникновение в органы и ткани [кроме спинномозговой жидкости (СМЖ)];
- элиминация через печень.
Степень всасывания макролидов из ЖКТ зависит от вида препарата, его лекарственной формы и присутствия пищи. Пища существенно снижает биодоступность эритромицина, в меньшей степени других макролидов и практически не влияет на биодоступность кларитромицина и спирамицина. Макролиды относят к тканевым антибиотикам, следовательно, их пиковые концентрации в сыворотке крови значительно ниже тканевых и варьируют у различных
препаратов. Макролиды подвергаются биотрансформации в печени. Препараты этой группы в различной степени связываются с белками плазмы: рокситромицин - более чем на 90%, спирамицин - менее чем на 20%. Макролиды хорошо распределяются в организме, создавая высокие концентрации во многих органах и тканях (миндалины, придаточные пазухи носа, легкие, предстательная железа). При этом они хорошо проникают внутрь клеток и создают там высокие концентрации. Макролиды плохо проходят через гематоэнцефалический и гематоофтальмический барьеры. Они проникают через плаценту и экскретируются в грудное молоко. Метаболиты макролидов выделяются с желчью. Почечная экскреция составляет 5-10%. Период полувыведения различных препаратов колеблется от 1,5 (эритромицин) до 65 ч (азитромицин). При почечной недостаточности период полувыведения большинства макролидов не изменяется. При циррозе печени отмечается его значительное увеличение.
Спектр активности
• Макролиды характеризуются высокой активностью против грам-положительных кокков, таких, как β-гемолитический стрептококк группы А (S. pyogenes), пневмококк (S. pneumoniae), золотистый стафилококк (S. aureus), за исключением MRSA.
• Действуют на внутриклеточно расположенные микроорганизмы: хламидии (C. trachomatis, C. pneumoniae), микоплазмы (M. pneumoniae), уреаплазмы (E. urealyticum).
• Активны против возбудителя коклюша (B. pertussis), дифтерийной палочки (C. diphtheriae).
• Действуют на моракселлу (M. catarrhalis), легионеллы (Legionella spp.), кампилобактеры (Campilobacter spp.), листерии (Listeria spp.).
• Активны против хеликобактера (H. pylori).
Микроорганизмы семейства Enterobacteriaceae, Pseudomonas spp., Acinetobacter spp. обладают природной устойчивостью ко всем макролидам.
Азитромицин превосходит все другие макролиды по активности в отношении гемофильной палочки (H. influenzae). Кларитромицин по сравнению с другими макролидами более активен против хели-кобактера (H. pylori) и атипичных микобактерий (M. avium, M. leprae). Спирамицин активен в отношении некоторых простейших (T. gondii, Cryptosporidium spp.).
Показания к применению
• Инфекции верхних и нижних отделов дыхательных путей (тон-зиллофарингит, синусит, обострение хронического бронхита, внебольничная пневмония).
• Инфекции, передающиеся половым путем (хламидиоз, уреаплаз-моз, микоплазмоз).
• Эрадикация H. pylori (кларитромицин).
• Болезнь легионеров.
• Ородентальные инфекции (периодонтит, периостит).
• Инфекции кожи и мягких тканей.
• Токсоплазмоз (спирамицин).
• Кампилобактериальные инфекции у детей (эритромицин).
• Криптоспоридиоз (спирамицин, рокситромицин).
• Тяжелая угревая сыпь.
• Профилактика и лечение микобактериоза, вызванного M. avium у больных с ВИЧ (кларитромицин, азитромицин).
С профилактической целью макролиды примененяют при:
- коклюше (для лиц, контактировавших с больными, - эритромицин);
- менингококковом менингите (спирамицин);
- ревматизме (при аллергии на пенициллин);
- малярии (азитромицин).
Нежелательные лекарственные реакции
Макролиды - одна из самых безопасных групп антибиотиков. Аллергические реакции возникают очень редко.
Эритромицин достаточно часто (у 30-35% пациентов) вызывает дискомфорт в животе, тошноту, рвоту, обладает умеренной гепато-токсичностью (чаще всего это проявляется транзиторным повышением активности печеночных ферментов), может вызывать холеста-тический гепатит. Также эритромицин может вызывать нарушения сердечного ритма, удлинять интервал QT (обычно у пациентов с заболеваниями сердца при совместном приеме с другими препаратами, удлиняющими интервал QT).
Другие макролиды переносятся значительно лучше. При внутривенном введении могут возникать тромбофлебиты, обусловленные местно-раздражающим действием.
Противопоказания
Макролиды противопоказаны пациентам с гиперчувствительностью. При беременности не рекомендуют применять кларитромицин, рокситромицин. Кормящим женщинам не следует назначать спира-мицин и мидекамицин (эти препараты проникают в грудное молоко). Безопасность применения у детей до 6 мес не определена для кларитро-мицина. При тяжелой почечной недостаточности (клиренс креатинина <30 мл/мин) увеличивается период полувыведения кларитромицина и рокситромицина. При заболеваниях печени с осторожностью следует применять эритромицин, рокситромицин и джозамицин, а при тяжелых заболеваниях печени дозу кларитромицина снижают.
Растворы эритромицина, кларитромицина и спирамицина обладают выраженным местно-раздражающим действием, и их следует вводить внутривенно медленно. Макролиды нельзя вводить внутривенно струйно и внутримышечно.
Взаимодействия с другими препаратами
Взаимодействия макролидов с другими ЛС основаны на ингиби-ровании активности микросомальных ферментов печени (система цитохрома Р-450). По степени ингибирования макролиды распределяются в следующем порядке: кларитромицин > эритромицин > азитромицин > спирамицин.
Большое значение имеет взаимодействие эритромицина и кла-ритромицина с непрямыми антикоагулянтами (варфарином), тео-филлином, противосудорожными препаратами (карбамазепином, вальпроевой кислотой), циклоспорином, в результате которого повышается риск развития нежелательных реакций (например, кровотечений при назначении макролидов с варфарином, нарушений сердечного ритма при взаимодействии макролидов и теофиллина). Сочетание макролидов (кроме спирамицина) с цизапридом® очень опасно из-за высокого риска развития тяжелых желудочковых аритмий. Антациды замедляют всасывание макролидов из ЖКТ.
29.9. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ЛИНКОЗАМИДОВ
Группа линкозамидов представлена природным антибиотиком линкомицином и его полусинтетическим аналогом клиндамицином,
который имеет более высокую активность in vitro. Спектр антимикробной активности этих препаратов достаточно узкий. Их назначают преимущественно в качестве препаратов второго ряда при инфекциях, вызванных грамположительными кокками, а также выявлении неспорообразующей анаэробной флоры, включая В. fragilis. Отмечена быстро развивающаяся, перекрестная с макролидами резистентность стафилококков к обоим препаратам.
Механизм действия
Бактериостатический эффект обусловлен ингибированием синтеза белка на рибосомах. Бактерицидный эффект может проявиться при высоких концентрациях в отношении высокочувствительных микроорганизмов.
Фармакокинетика
Особенности фармакокинетики линкозамидов:
- хорошая биодоступность (пища не влияет на всасывание);
- хорошее проникновение в органы и ткани (особенно в костную) и полость абсцессов;
- элиминация преимущественно через ЖКТ и печень. Клиндамицин лучше всасывается из ЖКТ. Его биодоступность
составляет 90%, причем не зависит от пищи, в то время как биодоступность линкомицина - всего 30%, а в присутствии пищи снижается до 5%. Препараты подвергаются биотрансформации в печени. Хорошо проникают в различные ткани и органы. Высокие концентрации достигаются в бронхолегочном отделяемом, костях, желчи. Проникают через плаценту и в грудное молоко. Плохо проходят через ГЭБ. Выводятся преимущественно через ЖКТ, с мочой экс-кретируется 10-30% принятой дозы. Период полувыведения линко-мицина составляет 4-6 ч, клиндамицина - несколько меньше. Эти величины при почечной недостаточности не изменяются, но могут значительно возрастать при тяжелой патологии печени.
Спектр активности
Наиболее чувствительны стафилококки (кроме метициллиноре-зистентных), стрептококки, пневмококки и неспорообразующие анаэробы - пептококк, пептострептококки, фузобактерии, бактероиды
(включая большинство штаммов В. fragilis). Клиндамицин умеренно активен в отношении некоторых простейших - токсоплазма, пнев-моциста, Р. falciparum.
Показания к применению
• Инфекции нижних отделов дыхательных путей: аспирационная пневмония, абсцесс легкого, эмпиема плевры.
• Инфекции кожи и мягких тканей, включая диабетическую стопу.
• Инфекции костей и суставов.
• Интраабдоминальные инфекции: перитонит, абсцессы.
• Инфекции органов малого таза: эндометрит, аднексит, сальпин-гоофорит. негонорейный абсцесс маточных труб и яичников, пельвиоцеллюлит, послеоперационные анаэробные вагинальные инфекции.
• Хлорохинорезистентная тропическая малярия, вызываемая Р. falciparum (только клиндамицин в сочетании с хинином).
• Токсоплазмоз (только клиндамицин в сочетании с пириметами-ном).
При тяжелых инфекциях линкосамиды необходимо комбинировать с антибиотиками, действующими на грамотрицательную флору (аминогликозиды).
Нежелательные лекарственные реакции
Наиболее неблагоприятной НЛР считают развитие псевдомем-бранозного колита, вызванного С. dificile, проявляющегося кровавой диареей, болями в животе, лихорадкой. Псевдомембранозый колит - потенциально смертельное заболевание. Возможно также развитие нейтропении, гиперчувствительности, гепатотоксического действия на плод.
Противопоказания
• Заболевания ЖКТ в анамнезе - неспецифический язвенный колит, энтерит или колит, связанный с применением антибиотиков.
• Повышенная чувствительность к линкозамидам или доксоруби-цину.
• При терминальной почечной или печеночной недостаточности необходимо снизить дозу.
• Беременность, лактация.
Взаимодействие с другими препаратами
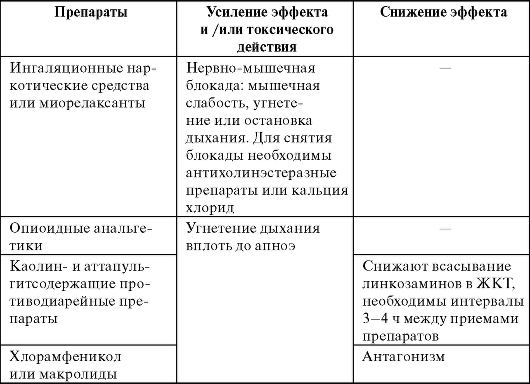
Приведены в табл. 29-6.
Таблица 29-6. Лекарственные взаимодействия линкозаминов
29.10. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ТЕТРАЦИКЛИНОВ
К группе тетрациклинов относят природный антибиотик тетрациклин и полусинтетический препарат доксициклин. Общие свойства антибиотиков этой группы:
- бактериостатическое действие;
- широкий спектр активности, но высокий уровень вторичной резистентности многих бактерий;
- перекрестная устойчивость микроорганизмов ко всем препаратам группы;
- высокая частота НЛР.
Механизм действия
Тетрациклины угнетают синтез белка, связываясь с 30S-субъеди-ницей бактериальных рибосом.
Фармакокинетика
Биодоступность доксициклина составляет 90-100% и практически не зависит от пищи. Биодоступность тетрациклина при приеме натощак - 75%, а при приеме с пищей снижается в 2 раза. Максимальная концентрация препаратов в сыворотке крови достигается через 1-3 ч после приема внутрь. Метаболизм тетрациклинов осуществляется в печени. Тетрациклины распределяются во многих органах и средах организма. Доксициклин, по сравнению с тетрациклином, создает более высокие тканевые концентрации. Концентрация в СМЖ составляет 10-25% таковой в сыворотке крови, в желчи - в 5-20 раз выше, чем в крови. Препараты этой группы проникают через плаценту и в грудное молоко в высоких концентрациях. Тетрациклин преимущественно выводится почками, при почечной недостаточности его экскреция значительно замедляется. Доксициклин, в отличие от тетрациклина, имеет более высокую липофильность и выводится не только почками, но и через ЖКТ, причем у пациентов с почечной недостаточностью этот путь становится основным. Доксициклин имеет более длительный период полувыведения (15-24 ч), чем тетрациклин (8 ч).
Спектр антимикробной активности
Включает в себя грамположительные кокки (в настоящее время отмечается высокая устойчивость пневмококков, стрептококков и большинства стафилококков); грамположительные палочки (листе-рии, возбудители сибирской язвы); грамотрицательные бактерии (иерсинии, кампилобактеры, бруцеллы, гемофилы, холерный вибрион, возбудители чумы, туляремии; многие штаммы Е. coli, сальмонелл и шигелл устойчивы); анаэробы (клостридии, кроме С. difficile; фузо-бактерии); спирохеты, риккетсии, хламидии, микоплазмы, актино-
мицеты. Доксициклин активен в отношении малярийного плазмодия.
Показания к применению
• Инфекции, передающиеся половым путем - хламидиоз, уреа-плазмоз, микоплазмоз (доксициклин);
• Инфекции желчевыводящих путей.
• Ородентальные инфекции - периодонтит (доксициклин).
• Иерсиниоз (доксициклин).
• Эрадикация Н. pylori (тетрациклин в сочетании с другими антибиотиками и антисекреторными препаратами).
• Угревая сыпь, при неэффективности местного лечения (доксици-клин).
• Сифилис (при аллергии к -лактамам).
• Риккетсиозы.
• Особо опасные инфекции: чума (в сочетании со стрептомицином), холера (доксициклин).
• Зоонозные инфекции: болезнь Лайма, лептоспироз, бруцеллез, туляремия (в сочетании со стрептомицином).
Кроме того, доксициклин рассматривают как препарат резерва при инфекциях верхних (синусит) и нижних (бронхит, внебольнич-ная пневмония) дыхательных путей.
Нежелательные лекарственные реакции
• Аллергические реакции.
• Общее катаболическое действие, угнетение белкового обмена, гиперазотемия.
• Диспепсические расстройства, эрозии пищевода.
• Суперинфекции, включая кандидоз ЖКТ и влагалища.
• У детей - нарушение образования костной и зубной ткани: дис-колорация (изменение окраски) зубов, дефекты эмали, замедление линейного роста костей.
• Фотодерматит (чаще при приеме доксициклина).
• Гепатотоксичность, вплоть до некрозов печени (особенно при нарушении функций печени и быстром внутривенном введении).
• Повышение внутричерепного давления при длительном приеме.
Противопоказания
Возраст до 8 лет, беременность, кормление грудью, тяжелая патология печени, почечная недостаточность (тетрациклин).
Взаимодействия с другими препаратами
Пища и антациды значительно снижают биодоступность тетрациклина (но не доксициклина). Это обусловлено тем, что при взаимодействии с катионами Са2+, Mg+, Al3+, которые содержатся в пище, особенно в молочных продуктах, а в антацидах образуются нерастворимые хелатные соединения.
Карбамазепин, фенитоин и барбитураты ускоряют метаболизм доксициклина в печени и почти в 2 раза укорачивают его период полувыведения. Аналогичная картина может отмечаться у лиц, злоупотребляющих алкоголем.
29.11. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ХЛОРАМФЕНИКОЛА
Хлорамфеникол имеет широкий спектр активности. На пневмококк, менингококк и гемофильную палочку действует бактерицидно, на другую чувствительную микрофлору бактерио-статически. Применение хлорамфеникола ограничено из-за его способности вызывать тяжелые нежелательные реакции (в первую очередь - гематологические) и вторичной резистентности многих возбудителей.
Механизм действия
Бактериостатическое действие хлорамфеникола обусловлено его обратимым взаимодействием с 50S-субъединицей рибосом, в результате чего нарушается синтез белка.
Фармакокинетика
Хорошо всасывается из ЖКТ, биодоступность составляет 70-80% и не зависит от пищи. Препарат подвергается биотрансформации в печени. Хорошо распределяется в организме, проникает через ГЭБ, гематоофтальмический барьер, создает высокие концентра-
ции в ткани мозга, бронхиальном секрете, желчи. Выделяется через почки преимущественно в неактивном состоянии, и при почечной недостаточности дозу можно не снижать. Т1/2 у взрослых составляет 1,5-3,5 ч, у детей - 3-6,5 ч.
Спектр антимикробной активности
Грамположительные кокки: стрептококки, включая пневмококки (кроме пенициллинорезистентных); стафилококки (многие штаммы устойчивы); энтерококки. Грамотрицательные кокки: менингококки, гонококки, моракселла. Грамотрицательные палочки: гемо-фильная (включая ампициллинорезистентные штаммы), кишечная, сальмонеллы, шигеллы, бруцеллы, иерсинии. Следует учитывать, что в России 50-90% шигелл и более 10% сальмонелл устойчивы к препаратам этой группы. Риккетсии. Анаэробы: клостридии, анаэробные кокки, бактероиды (включая В. fragilis).
Показания к применению
Учитывая высокую частоту и опасность нежелательных реакций, при всех приведенных ниже показаниях хлорамфеникол рассматривают как резервный антибиотик.
• Бактериальный менингит.
• Абсцесс мозга.
• Интраабдоминальные и тазовые инфекции.
• Генерализованные формы сальмонеллеза.
• Брюшной тиф.
• Риккетсиоз.
• Газовая гангрена.
Нежелательные лекарственные реакции
• Гематотоксическое действие:
- обратимое - ретикулоцитопения, тромбоцитопения, анемия.
- необратимое - потенциально фатальная апластическая анемия. Встречается редко (1 случай на 10 000-40 000 больных), может развиваться через 6-8 нед после отмены препарата, при однократном приеме и даже местном применении. Угнетение кроветворения - самая серьезная НЛР хлорамфеникола. Таким образом, этот препарат применяют только в случае, если потен-
циальная польза от назначения превышает риск развития апла-стической анемии.
• «Серый» синдром: у новорожденных препарат кумулируется и оказывает кардиотоксическое действие, что ведет к развитию коллапса, сердечной недостаточности. При этом кожа приобретает серый оттенок.
• Гепатотоксическое действие.
• Нейротоксическое действие: поражение зрительного нерва, периферические полинейропатии.
• Диспепсические расстройства.
29.12. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ХИНОЛОНОВ И ФТОРХИНОЛОНОВ
Хинолоны - синтетические антибактериальные препараты, разделены на четыре поколения, причем три последних имеют свойства фторированных (фторхинолоны) (табл. 29-7).
Таблица 29-7. Классификация хинолонов
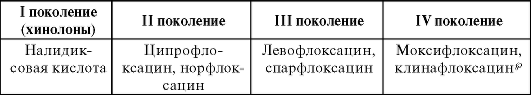
Хинолоны I поколения имеют узкий спектр активности, и многие из них (оксолиновая кислота, пипемидовая кислота) в настоящее время утратили свое значение. Фторхинолоны характеризуются значительно более широким антимикробным спектром, высокой бактерицидной активностью, что позволяет применять их для лечения инфекций различной локализации.
Механизм действия
Хинолоны обладают бактерицидным действием, инактивируя ферменты ДНК-гиразу и топоизомеразу IV, нарушая тем самым синтез ДНК микробной клетки.
Фармакокинетика
Все хинолоны хорошо всасываются из ЖКТ; пища может замедлить этот процесс, но не оказывает существенного влияния на биодоступность. Степень метаболизма препаратов данной группы в печени зависит от вида препарата: наиболее активно подвергается биотрансформации налидиксовая кислота, оксолиновая кислота, пефлоксацин, наименее - пипемидовая кислота, офлоксацин и ломефлоксацин. Хинолоны I поколения не создают терапевтических концентраций в крови, многих органах и тканях, создавая при этом терапевтически значимые концентрации в моче. Фторхинолоны характеризуются большим объемом распределения, создают высокие концентрации во многих органах и тканях, проникают внутрь клеток. Наиболее высокие тканевые концентрации создают офлоксацин и ломефлоксацин, наименьшие - норфлоксацин. Ципрофлоксацин, офлоксацин и пефлоксацин проникают через ГЭБ, выводятся из организма преимущественно почками, частично с желчью. При нарушении функций почек выведение препаратов замедляется, особенно офлоксацина и ломефлоксацина. При тяжелой почечной недостаточности необходима коррекция доз всех фторхинолонов. При тяжелой печеночной недостаточности необходима коррекция дозы пефлоксацина. При проведении гемодиализа фторхинолоны удаляются из крови в незначительных количествах (10-30%).
Спектр активности
Для хинолонов характерно действие на грамотрицательные бактерии - кишечную палочку (Е. coli), шигеллы, сальмонеллы, протей (Proteus spp), клебсиеллу (Klebsiella spp). Как было отмечено выше, фторхинолоны характеризуются более широким спектром активности, к ним чувствительны:
- стафилококки (в том числе PRSA и некоторые MRSA);
- грамотрицательные кокки (гонококк, менингококк, М. catar-rhalis);
- грамотрицательные бактерии семейства Enterobacteriaceae (Е. coli, сальмонеллы, шигеллы, протей, энтеробактер, клеб-сиелла, серрация, провиденция, цитробактер, морганелла), синегнойная палочка (Р. aeruginosa), а также кампилобактеры и легионеллы, М. tuberculosis.
Микробиологические особенности хинолонов II поколения • Малочувствительны большинство стрептококков (в том числе пневмококк), энтерококки, хламидии, микоплазмы.
• Не действуют на спирохеты, листерии и большинство анаэробов. Микробиологические особенности хинолонов III поколения
Обладают более высокой активностью в отношении пневмококков, включая пенициллинорезистентные, и атипичных возбудителей (хламидии, микоплазмы).
Микробиологические особенности хинолонов IV поколения
• По антипневмококковой активности и действию на атипичных возбудителей хинолоны превосходят предшествующие поколения.
• Обладают высокой активностью против неспорообразующих анаэробов (В. fragilis и др.).
Показания к применению
• Инфекции нижних дыхательных путей (обострение хронического бронхита, нозокомиальная пневмония).
• Инфекции желчевыводящих путей.
• Инфекции мочевыводящих путей.
• Простатит.
• Интраабдоминальные и тазовые инфекции (в сочетании с антианаэробными препаратами).
• Кишечные инфекции (шигеллез, сальмонеллез).
• Тяжелые инфекции кожи, мягких тканей, костей, суставов.
• Гонорея.
• Туберкулез (ципрофлоксацин, офлоксацин и ломефлоксацин - как препараты II ряда).
Нежелательные лекарственные реакции
Для хинолонов в большей степени характерны:
- диспепсические расстройства;
- цитопении;
- гемолитическая анемия;
- возбуждение ЦНС (понижение судорожного порога);
- гепатотоксичность.
Для фторхинолонов характерны:
- торможение развития хрящевой ткани (противопоказаны беременным и кормящим); у детей можно применять только по особым показаниям;
- удлинение интервала QT на ЭКГ, что может провоцировать развитие желудочковых аритмий;
- фотодерматиты;
- влияние на ЦНС - в некоторых случаях вызывают судороги, психозы, галлюцинации;
- редко возможно развитие тендинитов (воспаление сухожилий).
Противопоказания
Для всех хинолонов:
- аллергические реакции на препараты группы хинолонов;
- дефицит глюкозо-6-фосфатдегидрогеназы;
- беременность.
Дополнительно для хинолонов I поколения:
- тяжелые нарушения функций печени и почек;
- тяжелый церебральный атеросклероз. Дополнительно для хинолонов II-IV поколения:
- детский возраст;
- кормление грудью.
Применение фторхинолонов не рекомендовано в период формирования костно-суставной системы. Однако не исключается возможность их назначения по жизненным показаниям.
У пожилых пациентов увеличивается риск разрывов сухожилий, особенно при одновременном приеме глюкокортикоидов.
Взаимодействие с другими препаратами
Хинолоны I поколения не следует сочетать с нитрофуранами (снижается эффект).
Всасывание фторхинолонов ухудшается при одновременном приеме антацидов, препаратов, содержащих кальций или алюминий, железо, сукральфат.
Фторхинолоны (особенно ципрофлоксацин, норфлоксацин и пеф-локсацин) могут ингибировать метаболизм теофиллина в печени и повышать его концентрацию в крови.
При сочетании с НПВС возрастает риск нейротоксичности, вплоть до развития судорог.
29.13. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ НИТРОИМИДАЗОЛОВ
Группа нитроимидазолов представлена синтетическими препаратами (метронидазол, тинидазол, орнидазол) с высокой активностью в отношении анаэробных бактерий и простейших.
Механизм действия
Нитроимидазолы избирательно воздействуют на микроорганизмы, ферментные системы которых способны восстанавливать нитро-группу. Активные восстановленные формы препаратов нарушают репликацию ДНК и синтез белка в микробной клетке, ингибируют тканевое дыхание.
Фармакокинетика
Хорошо всасываются при приеме внутрь. Биодоступность (более 80%) не зависит от приема пищи. Нитроимидазолы подвергаются биотрансформации в печени с образованием активных и неактивных метаболитов. Хорошо распределяются, проходят через гематоэнце-фалический (создавая высокие концентрации в ликворе и в ткани мозга) и плацентарный барьер, проникают в грудное молоко, выделяются со слюной и желудочным соком. Выводятся из организма почками - 60-80% от принятой дозы, примерно 20% в неизмененном виде; со стулом - до 15%. При повторных введениях возможна кумуляция. Период полувыведения составляет от 6 до 14 ч, в зависимости от препарата, при почечной недостаточности не изменяется. У новорожденных может возрастать до суток.
Спектр активности
Большинство анаэробов - бактероиды (включая В. fragilis), кло-стридии (включая С. difficile), Fusobacterium spp., Eubacterium spp., Peptostreptococcus spp., P. niger, G. vaginalis чувствительны к препаратам этой группы. Устойчив только P. acnes.
К нитроимидазолам чувствительны простейшие (T. vaginalis, E. histolytica, G. lamblia, L. intestinalis, B. coli, Leishmania spp), а также H. pylori.
Показания к применению
• Анаэробные или смешанные аэробно-анаэробные инфекции различной локализации:
- кожи, мягких тканей, костей, суставов;
- верхних и нижних дыхательных путей (синусит, аспирацион-ная пневмония, эмпиема, абсцесс легкого);
- ЦНС (менингит, абсцесс мозга);
- интраабдоминальные, включая инфекции органов малого таза;
- псевдомембранозный колит;
• Протозойные инфекции: трихомониаз, лямблиоз, балантидиаз, амебная дизентерия и внекишечный амебиаз (амебный гепатит, абсцесс печени, абсцесс мозга).
• Эрадикация Н. pylori.
• Периоперационная профилактика при интраабдоминальных и гинекологических вмешательствах.
Нежелательные лекарственные реакции
К основным нежелательным лекарственным реакциям нитроими-дазолов относят:
- диспепсический синдром;
- нейротоксичность;
- гематотоксичность (нейтропения);
- гепатотоксичность (особенно при исходной патологии печени).
Противопоказания
• Повышенная чувствительность к нитроимидазолам.
• Органические заболевания ЦНС с выраженными клиническими проявлениями.
• Первый триместр беременности.
Применение нитроимидазолов в период грудного вскармливания не рекомендовано - концентрации метронидазола и его метаболитов в плазме крови ребенка составляют 10-20% от концентраций в крови матери.
Взаимодействие с другими препаратами
Приведены в табл. 29-8.
Таблица 29-8. Лекарственные взаимодействия нитроимидазолов
29.14. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ КО-ТРИМОКСАЗОЛА
Ко-тримоксазол принадлежит к группе антифолатов, - препаратов, нарушающих метаболизм фолиевой кислоты, которая синтезируется микроорганизмами и необходима для образования нуклеиновых кислот и белков. Представляет собой сочетание пяти частей сульфаметоксазола (сульфаниламид средней продолжительности действия) и одной части триметоприма. Обладает бактерицидным действием.
Механизм действия
Механизм действия сульфаниламидного компонента обусловлен сходностью его структуры с парааминобензойной кислотой, одной из составных частей фолиевой кислоты, необходимой для синтеза нуклеиновых кислот. Триметоприм, являясь структурным аналогом птеридиновой части фолиевой кислоты, нарушает следующий этап синтеза нуклеиновых кислот. Таким образом, проявляется синергизм между двумя компонентами ко-тримоксазола.
Фармакокинетика
Ко-тримоксазол хорошо всасывается при приеме внутрь. Биодоступность составляет 90-100%. Максимальная концентрация в плазме крови достигается через 2-4 ч. Частично расщепляется в печени. Проникает через многие тканевые барьеры. Связь компонентов (триметоприм и сульфаметоксазол) с белками плазмы крови составляет 45 и 66% соответственно. Препарат экскретиру-ется с мочой, преимущественно в неизмененном виде. Периоды полувыведения обоих компонентов составляют 10-12 ч. Кумуляция ко-тримоксазола возможна при почечной недостаточности.
Спектр активности
Ко-тримоксазол активен в отношении грамположительных и гра-мотрицательных аэробных кокков: стафилококков (включая некоторые метициллинорезистентные стафилококки), пневмококков, менингококков, моракселлы, энтеробактерий (Е. coli, протеи, шигеллы, сальмонеллы); Н. influenzae (включая некоторые ампициллиноустойчивые штаммы), пневмоцист, токсоплазм и ряда других микроорганизмов.
К ко-тримоксазолу устойчивы энтерококки, синегнойная палочка, микобактерии туберкулеза, бледные спирохеты и анаэробы.
Показания к применению
• Кишечные инфекции: шигеллез, сальмонеллез, диарея путешественников. Однако большинство шигелл и сальмонелл резистентны к ко-тримоксазолу.
• Инфекции мочевыводящих путей: острый цистит, хронический рецидивирующий цистит, пиелонефрит.
• Стафиллококковые инфекции.
• Пневмоцистная пневмония у больных СПИДом (лечение и профилактика).
• Нокардиоз.
• Токсоплазмоз.
• Бруцеллез.
Нежелательные лекарственные реакции
Обусловлены компонентами препарата. Наиболее тяжелые реакции развиваются на сульфаниламидный компонент. Триметоприм
переносится значительно лучше. Аллергические реакции проявляются в виде синдрома Лайелла и Стивенса - Джонсона, для которых характерно появление пузырей на коже и слизистых оболочках, выраженная интоксикация. Могут отмечаться диспепсические явления (тошнота, рвота) и диарея. Реже возникают гепатотоксические и гематотоксические реакции (гемолитическая анемия, тромбо-цитопения). Чаще всего - у 45-65% пациентов появляются сыпь и лейкопения.
Противопоказания
• Аллергия на сульфаниламидные препараты, фуросемид, тиазид-ные диуретики, ингибиторы карбоангидразы, препараты сульфо-нилмочевины.
• Возраст до 2 мес.
• Беременность (особенно в I и III триместре). Конкуренция сульфаметоксазола с билирубином за связывание с белками плазмы и высокие концентрации свободного сульфаметокса-зола повышают риск развития ядерной желтухи у новорожденных. Проникая в грудное молоко, сульфаметоксазол может вызвать ядерную желтуху у детей, находящихся на грудном вскармливании, а также гемолитическую анемию у детей с дефицитом глюкозо-6-фосфатдегидрогеназы. Триметоприм нарушает метаболизм фолиевой кислоты. Допустимо применение ко-тримоксазола у детей с 4-6 нед, родившихся у ВИЧ-инфицированных матерей.
• Тяжелая почечная недостаточность. Ко-тримоксазол не следует применять при клиренсе креатинина <15 мл/мин.
• Тяжелые нарушения функций печени.
• Мегалобластическая анемия, связанная с дефицитом фолиевой кислоты.
Взаимодействие с другими препаратами
Приведены в таблице 29-9.
Таблица 29-9. Лекарственные взаимодействия ко-тримоксазола
29.15. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ПРОТИВОТУБЕРКУЛЕЗНЫХ ПРЕПАРАТОВ
Множество препаратов, отличающихся по происхождению, химической структуре и механизму действия, обладают активностью в отношении М. tuberculosis. В основе современной классификации противотуберкулезных препаратов (ПТП) лежит эффективность и переносимость. ПТП разделяют на:
- препараты первого ряда (изониазид, рифампицин, пиразина-мид, стрептомицин, этамбутол);
- препараты второго ряда (этионамид, капреомицин, канами-цин, амикацин, рифабутин, ципрофлоксацин, офлоксацин, респираторные фторхинолоны - моксифлоксацин).
Классификация Международного союза борьбы с туберкулезом основана на распределении препаратов по эффективности:
- препараты высокой эффективности - изониазид, рифампи-цин;
- препараты средней эффективности - стрептомицин, канами-цин, виомицин, этионамид, пиразинамид;
- препараты низкой эффективности - аминосалициловая кислота (ПАСК*).
Лечение туберкулеза - длительный процесс, продолжающийся не менее 6 мес и требующий назначения нескольких препаратов. Основными принципами лечения туберкулеза считают:
- длительную поддерживающую терапию;
- назначение, как минимум, двух ПТП высокой эффективности;
- обеспечение регулярного приема препаратов.
Пренебрежение этими принципами приводит к развитию полирезистентных форм туберкулеза.
Для лечения впервые выявленного туберкулеза применяют изони-азид и рифампицин, а сочетание с ними еще трех препаратов - пира-зинамида, стрептомицина и этамбутола - позволяет добиться излечения большинства пациентов. Созданы комбинированные ПТП, представляющие собой различные сочетания препаратов I ряда.
Препараты II ряда, или резервные, применяют для лечения полирезистентного туберкулеза. Форма туберкулеза, тяжесть его течения, характер предыдущего лечения, чувствительность М. tuberculosis и переносимость ПТП пациентами определяют выбор препаратов и длительность их применения.
Препараты гидразида изоникотиновой кислоты
В качестве ПТП применяют следующие производные гидразида изоникотиновой кислоты (ГИНК): изониазид, фтивазид, метазид, опиниазид.
Изониазид
Основной препарат для лечения активного туберкулеза любой локализации и его химиопрофилактики.
Механизм действия: угнетает синтез миколевой кислоты в клеточной стенке М. tuberculosis. Бактерицидное действие проявляется на размножающихся, а бактериостатическое - на покоящихся мико-бактериях. Резистентность при монотерапии изониазидом развивается в 70%.
Фармакокинетика. Изониазид хорошо всасывается из ЖКТ, пиковые концентрации в крови достигаются через 1-3 ч после приема внутрь. Хорошо проникает в клетки и во все физиологические жидкости, в том числе плевральную, спинномозговую, асцитическую. Биотрансформируется в печени, скорость инактивации детерминирована системой цитохрома Р-450. Различают «быстрые инактива-торы», имеющие период полувыведения менее 65 мин и «медленные инактиваторы» с периодом полувыведения более 170 мин. Экскреция осуществляется почками.
Спектр активности: самый эффективный из препаратов ряда ГИНК при любой форме и локализации активного туберкулеза, как у взрослых, так и у детей. Значительно ниже активность в отношении некоторых атипичных микобактерий (М. kansasii).
НЛР. Печень: гепатотоксичность, вплоть до изониазидассоции-рованного гепатита. Факторы риска: «медленные инактиваторы», прием алкоголя во время лечения, снижение функции печени. Меры профилактики: контроль активности трансаминаз (два раза в первый месяц, а затем ежемесячно).
Нервная система: периферические полинейропатии, неврит или атрофия зрительного нерва, мышечные подергивания и генерализованные судороги, нарушения чувствительности, энцефалопатия, интоксикационный психоз. Меры профилактики: обязательный прием пиридоксина в суточной дозе 60-100 мг. Эндокринная система: гинекомастия у мужчин, дисменорея у женщин, «кушингоид», гипергликемия. Аллергические реакции: сыпь, лихорадка. ЖКТ: дискомфорт в животе. Сердечно-сосудистая система: АГ, усиление ишемии миокарда у пожилых пациентов. Местные реакции: флебиты при внутривенном введении.
Во время беременности изониазид проникает через плаценту и может вызвать задержку психомоторного развития ребенка, возникновение миеломенингоцеле и гипоспадии, геморрагий (при гиповитаминозе К). Концентрация в материнском молоке соответствует плазменной, и у ребенка возможно развитие гепатита и периферических невритов. Период полувыведения изониазида у новорожденных увеличен.
Нарушение функций почек повышает риск токсичности (клиренс креатинина меньше 10 мл/мин).
Меры помощи при острой передозировке (тошнота, рвота, нарушение зрения и слуха, невнятная речь, угнетение дыхания, ступор, кома, судороги) включают в себя промывание желудка, проведение ИВЛ, внутривенное назначение барбитуратов короткого действия, пири-доксина, осмотических диуретиков; натрия бикарбоната при развитии метаболического ацидоза.
Противопоказания: индивидуальная непереносимость, эпилепсия, тяжелые психозы, склонность к судорожным припадкам, полиомиелит в анамнезе, токсические гепатиты в анамнезе при приеме препаратов ГИНК, острая печеночная и почечная недостаточность, выраженный атеросклероз.
Взаимодействие с другими ЛС. Следует соблюдать максимально возможные интервалы между введениями изониазида и стрептомицина. Это обусловлено тем, что при одновременном их введении выделение с мочой замедляется. Рифампицин увеличивает риск гепатотоксичности.
Рифампицины
Рифампицин (ПТП I ряда) и рифабутин (ПТП II ряда) обладают широким спектром антимикробной активности.
Рифампицин
Полусинтетическое производное природного рифамицина SV. Его эффективно применяют не только как противотуберкулезный препарат, но и при атипичных микобактериозах, тяжелых формах некоторых других инфекций, когда лечение другими антибиотиками неэффективно.
Механизм действия: специфический ингибитор синтеза РНК.
Фармакокинетика. Хорошо всасывается при приеме внутрь. Пик концентрации в крови отмечается через 2 ч. Пища снижает биодоступность. Фармакокинетические показатели более стабильны при одномоментном приеме всей суточной дозы и курсе лечения более 10-14 сут. Создает эффективные концентрации в мокроте, слюне, назальном секрете, легких, плевральном и перитонеальном экссудатах, в почках, печени. Хорошо проникает внутрь клеток. Плохо проникает через гематоэнцефалический барьер, но при туберкулезном менингите обнаруживается в ликворе в эффективных концентрациях. Проникает через плаценту и в грудное молоко. Подвергается биотрансформации с образованием активного метаболита. Выводится из организма с желчью и мочой; с увеличением дозы доля почечной экскреции возрастает. Период полувыведения - 1-4 ч.
Спектр активности широкий. Бактерицидное действие наиболее выражено против микобактерий туберкулеза, атипичных микобак-терий различных типов, грамположительных кокков (метициллин-резистентных стафилококков, а также множественнорезистентных пневмококков), грамотрицательных кокков - N. meningitidis и N. gonorrhoeae (в том числе β-лактамазообразующие). Однако последние в процессе лечения быстро приобретают резистентность.
Рифампицин активен в отношении H. influenzae (в том числе резистентных к ампициллину и хлорамфениколу), H. ducreyi, B. pertussis, B. anthracis, L. monocytogenes, F. tularensis, легионелл, риккетсий.
Из представителей семейства Enterobacteriaceae умеренно чувствительны только некоторые штаммы E. coli и P. mirabilis.
Среди анаэробов чувствительны клостридии (включая C. difficile) и бактероиды (включая некоторые штаммы B. fragilis).
Показания к применению
• Туберкулез (необходимо сочетание с другими ПТП из-за быстрого развития устойчивости).
• Профилактика и лечение атипичных микобактериозов у ВИЧ-инфицированных пациентов (в сочетании с азитромицином, ципрофлоксацином).
• Лепра (в сочетании с клофазимином, дапсоном, этионамидом).
• Тяжелые формы стафилококковой инфекции, вызванные MRSA (в сочетании с фузидовой кислотой, оксациллином, ванкомици-ном).
• Легионеллез (в сочетании с макролидами).
Для сохранения рифампицина в резерве как основного противотуберкулезного препарата, профилактики менингита у носителей менингококка, а также для профилактики инфекций, вызванных Н. influenzae типа B, вопрос о назначении рифампицина каждый раз необходимо решать индивидуально.
НЛР. ЖКТ: снижение аппетита, тошнота, рвота, диарея (как правило, временные). Печень: повышение активности трансаминаз; концентрации билирубина в крови; редко - лекарственный гепатит. Факторы риска: алкоголизм, заболевания печени, сочетание с другими туберкулостатиками. Гепатотоксичность чаще проявляется у быстрых ацетиляторов. Алкоголизм повышает риск гепатотоксич-ности. Новорожденным и недоношенным препарат назначают только по жизненным показаниям из-за возрастной незрелости ферментных систем печени, а у пожилых людей - из-за возможных возрастных изменений функций печени.
Аллергические реакции носят перекрестный характер с рифабу-тином: сыпь, эозинофилия, отек Квинке; кожный синдром (в начале лечения), проявляющийся покраснением, зудом кожи лица и головы, слезотечением. Гриппоподобный синдром: головная боль, лихорадка, боли в костях (чаще развивается при нерегулярном приеме). Гематологические реакции: тромбоцитопеническая пурпура (иногда с кровотечением при интермиттирующей терапии); нейтропения (чаще у пациентов, получающих рифампицин в сочетании с пира-зинамидом и изониазидом). Почки: обратимая почечная недостаточность, чаще в ассоциации с гепатоцеллюлярными нарушениями. Красное окрашивание мочи, мокроты, слюны, слез, контактных линз (эти реакции безвредны, становятся результатом ярко-оранжевого цвета препарата).
Противопоказания: непереносимость и тяжелые заболевания печени. Тератогенность - при беременности, лактации назначают только по жизненным показаниям.
Взаимодействия с другими ЛС
Рифампицин - индуктор микросомальных ферментов системы цитохрома P-450.
• Ослабляет эффект непрямых антикоагулянтов, оральных контрацептивов, глюкокортикоидов.
• Снижает концентрацию в крови и укорачивает действие оральных антидиабетических средств; дигитоксина, хинидина, циклоспорина, хлорамфеникола, доксициклина, кетоконазола, итрако-назола, в меньшей степени - флуконазола.
Пиразинамид снижает концентрацию рифампицина в крови в результате воздействия на его печеночный или почечный клиренс.
Комбинированные противотуберкулезные препараты
На основании рекомендованных ВОЗ протоколов применения курсов краткосрочной химиотерапии, имеющих две фазы лечения - начальную и фазу продолжения, были предложены комбинированные препараты. Они включают в себя различные сочетания препаратов I ряда: рифампицина, изониазида, пиразинамида. Наиболее оптимальны эти препараты при амбулаторном лечении и для пациентов с низкой комплаентностью.
Целесообразность сочетания рифампицина, изониазида и пира-зинамида объясняется обеспечением бактерицидного и стерилизующего эффекта в зоне туберкулезного воспаления пораженного органа в начальной фазе краткосрочной химиотерапии.
При приеме комбинированных ПТП необходимо помнить о возможности суммирования нежелательных реакций.
Комбинированные ПТП следует с осторожностью назначать пациентам с заболеваниями печени, подагрой, СД, пожилым людям. В процессе лечения необходим контроль функций печени и зрения, концентрации мочевой кислоты в плазме крови.