Клиническая фармакология и фармакотерапия: учебник. - 3-е изд., перераб. и доп. / под ред. В. Г. Кукеса, А. К. Стародубцева. - 2012. - 840 с.: ил.
|
|
|
|
Глава 30. ФАРМАКОТЕРАПИЯ ВИРУСНЫХ ИНФЕКЦИЙ
Вирусы - мельчайшие внутриклеточные паразиты. Центральная часть вируса состоит из нуклеиновой кислоты (ДНК или РНК), оболочка - белковая, иногда в сочетании с липидами. Воспроизведение вируса возможно только в клетках организма-хозяина. Это обусловлено тем, что для своего размножения (репликации) вирусы используют метаболические и ферментные системы клеток макроорганизма. Размеры вирусов не позволяют различить их в световом микроскопе, но, как и другие чужеродные агенты, вирусы стимулируют выработку антител (иммуноглобулины) в организме хозяина, что используют для проведения серологической диагностики.
Вирусы, поражающие людей, распространяются самим человеком при выделении через дыхательные пути (грипп) или с фекалиями (гепатит А). Ряд тяжелых вирусных инфекций (гепатит В и С, ВИЧ-инфекция) распространяются половым путем и с кровью. Для многих вирусных инфекций характерен длительный инкубационный период.
Некоторым вирусам свойственна онкогенность, например вирус Эпштейна - Барр ассоциируется с развитием лимфомы, вирус папилломы человека - рака половых органов, вирус гепатита С - печеночно-клеточного рака.
Диагностика вирусных инфекций
• Путем выявления нуклеиновой кислоты вируса методом ПЦР. Это наиболее чувствительный и специфичный из способов диагностики, но его можно применять только в период активной репликации вирусных частиц в организме.
• Серологические методы, основанные на выявлении антител к вирусам (обладают меньшей чувствительностью, чем ПЦР).
• Выявление вирусов путем заражения культур клеток (в практической медицине не используется).
В настоящее время в клиническую практику активно внедряют новые противовирусные ЛС, но их создание по-прежнему остается
сложным. Из-за того, что размножение вирусов происходит благодаря ферментным системам клеток хозяина, число вирусспецифичных ферментов, на которые должны оказывать влияние противовирусные средства, очень невелико. Большинство противовирусных препаратов в той или иной степени нарушают метаболизм клеток хозяина и, следовательно, обладают очень узким терапевтическим диапазоном.
Ниже приведена характеристика наиболее распространенных в клинической практике вирусных заболеваний.
30.1. ОСТРЫЕ РЕСПИРАТОРНЫЕ ВИРУСНЫЕ ИНФЕКЦИИ И ГРИПП
Острые респираторные вирусные инфекции
ОРВИ - большая группа вирусных инфекций, отличительной особенностью которых считают развитие воспалительного процесса в каком-либо участке верхних дыхательных путей (нос, околоносовые пазухи, горло, гортань, трахея и бронхи).
Этиология: пикорновирусы, РС-вирусы, вирусы парагриппа, аденовирусы.
Механизм передачи инфекции: воздушно-капельный. Инкубационный период: 1-3 сут.
Симптомы: неприятные ощущения в носу и горле, чиханье, насморк, недомогание. Могут отмечаться кашель, обильные выделения из носа, отделение мокроты. Диагноз устанавливают на основании клинических особенностей заболевания.
Течение: симптомы проходят самостоятельно через 4-10 сут. У некоторых больных могут возникнуть осложнения (бронхит, воспаление придаточных пазух носа), связанные с присоединением бактериальной инфекции.
Лечение. Антибиотики и противовирусные средства при ОРВИ не применяют. Показано симптоматическое лечение - НПВС, за исключением ацетилсалициловой кислоты, которая может усиливать выделение вируса и вызывать геморрагические осложнения у детей (синдром Рейе). По показаниям назначают ЛС, уменьшающие отечность слизистой оболочки носа, противокашлевые препараты. Больным с аллергическими заболеваниями можно добавить к лечению антигистаминные препараты. Популярным средством лечения считают высокие дозы аскорбиновой кислоты, но эффективность этого метода не подтверждена в ходе клинических исследований.
Грипп
Грипп - острое вирусное заболевание дыхательных путей, характеризующееся интоксикацией (высокой температурой тела, головной болью, недомоганием) и развитием воспалительного процесса в слизистой оболочке верхних дыхательных путей, чаще - трахеи. В тяжелых случаях возможны присоединение осложнений (пневмонии, геморрагического бронхита) и смерть. Кроме того, грипп часто осложняется синуситом, отитом, фронтитом, реже - миокардитом. Особенно тяжело грипп протекает у пожилых и ослабленных хроническими заболеваниями лиц, а также у беременных. В период эпидемий у лиц пожилого возраста учащаются инсульты и ИМ.
Этиология: заболевание вызывают вирусы гриппа А (клинически выраженный грипп, протекающий в виде эпидемий), вирусы гриппа В (также вызывает тяжелые формы заболевания) и С. У детей сходная клиническая картина отмечается при поражении парамиксо-, рино-и ЕСНО-вирусами.
Механизм передачи инфекции: воздушно-капельный.
Инкубационный период: 48 ч.
Симптомы. Заболевание начинается остро, с повышения температуры тела до 39-39,5 °С, озноба. Больные жалуются на резкую слабость, головную боль, боли в глазах, иногда - на головокружение и рвоту. Несколько позже присоединяются сухость и першение в области носоглотки, сухой кашель, заложенность носа. Могут отмечаться боли в спине и ногах. Развиваются гиперемия лица и конъюнктив. Существуют методы серологической диагностики, но обычно диагноз ставят на основании клинических особенностей заболевания.
Течение. Длительность заболевания не превышает 3-5 сут. Сохранение лихорадки и других симптомов более 5 сут свидетельствует о развитии осложнений (бронхите, пневмонии) и требуют дополнительного обследования. Основной причиной гибели больных становится молниеносное (за 48 ч) развитие тяжелой вирусной пневмонии с геморрагическими осложнениями и прогрессирующей сердечной недостаточностью.
Профилактика. Перенесенная инфекция формирует временный иммунитет к данному серологическому типу возбудителя, но организм остается восприимчивым к другим серотипам. Серотипы вируса гриппа А, вызывающего эпидемии, регулярно сменяют друг друга (антигенный дрейф). Существуют вакцины, состоящие из цельных тел инактивированных вирусов или их компонентов.
Из-за изменчивости антигенной структуры вируса применение этих вакцин для плановой коллективной вакцинации населения не дает желаемого результата, хотя и снижает заболеваемость. Ежегодная вакцинация особенно важна для пожилых людей, лиц с хроническими заболеваниями сердечно-сосудистой и дыхательной системы. Для профилактики гриппа применяют амантадин и римантадин
(табл. 30-1).
Лечение. Раннее назначение противовирусных ЛС позволяет быстро купировать лихорадку и поражение дыхательных путей (см. табл. 30-1). В большинстве случаев показано симптоматическое лечение - постельный режим и покой (до 1-2 сут после нормализации температуры), жаропонижающие (предпочтение отдают парацетамолу) ЛС, препараты, уменьшающие отечность слизистой оболочки носа, противокашлевые средства.
Аспирин больным гриппом детям противопоказан (синдром Рейе).
Парагрипп
Острое вирусное заболевание, поражающее верхние дыхательные пути, особенно гортань, и протекающее со слабо выраженной интоксикацией.
Этиология. Заболевание вызывают РНК-содержащие парамиксо-вирусы четырех серологических типов.
Клиническая картина различается в зависимости от серотипа возбудителя.
Заболевание чаще протекает с умеренным повышением температуры (для детей характерна высокая лихорадка), насморком, сухим кашлем, осиплостью голоса. Может осложняться развитием бронхита и пневмонии. Вирусы парагриппа - основная причина ложного крупа у детей. После перенесенного заболевания формируется частичный иммунитет к вирусу данного серотипа, что снижает тяжесть течения последующих инфекций.
Лечение. Специфического лечения нет. Лечебные мероприятия ограничиваются назначением симптоматических средств.
30.2. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ПРОТИВОГРИППОЗНЫХ ПРЕПАРАТОВ
Существует две группы противогриппозных препаратов, обладающих доказанной клинической эффективностью: блокаторы М2-каналов - амантадин, римантадин, и ингибиторы вирусной нейроаминидазы - занамивир, осельтамивир.
В настоящее время основным препаратом для лечения и профилактики гриппа, вызванного вирусом А, считают римантадин. Он был разработан в СССР путем модификации структуры амантадина. В РФ также применяют арбидол*, созданный на основе отечественных разработок. Следует отметить, что применение для лечения и профилактики гриппа многих других препаратов, таких, как дибазол, оксолиновая мазь*, теброфен*, флореналь*, интерферон альфа-2 в виде носовых капель, не имеет достаточных оснований с точки зрения доказательной медицины, поскольку их эффективность не изучена в рандомизированных клинических исследованиях.
Блокаторы М2-каналов
Механизм действия. Противовирусный эффект амантадина и римантадина реализуется путем блокирования особых ионных М2-каналов вируса гриппа А, в связи с чем нарушается его способность проникать в клетки и высвобождать рибонуклеопротеид. Тем самым ингибируется важнейшая стадия репликации вирусов.
Спектр активности. Амантадин и римантадин активны только в отношении вируса гриппа А. В процессе применения возможно развитие резистентности, частота которой к 5-м суткам лечения может достигать 30%.
Фармакокинетика. Амантадин и римантадин практически полностью, но относительно медленно всасываются из ЖКТ. Пища не влияет на биодоступность. Максимальные концентрации в крови достигаются в среднем через 2-4 ч. Связывание с белками плазмы крови амантадина - 67%, римантадина - 40%. Препараты хорошо распределяются в организме. При этом высокие концентрации создаются в тканях и жидкостях, которые первично контактируют с вирусом: в слизи носовых ходов, слюне, слезной жидкости. Концентрации римантадина в носовой слизи на 50% выше, чем в плазме. Препараты проходят через ГЭБ, плаценту. Амантадин проникает в грудное молоко. Римантадин примерно на 75% биотрансформируется в печени,
выводится почками преимущественно в виде неактивных метаболитов. Амантадин почти не подвергается метаболизму, выводится почками в активной форме. Период полувыведения амантадина составляет 11-15 ч, у пожилых людей может увеличиваться до 24-29 ч, у пациентов с почечной недостаточностью - до 7-10 сут. Период полувыведения римантадина - 1-1,5 сут, при тяжелой почечной недостаточности может увеличиваться до 2-2,5 сут. Оба препарата не удаляются при гемодиализе.
НЛР. ЖКТ: боль в животе, нарушение аппетита, тошнота. ЦНС: при применении амантадина у 14% пациентов, римантадина - у 3-6% возникают сонливость, бессонница, головная боль, головокружение, нарушения зрения, раздражительность, парестезии, тремор, судороги.
Показания. Лечение гриппа, вызванного вирусом А. Профилактика гриппа (если эпидемия вызвана вирусом А). Эффективность -
70-90%.
Ингибиторы нейроаминидазы
Механизм действия. Нейроаминидаза - один из ключевых ферментов, участвующих в репликации вирусов гриппа А и В. При ее ингибировании нарушается способность вирусов проникать в здоровые клетки, тормозится выход вирионов из инфицированной клетки и уменьшается их устойчивость к инактивирующему действию слизистого секрета дыхательных путей, причем тормозится дальнейшее распространение вируса в организме. Кроме того, ингибиторы ней-роаминидазы уменьшают продукцию некоторых цитокинов, препятствуя развитию местной воспалительной реакции и ослабляя системные проявления вирусной инфекции (лихорадка).
Спектр активности. Вирусы гриппа А и В. Частота резистентности клинических штаммов составляет 2%.
Фармакокинетика. Осельтамивир хорошо всасывается из ЖКТ. В процессе всасывания и при первом прохождении через печень превращается в активный метаболит (осельтамивира карбоксилат). Пища не влияет на биодоступность. Занамивир обладает низкой биодоступностью при приеме внутрь, и его вводят ингаляционно. При этом 10-20% препарата проникает в трахеобронхиальное дерево и легкие. Связывание препаратов с белками плазмы низкое - 3-5%. Метаболит осельтамивира создает высокие концентрации в основных очагах гриппозной инфекции - слизистой оболочке носа, среднем ухе, трахее, бронхах, легких. Оба препарата экскретируются преиму-
щественно с мочой. Период полувыведения занамивира - 2,5-5 ч, осельтамивира карбоксилата - 7-8 ч; при почечной недостаточности возможно его значительное увеличение, особенно у осельтамивира
(до 18 ч).
НЛР. ЖКТ: боль в животе, тошнота, рвота, диарея. ЦНС: головная боль, головокружение, бессонница, общая слабость. Другие: заложенность носа, боль в горле, кашель.
Показания. Лечение гриппа, вызванного вирусами А и В. Профилактика гриппа (только осельтамивир).
Противопоказания. Гиперчувствительность к занамивиру или осель-тамивиру. Тяжелая почечная недостаточность (осельтамивир).
30.3. ПРОСТОЙ ГЕРПЕС
Простой герпес - рецидивирующая инфекция, характеризующаяся появлением на коже или на поверхности слизистых оболочек единичных или множественных скоплений мелких пузырьков, заполненных прозрачной жидкостью и располагающихся на слегка приподнятом, воспаленном основании.
Этиология: известно два типа возбудителей герпеса: Herpes simplex-1 обычно вызывает поражение губ, а Herpes simplex-2 - поражение кожи и половых органов. Вирус способен персистировать (сохраняться) в латентном состоянии в нервных узлах.
Механизм передачи инфекции: контактный (в том числе при половых сношениях).
Симптомы: высыпания могут появляться на любом участке кожи или слизистых оболочек. Обычно появлению высыпаний предшествует зуд. Сыпь представлена единичными или множественными скоплениями мелких пузырьков (от 0,5 до 1,5 см в диаметре). Высыпания обычно болезненны. Спустя несколько дней пузырьки подсыхают с образованием корочек. Диагноз, как правило, устанавливают клинически, также существуют серологические методы диагностики.
Течение: заживление наступает через 8-12 сут. Течение заболевания может осложняться присоединением вторичной бактериальной инфекции.
Лечение. Местное применение ацикловира или других противо-герпетических лекарственных средств. При вторичных инфекциях - местное применение антибиотиков. При тяжелых формах инфекции (генерализованный герпес новорожденных) лечение проводят в усло-
виях стационара с применением внутривенных инъекций ациклови-ра. Системно ацикловир назначают и при рецидивирующем гени-тальном герпесе.
Опоясывающий лишай
Опоясывающий лишай - острое поражение ЦНС, в первую очередь нервных узлов, которое характеризуется появлением герпетических высыпаний и неврологическими болями в участках кожи, расположенных вдоль пораженных нервов.
Этиология: опоясывающий лишай и ветряную оспу вызывает один и тот же вирус. Вирусные частицы могут длительное время персистиро-вать в нервных узлах. К активации вируса приводит местное поражение нервных корешков или прием иммуносупрессирующих препаратов.
Симптомы: заболевание начинается с повышения температуры тела, общего недомогания и появления болей на отдельных участках тела (чаще только на одной стороне тела). Позднее (на 4-5-е сутки) на этих участках появляются характерные высыпания. Рецидивы отмечаются только в 4% случаев.
Лечение. Противовирусные средства (см. табл. 30-1). Симптоматическое - НПВС в сочетании с кодеином.
30.4. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ПРОТИВОГЕРПЕТИЧЕСКИХ СРЕДСТВ
К основным противогерпетическим ЛС с эффективностью, доказанной в рандомизированных клинических исследованиях, относят четыре близких по структуре препарата из группы аналогов нуклео-зидов - ацикловир, валацикловир, пенцикловир и фамцикловир. Причем валацикловир и фамцикловир представляют собой исходно неактивные соединения, которые в организме человека превращаются в ацикловир и пенцикловир соответственно. Все эти ЛС блокируют синтез ДНК у размножающихся вирусов герпеса, но не действуют на вирусы, находящиеся в латентном состоянии.
Для местного применения используются ацикловир, пенцикло-вир, идоксуридин®, фоскарнет натрия и тромантадин.
Механизм действия. Ацикловир считают родоначальником проти-вогерпетических препаратов - блокаторов синтеза вирусной ДНК. Противовирусное действие оказывает активный метаболит ацикло-
вира - ацикловира трифосфат, который образуется в клетках, пораженных вирусом герпеса. Ингибируя вирусную ДНК-полимеразу, ацикловира трифосфат блокирует синтез вирусной ДНК. Препарат обладает очень низкой токсичностью, так как не действует на ДНК-полимеразу клеток человека и неактивен в здоровых клетках.
Пенцикловир в пораженных вирусом клетках человека активируется, превращаясь в пенцикловира трифосфат, который нарушает синтез вирусной ДНК. Пенцикловир имеет длительный внутриклеточный период полувыведения (7-20 ч), что значительно выше, чем у ацикловира (менее 1 ч). Однако он обладает меньшим сродством к вирусной ДНК-полимеразе, чем фосфорилированный ацикловир.
В целом все три препарата (ацикловир, валацикловир и фамци-кловир) при приеме внутрь имеют сравнимую клиническую эффективность.
Фоскарнет натрия образует неактивные комплексы с ДНК-полимеразой герпетических вирусов и ЦМВ.
Спектр активности. Наиболее чувствительны к ацикловиру вирусы простого герпеса (ВПГ) 1-го и 2-го типа. Вирус Varicella -zoster более чем в 20 раз, а ЦМВ менее чем в 470 раз чувствителен к ацикловиру, чем ВПГ 1-го типа. Пенцикловир очень близок к ацикловиру по активности в отношении ВПГ 1-го и 2-го типа и вируса Varicella-zoster.
Фармакокинетика. Для приема внутрь применяют три препарата - ацикловир, валацикловир и фамцикловир, а внутривенно вводят только ацикловир. Наиболее низкую биодоступность при приеме внутрь имеет ацикловир (15-20%), но даже суточная доза (0,8-1,0 г) достаточна для подавления ВПГ. Валацикловир представляет собой валиновый эфир ацикловира, предназначен для приема внутрь и имеет более высокую биодоступность (54%). В процессе всасывания из ЖКТ и в печени он превращается в ацикловир. Биодоступность фамцикловира при приеме внутрь натощак - 70-80%. В ЖКТ он превращается в пенцикловир, который затем фосфорилируется в клетках, пораженных вирусом.
Пенцикловир применяют только наружно, так как при приеме внутрь он имеет очень низкую биодоступность (5%).
Ацикловир хорошо распределяется в организме. Проникает в слюну, внутриглазную жидкость, вагинальный секрет, жидкость герпетических пузырьков. Проходит через ГЭБ. При местном применении незначительно всасывается через кожу и слизистые оболочки.
Как ацикловир, так и пенцикловир экскретируются преимущественно почками, на 60-90% в неизмененном виде. Ацикловир
выводится путем клубочковой фильтрации и канальцевой секреции. Препараты имеют примерно сходный период полувыведения - 2-3 ч, у детей младшего возраста - до 4 ч. При почечной недостаточности (клиренс креатинина менее 30 мл/мин) период полувыведения значительно возрастает, что требует коррекции доз и режимов введения.
НЛР. Ацикловир, как правило, хорошо переносится пациентами, НЛР развиваются редко. Местные реакции: жжение при нанесении на слизистые оболочки, особенно при вагинальном применении; флебит при внутривенном введении. Системные реакции со стороны ЖКТ: боль или дискомфорт в животе, тошнота, рвота, диарея. У 1-4% пациентов при внутривенном введении ацикловира отмечаются заторможенность, тремор, судороги, галлюцинации, бред, экстрапирамидные расстройства. Симптомы обычно появляются в первые 3 сут лечения, связаны с высокой концентрацией ацикловира в сыворотке крови (более 25 мкг/мл) и постепенно исчезают по мере ее снижения. Из-за кристаллизации препарата в почечных канальцах у 5% пациентов при внутривенном введении развивается обструктив-ная нефропатия, проявляющаяся тошнотой, рвотой, болью в пояснице, азотемией. Меры профилактики: обильное питье. Меры помощи: отмена препарата, инфузионная терапия. Валацикловир по переносимости близок к ацикловиру для приема внутрь. По профилю безопасности у взрослых фамцикловир близок к ацикловиру. Наиболее частые НЛР - головная боль и тошнота.
Показания. Инфекции, вызванные ВПГ 1 и 2 типа: инфекции кожи и слизистых оболочек; офтальмогерпес (только ацикловир); генитальный герпес; герпетический энцефалит; неонатальный герпес. Инфекции, вызванные вирусом Varicella-zoster: опоясывающий лишай; ветряная оспа; пневмония; энцефалит. Профилактика ЦМВ инфекции после трансплантации почек (ацикловир, валацикловир).
Противопоказания. Аллергические реакции.
30.5. ХРОНИЧЕСКИЕ ВИРУСНЫЕ ГЕПАТИТЫ
Хронические вирусные гепатиты - группа хронических заболеваний, вызываемых гепатотропными (повреждающими печень) вирусами. Заболевание протекает с развитием хронического воспаления печени, которое обычно переходит в цирроз.
Этиология: чаще всего вирусы гепатита В и С.
Механизм передачи инфекции: инфекция передается через кровь (нарушение асептики при проведении медицинских процедур, инъекционные наркоманы) или контактно - через микроповреждения покровных тканей (в том числе половым путем).
Симптомы: после длительного (90-120 сут) периода инкубации заболевание начинается остро (желтуха, потемнение мочи). При этом у определенной части больных сохраняется персистирование вируса, повышение активности трансаминаз, свидетельствующее о хроническом воспалении печени. При гепатите С выраженные клинические симптомы и желтушный период часто отсутствуют, а диагноз гепатита впервые устанавливают при развитии в печени необратимых изменений.
На поздних этапах заболевания развиваются цирроз печени, синдром портальной гипертензии, который характеризуется накоплением жидкости в брюшной полости (асцит) и прогрессированием печеночной недостаточности. Вирус гепатита С часто вызывает развитие рака печени.
Диагностика основана на применении серологических методов и ПЦР. Методом ПЦР можно получить информацию об активности процесса репликации вируса.
Лечение. Решение о применении противовирусных средств (см. табл. 30-1) должен принимать специалист. Больным с хроническим гепатитом не следует назначать препараты с гепатотоксическим действием, индукторы микросомального окисления. Гепатопротекторы при хронических вирусных гепатитах не эффективны.
30.6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ПРЕПАРАТОВ ДЛЯ ЛЕЧЕНИЯ ХРОНИЧЕСКИХ ВИРУСНЫХ ГЕПАТИТОВ
Рибавирин
Синтетический препарат, близкий по структуре к нуклеотиду гуанозину. Обладает широким спектром активности в отношении многих ДНК- и РНК-содержащих вирусов и высокой токсичностью.
Механизм действия. Механизм противовирусного действия до конца не выяснен. Предполагают, что рибавирин вызывает уменьшение внутриклеточного пула гуанозина трифосфата и, таким образом, опосредованно понижает синтез нуклеиновых кислот вирусов.
Спектр активности. Клиническое значение имеет активность против РНК-содержащих вирусов, а также вирусов, вызывающих болезнь Ласса, геморрагическую лихорадку с почечным синдромом и гепатит С (в сочетании с интерферонами).
Фармакокинетика. Биодоступность при приеме внутрь - 45%, максимальная концентрация в крови достигается через 1-1,5 ч. При ингаляционном применении высокие концентрации отмечаются в секретах дыхательных путей и значительно более низкие - в плазме крови. Препарат не связывается с белками. Может накапливаться в эритроцитах. Проникает через ГЭБ. Биотрансформируется путем фосфорилирования в печени, экскретируется преимущественно с мочой. Период полувыведения при приеме внутрь - 27-36 ч, при достижении стабильной концентрации - 6 сут. После ингаляционного введения 30-55% препарата выводится с мочой в виде метаболита в течение 72-80 ч.
НЛР. Гематологические реакции: анемия, гемолитическая анемия, лейкопения, нейтропения, гранулоцитопения, тромбоцитопе-ния. Методы контроля: клинический анализ крови каждые 2 нед. ЦНС: астенический синдром, головная боль, бессонница, ощущение усталости, раздражительность. Местные реакции: сыпь, раздражение кожи, конъюнктивит (при ингаляционном применении вследствие длительного контакта с препаратом как у пациентов, так и у медицинского персонала). Сердце: снижение АД, брадикардия, асистолия. Требуется соответствующий клинический и инструментальный контроль. ЖКТ: анорексия, тошнота, металлический привкус во рту, боль в животе, метеоризм. Печень: гипербилирубинемия.
Показания. Инфекции, вызванные риносинтициальными вирусами (только серологически подтвержденные): тяжелый бронхиолит и пневмония у новорожденных и детей раннего возраста, относящихся к группе риска по летальному исходу (врожденный порок сердца, иммунодефицит, бронхолегочная дисплазия), на фоне тяжелого муковисцидоза или легочной гипертензии. Гепатит С (в сочетании с интерферонами). Геморрагическая лихорадка с почечным синдромом.
Противопоказания. Гиперчувствительность к рибавирину. Тяжелая печеночная и /или почечная недостаточность. Анемия. Гемоглобинопатия. Тяжелая сердечная недостаточность. Беременность. Кормление грудью.
Ламивудин
Синтетический аналог нуклеозида дезоксицитидина. Был создан как антиретровирусный препарат для лечения ВИЧ-инфекции. Затем было выявлено, что он обладает активностью и в отношении некоторых других вирусов.
Механизм действия. В клетках, пораженных вирусом, активируется, превращаясь в ламивудина трифосфат, который ингибирует ДНК-полимеразу вируса гепатита В и обратную транскриптазу ВИЧ.
Спектр активности. Клиническое значение имеет активность против ретровирусов (ВИЧ) и вируса гепатита В. При монотерапии может довольно быстро развиваться резистентность к ламивудину как вируса гепатита В, так и ВИЧ.
Фармакокинетика. Хорошо и быстро всасывается из ЖКТ. Пища существенно не влияет на биодоступность, но увеличивает время достижения пиковой концентрации в крови и несколько снижает ее (это не имеет клинического значения). Время достижения пиковой концентрации - 0,5-2 ч. Распределяется во многие ткани и жидкости, проходит через ГЭБ, плаценту. Связывание с белками плазмы низкое - 36%. Частично биотрансформируется, выводится преимущественно почками (около 70%) в неизмененном виде. Период полувыведения у взрослых - 2-11 ч, у детей - около 2 ч, при почечной недостаточности возрастает.
НЛР. ЖКТ: боль или дискомфорт в животе, тошнота, рвота, диарея. Печень: повышение активности АЛТ, гепатомегалия со стеатозом (возможно, связана с нарушением функции митохондрий - митохон-дриальная цитотоксичность). Нервная система: утомляемость, головная боль, головокружение, слабость, бессонница, периферическая нейропатия, парестезии (чаще у детей). Кровь: нейтропения, анемия. Аллергические реакции: сыпь.
Показания. Хронический гепатит В. Лечение и профилактика ВИЧ-инфекции.
Противопоказания. Гиперчувствительность к ламивудину. Беременность. Кормление грудью.
Телбивудин
Противовирусный препарат, синтетический тимидиновый аналог нуклеозида.
Механизм действия. Блокирует активность фермента ДНК-полимеразы вируса гепатита В. Включение телбивудина-5-трифосфата
в структуру вирусной ДНК вызывает обрыв ее цепи и подавление репликации вируса гепатита В.
Спектр активности. Клиническое значение имеет активность против вируса гепатита В. Препарат не действует на другие РНК- и ДНК-содержащие вирусы, включая ВИЧ.
Фармакокинетика. T1/2 составляет примерно 15 ч. Телбивудин не является субстратом, ингибитором или индуктором ферментной системы цитохрома Р-450. Выводится преимущественно с мочой в неизмененном виде.
НЛР. ЖКТ: тошнота, диарея. Печень: повышение активности АЛТ, АСТ. Нервная система: утомляемость, головная боль, периферическая нейропатия. Аллергические реакции: сыпь.
Показания. Хронический гепатит В с подтвержденной репликацией вируса и активным воспалительным процессом в печени.
Интерфероны
Интерфероны - биологически активные белки, которые синтезируются клеткой в процессе защитной реакции. Они секретируются во внеклеточную жидкость и через рецепторы действуют на другие клетки, повышая устойчивость к внутриклеточным микроорганизмам, в первую очередь - вирусам. По структуре и биологическим свойствам интерфероны разделяют на три вида: интерферон альфа, интерферон бета и интерферон гамма. По способу получения выделяют лейкоцитарные, лимфобластоидные и рекомбинантные интерфероны.
В качестве противовирусных препаратов наиболее широко применяют рекомбинантные интерфероны альфа. Все они представляют собой рекомбинантную форму человеческого интерферона альфа-2, и их фармакологическое действие сходно. В зависимости от содержания аминокислот выделяют интерферон альфа-2а и интерферон альфа-2Ь, которые существенно не отличаются по клинической эффективности и безопасности. В настоящее время разработаны пегилированные интерфероны, получаемые путем присоединения к молекуле интерферона полиэтиленгликоля. Пегилированные интерфероны обладают более длительным периодом полувыведения и лучшей клинической эффективностью.
Лейкоцитарные интерфероны в настоящее время практически не применяют из-за недостаточной стабильности состава, наличием в препарате других пептидов и медиаторов иммунной системы. Кроме того, невозможно полностью исключить риск контаминирова-
ния лейкоцитарных интерферонов вирусами, передающимися через кровь. Интраназальное применение лейкоцитарных интерферонов неоправдано в связи с отсутствием доказательств их эффективности при острых респираторных вирусных инфекциях (ОРВИ) и гриппе.
Классификация интерферонов
• Лимфобластоидные: интерферон альфа-п1.
• Рекомбинантные: интерферон альфа-2а, интерферон альфа-2b.
• Пегилированные: пегинтерферон альфа-2а, пегинтерферон альфа-2b.
Механизм действия. Основной механизм противовирусного действия интерферонов заключается в подавлении синтеза вирусных белков. Рекомбинантные интерфероны альфа обладают основными свойствами природных интерферонов человека. Они оказывает противовирусное действие, индуцируя в клетках состояние резистентности к вирусным инфекциям и модулируя ответную реакцию иммунной системы, направленную на нейтрализацию вирусов или уничтожение инфицированных ими клеток (рис. 30-1).
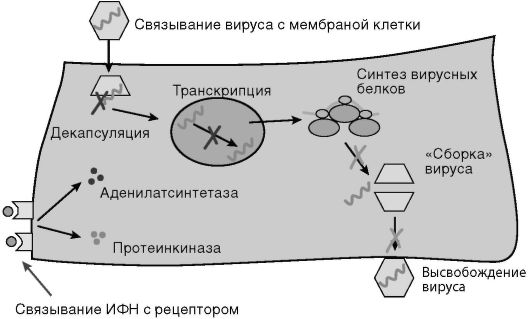
Рис. 30-1. Внутриклеточные механизмы противовирусного действия интерферона
Спектр активности. Интерфероны альфа не обладают специфичностью и подавляют репликацию различных вирусов. Основное кли-
ническое значение имеет активность в отношении вирусов гепатита В, С и D.
Фармакокинетика. Являясь белками, интерфероны разрушаются в ЖКТ, из-за этого их можно вводить только парентерально. При внутримышечном и подкожном введении биодоступность составляет 80%, максимальная концентрация в крови достигается в среднем через 3,8 ч. Отмечены низкие концентрации интерферонов в отделяемом дыхательных путей, тканях глаза, ЦНС. Подвергаются быстрой инактивации в почках и в меньшей степени - в печени. Период полувыведения - 2-4 ч, при почечной недостаточности не изменяется. Фармакокинетика пегинтерферонов изучена несколько меньше. Максимальная концентрация в крови достигается в течение 15-44 ч, причем она в 10 раз выше, а площадь под фармакокинетической кривой в 50 раз больше, чем у обычного интерферона альфа. Период полувыведения - 40 ч.
НЛР. Имеют дозозависимый характер. Бывают ранние, возникающие чаще на первой неделе лечения, и поздние, развивающиеся на 2-6-й неделе приема препарата. Ранние (на 1-й неделе лечения) - гриппоподобный синдром с лихорадкой, миалгией, болезненностью глазных яблок и обычно не требует отмены препарата. Поздние (на 2-6-й неделе лечения, обычно бывают причиной отмены интерферона) - анемия, тромбоцитопения, агранулоцитоз, заторможенность, депрессия, аритмии, транзиторная кардиомиопатия, артериальная гипотензия, аутоиммунный тиреоидит, гиперлипидемия, алопеция.
Показания. Лимфобластоидный и рекомбинантный интерферон альфа - хронический гепатит В. Острый гепатит С. Хронический гепатит С (иногда в сочетании с рибавирином). Хронический гепатит D.
Пегинтерфероны - хронический гепатит С.
Противопоказания. Гиперчувствительность к препаратам. Психоз (на момент лечения или в анамнезе). Тяжелая депрессия. Нейтро-пения или тромбоцитопения. Декомпенсированные заболевания сердечно-сосудистой системы. Декомпенсированный цирроз печени. Неконтролируемые судороги. Трансплантация органов (кроме печени). Беременность. Цирроз печени (кроме пегинтерферонов).
30.7. ВИРУС ИММУНОДЕФИЦИТА ЧЕЛОВЕКА
ВИЧ - инфекция, вызываемая рядом ретровирусов и проявляющаяся разнообразными клиническими состояниями от бессимптом-
ного носительства до тяжелого и смертельного заболевания - синдрома приобретенного иммунодефицита (СПИД). СПИД - вторичный иммунодефицитный синдром, развивающийся у больных с ВИЧ-инфекцией и характеризующийся оппортунистическими инфек-циями1, злокачественными новообразованиями и неврологическими проявлениями.
Этиология: ВИЧ-инфекцию вызывает ретровирус, получивший название ВИЧ. Данный вирус инфицирует субпопуляцию CD4 Т-лимфоцитов (Т-хелперы) и некоторые другие клетки легких, головного мозга, кожи и лимфатических узлов, вызывая их гибель.
Механизм передачи инфекции: инфекция передается через жидкости организма, в состав которых входит плазма или инфицированные клетки: кровь, семенная жидкость, секрет влагалища, слюна. Передача инфекции от матери ребенку может происходить непосредственно через плаценту, в родах или через грудное молоко.
Симптомы. Для ВИЧ-инфекции характерно наличие длительного (до нескольких лет) бессимптомного периода, в течение которого вирусы практически не размножаются. Развернутая клиника СПИД характеризуется появлением оппортунистических инфекций (пнев-моцистная пневмония, туберкулезный и пневмококковый менингит), опухолей (саркома Капоши, лимфома головного мозга), неврологическими симптомами (периферические нейропатии, менингит, судорожные припадки, прогрессирующее слабоумие).
Для диагностики заболевания используют серологические тесты - определение антител к белкам ВИЧ методом твердофазного иммуноферментного анализа (ELISA-тест). При положительных результатах ELISA-теста для подтверждения диагноза выполняют более специфичный тест - вестерн-блоттинг. Показателем тяжести заболевания, позволяющим судить о прогнозе и риске осложнений, считают количество циркулирующих СD4Т-лимфоцитов (именно эти клетки становятся основной мишенью вируса и погибают при его массовом размножении в организме).
Лечение. ВИЧ быстро вырабатывает устойчивость к действию всех существующих в настоящее время противовирусных ЛС, в силу этого противовирусное лечение способно только замедлить прогрессиро-вание заболевания.
1 Оппортунистические инфекции - инфекции, возникающие при повреждении физиологических и иммунологических защитных механизмов организма. Микроорганизмы, выступающие в качестве возбудителей при оппортунистических инфекциях, как правило, не вызывают заболеваний у лиц с сохранным иммунитетом.
Показанием к лечению считают снижение количества циркулирующих СD4Т-лимфоцитов менее 350-500 106/л и /или высокую степень репликации вируса (определяется при ПЦР). Кроме того, высокие дозы противовирусных препаратов применяют в родах у ВИЧ-инфицированных женщин, что позволяет снизить риск передачи инфекции при движении новорожденного по родовым путям.
Для лечения назначают зидовудин, ламивудин, индинавир, ста-вудин, диданозин.
30.8. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ АНТИРЕТРОВИРУСНЫХ ПРЕПАРАТОВ
Антиретровирусные препараты применяют для лечения и профилактики ВИЧ-инфекции. Существует три класса этих препаратов.
• Нуклеозидные ингибиторы обратной транскриптазы ВИЧ (зидо-вудин, фосфазид, ставудин, диданозин, ламивудин, абакавир, комбинированные препараты: зидовудин + ламивудин, зидову-дин + ламивудин + абакавир).
• Ненуклеозидные ингибиторы обратной транскриптазы ВИЧ: невирапин и ифавиренц*3.
• Ингибиторы протеазы ВИЧ: ампренавир, саквинавир, индина-вир, ритонавир, нелфинавир.
Общие показания к применению антиретровирусных препаратов. Лечение инфекции, вызванной ВИЧ-1 и ВИЧ-2 (зидовудин, фос-фазид, ставудин, диданозин, зальцитабин, ламивудин, абакавир). Профилактика перинатальной ВИЧ-инфекции (зидовудин, фосфа-зид). Химиопрофилактика ВИЧ-инфекции у новорожденных (зидо-вудин). Химиопрофилактика парентерального заражения ВИЧ (зидо-вудин, фосфазид, ставудин, диданозин, ламивудин, абакавир).
Нуклеозидные ингибиторы обратной транскриптазы вируса иммунодефицита человека
Механизм действия. В основе структуры всех нуклеозидных ингибиторов обратной транскриптазы лежит один из аналогов природного нуклеозида (тимидин, аденин, цитидин или гуанин), что обусловливает общее свойство метаболитов каждого из препаратов блокировать обратную транскриптазу ВИЧ и избирательно ингибировать репликацию вирусной ДНК. Под действием соответствующих фер-
ментов препараты трансформируются с образованием трифосфатов, которые и проявляют фармакологическую активность. Способность препаратов этой группы ингибировать обратную транскриптазу ВИЧ в сотни раз выше, чем способность подавлять ДНК-полимеразу человека. Нуклеозидные ингибиторы обратной транскриптазы активны в инфицированных ВИЧ Т-клетках и макрофагах, ингибируют ранние стадии жизненного цикла вируса.
Зидовудин
Аналог тимидина. Первый антиретровирусный препарат.
Фармакокинетика. Хорошо всасывается из ЖКТ, пища (особенно жирная) несколько уменьшает биодоступность. Время достижения пиковой концентрации в сыворотке - 0,5-1,5 ч, в СМЖ - 1 ч. Связывание с белками плазмы низкое (30-38%). Проникает через ГЭБ, плаценту и в семенную жидкость. Подвергается биотрансформации в печени до неактивного метаболита, выводится почками. Период полувыведения - 1,1 ч, клеточный - 3,3 ч.
НЛР. ЖКТ: наиболее часто - тошнота и рвота, редко - нарушения вкуса, боль в животе, диарея, анорексия, метеоризм. Печень: повышение активности трансаминаз, стеатоз. Гематологические реакции: анемия, нейтропения, лейкопения, тромбоцитопения. Нервная система: слабость, повышенная утомляемость, головная боль, бессонница, астенический синдром, сонливость, депрессия, периферические нейропатии, парестезии.
Противопоказания. Гиперчувствительность к зидовудину. Лейкопения (количество нейтрофилов менее 0,75 109/л). Анемия (концентрация гемоглобина менее 70 г/л).
Ненуклеозидные ингибиторы обратной транскриптазы вируса иммунодефицита
К группе ненуклеозидных ингибиторов обратной транскриптазы относятся невирапин и ифавиренц*3. Они ингибируют ранние стадии жизненного цикла вируса, поэтому активны в отношении остро инфицированных клеток.
Спектр активности. Клиническое значение имеет активность ненуклеозидных ингибиторов обратной транскриптазы в отношении ВИЧ-1. В то же время против ВИЧ-2 препараты данной группы неактивны.
Показания. Комбинированное лечение инфекции, вызванной ВИЧ-1 (невирапин, ифавиренц*3). Профилактика передачи инфекции, вызванной ВИЧ-1, от матери к новорожденному (невирапин). Химиопрофилактика парентерального заражения ВИЧ (ифавиренц*3).
Невирапин
Механизм действия. Вызывает разрушение каталитического участка обратной транскриптазы ВИЧ-1. Блокирует активность РНК- и ДНК-зависимой полимеразы. Не ингибирует обратную транскриптазу ВИЧ-2 и человеческой α-, β-, γ- или σ-ДНК-полимеразы. При монотерапии быстро и практически всегда развивается устойчивость вирусов. Активен в остро инфицированных ВИЧ Т-клетках, ингибирует ранние стадии жизненного цикла вируса. В сочетании с зидовудином уменьшает концентрацию вирусов в сыворотке и увеличивает количество CD4-клеток; замедляет прогрессирование заболевания.
Фармакокинетика. Хорошо всасывается из ЖКТ, биодоступность не зависит от приема пищи. Время достижения пиковой концентрации в крови - 4 ч. Связывание с белками плазмы - 60%. Обладает высокой липофильностью. Хорошо проходит через ГЭБ, концентрация в СМЖ достигает 45% концентрации в плазме. Проходит через плаценту, накапливается в грудном молоке. Биотрансформируется в печени, выводится преимущественно почками. Период полувыведения - 20-45 ч.
НЛР. Симптомы гиперчувствительности: сыпь (у 17% пациентов), лихорадка, артралгия, миалгия. В редких случаях развивается токсический эпидермальный некролиз, синдром Стивенса - Джонсона. ЖКТ: тошнота, стоматит. ЦНС: головная боль, утомляемость, сонливость. Гематологические реакции: гранулоцитопения. Печень: гепатит (чаще у пациентов с хроническим вирусным гепатитом, а также у злоупотребляющих алкоголем).
Противопоказания. Гиперчувствительность к невирапину.
Ингибиторы протеазы вируса иммунодефицита
К ингибиторам протеазы ВИЧ относят саквинавир, индинавир, ритонавир, нелфинавир и ампренавир.
Механизм действия. Протеаза ВИЧ - фермент, необходимый для протеолитического расщепления полипротеиновых предшественников вируса на отдельные белки, входящие в состав ВИЧ. Расщепление вирусных полипротеинов крайне важно для созревания
вируса, способного к инфицированию. Ингибиторы протеаз блокируют активный центр фермента и нарушают образование белков вирусного капсида. Препараты этой группы подавляют репликацию ВИЧ, в том числе при резистентности к ингибиторам обратной транс-криптазы. В результате угнетения активности ВИЧ-протеазы формируются незрелые вирусные частицы, неспособные к инфицированию других клеток.
Спектр активности. Клиническое значение имеет активность препаратов этой группы против ВИЧ-1 и ВИЧ-2.
Показания. Лечение ВИЧ-инфекции в составе комбинированной терапии. Химиопрофилактика парентерального заражения ВИЧ.
Саквинавир
Первый препарат группы ингибиторов протеаз, внедренный в клиническую практику в 1995 г.
Фармакокинетика. Всасывается из ЖКТ на 30%, но биодоступность составляет всего 4%, что обусловлено эффектом «первого прохождения» через печень. Пища (особенно жирная) существенно повышает биодоступность саквинавира. Время достижения пиковой концентрации в крови - 4 ч. Связывание с белками плазмы - 98%. Хорошо распределяется, но практически не проходит через ГЭБ. Биотрансформируется в печени, выводится в основном с калом. Период полувыведения - 1-2 ч. При длительном приеме кумулиру-ет.
НЛР. ЖКТ: диарея, боль в животе, тошнота. Полость рта: изъязвление слизистой оболочки, фарингит. Гематологические реакции: гемолитическая анемия. Метаболические нарушения: перераспределение подкожной жировой клетчатки, повышение концентрации ХС (в том числе липопротеидов низкой плотности), триглицеридов, гипергликемия (иногда развивается СД II типа). Нервная система: головная боль, спутанность сознания, атаксия, слабость, головокружение, астенический синдром, судороги, периферические нейропа-тии, онемение конечностей. Кожа: сыпь, зуд, синдром Стивенса - Джонсона, дерматит. Опорно-двигательный аппарат: боль в мышцах и суставах, остеопороз.
Противопоказания. Гиперчувствительность к саквинавиру. Печеночная недостаточность.