Клиническая фармакология и фармакотерапия: учебник. - 3-е изд., перераб. и доп. / под ред. В. Г. Кукеса, А. К. Стародубцева. - 2012. - 840 с.: ил.
|
|
|
|
Глава 17. САХАРНЫЙ ДИАБЕТ
САХАРНЫЙ ДИАБЕТ
Сахарный диабет (СД) - группа заболеваний, которая характеризуется хронической гипергликемией1. В основе патогенеза СД лежит недостаточность инсулина в организме, которая может быть:
- абсолютной - при нарушении секреции инсулина;
- относительной:
◊ при уменьшении количества рецепторов к инсулину на поверхности клеток и развитии толерантности клеток к его действию;
◊ при увеличении синтеза глюкозы в организме2.
Эпидемиология сахарного диабета
СД - наиболее распространенное заболевание желез внутренней секреции: в 2000 г. в мире было зарегистрировано 151 млн больных СД II типа. Число больных с СД I типа примерно в 4 раза меньше. Большинство больных СД одновременно страдают еще целым рядом заболеваний, наиболее частые из которых - атеросклероз, ИБС и АГ. Примерно 25% больных СД нуждаются в постоянном введении препаратов инсулина.
Этиология и патогенез сахарного диабета
Инсулин - полипептидный гормон, состоящий из двух аминокислотных цепей. Синтез инсулина происходит в β-клетках островков Лангерганса поджелудочной железы. Синтезированный инсулин накапливается в секреторных гранулах этих клеток в виде кристаллов, содержащих цинк.
1 Гипергликемия - повышение концентрации глюкозы в крови выше 6,1 ммоль/л.
2 Некоторые гормоны (глюкогон, адреналин и глюкокортикоиды) стимулируют синтез глюкозы в организме и /или тормозят синтез инсулина.
Высвобождение инсулина из секреторных гранул в кровь происходит под влиянием различных факторов1, важнейший из которых - повышение концентрации глюкозы в крови (после приема пищи наблюдается повышение секреции инсулина). В процессах высвобождения инсулина из β-клеток островков Лангерганса принимают участие калиевые каналы, проницаемость которых регулируется АТФ. При повышении концентрации глюкозы в крови увеличивается ее поступление в β-клетки, что приводит к увеличению синтеза АТФ и закрытию калиевых каналов. Этот процесс вызывает деполяризацию клеточной мембраны и увеличение поступления в клетку ионов Са++, что приводит к высвобождению инсулина из гранул.
Метаболизм инсулина. В плазме инсулин не имеет белка-носителя, соответственно период его полураспада не превышает 5-7 мин. Метаболизм инсулина особенно активно происходит в печени и почках (у беременных в плаценте). За один проход через печень из плазмы исчезает до 50% содержащегося в ней инсулина. В метаболизме инсулина принимают участие две ферментные системы: инсулин-специфическая протеиназа, содержащаяся во многих тканях организма, но преимущественно в печени и почках; глутатион-инсулин-трансгидрогеназа.
На поверхности клеток молекулы инсулина взаимодействуют с инсулиновыми рецепторами, которые представляют собой гликопро-теиновые комплексы, состоящие из двух субъединиц (α и β), связанных между собой дисульфидными мостиками. α-Субъединица расположена внеклеточно и отвечает за связь с молекулой инсулина, а β-субъединица - за преобразование сигнала. Рецепторы к инсулину постоянно синтезируются и распадаются, в среднем период жизни рецептора на поверхности мембраны составляет 7-12 ч, а их количество на поверхности одной клетки достигает 20 тыс.
У некоторых больных СД протекает с образованием антител, которые препятствуют связыванию рецептора с инсулином, что приводит к инсулинорезистентности. Дефекты строения рецепторов, обусловленные генетически, встречаются крайне редко.
Физиологические эффекты инсулина в организме
• Стимулирует транспорт глюкозы через мембрану клетки с помощью облегченной диффузии. Скорость поступления глюкозы в мышечные и жировые клетки определяет интенсивность ее
1 α-Адреномиметики (эпинефрин) тормозят секрецию инсулина даже в присутствии глюкозы, β-адреномиметики обладают противоположным действием.
фосфорилирования и дальнейшего метаболизма. Примерно половина глюкозы, поступившей в организм, расходуется на энергетические нужды (гликолиз), от 30 до 40% превращается в жиры, а около 10% - в гликоген.
• Снижает концентрацию глюкозы в плазме крови.
• Ингибирует глюконеогенез.
• Ингибирует липолиз.
• Стимулирует синтез белков и тормозит их распад - анаболическое действие.
• Стимулирует рост и размножение клеток.
Недостаточность инсулина при СД приводит в первую очередь к снижению поглощения глюкозы клетками и к гипергликемии. Особенно высокая концентрация глюкозы в плазме крови наблюдается вскоре после приема пищи (так называемая постпрандиальная гипергликемия).
В норме почечные клубочки непроницаемы для глюкозы, но при повышении ее концентрации в плазме выше 9-10 ммоль/л она начинает активно выделяться с мочой (глюкозурия). Это, в свою очередь, приводит к повышению осмотического давления мочи, замедлению реабсорбции воды и электролитов. Объем суточной мочи увеличивается до 3-5 л (в тяжелых случаях - 7-8 л) - развивается полиурия, а как следствие - обезвоживание (гипогидрата-ция) организма (рис. 17-1), что сопровождается сильной жаждой. При отсутствии инсулина происходит избыточное расщепление белков и жиров, которые используются клетками в качестве источников энергии. Из-за этого, с одной стороны, организм теряет азот (в виде мочевины) и аминокислоты, а с другой стороны, в нем накапливаются токсичные продукты липолиза - кетоны1. Они имеют очень большое значение в патофизиологии СД: выведение из организма сильных кислот (ацетоуксусная и β-гидроксимасляная кислота) приводит к потере буферных катионов, истощению щелочного резерва и кетоацидозу. Особенно чувствительны к изменению осмотического давления крови и параметров кислотно-основного равновесия ткани головного мозга. Таким образом, нарастание кетоацидоза может приводить к кетоацидотической коме, а затем к необратимым повреждениям нейронов и смерти больного.
1 Ацетил-КоА, образующийся в печени в процессе быстрого окисления жирных кислот, затем превращается в ацетоуксусную кислоту, которая переходит в β -гидроксимасляную кислоту и декарбоксилируется до ацетона. Продукты липолиза можно обнаружить в крови и моче больных (кетоны или кетоновые тела).
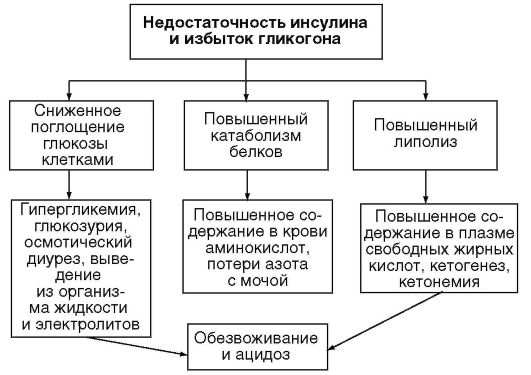
Рис. 17-1. Патофизиология недостаточности инсулина в организме
СД вызывает целый ряд осложнений, которые могут оказаться более тяжелыми, чем основное заболевание, привести к инвалидности и смерти больных. В основе большинства осложнений лежит повреждение кровеносных сосудов при атеросклерозе и гликозили-ровании белков (присоединении глюкозы к молекулам белков).
Основные осложнения сахарного диабета
• Атеросклероз (увеличение концентрации в крови свободных жирных кислот), который, в свою очередь, приводит к развитию макрососудистых осложнений (атеросклероз - непосредственная причина гибели 65% больных СД):
- ИМ;
- инсульта.
• Нефропатия (повреждение почек) с прогрессированием ХПН (встречается у 9-18% больных).
• Нейропатия (преимущественно поражаются периферические нервы).
• Ретинопатия (повреждение сетчатки, приводящее к слепоте) и катаракта (уменьшение прозрачности хрусталика).
• Снижение резистентности организма к инфекционным заболеваниям.
• Трофические нарушения (с образованием длительно незаживающих язв). Отдельно выделяют синдром диабетической стопы, под которым понимают инфекцию, язву и /или деструкцию глубоких тканей стопы, связанную с неврологическими нарушениями (нейропатия) и снижением магистрального кровотока (ангио-патия) в артериях нижних конечностей. Синдром диабетической стопы - наиболее частое осложнение диабета.
Классификация сахарного диабета
В настоящее время различают две основные клинические формы
СД:
- СД I типа;
- СД II типа.
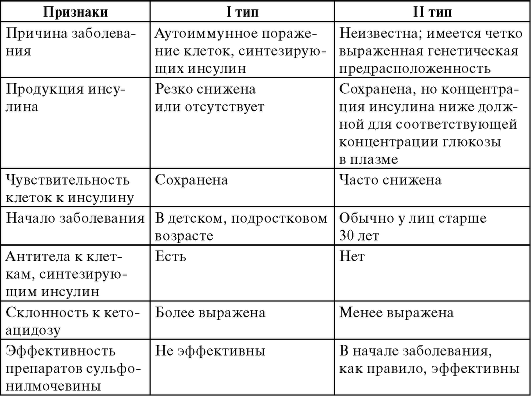
Сравнительная характеристика этих типов диабета представлена в табл. 17-1.
Таблица 17-1. Сравнительная характеристика основных типов сахарного диабета
Окончание табл. 17-1

СД I типа - полиэтиологический синдром, обусловленный абсолютным дефицитом инсулина, что приводит к нарушению углеводного, а затем и других видов метаболизма. СД I типа развивается в результате аутоиммунного разрушения инсулинпродуцирующих клеток поджелудочной железы (аутоиммунный вариант) или спонтанно (идиопатический вариант). СД I типа - аутоиммунное заболевание, при котором специфические антитела повреждают β-клетки островков Лангерганса, постепенно (в течение нескольких лет) приводя к их полной гибели. СД I типа обычно развивается в молодом возрасте и требует пожизненной заместительной терапии инсулином.
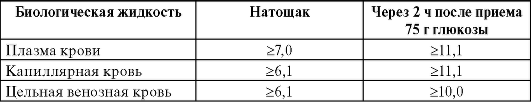
Диагноз СД I типа ставят только при обязательном определении концентрации глюкозы в плазме крови (гликемии), а также на основании типичной клинической картины (прогрессивное снижение массы тела, развитие кетоацидоза, прогрессирующая физическая слабость) (табл. 17-2).
Таблица 17-2. Лабораторные критерии СД по концентрации глюкозы в крови (моль/л)
Лечение СД I типа включает в себя диетотерапию, физические нагрузки, инсулинотерапию. Большое значение имеет обучение больных, так как именно больной становится основным исполнителем медицинских рекомендаций.
СД II типа - синдром гипергликемии, хроническое заболевание, вызванное преимущественной инсулинорезистентностью и относительной инсулиновой недостаточностью, либо преимущественным дефектом секреции инсулина с инсулинорезистентностью или без нее. СД II типа составляет 80% всех случаев СД. СД II типа
обычно заболевают в зрелом возрасте. У этих больных часто имеется генетическая предрасположенность и характерно сохранение (частичное) синтеза инсулина. Заместительная терапия инсулином больным с СД II типа, как правило, не нужна.
Встречаются и другие виды диабета: диабет беременных, диабет на фоне болезни Иценко - Кушинга1 или длительного приема глю-кокортикоидов, а также у лиц с тяжелыми поражениями поджелудочной железы (острый и хронический панкреатит).
Симптомокомплекс сахарного диабета
Основные признаки заболевания - быстрая утомляемость, полиурия (увеличение объема мочи), полидипсия (жажда, частое питье) и полифагия (повышенный аппетит). Кроме того, характерны кожные проявления (зуд, особенно в области промежности, фурункулы, карбункулы), ухудшение зрения, похудение, раздражительность.
В течении СД выделяют состояние компенсации и декомпенсации. В последнем случае у больного развивается обезвоживание (сухость кожи и слизистых оболочек), заторможенность, резко усиливается жажда. У больных с декомпенсацией СД имеется высокий риск развития кетоацидотической комы. Непосредственными причинами декомпенсации СД могут стать стресс, чрезмерная физическая нагрузка, грубое нарушение диеты, инфекции, обострение сопутствующих заболеваний. Кома при СД может развиваться как при гипер-, так и при гипогликемических состояниях. Гипогликемия - состояние, при котором концентрация глюкозы в крови менее 3,5 ммоль/л, что сопровождается активацией кон-тринсулярных гормонов (в первую очередь - выброс надпочечниками катехоламинов). Гипогликемическая кома развивается быстро (в течение нескольких минут), проявляется резкой слабостью, тахикардией, холодным потом, потерей сознания. При отсутствии экстренной помощи гипогликемическая кома может привести к смерти больного. Гипергликемическое состояние характеризуется медленным, постепенным нарастанием симптомов: жаждой, вялостью, заторможенностью вплоть до потери сознания и развитием гипер-гликемической комы.
1 Синдром и болезнь характеризуются повышенным синтезом глюкокортикоидов при наличии у больного гормонопродуцирующих опухолей.
Диагноз и методы обследования больных с сахарным диабетом
Наличие СД можно заподозрить на основании характерных жалоб (полиурия, полидипсия и полифагия).
При осмотре отмечается ожирение (СД II типа) или снижение массы тела (СД I типа), часто выявляют сухость кожных покровов. В далеко зашедших случаях заболевания могут иметься трофические нарушения (язвы, гангрена нижних конечностей).
Однако для подтверждения диагноза необходимы лабораторные исследования - определение концентрации глюкозы в крови и моче. Иногда для подтверждения диагноза необходимо выполнение нагрузочного теста с глюкозой.
Для диагностики кетоацидоза используют анализ мочи на кетоновые тела.
Критерием наличия у больного СД считают увеличение концентрации глюкозы в крови натощак более 6,1 ммоль/л.
Клинико-фармакологические подходы к лечению сахарного диабета I типа
Всем больным с СД I типа показана пожизненная заместительная терапия инсулином.
Секреция инсулина у здорового человека происходит в течение дня неравномерно. Можно выделить следующие периоды:
- базальную (фоновую) секрецию инсулина, величина которой не зависит от приема пищи и составляет примерно 1 ЕД инсулина в час;
- во время еды происходит добавочная (стимулированная) секреция инсулина - около 1-2 ЕД инсулина на каждые 10 г углеводов, поступающих в организм.
Из этого следует, что заместительная терапия инсулином должна имитировать сложную физиологическую кинетику секреции инсулина: перед едой больной должен получать препарат инсулина с короткой продолжительностью действия, а для поддержания необходимой концентрации инсулина в промежутках между приемами пищи, а также ночью - длительно действующие препараты с медленным (1 ЕД/час) высвобождением действующего вещества.
Необходимая для лечения больного доза ЛС зависит от концентрации глюкозы в крови, которая, в свою очередь, зависит от целого ряда факторов - характера питания, физических нагрузок, наличия забо-
леваний, предрасполагающих к декомпенсации. Избыточная концентрация инсулина еще более опасна для больного, чем его недостаточность; это обусловлено тем, что при избытке инсулина возникает опасное для жизни гипогликемическое состояние. Следовательно, адекватное и безопасное лечение можно обеспечить только в том случае, если больной прошел специальное обучение, которое должно включать в себя следующие аспекты:
- знакомство с правилами рационального питания при СД (ограничение легкоусвояемых углеводов);
- оценку энергетической ценности пищи (для этого используют специальные таблицы или систему «хлебных единиц»1);
- обучение правильной технике введения инсулина;
- обучение правилам профилактики осложнений диабета (уход за стопами, с целью предупреждения развития синдрома диабетической стопы);
- знакомство больных с симптомами гипогликемии и методами неотложной помощи при этом состоянии;
- инструктаж больных о допустимом уровне физических нагрузок;
- обучение правилам поведения в нестандартных ситуациях (как поступить, если была пропущена очередная инъекция инсулина, что делать при респираторной инфекции).
Наиболее распространенная схема инсулинотерапии в настоящее время2
• Перед завтраком - инсулин пролонгированного (12 ч) действия + инсулин короткого действия.
• Перед обедом - инсулин короткого действия.
• Перед ужином - инсулин короткого действия.
• На ночь - инсулин пролонгированного (12 ч) действия. Контроль эффективности лечения проводит сам больной
(или медицинский персонал, если больной не может осуществлять его самостоятельно) с помощью портативных приборов или тест-полосок для определения концентрации глюкозы в крови.
1 При этом энергетическую ценность всех продуктов оценивают по числу хлебных единиц в одной порции. Больному, в зависимости от тяжести состояния, рекомендуется ограничивать рацион определенным количеством хлебных единиц, исходя из чего он может планировать свое питание.
2 Альтернативные схемы лечения.
Об эффективности лечения свидетельствует достижение концентрации глюкозы:
- перед приемом пищи - 3,9-6,7 ммоль/л;
- после приема пищи - <10 ммоль/л.
Кроме того, у больного должны отсутствовать симптомы гипергликемии, кетонурия и эпизоды гипогликемии. Другой важной целью терапии СД I типа считают профилактику развития или прогресси-рования осложнений.
Для лечения больных СД I типа преимущественно используют препараты инсулина человека.
Клинико-фармакологические подходы к лечению сахарного диабета II типа
Выделяют два основных подхода к лечению СД II типа.
• Консервативная стратегия лечения. Цель лечения в этом случае - устранение симптомов гипергликемии. Сначала больным с впервые выявленным СД II типа рекомендуют диету и снижение массы тела1, также к лечению добавляют один из пероральных сахароснижающих препаратов (ПССП).
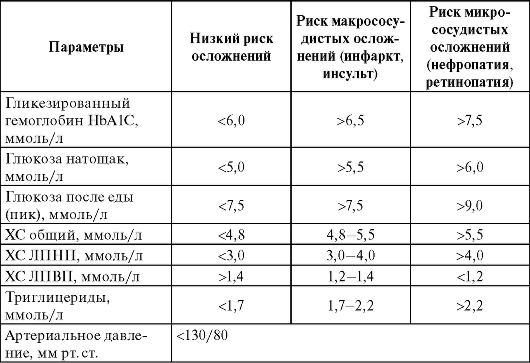
• Интенсивная стратегия лечения. При этом подходе цель лечения - достижение целевой концентрации глюкозы и липидов крови (табл. 17-3). Это достигается применением одного ПССП, а при неэффективности - нескольких ЛС или комбинация ПССП с инсулином. Дополнительными условиями интенсивного лечения считают:
- оптимизацию массы тела до нормального уровня;
- низкокалорийную диету с пониженным содержанием углеводов и липидов;
- частое, дробное (5-6 раз в сутки) питание;
- рациональный уровень физической активности. Многолетнее (продолжительностью 20 лет) многоцентровое контролируемое исследование, в которое были включены 5000 больных СД II типа, определило значительное (на 21%) уменьшение риска осложнений диабета при использовании интенсивной тактики лечения.
1 Снижение массы тела у больных с СД II типа в ряде случаев позволяет преодолеть толерантность к инсулину и нормализовать концентрацию глюкозы в крови.
Таблица 17-3. Цели лечения СД II типа
Назначение ПССП показано тем больным, у которых соблюдение диеты в сочетании со снижением массы тела и физической нагрузкой в течение 3 мес не обеспечивает компенсации углеводного обмена. В настоящее время доступны шесть фармакологических групп ПССП с различными механизмами действия. Их выбор часто представляет собой проблему, решать которую должен врач-эндокринолог. Для лечения впервые выявленного СД II типа препаратами первого выбора считают несульфонил-мочевинные секретогены, например производные меглитинида (репаглинид). При лечении больных с небольшой степенью гипергликемии и повышенной массой тела предпочтительнее назначение бигуанидов, а в более тяжелых случаях - производных сульфонилмочевины. При сочетании двух ПССП рациональным считают комбинированное назначение ЛС с различным механизмом действия (см. главу 27, табл. 27-4). Дополнительное условие правильного лечения - обучение больных.
Инсулин больным с СД II типа назначают только при декомпенсации:
- кетоацидозе и коме;
- присоединении инфекционных заболеваний;
- хирургических вмешательствах (при состояниях, предрасполагающих к развитию декомпенсации);
- беременности.
В этих случаях назначение препаратов инсулина носит временный характер и затем больной возвращается к приему ПССП. Относительное показание к назначению препаратов инсулина - неэффективность ПССП, их непереносимость и впервые выявленный СД II типа с высокой степенью гипергликемии.
Контроль безопасности лечения сахарного диабета
Основная НЛР при лечении СД - гипогликемия (снижение концентрации глюкозы <3,5 ммоль/л). Появление признаков гипогликемии требует немедленных действий - внутривенного введения растворов глюкозы* и глюкагона.
При лечении препаратами сульфонилмочевины необходим ежемесячный контроль общего анализа крови и мочи (для выявления нарушений функции почек и кроветворения).
17.1. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ИНСУЛИНА
Фармакодинамика и метаболизм инсулина подробно освещены в начале этой главы.
Фармакокинетика. В клинической практике применяют препараты инсулина, получаемые из поджелудочных желез крупного рогатого скота, свиней, а также инсулин человека (синтетический и полученный путем генной инженерии). В настоящее время для профилактики аллергических реакций на обычные препараты инсулина предпочитают применять высокоочищенные препараты и инсулин человека. Пролонгируют действие инсулина различные добавки - цинк, белки, полимеры.
Инсулины короткого действия применяют в виде растворов, их можно назначать как внутривенно, так и в виде подкожных инъекций. При подкожном введении эффект наступает через 30-60 мин, а максимум действия отмечается через 2-4 ч. Новый препарат инсулина быстрого действия - инсулин лизпро, рекомбинант-ный аналог инсулина человека (инсулин ультракороткого действия). Для этого препарата характерны быстрое начало действия (15 мин при подкожном введении) и меньшая продолжительность действия.
По сравнению с обычными растворимыми инсулинами, фармако-кинетика инсулина лизпро более близка к кинетике человеческого инсулина, что позволяет эффективно проводить лечение пост-прандиальной гипергликемии (гликемии после приема пищи). Кроме того, применение инсулина ультракороткого действия обеспечивает большую гибкость в режиме дня и приеме пищи. Это обусловлено тем, что обычный инсулин рекомендуется вводить за 30 мин до еды, а после инъекции больной обязательно должен принять пищу, кроме того, поскольку продолжительность действия растворимого инсулина достигает 6-8 ч, в этом промежутке времени больному часто необходим дополнительный прием пищи (в противном случае у него возникнет гипогликемия). Инсулин лизпро можно назначать непосредственно перед едой, и благодаря небольшой продолжительности действия дополнительных приемов пищи не требуется. Вместе с тем инсулин ультракороткого действия не следует применять при тяжелой гипергликемии.
Из числа пролонгированных инсулинов в клинической практике наиболее часто применяют НПХ инсулин (нейтральный хумулин НПХ*), который в отличие от суспензий цинк-инсулинов можно смешивать в одном шприце с инсулинами короткого действия. Начало действия хумулина НПХ* (через 1,5-2 ч после инъекции) приходится на максимум действия растворимого инсулина, благодаря чему одновременное назначение обоих препаратов не вызывает дополнительной гипергликемии. Инсулины с промежуточной продолжительностью действия назначают 2 раза в сутки (реже - 1 раз в сутки, на ночь, или 3 раза в сутки). Важно отметить, что реальная продолжительность действия таких препаратов зависит от их дозы - при применении низких доз эффект заканчивается быстрее, чем при высоких дозах. Все инсулины с промежуточным или длительным действием назначают только подкожно.
НЛР. Передозировка инсулина или (чаще) нарушение диеты при лечении инсулином может привести к развитию гипогликемии или гипогликемической комы. У некоторых больных могут развиваться аллергические реакции на прием инсулина. В местах подкожных инъекций возникают участки липодистрофии. К НЛР также относят инсулинорезистентность с формированием синдрома Самоджи (спонтанная гипогликемия с последующим развитием гипергликемии).
17.2. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ПРЕПАРАТОВ СУЛЬФОНИЛМОЧЕВИНЫ
Фармакодинамика. Препараты сульфонилмочевины обладают способностью стимулировать секрецию инсулина β-клетками поджелудочной железы (но только в том случае, когда клетки сохранили способность к продукции инсулина) - табл. 17-4. Это свойство обусловлено их взаимодействием со специфическими рецепторами на поверхности клеток, которые подобно инсулиновым рецепторам вызывают закрытие калиевых каналов и деполяризацию клеточных мембран. В присутствии глюкозы стимулирующее действие производных сульфонилмочевины выражено сильнее из-за того, что эти ЛС используют тот же механизм активации β-клеток, что и глюкоза. Различие между отдельными препаратами этой группы касаются в основном фармакокинетики.
Таблица 17-4. Группы пероральных сахароснижающих препаратов
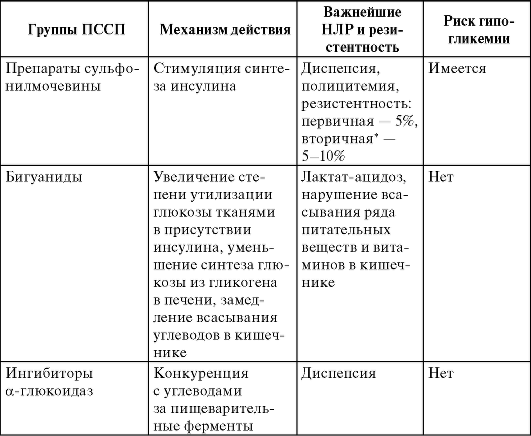
Окончание табл. 17-4
Возникает в течение 1 года лечения.
Дозы производных сульфонилмочевины подбирают индивидуально, путем титрации (интервал между назначением очередной титруемой дозы должен составлять 1-2 нед).
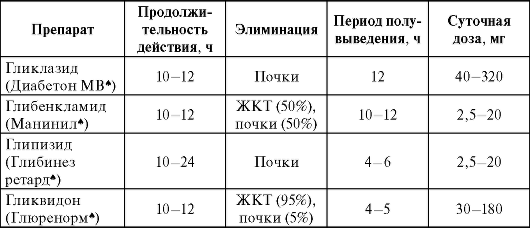
Фармакокинетика. Препараты сульфонилмочевины хорошо абсорбируются из ЖКТ, а основные различия в фармакокинетике этих препаратов определяются особенностями их элиминации (табл. 17-5).
Таблица 17-5. Фармакокинетика производных сульфонилмочевины
НЛР. Наиболее серьезной НЛР при приеме препаратов сульфонил-мочевины считают гипогликемию, возникающую при неадекватном выборе дозы или погрешностях в диете. В отличие от гипогликемии при лечении инсулином, гипогликемия при передозировке препаратов сульфонилмочевины носит более продолжительный характер
из-за большей продолжительности сахароснижающего действия этих ЛС. Даже после восстановления нормальной концентрации глюкозы в крови гипогликемия может рецидивировать на протяжении последующих 12-72 ч.
Препараты этой группы также могут вызывать диспепсический синдром (снижение аппетита, боли в животе, тошноту, рвоту, диарею), который развивается в течение первых месяцев лечения и обычно не требует отмены препарата. Более серьезными НЛР считают аллергические реакции, нарушения со стороны кроветворения - панцитопению1, токсическое поражение печени и почек. Кроме того, препараты этой группы могут вызывать увеличение массы тела.
Взаимодействие препаратов сульфонилмочевины: отмечается усиление гипогликемического действия при сочетании с салицилатами, бутадионом, противотуберкулезными препаратами, левомицетином, тетрациклиновыми антибиотиками, ингибиторами МАО и БАБ. Ослабление гипогликемического эффекта наблюдается при комбинировании ПССП с оральными контрацептивами, хлорпромазином, симпатомиметиками, глюкокортикоидами, гормонами щитовидной железы, препаратами, содержащими никотиновую кислоту.
Резистентность к препаратам сульфонилмочевины. При отсутствии сахароснижающего действия у препаратов сульфонилмочевины, даже при их назначении в максимально высокой дозе, приходится констатировать наличие у больного первичной резистентности, которая отмечается у 5% пациентов с СД II типа. Как правило, наличие первичной резистентности означает неспособность β-клеток поджелудочной железы выполнять свои функции, и таким больным показано назначение препаратов инсулина. Вторичная резистентность развивается спустя несколько лет лечения, ежегодно с этим явлением приходится сталкиваться у 5-10% больных. Причина вторичной резистентности обычно также заключается в прогрессировании заболевания, и это состояние тоже требует назначения препаратов инсулина. В других случаях неэффективность этих ЛС может быть вызвана обострением сопутствующих заболеваний, и обычно после курса инсулинотера-пии чувствительность β-клеток к препаратам сульфонилмочевины восстанавливается.
Глибенкламид (манинил*) - наиболее широко применяемый ПССП в мире. Существуют две формы препарата:
1 Уменьшение количества всех форменных элементов крови - анемия, лейкопения и тромбоцитопения.
- обычная - таблетки по 5 мг с биодоступностью до 70% и периодом полувыведения, составляющим 10-12 ч;
- микроионизированная - таблетки по 1,75 и 3,5 мг, обладающие биодоступностью, близкой к 100%, и периодом полувыведения несколько меньше 10 ч.
Суточная доза глибенкламида в обычной форме составляет от 2,5 до 20 мг. В РФ глибенкламид принято назначать 3 раза в сутки, но из-за высокой продолжительности действия этого ЛС более оптимальным считают его назначение 1 или 2 раза в сутки (в последнем случае утренняя доза равна вечерней или их соотношение составляет 2:1). Принимают глибенкламид за 30 мин до еды.
Эффективность ионизированной формы глибенкламида составляет 50-75% обычной формы при применении одинаковых доз. Микроионизированный глибенкламид начинает активно всасываться уже через 5 мин после приема, и интервал между приемом препарата и пищи можно сократить. Максимальная концентрация препарата в крови также отмечается раньше, совпадая с пиком постпрандиальной гликемии. Действие этой формы глибенкламида продолжается около 24 ч, что позволяет стимулировать секрецию инсулина в течение суток и уменьшает риск возникновения гипогликемии.
Глипизид - также представлен двумя формами с различной кинетикой: традиционной и ретардированной ГИТС1 формой (глибенез ретард*).
Препарат назначают в дозе от 2,5 до 20 мг в сутки, разделенной на два приема. Глипизид в виде гастроинтестинальной терапевтической системы принимают 1 раз в сутки. Отличие этой формы заключается в строении таблетки, ядро которой состоит из двух слоев, окруженных полупроницаемой для воды мембраной. В одном из слоев ядра содержится ЛС, в другом - нейтральные вещества, обладающие высокой осмотической активностью. Вода, проникая в лекарственную форму, накапливается в осмотическом слое, который, расширяясь, постепенно «выдавливает» действующее вещество наружу, сквозь мельчайшие отверстия в поверхности таблетки, выполненные с помощью лазера. Это обеспечивает равномерное высвобождение препарата в течение суток и снижает риск гипогликемии. Препарат в ретардированной форме начинает действовать через 2-3 ч после приема, максимум достигается через 6-12 ч. Равновесная
ГИТС - гастроинтестинальная терапевтическая система.
концентрация препарата в плазме достигается на 50-е сутки лечения. Прием пищи практически не влияет на кинетику и фармакодинами-ку этого ЛС.
Гликлазид (диабетон МВ*) по эффективности несколько уступает глибенкламиду, но наряду со стимуляцией β-клеток поджелудочной железы способен улучшать микроциркуляцию и реологические свойства крови. Препарат стимулирует преимущественно раннюю фазу секреции инсулина. Гликлазид принимают 2 раза в сутки. Существует форма с модифицированными свойствами - диабетон МВ*, обладающая практически 100% биодоступностью, назначаемая 1 раз в сутки (эффективная доза при приеме этой формы препарата в 2 раза меньше, чем при лечении обычным гликлазидом).
Глимепирид (амарил*) взаимодействует с рецептором, отличным от рецептора сульфонилмочевины, при этом высвобождение инсулина при его применении происходит в 2,5-3 раза быстрее, чем при лечении глибенкламидом (механизм стимуляции β-клеток у обоих препаратов одинаков). Кроме того, усиление секреции инсулина происходит исключительно после приема пищи (в присутствии глюкозы), благодаря чему при применении глимепирида почти не возникает гипогликемии. Препарат производят в таблетках по 1, 2, 3, 4 и 6 мг, что создает дополнительные удобства при применении; кроме того, его можно назначать только 1 раз в сутки.
Гликвидон практически полностью (на 95%) выводится с каловыми массами, что позволяет применять это ЛС при ХПН. Гликвидон - единственный ПССП, который можно назначать больным с тяжелой диабетической нефропатией.
17.3. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ БИГУАНИДОВ
Фармакодинамика. Бигуаниды применяют для лечения легкой или среднетяжелой формы СД II типа у больных с повышенной массой тела. Они не влияют на высвобождение инсулина, но в присутствии последнего повышают степень утилизации глюкозы тканями. Бигуаниды уменьшают продукцию глюкозы из гликогена в печени и замедляют всасывание углеводов в кишечнике. Все это позволяет комбинировать бигуаниды с препаратами суль-фонилмочевины.
Бигуаниды снижают липогенез и концентрацию триглицеридов в крови, но повышают липолиз, концентрацию свободных жирных кислот и глицерина. (Применение метформина у пациентов с МС см. подробнее в главе 16.)
Фармакокинетика. Препараты этой группы отличаются небольшой продолжительностью действия, выводятся в основном почками (табл. 17-6).
Таблица 17-6. Фармакокинетика бигуанидов
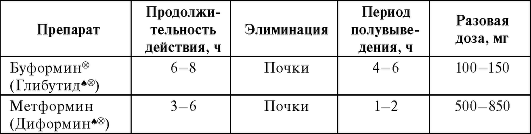
Биодоступность наиболее часто применяемого препарата этой группы - метформина - составляет 50-60%. При его назначении в дозе, превышающей 3 г, дальнейшего усиления сахароснижающе-го действия не отмечается. Метформин принимают одновременно с пищей.
НЛР. Бигуаниды увеличивают анаэробный гликолиз, продукцию лактата и пирувата в крови и могут вызвать лактат-ацидоз. Одновременно с нарушением всасывания глюкозы в тонкой кишке они уменьшают всасывание аминокислот, желчных кислот, воды, витамина B12, фолиевой кислоты. Недопустимо применение бигуа-нидов у больных, употребляющих в пищевом рационе фруктозу, из-за большой вероятности развития лактат-ацидоза. Наименьший риск развития лактат-ацидоза отмечается при применении метфор-мина.
При лечении бигуанидами могут появляться фотосенсибилизация, тошнота, металлический вкус во рту, рвота. Кроме того, применение этих ЛС способно вызывать увеличение активности печеночных ферментов (щелочной фосфатазы) и развитие холестаза. Однако эти явления самостоятельно исчезают в течение 5-6 нед после отмены препаратов. К числу НЛР также относятся лейкопения и агранулоцитоз.
Взаимодействия. Салицилаты и препараты сульфонилмочевины потенцируют действие бигуанидов.
17.4. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ПЕРОРАЛЬНЫХ САХАРОСНИЖАЮЩИХ ПРЕПАРАТОВ ДРУГИХ ФАРМАКОЛОГИЧЕСКИХ
ГРУПП
Ингибиторы α-глюкозидаз
К этой группе ПССП относятся псевдотетрасахариды (акарбо-за), которые конкурентно взаимодействуют с пищеварительными ферментами (сахаразой, мальтазой, декстразой), замедляя процессы ферментирования и всасывания ди-, олиго- и полисахаридов, что способствует снижению уровня постпрандиальной гипергликемии. Акарбоза наиболее эффективна у больных с изолированной постпрандиальной гипергликемией и нормальной концентрацией глюкозы в крови натощак.
К НЛР этих препаратов относят метеоризм и диарею (активация микрофлоры кишечника на фоне высокого содержания углеводов в каловых массах).
Акарбоза самостоятельно не вызывает гипогликемию, но может потенцировать сахароснижающее действие других ПССП.
(О применении акарбозы у пациентов с МС - см. гл. 16.)
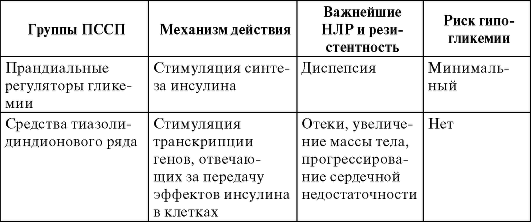
Прандиальные регуляторы гликемии
На российском рынке препараты этой группы представлены репа-глинидом (другой препарат этой группы - натеглинид). Подобно производным сульфонилмочевины эти препараты стимулируют секрецию инсулина β-клетками поджелудочной железы, но используют для этого рецептор, отличный от рецептора сульфонилмочеви-ны. При этом стимуляция клеток возможна только в присутствии глюкозы (при концентрации глюкозы >5 ммоль/л), а эффективность репаглинида в несколько раз превышает эффективность препаратов сульфонилмочевины.
Репаглинид быстро всасывается из ЖКТ, начало действия отмечается уже через 5-10 мин после приема, что позволяет совмещать его с пищей. Пиковая концентрация в плазме достигается через 40-60 мин, а продолжительность действия не превышает 3 ч. Таким образом, параметры кинетики репаглинида позволяют эффективно контролировать постпрандиальную гипергликемию, с минимальным риском развития гипогликемических состояний. Выводится репа-
глинид на 90% с желчью, что позволяет назначать препарат больным с нарушениями функций почек.
Репаглинид назначают в дозе от 0,5 до 4 мг перед приемом пищи (2-4 раза в сутки). Если больной не собирается есть, очередной прием препарата должен быть отменен.
Тиазолидиндионы
Действие тиазолидиндионов (пиоглитазона, росиглитазона) заключается в повышении чувствительности тканей к инсулину. Однако, в отличие от бигуанидов, средства тиазолидиндионового ряда воздействуют на транскрипцию генов, отвечающих за передачу эффектов инсулина в клетках, и, следовательно, для реализации их эффектов требуется несколько месяцев. Препараты этой группы не вызывают гипогликемию, благодаря чему их можно безопасно сочетать с инсулином и ПССП.
Пиоглитазон назначают 1 раз в сутки, независимо от приема пищи, в ходе лечения необходим контроль активности печеночных ферментов.
Ингибиторы дипептидилпептидазы-4
Вилдаглиптин - новый ингибитор дипептидилпептидазы-4, который улучшает контроль гликемии путем коррекции нарушенной функции β-клеток поджелудочной железы, таким образом усиливая секрецию инсулина и снижая секрецию глюкагона. Препарат не био-трансформируется с участием цитохрома Р-450, также не выявлено лекарственных взаимодействий с наиболее часто назначаемыми препаратами.