Клиническая фармакология и фармакотерапия: учебник. - 3-е изд., перераб. и доп. / под ред. В. Г. Кукеса, А. К. Стародубцева. - 2012. - 840 с.: ил.
|
|
|
|
Глава 20. ЗАБОЛЕВАНИЯ ЛЕГКИХ И БРОНХОВ
Группа бронхообструктивных заболеваний объединяет несколько болезней, у которых одним из главных звеньев патогенеза является ограничение воздушного потока в бронхах. Движение воздуха при дыхании может быть ограничено из-за спазма бронхов, отека бронхиальной стенки или скопления в просвете бронхов мокроты. В этом случае, более типичном для БА, бронхообструкция носит обратимый характер и может полностью исчезнуть после лечения. Если у больного имеет место сдавление бронхов извне или ремоделирование стенки бронхов, бронхообструкция принимает необратимый характер, что типично для хронической обструктивной болезни легких (ХОБЛ).
20.1. БРОНХИАЛЬНАЯ АСТМА
Бронхиальная астма (БА) - хроническое воспалительное заболевание дыхательных путей, в патогенезе которого принимают участие многие клетки и клеточные элементы, особенно тучные клетки, эозинофилы, Т-лимфоциты, нейтрофилы и эпителиоциты. У предрасположенных лиц воспаление приводит к рецидивирующим эпизодам свистящего дыхания, скованности в грудной клетке и кашля, особенно ночью и ранним утром. Эти эпизоды обычно связаны с вариабельной по выраженности обструкцией дыхательных путей, которая часто обратима спонтанно либо под действием лечения. Воспаление также вызывает развитие гиперреактивности бронхов в ответ на различные стимулы.
БА - одно из самых распространенных заболеваний дыхательной системы. В европейских странах БА страдают до 5% взрослого населения и до 7% детей. Только в РФ число больных БА составляет 7 млн человек.
Этиология и патогенез бронхиальной астмы
Предрасполагающими факторами развития БА считают наличие у больного атопии (гиперпродукция IgE - см. главу 19) и другие
наследственные факторы. У больных с атопией контакт с аллергеном вызывает развитие аллергической реакции I типа. Комплексы IgE - аллерген активируют тучные клетки и эозинофилы в дыхательных путях, а те, в свою очередь, выделяют высокоактивные вещества - медиаторы, способные вызывать спазм мышечного слоя бронха, его отек и повышенную чувствительность к различным раздражителям. После того как больной прекращает контактировать с аллергеном, эти процессы претерпевают обратное развитие, но, если быстро устранить аллерген невозможно (например, аллергия на домашнюю пыль, пыльцу), воспаление переходит в хроническую фазу.
Симптомокомплекс бронхиальной астмы
БА может впервые возникнуть в любом возрасте. Основные ее симптомы: приступы одышки с затруднением выдоха, свистящие хрипы в легких (выслушиваемые при аускультации), кашель. Наиболее часто она возникает при контакте с домашней пылью, пыльцой растений, шерстью домашних животных, пером подушки, плесневыми грибами и некоторыми пищевыми продуктами. Вещества, вызывающие аллергию, индивидуальны для каждого больного, что определяет разнообразие клинических проявлений БА. При бытовой аллергии эпизоды кашля и удушья чаще отмечаются в ночные и утренние часы (т.е. после длительного пребывания дома), у больных аллергией на цветочную пыльцу - при поездках за город в период цветения растений, при пищевой аллергии симптомы БА возникают после приема пищи. У большинства больных отмечают симптомы бронхиальной гиперреактивности (повышенная чувствительность к сильным запахам, горячему и холодному воздуху, физической нагрузке). Тяжелые приступы часто сопровождаются симптомами дыхательной недостаточности - цианозом (кожа приобретает сероватый оттенок), ортопноэ - больному легче дышать в положении сидя, нарушением сознания (вплоть до комы) и остановкой дыхания. Важный симптом БА - положительный эффект бронхолитиков (ингаляционных Р2-адреномиметиков или эуфиллина).
При аускультации во время приступов выслушиваются сухие хрипы. Однако в период между обострениями БА хрипы в легких могут полностью отсутствовать.
Течение и тяжесть заболевания
Для БА характерно чередование приступов удушья с периодами (иногда длительными) полного благополучия, которые имеют место
при отсутствии контакта с аллергеном или на фоне адекватного лечения. При тяжелом течении заболевания приступы возникают ежедневно, существенно ограничивая физическую активность больного. Количество симптомов в течение недели определяет тяжесть БА.
Диагноз и методы обследования
Спирометрия (оценка функции внешнего дыхания) - позволяет выявить и количественно оценить уровень ограничения воздушного потока. При сужении просвета бронхов (независимо от причины) отмечается снижение пиковой скорости выдоха и объема форсированного выдоха за первую секунду (ОФВ1). При проведении спирометрии величину пиковой скорости выдоха и ОФВ1 у больного сравнивают с должными значениями для лиц данного возраста и телосложения. Важно отметить, что в период между обострениями или при эффективном лечении показатели спирометрии у больных БА соответствуют норме.
Тест с бронходилататорами. Отличительная особенность брон-хообструкции при БА (в отличие от других бронхообструктивных заболеваний) - ее обратимость после приема бронходилататоров (чаще всего Р2-адреномиметиков). Этот тест имеет большое диагностическое значение и позволяет отличить БА от других заболеваний, протекающих с явлениями бронхообструкции. Диагностически значимым считают увеличение ОФВ1 после ингаляции бронхолитика на 15% по сравнению с исходной.
Наличие атопии можно выявить по увеличению концентрации IgE в крови (бывает увеличена не только у больных БА, но и при всех других аллергических заболеваниях). Для выявления конкретных аллергенов проводят исследования аллергоспецифических IgE в крови или выполняют кожные пробы с растворами различных аллергенов.
Клинико-фармакологические подходы к лечению бронхиальной астмы
Немедикаментозное лечение: ограничение контакта с аллергенами, вызывающими приступы.
Медикаментозное лечение
Оптимальный путь введения большинства средств для лечения БА - ингаляционный. При этом происходит усиление местного (лечебного) эффекта ЛС и уменьшается их системное (как правило, неблагоприятное) действие.
Препараты для лечения больных с БА принято подразделять на две категории:
- препараты для контроля течения БА - ингаляционные глюко-кортикоиды, Р2-адреномиметики длительного действия, антагонисты лейкотриеновых рецепторов;
- препараты для купирования симптомов БА - Р2-адреномиме-тики короткого действия.
Препараты для контроля течения БА назначают всем больным, кроме пациентов с очень легким течением БА (несколько приступов в год), при этом предпочтение отдают ингаляционным глюкокорти-коидам. Если постоянный прием ингаляционных глюкокортикоидов не позволяет контролировать течение заболевания, дозу этих препаратов последовательно повышают и /или добавляют дополнительные ЛС для базисной терапии: Р2-адреномиметики длительного действия, антилейкотриеновые средства и теофиллин. Одновременно с базовой терапией для купирования симптомов БА больным назначают Р2-адреномиметики короткого действия в режиме «по требованию».
Обострение БА в условиях стационара лечат с применением коротких курсов глюкокортикоидов для приема внутрь и высоких доз бронхолитиков. Наличие тяжелой бронхообструкции может потребовать дополнительного проведения ингаляций кислорода.
Контроль эффективности лечения бронхиальной астмы
Цель лечения БА - достижение контроля за течением заболевания:
- исчезновение у больного симптомов и жалоб;
- исчезновение признаков бронхообструкции при проведении спирометрии;
- эффективное предотвращение обострений;
- отсутствие ограничений физической нагрузки.
20.2. ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ
ЛЕГКИХ
ХОБЛ - заболевание, характеризующееся не полностью обратимым ограничением воздушного потока (бронхиальной обструкцией), которое, как правило, неуклонно прогрессирует и вызвано воспалительной реакцией легочной ткани на воздействие патогенных частиц или газов.
Этиология и патогенез хронической обструктивной
болезни легких
Причина ХОБЛ - длительное воздействие на бронхиальную стенку различных повреждающих факторов и в первую очередь табачного дыма. Другие причины ХОБЛ - повреждение бронхов вредными факторами производственной среды (цементной, мучной, бумажной или хлопковой пылью, горячим сухим воздухом в металлургических цехах). Определенное значение имеют и наследственные факторы, например недостаток а1-антитрипсина.
Длительное воздействие повреждающих факторов на эпителий дыхательных путей приводит к развитию хронического воспаления, продолжающегося много лет и проявляющегося бронхообструкцией. При ХОБЛ бронхообструкция носит преимущественно необратимый характер и все лечебные мероприятия направлены на профилактику дальнейшего прогрессирования заболевания и уменьшение выраженности отдельных симптомов. Для ХОБЛ свойственно многолетнее, медленно прогрессирующее течение, частые обострения, обычно связанные с инфекцией нижних дыхательных путей, приводящие к инвалидизации больных из-за развития тяжелой дыхательной недостаточности. Несмотря на то что ХОБЛ обычно развивается уже в зрелом возрасте (после 40-45 лет), общая продолжительность жизни значительно сокращается.
ХОБЛ - самое распространенное хроническое заболевание органов дыхания и лидирует среди других заболеваний по числу дней нетрудоспособности, причинам инвалидности. ХОБЛ занимают четвертое место среди причин смерти взрослого населения.
Симптомокомплекс хронической обструктивной
болезни легких
ХОБЛ, как правило, возникает у лиц старше 45 лет, среди больных преобладают мужчины. Основные симптомы заболевания - ежедневный кашель с отделением мокроты, одышка (первоначально при физической нагрузке, а при дальнейшем прогрессировании заболевания и в покое). Прогрессирование бронхообструкции сопровождается увеличением частоты дыхания (удлиняется фаза выдоха) и развитием ортопноэ. При тяжелой дыхательной недостаточности кожа больных приобретает сероватый оттенок (цианоз) из-за снижения концентрации кислорода в крови. Дальнейшее нарастание гипоксии приводит к нарушению сознания, может наступить остановка дыхания.
У больных с тяжелым течением ХОБЛ увеличение давления в легочной артерии приводит к гипертрофии и дилатации правых отделов сердца. С течением времени у больного прогрессирует снижение сократимости правого желудочка, формируется так называемое хроническое легочное сердце, развивается застой крови в большом круге кровообращения (увеличение печени, отеки, асцит).
Для ХОБЛ характерно постепенное прогрессирование заболевания. Для этих больных характерны обострения, связанные с инфекцией нижних дыхательных путей. При этом увеличивается количество мокроты, которая приобретает гнойный характер, повышается температура тела, нарастают одышка и кашель.
При аускультации характерны ослабление дыхания и сухие хрипы.
Диагноз и методы обследования
При спирометрии отмечается снижение ОФВ1 и увеличение остаточного объема легких. Тест с бронходилататорами у большинства больных отрицательный.
Клинико-фармакологические подходы к лечению хронической обструктивной болезни легких
Немедикаментозное лечение заключается в отказе от курения. Это позволяет существенно затормозить прогрессирование заболевания.
Медикаментозное лечение. В настоящее время не существует препаратов, способных воздействовать на механизмы необратимой бронхо-обструкции. Таким образом, целью лечения становится уменьшение тяжести симптомов заболевания и скорости его прогрессирования.
При лечении ХОБЛ для уменьшения одышки применяют Р2-адреномиметики, м-холиноблокаторы (или комбинированные препараты Р2-адреномиметик + м-холиноблокатор), препараты тео-филлина пролонгированного действия. При обострениях ХОБЛ Р2-адреномиметики и м-холиноблокаторы назначают в ингаляциях через небулайзер, а эуфиллин - в виде инфузий. В последнее время для длительного лечения ХОБЛ применяют ингаляции Р2-адреномиметиков длительного действия. В ряде случаев положительного эффекта можно достигнуть назначением ингаляционных глюкокортикоидов (особенно в комбинации с Р2-адреномиметиками длительного действия). Однако положительное действие этих пре-
паратов наблюдается лишь у небольшого числа больных и носит кратковременный характер. Кислородотерапию назначают больным с тяжелой бронхообструкцией и дыхательной недостаточностью. При наличии у больного бронхоэктазов к лечению можно добавить муколитики. При обострениях ХОБЛ, связанных с инфекцией нижних дыхательных путей, показано назначение антибактериальных препаратов (амоксициллин/клавулановую кислоту, фторхинолоны).
20.3. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ β-АДРЕНОМИМЕТИКОВ
Р2-Адренорецепторы представляют собой трансмембранные рецепторы, связанные с регуляторными G-протеинами. Структура, отвечающая за взаимодействие с агонистом, расположена на наружной поверхности клетки. Внутри клетки рецепторы связаны с регулятор-ным G-протеинами различных типов. G-протеины взаимодействуют с аденилатциклазой, которая отвечает за синтез вторичного передатчика - циклического аденозинмонофосфата (цАМФ).
Ряд ферментов, обозначаемых как цАМФ-зависимые протеинки-назы, активирует цАМФ. Каскад передачи сигнала в итоге приводит к активации различных генов, кроме того, одна из активированных под воздействием цАМФ протеинкиназ вызывает расслабление мускулатуры бронхов. Активация Р2-адренорецепторов препятствует дегрануляции тучных клеток и эозинофилов, прекращая выделение гистамина, снижает проницаемость кровеносных сосудов и тормозит секрецию слизи в бронхах.
Интенсивная стимуляция β-адренорецепторов приводит к торможению передачи сигнала (десенситизация рецептора), а затем и к прекращению синтеза новых рецепторов («^о^и»-регуляция). Таким образом, при частом приеме этих препаратов фармакологический эффект ослабевает. Назначение глюкокортикоидов позволяет быстрее (в течение 1 ч) восстановить активность Р-адренорецепторов.
Фармакокинетика 32-адреномиметиков
При ингаляциях с использованием дозированного аэрозоля непосредственно в легкие поступает от 7 до 50% дозы Р2-адреностимулятора. Еще 3-6% оказывается в альвеолах, а от 10 до 77% дозы оказывается в орофарингеальной области. Таким образом, учитывая высокую био-
доступность Р2-адреномиметиков, значительная часть дозы поступает в системный кровоток и может вызвать нежелательные эффекты.
Фармакодинамика 32-адреномиметиков
Общая характеристика основных Р2-адреномиметиков приведена в табл. 20-1. Формотерол - полный агонист Р2-адренорецепторов: после его назначения концентрация цАМФ в клетках увеличивается более чем в 4 раза. Частичные агонисты Р2-адренорецепторов (сальбутамол, салметерол) увеличивают концентрацию цАМФ только в 2-2,5 раза и уступают полным агонистам по выраженности бронхолитического эффекта. Последнее обстоятельство, впрочем, не имеет существенного клинического значения. Однако в ходе клинических исследований было определено, что полный агонист Р2-адренорецепторов (формотерол) может быть эффективен у больных, не отвечающих на лечение сальбутамолом.
Таблица 20-1. Сравнительная характеристика основных Р-адреномиметиков
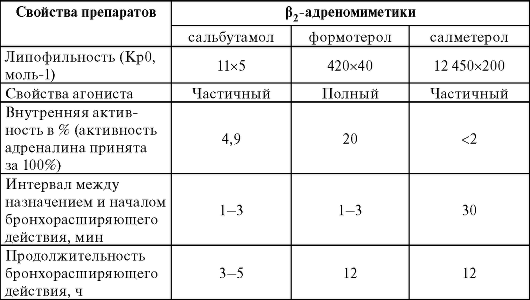
Р2-адреномиметики с быстрым началом действия (сальбутамол, фенотерол) обладают сравнительно небольшой липофильностью, благодаря чему активно распределяются в интерстициальной жидкости и очень быстро стимулируют рецепторы. Формотерол - препарат с промежуточной липофильностью. Он также хорошо распределяется в интерстициальной жидкости, но при этом значительная часть пре-
парата накапливается между слоями клеточных мембран, образуя депо, которое расходуется по мере уменьшения концентрации внеклеточного формотерола. Это обеспечивает более длительное (12 ч) действие препарата, в отличие от сальбутамола и фенотерола, эффект которых сохраняется на протяжении 3-5 ч.
Наиболее липофильный Р2-адреномиметик - салметерол, практически отсутствует в интерстициальной жидкости. Поступая в клеточные мембраны и распределяясь вдоль них, салметерол активирует Р2-адренорецепторы, не выходя за пределы клеток. При этом начало действия препарата замедляется примерно на 30 мин.
Салметерол связывается с Р2-адренорецептором примерно на 12 ч. Это объясняется тем, что достаточно протяженная молекула препарата прикрепляется к неактивной области рецептора. Будучи плотно связанной с рецептором, молекула салметерола подвижна, благодаря чему она многократно активирует рецептор в те моменты, когда активная салигениновая часть молекулы салметерола оказывается в активной области рецептора.
НЛР. Большинство нежелательных эффектов Р2-адреностимуля-торов определяются взаимодействием Р2-адренорецепто ров миокарда (на долю этих рецепторов приходится до 30%, а у больных с ХСН - до 50% от общего количества Р-адренорецепторов) и кровеносных сосудов. Воздействие препаратов этой группы на сердечнососудистую систему заключается в развитии тахикардии и аритмий. Препараты этой группы вызывают удлинение интервала QT на ЭКГ и снижают концентрации ионов калия и магния в крови. В условиях гипоксии риск развития нежелательных эффектов при использовании Р2-адреномиметиков короткого действия существенно увеличивается.
20.4. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ИНГАЛЯЦИОННЫХ ГЛЮКОКОРТИКОИДОВ
Рецепторы к глюкокортикоидам циркулируют в цитоплазме клеток. Взаимодействие между препаратом и его рецептором в этом случае выглядит сложнее, а реализация эффекта занимает больше времени, чем при взаимодействии с поверхностно расположенными трансмембранными рецепторами. Считают, что глюкокортикоиды контролируют (напрямую или благодаря взаимодействию с другими факторами транскрипции) от 10 до 100 различных генов. Кроме того,
имеются данные о том, что глюкокортикоиды, взаимодействуя с факторами транскрипции, способны подавлять экспрессию генов целого ряда белков, участвующих в процессах воспаления в дыхательных путях. Опосредованная глюкокортикоидами транскрипция некоторых биологически активных белков вызывает изменения функционального состояния клеток респираторного тракта, обеспечивая тем самым противовоспалительное действие.
Фармакокинетика глюкокортикоидов
Доля легочной депозиции ингаляционных глюкокортикоидов в значительной степени зависит от средства доставки. Однако в любом случае значительная часть препарата осаждается в орофарингеаль-ной области, проглатывается со слюной или покидает дыхательные пути на выдохе. Часть препарата, попадающая в ЖКТ, не вызывает опасений относительно нежелательных явлений благодаря эффекту первого прохождения через печень (при этом пути введения, биодоступность современных ингаляционных глюкокортикоидов очень низкая). С другой стороны, эти препараты могут поступать в кровь, минуя печень, путем абсорбции в дыхательных путях.
Активные метаболиты имеются только у двух современных глюкокортикоидов - беклометазона (образует три активных метаболита, из которых наибольшее значение имеет беклометазон-17-монопропионат) и циклезонида*3.
Метаболизм циклезонида*3 происходит непосредственно в дыхательных путях. Практически не обладающий активностью цикле-зонид*3 путем гидролиза превращается в активный метаболит дес-циклезонид, аффинность которого в 100 раз выше, чем у исходного препарата. Благодаря тому, что метаболизм (и, как следствие, активация) циклезонида* происходит исключительно в легочной ткани, препарат не вызывает нежелательных системных эффектов.
Обратимая эстерификация (образование эфиров) некоторых глю-кокортикоидов (будесонид, циклезонид* ) позволяет накапливать в клетках депо препарата, благодаря чему увеличивается их продолжительность действия.
Фармакодинамика глюкокортикоидов
При назначении больным БА глюкокортикоидов в виде ингаляций начинают действовать уже через несколько десятков минут. При этом
эффект ингаляционных глюкокортикоидов (их влияние на показатели спирометрии и снижение риска госпитализации в стационар) достоверно выше, чем у плацебо и глюкокортикоидов, назначаемых в виде инъекций. Однако о полном эффекте регулярного приема ингаляционных глюкокортикоидов можно судить только спустя 3-4 мес лечения.
У препаратов, способных накапливаться в клетках в эстерифици-рованном виде (будесонид, циклезонид* , мометазон) была доказана хорошая эффективность при приеме 1 раз в сутки, но более частое назначение ингаляционных глюкокортикоидов (4 раза в сутки) позволяет добиться лучшего ответа на лечение, чем использование такой же суточной дозы, разделенной на 2 приема.
Соотношение доза - эффект для глюкокортикоидов носит нелинейный характер. В частности, в опытах на биологических моделях определено, что десятикратное увеличение дозы препаратов сопровождается увеличением максимальной выраженности эффекта только на 50% и удвоением продолжительности действия препарата. Больные БА, получающие будесонид в дозе 200-400 мкг, имеют 80%, а получающие 400-600 мкг, - 90% эффекта препарата в дозе 1600 мкг. Аналогичные данные были получены для флутиказона. Степень ответа на назначение глюкокортикоидов может существенно варьировать, а у ряда больных ответ на действие этих препаратов может полностью отсутствовать (резистентность к глюкокортикоидам).
Нежелательные лекарственные реакции
Риск появления и выраженность НЛР увеличиваются пропорционально дозе глюкокортикоидов и продолжительности лечения. К числу нежелательных эффектов относят: орофарингеальный кандидоз, изменение тембра голоса (дисфония), угнетение гипоталамо-гипофизарно-надпочечниковой системы, различные проявления синдрома Кушинга, снижение костной плотности у взрослых, развитие катаракты (у пожилых) и глаукомы, появление капилляропатий и истончения кожи.
Дисфония (охриплость голоса) встречается в той или иной степени почти у половины больных, принимающих ингаляционные глюкокор-тикоиды в виде дозированных аэрозолей. Причина дисфонии заключается в миопатии мышц гортани. Применение спейсера не уменьшает риск развития этого нежелательного явления, но после отмены глю-кокортикоидов дисфония исчезает. Другим частым нежелательным эффектом этих препаратов считают развитие системного кандидоза (риск кандидоза имеет дозозависимый характер). Ингаляции через
спейсер и полоскание полости рта после ингаляции достоверно снижают риск этой инфекции. Все остальные нежелательные явления при приеме глюкокортикоидов встречаются существенно реже.
Особенно остро встает вопрос о безопасности ингаляционных глюкокортикоидов у детей. В частности, предметом постоянной дискуссии является задержка роста у детей, принимавших эти препараты. По данным ряда исследований, влияние ингаляционных глюкокортикоидов на рост может колебаться от слабого замедления роста в течение первого года лечения до отсутствия долгосрочного влияния на рост во взрослом состоянии.
20.5. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
ТЕОФИЛЛИНА
Фармакокинетика теофиллина
Достоинства препарата существенно ограничены узким диапазоном терапевтической концентрации (от 10 до 15-20 мкг/мл), кроме того, на фармакокинетику теофиллина оказывает разнонаправленное влияние большое число различных факторов. Таким образом, безопасное применение теофиллина возможно лишь при индивидуальном подборе дозы и требует проведения терапевтического мониторинга концентрации препарата в крови.
Теофиллин при приеме внутрь относительно быстро и почти полностью всасывается из ЖКТ, при этом достигая приблизительно таких же концентраций в плазме, что и при внутривенном введении. Метаболизм препарата происходит в печени путем окисления и метилирования. Период полувыведения теофиллина у взрослых составляет около 8-9 ч, но эта величина индивидуальна.
Некоторые параметры фармакокинетики теофиллина также зависят от времени суток. Так, при приеме препарата внутрь в утренние часы максимальная концентрация в плазме наблюдается уже через 2 ч. Вечером для достижения пиковой концентрации может потребоваться в 2-3 раза больший промежуток времени.
Фармакодинамика теофиллина
Препарат обладает выраженным бронхолитическим действием, механизм которого заключается в неселективном ингибировании всех подтипов фосфодиэстеразы.
Теофиллин в терапевтических дозах снижает активность фос-фодиэстеразы только на 15%, но это достаточно для выраженного бронхолитического действия. Кроме того, теофиллин стимулирует высвобождение катехоламинов в нервных окончаниях и обладает слабой противовоспалительной активностью.
Бронхолитический эффект теофиллина зависит от дозы. В терапевтических концентрациях максимально возможный эффект не достигается.
Нежелательные лекарственные реакции
К нежелательным эффектам теофиллина относят беспокойство, головную боль, тремор, расстройства ЖКТ, проявляющиеся тошнотой, рвотой, болями в животе, диареей, кроме того, возможен выраженный диуретический эффект. Развитие тяжелого синдрома передозировки вплоть до возникновения угрожающих жизни больного аритмий отмечается при концентрации теофиллина крови 20-25 мкг/мл.
Назначение лекарственных форм теофиллина с длительным высвобождением активного вещества позволяет несколько снизить колебания концентрации препарата в крови, характерные для обычных лекарственных форм.
Взаимодействие теофиллина
с другими препаратами
Многие ЛС, влияющие на активность изоферментов цитохрома P-450, оказывают существенное влияние на клиренс теофиллина, модифицируя его метаболизм в печени. Например, аллопуринол в дозе 600 мг/сут снижает клиренс теофиллина на 25%, эритромицин к 5 сут приема уменьшает величину клиренса теофиллина на 25%, олеандомицин - на 50%, гормональные контрацептивы - в среднем на 30%, а циметидин - на 40%. Эффект циметидина проявляется через 24 ч после начала приема и исчезает только через 3 сут после его отмены. Рифампицин и фенитоин способны увеличить клиренс креатинина на 50-75%.
20.6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ АНТИЛЕЙКОТРИЕНОВЫХ ПРЕПАРАТОВ
Цистеиниловые лейкотриены (С4, D4 и Е4) - биологически активные вещества, относящиеся к числу наиболее важных медиаторов аллергического воспаления. По своей химической природе лейкотри-
ены - жирные кислоты, за синтез которых из арахидоновой кислоты отвечает фермент 5-липооксигеназа. Из числа эффектов лейкотрие-нов в дыхательных путях следует упомянуть стойкий бронхоспазм, гиперсекрецию слизи, увеличение проницаемости мелких сосудов. Лейкотриены способствуют таким процессам, как инфильтрация стенок бронхов клетками воспаления и гипертрофия гладкой мускулатуры бронхов. Взаимодействие лейкотриенов с клетками дыхательных путей происходит через цистеиниловые лейкотриеновые рецепторы. Существуют антилейкотриеновые препараты с различным механизмом действия: зафирлукаст и монтелукаст - антагонисты цистеини-ловых лейкотриеновых рецепторов I типа (ЦЛТ1-рецепторы), а зилеу-тон* ингибирует активность 5-липооксигеназы.
Фармакокинетика антилейкотриеновых препаратов
Все антилейкотриеновые препараты назначают внутрь. Монтелу-каст, зафирлукаст и зилеутон* всасываются из ЖКТ быстро и достаточно полно. Монтелукаст и зафирлукаст почти полностью связываются с белками плазмы, зилеутон* - на 93%. Все эти препараты подвергаются биотрансформации в печени и имеют средний период полувыведения, а их экскреция происходит преимущественно с желчью.
Фармакодинамика антилейкотриеновых препаратов
Конкурентные селективные антагонисты ЦЛТ1-рецепторов (зафирлукаст и монтелукаст) ингибируют эффекты цистеинило-вых лейкотриеновых рецепторов С4, D4 и Е4, но не воздействуют на рецепторы 2 типа, отвечающие за взаимодействие с простагланди-нами и тромбоксанами. Блокаторы ЦЛТ1 способны устранять спазм гладкой мускулатуры бронхов, они также уменьшают проницаемость сосудов и гиперсекрецию слизи, оказывают положительное влияние на мукоцилиарный клиренс и уменьшают хемотаксис эозинофилов. Для этих препаратов доказана способность предупреждать приступы БА, вызванные ацетилсалициловой кислотой, контактом с антигенами, физической нагрузкой и холодным воздухом.
Терапевтический эффект монтелукаста достигается после приема первой дозы и поддерживается на протяжении 24 ч. Терапевтический
эффект зафирлукаста развивается в течение первых недель или дней приема этого препарата.
В настоящее время продемонстрирована клиническая эффективность применения монтелукаста, зафирлукаста и других антилей-котриеновых препаратов для лечения различных форм БА, в том числе у детей: атопической, аспириновой, астмы физического усилия. Антилейкотриеновые препараты успешно применяют в качестве основного средства базисной терапии при БА легкого течения и в сочетании с глюкокортикоидами при тяжелом течении БА.
Часть своих эффектов лейкотриены реализуют через цистеинило-вые лейкотриеновые рецепторы 2 типа. Несмотря на то что ингибитор синтеза лейкотриенов зилеутон* нарушает действие лейкотриенов независимо от типа рецептора, клинически этот препарат не имеет преимуществ перед антагонистами лейкотриеновых рецепторов I типа.
Нежелательные лекарственные реакции
Антилейкотриеновые средства, как правило, хорошо переносятся. В крупных клинических исследованиях зафирлукаст и монтелу-каст не отличались от плацебо по частоте нежелательных явлений. Встречались единичные случаи эозинофилии и васкулита, это осложнение часто совпадало с уменьшением дозы глюкокортикоидов, что позволяет заподозрить заболевание, начавшееся еще до приема антилейкотриеновых средств. Зилеутон*3 практически столь же безопасен, но у 4-5% больных отмечалось повышение активности печеночных ферментов в первые 2 мес лечения.
Взаимодействие антилейкотриеновых препаратов
с другими лекарственными средствами
Зафирлукаст - ингибитор активности изоферментов цитохрома P-450 СУР2С9 и CYP3A4; таким образом, при одновременном назначении с субстратами этого изофермента возможен целый ряд нежелательных взаимодействий. В частности, при его назначении с теофил-лином происходят повышение концентрации теофиллина в плазме крови и увеличение риска развития побочных эффектов. Теофиллин, в свою очередь, вызывает снижение концентрации зафирлукаста на 30%. Подавляя активность СУР2С9, зафирлукаст также способен увеличивать концентрацию варфарина, что приводит к удлинению протромбинового времени в среднем на 35%.
Зилеутон*3 ингибирует изофермент CYP3A4 и может увеличивать концентрацию препаратов, подвергающихся биотрансформации с участием этого изофермента.
20.7. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
М-ХОЛИНОБЛОКАТОРОВ
М-холиноблокаторы - одни из первых средств, которые стали применять для лечения бронхообструктивного синдрома. Из пяти известных в настоящее время подтипов м-холинорецепторов для регуляции тонуса бронхов наибольшее значение имеют:
- м1-подтип - рецепторы парасимпатических ганглиев, их активация сопровождается ускорением передачи нервного импульса;
- м2-подтип - расположен в парасимпатических постганглио-нарных волокнах, при активации рецепторов этого подтипа прекращается высвобождение ацетилхолина, таким образом, эти рецепторы осуществляют торможение в парасимпатических нервных волокнах; селективная активация этого подвида холинорецепторов in vivo вызывает уменьшение выраженности бронхоспазма, индуцированного повышенной активностью блуждающего нерва на 80%, в то же время блокада м2-рецепторов приводит к увеличиению бронхоконстрикции в 5-10 раз;
- м3-подтип - расположен на поверхности мышечных клеток бронхов, при активации этих рецепторов происходит сокращение мышечного слоя.
Атропин и ипратропия бромид неселективно блокируют все три подтипа м-холинорецепторов в бронхах. При этом путем блокады м2-рецепторов эффективность этих средств ниже, чем могла бы быть. Более новый тиотропия бромид отчасти лишен этого недостатка. Он так же, как ипратропия бромид, имеет свойства антагониста всех трех подтипов холинорецепторов. Однако если период полувыведения для связи с м1- и м3-рецепторами у тиотропия бромида составляет 14,6 ч и 34,7 ч соответственно, то для м2-рецепторов эта величина равна всего лишь 3,6 ч. Таким образом, тиотропия бромид обладает временной селективностью по отношению к м1- и м3-подвидам холи-норецепторов. Кроме того, большая продолжительность связи этого препарата с холинорецепторами позволяет принимать его один раз в сутки, что существенно удобнее, чем назначение ипратропия бромида 3-4 раза в день.
По эффективности бронхолитики этой группы существенно уступают Р2-адреномиметикам. Ответ на применение м-холиноблокаторов зависит от состояния парасимпатического тонуса. У больных с тяжелыми обострениями БА, которые сопровождаются десенситизацией Р2-адренорецепторов, назначение м-холиноблокаторов дает более выраженный эффект, по сравнению с более легкими больными.
Препараты этой группы можно назвать одними из самых безопасных бронхолитиков. При их приеме больные изредка отмечают сухость во рту, приступы кашля и парадоксальный бронхоспазм.
20.8. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К IGE
IgE - ключевая молекула в патогенезе гиперчувствительности немедленного типа. У большей части больных БА отмечается генетически обусловленная гиперпродукция IgE. Первым из препаратов, влияющих на циркулирующие IgE, стал омализумаб. Он относится к числу гуманизированных моноклональных антител, производимых путем слияния фрагментов мышиных и человеческих антител. Таким образом, аминокислотная последовательность препарата на 95% гомологична человеческим антителам. Препарат избирательно блокирует IgE, образуя различные по строению биологически неактивные комплексы.
Уже в первых клинических исследованиях было установлено, что препарат позволяет снизить концентрацию сывороточного IgE в среднем на 90%. Результаты дальнейших исследований свидетельствуют о достоверном уменьшении частоты обострений БА (приблизительно на 50%) и снижении потребности в ингаляционных глюкокортикоидах у больных, принимавших омализумаб. Существуют положительные результаты применения омализумаба при атопическом рините.
Омализумаб назначают для лечения аллергической астмы от сред-нетяжелой до тяжелой степени у пациентов, невосприимчивых к действию ингаляционных глюкокортикоидов. Препарат доказал свою эффективность при тяжелой БА в целом ряде крупных клинических исследований (в сочетании с ингаляционными глюкокортикоидами). Рекомендуют применение этого препарата в тех случаях, когда контроль над атопической БА не достигается применением высоких доз ингаляционных или таблетированных глюкокортикоидов.
Препарат назначают в виде инъекций, исходя из массы тела больного и концентрации циркулирующего IgE (омализумаб блокирует только циркулирующий в плазме иммуноглобулин).
В ходе клинических исследований препарат хорошо переносился больными. Существуют данные метаанализа по безопасности ома-лизумаба у 1763 пациентов, получавших его от 24 до 52 нед в ходе Ilb и III фаз клинических исследований. Серьезные нежелательные явления при приеме омализумаба отмечали только 2,6% больных.
20.9. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ СТАБИЛИЗАТОРОВ МЕМБРАН ТУЧНЫХ КЛЕТОК
Стабилизаторы мембран тучных клеток ингибируют высвобождение гистамина, лейкотриена С4, простагландина D2 и других биологически активных веществ из различных клеток, находящихся в просвете бронхиального дерева и в слизистой оболочке бронхов. Благодаря этому они обладают умеренным (по сравнению с глюкокортикоидами) противовоспалительным действием. Длительное непрерывное применение этих средств уменьшает гиперреактивность бронхов, интенсивность и частоту возникновения приступов БА, улучшает бронхиальную проходимость. Препараты этой группы обладают эффективностью только при легких формах БА. При их приеме снижается потребность в назначении бронхорасширяющих препаратов. Терапевтический эффект развивается к концу первой недели приема.
Кромоглициевая кислота и недокромил имеют разную химическую структуру, но обладают примерно одинаковой эффективностью. При длительном применении 4 раза в сутки они улучшают течение атопической БА и астмы физического усилия. Эффективность этих препаратов существенно ниже, чем у ингаляционных глюкокорти-коидов. Поскольку они плохо проникают через слизистые оболочки, в системном кровотоке их высокие концентрации не создаются, а уровень нежелательных реакций минимален. С другой стороны, терапевтическая ценность этих средств также невелика.
20.10. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МУКОЛИТИКОВ И ОТХАРКИВАЮЩИХ СРЕДСТВ
Препараты этой группы утратили свое положение в фармакотерапии респираторных заболеваний, но остаются незаменимы при ряде заболеваний, таких, как муковисцидоз и бронхоэктатиче-ская болезнь.
Ацетилцистеин. Эффект препарата связан с наличием в его молекуле свободной сульфгидрильной группы, которая расщепляет дисульфидные связи гликопротеинов слизи. В результате образуются дисульфиды М-ацетилцистеина, имеющие значительно меньшую молекулярную массу, и снижается вязкость мокроты. Длительное применение ацетилцистеина нецелесообразно, так как в целом он подавляет мукоцилиарный транспорт и продукцию секреторного IgA. При назначении ацетилцистеина необходимо обеспечить условия для адекватного удаления мокроты: постуральный дренаж, вибромассаж. При приеме внутрь препарат быстро и хорошо всасывается, в печени расщепляется до своего активного метаболита - цистеина. Максимальная концентрация в плазме крови достигается через 1-3 ч, период полувыведения препарата короткий - около 1 ч.
Эффект другого муколитика - карбоцистеина связан с активацией сиаловой трансферазы - фермента бокаловидных клеток слизистой оболочки бронхов, под влиянием которой замедляется продукция кислых муцинов и уменьшается вязкость мокроты.
Рекомбинантная α-ДНКаза. Вязкий гнойный секрет в дыхательных путях больных муковисцидозом содержит очень высокие концентрации внеклеточной ДНК, которая высвобождается из разрушающихся лейкоцитов. α-ДНКаза специфически расщепляет высокомолекулярные нуклеиновые кислоты и нуклеопротеиды до небольших и растворимых молекул, что способствует уменьшению вязкости мокроты, а также оказывает противовоспалительное действие. α-ДНКаза - генно-инженерный вариант природного фермента человека, который расщепляет внеклеточную ДНК. В норме ДНКаза присутствует в сыворотке человека. В терапевтических дозах ингаляции α-ДНКазы не вызывают повышения активности фермента в крови, что свидетельствует о малом системном всасывании или малой кумуляции. Препарат достаточно безопасен.
Бромгексин оказывает муколитическое (секретолитическое) и отхаркивающее действие, что связано с деполимеризацией и разрушением мукопротеинов и мукополисахаридов, входящих в состав мокроты, кроме того, препарат обладает незначительным противокашлевым действием. Активный метаболит бромгекси-на - амброксол существенно превосходит его по клинической эффективности. После приема внутрь амброксол быстро и полностью всасывается, но 20-30% препарата подвергается быстрому метаболизму в печени вследствие феномена «первого прохожде-
ния» через печень. Продолжительность действия после приема одной дозы составляет 6-12 ч. Препарат подвергается биотрансформации в печени: образуются дибромантраниловая кислота и глукуроновые конъюгаты.
20.11. СРЕДСТВА ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРИ ИХ ИНГАЛЯЦИОННОМ ВВЕДЕНИИ
Ингаляционный путь введения ЛС при лечении заболеваний дыхательных путей имеет ряд дополнительных преимуществ:
- быстрое начало действия (ЛС поступает непосредственно в область рецепторов);
- высокая эффективность;
- высокий уровень безопасности (системные концентрации ЛС и, как следствие, выраженность НЛР - невелики).
В виде ингаляций наиболее часто назначают бронхолитики (Р2-адреномиметики и м-холиноблокаторы) и глюкокортикоиды для лечения бронхообструктивных заболеваний - БА, ХОБЛ; муколитики и антибактериальные препараты (например, фуза-фунгин® или гентамицин) для лечения хронических легочных инфекций.
История применения различных устройств для ингаляций ЛС насчитывает уже около 100 лет. Основным требованием к подобным устройствам считают оптимальный размер частиц аэрозоля, вдыхаемого больным. Диаметр таких частиц должен составлять 2-5 мкм, что обеспечивает их проникновение в область крупных и средних бронхов. Очень крупные (>5 мкм) частицы аэрозоля практически не поступают в бронхи, а их адсорбция в полости рта и глотки создает условия для всасывания ЛС в кровоток и появления системных эффектов. С другой стороны, очень мелкие частицы (<2 мкм) способны проникать в самые мелкие бронхи, что также сопровождается уменьшением клинического эффекта и увеличением системной концентрации ЛС. Кроме того, ингалятор должен быть прост в употреблении и по возможности быть более компактен.
Современный арсенал средств доставки ингаляционных ЛС можно разделить на несколько основных типов ингаляторов:
- аэрозольный дозированный ингалятор (АДИ);
- порошковый ингалятор (ПИ);
- небулайзер.
Аэрозольный дозированный ингалятор
Наиболее распространенная в настоящее время форма ингалятора. Позволяет распылять в виде аэрозоля различные ЛС. Его можно применять для доставки препаратов в легкие, носоглотку или полость носа (глюкокортикоиды). Основным недостатком АДИ считают необходимость координировать дыхательный маневр (интенсивный и равномерный вдох) с активацией ингалятора (нажатие пальцами на баллончик). Больного следует проинструктировать о том, что:
- ингаляции с помощью АДИ следует проводить сидя или стоя (но не лежа);
- перед использованием необходимо встряхнуть ингалятор;
- при вдохе губы больного должны плотно обхватить ингалятор;
- после завершения вдоха следует задержать дыхание на 5-10 с для обеспечения лучшей адсорбции аэрозоля.
Правильная техника ингаляций обеспечивает проникновение в бронхи около 15-20% (до 50% при использовании новых пропе-лентов, не содержащих фреон) дозы препарата, если же возникают ошибки в использовании этого АДИ, доля препарата, попавшего в бронхи, становится еще меньше.
Некоторые пациенты (дети, пожилые, лица со сниженным интеллектом или неврологическими нарушениями) испытывают проблемы при использовании АДИ, разрешить которые можно применяя спей-сер или ингалятор «легкое дыхание». Последний представляет собой АДИ, который автоматически активируется при вдохе больного.
Спейсер
Спейсер (рис. 20-1) представляет собой емкость различного объема. Его применение позволяет, во-первых, аккумулировать ЛС перед его приемом. При этом нет необходимости в координации между вдохом и активизацией ингалятора, во-вторых, очень крупные частицы аэрозоля адсорбируются на поверхности спейсера, благодаря чему не попадают в полость рта и не всасываются в системный кровоток. ЛС с выраженными НЛР (например, глюкокортикоиды) лучше назначать через спейсер.
Применение спейсера позволяет проводить ингаляции у больных с резким ограничением скорости воздушного потока (например, при приступе БА). В последнем случае клиническая эффективность бронхорасширяющих ЛС значительно выше, чем при использовании АДИ. Спейсер с лицевой маской используют для ингаляций у детей.
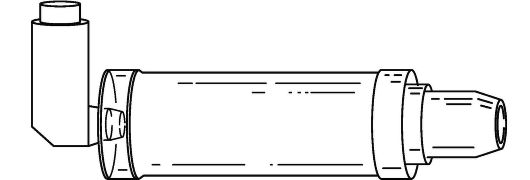
Рис. 20-1. Спейсер
Для лечения больных с тяжелой бронхообструкцией применяют спейсеры большого (>0,75 л) объема. Некоторые ингаляторы выпускают с небольшими спейсерами, основная функция которых заключается в адсорбции крупных частиц аэрозоля.
Порошковые ингаляторы
Первые порошковые ингаляторы (рис. 20-2) появились в начале 1970-х годов. Преимуществом этих средств доставки считают: простоту использования (ингалятор не нуждается в активации в процессе вдоха - ЛС в виде порошка пассивно поступает в бронхи с потоком воздуха), отсутствие эффекта «охлаждения» дыхательных путей (связанное с использованием фреона в АДИ). С другой стороны, для активации большинства ПИ необходима высокая скорость вдоха, при низкой скорости уменьшается доля препарата, поступающего в легкие. Тем не менее клинические исследования у больных с БА свидетельствуют о том, что эффективность препаратов, назначаемых с помощью ПИ, примерно равна их эффективности при использовании АДИ.
Ряд ПИ представляют собой устройства многоразового использования (спинхалер, ротахалер, аэролайзер), при их применении больные имеют возможность дополнительно приобретать капсулы с препаратом, что снижает стоимость ингаляций, но требует ухода и «перезарядки» ингалятора. Устройства для одноразового применения проще в использовании, но обходятся дороже (дискус, турбухалер).
Эффективность лечения ПИ зависит от условий хранения ЛС (низкая влажность воздуха), из-за этого ПИ часто снабжены поглотителями дополнительной влаги. Из дополнительных конструктивных
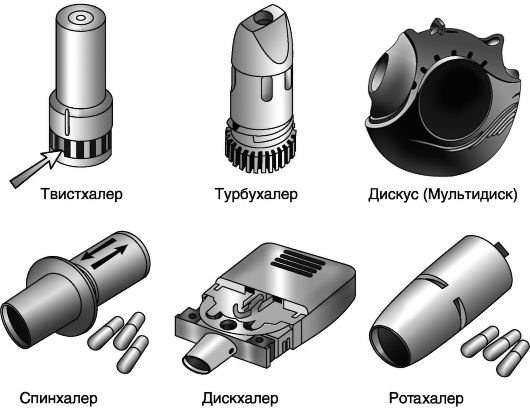
Рис. 20-2. Основные виды порошковых ингаляторов
особенностей ПИ следует упомянуть микротурбину (турбухалер), благодаря которой препарат распространяется по спиральной траектории, что увеличивает долю ЛС, поступающего в легкие (20-30% при использовании турбухалера, по сравнению с 11-15% при применении других ПИ).
Небулайзер
Небулайзер представляет собой стационарное устройство для ингаляций. Ограничение, связанное с применением небулайзера, заключается в первую очередь в необходимости источника электроэнергии (ряд моделей небулайзеров способны работать от автомобильного аккумулятора).
Образование аэрозоля в небулайзере происходит непрерывно и во время выдоха больного часть ЛС теряется. Для предотвращения этого некоторые модели небулайзеров снабжены прерывателем - больной сам регулирует образование аэрозоля. Некоторые модели небулайзеров способны согревать аэрозоль.
Существуют небулайзеры, способные выполнять ингаляции ЛС за небольшие (10-12 мин) промежутки времени, и приборы для длительных (1 ч и более) ингаляций.
Основные достоинства небулайзеров:
- независимость качества ингаляций от дыхательного маневра больного и скорости воздушного потока;
- возможность применения у детей, пожилых, лиц с неврологическими проблемами;
- проведение ингаляций не требует контроля со стороны больного и медицинского персонала;
- возможность введения очень больших доз ЛС;
- возможность применения различных ЛС через одно ингаляционное устройство.
Вместе с тем небулайзеры нуждаются в уходе и периодической дезинфекции. Среди областей применения небулайзеров следует назвать: ингаляционную терапию у детей (до 5 лет), пожилых, лечение тяжелых приступов БА, доставка в легкие антибиотиков и муколитиков.
Выбор средства доставки
Выбор средства доставки ЛС зависит от способности больного адекватно применять ингалятор. Большинство больных с хроническими заболеваниями легких могут успешно применять наиболее простой и сравнительно дешевый вид ингалятора - АДИ. У детей до 5 лет можно использовать только небулайзер или АДИ со спейсе-ром. Небулайзеры также можно применять у пожилых и лиц с выраженным ограничением воздушного потока.
20.12. ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЕГКИХ
И ПЛЕВРЫ Пневмония
Пневмония - острое инфекционное заболевание, характеризующееся очаговым поражением респираторных отделов легких с внутриальвеолярной экссудацией1, выявляемое при объективном
1 При пневмонии воспаление нижних отделов дыхательных путей приводит к повышению проницаемости капилляров и накоплению экссудата (воспалительной жидкости) в конечных отделах дыхательных путей (альвеолах). В обычных условиях в альвеолах происходит газообмен.
и рентгенологическом обследовании и протекающее с выраженными в различной степени лихорадкой и интоксикацией.
Этиология и патогенез пневмоний
Наиболее часто возбудителями внебольничной пневмонии становятся пневмококк (Streptococcus pneumoniae), который может вызывать как нетяжелые, так и тяжелые пневмонии с высокой летальностью, а также «атипичные» возбудители - Mycoplasma pneumoniae и Chlamydophila pneumoniae. «Атипичные» возбудители чаще встречаются у пациентов молодого и среднего возраста, вызывают нетяжелое течение заболевания, возможны вспышки инфекции в организованных коллективах (воинских подразделениях, школах). Реже пневмонии вызывают Legionella pneumophila (при этом характерно тяжелое течение заболевания с высокой летальностью), Haemophilus influenzae (обычно у курильщиков и /или на фоне хронического бронхита), представители семейства Enterobacteriaceae - Klebsiella pneumoniae, Escherichia coli (у пациентов пожилого возраста, с факторами риска - СД, декомпенсацией ХСН), Staphylococcus aureus (у пожилых пациентов, после перенесенного гриппа).
В этиологии нозокомиальной пневмонии основное значение имеют грамотрицательные бактерии семейства Enterobacteriaceae, Pseudomonas aeruginosa, Acinetobacter spp., S. aureus (в том числе метициллинорези-стентные штаммы - MRSA).
Симптомокомплекс пневмонии
Для клинической картины пневмонии характерно наличие как общих симптомов: повышение температуры тела, озноб, тахикардия, недомогание, слабость, потливость, потеря аппетита, так и специфических симптомов: боль в грудной клетке, усиливающаяся при глубоком вдохе и кашле; кашель; появление или усиление продукции гнойной мокроты, иногда «ржавой» или с прожилками крови; появление или усиление одышки. При объективном исследовании выявляют признаки инфильтрации легочной ткани1: усиление голосо-
1 Развитие пневмонии приводит к уплотнению легочной ткани и снижению ее воздушности (место воздуха в альвеолах занимает экссудат). Над пораженным участком лучше передается вибрация, возникающая при произношении отдельных слов (усиление голосового дрожания), при постукивании (перкуссия) выслушивается притупление звука, а при выслушивании (аускультация) - ослабление нормального (везикулярного) дыхания. Причина появления крепитации и влажных хрипов заключается в перемещении экссудата в нижних дыхательных путях. Воспаление листков плевры вызывает отложение на их поверхности фибрина, в результате при трении листков плевры друг о друга выслушивается посторонний шум трения.
вого дрожания, притупление перкуторного звука, при аускультации - ослабление везикулярного дыхания, крепитация. Наличие мокроты в бронхах приводит к появлению влажных хрипов. При вовлечении в процесс листков плевры выслушивается шум трения плевры.
Следует подчеркнуть, что по особенностям клинической и рентгенологической картины невозможно достоверно судить о возбудителе, вызвавшем пневмонию, тем более что во многих случаях заболевание вызывают ассоциации возбудителей (например, S. pneumoniae + M. pneumoniae или S. pneumoniae + H. influenzae).
Течение и тяжесть заболевания
Тяжесть пневмонии может быть различной и во многом определяется характером возбудителя. Наиболее тяжелое течение (с высокой частотой осложнений и летальных исходов) отмечается у больных с пневмонией, вызванной Enterobacteriaceae, Pseudomonas aeruginosa, Acinetobacter spp., метициллинрезистентными штаммами S. aureus. С другой стороны, тяжесть течения зависит от своевременного начала антибактериального лечения. По данным клинических исследований, раннее назначение антибактериальных ЛС - наиболее важный фактор, уменьшающий смертность больных. Наконец, более тяжелое течение пневмонии наблюдается у больных с тяжелыми сопутствующими заболеваниями: СД, тяжелой ХСН, почечной и печеночной недостаточностью, а также у лиц, злоупотребляющих алкоголем и наркотиками. Смертность от пневмонии у больных старше 75 лет в 10-15 раз выше, чем в целом по популяции.
Применение антибактериальных препаратов привело к значительному снижению смертности, например, в Италии в 1900-1936 гг. показатели смертности от пневмонии составляли 200-250 случаев на 100 000 населения, а с началом широкого применения антибактериальных средств к 1951-1961 гг. этот показатель уменьшился до 40-70 случаев на 100 000. Однако и сегодня пневмония занимает 6-е место в общем перечне причин смерти и 1-е место в структуре смертности от внутрибольничных инфекций.
От 0,5 до 1,0% больных, поступающих в стационары, заболевают госпитальными (нозокомиальными) пневмониями. В РФ заболеваемость нозокомиальными пневмониями оценивают как 1,1% от общего числа госпитализированных пациентов. Примерно 2/3 случаев госпитальных пневмоний приходятся на долю пациентов отделений интенсивной терапии, а смертность среди этой категории больных колеблется от 50 до 70%.
К осложнениям пневмонии относят парапневмонический плеврит, эмпиему плевры, абсцедирование.
При своевременном начале адекватной эмпирической1 терапии у большинства больных уже на 2-3-е сут отмечаются снижение температуры и уменьшение выраженности симптомов заболевания, но полное выздоровление даже при эффективном лечении наступает спустя 2-3 нед.
Диагноз и методы обследования. Помимо неспецифических изменений в крови (нейтрофильного лейкоцитоза со сдвигом влево, увеличения СОЭ, концентрации С-реактивного белка, гиперглобу-линемии) для пневмонии характерно изменение кислотно-основного равновесия и газового состава крови.
Основным рентгенологическим признаком пневмонии считают инфильтраты в легких. При появлении очагов деструкции участки инфильтрации становятся неоднородными, с участками просветления.
Заподозрить у больного пневмонию можно на основании клинической картины и данных объективного осмотра, но диагноз подтверждается только при наличии рентгенологических изменений.
Этиологическая диагностика2. Для определения этиологии пневмонии используют бактериологическое исследование крови и клинического материала, полученного из дыхательных путей (мокроты, транстрахеального аспирата, жидкости, полученной при бронхоаль-веолярном лаваже). Серологические методы позволяют определять этиологию пневмонии ретроспективно, и обычно их используют только при проведении научных и эпидемиологических исследований.
Наиболее распространенный метод этиологической диагностики - бактериологическое исследование мокроты. Бактериоскопия окрашенных по Грамму мазков мокроты позволяет отличить мокроту хорошего качества, из которой вероятно выделение возбудителя пневмонии (большое количество лейкоцитов, нет или мало клеток плоского эпителия), от образца, контаминированного слюной (мало или нет лейкоцитов, клетки плоского эпителия в большом количестве). Мокрота плохого качества не пригодна для дальнейшего бактериологического исследования.
Клинико-фармакологические подходы к лечению пневмонии
Чаще всего лечение пневмонии остается эмпирическим, из-за того, что от начала лечения до получения данных из лаборатории проходит 2-3 сут, кроме того, примерно в 50% случаев выявить возбудителя
1 Эмпирическая терапия - лечение до выявления возбудителя.
2 Диагностика, направленная на выявление возбудителя заболевания.
не удается. На практике обычно доля выявленных возбудителей не превышает 20-25%. Таким образом, в реальных условиях антибактериальная терапия практически всегда становится эмпирической, по крайней мере, в первые дни болезни.
При амбулаторном лечении и нетяжелых формах заболевания следует отдавать предпочтение антибактериальным ЛС для приема внутрь (амоксициллин, макролиды, фторхинолоны), больные с тяжелым течением пневмонии должны получать антибиотики внутривенно (цефалоспорины третьего поколения в сочетании с макролидами и респираторными фторхинолонами). При улучшении состояния возможен переход с внутривенной формы ЛС на таблетированную (ступенчатая терапия). Общая продолжительность лечения, как правило, составляет 7-10 сут (препарат отменяют через несколько дней после нормализации температуры тела), но при наличии микоплаз-менной или легионеллезной пневмонии продолжительность лечения составляет 2-3 нед. Более длительного лечения требуют больные, у которых развились осложнения - абсцедирование или плеврит.
Помимо антибактериальных ЛС при лечении пневмонии применяют инфузионную терапию (восполнение дефицита жидкости) и симптоматические средства (НПВС).
Контроль эффективности лечения пневмонии
Универсальных критериев эффективности антибактериальной терапии при пневмонии не существует. Принято считать, что оценку эффективности следует проводить через 48 ч после начала лечения. При этом снижение температуры тела и уменьшение выраженности симптомов заболевания позволяют считать лечение эффективным. Спустя 10-14 сут от начала лечения следует оценить эффективность по данным рентгенологического исследования (уменьшение инфильтрации или восстановление прозрачности легочных полей).
Дополнительно оценить эффективность лечения можно, опираясь на результаты повторного бактериологического исследования, динамику лабораторных показателей.
Абсцесс легких
Абсцесс легких представляет собой ограниченную полость в легочной ткани в результате ее некроза и гнойного расплавления. Наиболее часто абсцессы легких возникают при пневмонии или после аспирации содержимого ротоглотки (в бессознательном
состоянии при алкогольном опьянении, при заболеваниях ЦНС, передозировке седативных ЛС).
Этиология
Заболевание наиболее часто вызывает золотистый стафилококк, грамотрицательные палочки из семейства энтеробактерий или анаэробные бактерии (Bacteroides spp., Fusobacterium spp., Peptostreptococcus spp., Peptococcus spp. и др.), часто отмечают сочетание с энтеробактериями.
Симптомокомплекс
Из-за того, что абсцесс легких обычно формируется на фоне пневмонии, специфических клинических признаков у абсцедиро-вания нет. Характерны отсутствие динамики течения заболевания или ухудшение состояния пациента, несмотря на проводимую антибактериальную терапию, постоянная лихорадка и обильное выделение гнойной мокроты. Признаком анаэробной инфекции считают зловонный запах мокроты. При физикальном1 исследовании обычно определяют только симптомы пневмонии.
Диагноз и методы обследования
Диагноз абсцесса устанавливают на основании рентгенологического исследования или компьютерной томографии легких. При рентгенографии обнаруживают участки просветления на фоне пневмонической инфильтрации (в стадии формирования абсцесса) либо сформировавшуюся полость в легких с уровнем жидкости.
Клинико-фармакологические подходы к лечению абсцесса легких Препаратами выбора при лечении абсцесса легких считают амок-сициллин/клавулановую кислоту, Р-лактамные антибиотики в сочетании с респираторными фторхинолонами.
Эмпиема плевры
Эмпиема плевры (гнойный плеврит, пиоторакс) характеризуется скоплением гноя в плевральной полости. Выпот при эмпиеме содержит большое количество лейкоцитов - >10409/л, причем >75% составляют нейтрофилы. Основными возбудителями эмпиемы плевры на фоне пневмонии (с абсцессом легкого или без него) становятся анаэробы, при гнойном плеврите, развившемся в результате травмы
Общий осмотр больного, перкуссия, аускультация.
или оперативного вмешательства, - грамотрицательные аэробные бактерии или Staphylococcus aureus. Лечение эмпиемы плевры включает в себя дренирование плевральной полости с помощью дренажной трубки и назначение антибактериальных препаратов.
Клинико-фармакологические подходы к лечению эмпиемы плевры
Лечение при эмпиеме плевры - хирургическое: удаление выпота из плевральной полости и создание условий для ее дренирования. Выбор ЛС должен основываться на данных микробиологического исследования.
Туберкулез
Туберкулез - хроническая системная бактериальная инфекция, вызываемая Mycobacterium tuberculosis и характеризующаяся образованием специфических гранулем в пораженных тканях и выраженной клеточно-опосредованной гиперчувствительностью. Заболевание, как правило, поражает легкие, но в процесс могут вовлекаться и другие органы (лимфатические узлы, кости, суставы, органы мочеполовой системы, оболочки мозга, перикард). При отсутствии эффективного лечения обычно отмечается постепенное хроническое прогрессирование болезни, которое в большинстве случаев приводит к смертельному исходу.
Этиология и патогенез туберкулеза
Возбудитель инфекции передается от человека к человеку аэрогенным путем, другие пути передачи существенного значения не имеют. Обычно туберкулез развивается у ослабленных лиц, у пациентов с нарушениями иммунитета, при длительном контакте с бактерио-выделителем, чаще болезнь поражает молодых людей.
Первоначальное внедрение возбудителя туберкулеза в легкие ранее не инфицированного человека вызывает ответную острую неспецифическую реакцию, которая редко носит выраженный характер и обычно протекает бессимптомно. Для инфицирования достаточно попадания в альвеолы 1-3 клеток M. tuberculosis. Микобактерии захватываются макрофагами и переносятся в регионарные лимфатические узлы. Если распространение микобактерий не ограничивается регионарными лимфоузлами, возбудитель проникает в системный кровоток и возможна диссеминация инфекции.
В участках заражения происходит формирование специфических гранулем1. Микобактерии могут персистировать в гранулемах, но их дальнейшее размножение и распространение ограничены. Затем большинство первичных очагов туберкулеза заживает, часто с последующей кальцификацией гранулем, хотя они остаются потенциальными источниками более поздней реактивации. Сочетание кальцифици-рованного периферического очага в легких и кальцифицированного лимфатического узла в корне легкого иногда видно на рентгенограмме органов грудной клетки и известно как очаг Гона.
У большинства пациентов первичные туберкулезные очаги подвергаются полному заживлению без развития заболевания в дальнейшем. У другой части больных полного заживления первичного очага не происходит. Туберкулез как клинически выраженное заболевание развивается у лиц, которые не в состоянии справиться с первичной инфекцией. У некоторых больных туберкулез развивается в течение нескольких недель с момента внедрения первичной инфекции. У большинства пациентов возбудитель на протяжении многих лет сохраняется в латентном состоянии, до тех пор, пока активное размножение микобактерий не приведет к возникновению болезни. Таким образом, выделяют три стадии туберкулеза:
- первичное инфицирование;
- латентную или скрытую инфекцию;
- рецидивирующий туберкулез.
Первичная туберкулезная инфекция обычно бессимптомна. В нижних и средних долях легких в типичных случаях развивается неспецифический пневмонит. Обычно увеличиваются лимфатические узлы в корнях легких, у детей иногда настолько сильно, что вызывают обструкцию бронхов. Иногда первичная инфекция может непосредственно приводить к развитию клинически выраженного заболевания с симптомами, характерными для реактивации.
Туберкулезная реактивация - хроническое заболевание, клинические проявления которого у пациентов с туберкулезом легких включают в себя общие симптомы (похудение, невысокую лихорадку, обильное потоотделение в ночное время) и симптомы поражения легких (кашель с прогрессирующим увеличением количества мокроты, одышку, кровохарканье).
Наиболее частая локализация туберкулезных очагов в легких - апикальные (верхушечные) задние сегменты верхних долей и верх-
Воспалительное разрастание ткани, имеющее вид узелка или бугорка.
ние сегменты нижних долей легких. Тяжесть заболевания может варьировать от минимальной (небольшие инфильтраты, не вызывающие клинических проявлений болезни) до выраженной (массивное вовлечение легких с образованием каверн1). При отсутствии эффективного лечения туберкулез легких приобретает хроническое и прогрессирующее течение. Периоды длительной стабилизации состояния сменяются периодами прогрессирования с вовлечением в процесс все больших участков легких.
По мере прогрессирования туберкулеза патологические очаги в легких подвергаются центральному некрозу с признаками казео-за2. Некротизированная ткань может удаляться через бронхи, приводя к образованию полостей (каверн) на месте бывших узлов. Каверны могут становиться источником массивного кровохарканья. Трансбронхиально обсеменяются другие участки легких с образованием в них инфильтративных очагов.
Диагноз и методы обследования
Важнейший метод исследования при туберкулезе - рентгенография органов грудной клетки. Типичным рентгенологическим признаком активного туберкулеза легких считают множественные узловые инфильтраты в апикальных задних сегментах верхних долей легких и верхних сегментах нижних долей легких. Часто обнаруживают каверны на фоне инфильтративных теней. Иногда выявляют плевральный выпот. Когда туберкулезный процесс становится неактивным или излечивается, на рентгенограммах появляются фиброзные рубцы, пораженные верхние доли легких уменьшаются в объеме. Фиброзные очаги кальцифицируются.
Для диагностики туберкулеза все клинические лабораторные исследования, за исключением бактериологических, малоинформативны.
Бактериологическое исследование - единственный метод, позволяющий достоверно установить диагноз туберкулеза. При туберкулезе легких наиболее информативным считают исследование мокроты. При бактериоскопии мазков мокроты, окрашенных специальными методами (например, по Цилю - Нильсену), можно обнаружить кислотоустойчивые бактерии. Культуральное исследование позволяет
1 Каверна - полость распада легочной ткани.
2 То есть содержат беловатые, творожистые массы (специфический признак туберкулезной инфекции).
провести специфическую идентификацию кислотоустойчивых бактерий и определить их чувствительность к противотуберкулезным препаратам. M. tuberculosis - медленно растущий микроорганизм, и первичное выделение возбудителя из клинического материала на классических питательных средах требует от 4 до 8 нед.
Надежным способом распознавания первичной туберкулезной инфекции считают постановку внутрикожной туберкулиновой пробы (проба Манту). Туберкулиновая гиперчувствительность проявляется большим размером образующейся папулы и свидетельствует об инфицировании или о заболевании туберкулезом. Однако при нарушениях иммунного статуса у некоторых больных туберкулезом в стадии активного процесса, милиарным туберкулезом и туберкулезным плевритом отмечается парадоксальное отсутствие кожной туберкулиновой реактивности - анергия.
Клинико-фармакологические подходы к лечению туберкулеза
В настоящее время для лечения туберкулеза используют стандартные режимы, рекомендованные ВОЗ, включающие в себя сочетания 2-5 противотуберкулезных препаратов и длительностью от 6 до 9 мес. Пациенты должны принимать препараты под наблюдением медицинского персонала. Эти режимы лечения подтвердили свою высокую эффективность и предупреждают распространение лекарственной устойчивости у M. tuberculosis.
Контроль эффективности и безопасности лечения тебуркулеза проводят на основании клинических и инструментальных данных, среди которых центральное место отводят рентгенологическим исследованиям.