Клиническая фармакология и фармакотерапия: учебник. - 3-е изд., перераб. и доп. / под ред. В. Г. Кукеса, А. К. Стародубцева. - 2012. - 840 с.: ил.
|
|
|
|
Глава 24. ЗАБОЛЕВАНИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ
К диффузным заболеваниям соединительной ткани относят ревматоидный артрит, ювенильный артрит, системную красную волчанку, склеродермию, дерматомиозит, синдром Шегрена. Наиболее распространены ревматоидный артрит и системная красная волчанка, этиология которых неизвестна.
24.1. РЕВМАТОИДНЫЙ АРТРИТ
Ревматоидный артрит рассматривают как распространенный хронический полиартрит1 с неспецифическим воспалением периферических суставов, обычно симметричным. Нередко наряду с суставным синдромом отмечают системные проявления.
Эпидемиология. Распространенность составляет около 1%. Женщины болеют в 2-3 раза чаще мужчин.
Патогенез. При ревматоидном артрите в суставах разворачиваются два взаимосвязанных процесса: активация и пролиферация2 иммунокомпетентных клеток (лимфоцитов, макрофагов) с выработкой аутоантител и выделением медиаторов воспаления, а также пролиферация клеток синовиальной оболочки3, которые образуют агрессивную грануляционную ткань - паннус, разрастающуюся в суставе и разрушающую хрящ и субхондральную кость. Активацию иммунной системы считают первичным процессом, запускающим пролиферацию синовиацитов.
При ревматоидном артрите капилляры врастают в хрящ, способствуя проникновению паннуса и деструкции. Клетки паннуса размножаются, несут на своей поверхности много молекул адгезии, выделяют протеолитические ферменты и разрушают близлежащие
1 Артрит - воспаление сустава, полиартрит - воспаление нескольких суставов.
2 Пролиферация - разрастание ткани путем образования новых клеток.
3 Синовиальная оболочка - соединительнотканная оболочка, покрывающая сустав снаружи.
ткани - хрящ и субхондральную кость. Разрушение хряща и субхон-дральной кости приводит к образованию эрозий суставных поверхностей, деформации суставов с подвывихами, а затем к анкилозиро-ванию1 суставов.
Симптомокомплекс ревматоидного артрита. Заболевание может начинаться остро, с одновременного поражения многих суставов, или (чаще) прогрессирует постепенно.
Воспалительный процесс в суставе вызывает боль, припухлость и ограничение движения. Скованность и боль в мелких суставах кистей и стоп усиливаются к утру, после длительного пребывания в одном положении, и исчезают при движениях. Наряду с этим появляются нарушение сна, недомогание, дневная слабость, повышенная утомляемость, похудение.
Суставные проявления. Суставы деформируются, особенно заметна деформация межфаланговых суставов, они становятся веретенообразными. Типичным для ревматоидного артрита считают отклонение пальцев рук в локтевую сторону (ульнарная девиация) и одновременное соскальзывание сухожилий разгибателей с пястно-фаланговых суставов.
К системным проявлениям ревматоидного артрита относятся подкожные ревматоидные узелки (плотные подкожно расположенные узелки в области костных выступов, около суставов и на разгиба-тельных поверхностях), васкулит2, плевральный или перикардиаль-ный выпот, синдром Шегрена (сухость слизистой оболочки рта, глаз и других слизистых оболочек).
Течение и тяжесть заболевания. Течение заболевания хроническое, ревматоидный артрит может начаться в любом возрасте (чаще в 25-50 лет). Заболевание может приводить к прогрессирующему разрушению как суставных, так и внесуставных структур.
Диагноз и методы обследования. Диагностика основана на жалобах больного (боли в суставах и утренняя скованность). Большое значение имеет осмотр пораженных суставов (симметричное поражение и ульнарная девиация).
Главным серологическим признаком ревматоидного артрита считают ревматоидный фактор, который выявляют у 80-90% больных (серопозитивный ревматоидный артрит) (табл. 24-1).
1 Анкилоз - неподвижность сустава, обусловленная развитием фиброзной, хрящевой или костной спайки между суставными поверхностями сочленяющихся костей.
2 Васкулит - воспаление сосудов.
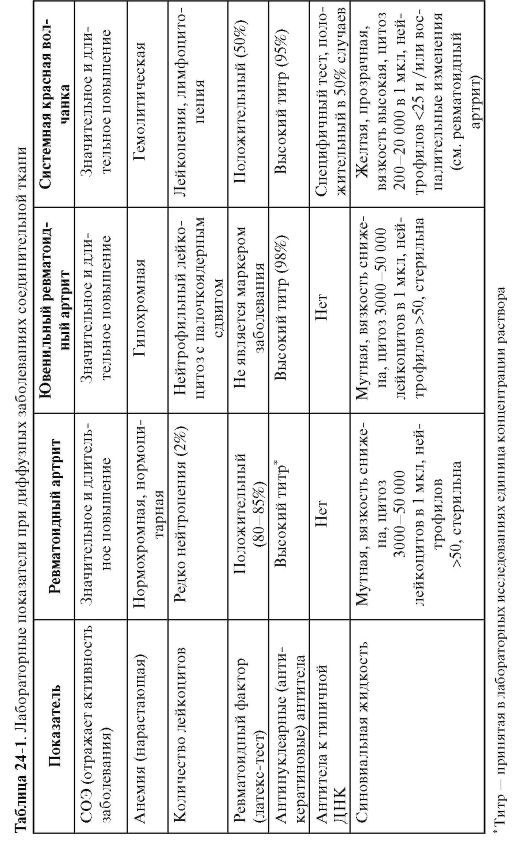
Типичные рентгенологические признаки ревматоидного артрита:
- симметричное увеличение объема околосуставных мягких тканей;
- околосуставной остеопороз1;
- сужение суставной щели;
- краевые эрозии суставов;
- отсутствие выраженных костных разрастаний2. Американской ревматологической ассоциацией предложены четкие диагностические критерии ревматоидного артрита. Диагноз ревматоидного артрита считают корректным только тогда, когда у больного имеются не менее 4 критериев. Длительность существования 1-4 критериев должна быть не менее 6 нед.
Диагностические критерии ревматоидного артрита (Американская ревматологическая ассоциация, пересмотр 1987 г.):
- утренняя скованность, продолжающаяся не менее 1 ч;
- артрит не менее чем трех суставов;
- артрит суставов кисти (лучезапястных, пястно-фаланговых или проксимальных межфаланговых);
- симметричность артрита;
- ревматоидные узелки;
- выявление ревматоидного фактора в сыворотке крови методом, дающим в контрольной группе не более 5% положительных результатов;
- рентгенологические изменения (изменения в кисти - эрозии или явный околосуставной остеопороз).
24.2. ЮВЕНИЛЬНЫЙ РЕВМАТОИДНЫЙ АРТРИТ
Ювенильный ревматоидный артрит развивается до 16 лет и во многих отношениях сходен с ревматоидным артритом взрослых. При юве-нильном ревматоидном артрите поражение одного или нескольких суставов сохраняется в течение 3 мес и более. Чаще наблюдаются олигоартрит (50%) и полиартрит (40%). У детей младшего возраста заболевание протекает в тяжелой форме (синдром Стилла), преимущественно с системными проявлениями.
1 Остеопороз - уменьшение минеральной плотности костной ткани.
2 Краевые костные разрастания - остеофиты типичны для другого распространенного заболевания суставов - остеоартроза.
Эпидемиология. Распространенность составляет 1 случай на 1000 детей.
Симптомокомплекс ювенильного ревматоидного артрита. Основное проявление (70%) - суставной синдром. Однако в отличие от ревматоидного артрита взрослых в патологический процесс наиболее часто вовлекаются крупные суставы - коленные, тазобедренные, голеностопные, лучезапястные, локтевые. У детей в патологический процесс вовлекаются шейный отдел позвоночника и челюстно-височные суставы, в результате чего развивается патогномоничная для детей микрогнатия - «птичья челюсть» с ограничением открывания рта. Вовлечение в процесс тазобедренных суставов отражается на осанке ребенка (усиливается лордоз), походка становится «утиной».
Одновременно с суставным синдромом развивается мышечная атрофия, преимущественно проксимальнее пораженного сустава. У части детей с тяжелым течением заболевания (до 30%) могут возникать внесуставные проявления: длительная (недели, месяцы) фебрильная лихорадка, преимущественно в утренние часы, кожные высыпания, увеличение лимфатических узлов, спленомегалия, поражение сердца (миокардит, перикардит), поражение легких (пневмо-нит), поражение глаз с прогрессирующим падением остроты зрения вплоть до полной слепоты.
Диагноз ювенильного ревматоидного артрита устанавливают на основании критериев, перечисленных ниже.
Диагностические критерии ювенильного ревматоидного артрита (Американская ревматологическая ассоциация, пересмотр 1987 г.):
- начало заболевания до 16 лет;
- поражение одного сустава или более с припухлостью/выпотом либо два следующих признака: ограничение функции, болезненность при пальпации, повышение местной температуры;
- длительность суставных изменений не менее 6 нед;
- исключение всех других ревматических заболеваний.
24.3. СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА
Системная красная волчанка - самое частое диффузное заболевание соединительной ткани у взрослых. Основные клинические проявления обусловлены васкулитом с преимущественным поражением мелких сосудов. До 90% больных системной красной волчанкой жалу-
ются на суставные проявления от преходящих артралгий до острого полиартрита, возникающие иногда за несколько лет до появления других симптомов.
Эпидемиология. Распространенность составляет 1 случай на 1000 населения. Заболевание чаще встречается у молодых женщин (90%) и детей.
Патогенез. Патологический процесс развивается главным образом в основной субстанции соединительной ткани с повреждением базальной мембраны клубочков почки, кожи, сосудов, плевры, перикарда и эндокарда.
Под воздействием ряда факторов (повышенная инсоляция, очаговая инфекция, ЛС, генетические факторы) возникают дефицит Т-супрессоров и компенсаторное увеличение количества В-лимфоцитов. В крови больного образуются аутоантигены к собственной ДНК. В результате реакции аутоантигена (собственная ДНК) с аутоантителами образуются циркулирующие иммунные комплексы, которые фиксируются на различных органах и тканях организма, вызывая иммунное воспаление (увеличение концентрации простагландинов, лейкотриенов, комплемента). Аутоиммунные механизмы способствуют самоподдержанию и непрерывному про-грессированию патологического процесса.
Образование иммунных комплексов, их осаждение на базальной мембране сосудов приводят к распространенным васкулитам и нарушению микроциркуляции в различных органах и системах. В результате отложения фибрина и микротромбирования капилляров, арте-риол и венул развивается ДВС-синдром, что приводит к ишемии и геморрагиям в органах. Морфологически это проявляется дезорганизацией соединительной ткани и васкулитами. Поражаются практически все органы и ткани.
Симптомокомплекс. Заболевание может начинаться неожиданно с лихорадки, имитирующей острую инфекцию, или постепенно на протяжении месяцев, лет с эпизодами повышения температуры и общего недомогания. Возможны изменения любых органов и систем.
Наиболее частый симптом системной красной волчанки - артрит (90%) с симметричным поражением мелких и средних суставов. Разрушения кости обычно не происходит. При длительном течении артрита возможны сухожильные контрактуры с вторичной деформацией суставов.
На коже в области скул появляется эритема в виде «бабочки».
Возможны также дискоидные изменения кожи и эритематозные1, плотные макулопапулезные2 высыпания на открытых участках шеи, верхней части грудной клетки и локтях, язвы на слизистых оболочках. Часто отмечают рецидивирующий плеврит (сухой или экс-судативный), перикардит. Генерализованная лимфаденопатия (увеличение лимфатических узлов) чаще развивается у детей и молодых пациентов, возможна спленомегалия (увеличение селезенки) (10% случаев).
При преимущественном поражении ЦНС преобладают головные боли, изменения личности, психозы, эпилептические судороги. Поражение почек может быть незначительным или, наоборот, неуклонно прогрессировать (волчаночный нефрит), приводя к смерти. Наиболее часто отмечается протеинурия.
Методы обследования и диагностика. Заподозрить системную красную волчанку можно на основании жалоб и данных общего осмотра. Для системной красной волчанки специфичны антитела к ДНК. Обнаружение в крови LE-клеток - менее специфичный признак заболевания (см. табл. 24-1). Большое значение имеют показатели крови, отражающие системную воспалительную реакцию - СОЭ и C-реактивный белок. Однако эти показатели неспецифические, они не входят в диагностические критерии, их показатели могут повышаться при любом воспалительном процессе.
При рентгенологическом исследовании у больных системной красной волчанкой признаки эрозии суставов не определяются.
В настоящее время в диагностике системной красной волчанки используют критерии, представленные ниже. Диагноз правомочен при наличии любых четырех критериев.
Диагностические критерии системной красной волчанки (Американская ревматологическая ассоциация, пересмотр 1987 г.):
- сыпь в области скуловых дуг;
- дискоидная сыпь;
- повышенная светочувствительность кожи;
- язвы в полости рта;
- артрит;
- серозит;
- поражение почек;
- лейкопения менее 4409/л;
1 Эритема - покраснение кожи.
2 Папула - плотный узелок различной величины, возвышающийся над кожей.
- гемолитическая анемия и /или тромбоцитопения 100409/л;
- неврологические расстройства;
- антитела к ДНК или Le-клетки;
- повышенный титр антинуклеарных антител.
24.4. КЛИНИКО-ФАРМАКОЛОГИЧЕСКИЕ ПОДХОДЫ К ЛЕЧЕНИЮ ДИФФУЗНЫХ ЗАБОЛЕВАНИЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Основой лечения ревматоидного артрита и системной красной волчанки считают сочетанное назначение быстродействующих противовоспалительных препаратов (чаще НПВС, реже глюкокортикои-дов) и одного из средств длительного (базисного) действия.
Противовоспалительные препараты оказывают не только симптоматическое, но и отчасти патогенетическое действие. Эффективность противовоспалительных препаратов проявляется в течение 1-х суток после назначения, но почти также быстро прекращается после отмены.
Базисные препараты по сравнению с противовоспалительными более глубоко подавляют воспалительный процесс путем тормозящего влияния на иммунные реакции и замедляют деструктивные изменения в суставах. Однако лечебное действие развивается медленно, в течение нескольких недель или месяцев.
Основные цели лечения ревматоидного артрита:
- подавить воспаление суставов и других тканей;
- предотвратить деформацию и сохранить функцию суставов и скелетных мышц;
- устранить значительные повреждения суставов для уменьшения боли и улучшения функции.
В остром периоде заболевания, когда боли значительны, рекомендуют постельный режим на непродолжительное время. В легких случаях достаточно периодического отдыха в постели. Локальный покой суставу обеспечивают съемные лонгеты. Как правило, рекомендуют обычное полноценное питание.
Традиционную основу медикаментозного лечения ревматоидного артрита составляют НПВС.
У больных с выраженным болевым синдромом в первые сутки лечения можно парентерально вводить НПВС, а в последующем принимать их внутрь. Широко распространенные НПВС для местного применения в виде мазей и гелей (индометацин, кетопрофен, дикло-
фенак) в лечении ревматоидного артрита имеют только вспомогательное значение.
Глюкокортикоиды оказывают мощное и быстрое противовоспалительное действие. Кроме того, они обладают выраженной имму-номодулирующей активностью. При длительном лечении эффективность глюкокортикоидов снижается, кроме того, они не способны предотвратить прогрессирующую деструкцию суставов, а при отмене у больных активным ревматоидным артритом возникает выраженное обострение. НЛР глюкокортикоидов при длительном приеме заставляют назначать их только при отсутствии лечебного эффекта НПВС и больным с системными проявлениями ревматоидного артрита.
Ревматоидные узелки и нетяжелые сенсорные нейропатии сами по себе не являются показанием к назначению глюкокортикоидов. Пожилые пациенты (75-80 лет) с ревматоидным артритом, как правило, лучше переносят малые дозы преднизолона, чем НПВС, которые в этом возрасте чаще вызывают образование язв желудка и двенадцатиперстной кишки.
Глюкокортикоиды противопоказаны при:
- гиперчувствительности;
- тяжелых инфекциях (кроме септического шока и туберкулезного менингита);
- иммунизации живыми вакцинами;
- ветряной оспе.
Относительные противопоказания к назначению глюкокортикои-дов: пептическая язва, гипертензия, СД, глаукома. При длительном приеме малых доз глюкокортикоидов серьезные осложнения возникают редко и хорошо поддаются коррекции даже при продолжающемся приеме ЛС (препараты кальция при остеопорозе, омепразол или ранитидин при эрозивно-язвенных поражениях желудка и двенадцатиперстной кишки).
При лечении ревматоидного артрита широко применяют внутрисуставное введение глюкокортикоидов, которое позволяет избежать их системного назначения. Длительность местного лечебного эффекта этих ЛС зависит от вида препарата. Наиболее продолжительное действие оказывают триамцинолон и бетаметазон, метилпреднизо-лон, гидрокортизон, которые вводят каждые 7-14 сут. Во многих случаях лечебный эффект может зависеть от индивидуальной реакции пациента и сохраняться до нескольких месяцев.
У детей с ювенильным ревматоидным артритом после введения ЛС в коленный сустав эффект в 40% случаев сохраняется 2 года и более.
Дозы препаратов зависят от размера пораженных суставов.
Повторные введения при необходимости делают с интервалами от нескольких недель до 3-4 мес в зависимости от степени и продолжительности лечебного эффекта.
Если после двух инъекций в один и тот же сустав улучшения не отмечается, последующие введения не показаны.
Противопоказания для внутриартикулярного введения глюкокор-тикоидов: инфекционный артрит, выраженная деструкция сустава, значительный остеопороз.
Переносимость внутрисуставного введения глюкокортикоидов обычно хорошая. НЛР: боль, временное обострение воспалительного процесса, инфицирование, особенно у пациентов, получающих иммуносупрессивную терапию, локальная атрофия и депигментация кожи, дегенеративные изменения в суставе, образование свищевых ходов, разрывы сухожилий, системные эффекты.
Объем глюкокортикоидов, вводимых в крупный сустав, не должен превышать 2 мл, в средний - 1 мл, в мелкий - 0,5 мл. После введения необходимо обеспечить иммобилизацию сустава в течение 1-2 сут. Глюкокортикоиды можно вводить одновременно не более чем в 3 сустава. Интервалы между инъекциями в один и тот же сустав должны быть как можно более длительными. Не рекомендуют вводить глюкокортикоиды в суставы, являющиеся основной опорой тела, более 3 раз в год. Нельзя вводить глюкокортикоиды непосредственно в сухожилия.
Базисное лечение. Препараты, действующие медленно, в отличие от быстродействующих НПВС замедляют суставную деструкцию, влияют на иммунные процессы, сроки ремиссии, благодаря кумулятивным свойствам сохраняют действие несколько месяцев после отмены. К ним относят метотрексат, соединения золота, пеницилла-мин, гидроксихлорохин, сульфасалазин. Как правило, их назначают при недостаточной эффективности НПВС после 3 или 4 мес лечения. При быстром прогрессировании заболевания эти препараты назначают в более ранние сроки.
Соединения золота обычно назначают в дополнение к НПВС, если они не подавляют в существенной мере воспаление суставов. Их действие развивается через 3-4 мес от начала лечения. При достижении максимального улучшения дозу постепенно снижают. Если с наступлением ремиссии препарат отменяют, то обычно через 3-6 мес снова развивается обострение. Если продолжать введение поддерживающих доз, достигнутое улучшение может сохраняться несколько лет.
Эффективность лечения ревматоидного артрита препаратами золота сопоставима с эффективностью метотрексата. Преимуществом считают отсутствие значительной иммуносупрессии и развития интеркуррентных инфекций. Однако препараты золота вызывают множество НЛР, требующих отмены ЛС.
Препараты золота противопоказаны при выраженных нарушениях функций печени, почек, беременности, а также при гематологических нарушениях.
В процессе лечения препаратами золота необходимо делать анализы мочи и крови (концентрация гемоглобина, количество лейкоцитов, лейкоцитарная формула и количество тромбоцитов). Исследования повторяют в 1-й месяц перед каждой инъекцией препарата, а затем через каждые 1-2 нед.
В настоящее время активно развивается новое направление в лечении ревматоидного артрита, так называемая биологическая терапия, при которой применяют антитела, рецепторы к цито-кинам и другие иммунологически активные препараты. Среди них наиболее перспективны методы, связанные с блокированием активности воспалительных цитокинов фактора некроза опухоли (ФНО) и интерлейкина-1 (ИЛ-1) путем введения моноклональных антител, антагонистов цитокинов или антагонистов цитокиновых рецепторов. К ним относятся лефлуномид, этанерцепт и инфлик-симаб.
Существуют различные схемы лечения ревматоидного артрита. По наиболее старой схеме лечение начинают с обеспечения покоя и назначения НПВС, при отсутствии улучшения присоединяют аминохинолиновые препараты, затем - производные 5-аминоса-лициловой кислоты или препараты золота, а в дальнейшем - глю-кокортикоиды, цитостатики. Однако при применении такой схемы пациенты поздно начинают получать эффективные базисные препараты.
Современная схема «step-down bridge» предполагает комбинированное назначение метотрексата, препарата золота, аминохинолинового препарата (гидроксихлорохина), глюкокортикоидов и цитостатиков с первых дней. По достижении эффекта препараты постепенно отменяют.
Хорошо зарекомендовала себя схема «sawtooth», когда в начале заболевания назначают активное базисное средство (метотрексат или соли золота), а затем меняют препараты каждые 2-3 года.
Тактика лечения системной красной волчанки зависит от локализации и тяжести патологического процесса.
При умеренно выраженном или волнообразном процессе с лихорадкой, артритом, плевритом, перикардитом, головными болями или сыпью базисная терапия должна быть минимальной, а иногда ее вообще не требуется. Например, артралгии хорошо поддаются лечению НПВС. Можно применять ацетилсалициловую кислоту, особенно при склонности к развитию тромбозов, но большие дозы этого препарата при системной красной волчанке могут вызвать токсическое повреждение печени.
При тяжелой форме системной красной волчанки применяют глю-кокортикоиды. Начальная доза преднизолона составляет: при гемолитической анемии - 60 мг/сут, при тромбоцитопенической пурпуре - 40-60 мг/сут, при выраженном полисерозите- 20-60 мг/сут, при поражении почек - 20-60 мг/сут (в сочетании с иммунодепрес-сантами).
Улучшение обычно наступает не ранее 4-12-й недели лечения, и его может не быть, пока доза глюкокортикоидов не будет снижена.
При активной системной красной волчанке или волчаночном нефрите показано комбинированное лечение (глюкокортикоиды + иммунодепрессанты). Наиболее часто применяют азатиоприн в дозе 2,5 мг/кг в сутки или циклофосфамид в дозе 2,5 мг/кг в сутки. Возможно перемежающееся применение иммунодепрессантов: например, вводят внутривенно циклофосфамид (500 мг) с интервалами, зависящими от данных анализа крови.
При остром васкулите и тяжелом волчаночном поражении ЦНС и почек (волчаночный нефрит, нейролюпус, ревматоидный васкулит, системные некротизирующие васкулиты) часто применяют пульс-терапию глюкокортикоидами (метилпреднизолон в дозе 1000 мг внутривенно в течение 1 ч) ежедневно 3 сут подряд. Одновременно внутривенно вводят циклофосфамид. Такое лечение можно сочетать с плазмаферезом.
При системной красной волчанке любой тяжести, когда удастся подавить воспалительный процесс, подбирают минимальные поддерживающие дозы глюкокортикоидов или других препаратов, снижая дозу не более чем на 10%. Интервалы между понижениями доз зависят от того, насколько быстро удалось достичь первоначального клинического улучшения. Результаты лечения оценивают по динамике клинических симптомов и лабораторных показателей.
Глюкокортикоид для наружного применения подбирают с учетом локализации и характера поражения, имеет значение и лекарственная форма. При системной красной волчанке предпочтительны
мази средней активности и мягкого, щадящего местного действия, которые практически не вызывают системных НЛР (гидрокортизона 17-бутират*, предникарбат*3, мометазона фуроат*).
Пульс-терапия
При диффузных заболеваниях соединительной ткани, в частности ревматоидном артрите, применяют пульс-терапию. Показаниями к ее проведению считают высокую, рефрактерную к обычным методам лечения активность заболевания и выраженные системные проявления (тяжелый кожный васкулит).
Пульс-терапия заключается в назначении сверхвысоких доз глю-кокортикоидов на короткий срок. Чаще применяют метилпредни-золон, который вводят в виде сукцината в дозе 1-2 г внутривенно капельно в течение 30-60 мин 1 раз в сутки на протяжении 3-5 сут. Максимальная концентрация препарата в крови развивается через 1 ч с последующим снижением в течение 6-7 ч, но в результате негеномного1 механизма действия эффект отмечается через короткий промежуток времени (несколько минут). Метилпреднизолон накапливается в различных тканях, причем больше в воспаленных, чем в нормальных, а также в эритроцитах. Пульс-терапия позволяет добиться быстрого эффекта и снизить поддерживающие дозы глюко-кортикоидов для приема внутрь.
Классическую пульс-терапию при ревматоидном артрите применяют редко, чаще внутривенно вводят большие дозы метилпредни-золона (250-1000 мг) в сочетании с цитостатиками - метотрексатом в дозе 20 мг или циклофосфамидом в дозе 400-1000 мг.
При системной красной волчанке наряду с классической схемой пульс-терапии у больных пожилого возраста, особенно с тенденцией к гипертензии и поражению миокарда, можно применять видоизмененные режимы (по 250-500 мг в течение 4-12 сут).
У больных наиболее тяжелыми формами ревматических заболеваний (волчаночный нефрит, волчаночное поражение ЦНС, ревматоидный васкулит, системные некротизирующие васкулиты) пульс-терапию необходимо сочетать с применением цитостати-ков.
1 Основной механизм действия глюкокортикоидов заключается в стимуляции транскрипции определенных генов, и для его реализации требуется как минимум 6-24 ч. В настоящее время исследованы так называемые негеномные эффекты этих препаратов, не связанные с влиянием на считывание генетической информации клеток.
24.5. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ НЕСТЕРОИДНЫХ ПРОТИВОВОСПАЛИТЕЛЬНЫХ
СРЕДСТВ
НПВС очень широко применяют в клинической практике.
Большая популярность НПВС объясняется тем, что они, оказывая противовоспалительное, аналгезирующее и жаропонижающее действия, приносят облегчение пациентам с симптомами (воспаление, боль, лихорадка), которые встречаются при многих заболеваниях.
НПВС классифицируют в зависимости от выраженности противовоспалительной активности и химической структуры (табл. 24-2). В 1-ю группу включены препараты с выраженным противовоспалительным действием. НПВС 2-й группы, дающие слабый, практически не имеющий клинического значения противовоспалительный эффект, часто обозначают терминами «ненаркотические анальгетики» или «анальгетики-антипиретики».
Таблица 24-2. Классификация НПВС
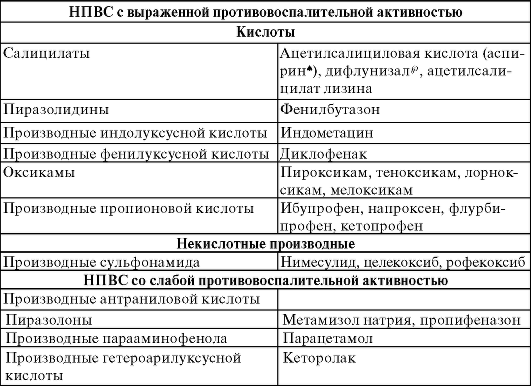
С практической точки зрения важно, что препараты одной группы и даже близкие по химической структуре несколько различаются как по силе эффекта, так и по частоте развития и характеру НЛР. Клиническая эффективность препарата может зависеть от вида и особенностей течения заболевания у конкретного больного, а также от его индивидуальной реакции.
Фармакокинетика
Все НПВС хорошо всасываются в ЖКТ. В значительной степени (более 90%) связываются с альбуминами плазмы, вытесняя при этом некоторые другие ЛС и способствуя усилению их эффектов. Многие НПВС хорошо проникают в синовиальную жидкость. НПВС подвергаются биотрансформации в печени, метаболиты выделяются почками.
Фармакодинамика
Главным и общим элементом механизма действия НПВС считают угнетение синтеза простагландинов из арахидоновой кислоты путем ингибирования фермента циклооксигеназы (рис. 24-1).
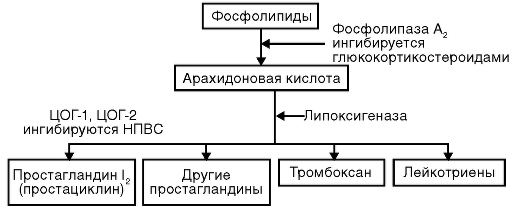
Рис. 24-1. Метаболизм арахидоновой кислоты
Простагландины имеют разностороннюю биологическую активность: выполняют функцию медиаторов воспалительной реакции, сенсибилизируют рецепторы к медиаторам боли (гистамину, бра-дикинину) и механическим воздействиям, понижая порог болевой чувствительности, повышают чувствительность гипоталамических центров терморегуляции к действию эндогенных пирогенов (ИЛ-1), образование которых индуцируют микроорганизмы и токсины.
В настоящее время выделены два изофермента циклооксигеназы, которые ингибируют НПВС. Первый (ЦОГ-1) контролирует выработку простагландинов, регулирующих целостность слизистой оболочки ЖКТ, функцию тромбоцитов и почечный кровоток. Второй (ЦОГ-2), участвующий в синтезе простагландинов при воспалении, усиленно образуется под действием ряда тканевых факторов, инициирующих воспалительную реакцию (цитокины). Считают, что противовоспалительное действие НПВС обусловлено ингибированием ЦОГ-2, а их нежелательные реакции - ингибированием ЦОГ-1, причем препараты различаются по селективности в отношении различных форм циклооксигеназы, что позволяет судить об их сравнительной активности и токсичности.
Так, выраженная селективность в отношении ЦОГ-1 свойственна ацетилсалициловой кислоте, индометацину, кетопрофену, пирок-сикаму, сулиндаку®. Умеренную селективность в отношении ЦОГ-1 проявляют диклофенак, ибупрофен, напроксен, лорноксикам, умеренную селективность в отношении ЦОГ-2 - этодолак®, мелоксикам, нимесулид, набуметон®, выраженную селективность в отношении ЦОГ-2 - целекоксиб.
Противовоспалительное действие НПВС может быть связано со стабилизацией мембран лизосом, торможением активации нейтро-филов и нарушением высвобождения из них медиаторов воспаления. В реализации аналгезирующего эффекта имеет значение нарушение проведения болевых импульсов на уровне спинного мозга (метамизол натрия) и активация опиоидных рецепторов (лорноксикам).
НПВС подавляют преимущественно фазу экссудации. По противовоспалительной активности все НПВС уступают глюкокорти-коидам, которые, ингибируя фермент фосфолипазу, тормозят метаболизм фосфолипидов и нарушают образование простагландинов и лейкотриенов - также важнейших медиаторов воспаления.
Развитие противовоспалительного эффекта отстает от аналгезирую-щего. Боль ослабевает в первые часы, а противовоспалительное действие наступает через 10-14 сут регулярного приема, причем при назначении напроксена или оксикамов еще позднее - через 2-4 нед.
Аналгезирующий эффект НПВС проявляется в большей степени при болях слабой и средней интенсивности в мышцах, суставах, сухожилиях, нервных стволах, при головной или зубной боли. При сильных висцеральных болях большинство НПВС менее эффективны, чем наркотические анальгетики (группа морфина). В отличие от наркотических анальгетиков НПВС не угнетают дыхательный центр и не вызывают лекарственную зависимость.
Жаропонижающий эффект. НПВС способны снижать только повышенную температуру тела и не влияют на нормальную. Больных необходимо предупреждать о том, что НПВС оказывают только симптоматическое действие и не обладают ни антибактериальной, ни противовирусной активностью. При сохранении лихорадки, боли, ухудшении общего состояния больные должны обращаться к врачу.
Антиагрегационный эффект. В результате ингибирования ЦОГ-1 в тромбоцитах подавляется синтез эндогенного проагреганта тром-боксана. Наиболее выраженной антиагрегационной активностью обладает ацетилсалициловая кислота, которую при этом назначают в низкой суточной дозе (75-250 мг). Селективные ингибиторы ЦОГ-2 не влияют на агрегацию тромбоцитов.
Показания к применению нестероидных противовоспалительных средств
• Ревматические заболевания. Ревматизм (ревматическая лихорадка), ревматоидный, подагрический и псориатический артриты, анкилозирующий спондилит (болезнь Бехтерева), синдром Рейтера.
• Неревматические заболевания опорно-двигательного аппарата. Остеоартроз, миозит, тендовагинит, травма (бытовая, спортивная).
• Неврологические заболевания. Невралгия, радикулит, ишиас, люмбаго.
• Почечная, печеночная колика.
• Головная и зубная боль, послеоперационные боли.
• Лихорадка (как правило, при температуре тела выше 38,5 °С).
• Профилактика артериальных тромбозов.
• Дисменорея (купирование болевого синдрома, связанного с повышением тонуса матки при гиперпродукции простагландина F2a; помимо аналгезирующего действия уменьшается кровопотеря).
Нежелательные лекарственные реакции
Основное негативное свойство НПВС - высокий риск развития нежелательных реакций со стороны ЖКТ. У 30-40% больных, получающих НПВС, отмечаются диспепсические расстройства (боли в животе, тошнота, рвота), У 10-20% - эрозии и язвы желудка и двенадцатиперстной кишки, у 2-5% - кровотечения и перфорации.
Ульцерогенный эффект частично связан с локальным повреждающим влиянием НПВС и в основном обусловлен ингибированием ЦОГ-1 в результате системного действия. Клинические проявления почти у 60% больных, особенно у пожилых, отсутствуют, и диагноз во многих случаях устанавливают при ЭГДС. Незначительно, но постоянно кровоточащие эрозии и язвы могут вести к систематической потере крови со стулом (2-5 мл/сут) и развитию железо-дефицитной анемии. Несколько меньшую гастротоксичность имеют лекарственные формы с кишечнорастворимым покрытием.
Факторы риска гастротоксичности: женский пол, возраст больше 60 лет, курение, злоупотребление алкоголем, семейный язвенный анамнез, сопутствующие тяжелые сердечно-сосудистые заболевания, прием глюкокортикоидов, иммуносупрессантов, антикоагулянтов, длительное лечение НПВС, большие дозы или одновременный прием двух НПВС или более. Наибольшую гастротоксичность имеют ацетилсалициловая кислота, индометацин и пироксикам.
Методы улучшения переносимости нестероидных противовоспалительных препаратов
• Одновременное назначение препаратов, защищающих слизистую оболочку ЖКТ. По данным контролируемых клинических исследований, высокой эффективностью обладает синтетический аналог простагландина Е2 - мизопростол, позволяющий предупредить развитие язв как в желудке, так и в двенадцатиперстной кишке. Ингибитор протонной помпы омепразол имеет примерно такую же эффективность, как и мизопростол, но лучше переносится.
• Изменение тактики применения НПВС:
- снижение дозы;
- переход на парентеральное, ректальное или местное введение;
- назначение кишечнорастворимых лекарственных форм; отрицательное влияние на ЖКТ представляет собой не столько местную, сколько системную реакцию.
• Применение НПВС, проявляющих селективность в отношении ЦОГ-2, особенно у пациентов группы риска.
Развитие язвы желудка у больного требует отмены НПВС и проведения специфического лечения. Продолжение приема НПВС, например, при ревматоидном артрите, возможно только при назначении мизопростола или омепразола и регулярном эндоскопическом контроле.
Выявлены два основных механизма отрицательного влияния НПВС на почки:
- путем блокады синтеза простагландинов в почках НПВС вызывают сужение сосудов и ухудшение почечного кровотока; это ведет к развитию ишемических изменений в почках и нарушению их функции; в результате возникают отеки, гипернатрие-мия, гиперкалиемия, повышается концентрация креатинина в сыворотке, АД; наиболее сильно влияют на почечный кровоток индометацин и фенилбутазон;
- прямое воздействие на паренхиму почек с развитием интерсти-циального нефрита (так называемая анальгетическая нефропа-тия) и тяжелой почечной недостаточности;
Факторы риска нефротоксичности: возраст более 65 лет, цирроз печени, предшествующая почечная патология, снижение ОЦК, длительный прием НПВС, сопутствующий прием диуретиков.
Гематотоксичность наиболее характерна для НПВС группы пира-золидинов и пиразолонов, особенно для фенилбутазона. Самые грозные осложнения при их применении - апластическая анемия и агра-нулоцитоз. Фенилбутазон следует назначать только как препарат резерва и по возможности коротким курсом.
Гепатотоксичность состоит в основном в изменении активности трансаминаз и других ферментов. В тяжелых случаях развивается желтуха, лекарственный гепатит.
Реакции гиперчувствительности - сыпь, отек Квинке, анафилактический шок, бронхоспазм. Описана аспириновая триада: сочетание полипоза носа и /или придаточных пазух, БА и полной непереносимости ацетилсалициловой кислоты. Желательно избегать назначения этого препарата больным бронхиальной астмой.
Нейротоксичность проявляется головной болью, головокружением, нарушением рефлекторных реакций, наиболее свойственна индометацину.
Синдром Рея развивается при назначении ацетилсалициловой кислоты детям с вирусными инфекциями (грипп, ветряная оспа). Проявляется тяжелой энцефалопатией, отеком мозга и поражением печени без желтухи, но с высокой концентрацией ХС и повышением активности печеночных ферментов. Летальность очень высокая (до 80%). Не следует применять ацетилсалициловую кислоту при вирусных инфекциях у детей до 12 лет.
Противопоказания к применению нестероидных противовоспалительных средств
НПВС противопоказаны при эрозивно-язвенных поражениях ЖКТ, особенно в стадии обострения, выраженных нарушениях функции печени и почек, цитопениях, индивидуальной непереносимости, беременности. При необходимости применения наиболее безопасны (но не перед родами!) небольшие дозы ацетилсалициловой кислоты.
Правила назначения
Для каждого больного следует подбирать наиболее эффективный препарат с наилучшей переносимостью. Чувствительность больных к НПВС даже одной химической группы может сильно различаться, и неэффективность одного из препаратов еще не говорит о неэффективности группы в целом.
Лечение следует начинать с наименьшей дозы, при хорошей переносимости через 2-3 сут ее можно повышать. В последние годы наметилась тенденция к увеличению разовых и суточных доз хорошо переносимых препаратов (ибупрофен) при сохранении ограничений для максимальных доз ацетилсалициловой кислоты, индометацина, пироксикама. Следует учитывать, что противовоспалительный эффект ацетилсалициловой кислоты проявляется только в дозах выше 4 г/сут.
При длительном курсовом лечении НПВС надо принимать после еды. Для получения быстрого аналгезирующего или жаропонижающего эффекта предпочтительнее назначать препараты натощак и запивать стаканом воды. НПВС наиболее быстро всасываются в ЖКТ и, следовательно, дают более быстрый эффект [напроксен, диклофенак, водорастворимые (шипучие) формы ацетилсалициловой кислоты и парацетамола]. Для быстрого купирования болевого синдрома можно назначать также парентеральные лекарственные формы НПВС (диклофенак, кеторолак).
Момент приема НПВС может определяться максимальной выраженностью симптомов заболевания (болью, скованностью в суставах). Можно отходить от общепринятых схем (прием 2-3 раза в день), что обычно позволяет достичь большего лечебного эффекта при меньшей суточной дозе.
Одновременное применение двух НПВС или более нецелесообразно, поскольку эффективность таких сочетаний объективно не доказана (исключением может быть назначение парацетамола в сочетании
с каким-либо другим НПВС для усиления аналгезирующего эффекта) и возрастает риск развития нежелательных реакций.
Взаимодействие с другими лекарственными средствами
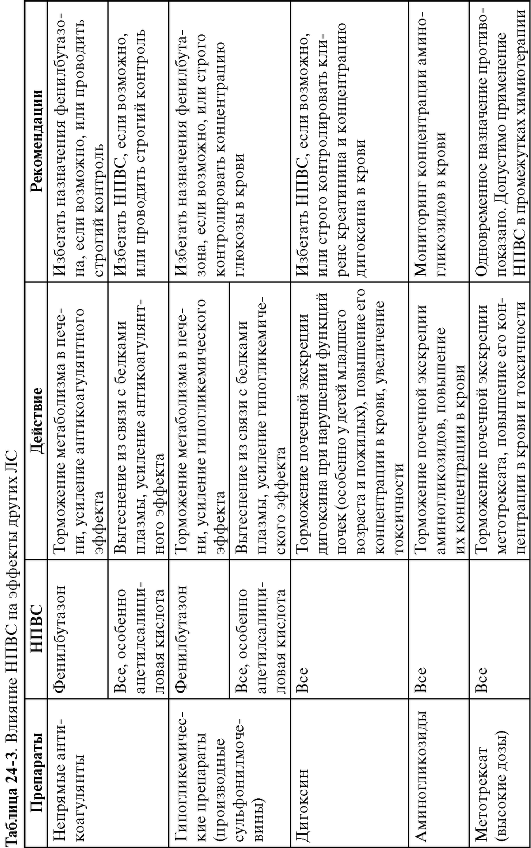
При одновременном назначении НПВС могут усиливать действие непрямых антикоагулянтов и гипогликемических средств. Однако они ослабляют эффект антигипертензивных препаратов, повышают токсичность аминогликозидов, дигоксина и некоторых других ЛС, что имеет существенное клиническое значение (табл. 24-3).
Многие препараты, назначаемые одновременно с НПВС, в свою очередь, могут влиять на их фармакокинетику и фармакодинамику:
- алюминийсодержащие антациды (алмагель*, маалокс*) и коле-стирамин® снижают всасывание НПВС в ЖКТ;
- глюкокортикоиды и медленно действующие (базисные) противовоспалительные средства (препараты золота) усиливают противовоспалительное действие НПВС;
- наркотические анальгетики и седативные препараты усиливают обезболивающий эффект НПВС.
Ацетилсалициловая кислота (аспирин)
Ацетилсалициловая кислота является первым НПВС. При проведении клинических испытаний она, как правило, служит стандартом, с эффективностью и переносимостью которого сравнивают другие
НПВС.
Фармакодинамика
Фармакодинамика ацетилсалициловой кислоты зависит от суточной дозы: малые дозы - 30-325 мг - вызывают торможение агрегации тромбоцитов; средние дозы (0,5-2 г) оказывают анальгезирую-щее и жаропонижающее действие; большие дозы (4-6 г) обладают противовоспалительным эффектом. В высоких дозах (более 4 г) стимулирует выведение мочевой кислоты, нарушая ее реабсорбцию в почечных канальцах.
Фармакокинетика
Хорошо всасывается в желудочно-кишечном тракте. Период полувыведения ацетилсалициловой кислоты составляет всего 15-20 мин. Под действием эстераз слизистой желудка, печени и крови от аце-
тилсалициловой кислоты отщепляется салицилат, который обладает основной фармакологической активностью. Максимальная концентрация салицилата в крови развивается через 2 часа после приема ацетилсалициловой кислоты, период полувыведения его составляет 4-6 часов. Метаболизируется в печени, выделяется с мочой, причем при повышении рН мочи (например, в случае назначения антацидов) выведение усиливается. При использовании больших доз ацетилсалициловой кислоты возможно насыщение метаболизирующих ферментов и увеличение периода полувыведения салицилата до 15-30 часов.
Взаимодействия
Глюкокортикоиды ускоряют метаболизм и экскрецию ацетилсалициловой кислоты. Всасывание ацетилсалициловой кислоты в желудочно-кишечном тракте усиливают кофеин и метоклопра-мид. Ацетилсалициловая кислота ингибирует желудочную алкоголь-дегидрогеназу, что ведет к повышению уровня этанола в организме.
НЛР
Ацетилсалициловая кислота может вызывать повреждение слизистой желудка и вести к развитию эрозий и /или язв, которые часто осложняются возникновением кровотечений, даже при использовании в низких дозах - 75-300 мг/сут (в качестве антиагреганта). Риск кровотечений является дозозависимым. Повышенная кровоточивость развивается вследствие нарушения агрегации тромбоцитов и торможения синтеза протромбина в печени (последнее - при дозе аспирина более 5 г/сут).
При приеме ацетилсалициловой кислоты возможны реакции гиперчувствительности: кожная сыпь, бронхоспазм. Выделяется особая нозологическая форма - синдром Фернан-Видаля («аспириновая триада»): сочетание полипоза носа и /или придаточных пазух, бронхиальной астмы и полной непереносимости ацетилсалициловой кислоты. Поэтому ацетилсалициловая кислота и другие НПВС рекомендуется с большой осторожностью применять у больных бронхиальной астмой.
Синдром Рея развивается при назначении ацетилсалициловой кислоты детям с вирусными инфекциями (грипп, ветряная оспа). Проявляется тяжелой энцефалопатией, отеком мозга и поражением печени, которое протекает без желтухи, но с высоким уровнем холестерина и печеночных ферментов. Дает очень высокую летальность (до 80%). Поэтому не следует применять ацетилсалициловую кислоту при острых респираторных вирусных инфекциях у детей первых 12 лет жизни.
Передозировка или отравление в легких случаях проявляется симптомами «салицилизма»: шум в ушах (признак «насыщения» салицилатом), оглушенность, снижение слуха, головная боль, нарушения зрения, иногда тошнота и рвота. При тяжелой интоксикации развиваются нарушения со стороны центральной нервной системы и водно-электролитного обмена. Отмечается одышка (как результат стимуляции дыхательного центра), нарушения кислотно-основного состояния (сначала респираторный алкалоз из-за потерь углекислоты, затем метаболический ацидоз вследствие угнетения тканевого обмена), полиурия, гипертермия, обезвоживание. Возрастает потребление кислорода миокардом, может развиться сердечная недостаточность, отек легких. Наиболее чувствительны к токсическому действию салицилата дети до 5 лет, у которых так же, как и у взрослых, оно проявляется выраженными нарушениями кислотно-основного состояния и неврологическими симптомами.
Показания
Ацетилсалициловая кислота используется как анальгетик, антипиретик и антиагрегант. Ацетилсалициловая кислота назначают сразу же при подозрении на инфаркт миокарда или ишемический инсульт. В то же время, ацетилсалициловая кислота слабо влияет на тромбообразование в венах, поэтому не следует препарат использовать для профилактики послеоперационных тромбозов в хирургии, где препаратом выбора является гепарин. Ацетилсалициловая кислота является одним из препаратов выбора для лечения ревматоидного артрита, в том числе и ювенильного.
Диклофенак
Диклофенак является одним из широко используемых НПВС в мире. Диклофенак сочетает высокую противовоспалительную активность с хорошей переносимостью при длительном приеме, широко используется в ревматологии. Обладает сильным и быстрым анальгезирующим действием.
Фармакокинетика
Диклофенак хорошо всасывается в желудочно-кишечном тракте. Биодоступность составляет 50-60%, что обусловлено эффектом «первого прохождения». Максимальная концентрация в крови развивается через 0,5-2 часа после приема внутрь и через 10-30 минут после введения внутримышечно. Период полувыведения - 1,5-2 часа.
НЛР
Диклофенак в целом хорошо переносится. При длительном применении препарат может оказать отрицательное влияние на желудочно-кишечный тракт и, особенно, на печень, поэтому необходим клинический и лабораторный контроль.
Мелоксикам
Мелоксикам является представителем нового поколения НПВС - селективных ингибиторов ЦОГ-2. Благодаря этому свойству мелокси-кам избирательно тормозит образование простагландинов, участвующих в формировании воспаления. В то же время, он значительно слабее ингибирует ЦОГ-1, поэтому меньше влияет на синтез проста-гландинов, регулирующих почечный кровоток, выработку защитной слизи в желудке и агрегацию тромбоцитов. Препарат часто назначается больным с ревматоидным артритом и остеоартрозом.
Фармакокинетика
Биодоступность при приеме внутрь составляет 89% и не зависит от приема пищи. Максимальная концентрация в крови развивается через 5-6 часов. Равновесная концентрация создается через 3-5 дней. Период полувыведения 20 часов, что позволяет назначать препарат 1 раз в сутки.
Ибупрофен
Ибупрофен, наряду с парацетамолом, является одним из наиболее безопасных НПВС, рекомендованным к приему, в том числе и у детей. Препарат характеризуется хорошим анальгезирующим и жаропонижающим действием, противовоспалительная активность препарата невысока. Применяется чаще как анальгетик, а также при легких вариантах течения ревматоидного артрита и остеоартроза.
Фармакокинетика
Максимальная концентрация в крови развивается через 1-2 часа после приема внутрь. Быстро метаболизируется и выводится из организма. Период полувыведения 1,5-2,5 часа, в силу этого, анальгетический и жаропонижающий эффекты поддерживаются до 8 часов. Достоинством препарата является хорошая переносимость, редкое развитие нежелательных реакций. Он меньше всего оказывает повреждающее действие на слизистую желудка среди
других НПВС.
Метамизол
В России и некоторых развивающихся странах широко используется метамизол (анальгин) и метамизолсодержащие средства. В Великобритании, Швеции, Норвегии, Саудовской Аравии, ОАЭ, США, Австралии, Израиле, Дании, Нидерландах, Ирландии, Германии, Сингапуре и других странах метамизол запрещен к применению в связи с большим количеством НЛР, таких как угнетение функций костного мозга, агранулоцитоз, апластическая анемия, развития осложнений со стороны почек (интерстициальный нефрит), печени (гепатит), легких (альвеолит), синдромы Лайелла, Стивенса-Джонсона.
Парацетамол (ацетаминофен)
Парацетамол больше подавляет синтез простагландинов в центральной нервной системе, чем в периферических тканях. Поэтому оказывает преимущественно «центральное» анальгезирующее и жаропонижающее действие и имеет очень слабую «периферическую» противовоспалительную активность.
Фармакокинетика
Парацетамол хорошо всасывается при приеме внутрь и ректальном введении. Максимальная концентрация в крови развивается через 0,5-2 часа после приема. Препарат метаболизируется в печени в 2 стадии: сначала под действием цитохрома Р-450 образуются промежуточные гепатотоксичные метаболиты, которые затем коньюги-руются с глютатионом. 3% введенного парацетамола экскретируется в неизмененном виде почками. Период полувыведения - 2-2,5 часа. Продолжительность действия - 3-4 часа.
Нежелательные реакции
Парацетамол считается одним из наиболее безопасных НПВС. Однако при длительном приеме парацетамола увеличивается риск развития тяжелой нефропатии, приводящей к терминальной почечной недостаточности. В основе лежит нефротоксическое действие метаболитов парацетамола, особенно парааминофенола. Следует также помнить о гепатотоксичности парацетамола при приеме в очень больших дозах. Одномоментный прием его в дозе более 10 г у взрослых или более 140 мг/кг у детей ведет к отравлению, сопровождающийся тяжелым поражением печени. Причина - истощение запасов глютатиона и накопление промежуточных продуктов метаболизма парацетамола, обладающих гепатотоксичным действием.
Необходимо иметь в виду, что форсированный диурез при отравлении парацетамолом малоэффективен и даже опасен, перитонеальный диализ и гемодиализ неэффективны. Эффективен прием сорбентов, донаторов глютатиона (ацетилцистеин), трансфузия плазмы.
Взаимодействия
Всасывание парацетамола в желудочно-кишечном тракте усиливают метоклопрамид и кофеин.
Индукторы печеночных ферментов (фенитоин, барбитураты, рифампицин, фенилбутазон, трициклические антидепрессанты, этанол и некоторые другие) ускоряют расщепление парацетамола до гепа-тотоксичных метаболитов и увеличивают риск поражений печени.
Нимесулид
Нимесулид - селективный ингибитор ЦОГ-2. В связи с этим избирательно нарушает образование простагландинов, участвующих в формировании воспалительной реакции, и не влияет на продукцию простагландинов, регулирующих почечный кровоток и целостность слизистой оболочки ЖКТ. Не нарушает синтез тромбоксана, поэтому не влияет на агрегацию тромбоцитов.
НЛР
При применении нимесулида довольно высок риск развития повышения активности печеночных трансаминиз, гепатитов, острой печеночной недостаточности, требующей трансплантации печени. При приеме нимесулида возможны аллергические реакции, в том числе синдром Стивенса-Джонсона, синдром Лайелла. Применение нимесулида может отрицательно влиять на женскую фертильность. В ряде стран запрещена продажа нимесулида. Европейское Медицинское Агентство (ЕМЕА) ввело ряд ограничений: схема приема не должна превышать 200 мг в сутки; курс приема не должен превышать 15 дней.
24.6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ГЛЮКОКОРТИКОИДОВ
Глюкокортикоиды - гормоны, вырабатываемые корой надпочечников. Термин относится также к полусинтетическим препаратам, таким, как преднизолон, дексаметазон и другим препаратом, которые представляют собой производные гидрокортизона - наиболее активного природного глюкокортикоида.
В коре надпочечников синтезируются два глюкокортикоида: кортизон и гидрокортизон (кортизол). Кортизон - биологически неактивное соединение, которое в печени превращается в гидрокортизон. Оба природных глюкокортикоида обладают минералокортикоидной активностью, но более слабой, чем истинные минералокортикоиды.
Контроль продукции глюкокортикоидов осуществляет гипота-ламо-гипофизарно-надпочечниковая система. Ключевой орган регуляции синтеза глюкокортикоидов - гипоталамус, реагирующий на концентрацию гидрокортизона в плазме в крови и стресс. При низкой концентрации глюкокортикоидов в крови или стрессовом воздействии (травма, инфекция, физическое напряжение) гипоталамус вырабатывает кортикотропин-рилизинг-фактор (кор-тиколиберин), который стимулирует выброс адренокортикотроп-ного гормона (АКТГ) из гипофиза. Под действием АКТГ в надпочечниках синтезируются глюкокортикоиды и минералокортикоиды. При избытке глюкокортикоидов в крови гипоталамус перестает продуцировать кортикотропин-рилизинг-фактор. Таким образом, гипоталамо-гипофизарно-надпочечниковая система функционирует по механизму отрицательной обратной связи (рис. 24-2).
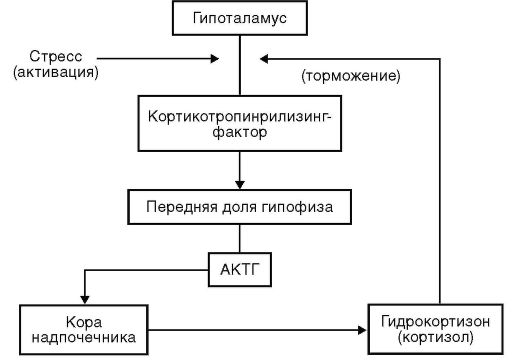
Рис. 24-2. Регуляция функции гипоталамо-гипофизарно-надпочечниковой системы
Выход глюкокортикоидов из надпочечников в кровь в течение суток происходит не равномерно, а в виде 8-12 импульсов, которые подчиняются циркадианному ритму. Максимальная секреция гидрокортизона происходит в ранние часы (6-8 ч) и резко снижается вечером и ночью.
Фармакокинетика
Глюкокортикоиды хорошо всасываются в ЖКТ. Максимальная концентрация в крови отмечается через 0,5-1,5 ч. Пища несколько замедляет скорость всасывания, но не уменьшает его степень.
Глюкокортикоиды для инъекций выпускаются в виде различных эфиров. Сукцинаты, гемисукцинаты и фосфаты водорастворимы, оказывают быстрое и относительно кратковременное действие. В неотложных ситуациях это препараты выбора, их вводят внутривенно. При внутримышечном введении максимальный эффект развивается через 1-2 ч. Ацетаты и ацетониды представляют собой мелкокристаллические суспензии, нерастворимые в воде, действие которых развивается медленно (несколько часов) и продолжается долго (несколько недель). Они предназначены для внутри- и околосуставного введения. При внутримышечном введении медленно всасываются с началом действия через 1-2 сут, максимумом - через 4-8 сут и продолжительностью до 4 нед. Внутривенно их вводить нельзя.
Метаболизм. Глюкокортикоиды подвергаются биотрансформации в печени с образованием неактивных метаболитов, причем природные быстрее, чем полусинтетические. Кортизон и преднизон сначала подвергаются пресистемному метаболизму с превращением в активные формы - гидрокортизон и преднизолон соответственно. Фторированные глюкокортикоиды (триамцинолон, дексаметазон, бетаметазон) биотрансформируются медленнее, чем все остальные.
В плазме крови глюкокортикоиды связываются с белками (транс-кортин, альбумины), причем природные на 90%, а полусинтетические - на 40-60%. Этим обусловлены более высокая концентрация в тканях полусинтетических глюкокортикоидов и их более высокая активность.
Экскреция неактивных метаболитов глюкокортикоидов осуществляется почками. Природные глюкокортикоиды имеют наиболее короткий Т1/2, фторированные препараты - наиболее длинный. При почечной недостаточности этот параметр не изменяется, и коррекция дозы не требуется.
Фармакодинамика
После прохождения через мембрану клетки глюкокортикоиды в цитоплазме связываются со специфическим стероидным рецептором. Активированный комплекс глюкокортикоид - рецептор проникает в ядро клетки, соединяется с ДНК и стимулирует образование информационной РНК. В результате трансляции РНК на рибосомах синтезируются различные регуляторные белки. Одним из важнейших считают липокортин, который ингибирует фермент фосфолипазу А2 и тем самым подавляет синтез простагландинов и лейкотриенов, имеющих большое значение в развитии воспалительной реакции.
Существует и теория негеномного действия глюкокортикои-дов, согласно которой эффекты реализуются не только через ядро, а через мембранные и цитоплазматические рецепторы. Благодаря этому некоторые глюкокортикоидные эффекты могут развиваться быстрее, особенно при введении высоких доз внутривенно. Однако максимум фармакологической активности глюкокортикоидов приходится на тот период, когда их пиковые концентрации в крови уже позади.
Водно-электролитный баланс. Препараты этой группы замедляют выделение из организма натрия и воды в результате увеличения реаб-сорбции в дистальных почечных канальцах, усиливают выведения калия (минералокортикоидная активность). Эти эффекты более присущи природным глюкокортикостероидам (кортизону и гидрокортизону), менее - полусинтетическим (преднизону, преднизолону, метилпред-низолону). Фторированные препараты триамцинолон, дексаметазон и бетаметазон минералокортикоидной активности не имеют.
Углеводный обмен. Увеличение концентрации глюкозы в крови из-за стимуляции глюконеогенеза в печени, уменьшение проницаемости мембран для глюкозы. Возможно развитие глюкозурии и стероидного диабета.
Белковый обмен. Угнетение синтеза и усиление процессов распада белка, особенно в коже, мышечной и костной тканях. Это проявляется похудением, мышечной слабостью, атрофией кожи и мышц, стриями, кровоизлияниями, замедлением заживления ран.
Жировой обмен. Перераспределение подкожной жировой клетчатки по кушингоидному типу (синдром Иценко - Кушинга: лунообразное лицо, ожирение гипофизарного типа, гирсутизм, повышение АД, дисменорея, стрии). Это обусловлено тем, что в тканях конечностей преобладает липолиз, а в тканях груди, шеи, лица, плечевого пояса - липогенез.
Обмен кальция. Глюкокортикоиды уменьшают всасывание кальция в кишечнике, способствуют его выходу из костной ткани и усилению экскреции с мочой. В результате могут развиваться остеопороз, гипо-кальциемия и гиперкальциурия.
Сердечно-сосудистая система. Глюкокортикоиды повышают чувствительность адренорецепторов к катехоламинам, усиливают прессорное действие ангиотензина II. Они уменьшают проницаемость капилляров, поддерживают нормальный тонус артериол, сократимость миокарда. При надпочечниковой недостаточности снижается сердечный выброс, расширяются артериолы, ослабляется реакция на адреналин. В совокупности с гиповолемией, вызванной дефицитом минералокор-тикоидов, эти изменения могут привести к сосудистому коллапсу.
Противовоспалительное действие. Глюкокортикоиды угнетают все фазы воспаления. В их противовоспалительном действии имеют значение многие факторы: ингибирование фосфолипазы А и связанное с этим нарушение образования простагландинов и лейкотриенов, стабилизация мембран лизосом, уменьшение проницаемости капилляров, торможение миграции нейтрофилов и макрофагов в очаг воспаления, угнетение пролиферации фибробластов и синтеза коллагена, подавление образования цитокинов лимфоцитами и макрофагами.
Иммуномодулирующее и противоаллергическое действие. Глюкокор-тикоиды угнетают пролиферацию лимфоидной ткани и клеточный иммунитет, что лежит в основе их применения при пересадке органов и тканей. Эти препараты тормозят образование и нарушают кинетику Т-лимфоцитов, снижая их цитотоксическую активность, препятствуют взаимодействию иммуноглобулинов с тучными клетками, макрофагами, ингибируя высвобождение из них биологически активных веществ.
Кровь. Глюкокортикоиды вызывают лимфоцитопению, моноци-топению и эозинопению, но стимулируют образование эритроцитов и тромбоцитов.
После приема даже 1 дозы глюкокортикоидов снижается количество лимфоцитов, моноцитов, эозинофилов, базофилов с одновременным развитием нейтрофильного лейкоцитоза. Максимум изменений в крови отмечается через 4-6 ч, исходное состояние восстанавливается через 24 ч. После завершения длительного курса глюкокортикоидов изменения в крови могут сохраняться на протяжении 1-4 нед.
Эндокринная система. Введение глюкокортикоидов сопровождается угнетением гипоталамо-гипофизарно-надпочечниковой системы, что обусловлено отрицательной обратной связью. Угнетение более выражено при длительном применении глюкокортикоидов и /или назначении препаратов продолжительного действия.
Глюкокортикоиды снижают выработку половых гормонов в результате прямого подавления их синтеза и уменьшения продукции люте-инизирующего гормона гипофиза.
Нежелательные лекарственные реакции
При системном введении глюкокортикоидов могут развиваться самые разнообразные НЛР (табл. 24-4). Риск их появления, как правило, повышается с увеличением доз и длительности приема препаратов.
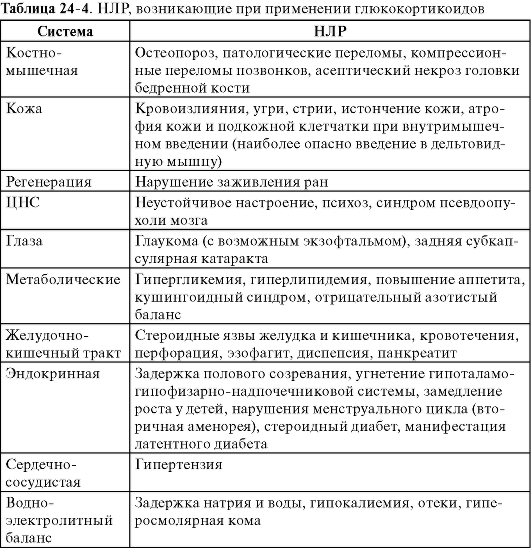
Иммунитет_I Активизация туберкулеза и других инфекций
Современные методы применения глюкокортикоидов (например, альтернирующая терапия), ингаляционное и внутрисуставное введение позволяют не только уменьшить частоту развития НЛР, но и повысить эффективность лечения. Однако при любом лечении необходим контроль развития НЛР (наблюдение за массой тела, АД, электролитным составом крови, состоянием ЖКТ, костно-мышечной системы, органов зрения, определение концентрации глюкозы в крови и моче, контроль развития инфекционных осложнений).
Инфекционные осложнения терапии глюкокортикоидами. Инфекционные осложнения (бактериальные, вирусные, грибковые, паразитарные) чаще развиваются у пациентов с исходными нарушениями иммунитета. При их возникновении, помимо специфического лечения, необходимо попытаться снизить дозы глюкокортикоидов или перевести больного на альтернирующую терапию.
Бактериальные инфекции (как правило, в форме пневмонии или септицемии) возникают наиболее часто. Основными возбудителями становятся стафилококки и грамотрицательные бактерии кишечной группы, что следует учитывать при выборе эмпирической антибактериальной терапии.
Туберкулез. Больные с положительными туберкулиновыми пробами подвержены риску развития тяжелой формы туберкулеза, и при длительном лечении глюкокортикоидами они должны с профилактической целью принимать изониазид.
Вирусные инфекции. Применение глюкокортикоидов повышает риск диссеминации вирусных инфекций. При контакте с больным ветряной оспой или опоясывающим лишаем пациент, ранее не болевший, в течение 48 ч должен получить специфический иммуноглобулин. Если курс глюкокортикоидов превышает 2 нед, то применять живые вирусные вакцины не рекомендуют.
Вторичная надпочечниковая недостаточность. К наиболее тяжелым осложнениям приема глюкокортикоидов, потенциально опасным для жизни, относят вторичную надпочечниковую недостаточность - следствие угнетения гипоталамо-гипофизарно-надпочечниковой системы при длительном применении глюкокортикоидов.
Факторы риска угнетения
гипоталамо-гипофизарно-надпочечниковой системы
Доза. При приеме глюкокортикоидов в физиологических дозах (для взрослого 2,5-5 мг/сут преднизолона или 10-30 мг/сут гидрокортизона) угнетения гипоталамо-гипофизарно-надпочечниковой
системы не происходит. При более высоких дозах уже через 1-2 нед отмечают нарушение функции коры надпочечников, а в дальнейшем может развиться ее атрофия.
Длительность курса лечения. При курсе до 10 сут (в дозе не более 40 мг/сут преднизолона) нет опасности значительного угнетения гипоталамо-гипофизарно-надпочечниковой системы, при приеме в течение нескольких недель возможна атрофия коры надпочечников.
Время приема. Необходимо учитывать циркадианный ритм выработки глюкокортикоидов (опаснее принимать 5 мг преднизолона вечером, чем 20 мг утром).
Вид препарата. Угнетение гипоталамо-гипофизарно-надпочеч-никовой системы более выражено при приеме фторированных глюко-кортикоидов - триамцинолона, дексаметазона, бетаметазона с наиболее продолжительным действием.
Клиника синдрома отмены. Тяжесть синдрома отмены зависит от сохранности функции коры надпочечников. В легких случаях появляются общая слабость, быстрая утомляемость, потеря аппетита, мышечные боли, обострение основного заболевания, повышение температуры. В тяжелых случаях (особенно при сильном стрессе) может развиться классический аддисонический криз с рвотой, коллапсом, судорогами. Без введения глюкокортикоидов больные быстро умирают от острой сердечно-сосудистой недостаточности.
Меры профилактики вторичной надпочечниковой недостаточности:
- за исключением неотложных состояний и специальных показаний рекомендовано назначать глюкокортикоиды в соответствии с циркадианным ритмом;
- необходимо максимально широко использовать альтернирующую терапию;
- при курсе лечения более 10 сут глюкокортикоиды отменяют с постепенным снижением их дозы; режим отмены зависит от длительности приема; при курсе от нескольких недель до нескольких месяцев допустимо снижение дозы на 2,5-5 мг преднизолона (или эквивалентное количество другого препарата) каждые 3-5 сут. При более продолжительном применении необходимо понижать дозу медленнее - на 2,5 мг каждые 1-3 нед;
- после отмены глюкокортикоидов, принимаемых на протяжении 2 нед и более, в течение 1,5-2 лет контролировать состояние больного в стрессовых ситуациях. При необходимости проводить защитную терапию глюкокортикоидами.
Взаимодействия с другими лекарственными средствами
Эффект глюкокортикоидов усиливается при сопутствующем приеме эритромицина (замедляет метаболизм глюкокортикоидов в печени), салицилатов (увеличение не связанной с белками фракции глюкокортикоидов), эстрогенов.
Действие глюкокортикоидов ослабляют индукторы микросомаль-ных ферментов печени - фенобарбитал, фенитоин, рифампицин.
Глюкокортикоиды ослабляют действие антикоагулянтов, проти-водиабетических и антигипертензивных препаратов.
Глюкокортикоиды усиливают действие теофиллина, симпатоми-метиков, иммуносупрессантов, НПВС.
Показания к назначению глюкокортикоидов
Существует три принципиально различных схемы назначения глюкокортикоидов.
Заместительная терапия. Применение глюкокортикоидов в физиологических дозах при надпочечниковой недостаточности любой этиологии. Кортизон или гидрокортизон вводят с учетом циркадианного ритма - 2/3 дозы утром и 1/3 - вечером. Другие препараты назначают 1 раз в сутки утром.
Супрессивная терапия. Применение глюкокортикоидов при адре-ногенитальном1 синдроме в фармакологических (превышающих физиологические) дозах, что ведет к подавлению секреции АКТГ и последующему снижению гиперсекреции андрогенов корой надпочечников; 1/3 суточной дозы кортизона или гидрокортизона обычно дают утром, а 2/3 дозы - вечером.
Фармакодинамическая терапия. Наиболее частый вариант применения глюкокортикоидов подразделяется на системную и местную. При системной терапии глюкокортикоиды назначают в расчете на их противовоспалительное, противоаллергическое, иммуносу-прессивное и противошоковое действие. При системной фармакоди-намической терапии можно использовать различные пути введения и режимы дозирования препаратов в зависимости от тяжести состояния больного (табл. 24-5). Наиболее предпочтительны препараты средней продолжительности действия - преднизон, преднизолон, метилпреднизолон (табл. 24-6).
1 Адреногенитальный синдром связан с гиперсекрецией надпочечников и половых гормонов.

Таблица 24-6. Сравнительная активность глюкокортикоидов
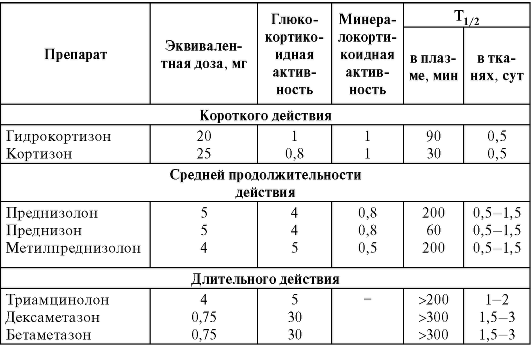
Препараты длительного действия следует назначать коротким курсом. Дексаметазон имеет некоторые особые показания к применению: бактериальный менингит, отек мозга, профилактика синдрома дыхательных расстройств у недоношенных новорожденных (дексаме-тазон стимулирует синтез сурфактанта в альвеолах легких), лейкоз (замена преднизолона дексаметазоном при остром лимфобластном лейкозе значительно снижает частоту поражения ЦНС).
Принципы длительного лечения
Назначение глюкокортикоидов рекомендовано только при неэффективности других препаратов. Исключения - надпочечниковая недостаточность, адреногенитальный синдром, опасные для жизни состояния.
Предпочтительно применение глюкокортикоидов средней продолжительности действия.
Необходим индивидуальный подбор дозы, больше в зависимости от характера заболевания, реакции больного на лечение, чем от возраста или массы тела.
Дозу снижают постепенно, до минимальной, обеспечивающей клиническую стабильность после получения желаемого эффекта.
Учет физиологического циркадианного ритма выделения глю-кокортикоидов: в большинстве случаев препараты следует назначать в виде одной утренней дозы, возможно назначение 2/3-3/4 дозы утром, а оставшейся части - около полудня. Такая схема приема снижает опасность угнетения гипоталамо-гипофизарно-надпочечниковой системы, поскольку утром эта система наименее чувствительна к супрессивному действию экзогенных глюкокорти-коидов.
Перевод больного на альтернирующую терапию возможен только при стабилизации состояния.
Альтернирующая терапия
Альтернирующая терапия заключается в назначении глюкокорти-коида через день в виде 1 дозы, которая должна быть в 2 раза больше той, которую вводили до перевода на альтернирующую терапию.
Главное преимущество этого метода заключается в меньшем подавлении гипоталамо-гипофизарно-надпочечниковой системы и, следовательно, снижении риска развития надпочечниковой недостаточности.
Больного переводят на альтернирующую терапию постепенно и только после стабилизации состояния. Для такого режима назначения пригодны только глюкокортикоиды средней продолжительности действия (преднизолон, метилпреднизолон, преднизон), после приема 1 дозы которых гипоталамо-гипофизарно-надпочечниковая система подавляется на 12-36 ч. Нельзя применять препараты длительного действия (триамцинолон, дексаметазон, бетаметазон), так как при их назначении даже через день риск угнетения гипоталамо-гипофизарно-надпочечниковой системы не уменьшается.
Альтернирующая терапия недостаточно эффективна при лечении гематологических заболеваний, язвенного колита, злокачественных опухолей, при тяжелых состояниях.
Пульс-терапия
Пульс-терапия заключается в кратковременном назначении сверхвысоких доз глюкокортикоидов. Минимальное минералокортикоид-ное действие метилпреднизолона, более слабое, чем у преднизолона, влияние на ЖКТ и ЦНС делают его препаратом выбора при проведении пульс-терапии. Обычно метилпреднизолон вводят в дозе 1-2 г/сут внутривенно капельно 1 раз в сутки в течение 3-5 дней.
Показания к проведению пульс-терапии - тяжелые и опасные для жизни заболевания, прежде всего системные коллагенозы (систем-
ная красная волчанка, васкулиты, тяжелый ревматоидный артрит с висцеральными поражениями, тяжелый анкилозирующий спондилит). Пульс-терапию применяют также при тромбоцитопенической пурпуре, острой травме спинного мозга, рассеянном склерозе.
У больных с наиболее тяжелыми формами ревматических заболеваний (волчаночный нефрит, волчаночное поражение ЦНС, ревматоидный васкулит, системные некротизирующие васкулиты) пульс-терапию следует обязательно сочетать с применением цитостатиков (циклофосфамид).
Противопоказания для назначения глюкокортикоидов относительные, их нужно принимать во внимание при планировании длительного лечения:
- СД (особенно опасны фторированные глюкокортикоиды);
- психические заболевания, эпилепсия;
- язвенная болезнь желудка и двенадцатиперстной кишки;
- выраженный остеопороз;
- тяжелая АГ.
В неотложных ситуациях глюкокортикоиды вводят без учета противопоказаний.
Глюкокортикоиды хорошо проникают через плаценту. Природные и нефторированные полусинтетические препараты в целом безопасны для плода, не ведут к внутриутробному развитию синдрома Кушинга и угнетению гипоталамо-гипофизарно-надпочечниковой системы. Фторированные глюкокортикоиды при длительном приеме могут вызывать нежелательные реакции, в том числе и уродства.
Глюкокортикоиды применяют для профилактики синдрома дыхательных расстройств у недоношенных детей. Как правило, назначают препараты длительного действия, чаще дексаметазон. Его вводят внутримышечно матери при сроке беременности до 34 нед за 24-48 ч до ожидаемых родов.
Роженице, принимавшей глюкокортикоиды в течение последних 1,5-2 лет, для предупреждения острой надпочечниковой недостаточности следует дополнительно ввести гидрокортизона гемисукцинат* по 100 мг каждые 6 ч.
При кормлении грудью низкие дозы глюкокортикоидов, эквивалентные 5 мг преднизолона, не представляют опасности для ребенка, благодаря плохому проникновению в грудное молоко. Более высокие дозы препаратов и их длительный прием могут вызвать задержку роста и угнетение гипоталамо-гипофизарно-надпочечниковой системы ребенка.
Местное применение глюкокортикоидов
Местное применение глюкокортикоидов позволяет создать в патологическом очаге высокую концентрацию препарата и значительно снизить риск развития нежелательных системных реакций. Варианты местного применения:
- ингаляционное (в легкие или полость носа);
- внутрисуставное, околосуставное;
- внутрикожное (в рубцы);
- эпидуральное;
- внутриполостное (внутриперикардиальное, внутриплевраль-ное);
- ректальное;
- наружное (кожа, глаза, уши).
Внутрисуставное введение. Для внутри- и околосуставного введения используют водонерастворимые инъекционные препараты. При этом создается высокая концентрация глюкокортикоидов в синовиальной оболочке и синовиальной жидкости, обеспечивается максимальное местное противовоспалительное действие с минимумом вероятности системных эффектов.
Показания к внутрисуставному введению. Ревматоидный артрит, псо-риатический артрит, анкилозирующий спондилит, болезнь Рейтера. Внутрисуставное введение применяют при моноили олигоартри-те, а в случае полиартрита - при выраженном воспалении одного или нескольких суставов.
Длительность эффекта зависит от вида используемого препарата и составляет от 1 до 3 нед. Во многих случаях лечебный эффект может зависеть от индивидуальной реакции пациента и сохраняться до нескольких месяцев.
Противопоказания. Инфекционный артрит, выраженная деструкция сустава, значительный остеопороз, внутрисуставной перелом, периартикулярный целлюлит, остеомиелит, бактериальный эндокардит, сепсис, патология свертывания крови.
Околосуставное введение глюкокортикоидов предпочтительно при упорных, не поддающихся лечению другими препаратами воспалительных заболеваниях околосуставных тканей с болевым синдромом и нарушением функции суставов.
Показания. Капсулит, тендовагинит, бурсит, эпикондилит, подошвенный фасциит, предплечный туннельный синдром.
Для периартикулярного введения желательно применять гидрокортизона ацетат* (5-25 мг), поскольку его действие короче и отри-
цательное влияние на метаболизм соединительной ткани (нарушение синтеза белка) менее выражено, чем у других препаратов.
НЛР. Боль, временное обострение воспалительного процесса, инфицирование, локальная атрофия и депигментация кожи, дегенеративные изменения в суставе, асептический некроз кости, образование свищевых ходов (если по ходу иглы остаются кристаллы препарата), повреждение сухожилий или нервных стволов.
Профилактика НЛР. Строгое соблюдение асептики и антисептики, использование тонкой иглы, местных анестетиков, покой для сустава в течение 1-2 сут после процедуры, одновременное введение не более чем в 3 сустава, как можно более длительные интервалы между инъекциями в один и тот же сустав.
Кортизон - препарат природного глюкокортикоида, биологически неактивен. Активируется в печени, превращаясь в гидрокортизон. Обладает кратковременным действием. В основном используется для заместительной терапии надпочечниковой недостаточности у больных с нормальной функцией печени.
Преднизолон синтетический глюкокортикоид, наиболее часто используется в клинической практике и рассматривается как стандартный препарат. Относится к глюкокортикоидам со средней продолжительностью действия.
Метилпреднизолон по сравнению с преднизолоном обладает несколько большей (на 20%) глюкокортикоидной активностью, минимальным минералокортикоидным действием, реже вызывает нежелательные реакции (особенно изменения психики, аппетита, ульцеро-генное действие). Предпочтителен при проведении пульс-терапии.
Дексаметазон является фторированным гомологом гидрокортизона. Один из наиболее мощных глюкокортикоидов: в 7 раз сильнее преднизолона по глюкокортикоидной активности. Не обладает минералокортикоидным действием. Вызывает сильное угнетение гипоталамо-гипофизарно-надпочечниковой системы, выраженные нарушения углеводного, жирового, кальциевого обмена, психостимулирующее действие, поэтому не рекомендуется назначать его на длительный срок. Препарат имеет некоторые особые показания к применению: бактериальный менингит; отек мозга; в офтальмологии (кератит, увеит и другие); профилактика и лечение тошноты и рвоты при химиотерапии; лечение тяжелого абстинентного синдрома при алкоголизме; профилактика синдрома дыхательных расстройств у недоношенных (дексаметазон стимулирует синтез сурфактанта в альвеолах легких); лейкоз (замена преднизолона на дексаметазон при
остром лимфобластном лейкозе значительно снижает частоту поражения центральной нервной системы).
24.7. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ПРЕПАРАТОВ ДЛЯ БАЗИСНОЙ ТЕРАПИИ РЕВМАТОИДНОГО АРТРИТА
Соединения золота
Соединения золота обычно назначают дополнительно к НПВС, если они не подавляют в существенной мере воспаление суставов. Парентерально вводят ауротиомалат*3 натрия и ауротиоглюкозу*3.
Препараты золота воздействуют на Т-лимфоциты, нарушая их активацию и развитие аутоиммунной реакции, их вводят внутримышечно 1 раз в неделю.
Эффективность лечения ревматоидного артрита препаратами золота сопоставима с метотрексатом. Преимуществом считают отсутствие значительной иммуносупрессии и меньший риск развития интеркуррентных инфекций. Однако препараты золота вызывают множество НЛР, требующих их отмены.
Препараты золота противопоказаны при выраженных нарушениях функций печени, почек, беременности, а также гематологических заболеваниях.
В процессе лечения препаратами золота необходимо контролировать состав мочи, концентрацию гемоглобина, количество лейкоцитов, лейкоцитарную формулу и число тромбоцитов. Эти исследования повторяют в течение месяца перед каждой инъекцией препарата, а затем через каждые 1-2 нед.
НЛР. Зуд, дерматит, стоматит, протеинурия, агранулоцитоз, тром-боцитопения, апластическая анемия, диарея, гепатит, пневмонит.
При развитии любой НЛР лечение препаратами золота прерывают. Если проявления НЛР выражены незначительно (слабый зуд или единичные кожные высыпания), через 2 нед можно осторожно возобновить лечение.
В случае значительных осложнений применяют димеркапрол (препарат, связывающий золото) в дозе 2,5 мг/кг внутримышечно до 4-6 раз в сутки в первые 2 дня, а затем 2 раза в день в течение 5-7 дней.
При приеме ауротиомалата*3, особенно хранившегося на свету, возможна кратковременная реакция: прилив крови к лицу, тахикардия, обморок через несколько минут после введения. В таких случаях
необходимо перейти к применению другого соединения золота - ауротиоглюкозы* , не вызывающей подобных реакций. Препарат золота для приема внутрь - ауранофин®.
Пеницилламин
При плохой переносимости или недостаточной эффективности препаратов золота назначают пеницилламин, который значительно им уступает по эффективности и переносимости.
НЛР (до 40%), заставляющие прекращать лечение пеницилла-мином, отмечают чаще, чем при лечении золотом. Пеницилламин может угнетать костно-мозговое кроветворение и вызывать протеи-нурию, нефротический синдром, холестатическую желтуху и другие серьезные осложнения (миастению, пузырчатку, синдром Гудпасчера, полимиозит, волчаночноподобный синдром), а также кожные сыпи и расстройства вкуса. Появление первых признаков этих осложнений требует прекращения лечения. Исключением считают расстройство вкуса, которое может пройти спонтанно. До начала лечения и каждые 2-4 нед в период приема препарата нужно делать анализ мочи и анализ крови с подсчетом тромбоцитов.
У детей из-за значительных нежелательных явлений препараты золота и пеницилламин не получили широкого применения.
Производные 5-аминосалициловой кислоты
Препараты из группы сульфаниламидов (сульфасалазин, меса-лазин), которые применяют при лечении язвенно-некротического энтероколита, назначают и при заболеваниях соединительной ткани (ревматоидный артрит). По эффективности они не уступают пени-цилламину, но превосходят его по переносимости.
Действие препаратов связано с антагонизмом в отношении фолиевой кислоты и антицитокиновым действием, подобным метотрексату.
НЛР. Тошнота, рвота, нейтропения, гемолиз, гепатит и кожные сыпи.
Существенных различий сульфасалазина и месалазина по эффективности и переносимости нет. Однако некоторые пациенты один из этих препаратов переносят лучше, чем другой.
Аминохинолиновые препараты
Противомалярийные препараты (хлорохин, гидроксихлорохин) часто применяют в связи с их хорошей переносимостью, но в дей-
ствительности это самые слабые среди базисных средств лечения системных заболеваний соединительной ткани.
Действие препаратов обусловлено слабым цитотоксическим свойством и угнетением функции макрофагов. Их можно применять у больных с минимальными проявлениями суставного синдрома, так как эффект развивается медленно, через 3-6 мес непрерывного приема.
НЛР незначительны и возникают редко: дерматит, миопатия и помутнение роговицы, как правило, обратимое. При первых же жалобах на зрение препарат отменяют. Переносимость гидрокси-хлорохина лучше.
24.8. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
ЦИТОСТАТИКОВ И ПРЕПАРАТОВ ИММУНОСУПРЕССИВНОГО ДЕЙСТВИЯ
Многие препараты, применяемые для химиотерапии злокачественных новообразований, оказывают иммуносупрессивное действие и могут использоваться в трансплантологии и лечении аутоиммунных заболеваний. Цитостатики объединяют сходный механизм действия и способность блокировать как В-, так и Т-клеточную клональную активацию. Наиболее широко применяют азатиоприн, микофенолата мофетил, циклофосфамид, метотрексат. Другие противоопухолевые цитостатики, такие, как хлорамбуцил, винкристин, винбластин, дакти-номицин, в качестве иммуносупрессивных препаратов не назначают.
Для более старых цитостатиков (азатиоприн, циклофосфамид, метотрексат) характерно действие на клетки многих тканей и органов, новые препараты (мизорибин* , микофенолата мофетил, бреквинар натрия* ) более селективно влияют на иммунокомпетентные клетки.
Циклоспорин активирует Т-лимфоциты. В настоящее время этот препарат наиболее распространен в трансплантологии и при лечении некоторых аутоиммунных болезней.
Фармакокинетика. Биодоступность циклоспорина при приеме внутрь составляет 20-50%. Жирная пища снижает биодоступность, если препарат принимают в мягких желатиновых капсулах, и не влияет на всасывание циклоспорина, применяемого в виде микроэмульсии. Пиковая концентрация достигается через 1,3-4 ч после приема внутрь. Благодаря хорошей растворимости в жирах циклоспорин равномерно распределяется в организме (объем распределения -
13 л/кг), особенно в печени, легких, почках, поджелудочной железе, селезенке, жировой клетчатке, лимфатических узлах, где концентрация препарата превышает плазменную. Циклоспорин плохо проникает через гематоэнцефалический барьер и в грудное молоко, хотя преодолевает плацентарный барьер и выявляется в амниотиче-ской жидкости. 50-60% препарата аккумулируется в эритроцитах, 10-20% - в лейкоцитах, оставшаяся часть связывается с липопро-теидами плазмы и в меньшей степени - с альбумином. Т1/2-6 ч. Препарат подвергается биотрансформации в печени с образованием более чем 30 метаболитов, которые выделяются преимущественно с желчью. Элиминация снижается при нарушении функций печени и у пожилых пациентов.
Фармакодинамика. Циклоспорин селективно подавляет активность CD4 Т-лимфоцитов, угнетает ранние фазы клеточного ответа на антигены и регуляторные стимулы путем нарушения функции белков, участвующих в активации Т-лимфоцитов и экспрессии генов, кодирующих синтез цитокинов (ИЛ-2, ИЛ-3, ИЛ-4, ФНО). Циклоспорин также подавляет хемотаксис мононуклеарных фагоцитов, экспрессию антигенов класса II главного комплекса гистосовме-стимости на мембранах антигенпрезентирующих клеток.
Показания. Циклоспорин остается основным препаратом для предупреждения реакции отторжения трансплантата (при пересадке почек, сердца, печени и других органов) в виде монотерапии или в сочетании с глюкокортикоидами. Его также назначают при аутоиммунных заболеваниях: синдроме Бехчета, эндогенном увеите, псориазе, ато-пическом дерматите, ревматоидном артрите, болезни Крона (один из видов язвенного колита).
НЛР. Циклоспорин оказывает нефротоксическое действие, которое часто заставляет отменять препарат. Реже развиваются гипертен-зия, гепатотоксичность, нейротоксичность, гирсутизм, гиперплазия десен, диспепсические явления.
Взаимодействие с другими ЛС. Циклоспорин взаимодействует со многими препаратами путем влияния на цитохром Р-450. Концентрацию циклоспорина снижают барбитураты, карбамазепин, рифампицин, сульфаниламиды, фенитоин. Концентрация циклоспорина повышается при одновременном назначении амфотерици-на В, эритромицина, кетоконазола, глюкокортикоидов, некоторых антагонистов кальция (верапамила, дилтиазема), доксициклина. Метоклопрамид увеличивает всасывание циклоспорина.
Азатиоприн
Синтетическое производное 6-меркаптопурина. Иммунодепрес-сивное действие азатиоприна сильнее его цитотоксического эффекта.
Фармакокинетика. Биодоступность при приеме внутрь составляет около 20%. Максимальная концентрация препарата достигается через 1-2 ч. Наиболее высокие концентрации создаются в тканях печени, кишечника, а также в почках, легких, селезенке, мышцах. Препарат быстро биотрансформируется и имеет очень вариабельный Т1/2 (в среднем около 5 ч). Азатиоприн и его метаболиты выводятся почками.
Фармакодинамика. Азатиоприн подавляет пролиферацию всех быстроделящихся клеток, причем Т-лимфоцитов в большей степени, чем В-лимфоцитов, в результате нарушения синтеза ДНК. Азатиоприн оказывает повреждающее действие на клетки во время митоза, поэтому он эффективен как до, так и после введения антигена.
Показания. При пересадке органов (в первую очередь почки) для предупреждения реакции отторжения трансплантата в сочетании с циклоспорином или глюкокортикоидами либо в виде монотерапии. Азатиоприн считают препаратом резерва при некоторых аутоиммунных заболеваниях (тяжелого, рефрактерного к глюкокор-тикоидам ревматоидного артрита).
НЛР. Угнетение костного мозга (лейкопения, тромбоцитопения), реакции со стороны ЖКТ, гепатотоксичность, алопеция, повышенная восприимчивость к инфекциям, мутагенность, канцерогенность.
Взаимодействие с другими ЛС. При одновременном назначении с аллопуринолом повышается токсичность азатиоприна. При необходимости одновременного назначения этих препаратов нужно снизить дозу азатиоприна на 25-35%.
Циклофосфамид
Фармакокинетика. Хорошо всасывается при приеме внутрь, биодоступность более 75%. Связывание с белками плазмы низкое, подвергается метаболизму в печени. Пиковая концентрация достигается через 2-3 ч. Т1/2 3-12 ч. Выводится почками преимущественно в виде метаболитов, 5-25% в неизмененном виде.
Фармакодинамика. Циклофосфамид угнетает синтез ДНК как про-лиферирующих, так и покоящихся клеток, подавляет активность В- и Т-лимфоцитов. В большей степени влияет на В-лимфоциты и соответственно на активность антителогенеза.
Показания. Пересадка костного мозга. В низких дозах циклофос-фамид применяют при лечении аутоиммунных заболеваний, таких,
как системная красная волчанка, гранулематоз Вегенера, идиопати-ческая тромбоцитопеническая пурпура, ревматоидный артрит, дер-матомиозит.
НЛР. При назначении больших доз возможны развитие геморрагического цистита, кардиотоксичность, тяжелая панцитопения, инфекции, токсическое поражение почек. Реже развивается анемия, тромбоцитопения. Крайне редко возникают анафилактические реакции, геморрагический колит, гепатит, стоматит.
Взаимодействие с другими ЛС. Циклофосфамид потенцирует угнетение костного мозга другими миелотоксичными препаратами. Возможны усиление кардиотоксичности при применении циклофос-фамида с доксорубицином и усиление гепатотоксичности при одновременном применении с азатиоприном, хлорамбуцилом, глюкокор-тикоидами, циклоспорином.
Метотрексат
Фармакокинетика. Максимальная концентрация в крови достигается через 1-4 ч после приема внутрь и через 40 мин после внутривенного введения. Биодоступность составляет 60-70%. Т1 /2-10 ч. Выводится преимущественно почками. Часть препарата связывается с белками и может оставаться в тканях до 1 мес.
Фармакодинамика. Применение метотрексата в больших дозах приводит к подавлению фолатзависимых ферментов, синтеза пурина и соответственно к гибели пролиферирующих клеток - развивается преимущественно цитотоксический эффект.
При назначении в малых и средних дозах преобладает иммуно-супрессивный эффект препарата в результате подавления синтеза провоспалительных цитокинов, индукции апоптоза активированных Т-лимфоцитов, угнетения подвижности нейтрофилов. Метотрексат также подавляет гуморальное звено иммунной системы и снижает концентрацию иммуноглобулинов классов G, М и А.
Показания. Препарат второй линии для лечения ревматоидного артрита. Назначают при лечении псориаза, рефрактерного к стандартной терапии, псориатического артрита, дерматомиозита.
НЛР. Тошнота, рвота, снижение аппетита, диарея, повышение активности трансаминаз. При длительном использовании метотрек-сата у 40% пациентов отмечается дозозависимая гепатотоксичность с возможным развитием фиброза и цирроза печени. Возможны угнетение костного мозга, пневмониты, анафилаксия. Оказывает тератогенное и канцерогенное действие.
Взаимодействие с другими ЛС. Метотрексат повышает гепатотоксич-ность других препаратов. При сочетании с фенилбутазоном возрастает риск угнетения костного мозга. Пенициллины и пробеницид* повышает, а фенитоин снижает концентрацию метотрексата в плазме. Параллельное назначение пириметамина, триамтерена, триметоприма может привести к усилению токсических эффектов метотрексата.
24.9. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ПРЕПАРАТОВ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ
Традиционное лечение НПВС, глюкокортикоидами, классическими иммунодепрессантами неэффективно у 25-50% больных ревматоидным артритом, не снижает активность заболевания и не предотвращает прогрессирование костно-хрящевой деструкции и инвалидизации больных. Ключевым цитокином в развитии заболевания считают фактор некроза опухоли-альфа, который продуцируется моноцитами, макрофагами, фибробластами, а также Ти В-лимфоцитами. Он обусловливает развитие хронического воспаления, деструкции хряща и кости, потери костной массы, выполняет функцию посредника воспалительного ответа и участвует в модуляции иммунной системы. ФНО-α имеет значение в развитии аутоиммунных и воспалительных заболеваний. Блокаторы ФНО-α (инфлик-симаб, адалимумаб) применяют в качестве препаратов для лечения ревматоидного, псориатического артрита, анкилозирующего спондилита и болезни Крона.
Инфликсимаб (ремикейд*) представляет собой химерные IgG1 моноклональные антитела, состоящие на 75% из человеческого белка и на 25% - из мышиного. Иммунодепрессивное средство, обладает высоким аффинитетом к ФНО-α.
Препарат быстро связывается и образует устойчивое соединение с растворимой и трансмембранной формами человеческого ФНО-α, снижая его функциональную активность. Специфичность инфлик-симаба по отношению к ФНО-α подтверждена его неспособностью нейтрализовать цитотоксический эффект лимфотоксина-цитокина, использующего те же рецепторы, что и ФНО-α.
Фармакокинетика
Фармакокинетические параметры (Cmax, объем распределения, AUC) - дозозависимы. Cmax после однократной внутривенной инфу-
зии в дозе 5 мг/кг составляет 118 мкг/мл, объем распределения - 3 л. Конечный T1/2-9,5 сут. Выводится в течение 6 мес.
Показания к применению
Ревматоидный артрит (при неэффективности проведенного ранее лечения, в том числе метотрексатом). Болезнь Крона (тяжелое течение, при неэффективности стандартного лечения, включая глюко-кортикоиды и /или иммунодепрессанты).
НЛР
Аллергические реакции (замедленного типа): миалгия и/или артралгия с лихорадкой, крапивница, зуд, отек лица, губ, кистей, дисфагия. Применение препарата через 2-4 года после введения последней дозы у большинства пациентов сопровождается развитием аллергических реакций. НЛР других органов и систем: головокружение, обморочные состояния, «приливы» крови к коже лица, повышение или снижение АД, тошнота, диарея, диспепсия, анемия, лейкопения, лимфоаденопатия.
Взаимодействие с другими ЛС
Метотрексат снижает образование антител к инфликсимабу и повышает его концентрацию в плазме.
Адалимумаб. Селективно связываясь с ФНО, блокирует его взаимодействие с поверхностными клеточными р55- и р75-рецепторами, нейтрализует функции ФНО. Изменяет ответные биологические реакции, которые контролируются ФНО, включая изменения молекул адгезии, вызывающих миграцию лейкоцитов. Снижает концентрацию С-реактивного белка, СОЭ, сывороточных цитокинов
(ИЛ-6).
Фармакокинетика
Всасывается медленно. Биодоступность при однократном подкожном введении 40 мг составляет 64%. ТСтах - 5 сут. Объем распределения при внутривенном введении - 4,7-6 л. Концентрация в синовиальной жидкости - 31-96% сывороточной. Выводится медленно. Клиренс - 12 мл/ч; зависит от массы тела и наличия антител к адалимумабу. Клиренс и Т1 / 2 существенно не изменяются при дозе 0,25-10 мг/кг. Возраст оказывает минимальное влияние на клиренс. Т1 / 2 при внутривенном и подкожном введении - 2 нед
(10-20 сут).
Показания к применению
Обострение ревматоидного артрита средней и тяжелой степени тяжести, псориатического артрита, анкилозирующего спондилита.
НЛР. Головная боль, головокружение, парестезии, повышение АД, тошнота, боль в животе, диарея, диспепсия, анемия, лимфопения. Местные реакции: боль, отек, покраснение, зуд в месте инъекции.
Противопоказания
Гиперчувствительность (в том числе к латексу), инфекционные заболевания (туберкулез), возраст до 18 лет, беременность, период лактации.
Взаимодействие
Однократное и повторное применение с метотрексатом снижает клиренс адалимумаба на 29 и 44% соответственно, но это не требует коррекции доз метотрексата и адалимумаба.