Клиническая фармакология и фармакотерапия: учебник. - 3-е изд., перераб. и доп. / под ред. В. Г. Кукеса, А. К. Стародубцева. - 2012. - 840 с.: ил.
|
|
|
|
Глава 13. НАРУШЕНИЯ СЕРДЕЧНОГО РИТМА
Нарушения ритма сердца могут осложнять течение сердечнососудистых, а также других заболеваний. Их лечение определяется целым рядом факторов. У некоторых пациентов с органическими заболеваниями сердца нарушения ритма могут стать причиной смерти. Аритмии способны существенно снижать качество жизни пациентов с сердечно-сосудистыми заболеваниями из-за нарушений гемодинамики, психологического дискомфорта и необходимости постоянного приема антиаритмических препаратов.
Нарушения ритма сердца развиваются в результате врожденных или приобретенных нарушений электрических свойств миокардио-цитов.
13.1. ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА КЛЕТОК СЕРДЦА
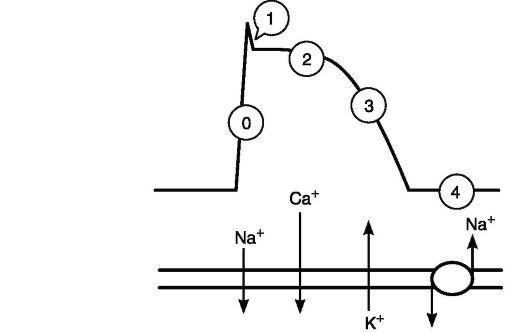
Электрические свойства клеток миокарда иллюстрирует потенциал действия (ПД). Он формируется в результате функционирования ионных каналов, которые активируются в строго определенной временной последовательности и формируют фазы потенциала действия (рис. 13-1).
Представленная на рисунке форма ПД характерна для клеток проводящей системы сердца и сократительного миокарда предсердий и желудочков. Фазы обозначены на рисунке цифрами. Фаза 0 - быстрая деполяризация клеточной мембраны, обусловленная входящим током ионов натрия через специфические натриевые каналы. Под влиянием электрического потенциала они переходят в активное состояние и способны пропускать ионы натрия. Скорость деполяризации сердечной клетки определяется скоростью деполяризации соседней сердечной клетки. Такая последовательная активация обусловливает скорость распространения импульса в миокарде.
Фаза 1 - короткий начальный период реполяризации, вызванный выходящим из клетки током ионов калия.
Фаза 2 - период медленной реполяризации (плато), обусловленный медленным движением ионов кальция внутрь клетки через кальциевые каналы.
к+
Рис. 13-1. Основные ионные токи. Пояснения в тексте
Фаза 3 - период быстрой реполяризации, во время которой ионы калия выходят из клетки. Во время периода реполяризации клетка не может ответить электрическим возбуждением на стимул. Этот феномен известен как рефрактерность, а временной промежуток от окончания фазы деполяризации до окончания фазы реполяриза-ции определяется как рефрактерный период.
Фаза 4 - полная реполяризация или потенциал покоя. Во время этой фазы восстанавливаются исходные ионные концентрации по обе стороны клеточной мембраны. При этом с помощью системы взаимодействующих ионных насосов ионы калия перемещаются обратно внутрь клетки, а ионы натрия и кальция выходят из клетки
В сердце также имеются клетки, способные спонтанно генерировать электрические импульсы, которые активируют клетки проводящей системы и сократительного миокарда предсердий и желудочков. Эти клетки получили название водителей ритма, или пейсмекерных. Их потенциал действия отличается от потенциала действия других клеток миокарда (рис. 13-2). В клетках-водителях ритма СА-узла, в отличие от клеток сократительного миокарда, во время фазы покоя (4) потенциал не остается стабильным. Он постепенно увеличивается до определенного порогового уровня, что вызывает развитие деполяризации. Такое изменение потенциала в фазу покоя, ведущее к появлению спонтанной деполяризации, считают основой способности пейсмекерных клеток
НАРУШЕНИЯ СЕРДЕЧНОГО РИТМА
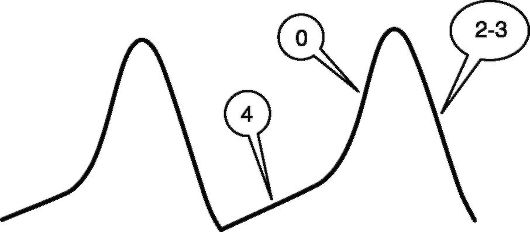
Рис. 13-2. Потенциал действия клеток водителей ритма. Пояснения в тексте
самостоятельно генерировать электрические импульсы. Скорость диа-столических ионных потоков изменяется под влиянием симпатической и парасимпатической нервной системы, что обеспечивает изменение скорости образования импульсов и частоты ритма
С биофизической точки зрения сердце представляет собой сложный электромеханический насос, который должен снабжать кровью органы и ткани не только в покое, но и в условиях стресса или физической нагрузки. Для более оптимальной работы сердца и синхронизации его различных отделов существует управление с помощью электрической системы, представленной синоатриальным (СА) узлом, проводящими предсердными путями, АВ-узлом, пучком Гиса и волокнами Гиса - Пуркинье. Генерация импульсов в СА-узле обеспечивает последовательную активацию предсердий, затем импульс «задерживается» в атриовентрикулярном узле, что позволяет сократиться предсердиям и обеспечить максимальное заполнение желудочков. Затем импульс распространяется по пучку Гиса, его ветвям и волокнам Гиса - Пуркинье на сократительный миокард, обеспечивая последовательное сокращение различных отделов и слоев миокарда, показывая оптимальный сердечный выброс.
Аритмии, нарушая нормальное распространение электрического импульса по миокарду, снижают эффективность работы сердца.
13.2. МЕХАНИЗМЫ РАЗВИТИЯ АРИТМИЙ
Механизмы развития аритмий можно классифицировать следующим образом:
- аритмии, обусловленные патологическим автоматизмом (автоматические аритмии);
- аритмии, обусловленные механизмом повторного входа возбуждения («re-entry» аритмии);
- аритмии, обусловленные появлением следовых деполяризаций (триггерные аритмии).
Аритмии, обусловленные патологическим автоматизмом, возникают в ситуации, когда под влиянием определенных причин (гипоксии, ишемии, высокого симпатического тонуса, электролитного дисбаланса) клетки, не обладающие свойствами водителей ритма - предсердий, проводящей системы или миокарда желудочков, приобретают свойство спонтанно генерировать импульсы. Обычно это связано с появлением в клетках аномальных ионных токов в фазу покоя с возникновением спонтанной диастолической деполяризации, что приводит к генерации импульсов клетками, не обладающими в нормальных условиях свойствами водителей ритма.
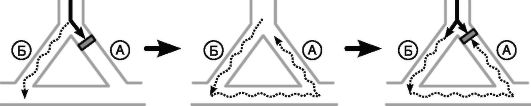
Аритмии, обусловленные механизмом re-entry, считают наиболее распространенными. В упрощенном виде механизм re-entry можно представить следующим образом (рис. 13-3).
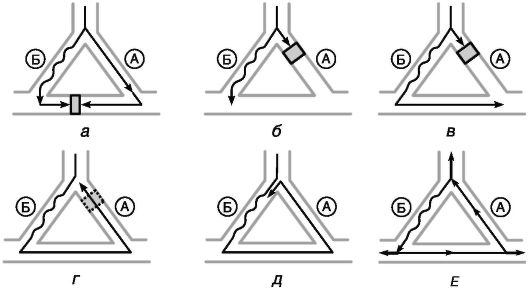
Рис. 13-3. Развитие аритмии по механизму повторного входа. Пояснения в тексте
Для развития re-entry аритмий необходимы определенные условия.
• Наличие двух параллельных путей (А и Б), которые соединяются с помощью проводящей ткани с формированием замкнутого электрического контура.
• Эти проводящие пути должны иметь различные электрофизиологические характеристики. Один из этих путей (А) характеризуется
быстрым проведением импульса и более длинным рефрактерным периодом («быстрый»). Второй путь (Б) должен иметь медленную скорость проведения, но короткий рефрактерный период («медленный»).
• Наличие преждевременного инициирующего импульса, вступающего в круг циркуляции в строго определенный временной промежуток. Этот временной промежуток определяется различием в длительности рефрактерных периодов быстрого и медленного путей и обозначается как зона тахикардии.
• Достаточно высокая скорость циркуляции импульса по кругу, поскольку очередной импульс, генерируемый вышележащим водителем ритма, способен блокировать циркуляцию.
• Возможность беспрепятственного распространения циркулирующего импульса за пределы круга для активации остальных отделов сердца.
Этапы развития аритмий по механизму re-entry (обозначены на рис. 13-3 буквами): А - очередной синусовый импульс проводится по пути А и Б с разной скоростью, но фронты возбуждения «сталкиваются» на уровне анастомозов и циркуляции импульса по кругу не происходит, Б - преждевременный импульс вступает в круг циркуляции. Путь А уже провел очередной синусовый импульс и находится в состоянии рефрактерности, что приводит к блокаде проведения преждевременного импульса. Путь Б имеет более короткий рефрактерный период и способен провести преждевременный импульс, В - из-за низкой скорости проведения импульс медленно движется по пути Б и анастомозам, Г - к моменту достижения импульсом пути А этот путь выходит из состояния рефрактерности и проводит импульс в ретроградном направлении, Д - импульс вновь повторно входит в путь Б и циркулирует по кругу, Е - циркулирующий по кругу импульс выходит за пределы круга и активирует остальные отделы сердца, становясь водителем ритма.
Петли, определяющие развитие re-entry аритмий, могут быть как врожденными, так и приобретенными. Наджелудочковые reentry тахикардии часто связаны с наличием врожденных дополнительных проводящих путей или продольной диссоциацией АВ-узла на два канала с различными электрофизиологическими свойствами. Желудочковые re-entry аритмии обычно развиваются в результате заболеваний, приводящих к поражению миокарда. Петли reentry в желудочках возникают в тех областях, где нормальная ткань
соседствует с участками фиброзной ткани, появившейся после ИМ или кардиомиопатии.
Триггерные аритмии возникают в результате появления в фазу быстрой реполяризации или в ранний период фазы покоя положительно направленных «выступов» потенциала действия, получивших название ранних или поздних следовых деполяризаций (рис. 13-4).

Рис. 13-4. Ранние (1) и поздние (2) следовые деполяризации
В случаях, когда амплитуда следовых деполяризаций достигает определенной пороговой величины, происходит генерация импульсов путем активации натриевых каналов.
Ранние следовые деполяризации отмечаются при врожденных электрических аномалиях, приводящих к удлинению интервала QT, или в результате воздействия препаратов, в том числе и антиаритмических, которые также удлиняют интервал QT при воздействии на миокард катехоламинов, ишемии, при уменьшении концентрации калия в крови.
Поздние следовые деполяризации могут вызывать передозировка сердечными гликозидами, катехоламинами или ишемия.
Клинические проявления и методы диагностики нарушений ритма сердца
Клиническая картина аритмий определяется ЧСС во время эпизода нарушения ритма, его длительностью и состоянием сократительной функции сердца.
Проявления аритмий включают в себя ощущение сердцебиения или перебоев в работе сердца, обморочные или предобморочные состояния, симптомы сердечной недостаточности - одышку, хрипы в легких, снижение АД. У некоторых пациентов эпизоды аритмий протекают практически бессимптомно.
Ведущий метод диагностики аритмий - ЭКГ.
Регистрация ЭКГ с поверхности тела осуществляется с помощью системы электродов, которые формируют электрокардиографические отведения. Рисунок ЭКГ в различных отведениях несколько различается, но в норме содержит определенные компоненты, которые отражают последовательную активацию различных отделов сердца.
• Начальная часть зубца Р отражает генерацию импульса в синусовом узле.
• Зубец Р отражает распространение электрического импульса на предсердия.
• Сегмент PQ (PR) отражает прохождение электрического импульса через АВ-узел.
• Комплекс QRS отражает распространение электрического возбуждения на желудочки.
• Сегмент ST.
• Зубец Т отражает процесс реполяризации желудочков.
• Интервал Т - Р - период электрической диастолы. Существенное значение имеет оценка длительности интервала QT,
который измеряется от начала комплекса QRS до окончания зубца Т.
С помощью ЭКГ в большинстве случаев можно установить локализацию источника аритмии, ЧСС, а в ряде случаев предположить наиболее вероятный механизм развития.
Клинические и ЭКГ-симптомы аритмий представлены в табл. 13-1.
Таблица 13-1. Клинические и ЭКГ-симптомы аритмий
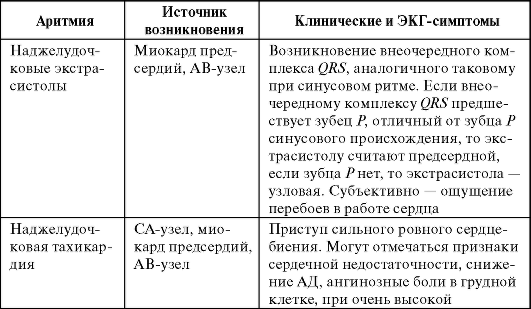
Продолжение табл. 13-1
Окончание табл. 13-1
Для диагностики аритмий можно использовать и другие методы, основанные на регистрации электрической активности сердца. Среди них можно выделить длительное амбулаторное мониторирование ЭКГ по Холтеру, регистрацию ЭКГ во время тестов с физической нагрузкой, инвазивные внутрисердечные исследования, а также методы, позволяющие вызвать суправентрикулярные или желудочковые тахикардии (программируемая стимуляция предсердий или желудочков).
Классификация аритмий
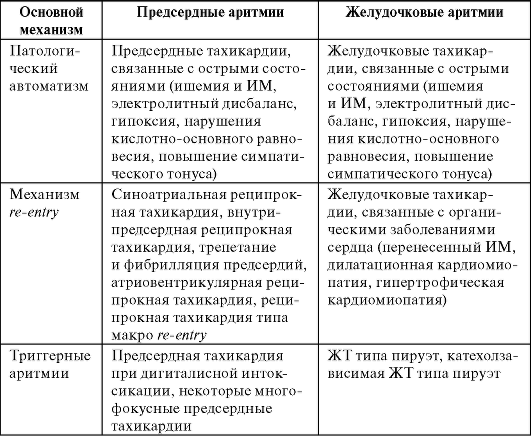
Классификация наиболее распространенных аритмий по механизму развития и локализации представлена в табл. 13-2.
Таблица 13-2. Классификация наиболее распространенных аритмий по механизму развития и локализации
Основные цели лечения аритмий
При заболеваниях сердца (в основном при органических поражениях: перенесенном ИМ, дилатационной или гипертрофической кардиомио-патии, поражении сердца при АГ) самая частая причина смерти - внезапная коронарная смерть (ВКС). Основная причина ВКС - желудочковые тахикардии, переходящие в ФЖ с последующей остановкой сердца. Главной задачей лечения этой категории пациентов считают снижение риска ВКС и увеличение продолжительности жизни.
Некоторые аритмии (обычно наджелудочковые), особенно у пациентов без органических заболеваний сердца, не представляют угрозы для жизни. В то же время пароксизмы таких аритмий могут требовать госпитализации, ограничивают физическую активность или вызывают симптомы сердечной недостаточности. В этом случае целью лечения аритмии считают улучшение качества жизни больных.
Методы лечения аритмий могут быть как фармакологическими, так и нефармакологическими. Для фармакологического лечения применяют препараты, обладающие способностью изменять электрофизиологические свойства клеток миокарда и влиять на электрофизиологические нарушения, лежащие в основе развития аритмий. Эти препараты объединены в класс антиаритмических препаратов. Кроме того, при лечении аритмий эффективны препараты, влияющие на состояния, которые запускают аритмии, - ишемию миокарда, высокий симпатический тонус, например БАБ. Для лечения аритмий также могут быть эффективны препараты, которые воздействуют на патологические процессы в миокарде, приводящие к развитию аритмий (патологическое ремоделирование миокарда при инфаркте или кардиомиопатиях), - например, БАБ, ИАПФ, БРА, статины.
Для нефармакологического лечения аритмий в основном используют методы радиочастотной аблации компонентов петли re-entry (в основном при суправентрикулярных аритмиях) и имплантацию дефибриллятора-кардиовертера (для лечения желудочковых аритмий).
Имплантируемый кардиовертер-дефибриллятор (ИКД) - портативное устройство, обычно имплантируемое под грудную мышцу. Трансвенозный электрод при этом расположен в правом желудочке. ИКД способен распознавать желудочковые тахикардии и купировать их нанесением шокового импульса. ИКД чаще всего применяют для лечения желудочковых тахикардий и профилактики ВКС.
13.3. КЛАССИФИКАЦИЯ И МЕХАНИЗМЫ ДЕЙСТВИЯ АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ
К антиаритмическим препаратам (ААП) относят ЛС, изменяющие электрические свойства клеток миокарда. Основной механизм действия ААП - воздействие на ионные токи и каналы, участвующие в формировании потенциала действия. Кроме того, некоторые ААП обладают дополнительной фармакологической активностью, которая может обусловливать дополнительное антиаритмическое действие препарата или развитие НЛР.
Согласно общепринятой классификации, предложенной Vaughan - Williams (1969), выделяют следующие классы ААП.
Класс I. Блокаторы натриевых каналов.
Класс IA. Препараты этого класса блокируют натриевые каналы, что приводит к замедлению скорости деполяризации. Кроме того, эти
ЛС обладают способностью к частичной блокаде калиевых каналов, что приводит к умеренному удлинению реполяризации (рис. 13-5).

Препараты IA класса Препараты Ш класса

Препараты 1С класса Препараты III класса
Рис. 13-5. Влияние антиаритмических препаратов на потенциал действия
Изменения ПД под влиянием препаратов IA класса приводят к замедлению скорости распространения импульса и некоторому увеличению рефрактерного периода. Эти эффекты реализуются как в предсердной, так и в желудочковой ткани, следовательно препараты IA класса имеют потенциальную эффективность как при пред-сердных, так и при желудочковых аритмиях. Эти ЛС представлены хинидином, прокаинамидом и дизопирамидом®.
Класс IB. Препараты этого класса обладают умеренной способностью блокировать натриевые каналы. Такой эффект при нормальной частоте ритма почти не проявляется, но существенно возрастает при высокой ЧСС или в условиях ишемии. Основной электрофизиологический эффект этой группы препаратов связан со способностью уменьшать продолжительность потенциала действия и рефрактерного периода. Действие препаратов IB класса реализуется преимущественно в миокарде желудочков, из-за чего эти ЛС обычно используют для лечения желудочковых аритмий. Препараты 1В класса представлены лидокаином, мексилетином® и фенотоином.
Класс IC. Препараты этого класса являются активными блокато-рами натриевых каналов, что обеспечивает их выраженное влияние на скорость деполяризации и проведения импульса. Влияние этих препаратов на реполяризацию и рефрактерность незначительно (см.
рис. 13-5). Препараты IC класса оказывают практически одинаковое влияние на предсердную и желудочковую ткани и эффективны как при предсердных, так и при желудочковых аритмиях. Представители этого класса - пропафенон и морацизин.
Класс II. β-Адреноблокаторы. БАБ обладают способностью блокировать действие катехоламинов на скорость спонтанной диастоличе-ской деполяризации водителей ритма СА-узла, что приводит к снижению ЧСС. БАБ замедляют проведение импульса и увеличивают рефрактерный период АВ-узла. БАБ эффективны при аритмиях, возникающих в отделах сердца, находящихся под прямым симпатическим контролем, и наджелудочковых аритмиях. Препараты этого класса также уменьшают частоту генерации импульсов эктопическими водителями ритма. БАБ чаще всего применяют для лечения желудочковых тахикардий. Механизмы эффективности БАБ при ЖТ обусловлены:
- антиишемической активностью (ишемия миокарда - важный пусковой механизм, приводящий к развитию ЖТ);
- торможением базовых патологических процессов, лежащих в основе структурно-функциональной перестройки миокарда у пациентов органическими заболеваниями сердца.
Класс III. Блокаторы калиевых каналов. Основное электрофизиологическое свойство препаратов этого класса - блокада калиевых каналов и замедление калиевого тока, что приводит к увеличению продолжительности реполяризации. Эти ЛС незначительно влияют на скорость деполяризации и проведения импульса, но увеличивают рефрактерные периоды в предсердной и желудочковой ткани. Препараты этого класса эффективны как при суправентрикулярных, так и желудочковых аритмиях. Представители: амиодарон и сота-лол.
Класс IV. Блокаторы медленных кальциевых каналов. Препараты этой группы (верапамил и дилтиазем) блокируют медленные кальциевые каналы, определяющие скорость деполяризации СА- и АВ-узлов. БМКК подавляют автоматизм, замедляют проведение и увеличивают их рефрактерность. Эти ЛС особенно эффективны при суправен-трикулярных re-entry аритмиях, когда круг циркуляции импульса включает в себя ткани АВ-узла. Патологические кальциевые токи могут показывать развитие следовых деполяризаций и аритмий, обусловленных триггерным механизмом. Это факт определяет успешное применение БМКК для лечения этих аритмий, в частности триггер-ных желудочковых тахикардий.
13.4. МЕХАНИЗМЫ ДЕЙСТВИЯ АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ ПРИ РАЗЛИЧНЫХ ТИПАХ АРИТМИЙ
Обычно нарушения автоматизма развиваются при острых состояниях - ишемии миокарда, нарушении электролитного баланса, высоком симпатическом тонусе, нарушении кислотно-основного равновесия. Эффективность ААП при лечении таких аритмий невысока. Основная задача лечения нарушений автоматизма - устранение и коррекция факторов, вызывающих их развитие.
Для эффективного лечения re-entry аритмий необходимо изменить электрофизиологические свойства путей, по которым циркулирует импульс. При этом ААП позволяют воздействовать как на скорость проведения импульса, так и на длительность рефрактерных периодов путей циркуляции импульса.
Изменять скорость проведения импульса способны препараты IA, IC классов, БМКК и БАБ (в тканях АВ-узла), а изменять длительность рефрактерных периодов способны препараты IB (уменьшение продолжительности), а также IA и III класса (увеличение продолжительности).
Механизм влияния ААП на re-entry аритмии представлен на рис. 13-6-13-9.

Рис. 13-6. Механизм купирования re-entry аритмий антиаритмическими препаратами, уменьшающими скорость деполяризации
Механизм действия препаратов, замедляющих скорость деполяризации (IA, IB, IC классов, БМКК и БАБ), связан с выраженным замедлением скорости проведения импульса по «медленному» (Б) и «быстрому» (А) путям. Существенное снижение скорости циркуляции импульса позволяет вступить в круг импульсу из других источников автоматизма (чаще всего из СА-узла), столкновение импульсов прекращает циркуляцию и купирует re-entry аритмию.
а б в
Рис. 13-7. Механизм профилактики re-entry аритмий антиаритмическими препаратами, уменьшающими скорость деполяризации
Снижение скорости проведения импульса в круге re-entry способно предотвратить развитие аритмии: а - внеочередной импульс вступает в круг re-entry. Путь А ранее провел очередной синусовый импульс и находится в состоянии рефрактерности, что приводит к блокаде проведения преждевременного импульса. Путь Б имеет более короткий рефрактерный период и способен провести преждевременный импульс; б - под влиянием ААП импульс медленно движется по анастомозам и вступает в путь А; в - низкая скорость проведения импульса позволяет вступить в круг А очередному синусовому импульсу до того, как циркулирующий импульс вступит в круг Б. Импульсы сталкиваются, что делает невозможным развитие re-entry аритмии.
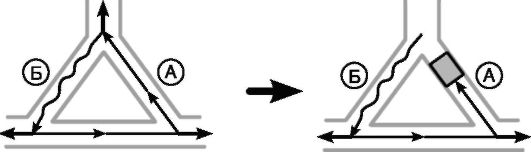
Рис. 13-8. Механизм купирования re-entry аритмий антиаритмическими препаратами, удлиняющими продолжительность потенциала действия
Механизм действия препаратов, увеличивающих длительность потенциала действия (III и IA классы), связан с их преимущественным влиянием на рефрактерность «быстрого» пути А. Увеличение длительности рефрактерного периода «быстрого» пути А приводит к тому, что циркулирующий по кругу re-entry импульс застает путь А в состоянии рефрактерности и неспособности провести импульс. Это приводит к прекращению циркуляции импульса и купированию аритмии.
в
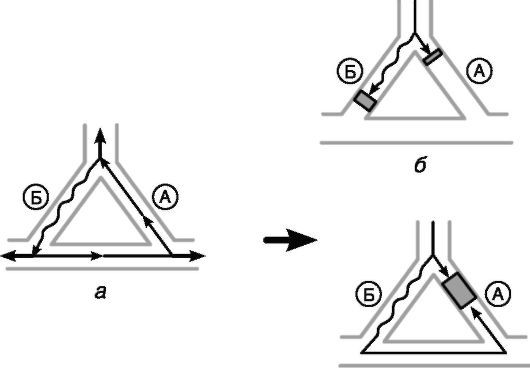
Рис. 13-9. Механизм профилактики re-entry аритмий антиаритмическими препаратами, удлиняющими продолжительность потенциала действия
Механизм профилактического действия препаратов, удлиняющих продолжительность потенциала действия (IA и III классы), можно объяснить следующим образом. Во-первых, увеличение рефрактерного периода «медленного» пути Б приводит к тому, что длительность рефрактерных периодов «быстрого» (А) и «медленного» (Б) путей становится практически одинаковой. Это приводит к блокаде проведения внеочередного импульса как в быстром, так и в медленном пути, создавая условия, не позволяющие внеочередному импульсу циркулировать по кругу re-entry; (б). Во-вторых, дальнейшее увеличение рефрактерного периода «быстрого» пути (а) может вызвать блокаду ретроградного проведения импульса, что делает невозможным циркуляцию импульса и предотвращает развитие аритмии (в).
Основной момент в лечении триггерных аритмий - устранение факторов, которые приводят к возникновению следовых деполяризаций. К этим факторам относят: препараты, способные удлинять интервал QT (в том числе и антиаритмические), сердечные гли-козиды, а также ситуации, приводящие к выраженной активации симпато-адреналовой системы, в частности интенсивные физические или психоэмоциональные нагрузки.
Кроме того, для лечения триггерных аритмий можно применять БАБ и БМКК. БАБ способны подавлять триггерные аритмии путем
устранения следовых деполяризаций, вызванных катехоламинами. БМКК, замедляя медленные кальциевые токи, могут устранять следовые деполяризации и зависимые от них аритмии.
Основные нежелательные лекарственные реакции, связанные с применением антиаритмических препаратов
Основные НЛР антиаритмических препаратов можно классифицировать следующим образом:
- проаритмические эффекты;
- системные токсические эффекты;
- угнетение функций СА-узла и проведения импульса по проводящей системе сердца (АВ- и внутрижелудочковые блокады);
- угнетение сократимости миокарда.
Проаритмические эффекты ААП имеют большое клиническое значение. Аритмии, вызываемые ААП, могут приводить к ВКС. Развитие проаритмий после приема ААП напрямую связано с их способностью влиять на ионные токи и изменять скорость проведения импульса и /или длительность рефрактерного периода.
Механизмы развития проаритмий, вызванных ААП, включают в себя:
- активацию кругов циркуляции импульса и создание условий для развития новых re-entry аритмий;
- развитие следовых деполяризаций и триггерных аритмий. Способность ААП устранять или предупреждать re-entry аритмии
связана с изменением скорости проведения импульса и /или продолжительности рефрактерного периода в отдельных компонентах петли циркуляции импульса. Назначение препаратов, изменяющих скорость проведения импульса и /или продолжительность рефрактерного периода, может менять электрофизиологические свойства путей циркуляции таким образом, что ранее неактивный круг приобретает патологические свойства, что приводит к появлению «новой» re-entry аритмии. Чаще всего появление re-entry аритмий вызывают препараты IA и ГС классов. Проаритмическая тахикардия может иметь меньшую частоту, чем исходная аритмия. Эпизоды проаритмической re-entry тахикардии могут приводить к ФЖ и ВКС.
Препараты, увеличивающие продолжительность потенциала действия (IA и III классов), могут вызывать развитие ранних следовых деполяризаций и триггерных желудочковых аритмий. Эти аритмии проявляются как повторяющиеся эпизоды полиморфной ЖТ.
Обычно они протекают бессимптомно, но могут вызывать обмороки
или ВКС.
Большинство ААП подавляют активность синусового узла, вызывают нарушение АВили внутрижелудочковой проводимости. Клинически значимое угнетение функции синусового узла проявляется уменьшением ЧСС (синусовой брадикардией). ААП способны снижать скорость проведения импульса или полностью блокировать его проведение в АВ-узле. АВ-блокада чаще всего развивается при использовании БАБ и БМКК. Препараты IA, IC и реже III классов могут вызывать нарушения проведения импульса в системе Гиса - Пуркинье. Развитие внутрижелудочковой блокады сопряжено с высоким риском появления обморочных состояний и остановки сердца.
ААП снижают сократительную функцию миокарда ЛЖ. Таким свойством обладают пропафенон, хинидин, прокаинамид, БМКК. Соответственно необходимо тщательно подходить к выбору ААП при наличии сердечной недостаточности или дисфункции ЛЖ.
ААП могут вызывать НЛР, не связанные с их электрофизиологическим действием. Тем не менее эти эффекты могут быть клинически значимыми и требовать отмены препарата. Токсическое действие проявляется на уровне всех органов и тканей. В качестве примеров можно привести:
- острый пневмонит и хронический фиброзирующий легочный альвеолит при приеме амиодарона;
- угнетение образования лейкоцитов в костном мозге при применении прокаинамида;
- лекарственный гепатит, вызванный приемом хинидина;
- волчаночный синдром, обусловленный приемом прокаинами-да;
- нарушения функции щитовидной железы, вызванные амиода-роном.
Клиническая фармакология отдельных ААП подробно представлена в приложении на компакт-диске.
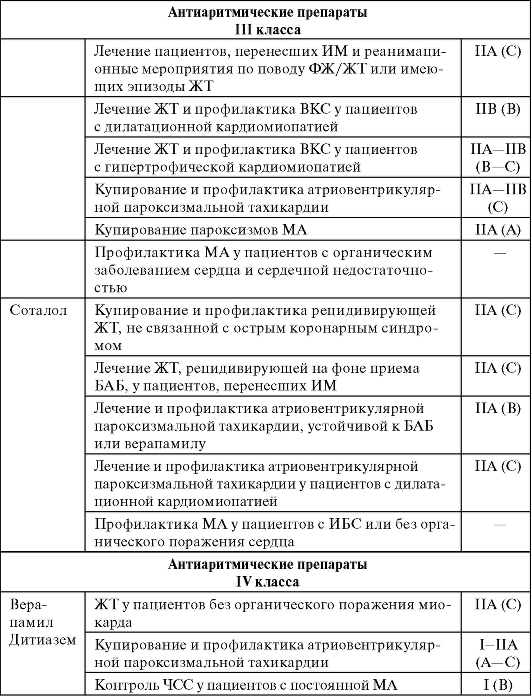
В таблице 13-3 даны рекомендации по применению ААП при различных аритмиях.
Таблица 13-3. Рекомендации по применению антиаритмических препаратов при различных аритмиях
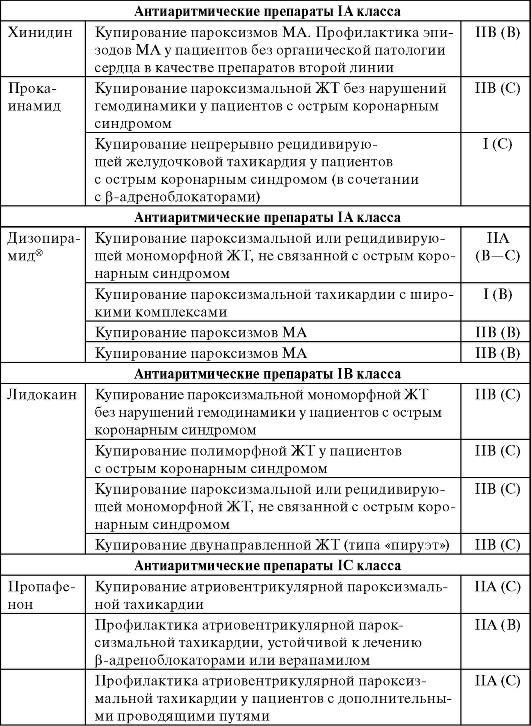
Продолжение табл. 13-3
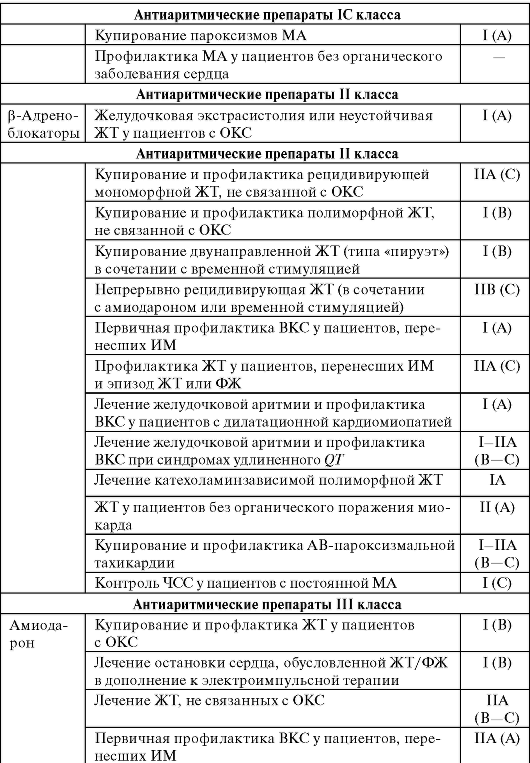
Окончание табл. 13-3
Принципы выбора антиаритмических препаратов и лечение некоторых наиболее распространенных
аритмий
Выбор антиаритмического препарата, как правило, основан на балансе между эффективностью и безопасностью.
Если у пациентов диагностирована аритмия, угрожающая жизни, предпочтение отдают препаратам с доказанной эффективностью. При лечении аритмий, снижающих качество жизни, но не приводящих к смерти, лучше назначать препараты с максимальной безопасностью, которые не вызывают проаритмий и обладают низкой токсичностью.
При выборе ААП необходимо учитывать наличие стандартных противопоказаний. Кроме того, принимают во внимание необходимость приема других препаратов, которые могут способствовать развитию проаритмий при совместном назначении с ААП.
Ниже представлены современные рекомендации по лечению наиболее распространенных аритмий.
Суправентрикулярные тахикардии
Синоатриальная реципрокная тахикардия. Наиболее вероятным механизмом ее развития считают повторный вход возбуждения. При этом круг циркуляции импульса в основном заключен внутри СА-узла, но может включать и околоузловую предсердную ткань. Для лечения синоатриальной реципрокной тахикардии рекомендуют назначать БАБ, БМКК, амиодарон. При частой рецидивирующей тахикардии этого типа, не контролирующейся приемом ААП, рекомендована радиочастотная аблация СА-узла.
Атриовентрикулярная реципрокная тахикардия. Механизм, ответственный за ее развитие, - повторный вход возбуждения. Круг циркуляции импульса находится в тканях АВ-узла и связан с его разделением на два канала с различными электрофизиологическими свойствами. Метод лечения, эффективность которого считают доказанной, -радиочастотная катерная аблация (уровень доказательности I). Ее применяют как у пациентов с плохо переносимыми повторяющимися приступами атриовентрикулярной реципрокной тахикардии, так и у больных с редкими приступами. Из антиаритмических препаратов показаны БМКК, БАБ (уровень доказательности I), соталол, амиодарон, флекаи-нид*>, пропафенон (уровень доказательности IIa). При этом флекаинид*3 и пропафенон не рекомендуют использовать при ИБС и дисфункции
ЛЖ. Соталол, флекаинид*3 и пропафенон целесообразны в качестве препаратов резерва при неэффективности БАБ и БМКК.
Мерцательная аритмия (МА). Механизм, ответственный за развитие МА, - циркуляция импульса в одной или нескольких петлях re-entry, локализованных в миокарде предсердий. Кроме того, предполагают, что МА может развиваться по механизму патологического автоматизма.
Лечение МА основано на двух подходах:
- купирование пароксизмов МА с последующим поддержанием синусового ритма;
- контроль ЧСС при сохраняющейся МА.
Для купирования пароксизмов МА и восстановления синусового ритма эффективна электрическая кардиоверсия (уровень доказательности I). При пароксизме МА эффективны пропафенон (уровень доказательности I), амиодарон (уровень доказательности IIa), менее эффективны (или менее изучены) хинидин и прокаинамид (уровень доказательности IIb).
Для профилактики повторных эпизодов МА у пациентов без органических заболеваний сердца в качестве препаратов первой линии назначают пропафенон и соталол, препаратов резерва - амиодарон, дизопирамид®, прокаинамид и хинидин. Препарат выбора при сердечной недостаточности - амиодарон. У пациентов с ИБС в качестве препарата первой линии применяют соталол, препаратом резерва служит амиодарон. При их неэффективности возможно назначение дизопирамида®, прокаинамида и хинидина.
Для контроля ЧСС при сохраняющейся МА эффективны БМКК (уровень доказательности I), БАБ (уровень доказательности I), сердечные гликозиды (уровень доказательности I).
Желудочковые аритмии
Желудочковая аритмия у пациентов, перенесших инфаркт миокарда.
У пациентов, перенесших ИМ, часто отмечается ВКС при желудочковых тахикардиях. Основным механизмом развития этих аритмий считают re-entry. Для первичной профилактики ВКС пациентам, перенесшим ИМ, назначают БАБ (уровень доказательности I) и амиодарон (уровень доказательности IIa). Эффективно снижать риск ВКС у пациентов после ИМ способны ИАПФ и статины (уровень доказательности I). Если у пациентов после ИМ повторяются эпизоды ФЖ или ЖТ, эффективно применение ИКД (уровень доказательности I). Также достаточно эффективны БАБ или амиодарон (уровень доказательности IIa).
Желудочковая аритмия у пациентов с дилатационной кардио-миопатией. У пациентов с дилатационной кардиомиопатией желудочковые тахиаритмии становятся основной причиной смерти. Механизмом развития этих аритмий считают re-entry. Для лечения желудочковых тахиаритмий и профилактики ВКС пациентам с дилатационной кардиомиопатией назначают БАБ (уровень доказательности I). Кроме того, эффективны препараты без прямых электрофизиологических свойств - ИАПФ (уровень доказательности I) и блокаторы рецепторов альдостерона (уровень доказательности IIa). Кроме того, можно применять ИКД как для первичной (уровень доказательности IIa), так и для вторичной (уровень доказательности I) профилактики.
Желудочковая аритмия у пациентов с синдромом удлиненного QT. Синдром удлиненного QT - наследственный дефект ионных каналов (калиевых или натриевых) миокардиоцитов. Функционирование патологических ионных токов приводит к увеличению продолжительности потенциала действия, что проявляется существенным увеличением интервала QT на стандартной ЭКГ. Пациенты с синдромом удлиненного QT имеют высокий риск развития желудочковых тахиаритмий и ВКС. Основным механизмом развития аритмий у этой категории пациентов считают следовые деполяризации. Для лечения и профилактики ЖТ у пациентов с синдромом удлиненного QT рекомендовано: избегать приема препаратов, удлиняющих интервал QT или снижающих концентрацию калия (уровень доказательности I-IIa), занятий профессиональным спортом (уровень доказательности I-IIa), прием БАБ (уровень доказательности I-IIA). При рецидиве аритмий на фоне приема БАБ показана имплантация ИКД в сочетании с дальнейшим приемом БАБ (уровень доказательности I-IIA).
Катехоламинзависимая полиморфная желудочковая тахикардия. Она развивается у пациентов без органического поражения сердца, характеризуется развитием эпизодов полиморфной ЖТ, возникающей после физической нагрузки или приема β-адреномиметиков. В качестве механизма развития катехоламинзависимой полиморфной ЖТ предполагают появление следовых деполяризаций. Препараты выбора для первичной профилактики ВКС - БАБ (уровень доказательности IIa). Пациентам, перенесшим эпизоды ЖТ и ВКС, рекомендована имплантация ИКД в сочетании с приемом БАБ (уровень доказательности I) или только БАБ (уровень доказательности IIa).
13.5. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ
13.5.1. Клиническая фармакология антиаритмических препаратов !А класса
Хинидин
Основной представитель !А группы.
Фармакокинетика. Биодоступность хинидина сульфата* при приеме внутрь составляет 70-80%. При приеме препарата до еды его максимальная концентрация в крови определяется через 1,5 ч, после еды - через 3-6 ч. При внутримышечном введении биодоступность составляет 85-90%, максимальная концентрация в крови определяется через 1,5-2 ч. Средняя терапевтическая концентрация хинидина в крови - 5 мкг/мл. Побочные эффекты проявляются при концентрации препарата в крови больше 10 мкг/мл. Хинидин на 60-90% связывается с альбуминами крови. Хорошо проникает в ткани, его концентрация в органах в 20-30 раз выше, чем в крови. Метаболизм (окисление) препарата происходит в печени. Скорость биотрансформации зависит от активности окислительных ферментов. Дозирование хинидина определяется скоростью его окисления. Неизмененный хинидин выводится с мочой (20%) и желчью (5%), метаболиты - с мочой. Снижение элиминации происходит при сердечной недостаточности, циррозе печени, поражении почек.
Фармакодинамика. Хинидин увеличивает продолжительность потенциала действия и эффективный рефрактерный период. Он снижает скорость проведения в AВ-узле, угнетает эктопические очаги возбуждения, что приводит к уменьшению частоты экстра-систолий. Подавляет re-entry, переводя однонаправленную блокаду проведения в двунаправленную. На ЭКГ больных, принимающих хинидин, часто регистрируются расширение зубца Р, удлинение интервалов PR и QT, расширение комплекса QRS, депрессия сегмента ST. Между концентрацией хинидина в плазме крови, шириной QRS и длиной QT имеется прямая зависимость. Препарат обладает холинолитическим действием, уменьшает влияние на сердце катехоламинов, оказывает выраженное отрицательное инотропное действие, снижает АД.
Показания. Хинидин применяют для купирования пароксизмаль-ной МА; пароксизмальной наджелудочковой тахикардии; частой предсердной и желудочковой экстрасистолии.
НЛР. При интоксикации хинидином отмечаются сердечнососудистые (артериальная гипотония, ФЖ, АВ-блокада, синусовая брадикардия) и внесердечные (тошнота, рвота, диарея, нарушения слуха, зрения, гемолитическая анемия) расстройства. Препарат нельзя назначать при повышенной чувствительности к нему, ХСН, значительной кардиомегалии, шоке, тромбоэмболии, тяжелой почечной и печеночной недостаточности, интоксикации сердечными гликозидами, АВ-блокаде II-III степени и блокадах ножек пучка Гиса.
Прокаинамид
Близкий по действию к хинидину и один из наиболее эффективных антиаритмических препаратов этой группы.
Фармакокинетика. Биодоступность прокаинамида - 85%. Максимальная концентрация препарата в крови при назначении внутрь достигается через 1 ч, при внутримышечном введении - через 15-30 мин. При использовании терапевтических доз до 10% препарата циркулирует в крови (85% из них в свободном виде), а остальная часть захватывается тканями. В печени происходит N-ацетилирование препарата, при этом образуется N-ацетилпрокаинамид, оказывающий одинаковое с прокаинамидом антиаритмическое действие. Скорость образования N-ацетилпрокаинамида генетически обусловлена. Основная часть (до 90%) прокаинамида выводится почками, из них в неизмененном виде - около половины. Скорость элиминации существенно зависит от функций печени и почек.
Показания. Прокаинамид широко применяют при наджелудочко-вых и желудочковых тахиаритмиях.
НЛР. Прокаинамид приводит к образованию антиядерных антител у 70% больных, что у 20% из них вызывает развитие синдрома системной красной волчанки. Этот лекарственный синдром чаще развивается у «медленных ацетиляторов». Прокаинамид обладает ганглиоблокирующим действием, снижая артериальное и венозное давление. При внутривенном введении может ухудшать сократительную активность миокарда, но в меньшей степени, чем хинидин. Противопоказан при AВ-блокаде, блокаде ножек пучка Гиса, декомпенсации ХСН.
13.5.2. Клиническая фармакология антиаритмических препаратов !В класса (местные анестетики)
Препараты блокируют вхождение натрия в 4 фазу ПД и увеличивают проницаемость мембран для ионов К+ в 3 фазу ПД, тем самым они снижают длительность реполяризации и укорачивают ПД. Анестетики снижают автоматизм эктопических очагов в желудочках, особенно в области ишемии. Не влияют на проводимость и силу сокращений миокарда. Основные показания к назначению ААП !В класса - желудочковая экстрасистолия в острой фазе ИМ, приступы ЖТ, аритмии по типу re-entry.
Лидокаин
Фармакокинетика. При приеме внутрь пресистемная элиминация лидокаина составляет 90%, из-за этого препарат не назначают внутрь. Основной путь введения - внутривенный. 20-25% лидокаи-на связывается с белками плазмы. Большая часть препарата выводится с мочой в виде метаболитов и только 3% - в неизмененном виде. При внутривенном введении период полувыведения лидо-каина составляет 1,5 ч. Терапевтическая концентрация сохраняется недолго - примерно 20 мин. При патологии печени период полувыведения может возрасти в 3 раза. При внутримышечном введении терапевтическая концентрация в крови сохраняется в течение 2 ч.
Фармакодинамика. Препарат в терапевтических дозах практически не влияет на сократимость миокарда.
Показания. Лидокаин применяют при желудочковой тахиаритмии, желудочковой экстрасистолии при остром ИМ, для профилактики ФЖ. Лидокаин особенно эффективен при желудочковых аритмиях, обусловленных механизмом re-entry.
НЛР. При передозировке возможно развитие судорог, парестезий, тошноты. Препарат не применяют при выраженной блокаде ножек пучка Гиса, артериальной гипотензии.
Фенитоин
Фармакокинетика. Препарат медленно, но полностью всасывается в ЖКТ. Максимальная концентрация в крови достигается через 8 ч. В плазме крови до 90% фенитоина находится в связанном состоянии. Биотрансформация происходит в печени, большая часть метаболитов выводится с желчью. Период полувыведения препарата - 24 ч.
Фармакодинамика. Оказывает влияние на электрофизиологические параметры кардиомиоцитов, схожее с лидокаином. Фенитоин повышает концентрацию ионов калия в кардиомиоцитах, что особенно актуально при аритмиях, связанных с интоксикацией сердечными гликозидами.
Показания к применению. Фенитоин применяют при дигиталис-ных токсических аритмиях, особенно желудочковых.
НЛР. Может вызывать изменения со стороны ЦНС: расстройства сна, головокружение, нистагм, тошноту. При длительном применении вызывает гипертрофию десен. Препарат противопоказан при ХСН, АВ-блокаде.
13. 5. 3. Клиническая фармакология
антиаритмических препаратов !С класса
Препараты блокируют №+-каналы, существенно замедляя скорость деполяризации (фаза 0) и угнетая автоматизм, преимущественно в волокнах Гиса - Пуркинье и желудочках, при этом практически не влияют на реполяризацию. ЛС этой группы применяют при пред-сердных и желудочковых аритмиях.
Лаппаконитина гидробромид
Препарат, полученный из растения аконита белоустого.
Фармакокинетика. При назначении препарата через рот его биодоступность составляет менее 40%. Латентный период составляет 40-60 мин, максимальный эффект развивается через 4-6 ч, продолжительность действия - 8 ч. При внутривенном введении действие препарата развивается относительно медленно - латентный период составляет 15-20 мин, максимальный эффект достигается через 2 ч, продолжительность действия - 6-8 ч.
Показания. Наджелудочковые и желудочковые аритмии (экстраси-столия, пароксизмальная тахикардия).
НЛР. Возможно появление головной боли, головокружения, диплопии, аритмогенное действие. Лаппаконитина гидробромид противопоказан при атриовентрикулярных и внутрижелудочковых блокадах.
Пропафенон
Фармакокинетика. Хорошо всасывается из ЖКТ, но биодоступность не превышает 50%. Латентный период пропафенона - 30 мин,
максимум эффекта достигается через 3 ч, длительность действия - от 4 до 8-10 ч. Выводится почками в виде метаболитов.
Фармакодинамика. Препарат уменьшает скорость быстрой деполяризации - фазы 0 преимущественно в волокнах Пуркинье и сократительных волокнах желудочков, снижает автоматизм, слабо блокирует β-адренорецепторы.
Показания. Препарат назначают при желудочковых аритмиях (ЖТ, синдроме Вольфа - Паркинсона - Уайта), фибрилляции предсердий.
НЛР. Наблюдаются у 13-17% больных. Чаще всего возникают слабость, головокружение, рвота. Проаритмические эффекты пропа-фенона регистрируют у 5-6% пациентов. Препарат противопоказан при АВ-блокаде, обструктивных заболеваниях легких.
13.5.4. Клиническая фармакология антиаритмических препаратов !! класса (β-адреноблокаторы)
ЛС этой группы блокируют влияние симпатомиметиче-ских веществ на развитие потенциала действия. Они уменьшают №+ ток в4и0 фазу ПД, снижают активность синусового узла и эктопических очагов. Большинство БАБ замедляют ЧСС, снижают СА- и АВ-проводимость, увеличивают рефрактер-ность AВ-узла. Препараты оказывают отрицательное инотроп-ное действие. БАБ отличаются по кардиоселективности (действие на β1-адренорецепторы сердца), наличию внутренней симпатоми-метической и мембраностабилизирующей активности.
При назначении БАБ в небольших дозах возникает антиаритмический эффект, при увеличении дозы развиваются антиангинальный и гипотензивный эффекты. Наиболее выраженной антиаритмической активностью обладают препараты без внутренней симпатоми-метической активности.
К БАБ, которые применяют в качестве антиаритмических препаратов, относят как неселективные препараты: пропранолол, окспре-нолол®, пиндолол, так и кардиоселективные: атенолол, талинолол. Все перечисленные БАБ показаны при синусовой тахикардии любого гене-за (кроме интоксикации сердечными гликозидами), при предсердной пароксизмальной тахикардии, мерцании и трепетании предсердий, синдроме Вольфа - Паркинсона - Уайта. При наличии у больного
экстрасистол в ранний период после ИМ применение БАБ может предупредить внезапную смерть больного от нарушений сердечного ритма. Кроме того, БАБ являются препаратами выбора при аритмиях, провоцируемых физическими нагрузками. Основные НЛР БАБ - выраженная брадикардия, АВ-блокада, артериальная гипотония, бронхоспазм. Выраженность НЛР зависит от селективности препарата. Кардиоселективные БАБ реже вызывают НЛР. Противопоказания к назначению БАБ - нарушения АВ-проводимости.
13. 5. 5. Клиническая фармакология антиаритмических препаратов !!! класса (ингибиторы реполяризации)
Антиаритмические препараты этой группы значительно удлиняют потенциал действия, блокируя К+-каналы, возможно Са2+- и №+-каналы, обладают антиадренергическим действием. Эти эффекты приводят к увеличению продолжительности ПД и эффективного рефрактерного периода путем снижения скорости реполяризации. Ингибиторы реполяризации действуют на все проводящие и сократительные клетки сердца.
Амиодарон
Фармакокинетика. Препарат медленно всасывается. Биодоступность низкая и в среднем составляет 35%. Латентный период - от 2 сут до нескольких недель. Период полувыведения - 1 мес. Амиодарон выводится из организма через ЖКТ.
Фармакодинамика. Помимо основного противоаритмического действия, амиодарон уменьшает работу сердца, ослабляя адренергиче-ское влияние на миокард. Он уменьшает ЧСС, увеличивает коронарный кровоток, улучшает метаболизм миокарда путем повышения концентрации креатинфосфата и гликогена. Не влияет на сократимость миокарда и сердечный выброс.
Показания к применению. Препарат назначают при угрожающих жизни желудочковых аритмиях у пациентов с ИБС, особенно осложняющейся декомпенсацией ХСН, фибрилляцией предсердий, частыми желудочковыми экстрасистолами; при синдроме Вольфа - Паркинсона - Уайта. Амиодарон назначают больным с желудочковыми тахиаритмиями при повышенном риске внезапной смерти.
НЛР. Амиодарон часто вызывает НЛР, что существенно ограничивает его применение. По разным данным, у 0,002-5% больных развиваются повреждения легких в виде глубокого интерстициального пневмонита. Ввиду этого при длительном приеме препарата необходимо каждые 3-4 мес проводить рентгенологическое исследование легких. Молекула амиодарона содержит йод (31% массы), что необходимо учитывать при заболеваниях щитовидной железы, кроме того, возможно развитие тиреотоксикоза. Частота возникновения этого осложнения колеблется от 1 до 5%. При длительном применении препарата у 5% больных возникает серовато-коричневая пигментация кожи, у 10-20% - фотосенсибилизация. Амиодарон не применяют при всех видах нарушений проводимости сердца, артериальной гипо-тензии, дисфункции щитовидной железы, БА.
Соталол
Фармакокинетика. При приеме внутрь препарат быстро всасывается из ЖКТ, его биодоступность составляет 90-100%. С белками плазмы практически не связывается, период полувыведения - 15 ч, выводится преимущественно почками.
Фармакодинамика. Соталол обладает электрофизиологическими свойствами антиаритмических препаратов как II, так и III класса. Как и все БАБ вызывает угнетение предсердно-желудочковой проводимости и уменьшение ЧСС, а также удлиняет рефрактерный период в предсердиях, желудочках и проводящей системе путем удлинения ПД в кардиомиоцитах, что характерно для антиаритмических препаратов III класса.
Показания. Соталол применяют при наджелудочковой и желудочковой тахикардии, пароксизмальной форме мерцания предсердий.
НЛР. Для соталола характерны НЛР, свойственные другим БАБ: брадикардия, АВ-блокада, артериальная гипотония, бронхоспазм.
13.5.6. Клиническая фармакология антиаритмических препаратов IV класса (блокаторы медленных кальциевых каналов)
Препараты блокируют медленный трансмембранный ток ионов кальция в клетку, что вызывает торможение фазы 0 ПД клеток с медленным электрическим ответом (клетки СА- и АВ-узлов, поврежденные волокна миокарда). Это способствует снижению автоматизма
СА-, AВ-узла и эктопических очагов. БМКК нарушают механизм reentry. Показания к применению - купирование приступов пред-сердной пароксизмальной тахикардии.
Верапамил
Верапамил (Изоптин*) - производное фенилалкиламинов (см. гл. 10), препарат, наиболее широко применяемый при аритмиях.
Фармакокинетика. Хорошо всасывается при приеме внутрь, но обладает низкой биодоступностью - 10-20% из-за метаболизма в печени при первом прохождении. В крови связывается с белками на 90%. Биотрансформация происходит в печени путем N-деалкилирования и O-деметилирования. Однако существуют значительные индивидуальные различия в фармакокинетике препарата. Период полувыведения варьирует от 2,5 до 7,5 ч после однократного введения и от 4,5 до 12 ч после повторного приема. Увеличение периода полувыведения при повторном введении обусловлено угнетением ферментных систем печени. Стабильная терапевтическая концентрация в крови достигается через 4 сут после начала приема. Выводится почками, в том числе в неизменном виде - 5% препарата. Толерантности к верапамилу не возникает.
Показания. Верапамил назначают для лечения и профилактики предсердных и наджелудочковых аритмий (пароксизмальной тахикардии, мерцании предсердий), профилактики приступов стенокардии, при АГ.
НЛР наблюдаются у 9% больных. У 4% пациентов возникают нарушения со стороны сердечно-сосудистой системы - АВ-блокады, артериальная гипотензия, декомпенсация ХСН. У 2% больных отмечаются нарушения со стороны ЖКТ - запор, тошнота, у 2% - негативные реакции со стороны ЦНС: головная боль, головокружение.
Противопоказания. Верапамил нельзя назначать при синдроме слабости синусового узла, АВ-блокаде степени, синдроме
Вольфа - Паркинсона - Уайта (WPW).
Взаимодействие с другими ЛС. Одновременное назначение вера-памила с БАБ или противоаритмическими препаратами !А класса может приводить к развитию АВ-блокады, брадикардии, артериальной гипотонии, сердечной недостаточности. При одновременном назначении верапамила с другими гипотензивными препаратами отмечается взаимное потенцирование их эффектов. При совместном назначении возможно повышение концентрации дигоксина в плазме. Нейротоксическое действие верапамила потенцируется карбамазепи-
ном и солями лития, причем психотропный эффект лития при этом ослабляется. Концентрация циклоспорина или теофиллина в плазме крови при совместном назначении с верапамилом возрастает. Верапамил потенцирует действие миорелаксантов.
Дилтиазем
Дилтиазем - селективный блокатор медленных кальциевых каналов, производное бензотиазепина (см. главу 10).
Показания. Дилтиазем назначают для купирования пароксизмов наджелудочковой тахикардии и МА с целью урежения ЧСС при МА, а также для предупреждения пароксизмов МА при острой ишемии миокарда.
НЛР. Брадикардия, нарушения атриовентрикулярной проводимости, ХСН, тахикардия, зуд, крапивница, фотосенсибилизация.
13.6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ПРЕПАРАТОВ РАЗНЫХ ГРУПП, ОБЛАДАЮЩИХ АНТИАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ
Аденозина фосфат
Эндогенное биологически активное вещество, принимающее участие в различных метаболических процессах в организме.
Фармакокинетика. При внутривенном введении захватывается эритроцитами и эндотелиальными клетками сосудов. В организме быстро окисляется до инозина и аденозинмонофасфата. Период полувыведения - менее 10 с. Выводится почками в виде неактивных метаболитов.
Фармакодинамика. Оказывает антиаритмическое действие, замедляет АВ-проводимость, увеличивает рефрактерность АВ-узла, понижает автоматизм синусового узла. Оказывает также сосудорасширяющее действие.
Показания. Купирование приступов наджелудочковой тахикардии, в том числе у больных с синдромом Вольфа - Паркинсона - Уайта.
Противопоказания: АВ-блокада II-III степени, синдром слабости синусового узла, гиперчувствительность к препарату.
НЛР: асистолия, ЖТ, ФЖ.
Лекарственное взаимодействие. Кофеин и теофиллин - конкурентные антагонисты препарата. Дипиридамол усиливает действие адено-зина фосфата. Карбамазепин - увеличивает степень АВ-блокады.
Препараты калия
К противоаритмическим препаратам можно отнести ЛС, содержащие калий и магний, - панангин*, аспаркам, калия хлорид. Иногда их причисляют к первой группе противоаритмических средств. Препараты калия вызывают торможение медленной спонтанной диа-столической деполяризации, снижают скорость проведения импульса в сердечных клетках.
Препараты калия способствуют поддержанию ионного баланса в организме, восполняют имеющийся дефицит ионов. Их назначают для лечения аритмий, связанных с гипокалиемией (например, на фоне приема салуретиков или при интоксикации сердечными гликозидами).
Противопоказания. Тяжелая почечная недостаточность, гиперка-лиемия, болезнь Аддисона, одновременный прием калийсберегаю-щих диуретиков.
НЛР: Тошнота, рвота, диарея, гиперкалиемия с возможным развитием аритмий, блокады сердца, асистолии.
Сердечные гликозиды
Сердечные гликозиды - это наиболее ранние соединения, применяемые при лечении предсердных тахиаритмий и сердечной недостаточности.
Это стероидные кардиотонические соединения растительного происхождения, и при гидролизе они расщепляются на сахарную (гликон) и несахарную (агликон или генин) части.
Фармакодинамика. Сердечные гликозиды - единственная широко применяемая группа препаратов с положительным инотропным действием. Положительное инотропное действие объясняется угнетением №+,К+-АТФазы, являющейся для них специфическим рецептором. Это способствует увеличению в кардиомиоцитах концентрации Na+, снижению - К+ и активации системы обмена Na+ - Ca2+, повышая концентрацию Ca2+ в цитоплазме и реализуя положительное инотропное действие. При этом процесс релаксации не страдает, так как сердечные гликозиды не ингибируют Са2+-АТФазу. Предполагают, что сердечные гликозиды имитируют эффект эндогенных дигиталисоподобных веществ.
Повышение силы и скорости сокращений сердца при введении сердечных гликозидов происходит без увеличения потребности миокарда в кислороде. Они в равной степени повышают сократимость миокарда при сердечной недостаточности и ее отсутствии. Однако
их применение у здоровых людей не сопровождается изменением минутного объема сердца, величина которого определяется не только силой сердечных сокращений, но и их частотой, величиной пред-и постнагрузки.
Механизм диастолического действия сердечных гликозидов связан с активацией барорецепторов дуги аорты путем повышения ударного объема сердца, с прямой активацией центра блуждающего нерва в продолговатом мозге и с замедлением АВ-проводимости. Увеличение времени диастолы оказывает положительное влияние на процессы кровенаполнения желудочков сердца и кровоснабжения миокарда.
При внутривенном введении сердечные гликозиды могут вызвать сужение артериол и венул, которое объясняется прямым миотроп-ным действием препаратов и стимуляцией α-адренорецепторов гладких мышц сосудов. Вазоспастическое действие сердечных гликозидов может сопровождаться повышением АД, что необходимо учитывать при лечении некоторых заболеваний, например острого ИМ. Этого эффекта можно избежать при медленном (в течение 15 мин) введении препарата.
Сердечные гликозиды оказывают прямое действие на канальце-вую реабсорбцию натрия, что также связано с подавлением активности Na+, К+-АТФазы. Однако в терапевтических дозах этот эффект проявляется слабо и не имеет существенного значения. Увеличение диуреза при приеме сердечных гликозидов объясняется улучшением почечной гемодинамики благодаря повышению минутного объема сердца.
Классификация сердечных гликозидов. К настоящему времени открыто более 400 сердечных гликозидов, но основное место в медицинской практике занимают гликозиды реснитчатой, шерстистой и пурпурной наперстянки (дигоксин, ланатозид Ц, дигитоксин), строфанта (строфантин К) и майского ландыша (коргликон*).
Принцип классификации сердечных гликозидов основан на их фармакокинетических свойствах: неполярные (жирорастворимые) и полярные (водорастворимые) препараты.
Фармакокинетика сердечных гликозидов. Неполярные сердечные гликозиды (дигитоксин, дигоксин, ланатозид Ц) хорошо всасываются в кишечнике, что определяет их применение в амбулаторной практике. В крови они находятся преимущественно в неактивной связанной (с альбуминами) форме, что обусловливает наличие у них латентного периода. Большая продолжительность действия и способность жирорастворимых гликозидов к кумуляции определяются
Окончание табл. 13-4
особенностями их метаболизма. Биотрансформация в печени протекает в два этапа: вначале при участии микросомальных ферментов происходит их метаболическая трансформация с последующей конъюгацией с глюкуроновой кислотой. Экскретируются гликозиды преимущественно с желчью (табл. 13-4).
Таблица 13-4. Сравнительная фармакокинетика основных сердечных глико-зидов
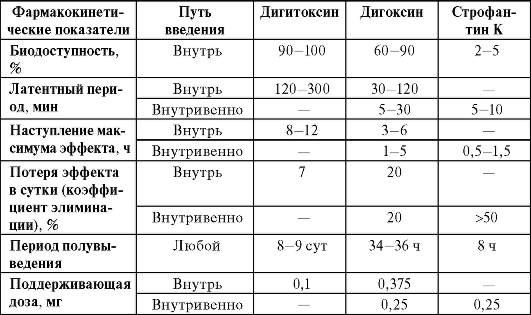
Полярные гликозиды (строфантин К, коргликон) в кишечнике всасываются плохо, из-за этого их вводят парентерально и назначают для лечения острой сердечной недостаточности или купирования пароксизмов нарушения ритма. Их связь с белками крови непрочная, выведение происходит через почки в неизмененном виде.
Токсичность неполярных гликозидов возрастает при заболеваниях печени, а водорастворимых - при заболеваниях почек.
Показания и противопоказания к применению сердечных гликози-дов. Основными показаниями к применению сердечных гликозидов считают нарушения сердечного ритма в виде мерцания предсердий, пароксизмальной наджелудочковой тахикардии, перевод трепетания предсердий в мерцание или синусовый ритм, а также сердечную недостаточность, обусловленную нарушением сократимости миокарда.
Применение и подбор адекватных доз. Наиболее часто применяют два вида дигитализации (насыщения сердечными гликозидами):
- быструю, при проведении которой в течение суток назначают насыщающую дозу гликозида с последующим переходом на поддерживающую;
- медленную (3-7 сут в зависимости от используемого препарата), когда сразу назначают поддерживающие дозы.
Быструю дигитализацию следует проводить в стационаре, медленную - при амбулаторном лечении.
Подбор индивидуальной поддерживающей дозы требует определения концентрации препарата в плазме крови, контроля динамики клинических проявлений и ЭКГ. При многомесячном или многолетнем лечении целесообразно делать короткие перерывы (например, 1 день в неделю) для предупреждения кумуляции препаратов и развития осложнений.
Факторы, влияющие на фармакокинетику и фармакодинамику сердечных гликозидов. Снижение клубочковой фильтрации вызывает замедление выведения дигоксина: в результате его концентрация в плазме превышает терапевтическую. В то же время наличие почечной недостаточности не отражается на выведении дигитокси-на. Перитонеальный диализ и гемодиализ существенно не влияют на выведение сердечных гликозидов, но могут снижать концентрацию калия в организме, способствуя проявлению аритмогенного действия препаратов. При гипертиреозе концентрация сердечных гликозидов в крови снижается в результате их повышенной биотрансформации. При гипотиреозе наблюдаются обратные изменения. У пожилых людей повышается чувствительность к сердечным гликозидам: увеличению их концентрации в крови способствуют снижение клубочковой фильтрации и уменьшение мышечной массы (основное депо сердечных гликозидов). При лечении больных пожилого возраста гликозиды следует назначать осторожно и в небольшой дозе. Чувствительность к ним повышается также при гипоксии на фоне заболеваний легких, сердечной недостаточности, ИМ и коронаросклероза, при гипокалиемии, гипомагниемии и гиперкальциемии.
Гликозидная интоксикация. Токсическое действие сердечных гли-козидов наблюдается не менее чем у половины больных на амбулаторном лечении и у 5-23% в условиях стационара. Основная причина столь частых осложнений - малая терапевтическая широта. Их токсичность трудно предсказать и диагностировать, поскольку ее про-
явления часто напоминают симптомы тех сердечных заболеваний, при которых эти препараты назначают.
В основе механизма гликозидной интоксикации лежат угнетение (на 60% и более) мембранной Na+, К+-АТФазы кардиомиоцитов и нейронов (в первую очередь) и накопление в клетках ионов кальция. Ограничение проникновения сердечных гликозидов в ЦНС снижает их токсичность и увеличивает терапевтическую широту. В реализации кардиотоксических эффектов сердечных гликозидов принимают участие и катехоламины: сердечные гликозиды облегчают их высвобождение из тканевых депо с одновременной блокадой их обратного захвата.
Интоксикация сердечными гликозидами проявляется изменениями со стороны ЖКТ (тошнотой, рвотой, анорексией, болями в животе), ЦНС (головной болью, утомляемостью, беспокойством, бессонницей, апатией), органов зрения (ксантопсией, фотофобией, выпадением полей зрения, видением светящихся точек, ободков и т.д.), сердечно-сосудистой системы (нарушением сердечного ритма, проводимости, на ЭКГ - корытообразной депрессией сегмента ST). У трети больных первым и единственным проявлением дигиталис-ной интоксикации оказываются нарушения ритма и проводимости. Сердечные гликозиды вызывают практически любые аритмии, в том числе желудочковую экстрасистолию (бигеминия и тригеминия для них наиболее типична), наджелудочковую и ЖТ, мерцание предсердий, ФЖ. Обычно у больных наблюдаются несколько видов аритмий одновременно. Наиболее типичная симптоматика начальных проявлений интоксикации - анорексия, тошнота, слабость, бради-кардия. Гибель больных происходит, как правило, на фоне сердечной блокады или ФЖ сердца.
При начальных проявлениях дигиталисной интоксикации достаточно отменить или снизить дозу сердечных гликозидов. При тяжелой гликозидной интоксикации вначале следует купировать те осложнения, которые могут привести к смерти больного, - АВ-блокаду и желудочковую тахикардию, а также проводить мероприятия по удалению сердечных гликозидов из организма.
Для лечения желудочковых аритмий применяют фенито-ин и лидокаин. Первый оказывает не только антиаритмическое действие, но и улучшает АВ-проводимость. При наджелудочко-вых аритмиях назначают БАБ, при АВ-блокаде II и III степени - атропин и глюкагон®. На фоне частой желудочковой экстрасисто-лии и при пароксизмах тахиаритмий назначают препараты калия
(панангин* или калия хлорид внутривенно). Следует учитывать, что концентрация калия в крови не всегда отражает его содержание внутри клеток, из-за этого препараты калия назначают и при отсутствии гипокалиемии. Они противопоказаны при нарушении АВ-проводимости и ХПН.
Основное звено патогенеза гликозидной интоксикации - повышение концентрации свободного кальция в тканях, что делает целесообразным назначение ЛС, выводящих кальций из организма, в частности, БМКК типа верапамила, препятствующих входу кальция в миокардиоциты. Для устранения дигиталисной интоксикации также назначают унитиол* (донатор SH-групп, восстанавливает активность Na+, К+-АТФазы), а также антитела к сердечным гликозидам (дигибид*3) и диготоксозу*3, нейтрализующие сам препарат.
Взаимодействие сердечных гликозидов с другими препаратами
При ХСН широко применяют сочетание сердечных гликозидов с ИАПФ, что значительно увеличивает эффективность каждого препарата. Инотропное действие сердечных гликозидов усиливают β2-адреномиметики (изопреналин, норэпинефрин, эпинефрин), а аритмогенное действие устраняют антиаритмические препараты IA (хинидин, прокаинамид) и IB (лидокаин, фенитоин) класса.
Усиление аритмогенных свойств гликозидов возможно при их взаимодействии с диуретиками (кроме калийсберегающих), β2-адреномиметиками, резерпином, клонидином, антагонистами кальция, трициклическими антидепрессантами, ингибиторами фос-фодиэстеразы (амринон*3, милринон*3), метилксантинами, амфоте-рицином В, глюкокортикоидами. АВ-проводимость в большей мере замедляется под действием БАБ и антиаритмических препаратов IA класса (особенно хинидина).
Препараты, снижающие перистальтику кишечника (М-холино-литики, спазмолитики, лоперамид), улучшают всасывание сердечных гликозидов, а препараты, увеличивающие перистальтику (М-холиномиметики, антихолинэстеразные средства), - снижают всасывание гликозидов. Уменьшают всасывание препаратов ионообменные смолы (холестирамин* , холестипол* ), неомицин, адсорбенты (каолин, пектин), неадсорбируемые антациды, НПВС, парааминосалициловая кислота* , салазосоединения, цитостати-ки, фенитоин и метоклопрамид. Повышение концентрации сердечных гликозидов в крови и усиление их эффектов возможны
при одновременном применении с БМКК (верапамил, галлопамил®, дилтиазем, нифедипин), ААП (хинидин, амиодарон, флекаинид* , пропафенон), НПВС (ибупрофен, индометацин), вазодилататорами (гидралазин, натрия нитропруссид), каптоприлом, спиронолакто-ном и тиреостатиками. Концентрацию гликозидов в крови снижают антибиотики (тетрациклин, эритромицин, римфапицин), фенитоин и тиреоидные гормоны.
Характеристика отдельных препаратов
Дигоксин
Фармакокинетика. Дигоксин - наиболее широко применяемый сердечный гликозид. Это объясняется его высокой биодоступностью, коротким периодом полувыведения, легкостью применения. Основными факторами, определяющими концентрацию дигоксина в крови, считают скорость и полноту его абсорбции. Его биологическая усвояемость зависит от индивидуальных особенностей больного, метода введения препарата, взаимоотношения с другими вводимыми препаратами, лекарственной формы и от вещества - наполнителя таблеток. С белками плазмы крови связывается только 20-25% препарата. Концентрация дигоксина в миокарде значительно выше, чем в плазме, он способен проникать через плаценту. 80% препарата выводится с мочой в неизмененном виде, причем выведение дигокси-на пропорционально скорости почечной фильтрации. В идеале концентрацию дигоксина в крови необходимо проверить через неделю от начала лечения (она должна находиться в терапевтической зоне - до 2 нг/мл), а затем достаточно регулярно (каждые 2-3 мес) контролировать ее у пожилых, похудевших и получающих диуретики пациентов. Новорожденные и дети младшего возраста лучше переносят большие дозы дигоксина в пересчете на единицу массы или поверхности тела, чем взрослые. Стабильная концентрация препарата при обычных методах дозирования достигается в течение 7 сут.
Ланатозид Ц отличается от дигоксина только углеводной частью. По фармакокинетическим свойствам (период полувыведения, путь выведения, степень кумуляции) препарат схож с дигоксином, хотя несколько хуже всасывается из ЖКТ (15-40%), а при внутривенном введении его действие начинается раньше. В настоящее время лана-тозид Ц используют относительно редко.
Дигитоксин - это сердечный гликозид с наибольшей длительностью действия. Он практически полностью (90-100%) всасы-
вается из кишечника и на 97% связывается с белками плазмы. Двухэтапная биотрансформация в печени определяет длительную циркуляцию препарата в крови и высокую способность к кумуляции. Терапевтические концентрации дигитоксина колеблются между 10 и 30 нг/мл, токсические - более 34 нг/мл. Препарат принимают 5-6 раз в неделю. Период полувыведения дигитоксина колеблется от 4 до 7 сут и не зависит от функций почек.
В медицинской практике нашли применение два схожих по фар-макокинетике и фармакодинамике препарата строфанта: строфантин К и уабаин. У препарата наиболее выражено систолическое действие, на АВ-проводимость и ЧСС он влияет мало. На фоне его введения у пациентов с острым ИМ может происходить увеличение зоны ишемии и некроза. Повышение сократительной способности миокарда ишемизированных (околоинфарктных) зон при приеме сердечных гликозидов в условии недостаточного снабжения клеток кислородом приводит к истощению энергетических запасов и может вызвать их повреждение и гибель, хотя они могли бы выжить в условиях сниженной нагрузки. Строфантин К выводится почками и обладает малой способностью к кумуляции.
Коргликон по характеру действия близок к строфантину К. Его эффект наступает через 5-10 мин, достигает максимума через 0,5-2 ч и длится 1-3 ч.
13.7. ФАРМАКОТЕРАПИЯ НАРУШЕНИЙ
ПРОВОДИМОСТИ И БРАДИАРИТМИЙ
В эту группу входят ЛС, повышающие процессы возбудимости и проводимости в сердце, а также устраняющие тормозящее влияние на них блуждающего нерва.
• М-холиноблокаторы (группа атропина). Препараты устраняют влияние блуждающего нерва на сердце и эффективны при резкой брадикардии, обусловленной его повышенной активностью. Их назначают при синусовой брадикардии, АВ-блокадах, интоксикации сердечными гликозидами.
• Стимуляторы β2-адренорецепторов (изопреналин, добутамин, допамин). Улучшают АВ-проводимость, повышают возбудимость миокарда. Используют при резкой брадикардии, АВ-блокадах.
• Глюкагон влияет на глюкагоновые рецепторы, что приводит к повышению концентрации свободного кальция в клетках серд-
ца. В результате возрастает автоматизм СА-узла, улучшается проводимость. Препарат имеет преимущества перед адреноми-метическими средствами, благодаря тому, что он не вызывает фибрилляции. Препарат вводят внутривенно капельно, он действует 10-15 мин. Показания к назначению - брадиаритмии, связанные с передозировкой БАБ, сердечных гликозидов и блокады различного происхождения. При применении глюкагона возможно развитие гипергликемии и гипокалиемии. Глюкагон не сочетают с препаратами, содержащими кальций.