Детские болезни: учебник / Под ред. А.А. Баранова - 2-е изд., - 2009. - 1008 с.
|
|
|
|
ГЛАВА 15 БОЛЕЗНИ КРОВИ
Геморрагические диатезы
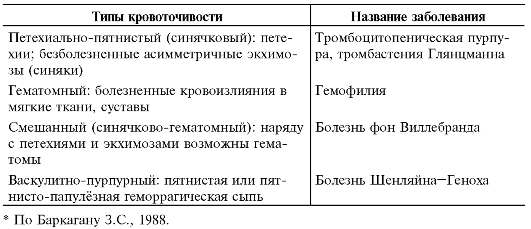
Геморрагические диатезы - заболевания, характеризующиеся наличием синдрома кровоточивости (табл. 15-1).
Таблица 15-1. Виды кровоточивости при некоторых заболеваниях из группы геморрагических диатезов*
ТРОМБОЦИТОПЕНИЧЕСКАЯ ПУРПУРА
Тромбоцитопеническая пурпура (болезнь Верльгофа) - заболевание, характеризующееся склонностью к кровоточивости, обусловленной тромбоцитопенией (снижением содержания тромбоцитов в крови ниже 150х109/л) при нормальном или увеличенном количестве мега- кариоцитов в красном костном мозге.
Тромбоцитопеническая пурпура - наиболее распространённое заболевание из группы геморрагических диатезов. Частота выявления новых случаев тромбоцитопенической пурпуры составляет от 10 до 125 на 1 млн населения в год. Заболевание, как правило, манифестирует в детском возрасте. До 10-летнего возраста заболевание встреча-
ется с одинаковой частотой у мальчиков и девочек, а после 10 лет и у взрослых - в 2-3 раза чаще у лиц женского пола.
Этиология и патогенез
При тромбоцитопенической пурпуре тромбоцитопения развивается вследствие разрушения тромбоцитов посредством иммунных механизмов. АТ к собственным тромбоцитам могут появляться спустя 1-3 нед после перенесённых вирусных или бактериальных инфекций; профилактических прививок; приёма лекарственных препаратов при индивидуальной их непереносимости; переохлаждения или инсоляции; после хирургических операций, травм. В ряде случаев какую-либо определённую причину выявить не удаётся. Поступившие в организм Аг (например вирусы, лекарственные средства, в том числе вакцины) оседают на тромбоцитах больного и индуцируют иммунный ответ. Антитромбоцитарные АТ относят преимущественно к IgG. Реакция «Аг+АТ» происходит на поверхности тромбоцитов. Продолжительность жизни тромбоцитов, нагруженных АТ, при тромбоцитопенической пурпуре снижена до нескольких часов вместо 9-11 дней в норме. Преждевременная гибель тромбоцитов происходит в селезёнке. Кровоточивость при тромбоцитопенической пурпуре обусловлена снижением количества тромбоцитов, вторичным повреждением сосудистой стенки в связи с выпадением ангиотрофической функции тромбоцитов, нарушением сократительной способности сосудов из-за понижения концентрации серотонина в крови, невозможностью ретракции кровеносного сгустка.
Клиническая картина
• Заболевание начинается исподволь или остро с появления геморрагического синдрома. Тип кровоточивости при тромбоцитопенической пурпуре петехиально-пятнистый (синячковый). По клиническим проявлениям выделяют два варианта тромбоцитопенической пурпуры: «сухой» - у больного возникает только кожный геморрагический синдром; «влажный» - кровоизлияния в сочетании с кровотечениями. Патогномоничные симптомы тромбоцитопенической пурпуры - кровоизлияния в кожу, слизистые оболочки и кровотечения. Кожный геморрагический синдром возникает у 100% больных.
Количество экхимозов варьирует от единичных до множественных.
Основные характеристики кожного геморрагического синдрома при
тромбоцитопенической пурпуре следующие.
- Несоответствие выраженности геморрагий степени травматического воздействия; возможно их спонтанное появление (преимущественно ночью).
- Полиморфизм геморрагических высыпаний (от петехий до крупных кровоизлияний).
- Полихромность кожных геморрагий (окраска от багровой до сине-зеленоватой и жёлтой в зависимости от давности их появления), что связано с постепенным превращением Hb через промежуточные стадии распада в билирубин.
- Асимметрия (нет излюбленной локализации) геморрагических элементов.
- Безболезненность.
• Нередко возникают кровоизлияния в слизистые оболочки, наиболее часто миндалин, мягкого и твёрдого нёба. Возможны кровоизлияния в барабанную перепонку, склеру, стекловидное тело, глазное дно.
• Кровоизлияние в склеру может указывать на угрозу возникновения самого тяжёлого и опасного проявления тромбоцитопенической пурпуры - кровоизлияния в головной мозг. Как правило, оно возникает внезапно и быстро прогрессирует. Клинически кровоизлияние в головной мозг проявляется головной болью, головокружением, судорогами, рвотой, очаговой неврологической симптоматикой. Исход кровоизлияния в мозг зависит от объёма, локализации патологического процесса, своевременности диагностики и адекватной терапии.
• Для тромбоцитопенической пурпуры характерны кровотечения из слизистых оболочек. Нередко они имеют профузный характер, вызывая тяжёлую постгеморрагическую анемию, угрожающую жизни больного. У детей наиболее часто возникают кровотечения из слизистой оболочки полости носа. Кровотечения из дёсен обычно менее обильны, но и они могут стать опасными при экстракции зубов, особенно у больных с недиагностированным заболеванием. Кровотечение после удаления зуба при тромбоцитопенической пурпуре возникает сразу же после вмешательства и не возобновляется после его прекращения, в отличие от поздних, отсроченных кровотечений при гемофилии. У девочек пубертатного периода возможны тяжёлые мено- и метроррагии. Реже бывают желудочно-кишечные и почечные кровотечения.
Характерные изменения внутренних органов при тромбоцитопенической пурпуре отсутствуют. Температура тела обычно нормальная. Иногда выявляют тахикардию, при аускультации сердца - систолический шум на верхушке и в точке Боткина, ослабление I тона, обусловленные анемией. Увеличение селезёнки не характерно и скорее исключает диагноз тромбоцитопенической пурпуры.
По течению выделяют острые (длительностью до 6 мес) и хронические (продолжительностью более 6 мес) формы заболевания. При первичном осмотре установить характер течения заболевания не-
возможно. В зависимости от степени проявления геморрагического синдрома, показателей крови в течении заболевания выделяют три периода: геморрагический криз, клиническая ремиссия и клиникогематологическая ремиссия.
• Геморрагический криз характеризуется выраженным синдромом кровоточивости, значительными изменениями лабораторных показателей.
• Во время клинической ремиссии исчезает геморрагический синдром, сокращается время кровотечения, уменьшаются вторичные изменения в свёртывающей системе крови, но тромбоцитопения сохраняется, хотя она менее выраженная, чем при геморрагическом кризе.
• Клинико-гематологическая ремиссия подразумевает не только отсутствие кровоточивости, но и нормализацию лабораторных показателей.
Лабораторные исследования
Характерны снижение содержания тромбоцитов в крови вплоть до единичных в препарате и увеличение времени кровотечения. Длительность кровотечения не всегда соответствует степени тромбоцитопении, так как зависит она не только от количества тромбоцитов, но и от их качественных характеристик. Значительно снижена или не наступает вообще ретракция кровяного сгустка. Вторично (в результате тромбоцитопении) изменяются плазменно-коагуляционные свойства крови, что проявляется недостаточностью образования тромбопластина в связи с дефицитом 3-го тромбоцитарного фактора. Нарушение образования тромбопластина приводит к снижению потребления про- тромбина в процессе свёртывания крови. В некоторых случаях при тромбоцитопенической пурпуре в период криза отмечают активацию фибринолитической системы и повышение антикоагулянтной активности (антитромбины, гепарин). У всех больных с тромбоцитопенией снижена концентрация серотонина в крови. Эндотелиальные пробы (жгута, щипка, молоточковая, уколочная) в период гематологического криза положительны. В красной крови и лейкограмме (при отсутствии кровопотерь) изменений не находят. При исследовании красного кост- ного мозга обычно находят нормальное или повышенное содержание мегакариоцитов.
Диагностика и дифференциальная диагностика
Диагностика тромбоцитопенической пурпуры основана на характерной клинической картине и лабораторных данных (табл. 15-2).
Тромбоцитопеническую пурпуру необходимо дифференцировать от острого лейкоза, гипоили аплазии красного костного мозга, СКВ, тромбоцитопатий.
Таблица 15-2. Основные диагностические критерии тромбоцитопеничес- кой пурпуры
Клинические | Геморрагии на коже и слизистых оболочках (от петехий до крупных экхимозов) Кровотечения из слизистых оболочек носа, дёсен, матки и др. Положительные эндотелиальные пробы |
Лабораторные | Тромбоцитопения Увеличение времени кровотечения Снижение ретракции кровяного сгустка |
• При гипо- и апластических состояниях при исследовании крови выявляют панцитопению. Пунктат красного костного мозга беден клеточными элементами.
• Бластная метаплазия в красном костном мозге - основной критерий острого лейкоза.
• Тромбоцитопеническая пурпура может быть проявлением диффузных заболеваний соединительной ткани, чаще всего СКВ. В этом случае необходимо опираться на результаты иммунологического исследования. Высокий титр антинуклеарного фактора, наличие АТ к ДНК свидетельствуют о СКВ.
• Основное отличие тромбоцитопенической пурпуры от тромбоцитопатий - снижение содержания тромбоцитов.
Лечение
В период геморрагического криза ребёнку показан постельный режим с постепенным его расширением по мере угасания геморра- гических явлений. Патогенетическая терапия аутоиммунной тромбоцитопенической пурпуры включает назначение глюкокортикоидов, иммуноглобулина, выполнение спленэктомии и использование иммунодепрессантов.
• Преднизолон назначают в дозе 2 мг/кг/сут на 2-3 нед с последующим снижением дозы и полной отменой препарата. При усилении геморрагического синдрома в период указанного лечения доза преднизолона может быть повышена до 3 мг/кг/сут на короткое время (до 3 дней) с последующим возвратом к исходной дозе 2 мг/ кг/сут. При резко выраженном геморрагическом синдроме, угрозе кровоизлияния в мозг возможна «пульс-терапия» метилпреднизолоном (20 мг/кг/сут внутривенно в течение 3 дней). В большинстве случаев эта терапия вполне эффективна. Вначале исчезает геморрагический синдром, затем начинает увеличиваться содержание тромбоцитов. У некоторых больных после отмены глюкокортикоидов наступает рецидив.
• В настоящее время в лечении тромбоцитопенической пурпуры с хорошим эффектом используют внутривенное введение иммуноглобулина человеческого нормального в дозе 0,4 или 1 г/кг в течение 5 или 2 дней соответственно (курсовая доза 2 г/кг) как монотерапию или в сочетании с глюкокортикоидами.
• Спленэктомию или тромбоэмболизацию сосудов селезёнки проводят при отсутствии или нестойкости эффекта от консервативного лечения, повторяющихся обильных длительных кровотечениях, приводящих к выраженной постгеморрагической анемии, тяжёлых кровотечениях, угрожающих жизни больного. Операцию обычно выполняют на фоне глюкокортикоидной терапии у детей старше 5 лет, так как в более раннем возрасте велик риск развития постспленэктомического сепсиса. У 70-80% больных операция приводит к практическому выздоровлению. Остальные дети и после спленэктомии нуждаются в продолжении лечения.
• Иммунодепрессанты (цитостатики) для лечения тромбоцитопенической пурпуры у детей используют лишь при отсутствии эффекта от других видов терапии, так как эффективность их применения значительно меньше, чем у спленэктомии. Применяют винкристин в дозе 1,5-2 мг/м2 поверхности тела внутрь, циклофосфамид в дозе 10 мг/кг - 5-10 инъекций, азатиоприн в дозе 2-3 мг/кг/сут в 2- 3 приёма в течение 1-2 мес.
В последнее время для лечения тромбоцитопенической пурпуры применяют также даназол (синтетический препарат андрогенного действия), препараты интерферона («Реаферон», «Интрон-А», «Роферон-А»), анти-D-Ig (анти-D). Однако положительный эффект от их применения нестойкий, возможны побочные действия, что делает необходимым дальнейшее изучение механизма их действия и определения их места в комплексной терапии данного заболевания.
Для уменьшения выраженности геморрагического синдрома в период повышенной кровоточивости назначают препараты, улучшающие адгезивно-агрегационные свойства тромбоцитов и обладающие ангиопротективным действием - аминокапроновую кислоту (противопоказана при гематурии), этамзилат, аминометилбензойную кислоту. Для остановки носовых кровотечений используют тампоны с перекисью водорода, эпинефрином, аминокапроновой кислотой; гемостатическую губку, фибринную, желатиновую плёнки.
При лечении постгеморрагической анемии у детей с тромбоцитопенической пурпурой применяют средства, стимулирующие кроветворение, так как регенераторные способности кроветворной системы при этом заболевании не нарушаются. Переливание отмытых эритроцитов, подобранных индивидуально, проводят только при выраженной острой анемии.
Профилактика
Первичная профилактика не разработана. Вторичная профилактика сводится к предупреждению рецидивов заболевания. При вакцинации детей с тромбоцитопенической пурпурой необходимы индивидуальный подход и особая осторожность. Школьников освобождают от занятий физкультурой; им следует избегать инсоляции. С целью профилактики геморрагического синдрома больным не следует назначать препараты, тормозящие агрегацию тромбоцитов (например, салицилаты, индометацин, барбитураты, кофеин, карбенициллин, нитрофураны и др.). После выписки из стационара дети подлежат диспансерному наблюдению в течение 5 лет. Показано исследование крови с подсчётом содержания тромбоцитов 1 раз в 7 дней, в дальнейшем (при сохранении ремиссии) ежемесячно. Обязательно исследование крови после каждого перенесённого заболевания.
Прогноз
Исходом тромбоцитопенической пурпуры могут быть выздоровление, клиническая ремиссия без нормализации лабораторных пока- зателей, хроническое рецидивирующее течение с геморрагическими кризами и в редких случаях - летальный исход в результате кровоизлияния в головной мозг (1-2%). При современных методах лечения прогноз для жизни в большинстве случаев благоприятный.
ТРОМБАСТЕНИЯ ГЛЯНЦМАННА
Тромбастения Глянцманна - наследственное заболевание, характеризующееся качественной неполноценностью тромбоцитов при нормальном их содержании и проявляющееся кровоточивостью синячкового типа.
Этиология и патогенез. Выявлено два типа болезни Глянцманна: тип А (9ΐ или ρ) и тип B (9ΐ). Развитие заболевания связано с аномалиями гликопротеина IIb/IIIa и снижением активности глицеральдегидгофосфат дегидрогеназы и пируваткиназы в тромбоцитах, что приводит к недостаточности ретракции тромба, нарушению морфологии тромбоцитов, снижению способности тромбоцитов к адгезии, нарушению агрегации тромбоцитов; время свёртывания крови и содержание тромбоцитов нормальные.
Клиническая картина тромбастении Глянцманна аналогична тром- боцитопенической пурпуре. Заболевание проявляется кровоточивостью различной степени выраженности.
Диагностика основана на клинических и лабораторных данных. Для тромбастении Глянцманна характерны:
• наличие повышенной кровоточивости у родственников;
• синячковый тип кровоточивости;
• нормальное содержание тромбоцитов;
• положительные эндотелиальные пробы;
• увеличение длительности кровотечения;
• снижение ретракции кровяного сгустка;
• снижение или отсутствие агрегации тромбоцитов с аденозиндифосфатом, коллагеном, адреналином.
Лечение. При лечении тромбастении Глянцманна используют пре- параты, улучшающие адгезивно-агрегационные свойства тромбоцитов: аминокапроновую кислоту, этамзилат; метаболические средства [например, трифосаденин (АТФ), препараты магния]. Кроме того, назначают кальция хлорид, аскорбиновую кислоту+рутозид, местные гемостатические средства.
Профилактика. Для профилактики кровоточивости рекомендуют повторные курсы трифосаденина (АТФ) и препаратов магния через 2-3 мес. Следует избегать назначения лекарственных средств, ухудшающих адгезивно-агрегационную способность тромбоцитов, а также физиотерапевтических процедур (УФО, УВЧ), которые могут оказывать на них повреждающее действие.
Прогноз. Заболевание неизлечимо, однако с возрастом кровоточи- вость может уменьшаться.
ГЕМОФИЛИИ
Гемофилия - наследственное заболевание, обусловленное дефицитом плазменных факторов свёртывания VIII (гемофилия А) или IX (гемофилия В) и характеризующееся кровоточивостью гематомного типа. Распространённость гемофилии составляет 13-14 случаев на 100 000 лиц мужского пола.
Этиология и патогенез
В зависимости от дефицита факторов свёртывающей системы крови выделяют два вида гемофилии: гемофилия А, характеризующаяся дефицитом антигемофильного глобулина - фактора VIII; гемофилия В, сопровождающаяся нарушением свёртывания крови вследствие не- достаточности компонента тромбопластина плазмы - фактора IX. Гемофилия А встречается в 5 раз чаще, чем гемофилия В.
Гемофилией А и В (К, рецессив) болеют в основном мужчины. Патологическая хромосома Х с геном гемофилии передаётся от больного отца дочерям. Они являются носительницами гена гемофилии, передавая заболевание половине сыновей, наследующих изменённую хромосому Х, а 50% их дочерей будут носителями (кондукторами) гена гемофилии.
Причиной кровоточивости при гемофилии является нарушение первой фазы свёртывания крови - образование тромбопластина в связи
с наследственным дефицитом антигемофильных факторов (VIII, IX). Время свёртывания крови при гемофилии увеличено, иногда кровь больных не сворачивается в течение нескольких часов.
Клиническая картина
Гемофилия может проявиться в любом возрасте. Самыми ранними признаками заболевания могут быть кровотечения из перевязанной пуповины у новорождённых, кефалогематома, кровоизлияния под кожу. На первом году жизни у детей, страдающих гемофилией, кровотечение может возникнуть во время прорезывания зубов. Заболевание чаще выявляют после года, когда ребёнок начинает ходить, становится более активным, в связи с чем возрастает риск травматизации. Гемофилии свойствен гематомный тип кровоточивости, для которого характерны гемартрозы, гематомы, отсроченные (поздние) кровотечения.
• Типичный симптом гемофилии - кровоизлияния в суставы (гемартрозы), очень болезненные, нередко сопровождающиеся высокой лихорадкой. Чаще страдают коленные, локтевые, голеностопные суставы; реже плечевые, тазобедренные и мелкие суставы кистей и стоп. После первых кровоизлияний кровь в синовиальной полости постепенно рассасывается, функция сустава восстанавливается. Повторные кровоизлияния в суставы приводят к развитию анкилоза. Кроме гемартрозов, при гемофилии возможны кровоизлияния в костную ткань с развитием асептических некрозов, декальцинации костей.
• Для гемофилии характерны гематомы - глубокие межмышечные кровоизлияния. Рассасывание их происходит медленно. Излившаяся кровь долгое время остаётся жидкой, поэтому легко проникает в ткани и вдоль фасций. Гематомы могут быть настолько значительными, что сдавливают периферические нервные стволы или крупные артерии, вызывая параличи и гангрены. При этом возникают интенсивные боли.
• Гемофилии свойственны продолжительные кровотечения из слизистых оболочек носа, дёсен, полости рта, реже ЖКТ, почек. К тяжёлым кровотечениям могут привести любые медицинские манипуляции, особенно внутримышечные инъекции. К длительным кровотечениям приводят экстракция зуба и тонзиллэктомия. Возможны кровоизлияния в головной мозг и мозговые оболочки, приводящие к летальному исходу или тяжёлым поражениям ЦНС.
• Особенность геморрагического синдрома при гемофилии - отсроченный, поздний характер кровотечений. Обычно они возникают не сразу после травмы, а спустя некоторое время, иногда через 6-12 ч и более, в зависимости от интенсивности травмы и тяжести забо-
левания, так как первичную остановку кровотечения осуществляют
тромбоциты, содержание которых не изменено.
Степень недостаточности антигемофильных факторов подвержена колебаниям, что обусловливает периодичность в проявлениях кровоточивости. Тяжесть геморрагических проявлений при гемофилии связана с концентрацией антигемофильных факторов (табл. 15-3).
Таблица 15-3. Формы гемофилии в зависимости от концентрации антиге-

Диагностика и дифференциальная диагностика
Диагностика гемофилии основана на семейном анамнезе, клинической картине и данных лабораторных исследований, среди которых ведущее значение имеют следующие изменения.
• Увеличение длительности свёртывания капиллярной и венозной крови.
• Замедление времени рекальцификации.
• Увеличение активированного частичного тромбопластинового времени (АЧТВ).
• Нарушение образования тромбопластина.
• Снижение потребления протромбина.
• Уменьшение концентрации одного из антигемофильных факторов
(VIII, IX).
Продолжительность кровотечения и содержание тромбоцитов при гемофилии нормальны, пробы жгута, щипка и другие эндотелиальные пробы отрицательны. Картина периферической крови не имеет характерных изменений, за исключением более или менее выраженной анемии в связи с кровотечением.
Гемофилию дифференцируют с болезнью фон Виллебранда, тромбастенией Глянцманна, тромбоцитопенической пурпурой (см. соответствующие разделы).
Лечение
Основной метод лечения - пожизненная заместительная терапия. В настоящее время могут быть использованы 3 метода лечения больных гемофилией: профилактический, лечение на дому, лечение по факту кровотечения.
Профилактический метод - поддержание активности дефецитного фактора на уровне приблизительно 5%, что позволяет упредить кровоизлияния в суставы и инвалидизацию больного. Используют концентраты антигемофильного глобулина высокой степени очистки. При гемофилии А препараты вводят 3 раза в неделю; при гемофилии В - 2 раза (соответственно периоду полувыведения антигемофильного глобулина). Этот метод позволяет полностью социально адаптировать больных, но является дорогостоящим, что ограничивает его использование.
Лечение на дому предполагает немедленное введение антигемофильного препарата сразу после травмы или при малейших признаках начинающегося кровоизлияния, что позволяет остановить кровотечение на раннем этапе, предотвратить образование гематом, гемартрозов. Этот метод требует обучения родителей методике использования антигемофильного глобулина.
Лечение по факту возникновения кровотечения. Используются анти- гемофильные препараты, дозы которых зависят от характера кровотечения.
В настоящее время на российском рынке существует достаточное количество концентратов антигемофильных препаратов. При гемофи- лии А можно использовать «Иммунат», «Эмоклот Д.И.», «Гемофил М», при гемофилии В - «Иммунин», «Аймарикс Д.И.», «Октанайн».
Все антигемофильные препараты вводят внутривенно струйно, сразу же после их расконсервирования. Учитывая период полураспада фактора VIII (8-12 ч), антигемофильные препараты при гемофилии А вводят 2 раза в сутки, а при гемофилии В (период полураспада фактора IX - 18-24 ч) - 1 раз в сутки.
При кровоизлияниях в сустав в острый период необходимы полный покой, кратковременная (3-5 дней) иммобилизация конечности в физиологическом положении. При массивном кровоизлиянии рекомендуют незамедлительно провести пункцию сустава с аспирацией крови и введение в полость сустава гидрокортизона. В дальнейшем показаны лёгкий массаж мышц поражённой конечности, осторожное применение физиотерапевтических процедур и лечебной гимнастики. В случае развития анкилоза показана хирургическая коррекция.
Интенсивная заместительно-трансфузионная терапия у больных гемофилией может привести к изоиммунизации, развитию ингибиторной гемофилии. Появление ингибиторов против факторов VIII и IX свёртывания крови осложняет лечение, поскольку ингибитор нейтрализует вводимый антигемофильный фактор, и обычная заместительная терапия оказывается неэффективной. В этих случаях назначают плазмаферез, иммунодепрессанты. Однако положительный эффект возникает не у всех больных. К осложнениям гемостатической терапии при
использовании криопреципитата и других средств также относят инфицирование ВИЧ-инфекцией, гепатитами с парентеральным путём передачи, цитомегаловирусной и герпетической инфекцией.
Профилактика
Заболевание неизлечимо; первичная профилактика невозможна. Большое значение имеет профилактика кровотечений. Следует избегать внутримышечного введения лекарственных средств из-за опасности возникновения гематом. Лекарственные препараты целесообразно назначать перорально или вводить внутривенно. Ребёнок с гемофилией должен посещать стоматолога каждые 3 мес, чтобы предупредить возможную экстракцию зуба. Родителей больного гемофилией необходимо ознакомить с особенностями ухода за детьми с этим заболеванием и принципами оказания им первой помощи. Поскольку больной гемофилией не сможет заниматься физической работой, родители должны развивать у него склонность к интеллектуальному труду.
Прогноз
Прогноз зависит от степени тяжести заболевания, своевременности и адекватности терапии.
БОЛЕЗНЬ ФОН ВИЛЛЕБРАНДА
Болезнь фон Виллебранда (ангиогемофилия) - наследственное заболевание (I тип - 9ΐ, II и III типы - ρ), характеризующееся синдромом кровоточивости смешанного (синячково-гематомного) типа.
Этиология и патогенез. Болезнью фон Виллебранда болеют лица обоего пола. Заболевание обусловлено нарушением синтеза плазменно-белкового комплекса VIII фактора свёртывания крови (фактора фон Виллебранда), что приводит к патологии агрегации тромбоцитов. Различают несколько типов болезни фон Виллебранда, наиболее тяжело протекает III тип. Фактор фон Виллебранда синтезируется в эндотелиальных клетках и в мегакариоцитах и выполняет двоякую функцию: участвует в каскаде свёртывания крови, обусловливая стабильность VIII фактора, и играет важную роль в сосудисто-тромбоцитарном гемостазе, обеспечивая адгезию тромбоцитов к субэндотелиальным структурам повреждённого сосуда и способствуя агрегации тромбоцитов.
Клиническая картина. Первые проявления заболевания при тяжёлом его течении появляются у детей на первом году жизни. Возникают спонтанные кровотечения из слизистых оболочек носа, полости рта, ЖКТ. В пубертатном периоде возможны меноррагии. Часто возникают подкожные кровоизлияния в виде экхимозов, петехий, иногда глубокие гематомы, гемартрозы, что делает сходным это заболевание с
гемофилией и отличает его от тромбастении Глянцманна и тромбоцитопенической пурпуры. Такие операции, как тонзиллэктомия и экстракция зубов, сопровождаются обильными кровотечениями, которые могут приводить к развитию острой постгеморрагической анемии. В отличие от гемофилии, при болезни фон Виллебранда после операций или травм кровотечение начинается сразу же, а не через какое-то время, и после остановки кровотечение не повторяется.
Диагностика. Диагностические критерии болезни фон Виллебранда: семейный анамнез; смешанный тип кровоточивости; увеличение времени кровотечения; снижение концентрации фактора фон Виллебранда и VIII фактора свёртывания крови; адгезивности (ретенции) тромбоцитов и их агрегации под воздействием ристоцитина (ристомицина).
Лечение. При лечении болезни фон Виллебранда используют те же препараты, что и при гемофилии. Можно применять синтетический аналог АДГ - десмопрессин. При возникновении кровотечений (кроме почечных!) используют аминокапроновую кислоту. При меноррагиях показан местранол.
Лимфогранулематоз
Лимфогранулематоз
(болезнь Ходжкина) - заболевание, характеризующееся злокачественной
гиперплазией лимфоидной ткани с образованием в лимфатических узлах и
внутренних органах лимфогранулём. Лимфогранулематоз - наиболее частая
форма лимфом. Заболевание впервые описал английский врач Томас Ходжкин в
Частота лимфогранулематоза составляет 1 случай на 100 000 детского населения. Пик заболеваемости приходится на дошкольный возраст. Мальчики болеют почти в 2 раза чаще, чем девочки.
Этиология и патогенез
Этиология и патогенез полностью не ясны. Заметное повышение заболеваемости в пределах определённого региона и в определённое время указывает, что этиологическая роль может принадлежать виру- сам и факторам окружающей среды. Полагают также, что причиной заболевания может быть вирус Эпстайна-Барр.
Диагноз лимфогранулематоза устанавливают только при обнаружении типичных («диагностических») клеток Березовского-Штернберга. Природа истинно злокачественной клетки (двуядерная гигантская клетка Березовского-Штернберга) оставалась неизвестной до появ- ления данных о возможном происхождении из клеток моноцитарномакрофагальной системы, а не из трансформированных лимфоцитов. Лимфогранулематоз отличает строгое распространение процесса от одной группы лимфатических узлов к другой (уницентрично).
Клиническая картина
Заболевание, как правило, начинается с увеличения одного или нескольких лимфатических узлов, чаще шейной группы (60-80%). Первым нередко замечает это сам больной или его родители. Реже происходит поражение лимфатических узлов других групп (подмышечные, паховые и др.). При прогрессировании заболевания в процесс вовлекаются внутригрудные и внутрибрюшные лимфатические узлы, увеличиваются печень и селезёнка. Постепенно размеры и количество лимфатических узлов возрастают, они образуют конгломерат плотных, безболезненных, не спаянных между собой и с окружающими тканями образований и, по образному выражению А.А. Киселя, напоминают «картошку в мешке». Возможно поражение ткани лёгких, плевры, ЖКТ, костного мозга, костного скелета, нервной системы. Общими проявлениями лимфогранулематоза могут быть лихорадка, ночные поты, потеря массы тела, быстрая утомляемость, сонливость, снижение аппетита, иногда зуд кожи.
Классификация
Международная клиническая классификация лимфогранулематоза выделяет четыре стадии заболевания (табл. 15-4).
Таблица 15-4. Классификация лимфогранулематоза по системе Энн Ар-бор
I стадия (локализованная) | Заболевание ограничено одной группой лимфатических узлов или двумя смежными, расположенными по одну сторону диафрагмы |
II стадия (регионарная) | В процесс вовлечены более двух смежных групп лимфатических узлов или две отдельные их группы по одну сторону диафрагмы |
III стадия (генерализованная) | Поражены лимфатические узлы по обе стороны диафрагмы, но в пределах лимфатической системы (лимфатические узлы, вилочковая железа, селезёнка, лимфатическое глоточное кольцо) |
IV стадия (диссеминированная) | Помимо лимфатической системы в процесс вовлечены внутренние органы: лёгкие, печень, костный мозг, нервная система и др. |
Примечание. Каждая стадия болезни имеет два варианта: А - без интоксикации; В - с интоксикацией.
Лабораторные исследования
В начальной стадии болезни в анализах крови выявляют умеренный нейтрофильный лейкоцитоз, относительную лимфопению, эозинофи-
лию. СОЭ несколько увеличена. По мере прогрессирования заболевания лейкоцитоз сменяется лейкопенией, возможно появление анемии, тромбоцитопении, чему способствует проводимая цитостатическая и лучевая терапия. СОЭ достигает высоких значений. Возможно увеличение концентрации фибриногена, снижение содержания альбуминов, повышение a2-глобулинов.
Диагностика и дифференциальная диагностика
Лимфогранулематоз следует заподозрить при наличии необъяснимой персистирующей лимфаденопатии. Для уточнения диагноза и определения стадии заболевания используют лабораторные, инструментальные, рентгенологические методы обследования. Однако определяющим является гистологическое исследование изменённого лимфатического узла, при котором выявляют специфические гранулёмы, гигантские многоядерные клетки Березовского-Штернберга.
Лимфогранулематоз необходимо дифференцировать с банальным и туберкулёзным лимфаденитом, лейкозом (см. раздел «Острый лей- коз»), метастазом злокачественной опухоли. При внутригрудной форме лимфогранулематоза необходимо исключить туберкулёзный бронхаденит (см. раздел «Туберкулёз» в главе «Хронические инфекции»), саркоидоз, лимфосаркоматоз. При внутрибрюшном варианте следует исключить туберкулёзный мезаденит, злокачественное новообразование брюшной полости.
Лечение
Лечение проводят в специализированных отделениях. Объём лечебных мероприятий зависит от клинической стадии заболевания. В настоящее время предпочтение отдают комбинированной терапии - одновременное использование лучевой и различных схем полихимиотерапии, что даёт возможность улучшить отдалённые результаты. Однако обязательно следует учитывать побочные действия терапии. Лучевая терапия может привести к поражению кожи, внутренних органов (лучевой пульмонит, кардит, пневмосклероз, поздний гипотиреоз, бесплодие и др.). Часто развивается токсическое действие химио- терапевтических препаратов (см. в разделе «Острый лейкоз»).
Прогноз
Прогноз зависит от стадии заболевания на момент начала лечения. Современные методы лечения позволяют добиться длительной ремиссии, а при I и IIA стадии - выздоровления.
Острый лейкоз
Лейкоз
- системное заболевание крови, характеризующееся замещением
нормального костномозгового кроветворения пролиферацией менее
дифференцированных и функционально активных клеток - ранних
предшественников клеток лейкоцитарного ряда. Термин «лейкоз» предложил в
Лейкозы наблюдают с частотой 4-5 случаев на 100 000 детей. В детском возрасте острый лейкоз диагностируют чаще, чем другие онкологические заболевания. Среди всех больных со злокачественными заболеваниями кроветворной и лимфоидной тканей каждый десятый больной - ребёнок. Пик заболеваемости лейкозом у детей приходится на возраст 2-4 года. В связи с наблюдаемой в последние десятилетия тенденцией к росту заболеваемости лейкозом и сохраняющейся высокой летальностью проблема лейкозов у детей стала особенно актуальной для практического здравоохранения.
Этиология и патогенез
Причины возникновения лейкоза изучены не полностью. В настоящее время подтверждены этиологическая роль ионизирующего излучения, химических экзогенных факторов, онкогенных вирусов и значение наследственной предрасположенности к возникновению лейкоза. Сформулированы основные положения мутационной теории и клоновая концепция.
Основные патогенетические звенья - изменение синтеза ДНК клеток, нарушение их дифференцировки и выход процесса из-под контроля регулирующих факторов. Общепризнанна моноклоновая теория развития гемобластозов, как и опухолей вообще. Согласно этой теории, лейкозные клетки представляют собой клон - потомство одной мутировавшей клетки. Клоновая теория патогенеза лейкоза рассматривает заболевание как результат пролиферации неконтролируемого клона клеток, утративших способность к дифференцировке и созреванию, постепенно замещающего другие ростки кроветворения. Известно, что мутации происходят почти непрерывно (в среднем в течение каждого часа мутирует одна клетка). У здоровых людей происходит элиминация изменённых клеток благодаря механизмам иммунной системы, реагирующей на эти клетки как на чужеродные. Следовательно, развитие лейкоза возможно при неблагоприятном сочетании воздействия мутагенных факторов и ослабления защитных сил организма.
Патоморфология
В основе лейкоза лежит гиперпластический опухолевый процесс в кроветворной ткани с очагами лейкемической метаплазии в различ-
ных органах и системах. Наиболее часто патологическое кроветворение возникает там, где оно существовало в эмбриональном периоде: в селезёнке, лимфатических узлах, печени. Изучение бластных клеток показало, что морфологический субстрат при остром лейкозе у разных больных неоднороден. По морфологии опухолевых клеток, а не по длительности болезни, лейкозы делят на острые и хронические
(рис. 15-1).
Клиническая картина
Заболевание чаще начинается исподволь с появления неопределён- ных жалоб на боли в костях и суставах, утомляемость, снижение аппетита, нарушение сна, повышение температуры тела. Реже наблюдают
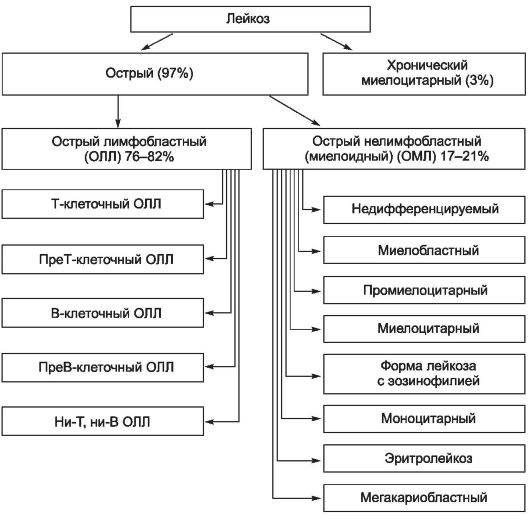
Рис. 15-1. Формы и варианты лейкоза
у детей.
внезапное начало заболевания с выраженной интоксикацией, геморрагическим синдромом.
• Кожные покровы и слизистые оболочки больных бледные, реже желтушные, иногда кожа приобретает землисто-зеленоватый оттенок. Возможны гингивиты и стоматиты (от катаральных до язвеннонекротических), лейкемическая инфильтрация кожи и слизистых оболочек. Нередко отмечают видимое увеличение лимфатических узлов. Они имеют плотноэластическую консистенцию, безболезненны, не спаяны с окружающими тканями. Иногда определяют симптомокомплекс Микулича - симметричное увеличение слёз- ных и слюнных желёз вследствие их лейкемической инфильтрации. В этом случае за счёт одутловатости лица дети внешне напоминают больных с эпидемическим паротитом.
• Геморрагический синдром - один из наиболее ярких и частых признаков острого лейкоза. У больных выявляют кровоизлияния в кожу и слизистые оболочки, кровотечения из носа, дёсен и ЖКТ, гематурию, кровоизлияния в мозг.
• Боли в суставах и костях могут быть обусловлены лейкемической инфильтрацией синовиальной оболочки, появлением надкостничных лейкозных пролифератов, кровоизлияниями в суставную полость.
• Частый симптом острого лейкоза - гепатоспленомегалия. Могут быть кардиоваскулярные расстройства в виде тахикардии, глухости тонов сердца, функциональных шумов; реже отмечают расширение границ сердца. Возможно развитие пневмонии.
• Поражение ЦНС (нейролейкоз) развивается вследствие метастаза бластных клеток в нервную систему. Чаще всего это происходит в начальный период заболевания в связи с тем, что препараты, применяемые для лечения лейкоза, не проникают через ГЭБ. Наиболее часто нейролейкоз обнаруживают у больных на фоне нормальных показателей кроветворения. Клиническая картина нейролейкоза развивается постепенно. Появляются головокружение, головная боль, тошнота, диплопия, боли в позвоночнике и межреберьях. У некоторых детей отмечают резкое увеличение массы тела за короткий отрезок времени, булимию, жажду, что связано с поражением диэнцефальной области. Иногда нейролейкоз выявляют случайно при клиническом обследовании больных.
В течении лейкоза выделяют три стадии (что необходимо для определения лечебной тактики).
• I стадия - дебют заболевания, период от начала клинических проявлений до получения эффекта от проводимой терапии.
• II стадия - ремиссия. Различают полную и неполную ремиссии. При полной клинико-гематологической ремиссии (длительность не
менее 1 мес) клинических проявлений нет, а в миелограмме определяют не более 5% бластных клеток и не более 30% лимфоцитов. Неполная клинико-гематологическая ремиссия сопровождается нормализацией клинических показателей и гемограммы, а в пунктате красного костного мозга сохраняется не более 20% бластных клеток.
• III стадия - рецидив заболевания. Чаще он начинается с появления экстрамедуллярных очагов лейкозной инфильтрации в яичках, нервной системе, лёгких на фоне нормальных показателей гемопоэза. При гематологическом рецидиве многие больные не предъявляют никаких жалоб. У некоторых детей рецидив диагностируют только на основании исследования красного костного мозга. Менее выраженная симптоматика в период рецидива острого лейкоза связана с непрерывным комплексным лечением, сдерживающим развитие заболевания.
Лабораторные исследования
При остром лейкозе у детей в периферической крови обнаруживают бластные клетки, анемию, тромбоцитопению, высокую СОЭ; количество лейкоцитов вариабельно: чаще выявляют лейкоцитоз различной степени, реже лейкопению. Характерным диагностическим критерием служит «лейкемический провал (зияние)» (hiatus leucaemicus) - отсутствие промежуточных форм между бластными и зрелыми клетками. Исследование красного костного мозга обычно проводят после исследования периферической крови. Достоверный диагностический критерий острого лейкоза - обнаружение бластных клеток в стернальном пунктате в количестве более 30% клеточного состава красного костного мозга.
Диагностика
Диагноз острого лейкоза ставят по клиническим данным (интоксикация, резкая бледность, полиадения и гепатоспленомегалия) и результатам исследования крови в динамике. Выявление в гемограмме бластных клеток с наличием «лейкемического зияния» позволяет заподозрить острый лейкоз. Подтверждают диагноз исследованием пунктата красного костного мозга. В тех редких случаях, когда исследование костного мозга не даёт чётких данных для диагностики, необходима трепанобиопсия. Обнаружение диффузной или крупно- очаговой бластной инфильтрации в красном костном мозге при нарушении нормального соотношения ростков кроветворения помогает поставить диагноз.
Для подтверждения диагноза нейролейкоза необходимо исследование ликвора. При этом обнаруживают ликворную гипертензию, плеоцитоз,
непостоянное повышение содержания белка. Вспомогательным диагностическим методом служит исследование глазного дна. Нарастающий отёк дисков зрительного нерва свидетельствует о стойком повышении внутричерепного давления, связанном не только с отёком, но и в ряде случаев с лейкемоидной инфильтрацией головного мозга. При рентгенологическом исследовании черепа обнаруживают уплотнение костной ткани по ходу швов, усиление рисунка пальцевых вдавлений и сосудистого рисунка, остеопороз турецкого седла.
Дифференциальная диагностика
Дифференциальный диагноз лейкоза прежде всего проводят с лейкемоидной реакцией, возникающей в ответ на такие заболевания, как сепсис, тяжёлые формы туберкулёза, коклюш, опухоли и др. В этих случаях в периферической крови обнаруживают гиперлейкоцитоз, но в лейкограмме преобладают зрелые клетки и лишь изредка появляются единичные миелоциты, не бывает «лейкемического зияния». В пунктате красного костного мозга нет выраженного омоложения клеток. Изменения исчезают по мере выздоровления от основного за- болевания.
В дифференциальной диагностике острого лейкоза и агранулоцитоза, гипопластической анемии (см. раздел «Гипо- и апластические анемии» в главе «Анемии»), тромбоцитопенической пурпуры (см. раздел «Тромбоцитопеническая пурпура»), коллагеновых заболеваний, инфекционного мононуклеоза (см. раздел «Инфекция, вызываемая вирусом Эпстайна-Барр» в главе «Герпетическая инфекция») главными критериями должны быть результаты цитологического исследования красного костного мозга.
Лечение
Терапию острого лейкоза проводят только в специализированных гематологических клиниках. Задача современной терапии лей- коза - полная эрадикация (уничтожение) лейкозных клеток. Этого достигают путём использования современных, принципиально новых программ (протоколов) лечения острых лейкозов у детей, включающих применение цитостатиков, глюкокортикоидов, лучевой терапии, трансплантации гемопоэтических стволовых клеток, иммунотерапии. Можно выделить 4 основных направления терапии:
• Специфическая химиотерапия, направленная на достижение и закрепление ремиссии заболевания; состоит из нескольких этапов, различна для лимфобластного и миелобластного лейкозов.
• Сопроводительная поддерживающая терапия, проводимая для снижения интоксикации при лизисе опухолевого субстрата и уменьшения побочных токсических эффектов химиопрепаратов.
• Заместительная терапия, необходимая при угрожающей тромбоцитопении и тяжёлой анемии.
• Трансплантация красного костного мозга и стволовых кроветворных клеток.
Этапы лечения: индукция (достижение) ремиссии, консолидация (закрепление) ремиссии, поддерживающая терапия. Задача своевременной терапии состоит не только в том, чтобы добиться ремиссии, но и в том, чтобы максимально её продлить и увеличить продолжительность жизни больного. Поскольку в период становления ремиссии в организме ребёнка сохраняется большое количество лейкозных клеток, необходима поддерживающая терапия. Однако ни интенсивная, ни поддерживающая терапии у большинства больных не в состоянии сдержать прогрессирование процесса, поэтому оправдана периодическая интенсификация лечения - реиндукция.
В процессе разработки находится новый метод воздействия на лейкозный клон - иммунотерапия, заключающаяся в максимальной мобилизации иммунной системы организма больного с целью устранения иммунологической инертности организма по отношению к лейкозогенному агенту. Используют методы активной иммунотерапии, основанные на введении гуморальных иммунных факторов (плазмы, Ig), и методы адаптивной иммунотерапии, состоящие из введения в организм иммунокомпетентных клеток донора (введение иммунных лимфоцитов, трансплантация красного костного мозга). По характеру методы иммунотерапии могут быть и специфическими, когда для стимуляции иммунного ответа применяют другие Аг, например вакцину БЦЖ и противооспенную вакцину. Рациональные схемы иммунотерапии пока ещё отрабатываются.
Успех лечения острого лейкоза зависит как от назначения специфической терапии, так и мероприятий по профилактике и терапии осложнений, обусловленных различными (преимущественно инфекционными) заболеваниями и побочными эффектами цитостатиков. В период лечения у больных возможны тошнота, рвота, анорексия. Самое грозное осложнение цитостатической терапии - угнетение костномозгового кроветворения, вследствие чего у больных развиваются такие инфекционные осложнения, как пневмония, энтеропатия, язвенно-некротический стоматит, гнойный отит и др. В этот период необходимо проводить интенсивную заместительную терапию, применять антибиотики широкого спектра действия. При глубокой миелодепрессии с целью профилактики инфекционных осложнений больного помещают в отдельную палату или бокс, где создают условия, максимально приближенные к стерильным. Персонал соблюдает те же правила асептики и антисептики, что и в операционных блоках.
Лечение больных острым лейкозом представляет значительные трудности: оно всегда длительное, нередко чревато тяжёлыми осложнениями. В связи с этим лечение необходимо проводить в специализированных отделениях при полном взаимопонимании врача и родителей больного ребёнка. Достижения последних лет в лечении острого лейкоза позволяют существенно продлить жизнь ребёнка, а у отдельных больных - добиться полного выздоровления.
Профилактика
Первичная профилактика острого лейкоза ещё не разработана. При достижении ремиссии необходима поддерживающая и противореци- дивная терапия. Ребёнок подлежит наблюдению педиатра и онкогематолога. Необходим чёткий контроль за показателями крови. Не рекомендуют проводить физиотерапевтические процедуры и изменять климатические условия. Профилактические прививки проводят с учё- том эпидемической ситуации по индивидуальному календарю.