Детские болезни: учебник / Под ред. А.А. Баранова - 2-е изд., - 2009. - 1008 с.
|
|
|
|
ГЛАВА 5 БОЛЕЗНИ НОВОРОЖДЁННЫХ
ПЕРИНАТАЛЬНЫЕ ПОРАЖЕНИЯ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
Перинатальное поражение ЦНС - группа патологических состояний, обусловленных воздействием на нервную систему плода или новорождённого неблагоприятных факторов в антенатальном периоде, начиная с 28 нед, во время родов и в первые 7 дней после рождения.
До недавнего времени применяли термины «перинатальная энцефалопатия», «нарушение мозгового кровообращения», «церебральная дисфункция», «гипоксически-ишемическая энцефалопатия» и др. Отсутствие единой терминологии было связано с однотипностью клинической картины, развивающейся при различных механизмах поражения головного мозга. Причина этого - незрелость нервной ткани новорождённого и склонность к генерализованным отёчно-геморрагическим и ишемическим процессам в ЦНС, сопровождающимся общемозговыми симптомами.
Классификация
Классификация перинатальных поражений нервной системы представлена в табл. 5-1. В течении перинатальных поражений нервной системы традиционно выделяют следующие периоды: острый (7- 10 дней, у глубоконедоношенных иногда до 1 мес), ранний восстановительный (до 4-6 мес), поздний восстановительный (до 1-2 лет) и остаточных явлений.
Этиология и патогенез
Основная причина повреждения головного мозга у плода и новорождённого - внутриутробная гипоксия, развивающаяся при отяго- щённом соматическом и акушерско-гинекологическом анамнезе женщины, неблагополучном течении беременности. Другие повреждения (травматические, метаболические, инфекционные), как правило, вторичны. Их развитию чаще всего способствует хроническая гипоксия
Таблица 5-1. Классификация перинатальных поражений нервной системы (Российская ассоциация специалистов перинатальной медицины, 2000; фрагмент)
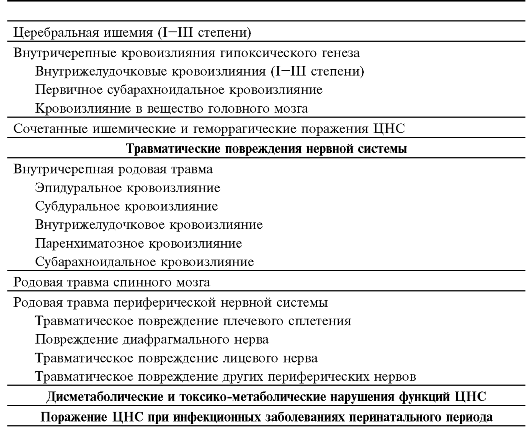
плода. Основная причина повреждения периферической нервной системы и спинного мозга - травмирующие плод акушерские пособия при большой массе плода, неправильном вставлении головки, тазовом предлежании, чрезмерных поворотах головки при её выведении, тракции за головку и т.д.
Пусковой механизм повреждения при гипоксических поражениях ЦНС - дефицит кислорода, а непосредственные повреждающие мозг факторы - продукты клеточного метаболизма. Дисметаболические и токсико-метаболические нарушения (гипогликемия, гипомагниемия, гипокальциемия, гипонатриемия, гипермагниемия, гипернатриемия) чаще всего присоединяются к гипоксическому поражению ЦНС. Инфекционная патология перинатального периода, как правило, вызываемая персистирующей микробной флорой, также возникает при транзиторном иммунодефиците беременной и плода вследствие ги-
поксии. Травматические повреждения нервной системы развиваются, как правило, в родах и связаны прежде всего с механическим фактором.
Клиническая картина
Клиническая картина зависит от нозологической формы перинатального поражения ЦНС, периода заболевания и степени его тяжести. Основные синдромы перинатальных поражений головного мозга
• В острый период: синдром угнетения ЦНС (вялость, гиподинамия, гипорефлексия, диффузная мышечная гипотония и т.д.), реже наблюдают синдром гипервозбудимости ЦНС (усиление спонтанной мышечной активности, поверхностный беспокойный сон, тремор подбородка и конечностей и т.д.), судорожный синдром, гипертензионный синдром.
• В ранний восстановительный период выраженность общемозговых симптомов уменьшается и становятся очевидными признаки очагового поражения головного мозга. Основные синдромы раннего восстановительного периода следующие.
- Синдром двигательных нарушений проявляется мышечной гипо-, гиперили дистонией, парезами и параличами, гиперкинезами.
- Гипертензионно-гидроцефальный синдром (рис. 5-1 на вклейке) проявляется увеличением окружности головы, расхождением швов, увеличением и выбуханием родничков, расширением венозной сети на лбу, висках, волосистой части головы, преобладанием размеров мозгового черепа над лицевым.
- Для вегето-висцерального синдрома характерны нарушения микроциркуляции (мраморность и бледность кожных покровов, преходящий акроцианоз, холодные кисти и стопы), расстройства терморегуляции, желудочно-кишечные дискинезии (срыгивание, неустойчивый стул, метеоризм и др.), лабильность сердечно-сосудистой и дыхательной систем (тахикардия, реже брадикардия, нарушения ритма дыхания и др.) и т.д.
В позднем восстановительном периоде постепенно происходит нормализация мышечного тонуса, статических функций. Полнота восстановления зависит от степени поражения ЦНС в перинатальный период. Детей в периоде остаточных явлений можно разделить на две группы: первая - с явными психоневрологическими расстройствами (около 20%), вторая - с нормализацией неврологических изменений (около 80%). Тем не менее нормализация неврологического статуса не может быть равноценна выздоровлению.
Дополнительные исследования: наибольшее значение для диагностики перинатальных поражений ЦНС имеют нейросонография, МРТ и КТ, допплерография сосудов головного мозга, ЭЭГ.
Клинические характеристики основных форм перинатальных поражений ЦНС
• Церебральная ишемия
- I степень: преходящие симптомы дисфункции ЦНС (у доношенных чаще наблюдают синдром гипервозбудимости, у недоношенных - синдром угнетения). Симптоматика исчезает через 5-7 сут. При лабораторных исследованиях выявляют умеренные метаболические нарушения (снижение paO2, повышение paCO2, ацидоз). Нейросонография, КТ, МРТ какой-либо патологии не выявляют.
- II степень: синдром угнетения/возбуждения ЦНС продолжительностью более 7 сут, могут быть однократные или повторные судороги, вегетативно-висцеральные нарушения, гипертензионный синдром. Метаболические расстройства более выраженные и стойкие, чем при церебральной ишемии I степени. При нейросонографии обнаруживают локальные гиперэхогенные очаги в паренхиме головного мозга, при КТ/МРТ - локальные кортикальные или субкортикальные патологические очаги.
- III степень: выраженный синдром угнетения ЦНС (вплоть до комы) свыше 10 дней, повторные судороги, возможен эпилептический статус, дисфункция стволовых отделов мозга (нарушения ритма дыхания, зрачковых реакций, глазодвигательные расстройства), поза декортикации или децеребрации, выраженные вегетативно-висцеральные нарушения, прогрессирующий синдром внутричерепной гипертензии, стойкие метаболические нарушения. При нейросонографии выявляют диффузное повышение эхогенности паренхимы головного мозга, при КТ или МРТ - множественные кортикальные или субкортикальные патологические очаги.
• Внутрижелудочковые кровоизлияния чаще наблюдают у недоношенных. В лёгких случаях (I степень) симптоматика отсутствует. При II степени течение может быть катастрофическим или волнообразным. В первом случае кратковременный период возбуждения быстро сменяется глубоким угнетением ЦНС (сопор, кома), которое сопровождается апноэ, тоническими судорогами, глазодвигательными расстройствами, брадиаритмией, нарушением терморегуляции. Во втором случае начало постепенное, симптоматика развивается в течение нескольких часов/суток, наблюдают постепенное нарушение сознания или чередование периодов возбужде- ния/угнетения, снижение двигательной активности, мышечную гипотонию, судороги. Неврологические расстройства сопровождаются колебаниями, а затем падением АД, снижением гематокрита и концентрации Hb в крови, выраженными метаболическими нарушениями (снижение paO2, повышение paCO2, ацидоз, гипокальциемия,
колебания концентрации глюкозы в крови). Диагноз внутрижелудочкового кровоизлияния подтверждают с помощью нейросонографии. По результатам последней выделяют 4 степени кровоизлияния (I - изолированное субэпендимальное кровоизлияние, II - кровоизлияние в желудочки головного мозга без изменения их размеров, III - кровоизлияние в желудочки головного мозга в сочетании с их расширением, IV - кровоизлияние в паренхиму и желудочки головного мозга).
• Сочетанные ишемические и геморрагические поражения ЦНС наблюдают значительно чаще изолированных форм. Клиническая картина зависит от преобладающего типа поражения (ишемия или кровоизлияние), его локализации и выраженности.
• При травматическом поражении спинного мозга в зависимости от тяжести и локализации повреждения выделяют 3 варианта клинического течения.
- Катастрофический (при повреждении на краниоспинальном уровне): мертворождение или летальный исход в первые часы после рождения на фоне прогрессирующих дыхательных и сердечно-сосудистых расстройств.
- Тяжёлый (поражение средне- и нижнешейного, верхнегрудного уровня): характеризуется развитием спинального шока (адинамия, мышечная атония с арефлексией; продолжительность до нескольких недель), нарушениями чувствительности ниже области поражения, диафрагмальным дыханием с «парадоксальными» дыхательными движениями. Возможен парез кишечника и мочевого пузыря. При поражении на уровне C8-Tt развивается синдром Бернара-Хорнера.
- Среднетяжёлый: продолжительность спинального шока меньше, двигательные и рефлекторные нарушения менее выраженные.
• Неврологическая симптоматика сопровождается снижением АД, брадикардией, гипотермией, метаболическими расстройствами, связанными с тяжёлой дыхательной недостаточностью (ацидоз, снижение paO2, повышение paCO2 и др.).
Диагностика и дифференциальная диагностика
Диагностика перинатальных поражений ЦНС основана на данных анамнеза (социально-биологических факторах, состоянии здоровья матери, её акушерско-гинекологическом анамнезе, течении беременности и родов) и результатах клинического обследования, подтверж- дённых инструментальными методами.
Перинатальные поражения ЦНС дифференцируют с врождёнными пороками развития, наследственными нарушениями обмена веществ, чаще аминокислот (обычно проявляются через несколько месяцев
после рождения), рахитом [быстрое нарастание окружности головы в первые месяцы жизни, мышечная гипотония, вегетативные нару- шения (потливость, мраморность, беспокойство) связаны чаще не с началом рахита, а с гипертензионно-гидроцефальным синдромом и вегетативно-висцеральными нарушениями при перинатальной энце- фалопатии].
Лечение
Принципы лечения при гипоксических поражения ЦНС в остром периоде (после проведения реанимационных мероприятий).
• Ликвидация отёка мозга - проведение дегидратации (маннитол, дексаметазон и др.).
• Ликвидация и/или профилактика судорожного синдрома с помощью фенобарбитала, фенитоина, диазепама, вальпроевой кислоты.
• Нормализация метаболизма нервной ткани и повышение её устойчивости к гипоксии (растворы глюкозы, аскорбиновая кислота, калия и магния аспарагинат, левокарнитин, препараты магния и др.).
• Восстановление функции лёгких, сердца, почек.
• Создание щадящего режима.
В восстановительном периоде лечение направлено на стимуляцию роста капилляров мозга, улучшение трофики повреждённых тканей.
• Лекарственная терапия:
- дегидратационная терапия - ацетазоламид;
- ноотропные препараты и корректоры метаболизма - монофостиамин и пиридоксин (по 10-15 инъекций, чередуя их), «Церебролизин», пирацетам, гамма-амино-бета-фенилмасляной кислоты гидрохлорид, гопантеновая кислота, пиритинол, ацетиламиноянтарная кислота, гамма-аминомасляная кислота, гаммаоксимасляной кислоты кальциевая соль, гексобендин+этамиван +этофиллин, полипептиды коры головного мозга скота, левокарнитин, «Актовегин» и др.;
- ангиопротекторы: винпоцетин, циннаризин, пентоксифиллин, гинкго билоба листьев экстракт, ницерголин, гексобендин+этами- ван+этофиллин, «Актовегин».
• Лечебная физкультура (ЛФК) и массаж.
Профилактика
За счёт высокой пластичности развивающегося головного и спинного мозга у новорождённых существует большой резерв для вос- становления поврежденной ЦНС. Основная задача предупреждения перинатального поражения ЦНС - профилактика внутриутробной гипоксии, заключающаяся в своевременном выявлении и коррекции неблагоприятных социально-биологических факторов, лечении хро-
нических заболеваний, выявлении ранних признаков патологического течения беременности. Профилактику гипоксии и интранатального травматизма следует продолжать и во время родов. Здоровье новорож- дённого на 90% определяется внутриутробным развитием и на 10% зависит от течения родов.
Прогноз
Прогноз при перинатальных поражениях ЦНС зависит от тяжести и характера повреждения ЦНС, полноты и своевременности лечебных мероприятий. Тяжёлая асфиксия и внутримозговые кровоизлияния нередко заканчиваются летально. Тяжёлые последствия в виде грубых нарушений психомоторного развития (органические формы нарушения психического развития, детский церебральный паралич), гидроцефалии, симптоматической эпилепсии формируются относительно редко (у 3-5% доношенных и у 10-20% глубоконедоношенных детей). Тем не менее практически у всех детей с перинатальным поражением головного мозга, даже лёгкой степени, длительно сохраняются признаки минимальной мозговой дисфункции - головные боли, рече- вые расстройства, тики, нарушение координации тонких движений. Для них характерна повышенная нервно-психическая истощаемость, «школьная дезадаптация», в части случаев развивается синдром дефицита внимания с гиперактивностью.
Последствия травмы спинного мозга в родах зависят от локализации и тяжести повреждения. При массивных кровоизлияниях новорождённые умирают в первые дни жизни. У выживших после острого периода постепенно формируются те или иные двигательные нарушения - нижний спастический парапарез (локализация повреждения ниже шейного утолщения), спастический тетрапарез (локализация повреждения выше шейного утолщения), нижний спастический парапарез и вялый верхний парез (локализация повреждения на уровне шейного утолщения).
ВНУТРИУТРОБНЫЕ ИНФЕКЦИИ. СЕПСИС Внутриутробные инфекции
Внутриутробная инфекция (ВУИ) - болезнь плода или новорож- дённого, возникшая вследствие его антеили интранатального зара- жения возбудителем какого-либо инфекционного заболевания.
В настоящее время адекватные статистические данные по ВУИ отсутствуют. Однако существуют отдельные исследования, косвенно свидетельствующие о значительной распространённости ВУИ. Так, в среднем у 33% женщин детородного возраста и у 60-80% пациен-
ток, относимых к группе высокого риска, в слизи из цервикального канала обнаруживают цитомегаловирус и вирус простого герпеса. Нормальную влагалищную микрофлору выявляют менее чем у 50% беременных. Считают, что привычное невынашивание в подавляющем большинстве случаев обусловлено ВУИ. Предполагают, что 50% случаев перинатального поражения ЦНС, а в тяжёлых случаях более 90% - инфекционного генеза. В последнее десятилетие прослеживается отчётливая тенденция к увеличению доли ВУИ в структуре пери- натальной смертности (главным образом за счёт улучшения диагностики). Частота инфицирования в определённой степени зависит от эпидемиологической ситуации и особенно высока среди групп населения с низким социальным статусом.
Этиология и патогенез
Чаще всего ВУИ вызывает смешанная вирусная (до 80%) и вирусно-бактериальная микрофлора. Также возможно внутриутробное заражение протозойными заболеваниями (токсоплазмозом, малярией).
• Антенатальное инфицирование плода чаще всего происходит трансплацентарно, реже через инфицированные околоплодные воды.
- Трансплацентарным путём происходит инфицирование цитомегаловирусом, вирусами простого герпеса 1 и 2 типов, краснухи, гепатита В и С, ВИЧ. Среди вирусных ассоциаций преобладают энтеровирусы Коксаки В или вирусы гриппа А либо С в сочетании с вирусами простого герпеса или цитомегаловирусом. Считают, что при тяжёлом поражении плода в его инфицировании участвует не менее трёх разных вирусов. Для большинства бактерий и простейших плацентарный барьер непроницаем; однако инфицирование может возникать при повреждении плаценты и формировании хронической фетоплацентарной недостаточности.
- Инфицирование околоплодных вод происходит восходящим (при локализации патологического процесса во влагалище или шейке матки), нисходящим (при проникновении возбудителя из брюшной полости через маточные трубы) и контактным (при воспалительном процессе в матке и плаценте) путём. В подобных случаях возможно инфицирование не только вирусами, но и грибами, бактериями (главным образом условно-патогенными), микоплазмами, хламидиями. Наиболее тяжёлые, септические формы ВУИ развиваются при заражении плаценты контактным путём от инфицированных околоплодных вод.
• Интранатальное заражение характерно для герпетической (главным образом, вирус простого герпеса 2 типа), микоплазменной и хламидийной инфекций. Однако возможно и интранатальное заражение
бактериями. В этом случае возбудителями ВУИ чаще бывают представители условно-патогенной грамотрицательной микрофлоры (кишечная и синегнойная палочки, клебсиелла, протей), стафилококки и стрептококки группы В.
Риск ВУИ связан не столько с острыми инфекционными заболеваниями во время беременности, сколько с наличием у будущей матери хронической патологии и различных осложнений беременности. ВУИ, как правило, вызывает персистирующая микрофлора, которая чаще всего отражает иммунологическое неблагополучие. Заболевание развивается на фоне иммунодефицита, который может быть генетически детерминированным, но чаще транзиторным, формированию последнего способствует гипоксия плода.
Клиническая картина
Клиническая картина ВУИ существенно зависит от времени и пути инфицирования (табл. 5-2).
• В первые 8-10 нед внутриутробного развития возможна только альтеративная фаза воспаления, процесс заканчивается либо гибелью эмбриона, либо формированием врождённых пороков развития.
• Позже начинает проявляться и пролиферативный компонент воспаления с исходом в фиброзно-склеротические деформации органов.
• При инфицировании плода после 28 нед участвуют три компонента воспаления - альтеративный, пролиферативный и сосудистый. Процесс формирования мозга плода продолжается в течение всей беременности, поэтому врождённые пороки развития и поражения ЦНС регистрируют значительно чаще, чем патологию других органов. Так как клинические проявления ВУИ в основном носят неспецифический характер, в большинстве случаев выставляют диагноз «перинатальная энцефалопатия» или «нарушение мозгового кровообращения».
Диагностика
Методы диагностики ВУИ можно подразделить на две группы: прямые и непрямые. Прямые методы
Прямые методы исследования направлены на выявление возбудителя или его Аг в организме больного ребёнка.
• Микроскопический (бактериоскопический) метод.
• Вирусологический метод наиболее точен, это «золотой стандарт» диагностики. Но его редко используют из-за дороговизны и длительности исследования.
• Молекулярно-биологический метод. Наибольшее распространение получила полимеразная цепная реакция (ПЦР), позволяющая обнаружить минимальное количество ДНК возбудителя. Результаты
Таблица 5-2. Клиническая картина ВУИ в зависимости от периода инфи- цирования

• оценивают в сопоставлении с данными других лабораторных методов и клиническими проявлениями. Для решения вопроса об активности процесса и эффективности лечения используют сочетание ПЦР и серологического метода, а также параллельно исследуют сыворотки крови ребёнка и матери в динамике (нарастание титра АТ при методе парных сывороток). С помощью иммуноферментного анализа (ИФА) и реакции иммунофлюоресценции (РИФ) выявляют специфические Аг. Непрямые (серологические) методы
При оценке данных серологических исследований крови новорождённого учитывают результаты аналогичных тестов у матери. Диагностическим критерием ВУИ служит увеличение титра IgG в сыворотке крови новорождённого в 4 раза и больше по сравнению с титром АТ у матери (IgG - единственный класс Ig, проникающих через плаценту). Имеет значение определение индекса авидности, характеризующего прочность связывания Аг с АТ. Высокоавидные IgG в сыворотке крови ребёнка обычно бывают материнскими. Наличие
низкоавидных IgG свидетельствует об их синтезе организмом новорождённого, т.е. об инфицировании самого ребёнка. Обнаружение IgM у новорождённого в первые дни жизни - бесспорное доказа- тельство внутриутробного инфицирования, так как IgM не проходят через плаценту и первыми из Ig появляются в ответ на присутствие Аг. Однако следует учитывать, что присутствие возбудителя не всегда приводит к заболеванию; поэтому нельзя ставить знак равенства между внутриутробным инфицированием и ВУИ.
По составу и количеству Ig у беременной можно судить о вероятности развития ВУИ.
• Обнаружение у беременной специфических IgG в небольшом количестве указывает на её иммунизацию соответствующим Аг в прошлом. В таких случаях опасности для плода нет. Плод получает материнские IgG, что обеспечивает ему иммунную защиту в первые 4-6 мес жизни.
• Нарастание титра специфических IgG или появление IgM указывает на рецидив инфекции во время беременности. В таком случае необходимо повторное обследование. Вероятность инфицирования плода составляет 8%.
• При персистирующей инфекции в крови у беременной обнаруживают Аг возбудителя и IgG, IgM отсутствуют. В этом случае вероятность передачи заболевания плоду составляет 2%.
• При первичной острой инфекции у ранее серонегативной женщины обнаруживают только IgM (IgG ещё нет). Возбудитель заболевания инфицирует плод более чем в 50% случаев, нередко вызывая генерализованные формы ВУИ.
Инфицирование плода может закончиться инфекционным процессом, санацией организма с формированием иммунитета или но- сительством с развитием отсроченной патологии. Поэтому нет смысла проводить лабораторную диагностику ВУИ всем новорождённым (АТ могут присутствовать в организме вследствие того, что ребёнок контактировал с возбудителем или переносит инфекцию в латентной форме, когда нет необходимости в лечении). Обследование показано при подозрении на ВУИ, причём провести его необходимо в первые часы жизни ребёнка, так как в более поздние сроки положительные результаты возможны и при постнатальном инфицировании. Считают, что в пользу ВУИ свидетельствуют положительные результаты, полученные в первые 7 дней после рождения, а при использовании вирусологического метода - обнаружение возбудителя в биологических жидкостях в первые 3 нед жизни ребёнка. Серологические результаты при ВУИ могут быть и отрицательными, если синтез Ig недостаточен из-за слабого антигенного раздражения или вследствие иммунодефицита (например, у недоношенных).
Дополнительные исследования
В общем анализе крови можно обнаружить лейкоцитоз с выраженным сдвигом влево в лейкоцитарной формуле, лимфоцитоз с нейтропенией, моноцитоз, тромбоцитоз, токсическую зернистость нейтрофилов, анемию.
При подозрении на ВУИ целесообразно провести нейросонографию. Возможные изменения: перивентрикулярная лейкомаляция, кальцификаты, кисты в веществе мозга, вентрикулит, хориоидит, внутрижелудочковые кровоизлияния, диффузная или перивентрикулярная гиперэхогенность. Эти изменения, как и клинические проявления, неспецифичны.
Дифференциальная диагностика
Дифференцировать ВУИ необходимо в первую очередь от заболеваний плода, вызванных гипоксией, приводящей к последующим метаболическим нарушениям. К ним относят гипоксически-ишемическую энцефалопатию (см. раздел «Перинатальные поражения центральной нервной системы»), гипоксическое поражение миокарда, дыхательной системы, ткани почек. В связи со сходством клинической картины и результатов УЗИ главным критерием дифференциальной диагностики служат специальные исследования (ПЦР, серологические реакции).
Лечение
Лечение при ВУИ должно быть комплексным и обязательно включать посиндромную терапию (табл. 5-3).
• Применение Ig - физиологический и естественный метод лечения, но в то же время плохо управляемый, так как не гарантирует изменения иммунного ответа в нужном направлении. Иногда возможны побочные эффекты внутривенного введения Ig: асептический менингит, пирогенные, вазомоторные и анафилактические реакции. Ig связывают вирусы только во внеклеточном пространстве (подавляют вирусемию), но не воздействуют на вирус, находящийся внутри клетки. Поэтому необходимы повторные курсы с интервалом 10-15 дней.
• Иммуномодуляторы, в частности интерфероны, назначают после противовирусной терапии или одновременно с Ig.
• Из противовирусных препаратов направленного действия для лечения новорождённых используют только ацикловир, препарат вводят внутривенно капельно в течение 14-21 дня в дозе до 70- 90 мг/кг/сут в 3 приёма.
• У новорождённых обычно приходится прибегать к эмпирической антибиотикотерапии с использованием антибиотиков широкого
Таблица 5-3. Лечение при внутриутробных инфекциях
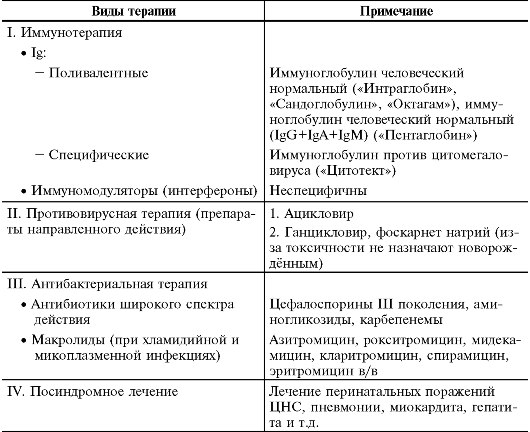
• спектра действия (ВУИ часто вызывают внутрибольничные штаммы, резистентные ко многим лекарственным средствам). В настоящее время чаще всего применяют комбинации цефалоспоринов III и IV поколения (цефтазидим, цефотаксим, цефтриаксон, цефоперазон) с аминогликозидами (нетилмицин). Широко распространено сочетание нетилмицина с цефтриаксоном, так как эти препараты вводят 1 раз в сутки. При отсутствии эффекта используют карбепенемы [имипенем+циластатин, меропенем] и гликопептиды, например ванкомицин, эффективный в 100% случаев в отношении стафилококков (в отличие от β-лактамных антибиотиков и аминогликозидов). Учитывая отсутствие достоверных методов диагностики и средств этиотропной терапии, в настоящее время в первую очередь проводят терапию отдельных проявлений ВУИ (перинатальных поражений ЦНС, пневмонии, миокардита, гепатита, гемолитической анемии, геморрагического синдрома). Если результаты лабораторных исследований положительны, но характерная для ВУИ клиническая
симптоматика отсутствует, от специфического лечения следует воздержаться.
Прогноз
При генерализованной ВУИ прогноз неблагоприятен: летальность достигает 80%. У детей, выживших после тяжёлых форм менингоэнцефалита или фетального гепатита, формируется грубая задержка психомоторного развития, хронический гепатит. При локализованных формах ВУИ прогноз главным образом зависит от наличия сопутствующих патологических состояний, своевременности и адекватности лечения. К наиболее тяжёлым последствиям приводит поражение ЦНС. Однако и при иной локализации процесса не исключено серьёзное поражение многих органов (кардиомиопатия, фиброэластоз эндокарда, интерстициальный нефрит, бронхолёгочная дисплазия с форми- рованием хронической патологии органов дыхания, хронический гепатит с исходом в цирроз и т.п.). Малоили бессимптомное течение ВУИ в дальнейшем приводит к развитию отсроченной патологии.
Сепсис
Постнатальное инфицирование обычно приводит к развитию локальных гнойно-воспалительных заболеваний; при сниженном иммунитете возможна генерализация инфекционного процесса с развитием сепсиса. Сепсис - генерализованная гнойно-воспалительная инфекция, вызванная условнопатогенной бактериальной флорой (главным образом, госпитальной) с бурным развитием воспалительной реакции организма на фоне иммунной дисфункции и присутствием возбудителя в крови.
Этиология и патогенез
Гнойно-воспалительные заболевания могут быть вызваны более чем 60 видами микроорганизмов. До последнего времени при сеп- сисе чаще выявляли условнопатогенную грамотрицательную флору. Преобладали неэнтеропатогенная кишечная и синегнойная палочки, клебсиелла, протей, стрептококки группы В, энтеробактер. В настоящее время, как и в 60-70-е гг. XX века, доминирующей постепенно становится грамположительная флора (чаще эпидермальный стафилококк). У новорождённых сепсис обычно развивается на фоне ВУИ, чаще её локализованной или малосимптомной формы. Большое значение имеет степень микробной колонизации, которая зависит от характера и продолжительности родов, срока прикладывания к груди, вида вскармливания, качества ухода за ребёнком и состояния санитарно-эпидемического режима в учреждении. В настоящее время у новорождённых распространены катетер-ассоциированные и венти-
лятор-ассоциированные инфекции. При использовании подключичного катетера инфицирование происходит у 1/3 детей, пупочного - у 1/5, «линий» - менее 1/10.
Ведущий патогенетический механизм сепсиса - синдром системного воспалительного ответа.
Клиническая картина
Чаще всего входными воротами бывает пупочная ранка. Также возможно проникновение инфекции через кожу, органы дыхания, органы слуха и ЖКТ. Раньше принято было выделение двух форм сепсиса - септицемии и септикопиемии. В настоящее время такое деление имеет второстепенное значение.
• При септицемии в клинической картине преобладает симптоматика инфекционного токсикоза. Заметно страдает общее состояние: сон нарушен, первоначальное беспокойство сменяется вялостью и слабостью. Появляются анорексия (ребёнок сосёт вяло или отказывается от груди), срыгивания, иногда с примесью жёлчи, неустойчивый стул. Снижается масса тела ребёнка при достаточном количестве молока у матери. Выявляют мышечную гипотонию и гипорефлексию (вплоть до арефлексии). Для кожных покровов характерна бледность, а затем землистая окраска и мраморность (рис. 5-2 на вклейке), возможна сыпь. Температура тела бывает различной (от гипотермии и субфебрилитета до гипертермии и гектической лихорадки). Возможен отёчный синдром. В результате нарушения микроциркуляции и метаболических изменений развиваются пневмопатия (одышка, цианоз, патологический тип дыхания), кардиопатия (глухость сердечных тонов, систолический шум, артериальная гипотензия; на ЭКГ изменение зубца P за счёт метаболических нарушений в миокарде, смещение сегмента ST), гепатоспленомегалия, желтуха, мочевой синдром, нарушение функций ЖКТ (вплоть до некротизирующего энтероколита). Возможен геморрагический синдром.
• При септикопиемии на фоне выраженной интоксикации появляются гнойные очаги (нередко множественные): абсцессы, флегмоны, остеомиелит, гнойный менингит, очаги деструкции лёгких и др. Различают молниеносное (1-7 дней), острое (4-8 нед, наиболее
частое) и затяжное или подострое (более 6-8 нед) течение заболевания. Для молниеносного течения характерно развитие септического шока с геморрагическим синдромом, резким снижением АД, олигу- рией; эта форма часто приводит к летальному исходу. Молниеносная форма сепсиса чрезвычайно напоминает генерализованную форму ВУИ. Некоторые авторы называют эту форму гиперергическим сепсисом; чаще всего заболевание вызывает стрептококк группы В.
Диагностика
Диагностика сепсиса достаточно сложна. В 60-70-е годы XX века из-за отсутствия диагностических критериев ВУИ, в первую очередь серологических и вирусологических, очень часто диагноз «сепсис» ста- вили при генерализованных формах ВУИ, особенно в тяжёлых случаях с молниеносным течением и летальным исходом. В диагностике сепсиса в последние годы возвращаются к результатам бактериологического исследования крови, от чего в 70-80-е годы в неонатологии практически отказались. В настоящее время считают, что наиболее достоверным подтверждением диагноза «сепсис» служит выделение гемокультуры. При её выделении необходимо учитывать следующие моменты.
• Попадание микроорганизмов в питательную среду возможно при нарушении правил асептики при заборе крови.
• Питательная среда может быть нестерильной при нарушении правил её приготовления и хранения.
• Бактериемия может быть транзиторной.
Для подтверждения диагноза необходимы многократные исследования. В настоящее время, особенно при отрицательных результатах, необходимо исследование на выявление микробных маркёров (ПЦР, прокальцитонин, ИЛ-6, ИЛ-18 и др.) Другие лабораторные исследования (общий и биохимический анализы крови, мочи и др.) при диагностике сепсиса имеют вспомогательное значение.
Дифференциальная диагностика
Сложной может быть дифференциальная диагностика сепсиса и генерализованной формы ВУИ (табл. 5-4).
Лечение
Лечение при сепсисе направлено на подавление возбудителя, повышение защитных свойств организма, санацию гнойных очагов. Антибиотикотерапия
Антибактериальную терапию проводят одновременно двумя антибиотиками (с учётом их синергизма) в течение 10-15 сут в максимальных возрастных дозах с последующей сменой препаратов. Предпочтительно внутривенное введение. Учитывают чувствительность возбудителя к антибиотику, а если результатов исследования на чувствительность нет, назначают антибиотики широкого спектра действия.
Посиндромная терапия
Проводят дезинтоксикационную терапию, коррекцию нарушений КЩС, восстановление ОЦК путём внутривенного введения растворов глюкозы, альбумина, плазмы, повидона + натрия хлори-
Таблица 5-4. Дифференциальная диагностика и лечение сепсиса и гене- рализованной ВУИ
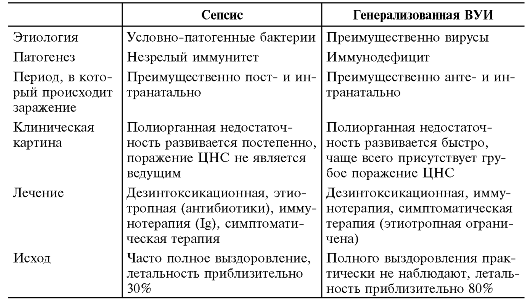
да + калия хлорида + кальция хлорида + магния хлорида + натрия гидрокарбоната («Гемодеза»), декстрана [мол.масса 30 000-40 000] («Реополиглюкина»). При гиперкоагуляции восстанавливают периферическое кровообращение (согревают конечности, назначают антиагреганты, «Реополиглюкин», гепарин натрий под контролем лабораторных данных). При появлении признаков гипокоагуляции вводят свежезамороженную нативную плазму. В настоящее время широко используют иммунотерапию в виде поливалентных Ig, обогащённых IgM («Пентаглобин»), структура которых способствует их более силь- ной агглютинации с бактериальными Аг. Применяются препараты рекомбинантных цитокинов (ИЛ-2).
Для повышения сопротивляемости организма желательно обеспечить ребёнка материнским нативным молоком.
Прогноз
Зависит от преморбидного фона больного, адекватности терапии. Летальные исходы наблюдаются особенно часто среди недоношенных, их частота составляет в среднем 30-40%, среди глубоко недоно- шенных - до 60%. Последствием сепсиса могут быть хронические заболевания органов дыхания, пиелонефрит, различные аллергические реакции, анемии, изменения со стороны ЦНС той или иной степени выраженности. Тем не менее, как правило, в отличие от генерали-
зованных форм ВУИ, выжившие дети при надлежащем наблюдении растут практически здоровыми.
Профилактика инфекционных заболеваний
Профилактика инфекционных заболеваний у новорождённых предусматривает:
• обследование женщин, относимых к группе риска по ВУИ, до наступления беременности;
• нередко многократное исследование беременной для выявления заболевания, протекающего либо в латентной форме, либо в виде первичной (острой) инфекции;
• своевременное выявление и санацию хронических очагов инфекции у беременной, предупреждение у неё острых инфекций;
• создание дома и на предприятии условий для благоприятного течения беременности, рождения ребёнка в срок;
• правильное ведение родов, предупреждение травматизации и инфицирования плода, особенно при влагалищных исследованиях, преждевременном отхождении околоплодных вод, применении акушерских пособий;
• соблюдение персоналом в родильных домах противоэпидемических мероприятий и правил личной гигиены;
• раннее начало естественного вскармливания.
НЕОНАТАЛЬНЫЕ ЖЕЛТУХИ
Желтушное окрашивание кожи (желтуха) у доношенных новорождённых возникает при концентрации билирубина в крови 80- 90 мкмоль/л, у недоношенных - более 120 мкмоль/л, у взрослых - 35-40 мкмоль/л. Причины гипербилирубинемии у новорождённых многообразны и отражены в изложенной ниже классификации.
Классификация неонатальных желтух
I. Неконъюгированная гипербилирубинемия.
1. Транзиторная (физиологическая) желтуха.
2. Гемолитические анемии.
A. ГБН;
Б. лекарственные;
B. наследственные:
• эритроцитарные мембранопатии (наследственный сфероцитоз, или болезнь Минковского-Шоффара);
• гемоглобинопатии (серповидноклеточная анемия, талассемия);
• эритроцитарные ферментопатии (недостаточность глюкозо-
6-фосфатдегидрогеназы);
3. Полицитемия.
4. Гематомы.
5. Нарушения конъюгации билирубина без гемолиза и анемии:
A. наследственные (синдром Жильбера, синдром КриглераНайяра типов I и II);
Б. при дефиците гормонов (гипотиреоз новорождённых, СД у матери);
B. при гепатитах новорождённых (как правило, инфекционного происхождения).
II. Конъюгированная гипербилирубинемия.
1. Внепечёночная обструкция жёлчных путей.
2. Внутрипечёночная обструкция жёлчных путей.
Неконъюгированная гипербилирубинемия
Накопление в крови неконъюгированного билирубина чаще всего связано с усиленным гемолизом или с недостаточной зрелостью ферментных систем гепатоцита. Наиболее часто в периоде новорож- дённости развивается ГБН. Транзиторная (физиологическая) желтуха описана в главе «Пограничные состояния».
ГЕМОЛИТИЧЕСКИЕ АНЕМИИ Гемолитическая болезнь новорождённых
Гемолитическая болезнь новорождённых (ГБН) - заболевание, в основе которого лежит гемолиз эритроцитов плода и новорождённого, связанный с несовместимостью крови матери и плода по эритроци- тарным Аг.
Этиология и патогенез. ГБН развивается преимущественно в результате несовместимости крови матери и плода по резус-фактору (Rh- фактору) или групповым Аг, реже - по другим антигенным системам из-за их меньшей иммуногенности.
• Rh-конфликт возникает, если у Rh-отрицательной женщины плод имеет Rh-положительную кровь.
• АВ0-конфликт развивается при наличии 0(I) группы крови у женщины, а у плода - А (II) (в 2/3 случаев) или B(III) (в 1/3 случаев). При несовместимости крови матери и плода по АВ0- или Rh-Аг
ГБН развивается в 3-6%. Существует мнение, что ГБН по системе АВ0 развивается не реже, а даже чаще, чем по Rh-фактору, но протекает в большинстве случаев легко и её нередко не диагностируют. В последние годы увеличилось количество детей с тяжёлыми формами ГБН по системе АВ0, особенно при наличии у новорождённых B(III) группы крови.
Rh-фактор, Аг А или В эритроцитов плода, попадая через плаценту в кровь матери, вызывают образование Rh-АТ или изоантител анти-А или анти-В соответственно, проникающих, в свою очередь, через плаценту в кровоток плода. Ребёнок рождается больным в случае предшествующей сенсибилизации матери. Rh-отрицательная женщина может быть сенсибилизирована переливаниями Rh-положительной крови даже в раннем детстве. Однако большее значение имеет иммунизация матери кровью плода при предыдущих, в том числе и прерванных беременностях, так как Rh-фактор начинает образовываться на 5-6-й неделе беременности и его можно обнаружить у плода на 10-14-й неделе. Наиболее выраженная трансплацентарная трансфузия происходит во время родов. При развитии ГБН по системе АВ0 порядковый номер беременности не имеет значения, так как в повседневной жизни сенсибилизация к АВ-Аг возникает достаточно часто (с пищей, при некоторых инфекциях, вакцинации).
Гемолиз эритроцитов плода и новорождённого приводит к гипербилирубинемии и анемии. Неконъюгированный билирубин нейро- токсичен. При определённой концентрации (свыше 340 мкмоль/л у доношенных и свыше 200 мкмоль/л у глубоконедоношенных) он может проникать через ГЭБ и повреждать структуры головного мозга, в первую очередь подкорковые ядра и кору, что приводит к развитию билирубиновой энцефалопатии (ядерной желтухи). Помимо концентрации неконъюгированного билирубина на его прохождение через ГЭБ влияют следующие факторы.
• Концентрация альбумина в плазме крови (в кровяном русле непрямой билирубин связывается с альбумином, теряя свои токсические свойства и способность проходить через ГЭБ).
• Концентрация неэстерифицированных жирных кислот, конкурирующих с билирубином за связь с альбумином.
• Концентрация глюкозы (глюкоза - исходный материал для образования глюкуроновой кислоты, кроме того, гипогликемия повышает концентрацию неэстерифицированных жирных кислот).
• Гипоксия (подавляет переход непрямого билирубина в прямой).
• Ацидоз (уменьшает прочность связывания неконъюгированного билирубина с альбумином).
Неконъюгированный билирубин - тканевой яд, тормозящий окислительные процессы и вызывающий в разных органах дегенератив- ные изменения клеток вплоть до некроза. В результате повреждения печёночных клеток в кровь попадает конъюгированный билирубин. Способность к его выведению снижена из-за незрелости экскреторной системы и особенностей жёлчных капилляров (узость, малое количество). В результате в жёлчных протоках возникает холестаз, возможно формирование реактивного гепатита.
В результате патологического разрушения эритроцитов развивается анемия, стимулирующая костномозговой гемопоэз. При выраженной анемии возникают очаги экстрамедуллярного кроветворения, в пери- ферической крови появляются эритробласты, в связи с чем заболевание ранее называли эритробластозом.
В селезёнке происходит фагоцитоз эритроцитов и их фрагментов. В эпителиальных клетках печени, почек, поджелудочной железы и других органов происходит отложение продуктов распада эритроцитов. Возникает дефицит железа, меди, цинка, кобальта. Печень и селезёнка увеличиваются в основном из-за очагов экстрамедуллярного кроветворения.
Клиническая картина. Различают отёчную (2%), желтушную (88%), анемическую (10%) формы заболевания.
• Отёчная форма - самая тяжёлая, развивается внутриутробно. При раннем иммунологическом конфликте может произойти выкидыш. При прогрессировании болезни массивный внутриутробный гемолиз эритроцитов приводит к тяжёлой анемии, гипоксии, нарушению обмена веществ, гипопротеинемии и отёку тканей. Образующийся в этих случаях неконъюгированный билирубин плода поступает в кровоток матери и обезвреживается её печенью (в крови беременной повышается концентрация билирубина). Плод погибает до рождения или рождается в крайне тяжёлом состоянии с распространёнными отёками. Кожа очень бледная, иногда с субиктеричным оттенком, лоснящаяся. Новорождённые вялы, мышечный тонус у них резко снижен, рефлексы угнетены, имеется сердечно- лёгочная недостаточность, выраженная гепатоспленомегалия, живот большой, бочкообразный. Концентрация Hb составляет менее
100 г/л.
• Желтушная форма - наиболее частая, среднетяжёлая форма заболевания. Основные её симптомы - рано возникающая желтуха, анемия и гепатоспленомегалия. Желтуха с апельсиновым оттенком появляется при рождении или в 1-е, реже на 2-е сутки и интенсивно нарастает. Увеличиваются печень и селезёнка. Чем раньше появляется желтуха, тем тяжелее протекает болезнь. По мере нарастания билирубиновой интоксикации дети становятся вялыми, сонливыми, появляются гипорефлексия, гипотония, монотонный крик, патологическое зевание. На 3-4-е сутки концентрация неконъюгированного билирубина может достигнуть критических значений. В этом случае появляются симптомы ядерной желтухи: ригидность мышц затылка, тонические судороги мышц-разгибателей, «мозговой» крик, симптом «заходящего солнца», выбухание большого родничка. Ядерная желтуха развивается у 10% доношенных при концентрации неконъюгированного билирубина в крови
выше 340 мкмоль/л, у 30% - выше 430 мкмоль/л, у 70% - выше 520 мкмоль/л. У некоторых детей даже при концентрации неконъю- гированного билирубина около 650 мкмоль/л ядерная желтуха не развивается. К концу 1-й недели жизни на фоне интенсивного гемолиза уменьшается выделение жёлчи в кишечник (синдром сгущения жёлчи) и появляются признаки холестаза. Кожа приобретает зеленоватый оттенок, кал обесцвечивается, моча темнеет, в крови повышается содержание конъюгированного билирубина. В тяжё- лых случаях желтушное окрашивание кожи сохраняется длительно. Желтушная форма ГБН обычно сопровождается гиперхромной анемией. Продолжительность анемии зависит от тяжести заболевания и вида лечения и может составлять до 2-3 мес.
• Анемическая форма по течению наиболее доброкачественная. Клинически проявляется сразу после рождения или в течение 1-й недели жизни. Иногда бледность кожных покровов сразу не выявляют. Заболевание постепенно прогрессирует, тяжёлую анемию диагностируют на 2-3-й неделе и даже позже. Общее состояние ребёнка изменяется мало, увеличиваются размеры селезёнки и печени. Концентрация неконъюгированного билирубина может быть слегка повышена. Прогноз благоприятный.
ГБН при конфликте по системе АВ0 протекает преимущественно в более лёгкой форме, однако возможно тяжёлое течение заболевания (особенно при несвоевременной диагностике) с исходом в билиру- биновую энцефалопатию. При двойной несовместимости ГБН, как правило, обусловлена А- или В-Аг и протекает легче, чем при изолированном Rh-конфликте.
Диагностика. Выделяют антенатальную и постнатальную диагностику.
• Прежде всего, необходима антенатальная диагностика возможного иммунного конфликта. Учитывают несовместимость крови родителей по эритроцитарным Аг, акушерско-гинекологический и соматический анамнез матери (предшествующие аборты, мертворождения, выкидыши, рождение больных детей, гемотрансфузии без учёта Rh-фактора). Во время беременности не менее трёх раз определяют титр противорезусных АТ в крови Rh-отрицательной женщины. Величина титра имеет относительное значение, так как обнаружение в крови беременной АТ позволяет лишь предположить вероятность заболевания плода. Тип кривой изменений титра Rh-АТ в динамике («скачущий», т.е. с резкими колебаниями, титр) имеет большее прогностическое значение, чем степень его повышения. В случае установления риска иммунного конфликта исследуют околоплодные воды, полученные методом трансабдоминального амниоцентеза с определением оптической плотности билирубина, концентрации белка, глюкозы, железа, меди, Ig и др. На развитие
ГБН при УЗИ указывают утолщение плаценты, её ускоренный рост за счёт возможного отёка, многоводие, увеличение размеров живота плода за счёт гепатоспленомегалии.
• Постнатальная диагностика ГБН основана, в первую очередь, на клинических проявлениях заболевания при рождении или вскоре после него (желтуха, анемия, гепатоспленомегалия). Большое значение имеют лабораторные данные (повышение концентрации неконъюгированного билирубина, эритробластоз, ретикулоцитоз, положительная проба Кумбса при Rh-конфликте). Все показатели учитывают в комплексе и, по возможности, в динамике. Лечение. В тяжёлых случаях прибегают к оперативному лечению -
заменному переливанию крови, гемосорбции, плазмаферезу. Заменное переливание крови позволяет вывести неконъюгированный билирубин и АТ из крови ребёнка и восполнить дефицит эритроцитов. Для заменного переливания крови обычно используют Rh-отрицательную кровь той же группы, что и кровь ребёнка. В настоящее время переливают не цельную кровь, а Rh-отрицательную эритроцитарную массу, смешанную со свежезамороженной плазмой. Если ГБН обусловлена групповой несовместимостью, то используют эритроцитарную массу 0(I) группы, а плазму либо АВ(IV) группы, либо одногруппную. Абсолютные показания к заменному переливанию крови в 1-е сутки жизни у доношенных новорождённых следующие.
• Концентрация неконъюгированного билирубина в пуповинной крови более 60 мкмоль/л.
• Почасовой прирост концентрации неконъюгированного билирубина более 6-10 мкмоль/л.
• Концентрация неконъюгированного билирубина в периферической крови более 340 мкмоль/л.
• Тяжёлая степень анемии (Hb менее 100 г/л).
Нередко (если почасовой прирост концентрации билирубина превышает 6-10 мкмоль/л) заменное переливание крови приходится проводить повторно (через 12 ч после первой процедуры). С 3-го дня жизни имеет значение только абсолютное значение концентрации билирубина, так как почасовой прирост замедляется из-за разрушения АТ. При интерпретации результатов лабораторных исследований в каждом конкретном случае их необходимо сопоставлять с клиническими данными. Глубокая недоношенность, патологическое течение беременности, совпадение групп крови матери и ребёнка при Rh-кон- фликте - факторы риска развития билирубиновой энцефалопатии. В этом случае необходимо проведение заменного переливания крови при более низкой концентрации неконъюгированного билирубина.
Широко применяют фототерапию. После введения этого метода необходимость в заменном переливании крови снизилась на 40%.
В настоящее время вместо специальных ламп, располагавшихся над кроватью ребёнка, используют систему, состоящую из источника света в виде высокоинтенсивной вольфрамовой галогенной лампы со встроенным рефлектором и фотооптического кабеля, по которому свет проходит от лампы к фиброоптической подушке. Последняя представляет собой матрац с вплетённым в него оптоволокном. На подушку надевают защитное покрытие, находящееся в непосредственном контакте с кожей новорождённого. Покрытие уменьшает риск загрязнения и распространения инфекции. Подушку крепят к телу ребёнка с помощью специального жилета (рис. 5-3 на вклейке). При фототерапии происходит фотоокисление неконъюгированного билирубина, находящегося в коже, с образованием биливердина и других водорастворимых изомеров, выводящихся с мочой и калом.
Для лечения ГБН применяют также индукторы микросомальных ферментов печени (например, фенобарбитал). Введение витаминов Е, В1, В2, В6, С, кокарбоксилазы улучшает работу печени и стабилизирует обменные процессы. С целью торможения абсорбции билирубина в кишечнике назначают очистительные клизмы, активированный уголь в первые 12 ч жизни. Синдром сгущения жёлчи купируют назначением внутрь желчегонных средств [урсодезоксихолевая кислота, магния сульфат, дротаверина (например, «Но-шпы») и др.]. При выраженной анемии производят трансфузии эритроцитарной массы или отмытых эритроцитов.
Ранее считали, что ребёнка с ГБН следует прикладывать к груди через 1-2 нед после рождения, так как в молоке присутствуют противорезусные АТ. В настоящее время доказано, что раннее прикладывание к груди не приводит к более тяжёлому течению заболевания, так как АТ, содержащиеся в молоке, разрушаются соляной кислотой и ферментами ЖКТ и не оказывают гемолизирующего действия.
Профилактика. Прежде всего проводят профилактику сенсибилизации женщины с Rh-отрицательной кровью.
• Неспецифическая профилактика: проведение гемотрансфузий только с учётом Rh-фактора, предупреждение абортов, комплекс социальных мер охраны здоровья женщины.
• Специфическая профилактика: введение Rh0(анти-D) Ig в первые 24 ч после рождения здорового Rh-положительного ребёнка, а также после абортов, что способствует быстрой элиминации эритроцитов ребёнка из кровотока матери, предотвращая у неё тем самым синтез Rh-АТ.
Метод специфической профилактики высокоэффективен, но при его применении возможны неудачи, вероятно, связанные с поздним введением препарата или его недостаточной дозой (например, при по- падании большого количества крови плода в кровоток матери).
Уровень перинатальной смертности при ГБН коррелирует с уровнем АТ у Rh-сенсибилизированной женщины до беременности. Необходимо добиться снижения их титра ещё до наступления беременности, допуская вынашивание при титре АТ 1:2-1:4.
Профилактика при выявлении Rh-сенсибилизации во время беременности включает следующие мероприятия.
• Неспецифическая гипосенсибилизация.
• Специфическая гипосенсибилизация: пересадка кожного лоскута от мужа с целью фиксации АТ на Аг трансплантата.
• Гемосорбция (от 1 до 8 операций), плазмаферез.
• 3-4-кратное внутриутробное заменное переливание крови на сроке беременности 25-27 нед отмытыми эритроцитами 0(I) группы Rh- отрицательной крови с последующим родоразрешением, начиная с 29-й недели беременности.
Прогноз зависит от степени тяжести ГБН. При тяжёлых формах возможна грубая задержка психомоторного развития, развитие детского церебрального паралича; при более лёгких - умеренная задержка формирования статических функций и психики, снижение слуха, косоглазие. В группе детей, перенёсших ГБН, выше общая заболеваемость, неадекватные реакции на профилактические прививки, склонность к развитию аллергических реакций, хроническое поражение гепатоби- лиарной системы. У 2/3 подростков, перенёсших ГБН, выявляют снижение физической работоспособности и психовегетативный синдром, что позволяет отнести их к группе высокого риска нарушения социальной адаптации.
Лекарственные гемолитические анемии
При применении некоторых лекарственных препаратов (например, салицилатов, сульфаниламидов, нитрофуранов) возможно развитие гемолиза эритроцитов и повышение концентрации билирубина в крови.
Наследственные гемолитические анемии
• Эритроцитарные мембранопатии (наследственный сфероцитоз, или болезнь Минковского-Шоффара). Наследственный сфероцитоз, или анемия Минковского-Шоффара, чаще проявляется в возрасте 3-15 лет (см. раздел «Гемолитические анемии» в главе «Анемии»).
• Из гемоглобинопатий наиболее распространена серповидноклеточная анемия. К этой же группе относят и талассемию. Гемоглобинопатии возникают в результате нарушения синтеза Hb вследствие мутации генов глобиновых цепей. Заболевания этой группы распространены в странах тропического и субтропического пояса; развиваются, как правило, к концу первого года жизни.
• Из эритроцитарных ферментопатий наиболее распространена гемолитическая анемия, обусловленная недостаточностью глюкозо- 6-фосфат дегидрогеназы. Недостаточность этого фермента чаще выявляют у жителей Средиземноморья, Востока, Азии, Африки. Заболевание может проявляться у новорождённых.
ПОЛИЦИТЕМИЯ
Может привести к гипербилирубинемии из-за неспособности печени метаболизировать избыточный билирубин. Развивается у 10-15% новорождённых с малой массой тела при рождении, при позднем пережатии пуповины, запоздалых родах, предлежании плаценты, фетофетальной и материнско-фетальной трансфузии, эндокринных нарушениях. Гематокрит у таких детей превышает 0,65, концентрация Hb более 220 г/л.
ГЕМАТОМЫ
Концентрация билирубина в крови может увеличиваться вследствие избыточного его образования при кефалогематомах, внутрижелудочковых кровоизлияниях.
НАРУШЕНИЯ КОНЪЮГАЦИИ БИЛИРУБИНА ПРИ ОТСУТСТВИИ ГЕМОЛИЗА И АНЕМИИ
Наследственные нарушения конъюгации билирубина
• Наиболее распространён синдром Жильбера. Это заболевание развивается вследствие нарушения захвата билирубина гепатоцитами и недостаточной активности глюкуронозилтрансферазы (9ΐ). Концентрация неконъюгированного билирубина в крови увеличивается незначительно, ядерная желтуха не развивается. Чаще диагностируют в школьном возрасте.
• В эту же группу входит синдром Криглера-Найяра I и II типа.
- I тип (ρ) протекает, как правило, с развитием ядерной желтухи, так как практически полностью отсутствует фермент глюкуронозилтрансфераза. Прогноз неблагоприятный. В настоящее время разрабатывают новые методы лечения этого заболевания: пересадка донорской печени, обычно от матери, введение клеток донорской печени.
- II тип (9ΐ) характеризуется доброкачественным течением. При этом типе снижена активность глюкуронозилтрансферазы.
Нарушения конъюгации билирубина при дефиците гормонов.
Гипербилирубинемия возникает при гипотиреозе новорождённых, так как гормоны щитовидной железы влияют на созревание глюкуронозилтрансферазы. Созревание этого фермента задерживается и при СД матери.
Нарушения конъюгации билирубина при гепатитах новорождённьгх.
Чаще развиваются при таких инфекциях, как гепатит В, С, краснуха, листериоз, токсоплазмоз, а также при цитомегаловирусной, микоплазменной, энтеровирусной инфекциях (см. раздел «Внутриутробные инфекции»). Гипербилирубинемия обычно смешанного происхожде- ния, связана как с поражением гепатоцитов, так и с повышенным гемолизом.
Конъюгированная гипербилирубинемия
Внепечёночная обструкция жёлчных путей обычно связана с их атрезией или гипоплазией в результате перенесённого внутриутробно инфекционного гепатита. Обструкция за счёт сгущения жёлчи может возникать при муковисцидозе, тяжёлых формах ГБН, парентеральном питании, особенно у недоношенных детей.
Внутрипечёночная обструкция жёлчных путей развивается при внутрипечёночных атрезиях жёлчных путей, возникающих также чаще всего после перенесённого внутриутробного гепатита.
Клиническая картина. При конъюгированной гипербилирубинемии желтуха (с зеленоватым оттенком) появляется или усиливается на 5-7-й день жизни. Несколько позже появляются постоянное или периодическое обесцвечивание кала, интенсивное окрашивание мочи. Развивается гепатоспленомегалия, печень становится очень плотной. Расширяются вены передней брюшной стенки, позднее развиваются асцит, геморрагический синдром, панцитопения. Перечисленные признаки появляются раньше и более постоянны при внепечёночном холестазе, чем при внутрипечёночной атрезии.
Лечение. Необходимо устранить холестаз. Назначают ферменты поджелудочной железы, улучшающие переваривание жиров, специальные питательные смеси, обогащённые среднецепочными триглицеридами и ненасыщенными жирными кислотами. При некоторых формах внепечёночной атрезии жёлчных путей применяют хирургическое лечение. В последние годы к хирургическому лечению иногда прибегают и при внутрипечёночной атрезии - производят трансплантацию печени, как правило, в возрасте старше 3-6 мес.
Дополнительные материалы на компакт-диске
• Локализованные гнойно-септические заболевания.
• Болезни лёгких.
• Болезни сердечно-сосудистой системы.
• Болезни желудочно-кишечного тракта.
• Болезни почек.