Клиническая фармакология.: учебник для вузов / Под ред. В.Г. Кукеса.- 4-е издание., перераб. и доп., - 2009. - 1056 с.
|
|
|
|
ГЛАВА 5. ВЗАИМОДЕЙСТВИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Под взаимодействием ЛС понимают изменение эффективности и безопасности одного ЛС при одновременном или последовательном его применении с другим ЛС, а также ксенобиотиками, пищей, алкоголем, при курении. Клиническое значение имеют взаимодействия ЛС, изменяющие эффективность и безопасность фармакотерапии.
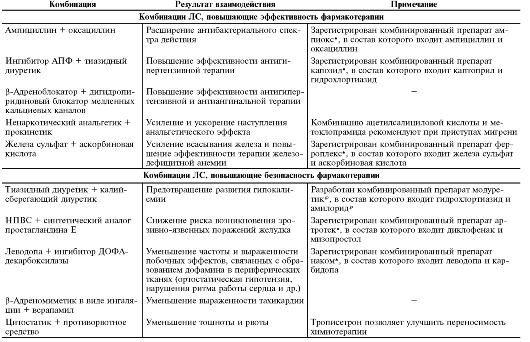
Взаимодействие ЛС, приводящее к повышению эффективности и безопасности фармакотерапии, лежит в основе рационального комбинирования ЛС. Примеры рациональных комбинаций ЛС приведены в табл. 5-1.
Взаимодействие ЛС может приводить и к снижению эффективности фармакотерапии, при этом говорят о нерациональных комбинациях ЛС. Например, практически все НПВС снижают эффективность ингибиторов АПФ при артериальной гипертензии и ХСН.
В основе потенциально опасных комбинаций ЛС лежит взаимодействие ЛС, приводящее к снижению безопасности фармакотерапии. Потенциально опасные комбинации ЛС составляют серьёзную клиническую проблему. По данным разных авторов, от 17-23% назначаемых врачами комбинаций ЛС потенциально опасны. Лишь у 6-8% больных, получающих потенциально опасные комбинации ЛС, развиваются побочные эффекты. В то же время, по статистическим данным только в США от побочных эффектов ЛС ежегодно умирают 160 000 больных. Причиной смерти трети из них оказывается взаимодействие ЛС, как правило, связанное с применением потенциально опасных комбинаций ЛС. Кроме того, побочные эффекты, возникающие при применении потенциально опасных комбинаций, также представляют собой и серьёзную экономическую проблему, так как расходы на их лечение составляют половину от затрат на терапию всех лекарственных осложнений.
5.1. ВИДЫ ВЗАИМОДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
В зависимости от механизма, различают фармакокинетическое и фармакодинамическое взаимодействия ЛС.
• Фармакокинетическое взаимодействие - влияние одного ЛС на фармакокинетические процессы (всасывание, распределение, метаболизм, выведение) другого. В результате фармакокинети-
Таблица 5-1. Примеры рациональных комбинаций лекарственных средств
 ческого
взаимодействия изменяется концентрация ЛС в плазме крови, а
следовательно, и его взаимодействие со специфическими
молекулами-мишенями (рецепторами, ферментами, ионными каналами и др.).
ческого
взаимодействия изменяется концентрация ЛС в плазме крови, а
следовательно, и его взаимодействие со специфическими
молекулами-мишенями (рецепторами, ферментами, ионными каналами и др.).
• Фармакодинамическое взаимодействие - влияние одного ЛС на процесс генерации и реализации фармакологического эффекта другого, при этом концентрация ЛС в плазме может не изменяться. Чаще всего при фармакодинамическом взаимодействии одно ЛС вмешивается в механизм действия другого.
5.2. ФАРМАКОКИНЕТИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ
ЛЕКАРСТВЕННЫХ СРЕДСТВ
Фармакокинетическое взаимодействие ЛС может происходить при их всасывании, распределении, метаболизме и выведении продуктов метаболизма.
Взаимодействие лекарственных средств при всасывании
Изменение всасывания через ЖКТ одних ЛС под действием других может происходить по различным механизмам. Основными механизмами, считают:
• образование хелатных и комплексных соединений;
• изменение рН желудочного или кишечного содержимого;
• влияние на нормальную микрофлору кишечника;
• повреждение слизистой оболочки кишечника или влияние на её функции;
• изменение моторики ЖКТ;
• влияние на гликопротеин Р.
Эти изменения могут приводить к ослаблению или усилению всасывания ЛС из ЖКТ. Как правило, взаимодействие ЛС при всасывании развивается при их одновременном приёме, или если интервал между приёмами ЛС составляет менее 2 ч. Если интервал между приёмами ЛС составляет более 4 ч, то взаимодействие на уровне всасывания практически невозможно. Взаимодействие при всасывании особенно значимо для ЛС с коротким периодом полувыведения (менее 12 ч) и для препаратов, фармакологический эффект которых развивается только при быстром достижении максимальной терапевтической концентрации. Это связано с тем, что даже незначительное уменьшение интенсивности всасывания подобных ЛС приводит к достижению лишь субтерапевтических концентраций, а следовательно, к снижению эффективности фармакотерапии. Это относится прежде
всего к снотворным и ненаркотическим анальгетикам. В то же время изменение всасывания практически не влияет на биодоступность ЛС с длинным периодом полувыведения (не менее 12 ч). Ниже приведены наиболее значимые механизмы взаимодействия ЛС при всасывании.
Образование комплексных и хелатных соединений
Суть этого механизма заключается в том, что при взаимодействии ЛС в ЖКТ могут образовываться невсасывающиеся комплексы и хелатные соединения. Так, активированный уголь и антациды значительно угнетают всасывание практически всех ЛС. Поэтому назначение активированного угля - неотъемлемый компонент терапии отравлений лекарственными препаратами (барбитуратами, бензодиазепинами и др.). Известно, что совместное применение фторхинолонов (ципрофлоксацина, левофлоксацина и др.) с антацидами и гастропротектором сукральфатом приводит к неэффективности антибактериальной терапии. Это происходит вследствие образования в ЖКТ невсасывающихся хелатных соединений фторхинолонов с магнием, алюминием, кальцием, сукральфатом. Тетрациклин образует в ЖКТ невсасывающиеся хелатные соединения с алюминием, кальцием, цинком, магнием, солями висмута, железа и других металлов, со всеми двух- и трёхвалентными катионами. Поэтому интенсивность всасывания тетрациклина снижается при его совместном применении с антацидами, препаратами висмута, а также с богатыми кальцием продуктами питания (молоко и молочные продукты), а вследствие этого терапия данным антибиотиком становится менее эффективной. В то же время образование невсасывающихся хелатных соединений тетрациклина с железом приводит как к снижению эффективности антибактериальной терапии, так и к неэффективности терапии препаратами железа. Ионообменные смолы, применяющиеся для лечения гиперлипидемий (колестирамин), могут образовывать невсасывающиеся комплексы, а следовательно, снижать всасывание самых разнообразных ЛС (антикоагулянтов, дигоксина, тиазидных диуретиков, гормонов щитовидной железы и жирорастворимых витаминов), в результате чего их концентрация в крови может существенно снизиться. Подобного рода взаимодействий ЛС при всасывании можно избежать, если между приёмом ЛС сделать промежуток не менее 4 ч.
Изменение рН желудочного содержимого
Липофильные неионизированные ЛС лучше всасываются в ЖКТ, чем гидрофильные ионизированные. Большинство ЛС - слабые кислоты или слабые основания, поэтому увеличение рН желудочного содержимого приводит к повышению ионизации ЛС - слабых кислот, и
снижению ионизации ЛС - слабых оснований. В этих условиях всасывание первых угнетается, а вторых - усиливается. Следовательно, ЛС (антациды, блокаторы Н2-рецепторов гистамина, ингибиторы протонного насоса), изменяющие рН желудочного содержимого, влияют на всасывание применяемых совместно с ними других лекарственных препаратов. Так, кетоконазол и другие противогрибковые ЛС - производные азола (слабые кислоты) практически не всасываются, а следовательно, и неэффективны, если пациент применяет их вместе с блокаторами Н2-рецепторов гистамина или ингибиторами протонного насоса. По этому же механизму снижается эффективность и других ЛС - слабых кислот (непрямых антикоагулянтов, ацетилсалициловой кислоты, дигоксина, сульфаниламидов, нитрофуранов) при их совместном применении с антацидами. Так, совместное применение антацидов с барбитуратами (слабые кислоты) приводит к практически полному устранению снотворного эффекта последних. В противоположность этому, увеличение рН желудочного содержимого при приё- ме антацидов повышает всасывание перорального сахароснижающего препарата глибутида (слабое основание) примерно на 25%, что увеличивает вероятность развития гипогликемии. ЛС в форме кишечно-растворимых таблеток могут всасываться быстрее, когда рН желудочного содержимого увеличивается, так как растворение оболочки в такой среде наступает быстрее, до того, как ЛС достигает тонкой кишки. Подобного рода взаимодействий ЛС при всасывании можно избежать, если назначать ЛС с интервалом не менее 4 ч.
Изменение состояние нормальной микрофлоры желудочно-кишечного тракта
Нормальная микрофлора ЖКТ принимает активное участие во всасывании некоторых ЛС (дигоксин, эстрогены и др.). Антибактериальные ЛС, особенно широкого спектра действия, подавляя нормальную микрофлору ЖКТ, могут изменять всасывание лекарственных препаратов. Так известно, что Eubacterium lentum (представитель нормальной микрофлоры кишечника) метаболизирует до неактивных продуктов около 10% принятого внутрь дигоксина. Совместное применение дигоксина с эритромицином приводит к повышению концентрации дигоксина в крови, что может привести к развитию побочных эффектов вплоть до гликозидной интоксикации. Другой пример - снижение эффективности оральных контрацептивов при их совместном применении с антибиотиками широкого спектра действия. Хорошо известно, что содержащийся в оральных контрацептивах этинилэстрадиол подвергается энтерогепатической рециркуляции: после всасывания, этинилэстрадиол метаболизируется (конъюгируется) в печени, затем
конъюгаты с жёлчью попадают в кишечник, где под действием ферментов нормальной микрофлоры гидролизуются до этинилэстрадиола, который вновь всасывается. При применении антибиотиков широкого спектра действия, подавляющих нормальную микрофлору, энтерогепатическая рециркуляция этинилэстрадиола нарушается, вследствие этого снижается и контрацептивная эффективность содержащих его ЛС.
Повреждение слизистой оболочки кишечника
Цитостатики, назначаемые как компонент химиотерапии при злокачественных опухолях, могут повреждать слизистую оболочку кишечника, что замедляет всасывание ЛС. Циклофосфамид, винкристин, прокарбазин могут угнетать всасывание дигоксина, снижая его эффективность. Для избегания данного феномена следует назначать дигоксин в форме капсул. Повреждения слизистой оболочки кишечника - основная причина нарушения всасывания железа, цианокобаламина и фолиевой кислоты при их совместном применении с неомицином и антибактериальными препаратами из группы полимиксина или тетрациклина.
Изменение моторики желудочно-кишечного тракта
Изменение моторики ЖКТ может приводить либо к ускорению, либо к замедлению всасывания ЛС. Быстрая эвакуация содержимого желудка под действием прокинетиков (метоклопрамид, домперидон) ускоряет всасывание некоторых ЛС (этанола, парацетамола, тетрациклина, диазепама, циклоспорина, пропранолола, солей лития и др.), поскольку они быстрее достигают тонкого кишечника. Концентрация циклоспорина в плазме возрастает примерно на 30%, когда его принимают вместе с прокинетиком метоклопрамидом, так как метоклопрамид ускоряет опорожнение желудка. Применение подобной комбинации может привести к быстрому развитию побочных эффектов циклоспорина (нефротоксичность, гепатотоксичность и гематотоксичность). Рационально совместное применение метоклопрамида с ненаркотическими анальгетиками. Метоклопрамид ускоряет попадание ненаркотических анальгетиков в тонкую кишку, где они интенсивно всасываются. В результате быстро достигается максимальная концентрация в плазме крови, ускоряется наступление и увеличивается выраженность анальгетического эффекта.
При одновременном применении медленно всасывающихся ЛС (дигоксин, циметидин и др.) и прокинетиков эффект обратный. Например, биодоступность медленно растворяющегося дигоксина снижается на 20%, если его принимают одновременно с метоклопрамидом. Ускорение перистальтики ЖКТ и уменьшение времени прохождения
по нему лекарственных препаратов замедляет всасывание и снижает биодоступность ЛС. Моторику ЖКТ могут усиливать эритромицин , слабительные ЛС. Противоположное действие (удлинение времени прохождения ЛС по ЖКТ) оказывают антихолинергические ЛС, наркотические анальгетики, блокаторы Н1-рецепторов гистамина, фенотиазиновые антипсихотические препараты. Ослабление моторики ЖКТ ускоряет всасывание и увеличивает биодоступность ЛС (сердечные гликозиды, препараты железа), повышая риск развития побочных эффектов. Например, при совместном приёме ослабляющих моторику ЖКТ препаратов с ацетилсалициловой кислотой увеличивается время контакта последней со слизистой оболочкой желудка и возрастает риск изъязвления (ульцерогенного эффекта).
Влияние на активность гликопротеина Р
Гликопротеин Р «выбрасывает» из энтероцитов в просвет кишечника всасывающиеся ЛС. У гликопротеина Р есть ЛС - субстраты, ингибиторы и индукторы (прил. 1.1). Совместное применение ингибиторов гликопротеина Р с его субстратами приводит к более полному всасыванию и увеличению концентрации последних в крови, в результате чего повышается риск развития побочных эффектов. Так, хинидин и верапамил (мощные ингибиторы гликопротеина Р) повышают концентрацию дигоксина (субстрат) в крови при совместном их приёме, что увеличивает риск развития побочных эффектов дигоксина, вплоть до дигиталисной интоксикации. С другой стороны, применение субстратов гликопротеина Р совместно с его индукторами снижает биодоступность и концентрацию субстратов в плазме крови, обуславливая их низкую эффективность. Например, препараты зверобоя снижают концентрацию дигоксина в плазме крови.
Взаимодействие лекарственных средств при распределении
После всасывания ЛС током крови разносятся по органам и тканям организма, где локализованы их фармакологические мишени. Распределение ЛС зависит от состояния гемодинамики в органах и тканях. Так, при уменьшении сердечного выброса у больных с ХСН снижается почечная перфузия, и петлевые диуретики оказывают недостаточное мочегонное действие, так как не достигают точки своего приложения (восходящего колена петли Генле). Если с помощью ЛС с положительным инторопным эффектом (сердечные гликозиды, добутамин и др.) увеличить сердечный выброс и почечную перфузию, то мочегонный эффект петлевых диуретиков возрастёт.
Наибольшее клиническое значение имеет взаимодействие ЛС на уровне связи с белками крови. Целый ряд ЛС характеризуются высоким
сродством к белкам плазмы крови. При этом слабые кислоты связываются с альбумином, а слабые основания - с α-1-кислым гликопротеином. Связь с белками разрывается в том случае, если в крови оказывается ЛС с более высоким к ним сродством. Такое ЛС вытесняет из связи с белком своего конкурента. Этот часто встречающийся механизм взаимодействия ЛС обуславливает увеличение свободной или активной фракции того ЛС, которое хуже связывается с белками, усиливая его фармакологическое действие (в том числе и побочные эффекты). Данный механизм взаимодействия приобретает клиническое значение, если ЛС имеет небольшой объём распределения (менее 35 л) и связывается с белками крови более чем на 90%. Если ЛС связывается с белками крови менее чем на 90%, то его вытеснение из связи с белками не приведёт к значимому изменению концентрации свободной фракции в крови. Если ЛС имеет большой объём распределения (более 35 л), то повышение концентрации его активной фракции нивелируется «уходом» в ткани. Следует отметить, что это взаимодействие обычно кратковременно, поскольку ЛС быстро метаболизируются и выводятся. Примеры ЛС, обладающих очень высоким сродством к белкам плазмы и имеющих небольшой объём распределения: фенитоин (связывается с белком на 90%, объём распределения 35 л), толбутамид (связывается с белком на 96%, объём распределения 10 л) и варфарин (связывается с белком на 99%, объём распределения 9 л). Данные ЛС вытесняются из связи с белками крови сульфаниламидами, ацетилсалициловой кислотой и фенилбутазоном. Увеличение концентрации вытесненных ЛС в крови может привести к побочным эффектам. Так, салицилаты, фенилбутазон и клофибрат увеличивают частоту внутренних кровотечений, вытесняя из связи с белком непрямые антикоагулянты [варфарин, аценокумарол (синкумар*), фениндион (фенилин*)].
ЛС - ингибиторы гликопротеина Р (прил. 1.1) увеличивают проникновение его субстратов через гистогематические барьеры и, в частности, через ГЭБ. Например, хинидин (ингибитор гликопротеина Р) способствует проникновению через ГЭБ антидиарейного ЛС лоперамида, способного вызвать морфиноподобные побочные эффекты (сухость во рту, миоз, угнетение дыхания). Домперидон проникает через ГЭБ, вызывая экстрапирамидные расстройства, при его совместном применении с циклоспорином (ингибитор гликопротеина Р).
Взаимодействие лекарственных средств при биотрансформации
Известно более 300 ЛС, влияющих на метаболизм других лекарственных препаратов. При этом они способны как повышать активность ферментов метаболизма ЛС (индукция), так и подавлять её (ингибирование) (прил. 1.3).
Индукция фермента биотрансформации - абсолютное увеличение его количества и(или) активности вследствие воздействия определён- ного химического агента и, в частности, ЛС. Это сопровождается гипертрофией эндоплазматического ретикулума, в котором локализовано большинство ферментов метаболизма. Индукции могут подвергаться как ферменты I фазы биотрансформации (изоферменты цитохрома Р-450), так и ферменты II фазы (УДФ-глюкуронилтрансфераза и др.). ЛС, индуцирующие ферменты, не имеют очевидного структурного сходства, но характеризуются некоторыми общими признаками:
• склонны растворяться в жирах (липофильны);
• служат субстратами ферментов (которые они индуцируют);
• у них, как правило, длительный период полувыведения. Различные субстраты способны индуцировать изоферменты ци-
тохрома Р-450 с неодинаковыми молекулярной массой, субстратной специфичностью, иммунохимическими и спектральными характеристиками. Кроме того, интенсивность индукции ферментов биотрансформации может существенно отличаться у разных людей (например, один и тот же субстрат повышает активность ферментов биотрансформации ЛС у различных индивидуумов в 15-100 раз).
Основные механизмы индукции ферментов биотрансформации:
• Молекулы индуктора непосредственно воздействуют на регуляторную область гена, что приводит к индукции фермента биотрансформации ЛС. Этот механизм наиболее характерен для аутоиндукции - увеличения активности фермента, метаболизирующего ксенобиотик под действием самого ксенобиотика. Аутоиндукцию рассматривают как адаптивный механизм, выработанный в процессе эволюции для инактивации ксенобиотиков, в том числе растительного происхождения. Так аутоиндукцией по отношению к цитохромам подсемейства IIB обладает фитонцид чеснока диалил сульфид. Типичные аутоиндукторы среди лекарственных препаратов - барбитураты (индукторы изоферментов цитохрома Р-450 3А4, 2С9, подсемейства IIB).
• Молекулы фермента биотрансформации ЛС стабилизируются вследствие образования комплекса с некоторыми ксенобиотиками (этанол, ацетон). Например, этанол индуцирует изофермент цитохрома Р-450 2Е1 на всех этапах его образования от транскрипции до трансляции. Полагают, что стабилизирующий эффект этанола связан с его способностью активировать систему фосфорилирования в гепатоците через цАМФ. С тем же механизмом связывают индукцию изофермента цитохрома Р-450 2Е1, развивающуюся при голодании и сахарном диабете. B данном
случае в качестве индукторов изофермента цитохрома Р-450 2Е1 выступают кетоновые тела.
• Активность изоферментов цитохрома Р-450 1А1, 3А4, 2В6 возрастает при взаимодействии молекулы индуктора со специфическими рецепторами, относящимися к классу белков - регуляторов транскрипции.
Индукция ведёт к ускорению биотрансформации ЛС - субстратов соответствующих ферментов и, как правило, к снижению их фармакологической активности. Среди индукторов ферментов биотрансформации ЛС наиболее широко в клинической практике применяют рифампицин (индуктор изоферментов цитохрома Р-450 1А2, 2С9, 2С19, 3A4, 3А5-7) и барбитураты (индукторы изоферментов цитохрома Р-450 1A2, 2В6, 2C8, 2С9, 2С19, 3A4, 3А5-7). В отличие от барбитуратов, для развития индуцирующего эффекта которых требуется несколько недель, рифампицин действует быстро (индукцию ферментов биотрансформации при его назначении можно обнаружить уже через 2-4 дня), а своего максимума эффект достигает через 6-10 дней. Индукция ферментов, вызванная рифампицином и барбитуратами, может приводить к снижению фармакологической эффективности непрямых антикоагулянтов (варфарина, аценокумарола, фениндиона) , циклоспорина, глюкокортикоидов, кетоконазола, теофиллина, хинидина, дигитоксина и верапамила, что требует коррекции режима дозирования данных ЛС (увеличение дозы).
Следует подчеркнуть, что при отмене индуктора ферментов биотрансформации ЛС, следует уменьшить дозировку сочетаемого ЛС, так как происходит увеличение его концентрации в крови. Пример такого взаимодействия - комбинирование антикоагулянтов непрямого действия и фенобарбитала. Причиной кровотечений при лечении непрямыми антикоагулянтами в 14% случаев становится отмена ЛС, индуцирующих ферменты биотрансформации.
Ингибирование ферментов биотрансформации ЛС - угнетение активности ферментов метаболизма под действием ЛС и ксенобиотиков.
Основные механизмы ингибирования ферментов биотрансформации ЛС:
• связывание с регуляторной областью гена, регулирующего синтез определённого изофермента цитохрома Р-450 (циметидин, флуоксетин, омепразол, фторхинолоны, макролиды, сульфаниламиды и др.);
• метаболическая конкуренция заключается в том, что некоторые препараты с высокой аффинностью (сродством) к определённым изоферментам цитохрома Р-450 (верапамил, нифедипин, исради-
пин, хинидин), ингибируют биотрансформацию ЛС с более низкой;
• прямая инактивация изоферментов цитохрома Р-450 и угнетение взаимодействия цитохрома Р-450 с НАДФ-Н-цитохром Р-450 редуктазой (фумарокумарины сока грейпфрута и лайма).
Снижение активности ферментов биотрансформации ЛС под действием соответствующих ингибиторов ведёт к повышению концентрации в крови ЛС (субстратов ферментов) и удлинению их периода полувыведения, что служит причиной развития побочных эффектов. Некоторые ингибиторы влияют сразу на несколько изоформ ферментов биотрансформации. Для угнетения сразу нескольких изоформ ферментов могут требоваться большие концентрации ингибитора.
Так, противогрибковый препарат флуконазол угнетает активность изофермента цитохрома Р-450 2С9 в дозе 100 мг/сут, а при повышении дозы до 400 мг угнетается активность и изофермента цитохрома Р-450 3А4. Кроме того, чем выше доза ингибитора, тем быстрее наступает его действие и тем ярче оно выражено. Ингибирование вообще развивается быстрее, чем индукция, обычно его можно зарегистрировать уже через 24 ч от момента назначения препарата. На скорость ингибирования активности фермента влияет также путь введения ЛСингибитора: при внутривенном введении взаимодействие развивается быстрее.
Рассмотрим несколько клинически значимых примеров данного механизма взаимодействия.
• К ингибиторам изофермента цитохрома Р-450 1А2 относятся фторхинолоны: ципрофлоксацин и, в меньшей степени, норфлоксацин. Совместное применение препаратов теофиллина с перечисленными фторхинолонами приводит к 4-5-кратному увеличению концентрации теофиллина в крови и к резкому усилению кардиотоксичности, поэтому не следует комбинировать теофиллин с ципрофлоксацином, эноксацином и норфлоксацином. Отсутствие ингибирующего действия других фторхинолонов на СYР1А2 объясняют наличием в их молекулах радикалов в положениях N1 и С7, которые не позволяют связываться с СYР1А2. Так, ломефлоксацин в положении С7 имеет 3-окси-4-метилпипе- разиновую группу, поэтому не ингибирует СYР1А2 и его можно безопасно использовать совместно с препаратами теофиллина.
• Совместное применение непрямого антикоагулянта варфарина (субстрат изофермента цитохрома Р-450 2С9) с сульфаниламидными препаратами (ингибиторы изофермента цитохрома Р-450 2С9) приводит к усилению антикоагулянтного эффекта и повышению риска геморрагических осложнений. Поэтому при
сочетании варфарина с сульфаниламидами рекомендуют строгий контроль международного нормализованного отношения (МНО) - по крайней мере, 1-2 раза в неделю.
• Антибиотики из группы макролидов ингибируют изофермент цитохрома Р-4450 3A4. Макролиды отличаются по способности ингибировать CYP3A4. В классификации, предложенной P. Periti и соавт. (1992), макролиды разделены по способности к ингибированию CYP3A4 на 3 группы:
1-я группа - сильные ингибиторы CYP3A4 (эритромицин и тролеандомицин);
2-я группа - умеренные ингибиторы CYP3A4 (кларитромицин); 3-я группа - макролиды, не ингибирующие CYP3A4 (азитромицин).
• Совместное применение с субстратами изофермента цитохрома Р-450 3А4 лишь макролидов 1-й и 2-й группы может приводить к побочным эффектам. Например, совместное применение макролидов 1-й и 2-й группы с блокаторами Н1-рецепторов гистамина (астемизол*, терфенадин* и др.) в 10% случаев приводит к кардиотоксичности, проявляющейся удлинением интервала Q-T по данным ЭКГ, что увеличивает риск возникновения опасной для жизни желудочковой тахикардии типа «пируэт» (двухнаправленной веретенообразной желудочковой тахикардии).
Многие лекарственные препараты могут влиять на интенсивность печёночного кровотока - «лимитирующего» фактора биотрансформации ЛС с высоким печёночным клиренсом, для которых характерен эффект «первого прохождения» (см. главу 1 «Клиническая фармакокинетика»). Поэтому ЛС, снижающие величину печёночного кровотока, угнетают биотрансформацию препаратов с высоким печёночным клиренсом, увеличивая их биодоступность.
Известно, что β-адреноблокаторы (пропранолол и др.), снижая интенсивность печёночного кровотока, угнетают свой собственный метаболизм, а также биотрансформацию лидокаина, хлорпромазина, верапамила и др. Концентрация этих ЛС в плазме крови повышается, и могут возникнуть побочные эффекты. Следует отметить, что для включения данного механизма взаимодействия необходимо несколько дней с момента назначения β-адреноблокаторов. Среди β-адреноблокаторов наибольшее влияние на печёночный кровоток оказывает пропранолол.
Взаимодействие лекарственных средств при выведении
При выведении ЛС взаимодействуют друг с другом, изменяя параметры клубочковой фильтрации, канальцевой секреции и реабсорбции.
Изменение клубочковой фильтрации
Лекарственные препараты, снижающие СКФ, обычно понижают фильтрационное давление, уменьшая объём циркулирующей крови, либо снижая АД или тонус почечных артерий. Концентрация препаратов, выводящихся из организма преимущественно путём пассивной фильтрации, увеличивается при их совместном применении с ЛС, снижающими СКФ. При этом возрастает и частота развития побочных эффектов.
Например, снижение СКФ при приёме фуросемида приводит к угнетению фильтрации аминогликозидных антибиотиков, повышению их концентрации в крови и увеличению нефротоксичности. В то же время сами нефротоксичные ЛС (например, аминогликозиды) могут уменьшать количество функционирующих клубочков и снижать СКФ, что приводит к накоплению в организме совместно применяющихся с ними ЛС, например дигоксина.
Изменение канальцевой секреции
Многие ЛС активно секретируются в проксимальной части канальца нефрона. Липофильные ЛС секретируются с помощью гликопротеина Р, гидрофильные, а также метаболиты ЛС - с помощью транспортёров органических анионов (ОАТ, ОТРР) и катионов (ОСТ) (см. главу 1). Снижение активности этих специфических систем может привести к повышению в крови концентрации ЛС, основной путь выведения которых - канальцевая секреция (табл. 5-2). Конкуренция эндогенных веществ (например, мочевая кислота) и лекарственных препаратов или их метаболитов (бензилпенициллин, пробеницид*, НПВС, метотрексат, сульфаниламиды и цефалоспорины) за транспортные системы может привести к развитию клинически значимых лекарственных взаимодействий (см. табл. 5-2).
НПВС, ингибируя ОАТ2, ОАТ3, ОАТ4 проксимальных почечных канальцев, угнетают активную секрецию метотрексата, повышая его концентрацию в плазме крови и увеличивая риск развития побочных эффектов (миелотоксичность и др.). Способность пробеницида* ингибировать ОАТ1 проксимальных почечных канальцев, угнетая при этом канальцевую секрецию пенициллинов, ранее широко использовали для повышения эффективности β-лактамных антибиотиков.
Изменение канальцевой реабсорбции
Отфильтрованные и секретированные ЛС реабсорбируются в дистальной части почечного канальца и в собирательных трубочках, при- чём реабсорбируются только неионизированные молекулы ЛС. Кислотность среды изменяет степень ионизации ЛС, поэтому на их ре-
Таблица 5-2. Ингибиторы канальцевой секреции лекарственных средств
 5.3. ФАРМАКОДИНАМИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
5.3. ФАРМАКОДИНАМИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Фармакодинамическое взаимодействие - изменение фармакологических эффектов одного ЛС под действием другого, не сопровож-
дающееся изменением его концентрации в крови и связи с молекулами-мишенями (рецепторами, ферментами, ионными каналами др.). Фармакодинамическое взаимодействие ЛС клинически проявляется их антагонизмом или синергизмом.
• Антагонизм - взаимодействие ЛС, угнетающее или устраняющее часть или все фармакологические эффекты одного или нескольких ЛС.
• Синергизм - однонаправленное действие ЛС, обеспечивающее более сильный фармакологический эффект, чем действие каждого ЛС в отдельности.
Различают следующие виды синергизма:
• сенситизирующее действие - результат синергичного взаимодействия ЛС, при котором фармакологический эффект одного препарата усиливается другим, не обладающим данным фармакологическим эффектом;
• аддитивное действие - результат синергичного взаимодействия ЛС, при котором фармакологический эффект комбинации больше, чем действие одного из компонентов, но меньше предполагаемого эффекта их суммы;
• суммация действия - результат синергичного взаимодействия ЛС, при котором фармакологический эффект комбинации лекарственных препаратов примерно равен сумме каждого из них;
• потенцирование - результат синергичного взаимодействия ЛС, при котором конечный фармакологический эффект комбинации лекарственных препаратов больше суммы эффектов каждого компонента комбинации.
Синергичное фармакодинамическое взаимодействие
В основе синергичного взаимодействия лежит однонаправленный эффект совместно применяемых ЛС. Приведём несколько примеров синергичного фармакодинамического взаимодействия. β-Адреноблокатор пропранолол и блокатор медленных кальциевых каналов верапамил снижают сократимость миокарда (отрицательный инотропный эффект) и ЧСС (отрицательный хронотропный эффект), угнетают атриовентрикулярную проводимость и др. Совместное применение этих ЛС усиливает данные фармакологические эффекты - комбинация пропранолола и верапамила потенциально опасна.
Сахароснижающее действие инсулина значительно усиливают пероральные сахароснижающие препараты группы сульфонилмочевины. Такие взаимодействия используют в терапевтических целях, но они могут вызывать серьёзные побочные эффекты (гипогликемию) и требуют более жёсткого контроля безопасности проводимой терапии.
Комбинация теофиллина с агонистами β2-адренорецепторов (например, сальбутамолом) оказывает гораздо более значительное бронхолитическое действие, чем эти ЛС по отдельности, но, к сожалению, существенно увеличивается риск развития нарушений ритма сердца.
Большинство антибиотиков подавляют активность нормальной микрофлоры кишечника, синтезирующей витамин К, поэтому значительно повышается риск развития геморрагических осложнений при применении непрямых антикоагулянтов (по механизму действия они антагонисты витамина К) совместно с антибиотиками.
Антагонистичное фармакодинамическое взаимодействие
Пример клинически значимого взаимодействия подобного рода - влияние НПВС на эффективность антигипертензивных ЛС. НПВС ослабляет гипотензивный эффект большинства антигипертензивных ЛС (ингибиторов АПФ, диуретиков, β-адреноблокаторов). Кроме того, у больных с ХСН при приёме НПВС увеличивается частота декомпенсаций, что, по-видимому, связано со снижением эффективности применяемых диуретиков и ингибиторов АПФ. Механизм этих феноменов состоит в угнетении синтеза вазодилатирующих простагландинов в почках при приёме НПВС.
Синергичное или антагонистичное фармакодинамическое взаимодействие в зависимости от механизма, лежащего в его основе, может быть прямым и косвенным (непрямым).
Прямое фармакодинамическое взаимодействие
При прямом фармакодинамическом взаимодействии оба ЛС влияют на один и тот же биосубстрат: специфические молекулы-мишени (рецепторы, ферменты, ионные каналы и др.), системы «вторичных» посредников, транспортные медиаторные системы. Ниже приведены примеры прямого фармакодинамического взаимодействия.
Взаимодействие на уровне специфических молекул-мишеней
При передозировке β-адреноблокаторов (гипотония, брадикардия, нарушение предсердно-желудочковой проводимости и др.) применяют агонист β1-адренорецепоторов добутамин, который вытесняет β-адреноблокатор из связи с β1-адренорецепоторами и устраняет его фармакологические эффекты.
Взаимодействие на уровне систем вторичных посредников
К вторичным посредникам (мессенджерам), переносящим сигналы от рецепторов в эффекторных клетках, относятся цАМФ, цГМФ, инозитолтрифосфат и др. На уровне цАМФ взаимодействуют теофиллин и
агонисты β2-адренорецепторов ф2-адреномиметики). Эту комбинацию применяют для усиления бронхолитического эффекта при недостаточной эффективности монотерапии β2-адреномиметиками.
β2-Адреномиметики стимулируют β2-адренорецепторы гладкой мускулатуры бронхов, в результате передачи сигнала через Gs-белки повышают активность аденилатциклазы, интенсивно превращающей АТФ в цАМФ - вторичный посредник передачи рецепторного сигала. Повышение внутриклеточной концентрации цАМФ приводит к активации цАМФ-зависимых протеинкиназ, фосфорилирующих и, таким образом, снижающих активность киназы лёгких цепей миозина. Последняя перестаёт фосфорилировать лёгкие цепи сократительного белка миозина, при этом миозин теряет способность соединиться с актином и гладкомышечные клетки бронхов остаются в расслабленном состоянии. Наступает бронхолитический эффект.
Теофиллин, ингибируя фосфодиэстеразу (фермент, разрушающий цАМФ), повышает концентрацию внутриклеточного цАМФ. Совместное применение β2-адреномиметиков и теофиллина приводит к ещё большему повышению концентрации цАМФ в гладкомышечных клетках бронхов, усиливая бронхолитический эффект.
Взаимодействие на уровне транспортных медиаторных систем
Совместное применение антидепрессантов - ингибиторов МАО с симпатомиметиками (амфетамин, эфедрин) - приводит к выраженному гипертоническому кризу, который может сопровождаться делирием и нарушениями ритма работы сердца. При приёме симпатомиметиков из окончаний симпатических нервов выбрасывается избыточное количество норадреналина, который накапливается в них в результате угнетения МАО.
Другой пример - возникновение «серотонинового синдрома» при применении следующих комбинаций ЛС: ингибиторы МАО и антидепрессанты - ингибиторы обратного нейронального захвата серотонина, ингибиторы МАО и трициклические антидепрессанты, ингибиторы МАО и триптофан. Данные взаимодействия приводят к избыточному накоплению серотонина в ЦНС, в результате чего возникает «серотониновый синдром» - лихорадка, атаксия, судороги и др.
Косвенное (непрямое) фармакодинамическое взаимодействие
Этот тип взаимодействия ЛС реализуется с включением разных биологических субстратов и может осуществляться на уровне эффекторных клеток, тканей, органов и функциональных систем. Ниже приведены примеры косвенного фармакодинамического взаимодействия на различных уровнях.
Взаимодействие на уровне эффекторных клеток
β2-Адреномиметики, особенно в высоких дозах, теряют свою селективность по отношению к β2-адренорецепторам, стимулируют β1-адренорецепотры синусового узла проводящей системы сердца. Это приводит к стимуляции аденилатциклазы через Gs-белок и активации синтеза цАМФ. Повышение внутриклеточной концентрации цАМФ приводит к активации цАМФ-зависимых протеинкиназ, которые фосфорилируют мембранные кальциевые каналы, способствуя их открытию. При этом создаётся ток ионов кальция из внеклеточного пространства внутрь кардиомиоцитов, который играет роль «кальциевой искры» для массивного высвобождения ионов кальция из внутриклеточного депо (саркоплазматического ретикулума). Повышение концентрации внутриклеточного кальция в кардиомиоцитах синусового узла приводит к увеличению ЧСС - тахикардии. Верапамил, блокируя медленные кальциевые каналы в клетках синусового узла, устраняет этот эффект β2-адреномиметиков. Поэтому верапамил используют для ослабления тахикардии, вызванной применением β2-адреномиметиков.
Другой пример косвенного фармакодинамического взаимодействия на уровне эффекторных клеток - ослабление антибактериальной активности бактерицидных антибиотиков (β-лактамные антибиотики, аминогликозиды и др.) при их совместном применении с бактериостатическими антибиотиками (тетрациклины, макролиды, линкозамиды и др.). Это связано с тем, что бактерицидные антибиотики действуют на делящиеся бактериальные клетки. При подавлении деления бактериальных клеток под действием бактериостатических антибиотиков количество делящихся бактерий - мишеней для бактерицидных антибиотиков - снижается, следовательно, ослабевает и их антибактериальная активность.
Взаимодействие на уровне эффекторных органов
Многие ЛС обладают органотоксичностью - способностью поражать определённые органы. Потенциально опасно совместно применять ЛС, оказывающие токсическое воздействие на один и тот же орган. Следует избегать подобных комбинаций ЛС, а в случае крайней необходимости их применения необходимо тщательно контролировать функциональное состояние соответствующего органа. Некоторые ЛС, обладающие органотоксичностью, приведены в табл. 5-4.
Взаимодействие на уровне эффекторных функциональных систем
При фармакотерапии артериальной гипертензии для повышения эффективности антигипертензивной терапии прибегают к комбинации ЛС с различным механизмом действия. Например, эффективной
Таблица 5-4. Лекарственные средства, обладающие органотоксичностью
Гепатотоксичность | Нефротоксичность | Ототоксичность | Миелотоксичность | Ульцерогенность |
Этанол Гризеофульвин Диклофенак натрия Фенитоин Изониазид Ингибиторы МАО Итраконазол Метотрексат Меркаптопурин Оксациллин Парацетамол Фенотиазины Рифампицин Тетрациклины Флуконазол Хлоралгидрат Хлорамфени- кол | Аминогликозиды Фенилбутазон Гризеофульвин Сульфаниламиды Фуросемид Цефалоспорины (особенно 1-го поколения) Циклоспорин | Аминогли- козиды Фуросемид Этакриновая кислота | Производные пирозолона (фенилбутазон, метамизол натрия) Тиамазол Тиклопидин Фенотиазины Цитостатики Хлорамфеникол | Глюкокортикоиды НПВС Резерпин |
и безопасной считают комбинацию тиазидных диуретиков (гидрохлоротиазид и др.) и ингибиторов АПФ (каптоприл, эналаприл и др.). При таком сочетании потенцируется гипотензивный эффект, что позволяет нормализовать АД.
5.4. ВЗАИМОДЕЙСТВИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ С ПИЩЕЙ
Пища может изменять как фармакокинетику, так и фармакодинамику ЛС.
Фармакокинетическое взаимодействие лекарственных средств с пищей
Фармакокинетическое взаимодействие принимаемых внутрь ЛС с пищей происходит, в основном, на уровне всасывания. При совместном приёме с пищей замедляется всасывание и снижается биодоступность одних ЛС и ускоряется всасывание других ЛС (см. табл. 5-6). Например, при приёме ненаркотических анальгетиков (ацетилсалициловая кислота, парацетамол и др.) с пищей замедляется развитие обезболивающего действия. Дольше развивается противоаллергический эффект, если блокаторы Н1-рецепторов гистамина принимать во время еды. Рекомендации по применению ЛС в зависимости от приё- ма пищи приведены в табл. 5-7.
Замедлению всасывания некоторых ЛС способствует определённый качественный состав пищи. Это может быть связано с влиянием некоторых продуктов на рН желудка.
К примеру, продукты, усиливающие секрецию соляной кислоты в желудке (помидоры, фруктовые соки, кофеинсодержащие напитки), замедляют всасывание и уменьшают биодоступность эритромицина и полусинтетических пенициллинов (ампициллин, оксациллин, амоксициллин). При защелачивании содержимого желудка некоторыми продуктами питания (молоко и молочные продукты) ионизируются противогрибковые ЛС - производные имидазола (клотримазол, кетоконазол и др.), что уменьшает их биодоступность.
В состав пищи могут входить компоненты, образующие с ЛС невсасывающиеся хелатные соединения и комплексы. Так, богатые кальцием продукты (молоко, сыры, мороженое, йогурты и другие молочные продукты) угнетают всасывание тетрациклинов и ципрофлоксацина. Преобладание в пище животных жиров может увеличить биодоступность липофильных ЛС. Повышенное содержание животных жиров в пище обеспечивает более полное всасывание теофиллина, в то время как богатые углеводами продукты снижают его всасывание. Это необходимо учитывать при назначении пероральных пролонгированных лекарственных форм теофиллина.
В некоторых случаях целенаправленно рекомендуют принимать ЛС во время еды для снижения риска развития побочных эффектов. К примеру, для уменьшения ульцерогенного эффекта НПВС и глюкокортикоидов (при длительном курсовом применении) их следует принимать во время еды или запивать молоком. На всасывание некоторых ЛС пища существенного влияния не оказывает (табл. 5-5).
Компоненты некоторых продуктов влияют на биотрансформацию ЛС. Например, флавоноиды сока грейпфрута ингибируют изофермент цитохрома Р-450 3А4. Стакан сока грейпфрута в 2 раза замедляет клиренс нифедипина (субстрат изофермента цитохрома Р-450 3А4), принятого внутрь, провоцируя выраженную артериальную гипотензию и тахикардию.
Фруктовые соки влияют на активность не только изоферментов цитохрома Р-450, но и транспортёров и способны изменять фармакокинетику ЛС (табл. 5-6). Так, апельсиновый сок индуцирует транспортёр ОАТР-С и почти в 2 раза снижает максимальную концентрацию атенолола в крови, что сопровождается менее выраженным снижением
ЧСС.
Следует предупредить больных о недопустимости запивать ЛС фруктовыми соками!
Таблица 5-5. Возможное влияние пищи на всасывание некоторых лекарственных средств из желудочно-кишечного тракта
Увеличение | Замедление | Снижение | Отсутствие изменений |
Амитриптилин Пропранолол Гидралазин Гризеофульвин Гидрохлортиазид Фенитоин Карбамазепин Этил бискумацетат Диазепам Спиронолактон Нитрофурантоин Фуразолидон Хлорохин | Дигоксин Диклофенак Препараты калия Парацетамол Сульфаниламиды Фенобарбитал Фуросемид Хинидин Циметидин | Ампициллин Феназон Дигоксин Доксициклин Ибупрофен Изониазид Ацетилсалициловая кислота Канамицин Леводопа Хлорамфеникол Линкомицин Метациклин Рифампицин Салицилаты Тетрациклины Циклосерин | Метронидазол Нитразепам Преднизолон Теофиллин Хлорпропамид |
Таблица 5-6. Влияние фруктовых соков на активность некоторых изоферментов цитохрома Р-450 и транспортёров
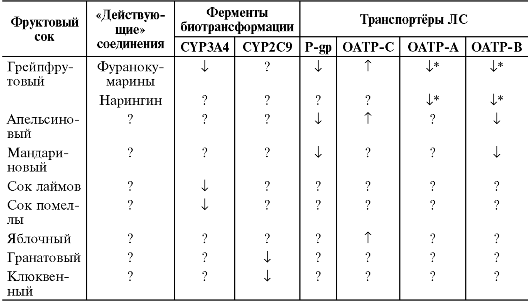 Примечания.
i - ингибирует; Τ - индуцирует; ? - нет данных о влиянии на фермент или
транспортёр; * - нет точных данных о том, какое именно вещество
(фуранокумарины или нарингин) оказывают действие.
Примечания.
i - ингибирует; Τ - индуцирует; ? - нет данных о влиянии на фермент или
транспортёр; * - нет точных данных о том, какое именно вещество
(фуранокумарины или нарингин) оказывают действие.
К индукторам изофермента цитохрома Р-450 1А2 относятся такие продукты питания, как броколли, брюссельская капуста, хорошо прожаренное мясо. Эффективность теофиллина (субстрат изофермента цитохрома Р-450 1А2) у больных, регулярно употребляющих эти продукты, снижена за счёт его интенсивного метаболизма. Показано, что некоторые сорта мёда индуцируют изофермент цитохрома Р-450 3A4, что может снизить эффективность ЛС, подвергающихся биотрансформации под действием данного изофермента.
Фармакодинамическое взаимодействие лекарственных средств с пищей
Фармакодинамическое взаимодействие ЛС с пищей также может быть прямым и непрямым.
Прямое взаимодействие на уровне специфических молекул-мишеней происходит при совместном применении непрямых антикоагулянтов [варфарин, аценокумарол (синкумар*), фениндион (фенилин*)] и овощей, богатых витамином К (шпинат, салат, капуста, редька, репа, брюссельская капуста, броколли, спаржа). Как известно, действие непрямых антикоагулянтов связано с угнетением образования восстановленного витамина К, необходимого для синтеза факторов свёр- тывания крови (II, V, IX, X). Перечисленные продукты пополняют запасы витамина К и уменьшают антикоагулянтное действие этих ЛС, снижая их эффективность. Поэтому при назначении непрямых антикоагулянтов необходимо проинформировать пациентов о необходимости ограничения употребления вышеперечисленных овощей.
Прямое фармакодинамическое взаимодействие на уровне транспортных медиаторных систем происходит при применении антидепрессантов из группы ингибиторов МАО совместно с продуктами, богатыми симпатомиметиком тирамином. Под действием тирамина из окончаний симпатических нервов выбрасывается избыточное количество норадреналина, накапливающегося в результате угнетения МАО. При этом развивается выраженный гипертонический криз, который может сопровождаться делирием и нарушениями ритма работы сердца. Тирамин в больших количествах находится в некоторых сортах сыра («Камамбер», «Чеддер», «Моцарелла», «Пармезан»), соевом соусе, колбасе «Салями», куриной печени, квашеной капусте, бананах, авокадо, изюме, пиве, винах херес и рислинг. Перед назначением ингибиторов МАО больных следует предупредить о необходимости строго соблюдать соответствующую диету.
Некоторые продукты питания могут вступать с ЛС в непрямое фармакодинамическое взаимодействие. Так, употребление продуктов с большим содержанием хлорида натрия (колбасы, ветчина, мясные и рыбные консервы, сало-шпик, солёная и копчёная рыба и др.) может
снизить гипотензивный эффект антигипертензивных ЛС (диуретиков, β-адреноблокаторов, блокаторов медленных кальциевых каналов, ингибиторов АПФ и др.). Богатые калием продукты (сухофрукты, абрикосы, картофель «в мундире», бананы, фиги, апельсиновый сок и др.) могут спровоцировать гиперкалиемию при применении спиронолактона, ингибиторов АПФ, антагонистов ангиотензиновых рецепторов.
Таким образом, пища может оказывать разнообразное влияние на фармакокинетику и фармакодинамику ЛС, что необходимо учитывать при проведении фармакотерапии (табл. 5-7).
Таблица 5-7. Рекомендации по применению некоторых лекарственных средств в зависимости от при- ёма пищи
 5.5. ВЗАИМОДЕЙСТВИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ С ТАБАКОМ
5.5. ВЗАИМОДЕЙСТВИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ С ТАБАКОМ
По распространённости курения Россия занимает одно из первых мест в мире. Среди мужского населения распространённость курения составляет 63,2%, среди женского - 9,7% (Оганов Р.Г. и др., 1998).
Табачный дым содержит более сотни различных химических соединений, оказывающих разнообразное воздействие на организм человека. Известно о влиянии компонентов табачного дыма на фармакокинетику и фармакодинамику некоторых ЛС, которое необходимо учитывать при проведении фармакотерапии у курильщиков. Наибольшее влияние на фармакокинетику ЛС оказывают ПАУ табачного дыма. Фармакокинетическое взаимодействие ЛС с ПАУ осуществляется на уровне биотрансформации, так как ПАУ индуцируют изофермент цитохрома Р-450 1А1 (локализован в лёгких) и 1А2 (локализован в печени). Клиническое значение имеет индукция под действием ПАУ изофермента цитохрома Р-450 1А2 в печени, при этом ускорятся биотрансформация субстратов этого изофермента: теофиллина, мексилетина, кофеина, пентазоцина, пропранолола, флекаинида*, эстрадиола и ряда психотропных препаратов (табл. 5-8), что приводит к снижению их концен-
Таблица 5-8. Психотропные лекарственные средства, биотрансформация которых индуцируется под действием полициклических ароматических углеводородов табачного дыма
Антипсихотики Антидепрессанты Анксиолитики | ||
Галоперидол Клозапин Флуфеназин Хлорпромазин Хлорпротиксен | Имипрамин Кломипрамин | Алпразолам Диазепам Лоразепам |
трации в крови и уменьшению фармакологической эффективности. Это требует назначения курильщикам этих ЛС в больших дозах.
Из всех компонентов табака наиболее значимое воздействие на фармакодинамику ЛС оказывает никотин. Известно непрямое фармакодинамическое взаимодействие β-адреноблокаторов с никотином. Никотин стимулирует Н-холинорецепторы клеток мозгового слоя надпочечников и симпатических ганглиев и вызывает высвобождение адреналина и норадреналина. При этом действие β-адреноблокаторов может нивелироваться, что уменьшает гипотензивный и антиангинальный эффект и требует повышения дозы β-адреноблокаторов. С непрямым фармакодинамическим взаимодействием наркотических анальгетиков и никотина связывают иногда недостаточный обезболивающий эффект этих ЛС у курильщиков.
5.6. ВЗАИМОДЕЙСТВИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ С ФИТОПРЕПАРАТАМИ
По данным разных авторов, от 20 до 30% больных, длительно получающих те или иные ЛС, дополнительно самостоятельно принимают различные безрецептурные лекарственные препараты и биологически активные добавки, содержащие растительное сырьё (фитопрепараты). Из них лишь 20-25% сообщают об этом своему лечащему врачу. Взаимодействие ЛС с лекарственными растениями изучено не достаточно. Опубликованы отдельные сообщения о клинически значимых взаимодействиях подобного рода. По некоторым данным, побочные эффекты при совместном применении ЛС и фитопрепаратов встречаются в 16% случаев, однако точной информации о частоте и характере взаимодействий ЛС с фитопрепаратами нет.
Для предупреждения развития нежелательных лекарственных реакций и предотвращения снижения эффективности ЛС, которые могут стать следствием подобных взаимодействий, при проведении фармакотерапии врач должен активно собирать информацию у больного о применении им фитопрепаратов.
Взаимодействие ЛС с фитопрепаратами может быть как фармакокинетическим, так и фармакодинамическим и осуществляться на различных уровнях. Наиболее хорошо изучено фармакокинетическое взаимодействие между ЛС и фитопрепаратами на уровне биотрансформации. В исследованиях in vitro и in vivo продемонстрировано влияние различных лекарственных растений на активность изоферментов цитохрома Р-450 (ингибирование и индукция). Фитопрепараты, содержащие перечисленные в табл. 5-9 растения, влияют на фармакокинетику ЛС, метаболизирующихся данными изоферментами.
Таблица 5-9. Лекарственные растения, влияющие на активность изофермента цитохрома P-450
 Продолжение табл. 5-9
Продолжение табл. 5-9
 Окончание табл. 5-9
Окончание табл. 5-9
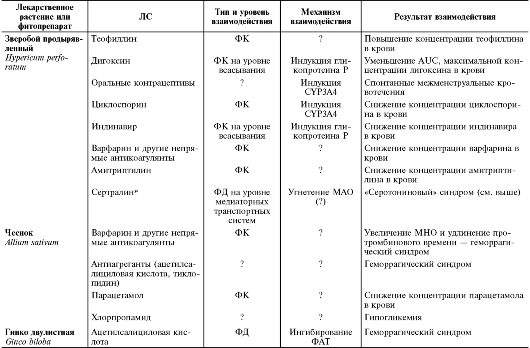
 В
половине случаев побочные эффекты возникают при совместном применении
ЛС с фитопрепаратами, содержащими зверобой. Зверобоя продырявленного
трава снижает эффективность дигоксина, непрямых антикоагулянтов,
циклоспорина, амитриптилина, индинавира. Возможно повышение концентрации
теофиллина в крови, высок риск кардиотоксического эффекта. При приёме
антидепрессантов из группы ингибиторов обратного захвата серотонина
больным категорически противопоказаны препараты зверобоя. При назначении
непрямых антикоагулянтов и антиагрегантов с препаратами Гинго
двулистной, чеснока или дягиля следует соблюдать особую осторожность и
тщательно контролировать показатели свёртывания крови (МНО, АЧТВ), так
как подобные комбинации могут привести к геморрагическим осложнениям.
Многие фитопрепараты (особенно выпускаемые как «таблетки для похудания»)
содержат слабительные лекарственные растения (сенна, сабур, крушина,
жостер, алоэ), при этом увеличение скорости пассажа кишечного
содержимого может уменьшить биодоступность многих ЛС и снизить
эффективность фармакотерапии.
В
половине случаев побочные эффекты возникают при совместном применении
ЛС с фитопрепаратами, содержащими зверобой. Зверобоя продырявленного
трава снижает эффективность дигоксина, непрямых антикоагулянтов,
циклоспорина, амитриптилина, индинавира. Возможно повышение концентрации
теофиллина в крови, высок риск кардиотоксического эффекта. При приёме
антидепрессантов из группы ингибиторов обратного захвата серотонина
больным категорически противопоказаны препараты зверобоя. При назначении
непрямых антикоагулянтов и антиагрегантов с препаратами Гинго
двулистной, чеснока или дягиля следует соблюдать особую осторожность и
тщательно контролировать показатели свёртывания крови (МНО, АЧТВ), так
как подобные комбинации могут привести к геморрагическим осложнениям.
Многие фитопрепараты (особенно выпускаемые как «таблетки для похудания»)
содержат слабительные лекарственные растения (сенна, сабур, крушина,
жостер, алоэ), при этом увеличение скорости пассажа кишечного
содержимого может уменьшить биодоступность многих ЛС и снизить
эффективность фармакотерапии.
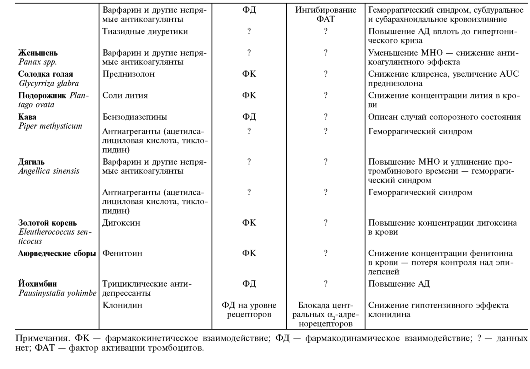
Некоторые известные клинически значимые взаимодействия ЛС с лекарственными растениями приведены в табл. 5-10.
5.7. ВЗАИМОДЕЙСТВИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
С ЭТАНОЛОМ
В России сохраняется высокий уровень потребления этанола (алкоголь, спирт этиловый), который составляет 7,57 л в год в пересчёте на абсолютный алкоголь на душу населения (Кошкина Е.А., 1999). По данным МЗ РФ, 20% населения России подвержено бытовому пьянству, а 1,5% - страдает алкоголизмом (МЗ РФ, 2000). Известно, что взаимодействие ЛС с этанолом может привести к серьёзным осложнениям, и даже к летальному исходу. Этанол может вступать как в фармакокинетическое, так и в фармакодинамическое взаимодействие
с ЛС.
Фармакокинетическое взаимодействие лекарственных средств с этанололом
Фармакокинетическое взаимодействие ЛС с этанолом происходит, в основном, на уровне биотрансформации. При этом как ЛС могут вмешиваться в метаболизм этанола, так и сам этанол влияет на биотрансформацию ЛС. Этанол метаболизируется по трём направлениям преимущественно в печени. Основной путь биотрансформации этанола - окисление в цитозоле гепатоцитов с помощью алкогольдегид-
Таблица 5-10. Некоторые описанные клинически значимые взаимодействия лекарственных средств с лекарственными растениями
 Окончание табл. 5-10
Окончание табл. 5-10
 рогеназы
до ацетальдегида, который затем под влиянием ацетальдегиддегидрогеназы
превращается в уксусную кислоту, быстро «сгорающую» в цикле Кребса. Этим
путём метаболизируется 70-80% этанола. Лишь 5-10% этанола окисляется в
эндоплазматическом ретикулуме гепатоцитов при участии изофермента
цитохрома Р-450 2Е1. Некоторые ЛС ингибируют ацетальдегиддегидрогеназу и
вызывают «синдром ацетальдегида», проявляющийся бурными вегетативными
реакциями (покраснение кожи, чувство жара, озноб, ощущение стеснения в
груди, затруднение дыхания, шум в голове, учащение сердцебиения и др.) и
чувством страха. К таким ЛС относятся: метронидазол, хлорамфеникол,
фуразолидон, цефалоспорины (цефамандол, цефоперазон), противогрибковые
лекарственные препараты - производные имидазола (клотримазол,
кетоконазол и др.). При проведении фармакотерапии перечисленными ЛС
следует предупредить больного о недопустимости приёма алкогольных
напитков, а также лекарственных форм, содержащих этанол (настойки, капли
и др.), в течение всего периода лечения и последующих трёх дней после
его окончания. «Синдром ацетальдегида» развивается и при применении
дисульфирама (тетурам*, антабус*) на фоне приёма алкоголя. Этот эффект
дисульфирама лежит в основе одного из методов лечения алкоголизма (метод
сенсибилизирующей терапии).
рогеназы
до ацетальдегида, который затем под влиянием ацетальдегиддегидрогеназы
превращается в уксусную кислоту, быстро «сгорающую» в цикле Кребса. Этим
путём метаболизируется 70-80% этанола. Лишь 5-10% этанола окисляется в
эндоплазматическом ретикулуме гепатоцитов при участии изофермента
цитохрома Р-450 2Е1. Некоторые ЛС ингибируют ацетальдегиддегидрогеназу и
вызывают «синдром ацетальдегида», проявляющийся бурными вегетативными
реакциями (покраснение кожи, чувство жара, озноб, ощущение стеснения в
груди, затруднение дыхания, шум в голове, учащение сердцебиения и др.) и
чувством страха. К таким ЛС относятся: метронидазол, хлорамфеникол,
фуразолидон, цефалоспорины (цефамандол, цефоперазон), противогрибковые
лекарственные препараты - производные имидазола (клотримазол,
кетоконазол и др.). При проведении фармакотерапии перечисленными ЛС
следует предупредить больного о недопустимости приёма алкогольных
напитков, а также лекарственных форм, содержащих этанол (настойки, капли
и др.), в течение всего периода лечения и последующих трёх дней после
его окончания. «Синдром ацетальдегида» развивается и при применении
дисульфирама (тетурам*, антабус*) на фоне приёма алкоголя. Этот эффект
дисульфирама лежит в основе одного из методов лечения алкоголизма (метод
сенсибилизирующей терапии).
Влияние этанола на биотрансформацию ЛС неоднозначно. При однократном приёме этанола в больших дозах неспецифически ингибируются изоферменты цитохрома Р-450. В результате однократного приёма большой дозы этанола угнетается биотрансформация непрямого антикоагулянта варфарина за счёт ингибирования изофермента цитохрома Р-450 2С9. Это приводит к повышению концентрации варфарина в плазме крови и усилению антикоагулянтного эффекта. В результате увеличивается риск геморрагических осложнений.
С другой стороны, длительное применение этанола вызывает индукцию изоферментов цитохрома Р-450. При этом могут индуцироваться все изоферменты цитохрома Р-450, но наиболее сильно - изофермент цитохрома Р-450 2Е1. Так, за счёт индукции изофермента цитохрома Р-450 2С9 равновесная концентрация варфарина снижается, что уменьшает выраженность антикоагулянтного эффекта и требует коррекции дозы этого ЛС. При длительном применении этанола аналогично изменяется фармакокинетика и других ЛС [андрогены, анаболические стероиды, фенитоин (дифенин*) и др.]. Известно, что гепатотоксическое действие парацетамола усиливается при хроническом употреблении этанола. Это объясняют тем, что этанол индуцирует изофермент цитохрома Р-450 2Е1, увеличивает долю окислительного пути метабо-
лизма парацетамола до гепатотоксичного метаболита N-ацетилбензохи- нонимина (см. главу 1 «Клиническая фармакокинетика»).
Следует отметить, что необходимая для ингибирования биотрансформации ЛС доза этанола при его однократном приёме сугубо индивидуальна и варьирует в широких пределах. Это же можно сказать и о дозах этанола, необходимых для индукции биотрансформации ЛС, при длительном его употреблении.
Фармакодинамическое взаимодействие лекарственных средств с алкоголем
Наибольшее клиническое значение имеет непрямое фармакодинамическое взаимодействие этанола и лекарственных препаратов, оказывающее влияние на ЦНС, функциональную систему регуляции величины АД, систему гемостаза.
Влияние взаимодействия этанола с ЛС на ЦНС проявляется потенцированием подавляющего эффекта, вплоть до угнетения дыхания. Такое воздействие на фоне употребления этанола могут оказать наркотические анальгетики, трициклические антидепрессанты, барбитураты, бензодиазепины, блокаторы Н1-рецепторов гистамина (обладающие седативным эффектом), гризеофульвин, кетотифен, метоклопрамид, антипсихотические и противосудорожные ЛС. Пациентам, применяющим перечисленные ЛС, следует полностью исключить потребление этанола в течение всего периода лечения.
Влияние взаимодействия этанола с ЛС на функциональную систему регуляции АД проявляется в потенцировании гипотензивного эффекта, вплоть до коллапса. Такое взаимодействие развивается при одновременном употреблении с этанолом клонидина, нифедипина, β-адреноблокаторов, нитратов. Особенно опасно (из-за возможности развития коллапса и летального исхода) взаимодействие этанола с клонидином. Следует предупредить больного о недопустимости совместного приёма клонидина с алкогольными напитками.
В результате взаимодействия этанола с ЛС может нарушаться функционирование системы гемостаза. Ацетилсалициловая кислота, тиклопидин и клопидогрел могут потенцировать антиагрегантный эффект и вызывать геморрагические осложнения.
Следует также упомянуть о возможности возникновения гипогликемии при взаимодействии этанола с дизопирамидом.
5.8. ФАКТОРЫ РИСКА ВЗАИМОДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Риск возникновения опасных взаимодействий ЛС зависит от многих факторов: возраст больного, сопутствующие заболевания, полипрагмазия, терапевтическая широта применяемых ЛС и др.
Возраст больного
Нежелательные эффекты лекарственного взаимодействия чаще возникают в «крайних» возрастных группах - у пожилых людей и новорож- дённых. Это можно объяснить особенностями фармакокинетики ЛС в этом возрасте. Процессы всасывания, биотрансформации, распределения и выведения ЛС у новорождённых ещё несовершенны, а у пожилых - замедлены из-за возрастных изменений функций ЖКТ, печени, почек. ЦНС у пожилых более чувствительна к наркотическим анальгетикам и бензодиазепинам, а кишечник и мочевой пузырь - к блокаторам холинергических рецепторов. У этой группы пациентов, как правило, много сопутствующих заболеваний, для лечения которых они принимают большее количество ЛС (полипрагмазия, см. ниже). В связи с этим следует более тщательно подбирать режим дозирования ЛС и контролировать состояние пожилых пациентов и новорождённых, чтобы не допустить развитие опасных эффектов лекарственных взаимодействий.
Сопутствующие заболевания
Риск развития опасных взаимодействий ЛС резко увеличивается при некоторых сопутствующих заболеваниях и состояниях. Это обусловлено несколькими причинами:
• при ХСН, а также заболеваниях печени и почек изменяется фармакокинетика ЛС, прежде всего вследствие поражения слизистой оболочки кишечника, эпителия почек и паренхимы печени, угнетения синтеза белков крови;
• при эпилепсии, сахарном диабете, системных заболеваниях соединительной ткани, маниакально-депрессивном психозе, туберкулёзе и других хронических или длительно протекающих заболеваниях больной в течение длительного времени принимает ЛС, наиболее часто вызывающие нежелательные эффекты фармакокинетического взаимодействия (индукторы и ингибиторы ферментов метаболизма, конкурирующие за связь с белками крови препараты и др.).
Полипрагмазия
Это вид фармакотерапии, при которой необоснованно назначают большое число ЛС. Риск развития опасных взаимодействий ЛС рез-
ко повышается при назначении сразу нескольких ЛС. Если больному назначают 2 ЛС, то вероятность развития нежелательных эффектов лекарственного взаимодействия составляет 3-5%, а если 10 ЛС - не менее 20%.
Например, если на фоне приёма непрямого антикоагулянта варфарина (метаболизируется изоферментами цитохрома Р-450 1А2 и 2С9) назначить ципрофлоксацин (ингибитор изофермента цитохрома Р-450 1А2) или циметидин (ингибитор изофермента цитохрома Р-450 2С9), то это вряд ли привёдет к появлению клинически значимого взаимодействия. Если же назначены все три вышеперечисленных ЛС, то резко усилится действие варфарина, а это чревато развитием серьёзных геморрагических осложнений.
Терапевтическая широта лекарственных средств
Риск развития эффектов опасного фармакокинетического взаимодействия ЛС больше, если лекарственные препараты имеют небольшую терапевтическую широту (узкий терапевтический диапазон). К таким ЛС относятся аминогликозиды, непрямые антикоагулянты, сердечные гликозиды, противоэпилептические препараты, трициклические антидепрессанты, соли лития, некоторые антиаритмические средства, теофиллин (табл. 5-11). Даже небольшое повышение концентрации таких ЛС в крови может привести к серьёзным побочным эффектам, вплоть до интоксикации. Особенно часто опасные взаимодействия ЛС возникают при применении высоких терапевтических доз ЛС с узким терапевтическим диапазоном. Для повышения безопасности фармакотерапии ЛС с узким терапевтическим диапазоном следует постоянно контролировать их равновесную концентрацию в крови (осуществлять терапевтический лекарственный мониторинг).
Фармакогенетические факторы
Известно существование межиндивидуальных различий фармакологического ответа на некоторые ЛС, связанные с генетически обусловленными изменениями фармакокинетики и фармакодинамики (см. главу 7 «Клиническая фармакогенетика»). В основе этих изменений лежат спонтанно возникающие и передающиеся из поколения в поколение мутации генов белков, ответственных за фармакокинетику и фармакодинамику ЛС. Этот феномен получил название генетического полиморфизма. Наибольшее клиническое значение имеет генетический полиморфизм ферментов биотрансформации ЛС.
Носителей «медленных» аллелей генов, кодирующих изоферменты цитохрома Р-450 2D6, 2C9, 2C19, принято считать «медленными метаболизаторами» ЛС (субстратов соответствующих изоферментов). Оче-
Таблица 5-11. Лекарственные средства с узким терапевтическим диапазоном
 видно,
что именно у этой категории больных максимально высокий риск
возникновения нежелательных эффектов взаимодействия ЛС. Для
предупреждения таких потенциально опасных взаимодействий ЛС в будущем
будут использовать методы генотипирования (выявление мутантных аллелей
методом ПЦР).
видно,
что именно у этой категории больных максимально высокий риск
возникновения нежелательных эффектов взаимодействия ЛС. Для
предупреждения таких потенциально опасных взаимодействий ЛС в будущем
будут использовать методы генотипирования (выявление мутантных аллелей
методом ПЦР).
Знание основных механизмов взаимодействия ЛС, учёт факторов риска их опасных взаимодействий при проведении фармакотерапии, а также чётко отлаженная система информирования о клинически значимых взаимодействиях лекарственных препаратов позволяют повысить эффективность и безопасность проводимой фармакотерапии.