Клиническая фармакология.: учебник для вузов / Под ред. В.Г. Кукеса.- 4-е издание., перераб. и доп., - 2009. - 1056 с.
|
|
|
|
ГЛАВА 17. ПРОТИВОВОСПАЛИТЕЛЬНЫЕ АНТИАСТМАТИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА
В настоящее время бронхиальную астму рассматривают как хроническое персистирующее заболевание дыхательных путей, в патогенезе которого участвуют тучные клетки, эозинофилы и Т-лимфоциты. С этих позиций ЛС, блокирующие определённые звенья процесса воспаления, нашли широкое применение в лечении и профилактике бронхиальной астмы. К ЛС этой подгруппы относят:
• ГКС;
• стабилизаторы мембран тучных клеток;
• антигистаминные препараты;
• блокаторы лейкотриеновых рецепторов.
ГКС обладают выраженным противовоспалительным и мембраностабилизирующим действием. Пероральная, парентеральная и ингаляционная формы ГКС применяются по показаниям при всех стадиях бронхообструктивного синдрома.
17.1. ИНГАЛЯЦИОННЫЕ ГЛЮКОКОРТИКОИДЫ
Механизм действия и основные фармакодинамические эффекты
ГКС для местного (ингаляционного) применения оказывают противовоспалительное, противоаллергическое и иммунодепрессивное действие, повышают продукцию липокортина, являющегося ингибитором фосфолипазы А, тормозят освобождение арахидоновой кислоты, угнетают синтез продуктов метаболизма арахидоновой кислоты - циклических эндоперекисей и простагландинов. Эти препараты уменьшают воспалительную экссудацию и продукцию лимфокинов; тормозят высвобождение из тучных клеток медиаторов воспаления, увеличивают количество активных β-адренорецепторов, устраняя их десенситизацию (восстанавливают реакцию на бронходилататоры, позволяя уменьшить частоту их применения), уменьшают отёк слизистой бронхов, продукцию слизи, улучшают мукоцилиарный транспорт.
В отличие от ГКС для приёма внутрь, препараты, назначаемые в виде ингаляций, обладают более высокой селективностью (по отношению к ткани лёгкого), более выраженной противовоспалительной и
минимальной минералокортикоидной активностью. Основным фактором, определяющим эффективность и безопасность ингаляционных ГКС, является селективность препарата по отношению к дыхательным путям - наличие высокой местной противовоспалительной активности и низкой системной активности.
ГКС, применяемые ингаляционно, обладают различной активностью, поэтому их эквивалентные (вызывающие одинаковый эффект) дозы существенно различаются (табл. 17-1), что следует помнить при переходе от одного ЛС к другому. Активность ЛС этой группы зависит в первую очередь от аффинности к ГКС-рецепторам и от фармакокинетических параметров (табл. 17-2).
Таблица 17.1. Эквивалентные дозы ингаляционных ГКС для терапии бронхиальной астмы у взрослых
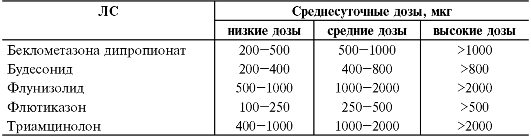 Ингаляционные
ГКС в настоящее время являются наиболее эффективными препаратами для
базовой, поддерживающей терапии бронхиальной астмы (БА). Их применение
основано на активном местном противовоспалительном действии. Кроме того,
при использовании в течение нескольких месяцев у больных бронхиальной
астмой они уменьшают гиперреактивностъ дыхательных путей, ослабляя
спазмогенные влияния многих биологически активных веществ (гистамин и
др.), холодного и сырого воздуха, двуокиси углерода. Эффект
ингаляционных ГКС при БА имеет дозозависимый характер. Отмена ГКС может
привести к ухудшению течения заболевания.
Ингаляционные
ГКС в настоящее время являются наиболее эффективными препаратами для
базовой, поддерживающей терапии бронхиальной астмы (БА). Их применение
основано на активном местном противовоспалительном действии. Кроме того,
при использовании в течение нескольких месяцев у больных бронхиальной
астмой они уменьшают гиперреактивностъ дыхательных путей, ослабляя
спазмогенные влияния многих биологически активных веществ (гистамин и
др.), холодного и сырого воздуха, двуокиси углерода. Эффект
ингаляционных ГКС при БА имеет дозозависимый характер. Отмена ГКС может
привести к ухудшению течения заболевания.
Фармакокинетика
Препараты для ингаляционного применения выпускаются в виде аэрозолей, сухой пудры с соответствующими устройствами для их употребления, а также в виде растворов или суспензий для применения с помощью небулайзеров.
При ингаляционном пути введения в лёгких осаждается приблизительно 10-30% от номинальной дозы. Доля препарата, поступающего в лёгкие, зависит от строения молекулы препарата, её величины и от системы его доставки в дыхательные пути. Большая часть дозы ингаляционных ГКС проглатывается, абсорбируется из желудочно-кишечного тракта
и быстро разрушается благодаря эффекту «первого прохождения» через печень. Таким образом, количество препарата, поступающего в кровоток из ЖКТ, невелико. Ингаляционные ГКС могут попадать в системный кровоток путём адсорбции части дозы в дыхательных путях, при этом препарат поступает в системный кровоток, минуя печень. На абсорбцию ингаляционных ГКС в дыхательных путях оказывает влияние размер ингалируемых частиц. Частицы размером менее 0,3 мкм легко откладываются в альвеолах, где быстро всасываются в кровь. Ингаляционные ГКС имеют довольно высокую связь с белками плазмы. Скорость их элиминации из организма сравнительно велика, благодаря чему обеспечивается минимальная выраженность системных побочных эффектов.
Фармакокинетические свойства ингаляционных ГКС на уровне тканей преимущественно определяются их липофильностью. Липофильность ЛС этой группы лежит в основе их селективности и определяет высокую степень адсорбции ингаляционных ГКС в дыхательных путях, замедляет их высвобождение из тканей, увеличивает сродство и продолжительность связи с ГКС-рецептором.
Таблица 17-2. Относительная аффинность ингаляционных ГКС по отношению к ГКС-рецепторам и их основные фармакокинетические параметры
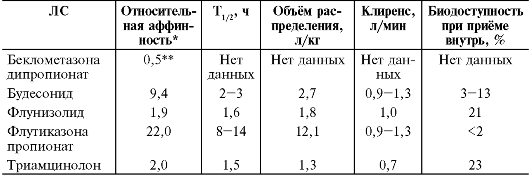 * За 1 принята аффинность связи дексаметазона.
* За 1 принята аффинность связи дексаметазона.
** Беклометазона дипропионат обладает низкой аффинностью по отношению к рецептору, однако его активный метаболит - беклометазона монопропионат обладает относительной аффинностью, оцениваемой как 13,0.
В наибольшей степени липофильность проявляется у флутиказона пропионата, далее у беклометазона дипропионата, будесонида, а триамцинолон ацетонид и флунизолид являются водорастворимыми препаратами. Высоколипофильные ингаляционные ГКС быстрее и лучше адсорбируются на поверхности клеток бронхиального эпителия и более длительное время задерживаются в тканях дыхательных путей. О высокой селективности будесонида свидетельствует то, что его концентрация в дыхательных путях через 1,5 ч после ингаляции в 8 раз превышает концентрацию в плазме крови.
Более липофильные ингаляционные ГКС могут откладываться на слизистой дыхательных путей в виде «микродепо»-препаратов и увеличивать продолжительность местных противовоспалительных эффектов. Например, продолжительность процесса растворения кристаллов липофильных ЛС: беклометазона дипропионата и флютикасона пропионата - в бронхиальной слизи превышает 5-8 ч, а у таких гидрофильных препаратов, как будесонид и флунизолид, составляет 6 и 2 мин соответственно.
В отличие от других ингаляционных ГКС будесонид способен образовывать внутриклеточные конъюгаты с жирными кислотами. Конъюгированный будесонид гидролизуется внутриклеточными липазами, постепенно высвобождая свободный и фармакологически активный будесонид, что может удлинить глюкокортикоидную активность препарата.
Если будесонид приблизительно в 40 раз менее липофилен, чем беклометазона дипропионат, то липофильность конъюгатов будесонида с жирными кислотами в десятки раз превышает липофильность интактного будесонида, чем и объясняется длительность пребывания будесонида в тканях дыхательных путей.
Побочные эффекты
Проявления системных эффектов ингаляционных ГКС определяются их фармакокинетикой и зависят от доли препарата, поступающей в системный кровоток (системная биодоступность), а также от величины клиренса ГКС.
Ингаляционные глюкокортикоиды практически не вызывают системных нежелательных реакций. Только при длительном использовании в высоких суточных дозах они могут угнетать гипоталамо-гипофизарно-надпочечниковую систему. Кроме того, возможно развитие остеопороза и задержки роста у детей.
Местные побочные эффекты отмечаются редко, как правило, в виде дисфонии и кандидоза полости рта.
Факторами риска развития кандидоза являются неправильное пользование ингалятором, пожилой возраст, ингаляции более двух раз в день, одновременное применение антибиотиков и/или ГКС внутрь. Меры профилактики включают в себя полоскание полости рта и горла после ингаляции, использование спейсера.
Основные проявления синдрома отмены ГКС связаны с вызываемой ими недостаточностью гипоталамо-гипофизарной системы: это недомогание, головная боль, депрессия, артралгия, миалгия, боль в животе, отсутствие аппетита, тошнота, рвота, гипотензия, слабость, ухудшение течения БА и усиление других аллергических проявлений.
Для ослабления побочного действия ГКС ряд авторов рекомендуют принимать ГКС по альтернирующей схеме (например, через день).
В большинстве случаев нежелательные эффекты ГКС-терапии поддаются коррекции и не требуют отмены препарата. Однако такие побочные действия, как задержка роста, остеопороз, катаракта, необратимы даже при отмене гормонов. У больных, получающих непрямые антикоагулянты, одновременный приём системных ГКС может приводить к развитию язв желудка и кровотечений.
Противопоказания
Гиперчувствительность; туберкулёз легких (активная форма), грибковые инфекции органов дыхания, грибковые, бактериальные и вирусные инфекции органов дыхания и кожи. Туберкулёз кожи, кожные проявления сифилиса, опухоли кожи, эритематозные угри, обыкновенный лишай, розацеа, периоральный дерматит, ветряная оспа, беременность, период лактации.
Взаимодействие
Имеются данные о влиянии фенобарбитала и фенитоина на метаболизм ГКС. Эти препараты повышают активность печёночных микросомальных ферментов, участвующих в метаболизме ГКС, что приводит к снижению их эффективности. Такое же действие оказывает одновременное назначение салицилатов и кумариновых антикоагулянтов. Эритромицин вызывает увеличение концентрации ГКС в крови.
17.2. СТАБИЛИЗАТОРЫ МЕМБРАН ТУЧНЫХ КЛЕТОК (КРОМОГЛИКАТ НАТРИЯ, НЕДОКРОМИЛ НАТРИЯ)
Механизм действия и основные фармакодинамические эффекты
Препараты не оказывают прямого действия на гладкую мускулатуру бронхов. Блокируя вход ионов кальция в тучную клетку, эти препараты предотвращают высвобождение гистамина, в меньшей степени лейкотриенов, ингибируют фосфодиэстеразу, что ведёт к накоплению цАМФ, снижению сократимости миофибрилл, уменьшению чувствительности тучных клеток к действию дегранулирующих агентов и предотвращению высвобождения из них медиаторов анафилаксии.
Недокромил натрия (тайлед) и кромогликат натрия (интал) дозозависимым образом частично подавляют IgE-опосредованный выход
гистамина, лейкотриена С4, простагландина D2 и других биологически активных веществ из тучных клеток и оказывает супрессивный эффект на другие «клетки воспаления» эозинофилов, нейтрофилов, макрофилов, тромбоцитов, лимфоцитов. Эти ЛС предупреждают развитие аллергической реакции немедленного типа, обусловленной выделением медиаторов анафилаксии в результате контакта сенсибилизированной тучной клетки с соответствующим аллергеном. Аналогичный эффект наблюдается и при поздней иммунологической реакции, он связан с предотвращением высвобождения гистамина и лейкотриенов из сенсибилизированных тучных клеток. Поскольку фармакологический эффект ЛС этой группы проявляется до взаимодействия антигена с антителом, их необходимо назначать профилактически. Кромогликат и недокромил натрия улучшают клиническую симптоматику, частоту обострения, приводят к увеличению ОФВ1; эффективность этих препаратов меньше, чем ингаляционных ГКС (уровень доказательности В). Противовоспалительная активность недокромила натрия выше, чем кромогликата натрия, в 4-10 раз; кроме того, это ЛС более эффективно предупреждает бронхоспастические реакции, вызываемые различными химическими агентами, холодным воздухом и др. Кромогликат натрия более эффективен у больных молодого возраста без деструктивных изменений в лёгких.
Фармакокинетика
Кромогликат натрия практически применяется в виде порошка для ингаляции или раствора в дозированных аэрозолях. Абсорбированная часть не подвергается биотранформации и выводится в течение суток также в неизменённом виде, в основном с мочой. После однократной ингаляции кромогликата натрия (20 мг) пик концентрации в крови достигается через 15 мин. В течение часа концентрация снижается с 80 до 10 пг/мл. После ингаляции 40 мг концентрация в крови составляет 225 пг/мл через 15 мин и 20 пг/мл через 1 ч; через 2 ч препарат в крови не определяют. Период полувыведения равен 80 мин; действие продолжается до 4-6 ч. Максимальный эффект отмечают в первые 2 ч после ингаляции. После внутривенного введения 4 мг препарата максимальная концентрация в сыворотке составляет 3 пг/мл, сохраняется в течение 20 мин, а затем снижается. Через 8 ч она составляет только 10%. Т1/2 равен 54 мин при введении в/в; 138 мин - при ингаляции и 20 ч - при приёме внутрь. Недокромил натрия связывается с белками крови на 80%, не подвергается метаболизму в печени и выводится из организма в неизменённом виде с мочой (64%) и с жёлчью (30%) в течение 96 ч.
Показания к применению и режим дозирования
Показания к применению: лёгкая персистирующая бронхиальная астма, астма физического напряжения, аллергический ринит, аллергический конъюнктивит; пищевая аллергия и аллергические заболевания ЖКТ (внутрь); профилактика бронхоспастических реакций, вызываемых химическими, газообразными веществами, пылью, холодным воздухом и др. Рекомендуют длительный регулярный приём кромогликата натрия в дозе 20-40 мг 4 раза в день в порошках (капсулы для спинхайлера содержат 20 мг препарата) или в дозированных аэрозолях (бихромат) (1 вдох - 5 мг и 1 мг) по 2 вдоха 3 раза в день или недокромила натрия в дозированных аэрозолях по 20 мг 4 раза в день. После снижения частоты приступов рекомендовано уменьшение числа приёмов препаратов в день.
Побочные эффекты и противопоказания к назначению
Препараты характеризуются хорошей переносимостью. В редких случаях (менее 2%) они вызывают раздражение слизистой оболочки горла и трахеи, сухость во рту, охриплость голоса, особенно на фоне местных инфекций. В начале лечения возможно появление быстро проходящего бронхоспазма после ингаляций сухого порошка. Недокромил натрия может вызывать симптомы раздражения слизистой оболочки горла и трахеи и бронхоспазм, которые устраняются предварительной (за 15-20 мин) ингаляцией β2-адреномиметиков и приёмом небольшого количества воды после этого. Описаны единичные случаи развития дерматитов, миозитов, гастроэнтеритов и аллергических реакций на кромогликат натрия. Противопоказаниями к назначению препаратов являются индивидуальная непереносимость, I триместр беременности; для кромогликата натрия и недокромила натрия - астматический статус. Кетотифен назначают с осторожностью больным, у которых работа связана с концентрацией внимания.
Взаимодействие
Кромогликат натрия и недокромил натрия оказывают более сильное действие при предварительном купировании бронхоспазма адреномиметиками. Кетотифен усиливает седативный эффект препаратов, угнетающих ЦНС.
17.3. КЕТОТИФЕН
Механизм действия и фармакодинамические эффекты
Кетотифен (задитен) обладает подобным кромогликату натрия механизмом действия, а также блокирует Н1-рецепторы гистамина. Ос-
новные эффекты - подавление острого бронхоспазма и проявлений бронхиальной гиперреактивности в ответ на фактор, активирующий тромбоциты (ФАТ); угнетение накопления эозинофилов в дыхательных путях, вызванного ФАТ; подавление выброса медиаторов воспаления (гистамин, лейкотриены); предупреждение острого бронхоспазма, вызванного лейкотриенами. Клиническая эффективность проявляется через 2 мес приёма: препарат снимает такие проявления заболевания, как кашель и приступы удушья, приводит к увеличению объёма форсированного выдоха. При оценке эффективности профилактического приёма кетотифена и азеластина у больных бронхиальной астмой показано, что азеластин в дозе 8 мг/сут был так же эффективен, как и кетотифен в дозе 1-2 мг/сут. По воздействию на отдельные симптомы астмы кетотифен сравним по активности с лоратадином, но уступает астемизолу. Кетотифен также обладает мощным и продолжительным блокирующим действием на Н2-рецепторы.
Фармакокинетика
После перорального приёма кетотифен практически полностью всасывается. Биодоступность составляет примерно 50% за счёт эффекта первого прохождения через печень. Максимальная концентрация в плазме крови достигается через 2 ч, период полувыведения 21 ч, связывание с белками - 75%. Характер метаболизма у детей такой же, как и у взрослых, однако клиренс более высокий. Антигистаминные препараты метаболизируются с участием цитохрома Р-450, продолжительность действия терфенадина и астемизола 12 ч.
Показания к применению и режимы дозирования
Кетотифен применяют для предупреждения астматических приступов у больных преимущественно аллергической астмой, при сопутствующих аллергических проявлениях другой локализации, а также для лечения и профилактики собственно аллергических заболеваний. При лечении больных с аллергическим конъюнктивитом, круглогодичным и сезонным аллергическим ринитом кетотифен не менее эффективен, чем кромогликат натрия и терфенадин, и более активен, чем клемастин. Антигистаминные препараты оказывают небольшой положительный эффект у больных с бронхиальной астмой с сопутствующим аллергическим ринитом (уровень доказательности В).
Побочные эффекты и противопоказания к назначению
Иногда наблюдается седативный эффект, который уменьшается при дальнейшем приёме препарата. Кетотифен может вызвать сонливость, сухость во рту, снижение секреции бронхиальных желёз. Кроме того,
у 2% больных возможно головокружение, проходящее при длительном приёме, а также сухость во рту. Препарат может повышать аппетит. Терфенадин и астемизол могут вызвать кардиотоксические побочные эффекты в виде нарушений сердечного ритма; сонливость, головная боль, головокружение, диспепсия возникают редко. При приёме астемизола возможны парестезии, миалгии, судороги.
Взаимодействия
При комбинации кетотифена и теофиллина резко увеличивается эффективность последнего при лечении больных бронхиальной астмой и уменьшается потребность в ингаляционных бронходилататорах. Не рекомендован приём кетотифена с седативными препаратами. При назначении терфенадина или астемизола совместно с макролидами (эритромицин, олеандомицин, азитромицин, кларитромицин), противогрибковыми средствами (кетоконазол и интраконазол), антиаритмиками (хинидин, новокаинамид, дизопирамид), некоторыми антидепрессантами, а также у больных с хроническими заболеваниями печени и гиперкалиемией повышается риск нарушений сердечного ритма.
17.4. ИНГИБИТОРЫ ЛЕЙКОТРИЕНОВ
Лейкотриены (ЛТ) - медленно реагирующая субстанция анафилаксии. ЛТ (C4, D4 и E4) - это единственная группа медиаторов, вовлечённых в комплексный воспалительный процесс и приводящих к клиническим проявлениям астмы. Синтезируются под воздействием специфических стимулов: IgE, IgJ, эндотоксинов, факторов фагоцитоза. ЛТ - жирные кислоты, образующиеся из арахидоновой кислоты под влиянием 5-липооксигеназы (5-ЛО) и имеющие в положении 5 гидроксигруппу, а в положении 6 - несколько боковых серосодержащих цепей. Боковыми цепями могут быть глутатион (ЛТС4), цистеинилглицин (ЛТД4), или цистеин (ЛТЕ4). Сначала образуется ЛТА4, из него - ЛТВ4 и ЛТС4. ЛТС4 быстро выделяется во внеклеточную среду, где под влиянием глутамилтрансфераз превращается в ЛТД4, из которого под влиянием аминопептидаз или карбоксипептидаз (плазмы крови, лейкоцитов и других тканей) в конечном счёте образуется ЛТЕ4. Превращение ЛТС4 в ЛТД4 происходит в течение 3-5 мин, поэтому в первые 15 мин синтеза ЛТД4 является основным медиатором ЛТ, в то время как образование ЛТЕ4 - процесс более медленный. ЛТЕ4 - конечный метаболит, в значительных количествах выводится с мочой и жёлчью. Места синтеза ЛТ в организме человека - лёгкие, аорта и тонкий кишечник. Лейкотриены вырабатываются эозинофилами,
макрофагами, нейтрофилами, мононуклеарами, тучными клетками, базофилами. Эффекты лейкотриенов С4, D4, E4 - спазм гладкой мускулатуры бронхов, спазм сосудов и отёк слизистой бронхов, привлечение эозинофилов в очаг аллергического воспаления, повышение секреции слизи, снижение мукоцилиарного транспорта; лейкотриена В4 - хемотаксис эозинофилов, адгезия нейтрофилов к эндотелию, агрегация и высвобождение протеаз, повышение проницаемости капилляров. Лейкотриены В4, С4, D4, Е4 способствуют миграции клеток, участвующих в развитии воспалительного процесса (активированные Т-клетки, тучные клетки, эозинофилы), а также повышают активность фосфолипаз, способствуя тем самым дополнительному высвобождению арахидоновой кислоты, и стимулируют образование простагландинов и тромбоксана.
Выделено три основных типа рецепторов лейкотриенов:
• рецептор ЛТ1 к лейкотриенам C/D/E4 (опосредует бронхоконстрикторный эффект лейкотриенов);
• рецептор ЛТ2 к C/D/E4 (играет роль в контроле над сосудистой проницаемостью);
• рецептор ЛТВ4 (опосредует хемотаксический эффект лейкотриенов).
Классификация
Пути влияния на лейкотриены:
1. Антагонисты рецепторов лейкотриенов блокируют рецептор ЛТ1. К ним относятся зафирлукаст (акколат), монтелукаст (сингуляр), побилукаст, верлукаст, циналукаст, иралукаст, томелукаст и др. Зафирлукаст и монтелукаст зарегистрированы в России.
2. Ингибитор 5-липооксигеназы (5ЛО) - зилеутон (зифло). Не зарегистрирован в России.
Механизм действия
Механизм объясняется точкой их приложения: зафирлукаст и монтелукаст блокируют рецепторы лейкотриенов, а зилеутон ингибирует 5ЛО. Степень снижения астматического ответа на фоне этих препаратов трудно предсказать. Антилейкотриены эффективны не во всех случаях астмы, что связано с различными патогенетическими механизмами этого заболевания и различным механизмом действия самих препаратов. Данные свидетельствуют о том, что антилейкотриены оказывают лечебное действие не менее чем у 50% больных с бронхиальной астмой (БА) разной этиологии, но чаще всего при БА, связанной с непереносимостью аспирина. Монтелукаст и зафирлукаст являются конкурентными селективными антагонистами ЛТ1-рецепторов
С4, Д4 и Е4, не действуют на ЛТ-рецепторы 2-го типа, рецепторы к простагландинам и тромбоксанам, холинергические и гистаминовые рецепторы. Эти ЛС нивелируют эффекты лейкотриенов и оказывают противовоспалительное действие, подавляя клеточные и неклеточные компоненты воспаления в бронхах, вызываемого антигенной провокацией; ослабляют как ранний, так и поздний астматический ответ.
Фармакокинетика и фармакодинамика
Антилейкотриены являются ЛС для приёма внутрь, однако проходят клинические испытания ингаляционные и внутривенные формы. Монтелукаст, зафирлукаст и зилеутон всасываются быстро и достаточно полно, почти полностью связываются с белками плазмы, зилеутон - на 93%. Антагонисты ЛТ-рецепторов метаболизируются в печени (с участием цитохрома Р-450). Экскреция антагонистов ЛТ-рецепторов происходит преимущественно с жёлчью. Т1/2 составляет приблизительно 10 ч, экскретируются с молоком матери. Зафирлукаст разрешён у детей с 7 лет, монтелукаст - с 6 лет. В отличие от двукратного приёма зафирлукаста, монтелукаст назначают лишь один раз в сутки. Терапевтический эффект монтелукаста достигается после первой дозы и поддерживается на протяжении 24 ч, эффект зафирлукаста развивается в течение первых дней приёма.
Эффективность и клинические испытания
Антагонисты рецепторов лейкотриенов демонстрируют умеренную эффективность при хроническом течении БА, однако их действие при острых приступах астмы изучено мало. В последней рекомендации «Глобальной стратегии по лечению астмы (2006)» присоединять антагонисты лейкотриенов рекомендовано к ингаляционным стероидам и пролонгированным β2-адреномиметикам в случае неудовлетворительного контроля симптомов астмы. В рандомизированном двойном слепом исследовании у больных с БА среднетяжёлого и тяжёлого течения, получавших обычное лечение в сочетании с внутривенным введением монтелукаста или плацебо, было показано, что через 20 мин ОФВ1 увеличивается в среднем на 14,8%, в то время как в группе, получавшей плацебо, - только на 3,6%. Уменьшение одышки было отмечено уже через 10 мин после введения препарата, эффект сохранялся более 2 ч. Переносимость монтелукаста не отличалась от переносимости плацебо, однако отмечено, что клиническая эффективность монтелукаста и зафирлукаста вдвое ниже альбутерола/сальбутамола. В двойных слепых исследованиях с параллельными группами при лечении лёгкой астмы продемонстрировано, что эффекты антагонистов лейкотриеновых рецепторов были сравнимы с низкими дозами ингаляци-
онных кортикостероидов (400 мкг беклометазона дипропионата), а по некоторым данным, даже уступали им, хотя некоторые исследователи отмечают более быстрое наступление эффекта, чем у ингаляционных ГКС. У больных с хроническим течением БА антагонисты рецепторов лейкотриенов на 8-10% увеличивают ОФВ1, облегчают симптомы астмы и улучшают качество жизни. Однако, несмотря на невысокую эффективность, у антилейкотриенов имеется ряд преимуществ перед другими противовоспалительными препаратами: способность влиять на мышечную гипертрофию у больных БА, в отличие от глюкокортикостероидов; монтелукаст и пранлукаст блокируют бронхоспазм, вызываемый воздействием аспирина, физической нагрузки, аллергенов, холодного воздуха или диоксида серы. Как известно, физическая нагрузка провоцирует развитие бронхоспазма у 70-80% больных с симптомами БА. Был продемонстрирован положительный эффект при применении различных антилейкотриенов при бронхоспазме, обусловленном физической нагрузкой и вдыханием холодного воздуха, что подтверждает в данном случае ведущую роль цистеиновых лейкотриенов. Предварительный приём антилейкотриенов (зафирлукаст) на 50-70% ослабляет максимальную бронхоконстрикторную реакцию на физическую нагрузку и значительно укорачивает время нормализации функции лёгких, а у 30-50% больных эти препараты полностью предотвращают развитие бронхоспазма.
Препараты являются альтернативой низким дозам ингаляционных ГКС при лечении лёгкой астмы. Так, было показано, что антилейкотриены у больных с лёгкой и среднетяжёлой БА способствуют некоторому улучшению клинических симптомов, качества жизни и значений ОФВ1, а также уменьшению частоты обострений астмы по сравнению с плацебо.
По данным рандомизированных исследований, только у 70-80% пациентов с бронхиальной астмой ингаляционные ГКС эффективны (к тому же не всем пациентам удаётся освоить технику ингалирования ЛС, некоторые пациенты испытывают «стероидофобию», остаётся открытым вопрос о системном влиянии высоких - более 1000 мкг/сут - доз ингаляционных ГКС, особенно у маленьких детей), в связи с чем терапия антилейкотриенами представляется перспективной. Оправдана комбинация ингаляционных ГКС и ингибиторов лейкотриенов, что является альтернативой увеличению дозы ингаляционных ГКС при нестабильном течении БА или, наоборот, уменьшению дозы ингаляционных ГКС. В пользу комбинации говорит отсутствие ингибирующего влияния глюкокортикостероидов (в частности, флютиказона и перорального преднизолона) на продукцию лейкотриенов у больных БА, а также снижение содержания эозинофилов в периферической
крови и в дыхательных путях, обнаруженное при совместном использовании антагонистов лейкотриеновых рецепторов и ингаляционных кортикостероидов. Хотя механизмы этого эффекта не до конца изучены, предполагают, что кортикостероиды укорачивают время жизни эозинофилов, усиливая апоптоз, а антагонисты лейкотриеновых рецепторов замедляют созревания эозинофилов в костном мозге за счёт ингибирования синергических эффектов цистеинил-лейкотриенов и пептидных факторов роста.
Зафирлукаст в качестве ЛС для лечения БА одобрен FDA (Департамент по лекарственным средствам и пищевым продуктам США), включён в перечень противоастматических ЛС в ряде других стран. Препарат монтелукаст оказался эффективным при лечении детей с астмой лёгкой и средней степени тяжести, приводя к повышению ОФВ1. При сравнении влияния монтелукаста с кромогликатом натрия было выявлено, что достоверное увеличение ОФВ1 при приёме монтелукаста наступает уже ко 2-м суткам лечения в отличие от кромонов, а через 2 мес терапии значения ОФВ1 становятся сравнимы в обеих группах. Показана положительная роль антагонистов лейкотриенов в предоперационной подготовке на слизистой полости носа у больных с аллергическими риносинуситами и БА, что особенно важно у пациентов с аспириновой триадой. Антагонисты ЛТ-рецепторов позволяют проводить лечение в амбулаторных условиях, что уменьшает стоимость лечения за счёт экономии лекарств, требующихся для подготовки пациента к операции и ведения послеоперационного периода. Показан положительный эффект при лечении аллергического ринита в комбинации с антигистаминными препаратами. Против ожидания, ингибиторы 5ЛО оказались малоэффективными в терапии язвенного колита. Есть сообщения о положительных результатах терапии ингибиторами лейкотриенов эозинофильного эзофагита, неаллергического эозинофильного ринита. Применение антилейкотриеновых препаратов при аспириновом варианте БА приводит к достоверному улучшению показателей функции внешнего дыхания (FVC, FEV1), ослаблению симптомов астмы и снижению повышенного уровня LTE4 в моче. Единственно точным методом диагностики аспириновой БА у больных служит провокационный тест - перорально с аспирином (в дозе 30-150 мг, в среднем 60 мг) или ингалированием лизин-аспирина - с дальнейшим исследованием функциональных показателей лёгких и определением уровня цистеиновых ЛТС4, ЛТE4, ЛТД4 в моче и назальной жидкости. Ингаляционный тест лизин-аспирином более безопасен, но его следует с осторожностью использовать у больных, имеющих в анамнезе ангиоотёк на анальгетики. В последнее время более подходящей и безопасной моделью считают назальный тест. Риск
развития побочных реакций на провокационный тест (общая генерализованная реакция, уртикарная сыпь, головная боль, конъюнктивит, ринит или бронхоспазм) указывает на необходимость его проведения в условиях стационара. Показан бронхопротективный эффект монтелукаста при ингалировании лизин-аспирина у больных с аспириновой БА, что сопровождалось улучшением у них лёгочной функции. При использовании зилеутона и зафирлукаста в терапии аспириновой БА показано не только улучшение клинических симптомов и параметров спирометрии, но и экстрапульмональных проявлений (назальные, гастроинтестинальные, кожные симптомы). Чаще всего антилейкотриены более эффективны при БА, вызываемой или усиливаемой приёмом нестероидных противовоспалительных средств (например, аспирином), а также при тяжёлой атопической БА. У таких больных наблюдаются аллергические реакции I типа, при которых резко повышен уровень лейкотриенов. Высокая стоимость антилейкотриенов при их умеренном клиническом эффекте ограничивает их широкое применение.
Побочные эффекты
Наименее токсичным является монтелукаст (сингуляр). Его наиболее часто обнаруживаемые неблагоприятные эффекты - головная боль, желудочно-кишечные расстройства, редко аллергические реакции. При приёме зафирлукаста (аколат) со стороны пищеварительной системы бывают нарушения функции ЖКТ и/или печени, со стороны опорно-двигательного аппарата - миалгия, артралгия, отёк нижних конечностей, аллергические реакции: крапивница, ангионевротический отёк. В редких случаях препарат может оказывать гепатотоксическое действие - от повышения активности сывороточных трансаминаз до лекарственного гепатита (вялость, утомляемость, апатия, тошнота, рвота, боли в правом подреберье, увеличение печени, желтуха и зуд, которые проходят после отмены ЛС). Зафирлукаст может вызывать фарингит и гриппоподобные симптомы, а у пожилых пациентов повышать восприимчивость к респираторным инфекциям, образование гематом при ушибах, редко - кровотечения, очень редко - агранулоцитоз.
Как правило, при длительном применении зафирлукаста не отмечается развития серьёзных побочных эффектов. Лишь в единичных случаях лечение этим препаратом ассоциируется с проявлениями синдрома Черджа-Строс. Он может наблюдаться у больных со стероидзависимой формой БА при одновременном снижении системной гормональной терапии и назначении антилейкотриеновых препаратов. Клинически синдром проявляется эозинофильным гранулематозным васкулитом верхних и нижних дыхательных путей, а также симптома-
ми ринита, синусита и астмы. Однако, по мнению многих исследователей, развитие синдрома не связано непосредственно с использованием антилейкотриенов, а обусловлено исключительно снижением дозы кортикостероидов, ассоциирующимся с их назначением.
Взаимодействие
Зафирлукаст + теофиллин - снижение концентрации зафирлукаста в плазме крови на 30% и повышение концентрации теофиллина в плазме крови вдвое.
Зафирлукаст + эритромицин - снижение концентрации зафирлукаста в плазме на 40%.
Зафирлукаст + ацетилсалициловая кислота - повышение концентрации зафирлукаста в плазме крови на 45%.
Зафирлукаст + варфарин - увеличение протромбинового времени
на 35%.
Зафирлукаст + терфенадин - уменьшение AUC зафирлукаста на
54%.
Зафирлукаст + ГКС - повышение эффективности.
Монтелукаст + фенобарбитал - уменьшение AUC монтелукаста
на 40%.
Ещё одним новым направлением в лечении бронхиальной астмы является применение рекомбинантных человеческих анти-IgЕ-антител
(омализумаб). Результаты третьей фазы клинических испытаний показали, что при лечении омализумабом уменьшаются интенсивность ранней и поздней фаз аллергической реакции и количество эозинофилов в мокроте. В ходе трёх больших плацебо-контролируемых исследований доказано преимущество омализумаба в качестве дополнительной терапии при лечении бронхиальной астмы среднего и тяжёлого течения. Наибольшая эффективность препарата проявилась при лечении больных с тяжёлыми формами заболевания. Несмотря на то, что использование омализумаба в США было разрешено FDA ещё в 2003 г., применение его ограничивают высокая стоимость, способ применения (только инъекционные формы), а также неуверенность врачей в его преимуществах перед десенсибилизирующими средствами.