Клиническая фармакология.: учебник для вузов / Под ред. В.Г. Кукеса.- 4-е издание., перераб. и доп., - 2009. - 1056 с.
|
|
|
|
ГЛАВА 13. АНТИАРИТМИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА
Аритмии могут осложнять течение практически любой болезни сердца и развиваться при внесердечных заболеваниях. Клиническое значение аритмий и их лечение зависит от ряда факторов, наиболее важным из которых считают прогностическую значимость аритмий. Нарушения ритма сердца могут влиять на продолжительность жизни пациента с сердечным заболеванием. Оценка значимости аритмий особенно важна у больных органической патологией сердца, поскольку в структуре летальности при этих заболеваниях велика доля внезапной сердечной смерти, обусловленной фибрилляцией желудочков и желудочковой тахикардией. Кроме того, из-за аритмии может существенно снижаться качество жизни пациентов с сердечно-сосудистыми заболеваниями из-за нарушений гемодинамики, психологического дискомфорта и необходимости постоянного приёма антиаритмических препаратов.
Аритмии бывают, как правило, обусловлены врождёнными или приобретёнными нарушениями электрических свойств миокардиальных клеток.
13.1. МЕХАНИЗМЫ РАЗВИТИЯ АРИТМИЙ
Механизмы развития аритмий - сложные и до конца не изученные процессы. Сформированы некоторые общепринятые концепции, с помощью которых удаётся непротиворечиво объяснить многообразие клинических форм аритмий и способы действия антиаритмических препаратов. Механизмы развития нарушений ритма можно классифицировать следующим образом.
• Аритмии, обусловленные патологическим автоматизмом (автоматические аритмии).
• Аритмии, связанные с повторным входом возбуждения (re-entry аритмии).
• Аритмии, возникающие из-за появления «следовых» деполяризаций (триггерные аритмии).
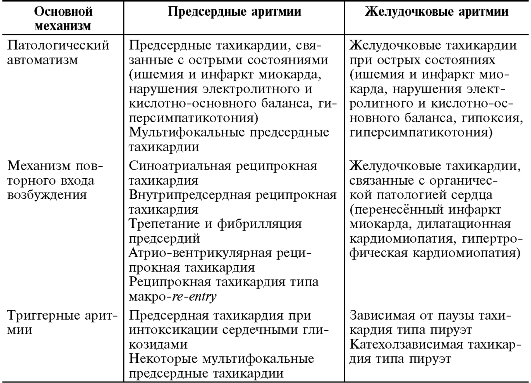
Классификация наиболее распространённых клинически значимых аритмий по механизму развития и локализации приведена в табл. 13-1.
Таблица 13-1. Классификация наиболее распространённых клинически значимых аритмий по механизму развития и локализации
 13.2. ОСНОВНЫЕ ЦЕЛИ АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ
13.2. ОСНОВНЫЕ ЦЕЛИ АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ
При заболеваниях сердца (в основном при органических поражениях - перенесённом инфаркте миокарда, дилатационной кардиомиопатии, гипертрофической кардиомиопатии) существенную долю в структуре причин смерти составляет внезапная сердечная смерть. Основная причина внезапной сердечной смерти - желудочковые тахикардии, трансформирующиеся в фибрилляцию желудочков. Благодаря ряду клинических маркеров можно выделить среди больных органическими заболеваниями сердца тех пациентов, у кого риск фатальных аритмий особенно высок. У этой категории лиц основными задачами антиаритмической терапии служат снижение риска внезапной сердечной смерти и увеличение продолжительности жизни.
Некоторые аритмии (как правило, суправентрикулярные), особенно у пациентов без органической патологии сердца, не считают непосредственной угрозой для жизни. В то же время из-за пароксизмов этих аритмий может возникнуть необходимость в госпитализации, а также появятся ограничения физической активности или симптомы
сердечной недостаточности, и в этом случае антиаритмическую терапию назначают с целью улучшения качества жизни пациентов.
13.3. ОБЩАЯ ХАРАКТЕРИСТИКА И КЛАССИФИКАЦИЯ АНТИАРИТМИЧЕСКИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Согласно общепринятой классификации, предложенной E. VaughanWilliams в 1969 г., выделяют следующие классы антиаритмических ЛС.
• I класс - ЛС, действующие преимущественно на натриевые каналы.
IA - препараты, замедляющие скорость деполяризации и удлиняющие реполяризацию (хинидин, прокаинамид, дизопирамид).
IB - препараты, практически не влияющие на скорость деполяризации и укорачивающие реполяризацию (лидокаин, мексилетин, токаинид*).
IC - ЛС, замедляющие скорость деполяризации и практически не изменяющие реполяризацию (пропафенон, флекаинид*, эн- каинид*, морацизин, этацизин*).
• II класс - β-адреноблокаторы (пропранолол, атенолол, метопролол, надолол, ацебутолол®, карведилол).
• III класс - препараты, преимущественно действующие на калиевые каналы и удлиняющие реполяризацию (амиодарон, соталол, бретилия тозилат, ибутилид).
• IV класс - блокаторы медленных кальциевых каналов (верапамил, дилтиазем).
13.4. МЕХАНИЗМЫ ДЕЙСТВИЯ
АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ
Класс I
Общее свойство препаратов I класса - способность блокировать натриевые каналы.
Класс IA
Препараты этого класса в основном блокируют натриевые каналы, что приводит к снижению скорости деполяризации. Кроме того, эти ЛС обладают способностью к умеренной блокаде калиевых каналов, что сопровождается удлинением реполяризации (рис. 13-1).
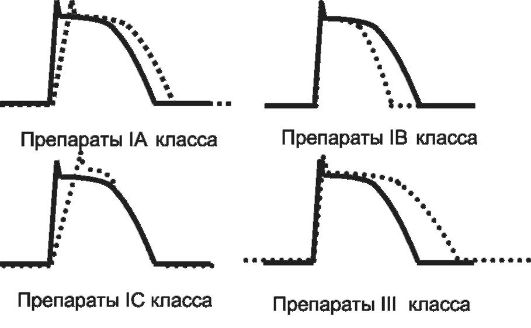 Рис. 13-1. Влияние антиаритмических препаратов на потенциал действия.
Рис. 13-1. Влияние антиаритмических препаратов на потенциал действия.
Под влиянием препаратов IA класса изменяется потенциал действия, снижается скорость распространения импульса и увеличивается рефрактерный период. Эти эффекты отмечают как в миокарде предсердий, так и в желудочках, поэтому антиаритмические ЛС IA класса потенциально эффективны как при предсердных, так и при желудочковых аритмиях.
Класс IB
Препараты IB класса при нормальной частоте ритма достаточно слабо воздействуют на натриевые каналы, но при высокой частоте ритма или в условиях ишемии блокада этих каналов существенно возрастает. Основной электрофизиологический эффект антиаритмических ЛС IB класса связан с уменьшением продолжительности потенциала действия и рефрактерного периода (см. рис. 13-1). Эффекты препаратов данной группы отмечают преимущественно в миокарде желудочков, в связи с чем эти ЛС используют в основном для лечения желудочковых аритмий.
Класс IC
Антиаритмические препараты IC класса - активные блокаторы натриевых каналов. При их назначении скорости деполяризации и проведения импульса изменяются существенно, а реполяризация и рефрактерность - незначительно (см. рис. 13-1). Препараты IC класса воздействуют практически одинаково на миокард предсердий и желудочков и эффективны как при предсердных, так и при желудочковых аритмиях.
Класс II
β-Адреноблокаторы блокируют влияние катехоламинов на скорость спонтанной диастолической деполяризации клеток-водителей ритма синусового узла, в результате чего снижается ЧСС. β-Адреноблокаторы также уменьшают частоту генерации импульсов эктопическими водителями ритма. При назначении препаратов данного класса замедляется проведение импульса и увеличивается рефрактерный период АВ-узла. β-Адреноблокаторы эффективны при аритмиях, возникающих в отделах сердца, где существует прямой симпатический контроль (наджелудочковые аритмии). Антиишемическая активность β-адреноблокаторов, по-видимому, служит одной из основных причин высокой профилактической эффективности данных ЛС при желудочковых аритмиях у пациентов с различными формами ИБС. Кроме того, β-адреноблокаторы активно влияют на базовые патологические процессы структурно-функционального ремоделирования миокарда (способствуют замедлению патологического ремоделирования миокарда у пациентов с органическим поражением левого желудочка), а также уменьшают перекисные процессы в миокарде. Некоторые β-адреноблокаторы (например, карведилол) обладают свойствами антиоксиданта. При использовании β-адреноблокаторов приостанавливается апоптоз кардиомиоцитов, опосредованный катехоламинами. Таким образом, при назначении антиаритмических препаратов II класса удаётся модифицировать процессы, влияющие на формирование кругового движения импульса в миокарде желудочков, а также блокировать механизмы активации этих кругов.
Класс III
Основным электрофизиологическим свойством препаратов данного класса антиаритмических ЛС служит блокада калиевых каналов и замедление калиевого тока, что сопровождается увеличением продолжительности реполяризации. Антиаритмические препараты III класса слабо влияют на скорости деполяризации и проведения импульса (см. рис. 13-1), однако способствуют увеличению рефрактерного периода в миокарде предсердий и желудочков, т.е. эффективны как при суправентрикулярных, так и желудочковых аритмиях.
Класс IV
Блокаторы медленных кальциевых каналов (верапамил и дилтиазем) нарушают функционирование медленных кальциевых каналов, которые в основном определяют скорость деполяризации синоатриального узла и АВ-узла. При назначении блокаторов медленных кальциевых каналов отмечают подавление автоматизма, замедление прове-
дения импульса и увеличение рефрактерности синоатриального узла и АВ-узла. Препараты данного класса особенно эффективны при суправентрикулярных аритмиях, обусловленных повторным входом и круговым движением импульса, когда круг циркуляции импульса включает миокард АВ-узла. Патологические кальциевые токи, возможно, бывают причиной следовых деполяризаций и аритмий, обусловленных триггерным механизмом. С помощью данного факта можно объяснить эффективность блокаторов медленных кальциевых каналов при лечении этих аритмий, в частности, чувствительность отдельных желудочковых тахикардий к лечению верапамилом.
Кроме того, существуют ЛС, не вошедшие в классификацию, но используемые для лечения аритмий.
• М-холиноблокаторы (атропин) используют для увеличения ЧСС при брадикардиях.
• Сердечные гликозиды (дигоксин) назначают для контроля ЧСС при предсердных аритмиях с высокой частотой предсердных сокращений, поскольку данные препараты снижают проводимость в АВ-узле, например, при мерцательной аритмии.
• Растворы электролитов (препараты калия, магния). Препараты магния применяют для лечения желудочковой тахикардии типа пируэт, возникающей по триггерному механизму. Кроме того, препараты магния можно принимать внутрь для симптоматического лечения желудочковой экстрасистолии у пациентов без органической патологии сердца.
• Трифосаденин используют в основном для купирования пароксизмальной наджелудочковой тахикардии.
• Препараты, не обладающие прямыми электрофизиологическими свойствами. Показано, что при назначении ингибиторов АПФ снижается риск фатальных желудочковых аритмий и внезапной сердечной смерти у пациентов с инфарктом миокарда и ДКМП. У больных, перенёсших инфаркт миокарда, применение блокаторов рецепторов альдостерона, статинов также сопровождается уменьшением риска фатальных желудочковых аритмий и внезапной сердечной смерти. По-видимому, препараты, не обладающие прямыми электрофизиологическими свойствами, влияют на ремоделирование миокарда, в результате чего снижается вероятность образования субстрата для аритмий re-entry, обусловленных повторным входом и круговым движением импульса (новых кругов циркуляции импульса, либо препятствуют активации существующих).
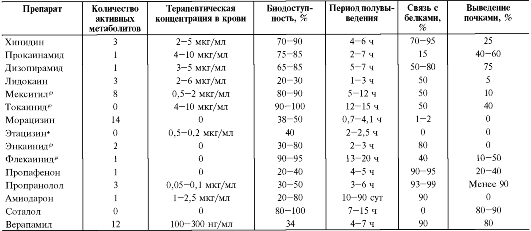
Основные фармакодинамические и фармакокинетические параметры указанных групп препаратов представлены в табл. 13-2 и 13-3.
Таблица 13-2. Клинико-фармакологические свойства антиаритмических лекарственных средств
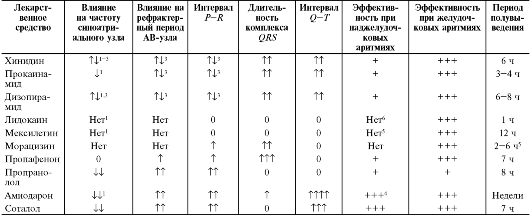 1 Может супрессировать поражённые синусные узлы.
1 Может супрессировать поражённые синусные узлы.
2 Начальная стимуляция высвобождающимся эндогенным норадреналином с последующей депрессией.
3 Антихолинергический эффект и прямое депрессивное действие.
4 Особенности при синдроме Вольфа-Паркинсона-Уайта.
5 Период полувыведения активных метаболитов значительно больше.
6 Может быть эффективным при предсердных аритмиях, вызванных сердечными гликозидами.
Таблица 13-3. Фармакокинетические параметры антиаритмических препаратов
 13.5. МЕХАНИЗМЫ ДЕЙСТВИЯ АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ ПРИ РАЗЛИЧНЫХ ТИПАХ АРИТМИЙ
13.5. МЕХАНИЗМЫ ДЕЙСТВИЯ АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ ПРИ РАЗЛИЧНЫХ ТИПАХ АРИТМИЙ
Автоматические аритмии
Автоматические аритмии чаще возникают при острых состояниях, сопровождающихся ишемией миокарда, нарушениями электролитного и кислотно-щелочного дисбаланса, высоким тонусом симпатической нервной системы. Эффективность антиаритмических препаратов при автоматических аритмиях, как правило, невысокая. Основной целью лечения автоматических аритмий считают адекватное устранение факторов, которые индуцируют развитие данных нарушений ритма.
Тем не менее определённые антиаритмические ЛС, оказывающие влияние на механизмы формирования автоматических аритмий, применяют для терапии последних. Например, при автоматических аритмиях, индуцированных высоким тонусом симпатической нервной системы, полезны β-адреноблокаторы, замедляющие скорость нарастания диастолического потенциала и таким образом замедляющие частоту генерации импульсов автоматическим очагом.
Блокаторы медленных кальциевых каналов также изменяют скорость нарастания диастолического потенциала (благодаря модуляции кальциевых токов), что влияет на частоту генерации импульсов.
Препараты 1А, IB и IC классов умеренно подавляют аномальный автоматизм. Механизм их действия, по-видимому, связан с повышением уровня порогового потенциала.
При назначении препаратов III класса частота генерации импульсов в автоматическом очаге может снизиться из-за увеличения продолжительности потенциала действия.
Аритмии, обусловленные повторным входом возбуждения
Для эффективной терапии аритмий, обусловленных повторным входом и круговым движением импульса, необходимо воздействовать на электрофизиологические свойства компонентов, формирующих круг циркуляции импульса. Иными словами, следует таким образом изменить скорости проведения и длительности рефрактерных периодов «быстрого» и «медленного» путей, чтобы циркуляция импульса стала невозможной.
На скорость проведения импульса влияют препараты IA, IC классов, блокаторы медленных кальциевых каналов и β-адреноблокаторы (в АВ-узле), а на длительность рефрактерных периодов - препараты IB (уменьшение продолжительности), IA и III классов (увеличение продолжительности).
• Механизм действия ЛС, замедляющих скорость деполяризации (IA и III классы, блокаторы медленных кальциевых каналов и β- адреноблокаторы), связан с выраженным замедлением скорости проведения импульса по «медленному» и «быстрому» путям, в результате чего при очередном регулярном импульсе прекращается круговое движение возбуждения (рис. 13-2).
• Эффективность препаратов, уменьшающих длительность потенциала действия (IB класс), в основном обусловлена их преимущественным влиянием на рефрактерность «быстрого» пути, благодаря чему продолжительность рефрактерных периодов «быстрого» и «медленного» путей становится одинаковой, что препятствует циркуляции возбуждения (рис. 13-3).
• При назначении препаратов, удлиняющих продолжительность потенциала действия (IA и III класс), отмечают следующие эффекты. Во-первых, увеличение рефрактерного периода «медленного» пути приводит к тому, что критическое различие рефрактерных периодов кругового движения импульса нивелируется, что сопровождается блокадой проведения внеочередного импульса, как в быстром, так и в медленном пути. Во-вторых, при дальнейшем увеличении рефрактерного периода «быстрого» пути возможна блокада ретроградного проведения импульса (рис. 13-4).
Триггерные аритмии
Основным компонентом лечения триггерных аритмий служит устранение факторов, которые приводят к возникновению следовых деполяризаций. К этим факторам относят препараты, удлиняющие интервал Q-T (в том числе и антиаритмические), сердечные гликозиды, а также ситуации, приводящие к выраженной активации симпатичес-
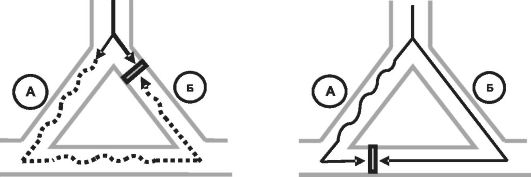 Рис. 13-2. Механизм действия препаратов, уменьшающих скорость проведения импульса.
Рис. 13-2. Механизм действия препаратов, уменьшающих скорость проведения импульса.
Рис. 13-3. Механизм действия препаратов, уменьшающих длительность рефрактерного периода.
кой системы, в частности, интенсивные физические или психоэмоциональные нагрузки.
Кроме того, для лечения триггерных аритмий можно применять блокаторы медленных кальциевых каналов и β-адреноблокаторы. β-Адреноблокаторы подавляют триггерные аритмии из-за устранения следовых деполяризациий, индуцированных катехоламинами. Предполагают, что в развитии следовых деполяризаций определённую роль играют медленные кальциевые токи, поэтому при назначении блокаторов медленных кальциевых каналов, ингибирующих эти токи, удаётся устранять следовые деполяризации и купировать зависимые от них аритмии.
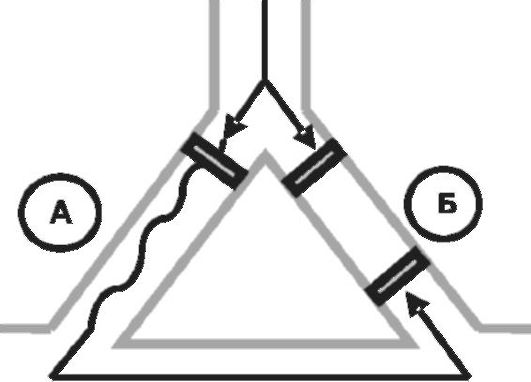 Рис. 13-4 . Механизм действия препаратов, удлиняющих продолжительность потенциала действия.
Рис. 13-4 . Механизм действия препаратов, удлиняющих продолжительность потенциала действия.
13.6. ОСНОВНЫЕ ПОБОЧНЫЕ (НЕБЛАГОПРИЯТНЫЕ) ЭФФЕКТЫ АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ
Основные неблагоприятные эффекты, связанные с применением антиаритмических ЛС, можно классифицировать следующим образом.
• Проаритмические эффекты.
• Депрессия функций синусного узла, АВ-проведения и внутрижелудочковой проводимости.
• Негативное влияние на сократимость миокарда.
• Системные токсические эффекты.
Проаритмический эффект
Проаритмические эффекты антиаритмических препаратов имеют существенное клинические значение. Это обусловлено тем, что нарушения ритма сердца, индуцируемые данным классом ЛС, могут быть жизнеугрожающими и приводить к внезапной сердечной смерти. При этом проаритмический эффект напрямую связан со способностью антиаритмических препаратов изменять скорость проведения импульса и/или длительность рефрактерного периода из-за модификации ионных токов. Выделяют следующие механизмы развития проаритмий.
• Активация кругов циркуляции импульса и создание условий для индукции аритмий, обусловленных повторным входом и круговым движением импульса.
• Индукция следовых деполяризаций и развитие триггерных аритмий.
Антиаритмические препараты устраняют или предупреждают реципрокные аритмии, обусловленные повторным входом и круговым движением импульса, благодаря модуляции скорости проведения импульса и/или изменению продолжительности рефрактерного периода в отдельных компонентах петли циркуляции возбуждения. В то же время у пациентов с органическим поражением сердца высока вероятность наличия нескольких анатомо-физиологических кругов циркуляции импульса. При этом в одном из них электрофизиологические свойства компонентов петли способствуют формированию нарушений ритма, а в других данные нарушения не достигают критических величин, необходимых для манифестации аритмии («спящие» круги повторного входа импульса). При назначении препаратов, изменяющих скорость проведения импульса и/или продолжительность рефрактерного периода, возможно изменение электрофизиологических свойств миокарда таким образом, что в ранее неактивном кругу появляются условия для циркуляции импульса, что в свою очередь сопровождается формированием «новой» реципрокной аритмии.
Наиболее часто усугубление реципрокных аритмий отмечают при использовании препаратов IA и IС классов. Проаритмическая тахикардия может иметь меньшую частоту, чем исходная аритмия. При проаритмической реципрокной тахикардии нередко регистрируют рецидивы и увеличенную продолжительность нарушения ритма, а также возможна внезапная сердечная смерть.
Препараты, увеличивающие продолжительность потенциала действия (IA и III классы), могут индуцировать желудочковые тахиаритмии, обусловленные ранними следовыми деполяризациями. Эти аритмии проявляются как рецидивирующие эпизоды полиморфной желудочковой тахикардии (типа пируэт). В ряде случаев они протекают бессимптомно, но иногда возможны обмороки или внезапная сердечная смерть.
Влияние на активность синотриального узла, атриовентрикулярную и внутрижелудочковую проводимость
Антиаритмические препараты подавляют активность синоатриального узла, вызывают нарушение АВ-проводимости или проводимости в системе Гиса-Пуркинье.
Клинически значимая депрессия синусового узла под влиянием антиаритмических ЛС чаще развивается при исходной дисфункции синоатриального узла и проявляется синусовой брадикардией. Другим клиническим проявлением депрессии синоатриального узла могут
быть синкопальные состояния после медикаментозного купирования предсердных аритмий, которые обусловлены посттахикардитической депрессией синоатриального узла и замедленным восстановлением его функции.
Антиаритмические препараты могут снижать скорость проведения импульса или полностью блокировать его проведение в АВ-узле. АВблокада чаще формируется при использовании блокаторов медленных кальциевых каналов и β-адреноблокаторов.
Препараты IA, IC и реже III классов могут вызывать нарушения проведения импульса в системе Хиса-Пуркинье, в том числе дистальные блокады. Развитие дистальной блокады сопряжено с высоким риском появления синкопальных состояний или асистолии в связи с тем, что нижележащие водители ритма имеют низкую активность.
Влияние на сократимость миокарда
При применении антиаритмических ЛС возможно снижение сократительной функции миокарда левого желудочка. Подобный эффект отмечают при назначении пропафенона, хинидина, прокаинамида, блокаторов медленных кальциевых каналов. В связи с этим необходимо тщательно подходить к выбору антиаритмического препарата при сердечной недостаточности или дисфункции левого желудочка.
Системная токсичность
При использовании антиаритмических ЛС иногда отмечают неблагоприятные эффекты, не связанные с антиаритмическим действием. Тем не менее эти реакции могут быть клинически значимыми, и из-за них приходится отменять препарат. Возможно токсическое поражение любых органов и тканей. В качестве примера можно привести острый пневмонит и хронический фиброзирующий лёгочный альвеолит (амиодарон), агранулоцитоз (прокаинамид), лекарственный гепатит (хинидин), волчаночный синдром (прокаинамид), нарушения функций щитовидной железы (амиодарон), желудочно-кишечные расстройства, поражения ЦНС.
13.7. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ОТДЕЛЬНЫХ АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ
Мембраностабилизирующие препараты
Препараты IA класса Хинидин
Электрофизиологические эффекты хинидина обусловлены блокадой натриевых каналов, в результате которой снижается скорость деполяризации и замедляется проводимость. При блокаде хинидином калиевых каналов отмечают удлинение потенциала действия и рефрактерного периода. Препарат воздействует на миокард как предсердий, так и желудочков. Хинидин умеренно подавляет автоматизм.
Хинидин также блокирует α-адренорецепторы, из-за чего возникают вазодилатация, снижение АД и рефлекторная тахикардия. Кроме того, хинидин обладает свойствами блокатора холинэргических рецепторов, что в основном проявляется в виде улучшения проводимости АВ-соединения. Этот эффект необходимо учитывать при назначении хинидина пациентам с мерцательной аритмией и трепетанием предсердий, поскольку данное ЛС может привести к увеличению частоты сокращений желудочков.
При приёме внутрь абсорбция хинидина достигает 80-90%. Пик концентрации препарата в плазме крови обнаруживают в пределах 2 ч. Хинидин связывается с белками плазмы на 80-90% и имеет большой объём распределения. Концентрация препарата в тканях сердца превышает содержание в крови в 4-10 раз. Хинидин метаболизируется в печени. Период полувыведения препарата составляет 5-8 ч.
При терапии в обычных дозах хинидин не вызывает значимого ухудшения сократимости миокарда.
Неблагоприятные побочные эффекты хинидина отмечают у 30- 50% пациентов. При назначении хинидина возможно появление как реципрокных желудочковых аритмий, так и триггерных желудочковых аритмий типа пируэт. Увеличение летальности, обнаруженное при анализе результатов исследований по применению хинидина у пациентов с мерцательной аритмией, может быть связано с развитием проаритмий. Системные токсические эффекты проявляются в виде желудочно-кишечных и неврологических нарушений, реакций гиперчувствительности (например, гемолитической анемии и тромбоцитопении). Относительно редкими побочными эффектами считают волчаночный синдром и гепатит.
В настоящее время хинидин рекомендовано применять для фармакологической кардиоверсии у пациентов с мерцательной аритмией или для поддержания синусового ритма при рецидивирующей мерцательной аритмии у больных без органических заболеваний сердца, а также у пациентов с артериальной гипертензией и ИБС. При этом хинидин рассматривают как препарат 2-й линии, назначаемый при неэффективности других, более активных и безопасных препаратов. Данные об эффективности данного ЛС достаточно противоречивы или недостаточно изучены.
Прокаинамид
Электрофизиологические эффекты прокаинамида обусловлены блокадой натриевых каналов и замедлением скорости проведения импульса, а также блокадой калиевых каналов и увеличением рефрактерности миокарда. Прокаинамид умеренно подавляет автоматизм.
Препарат обладает умеренно выраженной активностью ганглиоблокатора, что может приводить к развитию артериальной гипотензии, а также свойствами холиноблокатора, однако в меньшей степени, чем хинидин.
При внутривенном введении прокаинамид начинает действовать почти немедленно. При приёме внутрь абсорбция ЛС составляет 70- 90%. Препарат слабо связывается с белками плазмы крови. Прокаинамид выводится почками, а также подвергается трансформации в печени с образованием N-ацетилпрокаинамида - активного метаболита со свойствами антиаритмического средства III класса. Высокое содержание N-ацетилпрокаинамида в крови может быть связано с повышенным риском аритмий типа пируэт. N-ацетилпрокаинамид также элиминируется почками. Период полувыведения составляет в среднем 3-5 ч. При назначении прокаинамида возможно снижение сократимости миокарда, однако этот эффект бывает выражен незначительно.
Описаны следующие побочные эффекты прокаинамида.
• Проаритмии, свойственные IA классу антиаритмических препаратов.
• Артериальная гипотензия при внутривенном введении ЛС.
• Желудочно-кишечные расстройства.
• Агранулоцитоз, в том числе фатальный.
• Волчаночный синдром (лихорадка, кожная сыпь, артриты, плеврит и перикардит).
В настоящее время прокаинамид назначают для купирования пароксизмальных аритмий. Препарат используют для купирования желудочковой тахикардии при неэффективности лидокаина. Прокаинамид показан для купирования тахиаритмии с уширенными комплексами QRS неизвестного генеза (либо желудочковая тахикардия, либо супра-
вентрикулярная тахикардия с участием дополнительных проводящих путей. Кроме того, прокаинамид можно применять для купирования пароксизмов мерцательной аритмии, однако сведения об эффективности препарата при данном нарушении ритма достаточно противоречивы или недостаточно изучены. Дизопирамид
Электрофизиологические эффекты дизопирамида не отличаются от таковых, свойственных препаратам IA класса. Дизопирамид подавляет автоматизм.
Дизопирамид обладает выраженными холиноблокирующими свойствами, и при его назначении возможно учащение синусового ритма и улучшение АВ-проводимости.
Дизопирамид применяют только внутрь. Абсорбция препарата составляет 80-90%. Пиковую концентрацию в плазме крови отмечают через 2-3 ч после приёма. Доля препарата, связанного с белками плазмы крови, зависит от концентрации дизопирамида: при увеличении содержания ЛС количество связанного дизопирамида уменьшается. Большая часть дизопирамида (около 60%) выводится почками в неиз- менённом виде, остальная часть метаболизируется в печени.
Дизопирамид угнетает сократительную способность миокарда, особенно у пациентов с его исходной дисфункцией.
Основные побочные эффекты дизопирамида.
• Проаритмии, свойственные IA классу антиаритмических препаратов.
• Появление симптомов сердечной недостаточности.
• Антихолинергическое действие (сухость во рту, запор, задержка мочеиспускания, ухудшение течения глаукомы).
В настоящее время дизопирамид рекомендуют назначать лишь для лечения рецидивирующей фокальной (автоматической) предсердной тахикардии и только в комбинации с препаратами, замедляющими АВ-проводимость. При этом дизопирамид рассматривают в качестве препарата, эффективность (полезность) которого считают доказанной.
Препараты класса IB Лидокаин
Лидокаин блокирует быстрые натриевые каналы. Из-за особенностей кинетики связывания препарата с ионными каналами лидокаин не вызывает замедления деполяризации в нормальной ткани и при нормальной частоте ритма. Однако при тахикардии, а также при ишемии, гипокалиемии и ацидозе лидокаин существенно замедляет скорость деполяризации и проводимость. На фоне приёма препарата уко-
рачиваются продолжительность потенциала действия и рефрактерный период миокарда. Лидокаин подавляет нормальные и патологические очаги автоматизма, а также ранние и поздние следовые деполяризации. Препарат влияет преимущественно на желудочки.
Лидокаин применяют внутривенно. Связывание ЛС с белками плазмы крови достигает 70%. Основная часть введённого препарата метаболизируется в печени, и лишь небольшое количество выводится почками в неизменённом виде. Период полувыведения лидокаина зависит от концентрации белков плазмы крови (особенно белков острой фазы) и варьирует от 1 до 4 ч.
Лидокаин практически не оказывает значимого влияния на гемодинамику и не вызывает проаритмий. К неблагоприятным побочным эффектам лидокаина относят повышение риска асистолии, остановку дыхания при передозировке препарата и нейротоксичность (головокружение, парестезии).
Лидокаин - препарат выбора для купирования устойчивой желудочковой тахикардии, особенно у пациентов с ИБС.
Мексилетин и токаинид*
Мексилетин и токаинид- типичные представители IB класса антиаритмических препаратов. По своим электрофизиологическим свойствам эти два ЛС практически не отличаются от лидокаина, а благодаря особенностям фармакокинетики их можно принимать внутрь.
Мексилетин полностью абсорбируется в ЖКТ. Пиковую концентрацию препарата в плазме крови отмечают через 4-6 ч после приёма внутрь. Мексилетин связывается с белками плазмы (до 70%). Основная часть введённого ЛС подвергается метаболизму в печени. Период полувыведения составляет 8-16 ч.
Фармакокинетические характеристики токаинида схожи с таковыми мексилетина, за исключением того, что первый не только подвергается метаболизму в печени, но и выводится почками в неизменён- ном виде.
Побочные эффекты мексилетина - нейротоскичность и желудочно-кишечные нарушения. При назначении токаинида возможно развитие агранулоцитоза.
В современной клинической практике эти препараты практически не применяют.
Препараты класса IC Флекаинид*
Флекаинид- активный блокатор натриевых каналов. Поскольку флекаинид почти постоянно связан с натриевыми каналами, происходит выраженное замедление проведения возбуждения при любой ЧСС
(в том числе и при низкой). Кроме того, флекаинид в незначительной степени блокирует калиевые каналы, однако этот эффект не имеет существенного значения. Флекаинид влияет на миокард, как предсердий, так и желудочков. Умеренно подавляет автоматизм сердца.
Препарат хорошо абсорбируется из ЖКТ. Максимальную концентрацию ЛС в плазме крови отмечают через 2-4 ч после приёма внутрь. До 40% препарата связывается с белками плазмы крови. До 70% введённого флекаинида метаболизируется в печени, а оставшаяся часть (около 30%) выводится почками в неизмённом виде. Период полувыведения препарата составляет 12-24 ч.
Флекаинид обладает отрицательным инотропным действием и может вызывать проаритмии, особенно желудочковые аритмии, обусловленные повторным входом и круговым движением импульса.
К побочным эффектам флекаинида относят нечёткость зрения и желудочно-кишечные расстройства.
В современной клинической практике флекаинид рекомендуют использовать при рецидивирующей АВ-реципрокной тахикардии, особенно при резистентности к терапии блокаторами медленных кальциевых каналов и β-адреноблокаторами, а также при АВ-реципрокной тахикардии или мерцательной аритмии у пациентов с дополнительными проводящими путями (синдром Вольфа-Паркинсона-Уайта). Препарат применяют для фармакологической кардиоверсии при персистирующей мерцательной аритмии, а также для профилактической антиаритмической терапии при отсутствии органической патологии сердца. Кроме того, флекаинид назначают при фокальной предсердной тахикардии и фокальной тахикардии из АВ-соединения.
Пропафенон
Пропафенон - блокатор натриевых каналов, обладающий типичными электрофизиологическими эффектами IC класса антиаритмических препаратов, которые воздействует на миокард предсердий и желудочков. Препарат умеренно подавляет автоматизм сердца. Пропафенон также блокирует β-адренорецеторы и, возможно, медленные кальциевые каналы.
Пропафенон хорошо всасывается из ЖКТ. Пиковую концентрацию ЛС в крови регистрируют через 2-3 ч после приёма внутрь. Пропафенон на 90% связывается с белками плазмы крови и метаболизируется преимущественно в печени. Период полувыведения препарата составляет 6-7 ч.
Пропафенон оказывает умеренное отрицательное инотропное действие, а также уменьшает прирост ЧСС при нагрузке. Эти эффекты могут быть обусловлены блокадой β-адренорецепторов.
При назначении препарата возможно развитие аритмий, обусловленных повторным входом и круговым движением импульса, особенно у пациентов с органической патологией сердца.
К наиболее частым побочным эффектам пропафенона относят головокружение, атаксию, тошноту и металлический привкус во рту.
В современной клинической практике пропафенон рекомендуют использовать при АВ-реципрокной тахикардии (в том числе резистентной к терапии блокаторами медленных кальциевых каналов и β-адреноблокаторами). Пропафенон эффективен для лечения суправентрикулярных реципрокных аритмий у пациентов с дополнительными проводящими путями, а также для купирования персистирующей мерцательной аритмии и поддержания синусового ритма у больных без органической патологии сердца.
Кроме того, пропафенон рекомендуют назначать при терапии фокальной предсердной тахикардии и фокальной тахикардии из АВ-соединения.
Морацизин
Морацизин (этмозин*) блокирует натриевые каналы и обладает электрофизиологическими свойствами антиаритмических препаратов IC класса. Кроме того, морацизин укорачивает потенциал действия и длительность рефрактерного периода, подавляет автоматизм сердца и следовые деполяризации. Морацизин воздействует на миокард предсердий и желудочков.
Морацизин почти полностью всасывается из ЖКТ. Максимальную концентрацию препарата в плазме крови отмечают через 1-2 ч после приёма. Морацизин метаболизируется в печени, а период полувыведения варьирует от 3 до 12 ч.
Морацизин может оказывать слабый отрицательный инотропный эффект и индуцировать аритмии, обусловленные повторным входом и круговым движением импульса, особенно у пациентов с органической патологией сердца.
Из побочных эффектов наиболее часто отмечают симптомы нарушений ЦНС и ЖКТ (головная боль, головокружение и тошнота).
В современной клинической практике морацизин практически не применяют.
Класс II
Более подробное описание фармакологии β-адреноблокаторов представлено в соответствующем разделе. Возможные механизмы антиаритмической активности этой группы ЛС были приведены ранее. β-Адреноблокаторы влияют на скорость проведения возбуждения, по-
давляют автоматизм и следовые деполяризации, а также оказывают антиаритмическое действие, не связанное с их электрофизиологическими свойствами: устраняют и предотвращают ишемию (важный фактор индукции аритмий) или замедляют патологическое ремоделирование миокарда.
В отличие от «классических антиаритмических препаратов), β-адреноблокаторы не индуцируют развитие проаритмий.
К наиболее частым побочным эффектам β-адреноблокаторов относят брадиаритмии и нарушения АВ-проведения, бронхоспазм, обострение заболеваний периферических артерий, сексуальную дисфункцию, депрессию.
Благодаря эффективности и безопасности β-адреноблокаторы считают препаратами выбора при различных типах аритмий, как суправентрикулярных, так и желудочковых. Данную группу ЛС рекомендуют назначать для лечения суправентрикулярных аритмий, в частности симптоматической синусовой тахикардии на фоне психоэмоционального стресса, тревожности или панических атак, а также для терапии аритмий при тиреотоксикозе, пароксизмальной синоатриальной тахикардии, нарушений ритма, обусловленных повторным входом и круговым движением импульса, АВ-реципрокной тахикардии, реципрокных аритмий у пациентов с ДПП (при отсутствии аномально быстрых путей), фокальной предсердной тахикардии и фокальной тахикардии из АВ-соединения. β-Адреноблокаторы показаны для контроля ЧСС у пациентов с постоянной формой мерцательной аритмии.
Поскольку доказано, что β-адреноблокаторы снижают риск фатальных желудочковых аритмий и внезапной сердечной смерти у пациентов, перенёсших инфаркт миокарда или страдающих ДКМП, эту группу ЛС считают препаратами выбора для лечения желудочковых аритмий у данной категории больных. β-Адреноблокаторы (метопролол, бисопролол, карведилол) рекомендованы для первичной профилактики внезапной сердечной смерти пациентам, перенёсшим инфаркт миокарда. Применять β-адреноблокаторы следует также у пациентов, перенёсших инфаркт миокарда и имеющих в анамнезе эпизоды фибрилляции желудочков, устойчивой желудочковой тахикардии с выраженными нарушениями гемодинамики или без последних. β-Адреноблокаторы показаны для профилактики внезапной сердечной смерти у больных ДКМП, особенно при наличии факторов риска (перенесённой фибрилляции желудочков или эпизода устойчивой желудочковой тахикардии). Эти препараты назначают пациентам с синдромом врождённого удлинения интервала Q-T для профилактики желудочковых тахиаритмий, как при бессимптомном течении болезни, так и больным, перенёсшим пароксизм тахикардии типа пируэт.
β-Адреноблокаторы рекомендовано также использовать для терапии катехолзависимой полиморфной желудочковой тахикардии.
Препараты III класса Амиодарон
Амиодарон (как и все препараты III класса антиаритмических препаратов) - высокоактивный блокатор калиевых каналов. Его основной электрофизиологический эффект заключается в удлинении потенциала действия и увеличении рефрактерного периода в предсердиях, желудочках и системе Хиса-Пуркинье. Амиодарон также подавляет автоматизм. Кроме того, амиодарон незначительно блокирует натриевые каналы, медленные кальциевые каналы и умеренно затормаживает функционирование β и α-адренорецепторов.
Фармакокинетику амиодарона можно представить двумя фазами: фаза распределения и выведения препарата из сосудистого русла и фаза распределения и выведения амиодарона из жировой ткани, в которой ЛС может накапливаться. В первой фазе отмечают довольно быстрое накопление препарата (за 3-10 сут) и сравнительно быстрое его выведение. Максимально выраженное антиаритмическое действие ЛС регистрируют обычно через 2-3 нед после назначения, даже если использовали высокие нагрузочные дозы. Период полувыведения амиодарона варьирует от 30 до 110 сут (в среднем около 50 сут). Амиодарон связывается с белками крови более чем на 95% и выводится в основном с желчью.
При приёме внутрь амиодарон практически не влияет на центральную гемодинамику и сократительную способность миокарда, хотя при парентеральном введении возможен умеренный отрицательный инотропный эффект.
Амиодарон может индуцировать следовые деполяризации и желудочковые тахикардии типа пируэт, однако риск появления аритмий на фоне применения амиодарона относительно невысок.
Вместе с тем препарат часто вызывает системные токсические реакции, от слабо выраженных до жизнеугрожающих. Из побочных эффектов со стороны ЖКТ следует отметить тошноту, рвоту, анорексию, пищеводный рефлюкс вследствие паралича нижнего пищеводного сфинктера. Довольно редко развивается амиодарон-индуцированный гепатит. Самый опасный побочный эффект терапии амиодароном - поражение лёгких в виде острого пневмонита с симптомами дыхательной недостаточности или хронического фиброзирующего лёгочного альвеолита. При назначении амиодарона может изменяться функциональное состояние щитовидной железы, в результате чего развивается гипертиреоз или гипотиреоз. К достаточно редким осложнениям отно-
сят фотодерматит, поражение ЦНС (атаксия, тремор, периферическая нейропатия), а также изменения со стороны органа зрения, обусловленные отложениями ЛС в роговице.
Амиодарон широко используют в современной клинической практике. Амиодарон показан для лечения АВ-реципрокной тахикардии, особенно при плохой переносимости пароксизмов, сопровождающихся нарушениями гемодинамики. Амиодарон рекомендуют назначать при суправентрикулярных аритмиях у пациентов с ДПП (АВ-реципрокной тахикардии или мерцательной аритмии). Амиодарон рекомендуют использовать для терапии фокальной предсердной тахикардии и фокальной тахикардии из АВ-соединения, для восстановления синусового ритма при персистирующей мерцательной аритмии, а также для поддержания синусового ритма у больных сердечной недостаточностью, ИБС или выраженной гипертрофией левого желудочка и у пациентов без органической патологии сердца при неэффективности флекаинида, пропафенона или соталола.
Амиодарон показан пациентам, перенёсшим инфаркт миокарда, а также больным с эпизодами фибрилляции желудочков или желудочковой тахикардии в анамнезе для первичной профилактики внезапной сердечной смерти.
Соталол
Соталол, как и другие препараты III класса, блокирует калиевые каналы. Кроме того, он обладает свойствами достаточно активного блокатора β-адренорецепторов. Соталол умеренно подавляет автоматизм. Соталол действует на миокард предсердий и желудочков.
Препарат хорошо абсорбируется в ЖКТ, и его максимальную концентрацию в крови отмечают через 2-3 ч после приёма. Соталол не метаболизируется и выводится почками в неизмённом виде. Период полувыведения ЛС составляет 7-8 ч.
Соталол обладает отрицательным инотропным действием.
При назначении соталола вероятность тахикардии типа пируэт гораздо выше, чем при применении амиодарона или антиаритмических препаратов IA класса. Риск развития тахикардии типа пируэт зависит от дозы препарата и существенно увеличивается при превышении дозы 240 мг/сут. Гипокалиемия также приводит к увеличению риска проаритмического эффекта соталола, поэтому необходимо тщательно контролировать содержание калия в крови при совместном использовании соталола и диуретиков.
Побочные эффекты соталола в основном связаны с неселективной блокадой β-адренорецепторов (брадикардия, АВ-блокада, бронхоспазм).
Соталол показан при суправентрикулярных аритмиях, в частности при АВ-реципрокной тахикардии, особенно в случае плохо переноси-
мых пароксизмов, сопровождающихся нарушениями гемодинамики. Соталол рекомендуют использовать для терапии суправентрикулярных аритмий у пациентов с ДПП (АВ-реципрокной тахикардии или мерцательной аритмии). Препарат также назначают при фокальной предсердной тахикардии и фокальной тахикардии из АВ-соединения. Соталол применяют для поддержания синусового ритма при мерцательной аритмии. Его рекомендуют использовать у пациентов с ИБС или выраженной гипертрофией левого желудочка, а также у лиц без органической патологии сердца. Ибутилид
Ибутилид, в отличие от остальных препаратов III класса, не только воздействует на калиевые каналы, но и блокирует значительную часть входящих натриевых токов. Тем не менее ибутилид увеличивает продолжительность потенциала действия и рефрактерный период. Кроме того, ибутилид подавляет автоматизм сердечной мышцы.
Ибутилид назначают внутривенно. Препарат активно метаболизируется в печени. Более 80% введённого ЛС выводится почками в виде метаболитов и около 10% - в неизмённом виде. Период полувыведения ибутилида варьирует от 2 до 12 ч.
Ибутилид может индуцировать тахиаритмии типа пируэт. Вероятность желудочковой тахикардии возрастает при сердечной недостаточности и гипокалиемии.
Клиническое применение ибутилида ограничено купированием персистирующей мерцательной аритмии.
Класс IV
Блокаторы медленных кальциевых каналов ингибируют медленные кальциевые каналы, ответственные за деполяризацию синоатриального узла и АВ-узла. Основные электрофизиологические эффекты данного класса антиаритмических препаратов отмечают в этих структурах. Верапамил и дилтиазем подавляют автоматизм, замедляют скорость проведения и увеличивают рефрактерный период синоатриального узла и АВ-узла. Поскольку медленные кальциевые токи бывают необходимым субстратом следовых деполяризаций, блокаторы медленных кальциевых каналов могут подавлять последние, и поэтому данный класс антиаритмических препаратов бывает эффективен при триггерных аритмиях, в частности, при некоторых мультифокальных предсердных аритмиях и верапамилчувствительной желудочковой тахикардии.
Верапамил хорошо абсорбируется в ЖКТ (до 90%). Однако при первом прохождении препарата через печень биодоступность ЛС снижается до 20-35%. До 90% верапамила связывается с белками плазмы крови. Период полувыведения верапамила составляет 5-12 ч.
Дилтиазем также хорошо абсорбируется в ЖКТ, но при первом прохождении препарата через печень биодоступность ЛС снижается до 40%. С белками плазмы крови связывается до 70-80% дилтиазема. Препарат метаболизируется в печени, а период полувыведения составляет около 3,5 ч.
Блокаторы медленных кальциевых каналов оказывают отрицательный инотропный эффект и снижают АД. Однако данный класс антиаритмических препаратов не индуцирует проаритмии.
К побочным эффектам блокаторов медленных кальциевых каналов относят прогрессирование сердечной недостаточности, артериальную гипотензию, брадиаритмии, претибиальные отёки и запоры.
Блокаторы медленных кальциевых каналов показаны для лечения симптоматической синусовой тахикардии, для купирования и профилактики АВ-реципрокной тахикардии, фокальной и мультифокальной предсердной тахикардии. Блокаторы медленных кальциевых каналов рекомендуют использовать для контроля ЧСС у пациентов с постоянной формой мерцательной аритмии. Кроме того, блокаторы медленных кальциевых каналов могут быть эффективны при лечении относительно редкой идиопатической (верапамил-чувствительной) желудочковой тахикардии.
Немедикаментозное лечение аритмий
Для нефармакологического лечения аритмий в основном используют методы радиочастотной аблации компонентов петли re-entry (в основном при суправентрикулярных аритмиях) и имплантацию дефибриллятора-кардиовертера (в основном для лечения желудочковых аритмий).
Исходной процедурой перед выполнением радиочастотной аблации служит электрофизиологическое картирование предсердий, АВ-узла и желудочков для определения критических компонентов петли кругового движения импульса. После обнаружения таких участков проводят собственно радиочастное воздействие, в результате которого из-за локального повреждения тканей анатомически разрывается циркуляция возбуждения по петле кругового движения импульса. В основном радиочастотную аблацию проводят при АВ-реципрокной тахикардии. В некоторых случаях радиочастотную аблацию применяют для лечения автоматических аритмий, в основном для разрушения очагов патологического автоматизма.
Имплантируемый кардиовертер-дефибриллятор - портативное устройство, имплантируемое, как правило, под грудную мышцу. Трансвенозный электрод при этом помещают в правый желудочек. ИКД распознаёт желудочковые тахиаритмии и купирует их с помощью шо-
кового импульса. ИКД в основном применяют для лечения желудочковой тахикардии и профилактики внезапной сердечной смерти.
13.8. ПРИНЦИПЫ ВЫБОРА АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ И ТЕРАПИЯ НЕКОТОРЫХ НАИБОЛЕЕ РАСПРОСТРАНЕННЫХ АРИТМИЙ
Выбор антиаритмического препарата следует проводить на основе соотношения эффективности и безопасности ЛС. При назначении антиаритмических препаратов для лечения пациентов с высоким риском жизнеугрожающих аритмий или внезапной сердечной смерти рекомендовано ориентироваться на препараты с доказанной эффективностью. При решении вопроса о лечении аритмий, из-за которых снижается качество жизни, но не изменяется прогноз болезни, на первое место выходит вопрос безопасности терапии, и предпочтение отдают препаратам с минимальным проаритмическим потенциалом и низкой системной токсичностью.
При выборе антиаритмического препарата необходимо учитывать стандартные противопоказания. Кроме того, следует принимать во внимание необходимость приёма других препаратов, применение которых может способствовать развитию проаритмий при совместном назначении с антиаритмическими ЛС.
Ниже представлены современные рекомендации по выбору антиаритмических препаратов для лечения наиболее распространённых аритмий.
Суправентрикулярные тахикардии
Фокальная предсердная тахикардия
Наиболее вероятной причиной фокальной предсердной тахикардии служит наличие очага патологического автоматизма, триггерной активности или кругов микро-re-entry с локализацией патологического фокуса в предсердной ткани. При лечении пароксизма фокальной предсердной тахикардии с гемодинамическими нарушениями методом выбора считают электрическую кардиоверсию. Для купирования фокальной предсердной тахикардии без значимых гемодинамических нарушений рекомендуют использовать β-адреноблокаторы, блокаторы медленных кальциевых каналов, прокаинамид, трифосаденин, флекаинид, пропафенон, амиодарон, соталол. С целью профилактики данного нарушения ритма препаратами выбора служат β-адреноблокаторы и блокаторы медленных кальциевых каналов. Эффективными также могут быть соталол, амиодарон и радиочастотная катетерная аблация.
Мультифокальная предсердная тахикардия
Наиболее вероятной причиной развития мультифокальной предсердной тахикардии служит наличие нескольких очагов патологического автоматизма в миокарде предсердий. Эту форму нарушений ритма наиболее часто отмечают при лёгочных заболеваниях, метаболических и электролитных нарушениях. Основа лечения - устранение фоновой причины аритмии. Из антиаритмических препаратов рекомендуют использовать блокаторы медленных кальциевых каналов, трифосаденин.
Синоатриальная реципрокная тахикардия
Наиболее вероятной причиной синоатриальной реципрокной тахикардии служит наличие механизма повторного входа возбуждения. При этом круг циркуляции импульса в основном заключен внутри синоатриального узла, но может включать и ткань предсердий вокруг узла. Для лечения данной формы аритмии рекомендуют назначать β-адреноблокаторы, блокаторы медленных кальциевых каналов, амиодарон, трифосаденин. При частых рецидивах синоатриальной реципрокной тахикардии в случае неэффективности антиаритмических препаратов показана радиочастотная аблация синоатриального узла.
Атриовентрикулярная реципрокная тахикардия
АВ-реципрокная тахикардия развивается по механизму повторного входа возбуждения. Круг циркуляции импульса находится в тканях АВ-узла и связан с диссоциацией АВ-узла на 2 канала с различными электрофизиологическими свойствами. Эффективным методом лечения данного нарушения ритма считают катетерную радиочастотную аблацию, которую проводят как у пациентов с плохо переносимыми рецидивирующими пароксизмами АВ-реципрокной тахикардии, так и у больных редкими пароксизмами для полного устранения нарушения ритма. Из антиаритмических препаратов рекомендуют назначать β-адреноблокаторы, блокаторы медленных кальциевых каналов, соталол, амиодарон, флекаинид, пропафенон. Флекаинид и пропафенон не рекомендуют использовать при наличии ИБС и дисфункции левого желудочка. Соталол, флекаинид и пропафенон следует применять в качестве препаратов резерва при неэффективности β-адреноблокаторов и блокаторов медленных кальциевых каналов.
Мерцательная аритмия
Механизмом развития мерцательной аритмии считают циркуляцию возбуждения в одной или нескольких петлях кругового движения импульса, локализованных в миокарде предсердий. При мерцательной аритмии отмечают множество волн возбуждения, которые возникают
либо из-за функционирования нескольких кругов движения импульса, либо из-за «рассеивания» одиночной волны и образования «дочерних» волн. Кроме того, предполагают, что мерцательная аритмия может формироваться также по механизму патологического автоматизма. Лечение мерцательной аритмии основано на двух принципах.
• Купирование пароксизмов аритмии с последующим поддержанием синусового ритма.
• Контроль ЧСС при сохраняющемся нарушении ритма.
Для купирования пароксизмов мерцательной аритмии и восстановления синусового ритма показана электрическая кардиоверсия. Для купирования мерцательной аритмии давностью менее 7 сут назначают флекаинид, ибутилид, пропафенон, амиодарон, менее эффективны или менее изучены - хинидин и прокаинамид. Для восстановления ритма при сохранении аритмии в течение более 7 сут показаны амиодарон и ибутилид, а менее эффективны в этом случае - флекаинид, пропафенон и хинидин.
Для профилактики рецидивов мерцательной аритмии у больных без органической патологии сердца препаратами выбора считают флекаинид, пропафенон и соталол, а в качестве препаратов резерва используют амиодарон, дизопирамид, прокаинамид и хинидин. При наличии сердечной недостаточности препаратом выбора служит амиодарон. У пациентов с ИБС в качестве ЛС первой линии применяют соталол, а в качестве препаратов резерва - амиодарон. При их неэффективности можно назначать дизопирамид, прокаинамид и хинидин.
Для контроля ЧСС при сохраняющейся мерцательной аритмии эффективны верапамил и дилтиазем, β-адреноблокаторы и сердечные гликозиды.
Желудочковые аритмии
Желудочковые аритмии у пациентов, перенёсших инфаркт миокарда
Существенную долю в структуре причин смерти пациентов после инфаркта миокарда составляет внезапная сердечная смерть, обусловленная желудочковыми тахиаритмиями. Основным механизмом развития данных нарушений ритма считают повторный вход и круговое движение импульса. Для первичной профилактики внезапной сердечной смерти у этой категории больных применяют β-адреноблокаторы и амиодарон. Риск внезапной сердечной смерти снижается у пациентов после инфаркта миокарда также при назначении ингибиторов АПФ и статинов. Имплантация кардиовертера-дефибриллятора показана для первичной профилактики внезапной сердечной смерти у больных после инфаркта миокарда при наличии маркеров высокого
прогностического риска (фракция выброса левого желудочка менее 40% или эпизоды неустойчивой желудочковой тахикардии). При наличии эпизодов фибрилляции желудочков или желудочковой тахикардии, сопровождающейся гемодинамическими нарушениями, эффективно применение имплантируемого кардиовертера-дефибриллятора, а также β-адреноблокаторов или амиодарона. В случае отсутствия значимых гемодинамических нарушений во время пароксизмов желудочковой тахикардии наиболее эффективны β-адреноблокаторы или амиодарон.
Желудочковые аритмии у больных с дилатационной кардиомиопатией
У пациентов с дилатационной кардиомиопатией фатальные желудочковые тахиаритмии составляют значительную долю в структуре причин смерти. Механизмом развития этих нарушений ритма считают повторный вход и круговое движение импульса. Для лечения желудочковых тахиаритмий и профилактики внезапной сердечной смерти у пациентов с дилатационной кардиомиопатией используют β-адреноблокаторы. Кроме того, эффективны препараты без прямых электрофизиологических свойств: ингибиторы АПФ и блокаторы рецепторов альдостерона. Кроме того, рекомендовано применять имплантируемый кардиовертер-дефибриллятор, как для первичной, так и для вторичной профилактики.
Желудочковые аритмии у пациентов с гипертрофической кардиомиопатией
Желудочковые аритмии у больных с гипертрофической кардиомиопатией могут быть причиной внезапной сердечной смерти, в том числе у молодых пациентов без симптомов болезни. Миокард пациентов с гипертрофической кардиомиопатией имеет выраженные структурные изменения, и основным механизмом развития желудочковых аритмий считают повторный вход и круговое движение импульса. Эффективных антиаритмических препаратов, позволяющих снизить риск внезапной смерти у пациентов с гипертрофической кардиомиопатией, нет. Можно назначать амиодарон, но его эффективность недостаточно высока. Для профилактики фатальных желудочковых аритмий у больных с гипертрофической кардиомиопатией достаточно эффективным считают использование имплантируемого кардиовертера-дефибриллятора, как для первичной профилактики у пациентов с высоким риском аритмий, так и у больных, перенёсших эпизод остановки сердца.
Желудочковые аритмии у пациентов с синдромом удлинённого интервала Q-T
Синдром удлинённого интервала Q-T - наследственный дефект ионных каналов (калиевых или натриевых) кардиомиоцитов. Из-за
патологических ионных токов увеличивается продолжительность потенциала действия, что проявляется существенным увеличением интервала Q-T. У пациентов с синдромом удлинённого интервала Q-T отмечают высокий риск желудочковых тахиаритмий и внезапной сердечной смерти. Основным механизмом формирования аритмий у этой категории больных считают следовые деполяризации, индуцирующие желудочковые триггерные аритмии типа пируэт. Для лечения и профилактики желудочковой тахикардии у пациентов с синдромом уд- линённого интервала Q-T рекомендуют не назначать препараты, удлиняющие интервал Q-T или снижающие содержание калия в крови, а также избегать занятий профессиональным спортом. Эффективны также β-адреноблокаторы. При рецидиве аритмий на фоне терапии β-адреноблокаторами показана имплантация имплантируемого кардиовертера-дефибриллятора в сочетании с дальнейшим приёмом β-адреноблокаторов.
Катехолзависимая полиморфная желудочковая тахикардия
Катехолзависимая полиморфная желудочковая тахикардия развивается у пациентов без органического поражения сердца. Данное нарушение ритма характеризуется развитием пароксизмов полиморфной желудочковой тахикардии типа пируэт, индуцируемой нагрузкой или β-адреномиметиками. Причиной катехолзависимой полиморфной желудочковой тахикардии считают наличие следовых деполяризаций с последующей индукцией триггерной аритмии. В качестве препаратов выбора для первичной профилактики внезапной сердечной смерти рекомендуют использовать β-адреноблокаторы. Пациентам, перенёсшим эпизоды желудочковой тахикардии и внезапной сердечной смерти, показана имплантация имплантируемого кардиовертера-дефибриллятора в комбинации с β-адреноблокаторами или только β-адреноблокаторы.