Клиническая фармакология.: учебник для вузов / Под ред. В.Г. Кукеса.- 4-е издание., перераб. и доп., - 2009. - 1056 с.
|
|
|
|
ГЛАВА 12. ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПОНИЖАЮЩИЕ СОСУДИСТЫЙ ТОНУС
Описываемые в этой главе ЛС широко используют для лечения таких распространённых заболеваний, как артериальная гипертензия, ИБС, ХСН, а также состояний, обусловленных сужением периферических и сосудов головного мозга. Представленная нами классификация препаратов, понижающих тонус сосудов, отражает характер их воздействия на различные уровни регуляции сосудистого тонуса.
КЛАССИФИКАЦИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ПОНИЖАЮЩИХ СОСУДИСТЫЙ ТОНУС
• ЛС центрального действия.
Агонисты центральных а2-адренорецепторов и I1-имидазолиновых рецепторов.
• ЛС, влияющие на периферическую нервную систему.
Симпатолитики. Ганглиоблокаторы. α-Адреноблокаторы. Неселективные.
Селективные α1 -адреноблокаторы.
β-Адреноблокаторы.
Неселективные.
Селективные β1-aдреноблокаторы. α-, β-Адреноблокаторы.
• ЛС миотропного действия (вазодилататоры).
Венозные вазодилататоры (органические нитраты и нитриты, сиднонимины).
Вазодилататоры смешанного действия (нитропруссид натрия). Артериальные вазодилататоры (активаторы калиевых каналов, гидралазин, эндралазин*).
Блокаторы медленных кальциевых каналов (фенилалкиламины, дигидропиридины, бензотиазепины, дифенилпиперазины).
• ЛС, снижающие активность ренин-ангиотензин-альдостероно- вой системы.
Ингибиторы ангиотензинпревращающего фермента. Антагонисты ангиотензиновых рецепторов.
12.1. АГОНИСТЫ ЦЕНТРАЛЬНЫХ α2-АДРЕНОРЕЦЕПТОРОВ И I1-ИМИДАЗОЛИНОВЫХ РЕЦЕПТОРОВ
Гиперреактивность симпатической нервной системы - один из основных механизмов повышения АД и прогностически неблагоприятный признак у пациентов с сердечно-сосудистыми заболеваниями и особенно при артериальной гипертензии. Проявления гиперреактивности симпатической нервной системы: повышение АД, тахикардия, увеличение сердечного выброса, почечная вазоконстрикция, задержка жидкости, а также инсулинорезистентность.
С давних времён предпринимались попытки ослабить влияние гиперреактивности симпатической на сердечно-сосудистую систему путём применения седативных препаратов - симпатолитиков (например, алкалоидов раувольфии). В начале 60-х годов появились первые ЛС (метилдопа и клонидин), оказывающие гипотензивное действие в результате избирательного воздействия на вазомоторные центры продолговатого мозга. Позднее, в 70-е годы, был создан гуанфацин , а в 80-е годы - моксонидин, рилменидин.
По механизму действия препараты этой группы могут быть разделены на следующие подгруппы:
• агонисты α2-адренорецепторов (метилдопа, гуанфацин);
• агонисты α2-адрено- и I1-имидазолиновых рецепторов (клонидин);
• агонисты Ij-имидазолиновых рецепторов (моксонидин, рилменидин).
Механизм действия и основные фармакодинамические эффекты
Регуляция тонуса симпатической нервной системы в вазомоторных центрах продолговатого мозга опосредована двумя типами рецепторов, расположенных на пресинаптических мембранах нейронов: α2-адренергическими рецепторами и I1-имидазолиновыми рецепторами. Установлено, что α2-адренорецепторы расположены преимущественно на мембранах нейронов в ядрах солитарного тракта (nucleus tractus solitarii), которые по афферентным волокнам получают импульсы с баро- и хеморецепторов крупных артерий. Стимуляцию этих нейронов клонидином, и гуанфацином сопровождает снижение АД и уменьшение ЧСС. Ядра солитарного тракта соединены вставочными нейронами с вентролатеральными ядрами продолговатого мозга, которые своими волокнами связаны с преганглионарными симпатическими нейронами грудных сегментов спинного мозга и расположенными в продолговатом мозге ядрами блуждающего нерва. От спинномозговых симпатических нейронов отходят холинергические волокна к симпатическим
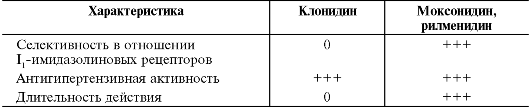
ганглиям и мозговому слою надпочечников, а от ядер блуждающего нерва в продолговатом мозге - одноимённые нервы. Помимо ядер солитарного тракта нейроны вентролатеральных ядер соединены с гипоталамусом. Следовательно, вентролатеральные ядра - общий путь для нескольких нисходящих влияний на активность симпатической нервной системы и тонус блуждающего нерва. В отличие от мембран нейронов ядер солитарного тракта, на мембранах нейронов вентролатеральных ядер продолговатого мозга расположены I1-имидазолиновые рецепторы, стимуляцию которых моксонидином и рилменидином сопровождает уменьшение АД и ЧСС. Таким образом, действуя на различные участки продолговатого мозга, агонисты α2-адренорецепторов и агонисты I1-имидазолиновых рецепторов вызывают сходные эффекты, связанные с ослаблением гиперреактивности симпатической нервной системы и повышением тонуса блуждающего нерва. Помимо вазомоторных центров продолговатого мозга, α2-адренорецепторы, I1-имидазолиновые рецепторы расположены на мембранах клеток других тканей и органов. Частое возникновение побочных эффектов, таких как сухость во рту и др., связанных с применением метилдопа, клонидина, гуанфацина, обусловлено стимуляцией α2-адренорецепторов, расположенных на клетках других тканей. Напротив, дополнительные эффекты, связанные со стимуляцией Ij-имидазолиновых рецепторов клеток почек (уменьшение реабсорбции натрия), надпочечников (торможение высвобождения катехоламинов), поджелудочной железы (увеличение секреции инсулина в ответ на нагрузку глюкозой), жировой ткани (усиление липолиза) и каротидных клубочков (по-видимому, повышение их чувствительности к снижению АД, гипоксии и гиперкапнии), весьма полезны, особенно у пациентов с артериальной гипертензией (см. табл. j2-j).
Таким образом, сравнение основных и дополнительных эффектов агонистов α2-адренорецепторов и агонистов 11-имидазолиновых рецепторов свидетельствует о преимуществах агонистов 11-имидазолиновых рецепторов (моксонидина и рилменидина), особенно при долгосрочном лечении пациентов с артериальной гипертензией.
Основные фармакодинамические эффекты агонистов центральных α2-адренорецепторов
Клонидин и гуанфацин - активные вещества, непосредственно стимулирующие а2-адренорецепторы, а метилдопа - не активное вещество и превращается в активный метаболит (α-метилнорадреналин) только в ЦНС. Гуанфацин - наиболее избирательный агонист α2-адренорецепторов. Его селективность в 3-10 раз выше, чем клонидина, однако клонидин обладает более выраженным гипотензивным дей-
ствием, чем эти препараты, в связи со своей способностью к одновременной стимуляции 11-имидазолиновых рецепторов. Иными словами, в отличие от селективных агонистов α2-адренорецепторов (гуанфацина), клонидин - смешанный агонист α2-адренорецепторов и 11-имидазолиновых рецепторов.
Фармакологические эффекты препаратов этой группы хорошо изучены. К ним относят:
• значительное снижение активности симпатической нервной системы (снижение АД, уменьшение ЧСС и снижение концентрации катехоламинов в крови);
• уменьшение ОПСС и сердечного выброса;
• поддержание почечного кровотока, несмотря на снижение системного АД;
• при длительном применении - регрессирование гипертрофии левого желудочка у больных с артериальной гипертензией;
• задержка жидкости в организме;
• отсутствие влияния на метаболизм глюкозы и липидов;
• частое возникновение (в большей степени при приёме клонидина) побочных эффектов, связанных с центральным механизмом действия (седативное действие) и влиянием на α2-адренорецепторы, которые расположены на мембранах клеток других органов и тканей (сухость во рту).
Следует отметить, что при внутривенном введении клонидина и гуанфацина снижению АД может предшествовать кратковременное (в первые 5-10 мин) его повышение (у клонидина в среднем на 10-15%), связанное с непосредственной стимуляцией α-адренорецепторов сосудов до проникновения препарата в ЦНС и проявлением их центрального гипотензивного действия, в связи с чем наиболее безопасный парентеральный путь введения клонидина и гуанфацина - внутривенное капельное введение, при котором этот феномен не наблюдают.
У клонидина при введении в конъюнктивальный мешок отмечена способность снижать внутриглазное давление за счёт местного адреномиметического и частично резорбтивного действия, в результате чего снижается секреция и улучшается отток внутриглазной жидкости.
Основные фармакодинамические эффекты агонистов центральных 11-имидазоловых рецепторов
Согласно современным представлениям, в основе антигипертензивного действия моксонидина и рилменидина лежит агонизм в отношении 11-имидазолиновых рецепторов нейронов, расположенных в вентролатеральных ядрах продолговатого мозга. Ослабляя гиперактивность симпатической нервной системы, эти агонисты 11-имидазо-
линовых рецепторов снижают АД и уменьшают ЧСС. Центральный механизм антигипертензивного действия моксонидина и рилменидина подтверждён результатами экспериментальных исследований. В частности, показано, что моксонидин вызывает значительное снижение АД при непосредственном введении в вентролатеральные ядра продолговатого мозга крыс, но не оказывает антигипертензивного действия у кошек после пересечения спинного мозга. У крыс антагонист I1-имидазолиновых рецепторов эфароксан* при введении в вентролатеральные ядра тормозит антигипертензивное действие моксонидина, вводимого внутривенно. Не исключено, что отчасти антигипертензивное действие моксонидина и рилменидина связано также со стимуляцией α2-адренорецепторов на мембранах нейронов ядер солитарного тракта. До конца не выяснено значение агонизма моксонидина и рилменидина в отношении периферических I1-имидазолиновых рецепторов мембран эпителиальных клеток почечных канальцев и хромаффинных клеток надпочечников (уменьшение реабсорбции натрия, воды и торможение высвобождения катехоламинов).
Моксонидин и рилменидин - высокоэффективные антигипертензивные средства, имеющие лучшую по сравнению с агонистами α2- адренорецепторов (клонидин, гуанфацин, метилдопа) переносимость. Весьма полезны их дополнительные фармакодинамические эффекты, связанные со стимуляцией I1-имидазолиновых рецепторов на мембранах клеток почек, надпочечников, поджелудочной железы, жировой ткани и каротидных клубочков. Эти благоприятные дополнительные фармакологические эффекты делают указанные препараты полезными при лечении пациентов с артериальной гипертензией в сочетании с ожирением и/или сахарным диабетом 2-го типа.
Несмотря на схожесть механизмов действия агонистов α2-адренорецепторов и агонистов Ij-имидазолиновых рецепторов, присутствуют существенные различия в степени выраженности вызываемых ими фармакодинамических эффектов, а именно чёткое преимущество препаратов из подгруппы агонистов 11-имидазолиновых рецепторов (табл. j2-j).
Таблица 12-1. Сравнительная характеристика антигипертензивных препаратов центрального действия (агонистов а2-адренорецепторов и агонистов I1-имидазолиновых рецепторов)
 Окончание табл. 12-1
Окончание табл. 12-1
 Примечания.
«0» - отсутствие существенного эффекта; «+», «++», «+++» - наличие
эффектов различной степени выраженности; «-», «--» - противоположные
эффекты различной степени выраженности.
Примечания.
«0» - отсутствие существенного эффекта; «+», «++», «+++» - наличие
эффектов различной степени выраженности; «-», «--» - противоположные
эффекты различной степени выраженности.
Фармакокинетика
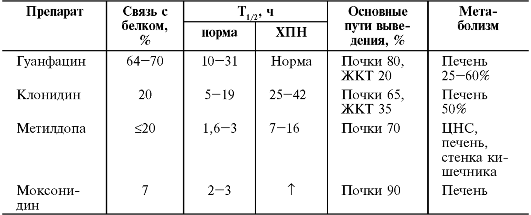
Основные показатели фармакокинетики препаратов этой группы представлены в табл. j2-2.
Таблица 12-2. Основные показатели фармакокинетики стимуляторов центральных α-адрено- и I1-имидазолиновых рецепторов
 Клонидин,
моксонидин и гуанфацин обладают высокой биодоступностью (соответственно
75%, 78% и 80-100%). Биодоступность метилдопа колеблется у разных людей
от 8 до 62% в зависимости от индивидуальных колебаний абсорбции
препарата. Начало гипотензивного действия клонидина, моксонидина и
гуанфацина коррелирует с достижением максимальной концентрации
препаратов в крови. Пик концентрации клонидина, моксонидина и гуанфацина
после перораль-
Клонидин,
моксонидин и гуанфацин обладают высокой биодоступностью (соответственно
75%, 78% и 80-100%). Биодоступность метилдопа колеблется у разных людей
от 8 до 62% в зависимости от индивидуальных колебаний абсорбции
препарата. Начало гипотензивного действия клонидина, моксонидина и
гуанфацина коррелирует с достижением максимальной концентрации
препаратов в крови. Пик концентрации клонидина, моксонидина и гуанфацина
после перораль-
ного приёма наступает соответственно через 2,5-4,5; 0,5-3 и 1-4 ч. У метилдопа связи между её концентрацией в крови и гипотензивным эффектом не наблюдают, так как активен только метаболит препарата, образующийся в ЦНС. Клонидин, метилдопа и моксонидин незначительно связываются белками крови, гуанфацин связывается с белками крови на 64-70% (40% препарата - с белками эритроцитов). Все препараты активно метаболизируются, причём клонидин (гидроксилирование), моксонидин и гуанфацин (ароматическое окисление и гидроксилирование в I фазе, затем конъюгация с глюкуроновой кислотой и сульфатом) - в печени, а метилдопа (конъюгация с сульфатом, метилирование) - в стенке кишечника и ЦНС. Клонидин и гуанфацин не имеют активных метаболитов. У метилдопа часть метаболитов (α-метилнорадреналин, α-метилдофамин) фармакологически активна и обладает гипотензивным эффектом. Выводятся препараты этой группы преимущественно почками в неизменённом виде и в виде метаболитов. Наибольший период полувыведения наблюдают у гуанфацина (у лиц молодого возраста 13-14 ч, у пожилых он увеличен до 30 ч), что позволяет достигнуть достаточного гипотензивного действия препарата при однократном приёме. Клонидин и метилдопа имеют меньший период полувыведения, что требует большей кратности приёма препаратов. Моксонидин и рилменидин, несмотря на небольшой период полувыведения, сохраняют свою активность в течение длительного времени, что позволяет достигать стабильного гипотензивного эффекта при их однократном назначении в течение суток (табл. 12-3).
У больных ХПН наблюдают увеличение периода полувыведения клонидина, моксонидина и метилдопа, что требует уменьшения кратности их приёма или снижения разовых доз. Уменьшение почечного клиренса гуанфацина у больных с различной степенью ХПН не сопровождается увеличением его концентрации в крови, так как увеличено внепочечное выведение препарата, в связи с чем отсутствует необходимость в коррекции режима его дозирования. Для внутривенного введения используют водорастворимый метилдопат гидрохлоридр (этиловый эфир метилдопа, незначительно отличающийся от неё по своим фармакокинетическим свойствам и метаболизму).
Побочные эффекты
Агонисты центральных α2-адренорецепторов часто вызывают сухость во рту, седативный эффект (сонливость), депрессию, заложенность носа, ортостатическую гипотензию, задержку жидкости и нарушение половой функции. Сухость во рту наиболее выражена в первые недели применения. Седативное действие агонистов α2-адренорецепторов может проявляться не только сонливостью, но и общей слабостью,
Таблица 12-3. Основные временные характеристики наступления эффекта агонистов центральных α2-адренорецепторов и I1-имидазолиновых рецепторов
 снижением
памяти и умственной активности. Крайним проявлением влияния на ЦНС,
особенно присущего клонидину и гуанфацину, служит депрессия, которая
чаще возникает у пожилых.
снижением
памяти и умственной активности. Крайним проявлением влияния на ЦНС,
особенно присущего клонидину и гуанфацину, служит депрессия, которая
чаще возникает у пожилых.
Наряду с характерными для всех агонистов α2-адренорецепторов побочными эффектами, связанными со стимуляцией α2-адренорецепторов, метилдопа может нарушать дофаминергические механизмы подавления секреции пролактина, в связи с чем при его применении в отдельных случаях у мужчин развивается гинекомастия, а у женщин - лактация. Реакциями гиперчувствительности объясняют такие редкие побочные эффекты метилдопа, как поражение печени, лихорадку и миокардит, а также положительный результат прямой реакции Кумбса. В единичных случаях метилдопа может вызывать гемолитическую анемию, лейкопению и тромбоцитопению. В отличие от метилдопа клонидин и гуанфацин не обладают гепатотоксичностью и не вызывают гематологических расстройств.
С другой стороны, для короткодействующего агониста α2-адренорецепторов клонидина характерен такой побочный эффект, как синдром отмены, наиболее изученное проявление которого - рикошетная гипертензия. Также синдром отмены может выражаться появлением тахикардии, потливости, тремора, возбуждения, головной боли. Развитие синдрома отмены связано с выбросом катехоламинов (после снятия центрального торможения) и возникающей на фоне приёма препаратов этой группы повышенной чувствительности рецепторов к катехоламинам. При этом определяют повышенное содержание катехоламинов в крови и моче. К числу других проявлений синдрома отмены относят рвоту без повышения АД. Иногда для возникновения синдрома отмены достаточно пропустить приём очередной дозы клонидина. При длительном (более 2-3 нед) применении клонидина даже в отсутствие достаточного гипотензивного эффекта также возможно развитие синдрома отмены.
Для профилактики синдрома отмены дозу клонидина, гуанфацина и метилдопа следует снижать постепенно в течение 7-10 дней. При отмене клонидина возможно одновременное назначение резерпина или гуанетидина, уменьшающих запасы катехоламинов. Для купирования остро возникшего синдрома отмены используют α-адреноблокаторы (фентоламин) и α-, β-адреноблокатор лабеталол®. Наиболее тяжёлая картина синдрома отмены может возникнуть при сочетанном назначении клонидина с β-адреноблокаторами. Повышенное содержание ренина плазмы - фактор риска возникновения данного осложнения.
Моксонидин и рилменидин, в отличие от клонидина и других агонистов а2-адренорецепторов, имеют хорошую переносимость. В плацебо-контролируемых исследованиях только сухость во рту достоверно чаще встречалась у пациентов с артериальной гипертензией, принимавших моксонидин, чем в контрольной группе (10,5% против 0,6%). В клинических исследованиях наиболее частыми побочными эффектами моксонидина были сухость во рту, головная боль и слабость, которые наблюдали более чем у 2% больных. Частота других побочных эффектов не превышала 1%.
Сухость во рту, сонливость и другие побочные эффекты при лечении рилменидином в дозе 1 мг/сут встречают с такой же частотой, как и при назначении плацебо. Побочные эффекты, которые наиболее часто наблюдают при лечении рилменидином: сухость во рту (4,9% в дозе 1 мг/сут и 7,7% в дозе 2 мг/сут), астения (2,7 и 4,1%), сонливость (2 и 4,5%) и головокружение (2,2 и 2,4%). В дозе 1-2 мг/сут препарат не оказывает седативного действия и не вызывает сухости во рту.
В отличие от клонидина, внезапную отмену моксонидина и рилменидина не сопровождает развитие синдрома отмены и рикошетная артериальная гипертензия.
Ни моксонидин, ни рилменидин не оказывают влияния на психические функции и не нарушают внимания при вождении автомашины и управлении механизмами. По сравнению с агонистами α2-адренорецепторов они значительно реже вызывают импотенцию у мужчин.
Противопоказания к назначению
Общие противопоказания к назначению агонистов α2-адренорецепторов: депрессия, атриовентрикулярная блокада и гиперчувствительность к препарату. Активные заболевания печени служат противопоказанием для применения метилдопа и гуанфацина. Гуанфацин, кроме того, противопоказан больным с тяжёлой почечной недостаточностью, а также во время беременности.
Противопоказания к назначению моксонидина и рилменидина: выраженная депрессия, синусовая брадикардия, синдром слабости синусового узла, АВ-блокада II-III степени, тяжёлые заболевания печени, тяжёлая почечная недостаточность. В связи с отсутствием клинического опыта не рекомендуют назначать моксонидин и рилменидин женщинам во время беременности и грудного вскармливания.
Показания к применению и режим дозирования
Препараты этой группы ранее широко использовали для лечения артериальной гипертензии. Следует отметить, что большое количество побочных эффектов, небольшая продолжительность действия и наличие синдрома отмены у клонидина привели к тому, что в настоящее время этот препарат применяют только для купирования гипертонических кризов, а его использование для долгосрочного лечения больных с артериальной гипертензией считают нецелесообразным. Предпочтительнее использование с гипотензивной целью препаратов, имеющих более продолжительное действие, таких, как моксонидин и рилменидин, у которых в многочисленных исследованиях продемонстрирована гипотензивная эффективность. Эти препараты вызывают наименьшее число побочных эффектов при высокой эффективности. К тому же они благоприятно влияют на обмен глюкозы и увеличивают липолиз, в связи с чем их можно считать препаратами первого ряда для длительного лечения артериальной гипертензии у пациентов с сахарным диабетом и ожирением.
Клонидин можно применять при мигрени (особенно провоцируемой употреблением шоколада, сыра, цитрусовых), в психиатрической практике для лечения абстиненции при отмене опиатов, этанола (алкоголя), никотина, а также при шизофрении. Иногда клонидин может быть использован для обезболивания в послеоперационном периоде и у онкологических больных. В виде глазных капель клонидин приме-
няют для снижения внутриглазного давления при первичной открытоугольной глаукоме. Наиболее часто используемый режим дозирования препаратов этой группы представлен в табл. 12-4.
Таблица 12-4. Режим дозирования агонистов центральных а2-адренорецепторов и ^-имидазолиновых рецепторов
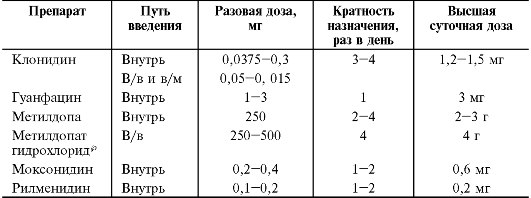 Клонидин в виде глазных капель назначают по 1-2 капли 0,025% раствора 2-4 раза в день. Гуанфацин назначают однократно на ночь.
Клонидин в виде глазных капель назначают по 1-2 капли 0,025% раствора 2-4 раза в день. Гуанфацин назначают однократно на ночь.
При ХПН изменяют режим дозирования метилдопа, метилдопат гидрохлорида, моксонидина и рилменидина в сторону уменьшения дозы. Режим дозирования гуанфацина при ХПН не изменяют.
Взаимодействие
Взаимодействие с другими ЛС препаратов этой группы представлено в приложении 3 (см. @).
12.2. СИМПАТОЛИТИКИ
Механизм действия и основные фармакодинамические эффекты
Общее свойство препаратов этой группы - способность уменьшать количество медиатора, поступающего к симпатическим нервным окончаниям, в результате чего резко ослабляется или прекращается передача нервного возбуждения. Резерпин уменьшает выход норадреналина в синаптическую щель за счёт его ускоренного высвобождения из гранул депо пресинаптических нервных окончаний, что способствует его быстрому разрушению МАО. Гуанетидин обладает способностью к накоплению в гранулах симпатических нервных окончаний, высвобождая оттуда норадреналин, который, достигая постсинаптических α-адренорецепторов, вызывает кратковременное (до нескольких часов) повышение АД, и только потом вытесненный норадреналин раз-
рушается аксональной МАО. Гуанетидин обладает кратковременным ганглиоблокирующим и небольшим стимулирующим действием на β- адренорецепторы сосудов. Накапливаясь в нервных окончаниях, гуанетидин обладает местно-анестезирующим действием.
В отличие от гуанетидина, плохо проникающего через гематоэнцефалический барьер, резерпин способен помимо периферического симпатолитического действия уменьшать содержание нейромедиаторов (норадреналина, дофамина, серотонина) в тканях головного мозга за счёт нарушения их транспорта из клеточной мембраны в гранулы депонирования, что объясняет его центральное симпатолитическое действие. В плазме медиаторы подвергаются действию МАО, превращаясь в неактивные метаболиты.
Благодаря периферическому симпатолитическому действию, резерпин и гуанетидин вызывают снижение систолического и диастолического АД, причём по силе гипотензивного действия гуанетидин превосходит резерпин. Снижение АД обусловлено как снижением ОПСС, так и уменьшением сердечного выброса. Под влиянием гуанетидина в начале лечения (иногда до нескольких часов) возможно развитие прессорной сосудистой реакции, которая затем сменяется стойкой гипотонией. При длительном приёме гуанетидина возможно уменьшение гипотензивного действия за счёт постепенного восстановления сердечного выброса.
Гуанетидин может выраженно снижать коронарный, церебральный и почечный кровоток, уменьшать клубочковую фильтрацию, у резерпина эти эффекты выражены намного слабее, а в ряде случаев он может вызвать улучшение показателей почечной гемодинамики.
Помимо сосудорасширяющего действия симпатолитики могут оказывать угнетающее действие на сердце, снижая сократимость, проводимость и ЧСС.
Резерпин, применяемый в дозе более 1,5 мг, способен оказывать нейролептическое действие, благодаря влиянию на нейрохимические процессы в ЦНС и вызывать депрессию, увеличивать секрецию пролактина.
Угнетение резерпином адренергической импульсации приводит к преобладанию холинергических эффектов, проявлением чего служит повышение секреторной и двигательной активности ЖКТ, развитие миоза, снижение внутриглазного давления. У больных, имеющих склонность к бронхоспазму, возможно его развитие.
Фармакокинетика
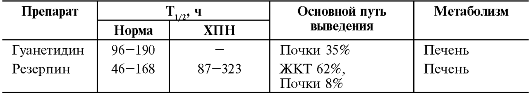
Основные показатели фармакокинетики симпатолитиков представлены в табл. 12-5.
Таблица 12-5. Показатели фармакокинетики симпатолитиков
 Оба
препарата обладают умеренной биодоступностью (40% у резерпина и 3-50% у
гуанетидина), что позволяет назначать их внутрь. Биодоступность
гуанетидина резко варьирует за счёт различной выраженности эффекта
первого прохождения. Оба препарата практически не связываются с белками,
однако длительное время остаются в окончаниях симпатических нервов, в
связи с чем имеют достаточно большой период полувыведения (44-168 ч у
резерпина и 96-190 ч у гуанетидина), который может увеличиваться в
терминальной стадии ХПН почти в 2 раза. В связи с большим периодом
полувыведения возможно достижение гипотензивного эффекта при однократном
назначении препаратов. Примерно 50% обоих препаратов метаболизируется в
печени. Резерпин в основном выводит ЖКТ в неизменённом виде (40%) и в
виде метаболитов, выведение через почки незначительно (8%), причём
только 1% в неизменённом виде. Гуанетидин экскретируют преимущественно
почки: половина в неизменённом виде и половина в виде метаболитов.
Метаболиты резерпина (метилрезерпат, триметоксибензойная кислота)
малоактивны, гуанетидина практически не активны.
Оба
препарата обладают умеренной биодоступностью (40% у резерпина и 3-50% у
гуанетидина), что позволяет назначать их внутрь. Биодоступность
гуанетидина резко варьирует за счёт различной выраженности эффекта
первого прохождения. Оба препарата практически не связываются с белками,
однако длительное время остаются в окончаниях симпатических нервов, в
связи с чем имеют достаточно большой период полувыведения (44-168 ч у
резерпина и 96-190 ч у гуанетидина), который может увеличиваться в
терминальной стадии ХПН почти в 2 раза. В связи с большим периодом
полувыведения возможно достижение гипотензивного эффекта при однократном
назначении препаратов. Примерно 50% обоих препаратов метаболизируется в
печени. Резерпин в основном выводит ЖКТ в неизменённом виде (40%) и в
виде метаболитов, выведение через почки незначительно (8%), причём
только 1% в неизменённом виде. Гуанетидин экскретируют преимущественно
почки: половина в неизменённом виде и половина в виде метаболитов.
Метаболиты резерпина (метилрезерпат, триметоксибензойная кислота)
малоактивны, гуанетидина практически не активны.
Существуют некоторые отличия в скорости наступления гипотензивного эффекта и его продолжительности, которые зависят в основном от способа введения препаратов (табл. 12-6).
Таблица 12-6. Основные временные характеристики наступления эффекта симпатолитиков
 После отмены резерпина эффект сохраняется в течение 2-4 нед, а гуанфацина - 7-14 дней.
После отмены резерпина эффект сохраняется в течение 2-4 нед, а гуанфацина - 7-14 дней.
Побочные эффекты и противопоказания к назначению
Часть побочных эффектов симпатолитиков связана с чрезмерно выраженным гипотензивным эффектом. Резкую гипотонию особенно часто наблюдают в первые недели лечения гуанетидином и очень редко - при лечении резерпином, чаще при его использовании в больших дозах. Кроме того, на фоне гуанетидина, хотя и значительно реже, чем при приёме ганглиоблокаторов, возможно развитие ортостатической гипотонии, иногда даже до степени коллапса, в связи с чем больным, принимающим гуанетидин, не рекомендуют резко переходить из горизонтального положения в вертикальное. Симпатолитики способны вызывать набухание слизистой оболочки полости носа, задержку натрия и воды в организме.
Другие побочные эффекты симпатолитиков связаны с преобладанием тонуса парасимпатической нервной системы на фоне их приёма, к ним относят: гиперсаливацию, боль в околоушной железе, тошноту, рвоту, диарею, гиперсекрецию желудочного сока, боль в желудке, ульцерозный гастрит, желудочное кровотечение, обострение язвенной болезни желудка и двенадцатиперстной кишки, ухудшение бронхиальной проходимости у предрасположенных к этому больных, развитие брадикардии, замедление АВ-проводимости (при использовании больших доз препаратов или применении у больных со склонностью к брадикардии или нарушению АВ-проводимости).
Кроме того, резерпин за счёт центрального действия может вызывать затяжную депрессию, экстрапирамидные расстройства, обусловленные истощением содержания дофамина в ЦНС, повышение аппетита, снижение либидо и потенции у мужчин, нарушения менструального цикла у женщин (за счёт гиперпролактинемии).
Приём симпатолитиков противопоказан при наличии тяжёлых сердечно-сосудистых заболеваний, особенно в стадии декомпенсации, резко выраженном атеросклерозе, острых нарушениях мозгового кровообращения, инфаркте миокарда, гипотонии, брадикардии, выраженном нефросклерозе с нарушениями функции почек, язвенной болезни желудка и двенадцатиперстной кишки (в большей степени для резерпина), феохромоцитоме (особенно для гуанетидина). Гуанетидин не рекомендуют назначать пожилым больным с доброкачественно протекающей артериальной гипертензией. Гуанетидин противопоказан во время беременности.
Таким образом, непредсказуемость первоначального гипотензивного эффекта (возможно как кратковременное повышение АД в начале лечения, так и развитие ортостатической гипотонии и коллапса), большое количество побочных эффектов, а для резерпина и слабо выраженное гипотензивное действие при использовании в средних терапевтических
дозах, а также появление более эффективных и обладающих малым количеством побочных эффектов препаратов для долгосрочного лечения артериальной гипертензии привели к тому, что в настоящее время препараты этой группы, а также комбинированные препараты, в состав которых входит резерпин (адельфан®, трирезид*, кристепин*) не рекомендуют для долгосрочного лечения артериальной гипертензии.
12.3. ГАНГЛИОБЛОКАТОРЫ
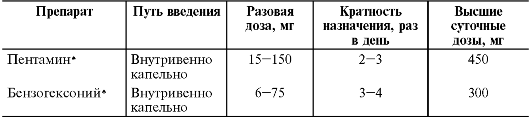
К ганглиоблокаторам относят ЛС короткого действия (триметофана камсилат®, гигроний*, имехин*) и ЛС средней продолжительности действия (бензогексоний*, пентамин*).
Механизм действия и основные фармакодинамические эффекты
Ганглиоблокаторы тормозят передачу нервного импульса с преганглионарных на постганглионарные волокна вегетативных ганглиев. Современные ганглиоблокаторы блокируют одновременно симпатические и парасимпатические ганглии, обладая неодинаковой активностью по отношению к разным группам ганглиев.
Кроме влияния на вегетативные ганглии, ганглиоблокаторы оказывают угнетающее действие на каротидные клубочки и хромаффинную ткань надпочечников. В больших дозах ганглиоблокаторы могут угнетать н-холинорецепторы нервно-мышечных синапсов и ЦНС.
Прерывая проведение нервных импульсов на уровне вегетативных ганглиев, ганглиоблокаторы изменяют функции органов, иннервируемых вегетативной нервной системой. Так, прекращая поток сосудосуживающих импульсов в симпатических ганглиях, ганглиоблокаторы способствуют значительному расширению мелких артерий, артериовенозных анастамозов и капилляров, замедляют кровоток до появления престатических изменений микроциркуляции, что следует учитывать при назначении ганглиоблокаторов лицам со склонностью к тромбообразованию. При применении ганглиоблокаторов АД и центральное венозное давление снижаются. В связи с угнетением рефлекторных механизмов, поддерживающих постоянный уровень АД при изменениях положения тела, возможно развитие ортостатического коллапса. Уменьшается сердечный выброс и ударный объём сердца в основном за счёт снижения венозного возврата, вследствие дилатации ёмкост- ных сосудов. В результате депонирования крови в расширенных брыжеечных сосудах и сосудах нижних конечностей снижается давление в малом круге кровообращения и в правом желудочке, уменьшается объ- ём циркулирующей крови. Снижение ОПСС обусловлено дилатацией
резистивных сосудов. В связи с уменьшением венозного возврата, минутного объёма крови и ОПСС снижена нагрузка на левый желудочек. Однако при значительном снижении АД возможно компенсаторное повышение тонуса резистивных сосудов и возрастание ОПСС. При умеренном снижении АД число сердечных сокращений не изменяется или наблюдают тенденцию к брадикардии. Но при значительном снижении АД может возникнуть компенсаторная тахикардия, появляется общая слабость, головокружение, сухость во рту, расширение зрачков, инъекция сосудов склер.
Угнетение хромаффинных клеток надпочечников и зоны каротидных клубочков приводит к уменьшению выделения катехоламинов и ослаблению прессорных сосудистых реакций. Вызывая фармакологическую денервацию, ганглиоблокаторы усиливают реактивность периферических адрено- и холинорецепторов и повышают реакцию последних на катехоламины и ацетилхолин.
Блокада парасимпатических ганглиев при применении этой группы ЛС приводит к уменьшению секреции экзокринных желез, уменьшению тонуса и перистальтики органов ЖКТ, мочевого пузыря и другим эффектам.
Фармакокинетика
По химическому строению ганглиоблокаторы короткого действия и средней продолжительности действия - четвертичные аммониевые соединения, которые плохо всасываются в ЖКТ, плохо проникают через ГЭБ, но при парентеральном применении весьма активны. Временные характеристики наступления эффекта ганглиоблокаторов представлены в табл. 12-7.
Таблица 12-7. Основные временные характеристики наступления эффекта ганглиоблокаторов
 Побочные эффекты и противопоказания к назначению
Побочные эффекты и противопоказания к назначению
При применении ганглиоблокаторов короткого действия и парентеральных форм препаратов средней продолжительности действия возможно развитие резко выраженной гипотонии, вплоть до коллапса. Типичное осложнение применения ганглиоблокаторов, связанное с угнетением симпатических ганглиев и нарушением компенсаторных реакций, - ортостатическая гипотония.
В связи с тем, что ганглиоблокаторы одновременно блокируют не только симпатические, но и парасимпатические ганглии, при их применении возможно снижение тонуса гладких мышц кишечника и развитие запоров, вздутия живота и в тяжёлых случаях - кишечной непроходимости. Кроме того, возможны сухость во рту, нарушение аккомодации, понижение тонуса мочевого пузыря с затруднением мочеиспускания, особенно у больных, имеющих нарушения уродинамики.
Абсолютное противопоказание к применению ганглиоблокаторов - феохромоцитома, так как денервация вегетативных ганглиев повышает чувствительность периферических адренергических структур, и прежде всего α1-адренорецепторов, в связи с чем возможно усиление вазопрессорного эффекта циркулирующих катехоламинов.
Ганглиоблокаторы противопоказаны при глаукоме, гипотонии, шоке, выраженном церебральном и коронарном атеросклерозе, тромбозах, перенесённом в недавнем прошлом инфаркте миокарда, ишемическом инсульте (менее 2 мес давности), тяжёлой почечной недостаточности, выраженной печёночной недостаточности, субарахноидальном кровоизлиянии.
Ганглиоблокаторы нежелательно назначать лицам старше 60 лет из-за возрастания опасности тромбообразования на фоне замедления кровотока под влиянием ганглиоблокаторов.
Показания к применению и режим дозирования
Препараты короткого действия (триметофана камсилат®, гигроний* и имехин*) оказывают кратковременное ганглиоблокирующее действие, и в связи с этим их используют главным образом в анестезиологической практике для проведения управляемой гипотонии и подавления вегетативных рефлексов, связанных с операцией (в частности, при проведении нейрохирургических вмешательств). Иногда их могут использовать для купирования тяжёлых гипертонических кризов, а также в акушерской практике для лечения нефропатии беременных и эклампсии.
Препараты средней продолжительности действия в настоящее время для длительного лечения артериальной гипертензии не используют, что связано с большим количеством побочных эффектов при их при-
 Таблица 12-8. Режим дозирования ганглиоблокатора короткого действия гигрония*
Таблица 12-8. Режим дозирования ганглиоблокатора короткого действия гигрония*
Управляемая гипотония (внутривенное капельное введение), капель/мин 0,1% раствор гигрония* | Однократное внутривенное введение в течение не менее 7 мин | |
начальная доза | поддерживающая доза | |
70-100 | 30-40 | 40-80 мг |
Таблица 12-9. Режим дозирования ганглиоблокаторов средней продолжительности действия
 Взаимодействие
Взаимодействие
Взаимодействие ганглиоблокаторов с другими препаратами см. в приложении 3 (см. @).
12.4. α-АДРЕНОБЛОКАТОРЫ
о -Адреноблокаторы - довольно большая и неоднородная группа ЛС, которые с начала 60-х годов используют для лечения различных форм артериальной гипертензии. Интерес к о -адреноблокаторам заметно ослабел в 70-е годы, когда для лечения артериальной гипертензии стали широко использовать тиазидные диуретики, β-адреноблокаторы, блокаторы медленных кальциевых каналов и ингибиторы АПФ. В начале 90-х годов интерес к α-адреноблокаторам вновь возрос, пос-
кольку было показано, что селективные блокаторы о 1-адренорецепторов длительного действия (в первую очередь доксазозин) вполне сравнимы по эффективности, переносимости и безопасности с другими антигипертензивными препаратами. Более того, оказалось, что о 1-адреноблокаторы обладают рядом ценных дополнительных свойств, благодаря которым они могут быть особенно полезны при лечении артериальной гипертензии у больных с доброкачественной гиперплазией предстательной железы, атерогенной дислипидемией, сахарным диабетом и облитерирующим атеросклерозом нижних конечностей, нарушениями половой функции у мужчин.
Классификацияα-адреноблокаторов
α-Адреноблокаторы разделяют на две основные группы:
• неселективные α1-, а2-адреноблокаторы;
• селективные α 1-адреноблокаторы.
Неселективные α-адреноблокаторы (фентоламин, феноксибенза- мин*) ослабляют эффекты катехоламинов как на α1-, так и на α2- адренорецепторы, тогда как селективные о -адреноблокаторы (празозин, доксазозин, теразозин, тримазозин*, буназозин*9 и препараты, преимущественно блокирующиеα1А-адренорецепторы, расположенные в гладкой мускулатуре предстательной железы, шейки мочевого пузыря и простатической части уретры, - альфузозин и тамсулозин) избирательно тормозят эффекты катехоламинов на о 1-адренорецепторы сосудов и других органов.
Кроме того, о -адреноблокирующими свойствами обладают некоторые антигипертензивные препараты, которые формально не относят к группе α-адреноблокаторов. Так, α1-адреноблокирующее действие обнаружено у трех β-адреноблокаторов (карведилола , лабеталола® и проксодолола*), селективного блокатора 5-НТ2-серотониновых рецепторов кетансерина*9и агониста центральных 5-НТ1А-рецепторов - урапидила.
Механизм действия и основные фармакодинамические эффекты
Как известно, по локализации о -адренорецепторы разделяют на постсинаптические (о 1 и о 2), пресинаптические (о 2), а также внесинаптические (α2). При лечении артериальной гипертензии клиническое значение имеет блокада постсинаптических о 1-адренорецепторов, которые опосредуют вазоконстрикторное действие норадреналина, высвобождаемого из окончаний постганглионарных симпатических нервных волокон. Пресинаптические о 2-адренорецепторы участвуют в регуляции высвобождения норадреналина из окончаний симпатических нервных волокон по механизму отрицательной обратной связи.
Поэтому при блокаде о 2-адренорецепторов высвобождение норадреналина увеличено, что нежелательно при артериальной гипертензии. В условиях о 2-адреноблокады высвобождаемый норадреналин может стимулировать β-адренорецепторы сердца, которые опосредуют положительные хроно- и инотропный эффекты катехоламинов. Таким образом, у пациентов с артериальной гипертензией блокада о 2-адренорецепторов весьма вредна.
В основе антигипертензивного действия селективных блокаторов о 1-адренорецепторов лежит их способность тормозить стимулирующие эффекты норадреналина на артерии и вены. о 1-Адреноблокаторы снижают АД, ослабляя артериальную и венозную вазоконстрикцию, характерную для больных с артериальной гипертензией. У празозина венорасширяющее действие преобладает над расширением артериол. Так, под влиянием празозина периферический венозный тонус снижается, как правило, на 60-70%, а ОПСС на 35-45%. Снижение венозного тонуса приводит к возрастанию венозной сосудистой ёмкости, уменьшению венозного возврата к сердцу и кровенаполнения лёгких. Уменьшение диастолического наполнения левого желудочка вызывает уменьшение преднагрузки и давления в малом круге кровообращения. Одновременно со снижением венозного тонуса уменьшается тонус артериол, что приводит к снижению АД (в среднем на 20%) и ОПСС (в среднем на 30-45%).
Важное клиническое значение имеют внесосудистые эффекты о 1-адреноблокаторов, в том числе их благоприятное влияние на обмен липидов и углеводов, агрегацию тромбоцитов, уродинамику и половую функцию у мужчин.
• Селективные блокаторы о 1-адренорецепторов могут улучшать липидный состав крови. В частности, они значительно снижают содержание в крови общего холестерина за счёт его атерогенной фракции - холестерина липопротеидов низкой плотности - и одновременно повышают уровни антиатерогенных липопротеидов высокой плотности. Содержание триглицеридов также снижается при применении о 1-адреноблокаторов. Благоприятное влияние празозина и других о 1-адреноблокаторов на липидный состав крови особенно выражено у больных с атерогенными дислипидемиями.
• о 1-Адреноблокаторы значительно повышают чувствительность тканей к действию инсулина. Доксазозин, например, вызывает небольшое, но статистически достоверное снижение базального уровня глюкозы (в среднем на 7 мг/дл или 5%) и инсулина (на 14 ммоль/л или 17%) у больных артериальной гипертензией.
• Показано, что о 1-адреноблокаторы (в частности доксазозин) тормозят агрегацию тромбоцитов, индуцированную адреналином, коллагеном и АДФ.
• Преобладание α1-адренорецепторов в гладкой мускулатуре предстательной железы и шейке мочевого пузыря послужило основанием для использования празозина, а затем и других α1-адреноблокаторов у больных с доброкачественной гиперплазией предстательной железы. В ряде исследований показано, что α1-адреноблокаторы значительно устраняют клинические симптомы доброкачественной гиперплазии предстательной железы. В частности, они увеличивают максимальную и среднюю скорость мочеиспускания. Наблюдения показывают, что у больных с исходно нормальным АД α1-адреноблокаторы улучшают мочеиспускание, не оказывая при этом существенного гипотензивного действия (снижение АД в среднем всего на 6/4 мм рт.ст.).
• У подавляющего большинства больных с расстройствами эрекции половая функция улучшается под влиянием доксазозина. В литературе есть сообщения о том, что празозин также способен улучшать половую функцию у мужчин. Можно предполагать, что способность нормализовать нарушенную половую функцию у мужчин с артериальной гипертензией присуща всем селективным α1-адреноблокаторам.
При проведении клинических исследований было также показано, что при длительном приёме одного из α1-адреноблокаторов, доксазозина, наблюдают обратное развитие гипертрофии левого желудочка у пациентов с артериальной гипертензией, причём по способности уменьшать массу миокарда левого желудочка он практически не имеет отличий от тиазидных диуретиков, β-блокаторов, ингибиторов АПФ и блокаторов медленных кальциевых каналов. Однако недавно было продемонстрировано, что длительное применение доксазозина у больных артериальной гипертензией сопряжено с увеличением риска развития хронической сердечной недостаточности.
Фармакокинетика
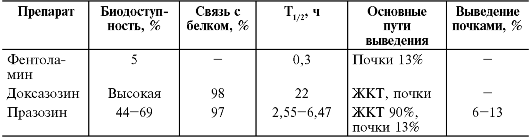
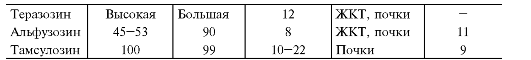
Основные показатели фармакокинетики α-адреноблокаторов представлены в табл. 12-10.
Таблица 12-10. Основные показатели фармакокинетики α-адреноблокаторов
 Окончание табл. 12-10
Окончание табл. 12-10
 Благодаря
низкой биодоступности фентоламин используют только в парентеральной
форме. И наоборот, обладающие высокой биодоступностью празозин,
доксазозин, теразозин, буназозин*, тримазо- зин*9, альфузозин, тамсулозин применяют перорально.
Благодаря
низкой биодоступности фентоламин используют только в парентеральной
форме. И наоборот, обладающие высокой биодоступностью празозин,
доксазозин, теразозин, буназозин*, тримазо- зин*9, альфузозин, тамсулозин применяют перорально.
Препататы этой группы в основном значительно связываются с белками крови, что следует учитывать при их назначении больным с гипопротеинемией, циррозом печени и т.п. α-Адреноблокаторы в основном метаболизируются в печени, а выводятся почками и ЖКТ в виде неактивных метаболитов, что позволяет использовать большинство α-адреноблокаторов при заболеваниях почек без коррекции доз. Празозин обладает эффектом первого прохождения. Фентоламин и празозин (при ХПН увеличен до 62 ч) имеют непродолжительный период полувыведения и обладают непродолжительным действием, в то же время доксазозин, тамсулозин и альфузозин, имеющие более продолжительный период полувыведения, назначают 1-2 раза в сутки.
Время наступления эффекта, максимальная выраженность эффекта, продолжительность действия отдельных α-адреноблокаторов в основном определяют их фармакокинетические особенности (табл. 12-11).
Таблица 12-11. Основные временные характеристики наступления эффекта при приёме α-адреноблокаторов
 Побочные эффекты и противопоказания к назначению
Побочные эффекты и противопоказания к назначению
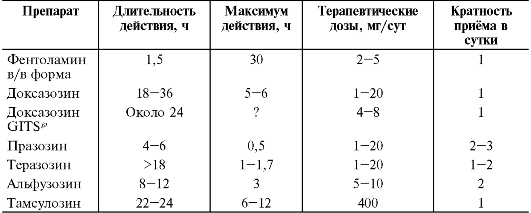
При применении α-адреноблокаторов (особенно фентоламина, празозина) возможно развитие ортостатической гипотонии и реже коллапса. Для α1-адреноблокаторов характерен так называемый «эффект первой дозы» - резкое снижение АД после приёма первой дозы препарата, которое проявляется головокружением и в ряде случаев обмороком. Обморок после первой дозы чаще возникает у больных с гипокалиемией, принимающих диуретики, β-адреноблокаторы и блокаторы медленных кальциевых каналов, а также у лиц пожилого возраста. В связи с этим лечение такими препаратами следует начинать с первой пробной дозы - 0,5 мг для празозина и 0,1 мг для теразозина в то время, когда больной находится в постели. Терапию диуретиками следует прекращать за 2-3 дня до назначения α1-адреноблокатора и возобновлять, если это необходимо для контроля АД, не ранее чем через 2-3 дня. Возникшая гипотония может быть устранена введением норэпинефрина, фенилэфрина. У доксазозина эффект первой дозы практически не наблюдают. Ретардная форма доксазозина даже в дозе 8 мг не имеет эффекта первой дозы.
Важная особенность α-адреноблокаторов, особенно неселективных и празозина, - возникновение тахифилаксии (уменьшение эффекта при курсовом назначении препаратов). У доксазозина тахифилаксии не наблюдают. При возникновении привыкания к препаратам для получения прежнего эффекта требуется увеличение их доз или присоединение к схеме лечения диуретиков.
Часть побочных эффектов обусловлена чрезмерной вазодилатацией, особенно часто наблюдаемой при применении препаратов в высоких дозах. К ним относят задержку жидкости в организме, появление отёков (так называемые «напёрсточные отёки»), головной боли, заложенности носа, рефлекторной активации симпатической нервной системы, (появление тахикардии, сердцебиения, нарушений ритма, учащение приступов стенокардии).
За счёт блокады α-адренорецепторов мочевыводящих путей у мужчин при применении α-адреноблокаторов может возникнуть ретроградная эякуляция, чаще всего наблюдаемая при применении празозина и реже - доксазозина, теразозина, тамсулозина.
Приём препаратов этой группы может вызывать появление слабости, утомляемости, сонливости, головокружения и артралгии. При- ём празозина и теразозина может вызвать учащение мочеиспускания. Теразозин при курсовом назначении способен вызывать снижение гематокрита, концентрации гемоглобина, содержания общего белка, альбуминов, лейкопению.
В длительных клинических исследованиях наиболее хорошо изучена переносимость коротко действующего α1-адреноблокатора празозина и длительно действующего α1-адреноблокатора доксазозина. По результатам многоцентровых, плацебо-контролируемых исследований установлена значительно меньшая частота развития побочных эффектов при лечении доксазозином, чем при лечении празозином. Кроме того, для доксазозина менее характерен эффект первой дозы.
Назначение α1-адреноблокаторов противопоказано при выраженном атеросклерозе коронарных и церебральных артерий, при значительных тахикардиях (особенно неселективных), аортальном стенозе, открытом боталловом протоке, пороках сердца со снижением наполнения левого желудочка (особенно празозина), выраженной гипотензии (систолическое АД ниже 80 мм рт.ст.). При тяжёлом поражении почек противопоказан фентоламин, при тяжёлом поражении печени - доксазозин. При беременности и в периоде лактации также относительно противопоказано назначение празозина, доксазозина.
Не следует применять α1-адреноблокаторы для лечения больных с систолической дисфункцией левого желудочка, поскольку, по данным рандомизированных исследований, они увеличивают смертность больных с хронической сердечной недостаточностью.
Наклонность к ортостатическим реакциям, которую часто имеют пожилые и больные диабетической нейропатией, - противопоказание для применения α1-адреноблокаторов. α-Адреноблокаторы не следует использовать при ИБС со стенокардией напряжения без одновременного назначения β-адреноблокаторов, которые предупреждают возникновение рефлекторной тахикардии.
Показания к применению и режим дозирования
В связи с тем, что у пациентов, страдающих артериальной гипертензией, блокада α2-адренорецепторов нежелательна (приводит к накоплению норадреналина в синаптической щели, что в конце концов, может уменьшить гипотензивное действие неселективных α-адреноблокаторов и способствовать развитию тахикардии и увеличению сердечного выброса) при длительной терапии, в настоящее время используют лишь селективные α1-адреноблокаторы. Неселективные α- адреноблокаторы (фентоламин) применяют только по специальным показаниям (для купирования и профилактики гипертонических кризов при феохромоцитоме, в том числе и во время операции, или при гипертонических кризах при отмене клонидина, или при приёме тираминсодержащих продуктов на фоне лечения ингибиторами МАО).
В многоцентровом контролируемом исследовании ALLHAT было показано, что длительное применение α1-адреноблокатора доксазо-
зина у больных с артериальной гипертензией достоверно повышает риск развития ХСН в два раза, а общее число сердечно-сосудистых осложнений - на 25%. Поэтому α1-адреноблокаторы следует назначать только определённым категориям пациентов с артериальной гипертензией, у которых эти препараты имеют явные преимущества перед другими антигипертензивными ЛС.
Благодаря тому, что селективные α1-адреноблокаторы, обладают рядом полезных дополнительных свойств (благоприятное влияние на метаболизм липидов и углеводов, агрегацию тромбоцитов, мочеотделение и половую функцию у мужчин), α1-адреноблокаторы в некоторых ситуациях предпочтительнее для длительной терапии артериальной гипертензии, чем другие антигипертензивные ЛС, а именно: у больных с сопутствующей доброкачественной гиперплазией предстательной железы, нарушениями эрекции, сахарным диабетом, атерогенной дислипидемией, хронической обструктивной болезнью лёгких и облитерирующим атеросклерозом сосудов нижних конечностей, а также у злостных курильщиков.
В РФ для длительной терапии артериальной гипертензии используют всего три селективных α1-адреноблокатора - празозин, доксазозин и теразозин. У теразозина отмечено более короткое антигипертензивное действие, чем у доксазозина; поэтому его необходимо принимать несколько раз в день. Как известно, чтобы свести к минимуму риск развития ортостатической гипотонии, лечение доксазозином начинают с назначения препарата в дозе 1 мг/сут. В дальнейшем дозу обычной формы доксазозина удваивают с интервалом в 1-2 нед и под контролем АД доводят до 8-16 мг/сут. Разработана ретардная форма доксазозина - доксазозин GITS. Доксазозин GITS можно сразу назначать в дозе 4 мг/сут. При необходимости через несколько дней или недель дозу доксазозина GITS повышают до 8 мг/сут. Клинические наблюдения показали, что эффект первой дозы не развивается даже при назначении доксазозина GITS' в таблетках по 8 мг.
Другое показание к назначению α1-адреноблокаторов - доброкачественная гиперплазия предстательной железы вне зависимости от уровня АД. α1-Адреноблокаторы можно использовать для лечения доброкачественной гиперплазии предстательной железы у больных как с повышенным, так и с нормальным АД. Для лечения доброкачественной гиперплазии предстательной железы применяют празозин, теразозин, альфузозин и тамсулозин. Такие α1-адреноблокаторы, как альфузозин и тамсулозин, предназначены только для лечения доброкачественной гиперплазии предстательной железы. Эти препараты обладают более избирательным действием на α1A-адренорецепторы, расположенные в гладкой мускулатуре предстательной железы, шейке мочевого пузыря
и простатической части уретры. Так, тамсулозин в 20 раз сильнее блокирует α1А-адренорецепторы, чем α1В-адренорецепторы гладкой мускулатуры сосудов.
Сравнительную характеристику α1-адреноблокаторов и режим их дозирования приведён в табл. 12-12.
Таблица 12-12. Сравнительная характеристика по продолжительности эффекта и режимы дозирования α-адреноблокаторов
 Взаимодействие
Взаимодействие
Взаимодействие α-адреноблокаторов с препаратами других групп представлено в приложении 3.
12.5. β-АДРЕНОБЛОКАТОРЫ
β-Адреноблокаторы конкурентно (обратимо) и избирательно ингибируют связывание катехоламинов с β-адренорецепторами. За более чем 40-летний период β-адреноблокаторы заняли прочную позицию в фармакотерапии, в первую очередь в лечении сердечно-сосудистых заболеваний. В настоящее время доказана высокая эффективность β-адреноблокаторов при всех формах ИБС, артериальной гипертензии, ХСН.
Механизм действия и основные фармакодинамические эффекты
Фармакологические эффекты β-адреноблокаторов можно подразделить на:
• обусловленные блокадой β1-адренорецепторов;
• обусловленные блокадой β2-адренорецепторов;
• не связанные с блокадой β-адренорецепторов. Кардиальные фармакологические эффекты β-адреноблокаторов
связаны с блокадой преимущественно β1-адренорецепторов сердца.
β-Адреноблокаторы, связываясь с β1-адренорецепторами, препятствуют взаимодействию с ними эндогенных катехоламинов, что ведёт к снижению стимулирующего действия G..-белка на аденилатциклазу. Её активность резко падает, что проявляется в замедлении синтеза цАМФ.
Снижение внутриклеточной концентрации цАМФ приводит к тому, что цАМФ-зависимые протеинкиназы, находясь в неактивном состоянии, не могут фосфорилировать мембранные кальциевые каналы, которые остаются закрытыми, и, таким образом, снижается ток ионов кальция из внеклеточного пространства, играющий роль «кальциевой искры», необходимой для массивного высвобождения ионов кальция из депо (саркоплазматического ретикулума). В сократительных кардиомиоцитах снижение внутриклеточной концентрации ионов кальция приводит к тому, что не может образоваться комплекс кальций-тропонин C, способный освободить места связывания сократительных белков актина и миозина, следствие этого - невозможность образования актино-миозинового комплекса и снижение силы сердечных сокращений (отрицательный инотропный эффект).
Уменьшение концентрации ионизированного кальция в клетках проводящей системы сердца приводит к:
• уменьшению ЧСС (отрицательный хронотропный эффект);
• угнетению проводимости (отрицательный дромотроный эффект), в большей степени в антеградном направлении через атриовентрикулярный узел и пучок Кента;
• снижению автоматизма (отрицательный батмотропный эффект), особенно в клетках синусового и атриовентрикулярного узла, предсердий, и в меньшей степени желудочков.
Снижение силы сердечных сокращений и ЧСС способствует уменьшению потребления миокардом кислорода, что обосновывает возможность применения β-адреноблокаторов в качестве антиангинальных ЛС у больных ИБС. Наличие у этой группы ЛС способности угнетать проводимость и автоматизм обусловливает антиаритмическое действие β-адреноблокаторов. Снижение содержания внутриклеточного кальция за счёт блокады β1-адренорецепторов в клетках юкста-гломерулярного аппарата почек сопровождает угнетение выброса ренина в кровь, уменьшение образования ангиотензина II, что наряду со снижением сердечного выброса (за счёт уменьшения силы сердечных сокращений и ЧСС) ведёт к снижению АД и определяет эффективность β-адреноблокаторов в качестве антигипертензивных ЛС.
Блокада β2-адренорецепторов гладкой мускулатуры бронхов также вызывает снижение активности аденилатциклазы и замедление синтеза цАМФ. Снижение концентрации цАМФ внутри клетки приводит к тому, что цАМФ-зависимые протеинкиназы остаются в неактивном
состоянии и не способны фосфорилировать и подавлять активность киназы лёгких цепей миозина. Последняя, в свою очередь, начинает активно фосфорилировать лёгкие цепи сократительного белка миозина. При этом миозин, соединяясь с актином, осуществляет сокращение гладкомышечной клетки, сопровождаемое повышением тонуса бронхов и развитием бронхоспазма.
По аналогичному механизму β-адреноблокаторы повышают тонус матки (стимуляция родовой деятельности); стимулируют ЖКТ - боль в животе, понос, тошнота, рвота; вызывают некоторое повышение ОПСС за счёт сужения артериол и венул (вплоть до развития синдрома Рейно).
Метаболические эффекты β-адреноблокаторов также опосредованы блокадой β-адренорецепторов. Блокада β2-адренорецепторов жировой ткани обусловливает уменьшение активности аденилатциклазы и замедление синтеза цАМФ, последнее приводит к тому, что цАМФзависимые протеинкиназы остаются неактивными и неспособными фосфорилировать и, таким образом, активировать триацилглицеролипазу. В результате происходит угнетение распада триглицеридов в жировой ткани, что препятствует повышению содержания свободных жирных кислот, при этом возрастает содержание триглицеридов в плазме крови, а концентрация общего холестерина не изменяется, содержание холестерина в липопротеидах высокой плотности снижается, уровень холестерина липопротеидов низкой плотности увеличивается. Подобные изменения приводят к повышению коэффициента атерогенности, и объясняют наличие атерогенного эффекта у некоторых β-адреноблокаторов (табл. 12-13).
Блокаду β1-адренорецепторов в печени также сопровождает снижение активности аденилатциклазы, замедление синтеза цАМФ и уменьшение работы цАМФ-зависимых протеинкиназ, которые становятся не способны влиять на функцию гликогенсинтетазы. В результате в печени происходит активация синтеза гликогена из глюкозы, что может привести к развитию гипогликемии. Следует отметить, что β-адреноблокаторы могут вызвать и гипергликемию за счёт блокады β2-адренорецепторов клеток островкового аппарата поджелудочной железы (при этом угнетена секреция инсулина). У людей без нарушения углеводного обмена описанные изменения не вызывают клинически значимых последствий. У больных сахарным диабетом в случаях неадекватной противодиабетической терапии β-адреноблокаторы могут привести к развитию серьёзных осложнений (гипогликемическая и кетоацидотическая кома и др.), также они могут маскировать симптомы гипогликемии (дрожь, сердцебиение, потливость), полностью невилируя их, лишая больных сигналов тревоги, и приводят к тому, что больные не принимают соответствующих мер.
Таблица 12-13. Влияние различных β-адреноблокаторов на липидный обмен
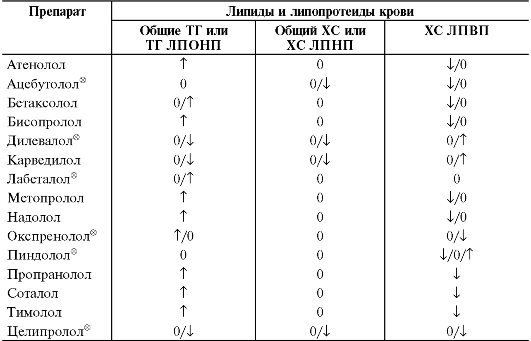 Примечания.
(i) - снижение (уменьшение); (Τ) - увеличение (повышение); (0) -
отсутствие существенного эффекта; (i/0/Τ) - данные литературы
противоречивы.
Примечания.
(i) - снижение (уменьшение); (Τ) - увеличение (повышение); (0) -
отсутствие существенного эффекта; (i/0/Τ) - данные литературы
противоречивы.
Классификация β-адреноблокаторов
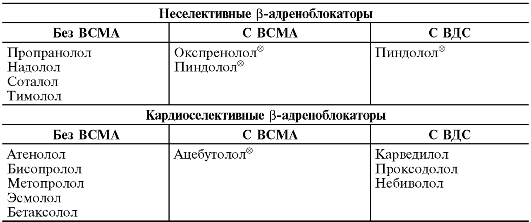
На основе фармакологических эффектов β-адреноблокаторы принято подразделять на:
• неселективные (неизбирательные), блокирующие β1- и β2-адренорецепторы (окспренолол®, пропранолол, пиндолол®, тимолол, надолол, соталол);
• кардиоселективные (избирательные), преимущественно блокирующие β1-адренорецепторы (ацебутолол®, талинолол , атенолол , метопролол) (табл. 12-14).
Следует отметить, что ряд β-адреноблокаторов обладает собственной или, как её ещё называют, внутренней (частичной агонистической) симпатомиметической активностью (ВСМА), проявляемой ими при низкой базальной (в покое) эндогенной симпатической активности. При повышении уровня эндогенной симпатической активности (например, при физической нагрузке) проявляется их β-адреноблокирующее действие. К таким препаратам (см. табл. 12-14) относят пиндолол, окспренолол®, ацебутолол®, талинолол. Они в меньшей степени снижают ЧСС и сократимость миокарда в покое, не оказывают негативного влияния на липидный обмен, у них слабее выражен синдром отмены.
Таблица 12-14. Классификация β-адреноблокаторов
 Выделяют
β-адреноблокаторы с дополнительными вазодилатирующими свойствами (см.
табл. 12-4). Гипотензивная и антиангинальная эффективность обычно выше,
чем у препаратов без вазодилатирующих свойств. Вазодилатирующие свойства
β-адреноблокаторов могут быть обусловлены тремя основными механизмами:
Выделяют
β-адреноблокаторы с дополнительными вазодилатирующими свойствами (см.
табл. 12-4). Гипотензивная и антиангинальная эффективность обычно выше,
чем у препаратов без вазодилатирующих свойств. Вазодилатирующие свойства
β-адреноблокаторов могут быть обусловлены тремя основными механизмами:
• сочетанием β-адреноблокирующей и α-адреноблокирующей активности (карведилол, проксодолол);
• высвобождением из эндотелиальных клеток оксида азота, обладающего вазодилатирующими свойствами (небиволол);
• выраженной ВСМА в отношении β2-адренорецепторов сосудов (пиндолол®).
При сравнении неселективных и кардиоселективных β-адреноблокаторов можно отметить, что последние в низких дозах мало влияют на физиологические реакции, опосредуемые периферическими β2-адренорецепторами (на тонус бронхов и артерий, секрецию инсулина, мобилизацию глюкозы из печени, сократительную активность матки во время беременности), что делает возможным их осторожное назначение для лечения больных с хронической обструктивной болезнью лёгких, сахарным диабетом, выраженными нарушениями периферического кровообращения (перемежающаяся хромота, синдром Рейно), а также во время беременности (табл. 12-15). Кроме того, кардиоселективные β-адреноблокаторы в минимальной степени ограничивают физическую активность, так как в отличие от неселективных препаратов они не вызывают сужение сосудов скелетной мускулатуры; поэтому при их применении реже наблюдают повышенную утомляемость и мышечную слабость. На фоне назначения кардиоселективных β-адреноблокаторов у некоторых больных, например, с гиперкинети-
ческим типом кровообращения, физическая работоспособность может даже увеличиться.
Таблица 12-15. Сравнительная характеристика основных фармакодинамических эффектов β-адреноблокаторов
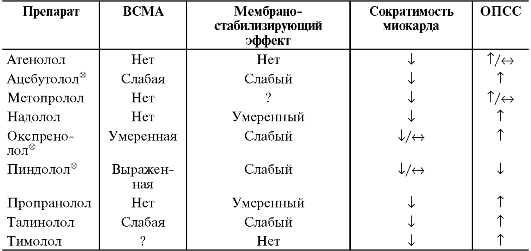 Примечания. i - снижает, Τ - повышает, o - не влияет.
Примечания. i - снижает, Τ - повышает, o - не влияет.
Все β-адреноблокаторы снижают ответ сердца на нагрузку, АД, ЧСС, атриовентрикулярную проводимость (кроме окспренолола® и пиндолола®, не влияющих на ЧСС и проводимость по атриовентрикулярному узлу), а также обладают выраженным антиаритмическим эффектом.
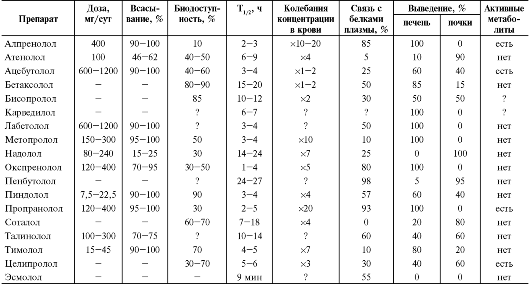
Фармакокинетика β-адреноблокаторов
Особенности фармакокинетики различных β-адреноблокаторов в значительной мере определяет степень их растворимости в липидах и воде (табл. 12-16). По этому признаку различают 3 группы β-адреноблокаторов:
• липофильные;
• гидрофильные;
• липо- и гидрофильные.
Липофильные β-адреноблокаторы, к которым относят бетаксолол, карведилол, метопролол, окспренолол®, пропранолол, тимолол и др., быстро и полностью (около 90%) всасываются в ЖКТ, легко проникают через ГЭБ (сопровождается повышением частоты побочных явлений со стороны ЦНС - бессонницей, общей слабостью, сонливостью, депрессией, кошмарными сновидениями, галлюцинациями и т.д.). Некоторые липофильные β-адреноблокаторы (карведилол, талинолол) выступают в качестве субстрата для гликопротеина Р (см. главу 1
«Клиническая фармакокинетика»), принимая участие в их всасывании (осуществляют их выделение из энтероцита в просвет кишечника), распределении (предотвращают проникновение черех ГЭБ в ЦНС) и выведении (осуществляют активную секрецию в мочу и желчь). Все липофильные β-адреноблокаторы подвергаются биотрансформации путём окисления с участием изофермента цитохрома Р-450 CYP2D6, причём пресистемный метаболизм β-адреноблокаторов при первом прохождении через печень составляет до 80%. CYP2D6 обладает генетическим полиморфизмом, поэтому у гомозигот по медленным аллелям этого изофермента отмечают более высокую максимальную концентрацию липофильных β-адреноблокаторов в плазме крови. Следовательно, для снижения риска нежелательных лекарственных реакций лечение β-адреноблокаторами у этой категории больных следует начинать с минимальной дозы (см. главу 7 «Клиническая фармакогенетика»). Следует отметить, что биотрансформация липофильных β-адреноблокаторов под действием CYP2D6 имеет стереоселективный характер: CYP2D6 в большей степени метаболизирует правовращающие энантиомеры β-адреноблокаторов, чем левовращающие. Необходимо учитывать, что метаболизм β-адреноблокаторов с эффектом первого прохождения через печень может меняться даже при нормальной функциональной активности гепатоцитов: липофильные β-адреноблокаторы, уменьшая печёночный кровоток (пропранолол, например, на 30%), могут замедлять свой собственный метаболизм в печени и таким образом удлинять период полувыведения при длительном применении. Так, при длительном назначении период полувыведения пропранолола может увеличиться в 2-3 раза по сравнению с однократным приёмом. Пропранолол, как и другие липофильные β-адреноблокаторы, может замедлять выведение из крови других ЛС, которые метаболизируются в печени (например, лидокаина, гидралазина, теофиллина). Снижение биотрансформации β-адреноблокаторов с выраженным пресистемным метаболизмом особенно выражено у больных циррозом печени, застойной недостаточностью кровообращения и в пожилом возрасте (у этих групп больных доза β-адреноблокаторов должна быть снижена). Липофильные β-адреноблокаторы интенсивно связываются с белками плазмы крови (пропранолол на 80-93%). У липофильных β-адреноблокаторов отмечают большой объём распределения.
Гидрофильные β-адреноблокаторы (атенолол , надолол , соталол и др.) не полностью (30-70%) и неравномерно всасываются в ЖКТ и обычно в незначительной мере (0-20%) метаболизируются в печени. Они выводятся почками в неизменённом виде (40-70%) либо в виде метаболитов. Гидрофильные β-адреноблокаторы имеют более продолжительный период полувыведения (6-24 ч), чем липофильные. Пе-
риод полувыведения гидрофильных β-адреноблокаторов увеличен у больных со сниженной скоростью клубочковой фильтрации, а также у пожилых; в таких случаях следует уменьшить суточную дозу препаратов за счёт кратности приёма. При выраженной почечной недостаточности более безопасно назначение не гидрофильных, а липофильных β-адреноблокаторов (бисопролол и др.), метаболизм которых протекает в печени. Поскольку выведение гидрофильных β-адреноблокаторов мало зависит от функции печени, они не взаимодействуют с ЛС, метаболизируемыми в печени, и более предпочтительны у больных тяжёлыми заболеваниями печени.
К третьей группе относят β-адреноблокаторы, растворимые как в жирах, так и в воде (ацебутолол®, бисопролол, пиндолол®, целипролол® и др.), они частично подвергаются биотрансформации в печени (40-60%) под действием CYP2D6, остальную часть выводят почки в неизменённом виде. β-адреноблокаторы со сбалансированным клиренсом обычно имеют небольшой период полувыведения (3-12 ч). Так, сбалансированный клиренс бисопролола объясняет низкую вероятность взаимодействия этого препарата с другими ЛС и большую безопасность их применения у больных с умеренной печёночной или почечной недостаточностью. В то же время при тяжёлой печёноч- ной и/или почечной недостаточности суточные дозы β-адреноблокаторов со сбалансированным клиренсом рекомендуют уменьшать в 1,5-2 раза.
β-Адреноблокатор эсмолол имеет очень короткий период полувыведения, так как разрушается эстеразами крови. Соответственно, он обладает сверхкоротким действием, которое полностью исчезает через 30 мин после прекращения внутривенной инфузии. Кратковременность действия делает его применение более безопасным у больных с сердечной недостаточностью, а кардиоселективность - у больных с хронической обструктивной болезнью лёгких. Препарат может быть использован при гипертонических кризах, особенно он эффективен при так называемом симпато-адреналовом кризе.
Побочные эффекты и противопоказания к назначению
Основные побочные эффекты β-адреноблокаторов, а также метаболические нарушения при их применении изложены в приложении 4. Следует отметить, что при применении кардиоселективных β-адреноблокаторов частота и выраженность побочных эффектов со стороны дыхательной системы, ЖКТ, ЦНС, мочеполовой системы, а также липидного и углеводного обмена гораздо ниже, чем при применении неселективных β-адреноблокаторов.
Таблица 12-16. Фармакокинетические параметры β-адреноблокаторов
 Противопоказания к назначению β-адреноблокаторов
Противопоказания к назначению β-адреноблокаторов
• к абсолютным противопоказаниям относят выраженную брадикардию в покое, синдром слабости синусового узла, АВ-блокаду II и III степени (кроме больных с искусственным водителем ритма), кардиогенный шок, отёк лёгких, бронхиальную астму, артериальную гипотензию (систолическое АД ниже 100 мм рт.ст.);
• к относительным противопоказаниям относят сахарный диабет (допускают назначение селективных β1-адреноблокаторов у больных с сахарным диабетом в стадии декомпенсации, у которых хорошо подобрана противодиабетическая терапия), хроническая обструктивная болезнь лёгких (допускают применение селективных β1-адреноблокаторов), нарушения периферического кровообращения, т.е. при облитерирующих заболеваниях артерий нижних конечностей, синдроме Рейно (допускают применение селективных β1-адреноблокаторов), депрессивные состояния, феохромоцитому, беременность и кормление грудью.
β-Адреноблокаторы - средства, небезразличные для развития плода и новорождённого, отдельные представители данной группы имеют различия между собой в этом плане.
Следует отметить, что в последние годы некоторые β-адреноблокаторы широко используют у беременных для лечения артериальной гипертензии, аритмий, обструктивной формы гипертрофической кардиомиопатии и других патологических процессов без серьёзных осложнений. Проникая через плацентарный барьер (например, атенолол) в I триместре беременности, может негативно влиять на плод; в III триместре при длительном применении может вызвать задержку внутриутробного развития плода, в связи с этим определение соотношения польза/риск при назначении препарата во время беременности обязательно.
Следует упомянуть о существовании у β-адреноблокаторов синдрома отмены, который однако наблюдают крайне редко. Резкое прекращение приёма β-адреноблокаторов опасно, в первую очередь, для больных ИБС, поэтому отменять их следует постепенно. При использовании препаратов с ВСМА риск обострения заболевания меньше. Организм реагирует на любое вмешательство в адаптационные механизмы, поэтому при блокаде β-адренорецепторов может возникнуть компенсаторное повышение чувствительности либо увеличиться количество β-адренорецепторов. Другими вероятными причинами синдрома отмены могут быть увеличение агрегации тромбоцитов и активности гормонов щитовидной железы. Внезапное прекращение применения β-адреноблокаторов проявляется симптомокомплексом (тахикардия, повышение АД, ухудшение течения стенокардии, иногда
развитие острого инфаркта миокарда вплоть до летального исхода), обусловленным повышенной активностью симпатической нервной системы. Последнее неблагоприятно сказывается на течении заболеваний сердечно-сосудистой системы. Кроме того, защитное действие β-адреноблокаторов позволяет больным ИБС переносить более высокие нагрузки, связанные с их работой. При резкой отмене препарата больные не успевают перестроиться (не ограничивают в должной мере физическую нагрузку), и поэтому их состояние может существенно ухудшаться.
Показания к применению и режим дозирования
Основные показания к применению β-адреноблокаторов.
• Стенокардия напряжения с эпизодами ишемии миокарда, сопровождаемыми или не сопровождаемыми болевыми ощущениями.
• Артериальная гипертензия.
• Профилактика развития желудочковых и предсердных аритмий.
• Первичная профилактика инсульта и ИБС у больных с артериальной гипертензией.
• Вторичная профилактика инфаркта миокарда после перенесён- ного ИМ.
• Профилактика внезапной смерти у больных с синдромом врожденного удлинения интервала Q-T.
• Улучшение насосной функции сердца при хронической сердечной недостаточности (карведилол, метопролол и бисопролол).
• Системные заболевания с нарушением адренергической активности (тиреотоксикоз, синдром Марфана, эссенциальный тремор, алкогольная абстиненция).
β-Адреноблокаторы применяют также по следующим показаниям:
• расслаивающая аневризма аорты;
• гипертрофическая обструктивная кардиомиопатия;
• дигиталисная интоксикация;
• пролапс митрального клапана;
• тетрада Фалло;
• митральный стеноз;
• синдром вегетативной дистонии.
Антиангинальный эффект β-адреноблокаторов объясняют следующими возможными механизмами:
• уменьшением потребности миокарда в кислороде за счёт снижения ЧСС, АД и сократимости миокарда;
• увеличением коронарного кровотока за счёт увеличения времени диастолической перфузии в условиях снижения ЧСС;
• улучшением коллатерального кровотока, перераспределением кровотока в зону ишемии миокарда;
• уменьшением микрососудистых повреждений миокарда;
• стабилизацией клеточных и лизосомальных мембран;
• улучшением высвобождения кислорода из оксигемоглобина;
• торможением агрегации тромбоцитов.
Антиангинальное действие β-адреноблокаторов широко используют при стабильной стенокардии, нестабильной стенокардии и при остром инфаркте миокарда. И хотя антиангинальное действие - группоспецифическое свойство всех β-адреноблокаторов, результаты многочисленных мультицентровых исследований показали, что только липофильные β-адреноблокаторы без ВСМА способны снижать риск развития острого инфаркта миокарда у больных ишемической болезнью сердца, обеспечивая как первичную, так и вторичную профилактику развития данного осложнения. Гидрофильные β-адреноблокаторы и β- адреноблокаторы с ВСМА не влияют на прогноз больных ИБС. Таким образом, эксперты Американского колледжа кардиологов и Американской ассоциации сердца относят β-адреноблокаторы к препаратам первого ряда для лечения стабильной стенокардии.
Механизм антигипертензивного действия различных β-адреноблокаторов обусловлен:
• уменьшением сердечного выброса в результате ослабления сократительной способности миокарда левого желудочка и урежения
ЧСС;
• торможением секреции ренина;
• перестройкой барорефлекторных механизмов дуги аорты и каротидного синуса;
• уменьшением высвобождения норадреналина из окончаний постганглионарных симпатических нервных волокон в результате блокады пресинаптических β2-адренорецепторов;
• увеличением высвобождения вазодилатирующих веществ (простагландинов Е2 и I2, оксида азота, предсердного натрийуретического фактора и др.);
• уменьшением ОПСС;
• влиянием на сосудодвигательные центры продолговатого мозга.
Механизмы антигипертензивного действия β-адреноблокаторов неодинаковы и зависят от наличия или отсутствия у них таких дополнительных свойств, как липофильность, кардиоселективность, ВСМА и вазодилатирующие свойства. Например, лишь неселективные β-адреноблокаторы могут существенно тормозить активность пресинаптических β2-адренорецепторов. ОПСС снижается только при использовании β-адреноблокаторов с вазодилатирующими свойствами. На со-
судодвигательные центры продолговатого мозга оказывают влияние, главным образом, липофильные β-адреноблокаторы, которые лучше гидрофильных проникают через ГЭБ.
β-Адреноблокаторы особенно показаны больным артериальной гипертонией на фоне гиперкатехоламинемии и гиперсимпатикотонии. Как правило, у таких пациентов присутствует тахикардия, повышен ударный и минутный объём. β-Адреноблокаторы применяют у больных с нормальным или сниженным тонусом резистивных сосудов, нормальным или скорригированным липидным спектром крови. Если правильно отобрать больных, то эффективность лечения составляет около 70%. Эффект достигает максимума к концу 3-й нед. На 1-й нед на терапию β-адреноблокаторами отвечают около 30% больных, на второй - 65%, поэтому судить об эффективности антигипертензивной терапии β-адреноблокаторами следует лишь к концу 2-3-й нед.
При лечении артериальной гипертонии очень важное значение имеет не только снижение АД, но и защита органов-мишеней - сердца, почек, головного мозга, периферических сосудов. β-Адреноблокаторы наравне с ингибиторами АПФ снижают выраженность гипертрофии миокарда левого желудочка.
Эксперты ВОЗ и Международного общества по изучению артериальной гипертонии в Международных рекомендациях по профилактике и лечению артериальной гипертонии определили место β-адреноблокаторов в терапии артериальной гипертонии: β-адреноблокаторы особенно показаны при сочетании артериальной гипертонии со стенокардией напряжения, тахиаритмиями и после перенесённого ОИМ.
В последнее время β-адреноблокаторы стали применять у больных ХСН. Активация симпато-адреналовой системы - один из основных ранних компенсаторных механизмов при снижении сердечного выброса и развитии сердечной недостаточности. При ХСН имеет место длительная хроническая гиперактивация симпатоадреналовой системы, которая из компенсаторной реакции превращается в патогенный фактор, способствующий усугублению ХСН. Так, существует прямая связь между повышенным уровнем норадреналина плазмы и смертностью больных с ХСН. Исследования последних лет позволили суммировать негативное воздействие гиперактивации симпатоадреналовой системы при ХСН:
• дисфункция и гибель кардиомиоцитов (за счёт некроза и ускорения апоптоза);
• ухудшение гемодинамики;
• снижение плотности и аффинности β-адренорецепторов;
• тахикардия;
• гипертрофия миокарда;
• провокация ишемии миокарда (за счёт тахикардии, гипертрофии миокарда и вазоконстрикции);
• провокация аритмий.
Исходя из изложенного, становится ясно, что теоретически существует множество точек приложения действия β-адреноблокаторов при
ХСН.
Говоря об эффективности β-адреноблокаторов при ХСН, следует разделять работы по оценке влияния препаратов на выживаемость больных и исследования по изучению изменения гемодинамических параметров, толерантности к нагрузке и т.д. Результаты многоцентровых контролируемых исследований показали, что только карведилол, метопролол, бисопролол уменьшают смертность у больных ХСН. В первом исследовании CIBIS-I отмечено снижение общей смертности на 20% при применении бисопролола, что, однако, не было достоверно. Причиной этому, как оказалось, послужила невысокая доза препарата - 5 мг. В дальнейшем были проведены более длительные исследования: US Carvedilol Trial, CIBIS-II, MERIT-HF, BEST. В исследовании US Carvedilol Trial (1094 пациента) было показанло, что карведилол снижает общую смертность у больных с сердечной недостаточностью на 48%. Эти данные были дополнены результатами австралийско-новозеландского исследования (всего 415 пациентов), которое выявило снижение общей смертности, числа госпитализаций, уменьшение числа используемых препаратов на 26%. В исследовании COPERNICUS показано снижение смертности на 35% при применении карведилола, причём в этом исследовании участвовали больные ХСН, имеющие IV функциональный класс. В исследовании BEST показано, что буциндолол снижает сердечно-сосудистую смертность на 12%. Однако показатели общей смертности, числа госпитализаций при лечении буциндололом существенно не изменились. Результаты двух других исследований (CIBIS-II с бисопрололом и MERIT-HF с метопрололом) оказались достаточно сходными. Оба препарата достоверно снижают общую смертность (на 34%), сердечно-сосудистую (на 29% и 38%) и внезапную смертность (на 44% и 41%), смертность, связанную с прогрессированием ХСН (на 36%). Четвертый препарат, продемонстрировавший эффективность при ХСН, - небиволол, который в исследовании SENIORS снижал смертность больных с ХСН старше 65 лет на 38%.
Как начинать терапию β-адреноблокаторами у больных ХСН? Как известно, β-дреноблокаторы при острой сердечной недостаточности противопоказаны. Перед началом терапии β-адреноблокаторами больной должен находиться в стабильном состоянии. Как долго? Опыт большинства исследований предусматривает время от 1 до 3 нед. Стабильность течения ХСН подразумевает:
• отсутствие необходимости парентерального назначения диуретиков, вазодилататоров и/или инотропных препаратов;
• неизменность базисной терапии на всем протяжении периода наблюдения;
• отсутствие выраженных лабораторных сдвигов, отражающих функцию почек, печени, водно-электролитного баланса;
• отсутствие побочных явлений со стороны лекарственных препаратов, входящих в состав базисной терапии;
• ремиссию сопутствующих заболеваний.
Начало терапии обычно должно соответствовать максимальному клиническому эффекту от проводимого стандартного лечения. Подразумевают, что при этом риск развития побочных эффектов β-адреноблокаторов уменьшен. В тяжёлых случаях возможно в течение некоторого времени наблюдать больного в амбулаторных условиях для оценки стабильности состояния пациента. После чего можно осуществить повторную госпитализацию для начала лечения β-адреноблокаторами. Вряд ли это необходимо для больных, у которых функциональный класс ХСН в результате проведённой терапии снижен до I-II. Побочные эффекты в этих случаях наблюдают не чаще, чем в начале лечения артериальной гипертензии β-адреноблокаторами.
Обычно используют следующие схемы назначения: в первый день
5 мг для метопролола и 3,125 мг для карведилола. Во второй день больные получают удвоенную дозу. Каждые 1-2 нед дозу увеличивают в два раза. Для достижения положительных гемодинамических и клинических эффектов β-адреноблокаторов, которые рассчитывает получить клиницист, суточная доза должна составлять 100-200 мг для метопролола и 50 мг для карведилола. Конечно, после первичной оценки толерантности к препаратам период титрования продолжают в амбулаторных условиях. Срок титрования строго не определён, но может быть растянут на месяцы (в исследовании CIBIS-II постепенное повышение дозы бисопролола с 1,25 до 10 мг производили в течение
6 мес).
Взаимодействие
Сочетание β-адреноблокаторов с ЛС, обладающими собственным отрицательным ино- и хронотропным действием, может привести к тяжёлым побочным реакциям. Так, комбинированное назначение β-адреноблокаторов с резерпином и гуанетидином возможно только при ежедневном врачебном контроле. При сочетанном применении β-адреноблокаторов с клонидином отмечают выраженное снижение АД и брадикардию, особенно при нахождении больных в горизонтальном положении. Отмена клонидина в этом случае может вызвать
значительное повышение АД, что связано с усилением выделения норадреналина из пресинаптических окончаний и значительным сужением сосудов за счёт стимуляции β-адренорецепторов, что усугубляет сопутствующая блокада β-адренорецепторов.
Сочетанное назначение β-адреноблокаторов с верапамилом , амиодароном, сердечными гликозидами может привести к резкой брадикардии и нарушениям АВ-проводимости. Поэтому, примененяя подобные комбинации, необходимо тщательно контролировать электрокардиограмму (ЧСС, интервал P-Q). Назначение β-адреноблокаторов с нитратами или дигидропиридиновыми блокаторами медленных кальциевых каналов обоснованно, поскольку первые снижают потребность миокарда в кислороде, а нитраты и блокаторы медленных кальциевых каналов, снижая тонус периферических и коронарных сосудов, обеспечивают гемодинамическую разгрузку миокарда и увеличение коронарного кровотока.
12.6. ВЕНОЗНЫЕ ВАЗОДИЛАТАТОРЫ
Нитраты - одни из старейших медикаментозных средств, используемых в клинической практике начиная со второй половины 19 века, что свидетельствует об их достаточной эффективности и безопасности.
Механизм действия и основные фармакодинамические эффекты
Установлено, что сосудорасширяющие эффекты органических нитратов и молсидомина реализуются через эндотелий-зависимый фактор релаксации сосудов, активная группа которого - оксид азота (NO). Эндогенный NO образуется в ходе превращения L-аргинина в цитруллин под действием NO-синтетазы.
Полагают, что спазм коронарных и других сосудов может в оп- ределённой мере быть обусловлен недостаточным синтезом эндогенного NO вследствие снижения эксперессии эндотелиальной NO-син- тетазы или ускоренным разрушением оксида азота. Установлено, что в организме органические нитраты превращаются в нитриты, из которых, возможно под влиянием альдегиддегидрогеназы, высвобождается NO, который, взаимодействуя со специфическими рецепторами (с их сульфгидрильными группами), образует нитрозотиолы, стимулирующие синтез цГМФ. Увеличение концентрации последнего и обуславливает в конечном итоге расслабление миоцитов.
Молсидомин в результате серии превращений также выделяет NO, таким образом, органические нитраты и молсидомин восполняют в этих случаях резервы NO в стенке сосудов. Известно, что эндотелийзависимый фактор релаксации сосудов вызывает активацию гуани-
латциклазы и стимулирует образование цГМФ (медиатор вазодилатации).
Кроме того, NO ингибирует агрегацию тромбоцитов, их адгезию к сосудистой стенке, а также вызывает дезагрегацию агрегированных тромбоцитов. Усиливая образование в стенках сосудов простациклина, венозные вазодилататоры улучшают процессы микроциркуляции.
Обнаружена различная чувствительность к нитратам емкостных и резистивных сосудов. Если максимально возможное расширение вен и начальное расширение артерий происходит уже при минимальных концентрациях нитратов (например, после приёма 0,1-0,2 мг нитроглицерина сублингвально), то артериолодилатирующее действие их проявляется после приёма больших доз (0,4-0,6 мг). Выраженность влияния нитратов на тонус артерий зависит не только от величины используемых доз, но и от исходного сосудистого тонуса.
Расширяя преимущественно венозные сосуды и незначительно - артериальные сосуды, венозные вазодилататоры уменьшают преднагрузку и постнагрузку на сердце, что, в конечном итоге, приводит к уменьшению наполнения левого желудочка в диастолу и - по закону гетерометрической регуляции Франка-Старлинга - к снижению ударного объёма и работы сердца, что закономерно приводит к уменьшению потребности миокарда в кислороде. У пациентов со стенокардией это способствует восстановлению баланса между потребностью миокарда в кислороде и его доставкой. С другой стороны, уменьшение преднагрузки приводит к разгрузке малого круга кровообращения и уменьшению в нём венозного застоя. Это свойство венозных вазодилататоров используют при лечении острой левожелудочковой недостаточности. Вены более чувствительны к нитратам, чем артерии. Возможно, причина в том, что гладкомышечные клетки вен содержат больше фермента, превращающего нитроглицерин в NO.
Дилатация артериол может вызвать системную гипотензию и рефлекторную тахикардию. Однако у больных с сердечной недостаточностью рефлекторной активации симпатической нервной системы не происходит, поскольку снижение у них постнагрузки в действительности улучшает сердечный выброс и снижает активность симпатической нервной системы.
Помимо снижения преднагрузки антиангинальное действие венозных вазодилататоров связано с их влиянием на тонус коронарных сосудов. Так, уменьшение (вследствие уменьшения наполнения камер сердца) интрамиокардиального напряжения стенок миокарда косвенно способствует улучшению коронарного кровообращения, особенно субэндокардиальных отделов миокарда, испытывающих наибольшую потребность в кислороде и получающих его в недостаточном количестве, так как
в систолу они сдавливаются сильнее других и поэтому особенно уязвимы. Немаловажную роль в увеличении коронарного кровотока на фоне приёма нитратов и молсидомина играет их способность снижать давление в системе коронарных вен. Непосредственное коронародилатирующее действие этих препаратов в дозах, используемых в клинике, выражено незначительно и, по-видимому, не имеет существенного значения в формировании антиангинального действия. В то же время у больных с резко увеличенным тонусом коронарных артерий нитроглицерин может способствовать его снижению. Следует отметить, что при приёме этих препаратов коронарные артерии малого диаметра расширяются в большей степени, чем крупные, что объясняет крайне редкое возникновение на фоне их приёма синдрома обкрадывания. Под влиянием венозных вазодилататоров коллатеральный кровоток увеличен.
Помимо снижения преднагрузки и влияния на коронарный кровоток антиангинальное действие венозных вазодилататоров связано также с тем, что они увеличивают функциональную активность нейронов головного мозга, оказывающих тормозящее влияние на симпатическую импульсацию.
Однако снижение ударного объёма и, в меньшей степени, снижение тонуса артерий на фоне приёма венозных вазодилататоров обусловливают развитие рефлекторной активации симпатического отдела вегетативной нервной системы, что вызывает рефлекторную тахикардию и усиление сократимости, а это в конечном итоге увеличивает потребность миокарда в кислороде и, в связи с уменьшением диастолы, ухудшает его доставку. Всё это отрицательно сказывается на антиангинальной активности препаратов.
Таким образом, механизм действия нитратов при стенокардии сложен и может отличаться у каждого больного в зависимости от лежащих в её основе патофизиологических факторов. Высокая терапевтическая концентрация препарата в плазме крови не всегда обеспечивает изменение гемодинамических показателей. По-видимому, в связи с этим некоторые больные не реагируют на нитраты. В то же время гемодинамический эффект после приёма нитратов не всегда сочетается с развитием антиангинального действия. Это обстоятельство ряд авторов объясняют тем, что при достижении гемодинамического эффекта, вызываемого нитратами, у этих больных не происходит изменения баланса между потребностью миокарда в кислороде и его доставкой.
При изучении зависимости доза-эффекта у одних и тех же больных со стенокардией было установлено, что с увеличением дозы нитрата нарастает не только выраженность гемодинамических изменений, но и количество побочных реакций, что ограничивает достижение необходимого антиангинального эффекта.
Существуют и другие фармакодинамические эффекты венозных вазодилататоров.
• Обладая системным действием, нитраты расширяют сосуды головного мозга, его оболочек, сосуды шеи, лица, что проявляется приливами и головной болью.
• Оказывают спазмолитическое действие на гладкомышечные клетки внутренних органов: бронхов, мочевыводящих путей, мочеточников, матки, ЖКТ.
• При длительном назначении нитратов у некоторых больных происходит повышение экскреции катехоламинов и продуктов их распада.
• Молсидомин способен ингибировать раннюю фазу агрегации тромбоцитов, уменьшать выделение (или синтез) серотонина, тромбоксана и других факторов, способствующих агрегации.
Фармакокинетика
Основные показатели фармакокинетики венозных вазодилататоров представлены в табл. 12-17.
Таблица 12-17. Основные показатели фармакокинетики венозных вазодилататоров
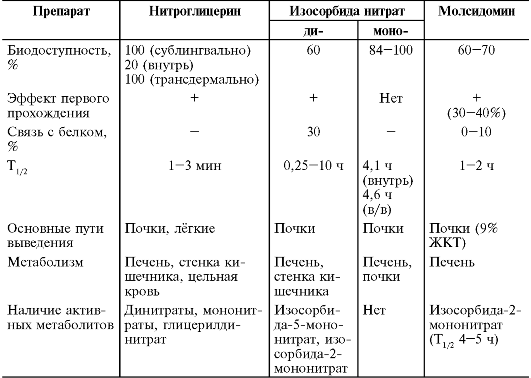 Нитроглицерин
и изосорбида динитрат при сублингвальном приё- ме всасываются быстро и
полно. Процесс этот существенно зависит от секреции слюны. Максимальная
концентрация в крови после приёма под язык 0,3 мг нитроглицерина и 5 мг
изосорбида динитрата наступает через 2-3 и 15-30 мин соответственно и
составляет около 1-1,5 и 10-20 нг/мл. Хотя оба препарата практически
полностью (на 90%) всасываются в тонком кишечнике, их биодоступность
относительно невелика за счёт интенсивного метаболизма в стенке
кишечника и печени при первом прохождении. Ввиду этого создают различные
формы нитроглицерина и изосорбида динитрата, при использовании которых
препараты попадают в организм, минуя ЖКТ. В отличие от них, изосорбида
мононитрат не имеет эффекта первого прохождения через печень, так как
сам представляет метаболит изосорбида динитрата. Молсидомин хорошо
всасывается из ЖКТ, имеет значительно меньший эффект первого прохождения
через печень и вследствие этого большую биодоступность (60-70%) при
пероральном приёме.
Нитроглицерин
и изосорбида динитрат при сублингвальном приё- ме всасываются быстро и
полно. Процесс этот существенно зависит от секреции слюны. Максимальная
концентрация в крови после приёма под язык 0,3 мг нитроглицерина и 5 мг
изосорбида динитрата наступает через 2-3 и 15-30 мин соответственно и
составляет около 1-1,5 и 10-20 нг/мл. Хотя оба препарата практически
полностью (на 90%) всасываются в тонком кишечнике, их биодоступность
относительно невелика за счёт интенсивного метаболизма в стенке
кишечника и печени при первом прохождении. Ввиду этого создают различные
формы нитроглицерина и изосорбида динитрата, при использовании которых
препараты попадают в организм, минуя ЖКТ. В отличие от них, изосорбида
мононитрат не имеет эффекта первого прохождения через печень, так как
сам представляет метаболит изосорбида динитрата. Молсидомин хорошо
всасывается из ЖКТ, имеет значительно меньший эффект первого прохождения
через печень и вследствие этого большую биодоступность (60-70%) при
пероральном приёме.
В последние годы большое распространение получили трансдермальные формы нитроглицерина и изосорбида динитрата. Это обусловлено тем, что при трансдермальном применении нитратов малые количества молекул нитратов быстро и стабильно поступают в кровь, что предотвращает их разрушение в стенке кишечника и в печени. При возникновении побочных явлений возможно быстрое удаление препарата. Вместе с тем оказалось, что трансдермальные формы препарата трудно дозировать, так как на абсорбцию влияют толщина слоя мази, кожи, подкожной жировой клетчатки; площадь поверхности кожи и локализация места аппликации; величина кровотока в коже и её гидратация; функциональная активность сальных и потовых желёз, температура тела и окружающей среды. По длительности гемодинамического и антиангинального действия нитроглицериновая мазь не уступает депо-форме нитроглицерина (сустак форте*) и изосорбида динитрату (4-8 ч). Пластыри, содержащие нитроглицерин, имеют более стабильную скорость всасывания и длительность действия (до 24 ч), что делает их довольно удобной формой для длительной профилактики приступов стенокардии. Необходимо учитывать, что биодоступность трансдермальных форм может значительно возрастать при нарушении целостности кожных покровов в месте аппликации, что приводит к развитию выраженных побочных эффектов, связанных с чрезмерным фармакологическим действием.
Основные метаболиты нитроглицерина (динитраты и мононитраты) фармакологически малоактивны, выводятся главным образом с мочой в виде конъюгатов с глюкуроновой кислотой, небольшую часть 20% выводят лёгкие. Период полувыведения нитроглицерина 1-1,4 мин, а его метаболитов - от 3,5 до 4,5 ч. Период полувыведения изосор-
бида динитрата - 2 ч после однократного приёма и около 8 ч - на фоне курсового лечения, у изосорбида мононитрата - 4,1 ч, у молсидомина - 2 ч. Изосорбида динитрат имеет активные метаболиты с большим, чем у основного препарата, периодом полувыведения. Метаболизм нитроглицерина активируют барбитураты. Возможна также аутоиндукция, что наиболее выражено при использовании препаратов пролонгированного действия. Изосорбида мононитрат не имеет активных метаболитов. Молсидомин в печени превращается в фармакологически активное соединение, которое неферментным путём превращается в нестойкое вещество, выделяющее NO и разлагающееся в крови и тканях до фармакологически неактивного состояния, метаболиты которого выводятся в основном через почки.
Очень высокий клиренс нитроглицерина и изосорбида динитрата указывает на наличие внепечёночного метаболизма. Нитроглицерин, помимо печени, метаболизируется в эритроцитах при участии сульфгидрильных радикалов, а также при взаимодействии с восстановленным гемоглобином. Количество восстановленного гемоглобина играет важную роль в метаболической активности, поэтому возможно замедление метаболизма нитроглицерина у больных с анемиями, выраженной гипоксией, что имеет особое значение при капельном применении и использовании трансдермальных систем нитроглицерина.
При применении венозных вазодилататоров время наступления эффекта, его продолжительность зависят от химической природы препаратов и способов их введения (табл. 12-18).
Таблица 12-18. Основные временные характеристики наступления эффекта венозных вазодилататоров
 В зависимости от лекарственной формы, определяющей фармакокинетику, выделяют следующие формы нитратов.
В зависимости от лекарственной формы, определяющей фармакокинетику, выделяют следующие формы нитратов.
• Всасывающиеся через слизистую оболочку рта таблетки нитроглицерина для приёма под язык; так называемые буккальные (для аппликации на слизистую оболочку щеки или десны) лекарственные формы нитроглицерина и изосорбида динитрата; аэрозоли нитроглицерина и изосорбида динитрата.
• Для приёма внутрь: таблетки и капсулы изосорбида динитрата, изосорбида мононитрата и нитроглицерина, как короткого действия, так и ретардированные формы с длительным высвобождением.
• Для накожного применения: мази и пластыри нитроглицерина, действующие в течение 24 ч.
• Для внутривенного введения: растворы нитроглицерина и изосорбида динитрата.
Кроме того, нитраты также классифицируют по продолжительности действия.
• Препараты с короткой продолжительностью действия (до 1 ч): таблетки нитроглицерина для сублингвального применения, аэрозоли нитроглицерина и изосорбида динитрата.
• Препараты умеренно пролонгированного действия (от 1 до 6 ч): таблетки нитроглицерина с замедленным высвобождением для приёма внутрь, буккальные формы нитратов, а также обычные таблетки изосорбида ди- и мононитрата.
• Препараты значительно пролонгированного действия (до 15- 24 ч): специальные таблетки или капсулы изосорбида ди- и мононитрата, пластыри с нитроглицерином и изосорбидом динитратом. Действие таблеток и капсул может продолжаться до 15 и более часов, а пластырей - до 24 ч.
Характеристика отдельных препаратов из группы органических нитратов
Нитроглицерин в форме сублингвальных таблеток или аэрозоля применяют для купирования или предупреждения приступов стенокардии. Принятый под язык препарат в течение нескольких секунд проникает через слизистую оболочку и в течение 2-3 мин начинает давать фармакодинамический эффект. При таком способе применения небольшая часть нитроглицерина подвергается метаболизму в печени. Период полувыведения нитроглицерина, принятого под язык, составляет в среднем 5 мин. Метаболиты нитроглицерина не активны и выводятся медленно, период их полувыведения составляет 4 ч. Нитроглицерин в таблетках при неправильном хранении (под воздействием ультрафиолетового излучения света) теряет свою активность. Пос-
ле приёма нитроглицерина под язык продолжительность его действия колеблется от нескольких минут до получаса (в среднем 10-15 мин). Нитроглицерин в таблетках может быть использован не только для купирования приступа стенокардии, его следует также рекомендовать больным для предупреждения приступов перед выполнением непродолжительной физической нагрузки, которая регулярно провоцирует их возникновение (выход на улицу, вскоре после еды, публичное выступление, половой акт и т.д.).
В настоящее время известны две лекарственные депо-формы нитроглицерина, обеспечивающие его пролонгированное действие:
• пероральная, микрокапсулированная;
• аппликационные формы (наносимые на слизистую оболочку или кожу).
Эти препараты назначают только с целью профилактики приступов стенокардии.
Микрокапсулированные формы нитроглицерина обладают низкой биодоступностью, поэтому малоэффективны. Но, к сожалению, эти формы нитроглицерина до сих пор широко применяют в нашей стране. Различия между препаратами этой группы невелики и касаются лишь количества содержащегося в них нитроглицерина (2,5; 2,6; 5,4; 6,4; 6,5 мг) и разности его высвобождения из микрокапсул. После поступления в ЖКТ микрокапсулы растворяются и нитроглицерин постепенно абсорбируется. Антиангинальный эффект при приёме препарата натощак возникает через 10-15 мин, максимальное действие отмечают в среднем через час. Продолжительность действия малых доз (2,5 и 2,6 мг) очень невелика (около 0,5-2 ч). Большие дозы препарата (5,4 и 6,5 мг) оказывают более чёткое и продолжительное фармакодинамическое действие - в среднем около 4 ч с индивидуальными колебаниями от 2 до 6 ч. Однако из-за низкой биодоступности, трудности выбора индивидуальной дозы для пациента применение этих препаратов в развитых странах прекращено.
Аппликационные формы нитроглицерина (нитроглицериновая мазь, трансдермальные терапевтические системы, диски) сравнительно редко, но всё же применяют в клинической практике, чаще всего у больных с IV функциональным классом стенокардии напряжения. Эти лекарственные формы нитроглицерина имеют как преимущества, так и недостатки. Общее преимущество - более быстрое начало действия, в особенности тринитролонга*, и возможность удаления препарата при необходимости. Вместе с тем, аппликации на кожу исключают водные процедуры и создают ряд неудобств для больного. Также на скорость поступления нитроглицерина в кровоток из аппликационных форм влияют ряд сопутствующих факторов: температура кожи в месте
аппликации, температура окружающей среды, физическая активность, приём алкоголя. На участке кожи не должно быть повреждений, кожа должна быть сухой. Место аппликации постоянно меняют, так как возможно раздражение кожи. Нитроглицериновую мазь (2%) обычно наносят на кожу груди. Антиангинальный эффект регистрируют спустя 15 мин, продолжительностью 4-6 ч. Эта лекарственная форма более приемлема для пациентов, страдающих спонтанной стенокардией, которая возникает в ночное время. Трансдермальные системы, кожные диски, содержащие нитроглицерин, содержат специальную силиконовую основу, которая увеличивает продолжительность действия до 24 ч, при этом обеспечивая поддержание постоянной концентрации нитроглицерина в крови.
Препараты нитроглицерина, представляющие полимерную пластинку, содержащую нитроглицерин в дозах 1,2 и 3 мг, наклеивают на слизистую оболочку десны над клыками или малыми коренными зубами. Препарат начинает оказывать своё действие очень быстро. Применение этой аппликационной формы нитроглицерина противопоказано при воспалительных заболеваниях дёсен, полости рта (гингивит, стоматит).
Раствор нитроглицерина для внутривенных инъекций вводят, начиная с дозы 10-20 мкг/мин. Его применяют при застойной сердечной недостаточности, нестабильной стенокардии, при остром инфаркте миокарда.
Изосорбида динитрат назначают внутрь в дозе 10-20 мг для профилактики приступов стенокардии.
При приёме под язык антиангинальное действие наступает спустя 3-5 мин.
Фармакодинамическое действие изосорбида динитрата, принятого внутрь, сохраняется в среднем в течение 4 ч. Биодоступность препарата составляет 50%, период полувыведения - около 30-60 мин.
Изосорбид динитрат (аэрозоль) представляет спиртовой раствор, в 15 мл которого содержится 375 мг препарата. Препарат распыляют в полости рта. Купирование приступа происходит в течение 3 мин.
Раствор изосорбида динитрата, подобно раствору нитроглицерина, используют для инфузионного введения по таким же показаниям (острый коронарный синдром, острая сердечная недостаточность). В 1 мл 0,1% раствора содержится 1 мг изосорбида динитрата.
Изосорбида мононитрат представляет метаболит изосорбида динитрата, который используют как лекарственный препарат. При приёме внутрь максимальная концентрация наступает через 1 ч, время полувыведения составляет 5 ч. Биодоступность 100%, т.е. препарат при первом прохождении через печень не метаболизируется.
В связи с тем, что обычные лекарственные формы изосорбида динитрата и изосорбида-5-мононитрата обеспечивают антиангинальное, антиишемическое действие от 2 до 6 ч, были созданы специальные лекарственные формы (ретардированные) с медленным высвобождением препарата и увеличением продолжительности действия препарата до 10-16 ч. Они содержат значительно большую дозу нитрата. Начало их действия после приёма внутрь регистрируют на 1-1,5 ч позже по сравнению с обычной лекарственной формой. Исключение составляет препарат эфокс лонг* (изосорбида мононитрат), который обеспечивает быстрое поступление препарата в кровоток после перорального приёма.
Побочные эффекты
Венозные вазодилататоры - наиболее безопасные из используемых в настоящее время антиангинальных препаратов. Из всех побочных эффектов наиболее часто возникает головная боль.
Артериальная дилатация затрагивает сосуды лица и артериолы мозговых оболочек, вызывая побочные эффекты в виде приливов и головной боли. Обычно через 3-5 дней постоянного приёма нитратов головная боль исчезает. Выраженность её прямо пропорциональна величине используемой дозы нитратов. В случае если при приёме нитроглицерина для купирования приступа стенокардии у больного возникает нестерпимая головная боль, что заставляет его отказываться от его применения, то больному можно рекомендовать приём при приступе стенокардии капель Вотчала, в состав которых помимо нитроглицерина (в 8 каплях половина дозы по сравнению с сублингвальными таблетками нитроглицерина) входит ментол, способный повышать тонус вен головного мозга. Оба этих мероприятия (меньшая доза нитроглицерина и добавление ментола) уменьшают выраженность головной боли при приёме нитроглицерина.
Второе наиболее часто встречаемое нежелательное проявление действия нитратов - снижение АД, выраженность которого увеличивается в вертикальном положении.
Следствие снижения венозного возврата, ударного объёма и АД - рефлекторная активация симпатической нервной системы, приводящая к увеличению ЧСС и сократимости миокарда, что может в ряде случаев повлечь за собой увеличение потребности миокарда в кислороде. В то же время снижение диастолического давления в аорте и укорочение диастолы может приводить к снижению доставки кислорода к миокарду. Результатом снижения коронарного кровотока и увеличения потребности миокарда в кислороде у ряда больных может быть развитие ангинальных приступов.
Метгемоглобинемия и повышение внутриглазного давления, отмеченные при применении нитратов в экспериментальных исследованиях, клинического значения, по-видимому, не имеют, так как дозы, используемые в практике, меньше тех, которые могут вызвать указанные фармакологические эффекты у больных.
Изредка у больных с тяжёлыми заболеваниями лёгких назначение нитратов ведёт к развитию гипоксемии вследствие расширения спазмированных сосудов малого круга кровообращения и перфузии невентилируемых участков лёгких.
Важное значение при лечении нитратами имеет синдром отмены. Имеются сообщения о внезапном появлении приступов стенокардии, и даже смерти через 1-2 дня после прекращения приёма нитратов. Описано ухудшение клинического течения стенокардии после внезапной отмены пролонгированных нитратов.
При применении нитроглицериновой мази или пластыря возможны раздражение кожи, аллергические реакции. У некоторых больных применение венозных вазодилататоров может вызывать тошноту.
Ко всем лекарственным формам нитратов, особенно к пластырям, возможно развитие полностью обратимой перекрёстной толерантности. В основе развития толерантности, как предполагают, лежит истощение сульфгидрильных групп эндогенных соединений (рецепторов) гладкой мускулатуры кровеносных сосудов. Так, уже после первой недели регулярного приёма изосорбида динитрата в дозе 15 мг 4 раза в день антиангинальный эффект препарата существенно снижается. Скорость развития толерантности варьирует от нескольких дней до 2-4 мес и более. Длительная терапия нитратами приводит не только к существенному снижению максимальной выраженности антиангинального действия, но и к укорочению его продолжительности. Поскольку механизм действия нитратов одинаков, становится вполне понятным существование перекрёстной толерантности между нитратами. В наименьшей степени она проявляется при использовании сублингвального нитроглицерина, который сохраняет свою антиангинальную активность даже при практически полном исчезновении действия пероральных и трансдермальных форм нитратов. Наиболее быстрое развитие толерантности отмечают у больных, получающих нитраты в виде пластырей, которые обеспечивают постоянную высокую концентрацию на протяжении суток. Частое и регулярное использование нитратов ускоряет развитие толерантности. Однако после отмены нитратов происходит быстрое восстановление чувствительности рецепторов сосудистой стенки и антиангинальной эффективности. Скорость восстановления чувствительности к нитратам у разных людей существенно различается. Для полного устранения
толерантности к нитратам необходимо от 24 ч до нескольких дней. Развитие толерантности к нитратам делает целесообразным их прерывистое назначение с сохранением в сутках 8-12-часового промежутка, свободного от действия нитратов. Так, больным стенокардией напряжения, у которых приступы возникают лишь в ранние утренние часы или при первом выходе на улицу, следует назначать ретардированные препараты перед сном или непролонгированные нитраты сразу после того, как больной проснулся утром. В обоих случаях до следующего приёма образуется длительный промежуток, свободный от действия препарата и предупреждающий возникновение толерантности. Если такого рода схемы приёма невозможны (IV функциональный класс стенокардии напряжения с ночными приступами стенокардии покоя), при возникновении толерантности к нитратам следует отменить их приём на несколько дней (обычно на 2-3 дня), ограничиваясь на это время таблетками нитроглицерина для купирования приступов (отметим, что их эффективность при этом сохраняется). При плохой переносимости нитратов может быть применён молсидомин, препарат с иной химической формулой, но сходным (образование N0) механизмом действия; однако он может дать те же побочные эффекты, что и нитраты.
Органические нитраты, особенно в максимальных дозах, могут повышать внутриглазное давление, поэтому его следует контролировать при повышении дозы препаратов у больных с глаукомой, при которой, однако, приём нитратов только относительно противопоказан.
Противопоказания для применения венозных вазодилататоров.
• Абсолютные.
Аллергическая реакция на нитраты. Повышенная чувствительность к нитратам.
Гипотензия и некорригированная гиповолемия (систолическое
АД ниже 100 мм рт.ст.; диастолическое АД ниже 60 мм рт.ст.;
центральное венозное давление менее 4-5 мм рт.ст.). Левожелудочковая недостаточность с низким конечно-диастоли-
ческим давлением левого желудочка. Острый инфаркт миокарда с низким конечно-диастолическим
давлением левого желудочка. Констриктивный перикардит и тампонада сердца. Неадекватная церебральная перфузия.
Острый инфаркт миокарда с поражением правого желудочка.
• Относительные.
Склонность больного к ортостатическим нарушениям. Повышенное внутричерепное давление. Выраженная анемия.
Выраженная закрытоугольная глаукома, с высоким внутриглазным давлением. Асимметричная гипертрофическая кардиомиопатия. Тяжёлый аортальный или митральный стеноз.
Показания к применению и режим дозирования
К показаниям относят: купирование и профилактику приступов стенокардии, лечение нестабильной стенокардии и устранение коронароспазма, гемодинамическую разгрузку сердца при острой и хронической сердечной недостаточности, управляемую гипотонию при хирургических вмешательствах. Нитраты можно применять также при гипертензии малого круга кровообращения, при желчных и почечных коликах, при проведении функциональных тестов по оценке состояния сердечно-сосудистой системы и лёгких.
Сублингвальные формы нитратов, аэрозоль изосорбида динитрата для перорального применения используют, прежде всего, для купирования приступов стенокардии, принимать их рекомендуют в положении сидя. Приём в вертикальном положении, особенно после прекращения быстрой ходьбы, может привести к выраженному снижению АД, а в горизонтальном положении эффект слабее. Если приём трёх таблеток нитроглицерина или трёх доз аэрозоля изосорбида динитрата для перорального применения в течение 15-20 мин не купировал приступ стенокардии, дозу не увеличивают, в этом случае необходимо применение наркотических анальгетиков или нейролептаналгезии для снятия боли. При температуре окружающей среды выше 24-26 °С происходит усиление всех фармакодинамических эффектов нитратов. Нитроглицерин, принятый сублингвально за 5-10 мин до предполагаемой физической нагрузки, может оказывать хороший антиангинальный эффект.
Пролонгированные формы нитроглицерина, изосорбида динитрата для приёма внутрь и в виде препаратов для чрескожного применения, изосорбида мононитрат, молсидомин используют с целью предупрежения приступов стенокардии. Наименее эффективными из них считают депо-формы нитроглицерина.
Нитраты и молсидомин благодаря своей способности снижать преднагрузку и давление в малом круге крообращения могут быть с успехом использованы при комплексной терапии сердечной недостаточности, в ситуации, когда ингибиторы АПФ противопоказаны или отмечают их непереносимость.
Представляется парадоксальным, что, несмотря на несомненное предупреждающее и купирующее действие при стенокардии, не удалось до настоящего времени выявить благоприятного влияние нитратов на
прогноз (развитие инфаркта миокарда, внезапная смерть, продолжительность жизни). Это обстоятельство требует более критического подхода к назначению нитратов больным стенокардией напряжения даже в тех случаях, когда хороший клинический эффект может быть достигнут с помощью β-адреноблокаторов. В то же время общепринятое сочетание нитратов и β-адреноблокаторов обычно оправданно, так как помимо аддитивного эффекта в отношении стенокардии β-адреноблокаторы устраняют свойственную иногда нитратам рефлекторную тахикардию.
При стенокардии напряжения I функционального класса нитраты назначают только прерывисто, перед предполагаемой нагрузкой или ситуацией, провоцирующей приступ (спорадический приём). Наиболее целесообразно назначать лекарственные формы короткого действия, обеспечивающие короткий и выраженный эффекты. К их числу относят буккальные таблетки, пластинки, аэрозоли нитроглицерина и изосорбида динитрата. Такие формы следует принимать за 5-10 мин до предполагаемой нагрузки, вызывающей приступ стенокардии. Использование препаратов значительно пролонгированного действия при стенокардии напряжения I функционального класса нецелесообразно.
При стенокардии напряжения II функционального класса нитраты также назначают прерывисто. Наряду с формами короткого действия можно использовать формы умеренно пролонгированного действия.
В качестве препаратов третьей линии на фоне приёма β-адреноблокаторов и БМКК при стенокардии III функционального класса показан постоянный, в течение дня, приём нитратов с соблюдением безнитратного периода продолжительностью 5-6 ч. Для этого используют современные нитраты пролонгированного действия.
При стенокардии IV функционального класса приступы стенокардии могут возникать в ночное время, поэтому при назначении нитратов необходимо обеспечить их круглосуточный эффект. Для этого можно принимать обычные таблетки изосорбида ди- и мононитрата 3-4 раза в день. Однако значительно удобнее использовать препараты более пролонгированного действия 1 раз в день. При стенокардии IV функционального класса иногда необходим приём таких препаратов до 2-3 раз в сутки.
Основные дозы венозных вазодилататоров представлены в табл. 12-19.
Взаимодействие
Одновременное лечение препаратами, содержащими барбитураты, ускоряет метаболизм и может снизить эффективность содержащих нитроглицерин ЛС.
Таблица 12-19. Режим дозирования венозных вазодилататоров
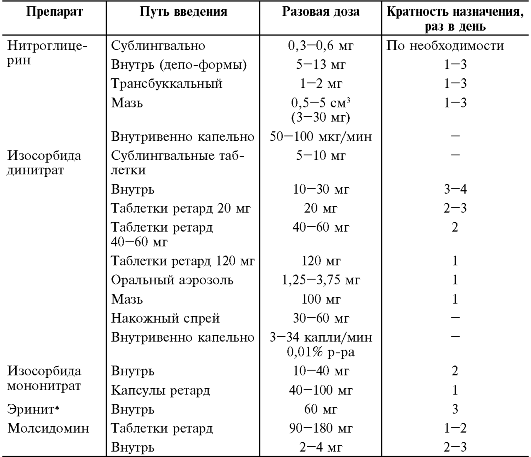 Атропин,
вызывающий снижение образования слюны, существенно снижает всасывание
нитроглицерина при его сублингвальном или буккальном применении. При
взаимодействии с алкоголем, другими вазодилататорами, трициклическими
антидепрессантами выраженность гипотензивного действия нитратов
усиливается. Сочетанное назначение нитратов с гистамином, ацетилхолином,
норэпинефрином ослабляет их эффективность.
Атропин,
вызывающий снижение образования слюны, существенно снижает всасывание
нитроглицерина при его сублингвальном или буккальном применении. При
взаимодействии с алкоголем, другими вазодилататорами, трициклическими
антидепрессантами выраженность гипотензивного действия нитратов
усиливается. Сочетанное назначение нитратов с гистамином, ацетилхолином,
норэпинефрином ослабляет их эффективность.
При ИБС нитраты и молсидомин с успехом применяют в комплексной антиангинальной терапии совместно с β-адреноблокаторами, а при наличии противопоказаний к применению β-адреноблокаторов - с блокаторами медленных кальциевых каналов (верапамилом, дилтиаземом), так как при этом происходит устранение или уменьшение рефлекторной тахикардии, вызываемой венозными вазодилататорами, благодаря чему при применении этих комбинаций наблюдают не только суммацию, но и потенцирование их антиангинальных эффектов.
Однако применение таких комбинаций часто ограничено в связи с возможностью значительного снижения АД, что может осложнять их антиангинальную эффективность и плохо переноситься больными.
Нецелесообразно совместное назначение нифедипина короткого действия и венозных вазодилататоров, поскольку на этом фоне может отмечаться чрезмерное снижение АД и суммация способности вызывать развитие рефлекторной тахикардии, значительно уменьшающие антиангинальную эффективность этой комбинации.
Опасна для жизни - комбинация препаратов из группы органических нитратов с ЛС, используемыми для лечения эректильной дисфункции из группы ингибиторов фосфодиэстеразы V типа (силденафил , тадалифил*, вальденафил*), так как возможно развитие гипотонии, коллапса, провокация ишемии миокарда. В основе этого феномена лежит фармакодинамическое взаимодействие.
12.7. БЛОКАТОРЫ МЕДЛЕННЫХ КАЛЬЦИЕВЫХ КАНАЛОВ
Блокаторы медленных кальциевых каналов представляют ЛС, избирательно блокирующие деятельность потенциалозависимых кальциевых каналов, в результате чего ограничивается поступление ионов кальция в клетку. Для оптимизации характеристики блокаторов медленных кальциевых каналов необходимо кратко рассмотреть механизм действия препаратов данной группы.
Физиологическая роль ионов кальция и характеристика кальциевых каналов
Ионы кальция занимают особое место в поддержании клеточных процессов. Благодаря своим уникальным физико-химическим свойствам (способность к селективному связыванию со сложными биоорганическими молекулами и изменению их конформации) они выступают в качестве наиболее универсальных посредников, связывающих процессы на поверхности мембраны клетки с внутриклеточными процессами. Каждая живая клетка тратит значительную часть энергии на выведение ионов кальция посредством систем специальных кальциевых насосов, поддерживая в состоянии покоя очень низкую концентрацию в цитоплазме (порядка 10-8 ммоль/л). Возникающий благодаря этому трансмембранный градиент концентрации ионов кальция способствует вхождению с высокой скоростью внутрь клетки ионов кальция и создаёт в ней кратковременное повышение их концентрации (кальциевый сигнал), которое, в свою очередь, может запускать или модулировать практически все функции клетки. Одна из
важнейших физиологических функций ионов кальция - обеспечение сопряжения процессов возбуждения и сокращения в гладкомышечных клетках, клетках миокарда и в скелетной мускулатуре. Основная структура, обеспечивающая генерацию импульсов с помощью ионов кальция, - специализированные белковые молекулы, встроенные в клеточные мембраны и способствующие под влиянием внешнего воздействия движению ионов по электрохимическому градиенту - ионные каналы.
Сокращение кардиомиоцитов и гладкомышечных клеток зависит от ионов кальция, которые поступают в цитозоль, главным образом, из саркоплазматического ретикулума и, в меньшей степени, через медленные каналы мембраны. Кальциевые каналы относят к группе потенциалозависимых. Перенос электрических зарядов по ним происходит с меньшей скоростью, чем по натриевым каналам. Таким образом, каналы для ионов кальция делят на трансмембранные потенциалозависимые (поступление ионов кальция внутрь клетки) и внутриклеточные, с помощью которых происходит высвобождение ионов кальция из саркоплазматического ретикулума. Потенциалозависимые кальциевые каналы по своей структуре и электрофизиологическим свойствам делят на следующие типы:
• кальциевые каналы L-типа;
• кальциевые каналы Т-типа;
• кальциевые каналы Р-типа;
• кальциевые каналы N-типа;
• кальциевые каналы R-типа.
Наиболее хорошо изучены потенциалозависимые каналы L- и Т-типа. Каналы Р-, N-, R-типа расположены в нейронах, и их физиология и биохимия изучены недостаточно.
Потенциалозависимые кальциевые каналы L-типа локализованы на поверхности цитоплазматической мембраны сократительных кардиомиоцитов, клеток синусового и атриовентрикулярного узла проводящей системы сердца, клеток гладкой и скелетной мускулатуры. Потенциалозависимые кальциевые каналы L-типа открываются в ответ на деполяризацию цитоплазматической мембраны. Электрофизиологические особенности этих каналов - высокий порог активации (поэтому данный тип кальциевых каналов называют ещё высокопороговыми кальциевыми каналами) и медленная инактивация. Основная функция потенциалозависимых кальциевых каналов L-типа в миокарде, гладкой и скелетной мускулатуре - сопряжение процессов возбуждения и сокращения; в синусовом узле - обеспечение пейсмейкерной активности; в клетках атриовентрикулярного узла - атриовентрикулярное проведение (табл. 12-20). Потенциалозависимые кальциевые каналы
Таблица 12-20. Характеристика цитоплазматических потенциалзависимых кальциевых каналов в сердечно-сосудистой системе
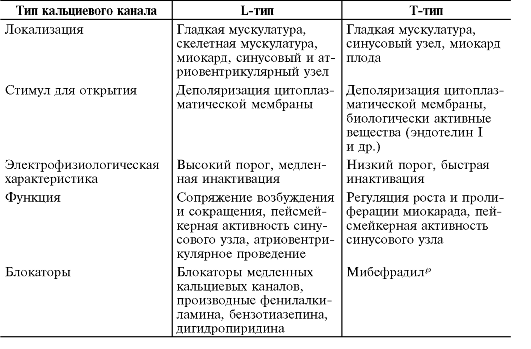 L-типа
выступают в качестве фармакологических мишеней для блокаторов медленных
кальциевых каналов производных фенилалкиламина, дигидропиридина и
бензотиазепина.
L-типа
выступают в качестве фармакологических мишеней для блокаторов медленных
кальциевых каналов производных фенилалкиламина, дигидропиридина и
бензотиазепина.
Потенциалозависимые кальциевые каналы Т-типа локализованы на поверхности цитоплазматической мембраны клеток миокарда у плода, клеток синусового узла, волокон Пуркинье, клеток гладкой мускулатуры. Плотность каналов Т-типа в миокарде взрослого человека очень мала, что позволяет говорить о том, что этот тип кальциевых каналов не играет существенной роли в сопряжении возбуждения и сокращения. Кальциевые каналы Т-типа вносят также определённый вклад в пейсмейкерную активность синусового узла и атриовентрикулярное проведение. Т-тип кальциевых каналов по их электрофизиологическим свойствам называют ещё низкопороговыми кальциевыми каналами, так как они активируются при уровнях мембранного потенциала, близких к потенциалу покоя (порядка -60 мВ), инактивация этого типа кальциевых каналов происходит быстро (см. табл. 12-20). Кальциевые каналы Т-типа - фармакологическая мишень для мибефрадила*, при этом он блокирует этот тип кальциевых каналов. Чувствительность к нему L-каналов в 20-30 раз меньше, чем Т-каналов.
В клетке существует двойная система регуляции входа ионов кальция для обеспечения сокращения мускулатуры (миокарда, гладкой и скелетной мускулатуры). Эта система представлена двумя взаимосвязанными циклами:
• внеклеточный кальциевый цикл, регулирующий вход ионов кальция из внеклеточного пространства в цитозоль через цитоплазматические потенциалозависимые кальциевые каналы, в основном L-типа;
• внутриклеточный кальциевый цикл, регулирующий высвобождение ионов кальция из саркоплазматического ретикулума через внутриклеточные каналы (рианодиновые рецепторы и IР3-рецепторы), при этом основная роль ионов кальция, выходящих из саркоплазматического ретикулума, заключается в активации сокращения миокарда, гладкой и скелетной мускулатуры.
Механизм действия и основные фармакодинамические эффекты
В основе механизма действия блокаторов медленных кальциевых каналов на молекулярном уровне лежит торможение входа ионов кальция внутрь клеток через цитоплазматические потенциалозависимые кальциевые каналы L-типа.
Блокада цитоплазматических кальциевых каналов L-типа миокарда производными фенилалкиламина приводит к нарушению входа ионов кальция через эти каналы в ответ на деполяризацию; таким образом, под цитоплазматической мембраной не создаётся высоких концентраций кальция, в связи с чем не происходит высвобождения ионов кальция из саркоплазматического ретикулума, а значит, в цитозоле недостаточно ионов кальция для соединения с тропонином С и активации сокращения. Итог этого процесса - угнетение производными фенилалкиламина сократимости миокарда (отрицательный инотропный эффект). Блокада производными фенилалкиламина цитоплазматических кальциевых каналов L-типа синусового узла приводит к угнетению пейсмейкерной активности синусового узла (отрицательный батмотропный эффект). Блокада производными фенилалкиламина цитоплазматических кальциевых каналов L-типа атриовентрикулярного узла приводит к угнетению проводимости в нём (отрицательный дромотропный эффект). Молекулярный механизм отрицательного инотропного, батмотропного и дромотропного эффектов производных бензотиазепина аналогичны.
Производные дигидропиридина практически не влияют на цитоплазматические потенциалозависимые кальциевые каналы миокарда и проводящей системы сердца. Производные дигидропиридина, также как и производные фенилалкиламина и бензотиазепина, блокируют
цитоплазматические кальциевые каналы L-типа гладкой мускулатуры сосудов, что приводит к нарушению входа ионов кальция через эти каналы в ответ на деполяризацию; таким образом, под цитоплазматической мембраной не возникает высокой концентрации ионов кальция, в связи с чем кальций не высвобождается из саркоплазматического ретикулума, а значит, в цитозоле недостаточно кальция для соединения с кальмодулином, который не образует комплекс кальций-кальмодулин, не активируется киназа лёгких цепей миозина, лёгкие цепи миозина не фосфорилируются, не происходит сокращение - сосуды расширяются (в том числе и коронарные).
Кардиотропные эффекты производных фенилалкиламина и бензотиазепина во многом сходны и в то же время значительно отличаются от таковых для производных дигидропиридина. Производные фенилалкиламина (группа верапамила) и бензотиазепина (группа дилтиазема) могут снижать сократимость миокарда, уменьшать частоту сердечных сокращений и замедлять предсердно-желудочковое проведение. Поэтому производные фенилалкиламина и бензотиазепина иногда объединяют и описывают как группу кардиоселективных или брадикардических блокаторов медленных кальциевых каналов (табл. 12-21).
Таблица 12-21. Сравнительная характеристика кардиотропных эффектов блокаторов медленных кальциевых каналов
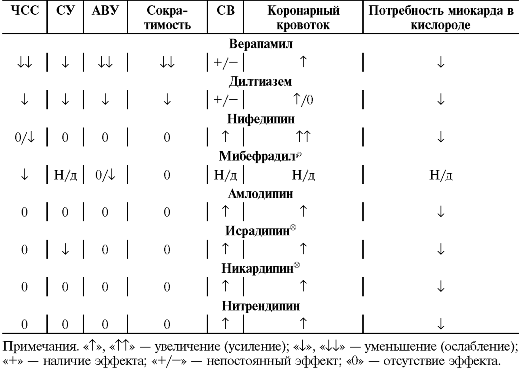 Антиаритмическим
действием из блокаторов медленных кальциевых каналов обладают только
производные фенилалкиламина (верапамил) и бензотиазепина (дилтиазем),
т.е. кардиоселективные блокаторы медленных кальциевых каналов, их
относят к IV классу антиаритмических средств по классификации E.
Vaughan-Williams.
Антиаритмическим
действием из блокаторов медленных кальциевых каналов обладают только
производные фенилалкиламина (верапамил) и бензотиазепина (дилтиазем),
т.е. кардиоселективные блокаторы медленных кальциевых каналов, их
относят к IV классу антиаритмических средств по классификации E.
Vaughan-Williams.
Производные дигидропиридина отличаются от производных фенилалкиламина и бензотиазепина большим влиянием на гладкую мускулатуру сосудов и отсутствием клинически значимого действия на функцию синусового узла и атриовентрикулярное проведение (см. табл. 12-21). Поэтому группу блокаторов медленных кальциевых каналов, производных дигидропиридина называют «вазоселективными» блокаторами медленных кальциевых каналов. Производные дигидропиридина обычно не урежают ЧСС, но она может учащаться в результате рефлекторной активации симпатоадреналовой системы в ответ на резкое расширение системных артерий, особенно это характерно для производных дигидропиридина I поколения. Вазоселективные блокаторы медленных кальциевых каналов, в отличие от кардиоселективных блокаторов медленных кальциевых каналов, оказывают более выраженное положительное влияние на коронарный кровоток
(табл. 12-22).
Таблица 12-22. Кардиоселективность некоторых блокаторов медленных кальциевых каналов
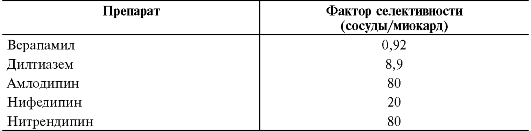 Блокаторы медленных кальциевых каналов обладают рядом экстракардиальных фармакологических эффектов.
Блокаторы медленных кальциевых каналов обладают рядом экстракардиальных фармакологических эффектов.
Существуют экспериментальные данные о положительном влиянии блокаторов медленных кальциевых каналов на факторы, участвующие в развитии атеросклероза. Механизмы антиатеросклеротического эффекта, по-видимому, заключаются в способности блокаторов медленных кальциевых каналов замедлять пролиферацию гладкомышечных клеток путём замедления высвобождения соответствующего фактора роста, ингибировать гиперплазию интимы сосудов, уменьшать адгезию моноцитов, уменьшать способность макрофагов к захвату эфиров холестерина, оказывать антиоксидантное действие. Также в основе антиатеросклеротического действия блокаторов мед-
ленных кальциевых каналов может лежать ингибирование экспрессии гена ГМГ-КоА-редуктазы и гена ЛПНП; благоприятное влияние на соотношение ЛПВП/ЛПНП; стабилизация цитоплазматической мембраны, препятствующая проникновению свободного холестерина в стенку сосуда.
Всё это позволяет предполагать, что блокаторы медленных кальциевых каналов способны замедлять рост начального минимального атерогенного поражения сосудов. Так, показано, что лацидипин по сравнению с атенололом достоверно замедляет утолщение интимы сонных артерий. Этот эффект лацидипина не зависит от степени снижения АД.
Некоторые блокаторы медленных кальциевых каналов обладают нефропротекторным действием. Так, для препаратов группы верапамила доказана способность увеличивать почечный кровоток, не изменяя при этом скорости клубочковой фильтрации или даже увеличивая её у больных со сниженной СКФ. Так, у больных с диабетической и гипертонической нефропатией производные фенилалкиламина существенно уменьшают выраженность протеинурии. Нефропротекторное действие у больных артериальной гипертензией продемонстрировано и для амлодипина.
Блокаторы медленных кальциевых каналов оказывают влияние на углеводный обмен у больных сахарным диабетом. Известно, что блокаторы медленных кальциевых каналов производные дигидропиридина могут вызывать гипергликемию, возможно, за счёт угнетения кальцийзависимого процесса высвобождения инсулина из β-клеток островкового аппарата поджелудочной железы. В то же время известно благоприятное действие производных фенилалкиламина на углеводный обмен, а именно улучшение толерантности к глюкозе. Этот эффект связывают со способностью производных фенилалкиламина усиливать захват глюкозы гепатоцитами и подавлять секрецию глюкогона α-клетками островкового аппарата поджелудочной железы.
Есть данные о благоприятном влиянии производных фенилалкиламина на липидный спектр. Так, эта группа препаратов достоверно способна снижать уровни ЛПНП (в среднем на 8%), ЛПОНП (в среднем на 11%), повышать уровень ЛПВП (на 6-15%) и таким образом уменьшать атерогенность плазмы крови.
Блокаторы медленных кальциевых каналов обладают антиагрегантной активностью, особенно этот эффект характерен для дигидропиридинов. Полагают, что механизм антиагрегантного действия блокаторов медленных кальциевых каналов заключён в угнетении синтеза проагрегантного соединения тромбоксана А2 и стимуляции синтеза эндотелием простациклина и эндотелиального релаксирующего фак-
тора, которые обладают выраженными антиагрегантными свойствами и вызывают вазодилатацию.
Для некоторых блокаторов медленных кальциевых каналов характерна клинически значимая стереоизомерия. Так, амлодипин представляет рацемическую смесь левовращающего и правовращающего изомеров амлодипина. Левовращающий изомер амлодипина блокирует кальциевые каналы L-типа и обладает вазодилатирующим действием. Напротив, правовращающий изомер амлодипина не обладает вазадилатирующим действием. Это даёт основу для создания препаратов, содержащих только левовращающий изомер амлодипина.
Среди производных дигидропиридина II поколения есть препарат, избирательно расширяющий артерии головного мозга, - нимодипин (нимотоп*), применяемый в неврологической практике при ишемическом и геморрагическом инсульте. Дифенилпиперазины (циннаризин, флунаризин®) также обладают избирательным вазодилатирующим действием на церебральные сосуды. Их широко применяют для профилактики приступов мигрени, для лечения и профилактики заболеваний, связанных с нарушением мозгового кровообращения.
Некоторые другие экстракардиальные фармакологические эффекты блокаторов медленных кальциевых каналов представлены в табл. 12-23.
Таблица 12-23. Некоторые экстракардиальные эффекты блокаторов медленных кальциевых каналов
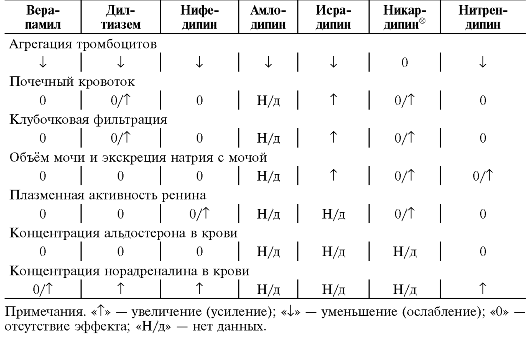 Классификация блокаторов медленных кальциевых каналов
Классификация блокаторов медленных кальциевых каналов
В соответствии с современной классификацией, блокаторы медленных кальциевых каналов L-типа по своей химической структуре подразделяют на следующие группы:
• производные фенилалкиламина (фенилалкиламины) или группа верапамила;
• производные бензотиазепина (бензотиазепины) или группа дил-
тиазема;
• производные дигидропиридина (дигидропиридины) или группа нифедипина;
• производные дифенилпиперазина (дифенилпиперазины) или группа циннаризина.
В свою очередь каждая из этих групп препаратов, в соответствии с особенностями фармакокинетики, представлена препаратами трёх поколений - I, II и III (табл. 12-24).
Таблица 12-24. Классификация блокаторов медленных кальциевых каналов L-типа
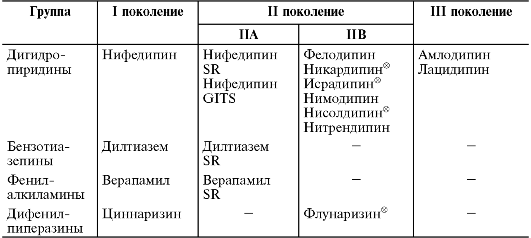 Примечания. SR и ER - замедленного высвобождения; GITS - гастроинтестинальная терапевтическая система.
Примечания. SR и ER - замедленного высвобождения; GITS - гастроинтестинальная терапевтическая система.
В основе вышеизложенной классификации блокаторов медленных кальциевых каналов лежат следующие принципы.
• Химическая структура, от которой зависят фармакологические эффекты блокаторов медленных кальциевых каналов: дигидропиридины оказывают большее влияние на гладкую мускулатуру сосудов и практически не влияют на миокард и проводящую систему сердца; фенилалкиламины, напротив, оказывают большее влияние на миокард, функции синусового и атриовентрикулярного узлов, чем на гладкую мускулатуру сосудов. Бензотиазепины
занимают промежуточное положение между дигидропиридинами и фениалалкиламинами.
• Фармакокинетика. Блокаторы медленных кальциевых каналов II поколения выделяются улучшенным фармакокинетическим профилем и более высокой вазоселективностью. Их разделяют на две подгруппы - IIA и IIB. К IIA подгруппе принадлежат пролонгированные формы ЛС, к IIB подгруппе - препараты с новой химической структурой. Блокаторы медленных кальциевых каналов II поколения отличаются от препаратов I поколения более продолжительным периодом полувыведения (для блокаторов медленных кальциевых каналов I поколения Т1/2 составляет 4-6 ч, II поколения 12-24 ч), продолжительностью действия, более плавным нарастанием концентрации препарата в плазме крови (отсутствие пикообразного изменения концентрации), более отсроченным началом действия и временем появления максимального эффекта (см. табл. 12-24). В связи с этими фармакокинетическими особенностями блокаторы медленных кальциевых каналов II поколения лишены многих побочных эффектов препаратов I поколения, прежде всего связанных с рефлекторной активацией симпатоадреналовой системы (особенно для производных дигидропиридинов), кроме того, препараты II поколения назначают 1-2 раза в сутки.
• Тканевая вазоселективность, т.е. способность препарата воздействовать на те или иные артериолярные области, характерна для некоторых блокаторов медленных кальциевых каналов II поколения производных дигидропиридина: нимодипин преимущественно действует на сосуды головного мозга, нисолдипин® - на коронарные сосуды, фелодипин - одинаково воздействует на коронарные сосуды и периферические артерии.
В качестве прототипа антагонистов кальция третьего поколения предлагают амлодипин, который отличается важными особенностями: более предсказуемой эффективностью, благодаря высокой биодоступности (в среднем 64%), и незначительными различиями между максимальной и минимальной концентрациями в плазме крови; сверхдлительным действием препарата - на протяжении более 24 ч, что делает ненужным создание его ретардных форм.
Предложенная классификация блокаторов медленных кальциевых каналов имеет важное клиническое значение, так как позволяет врачу по принадлежности лекарственного препарата к тому или иному поколению с достаточной определённостью судить о его потенциальных преимуществах и возможных недостатках. Кроме того, нетрудно определить место новых блокаторов медленных кальциевых каналов
Таблица 12-25. Основные фармакокинетические параметры блокаторов медленных кальциевых каналов
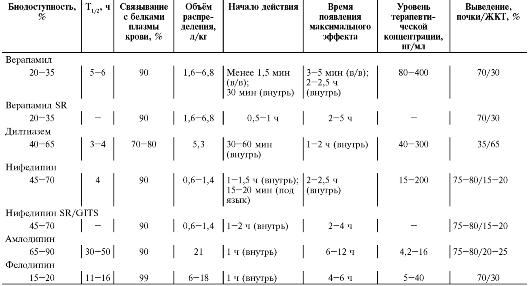 Окончание табл. 12-25
Окончание табл. 12-25
 среди
других препаратов со сходной химической структурой. Так, не упомянутый
анипимил*, несомненно, следует отнести к блокаторам медленных кальциевых
каналов второго поколения, а лацидипин - к третьей генерации. В
классификации не учитывают блокаторы медленных кальциевых каналов,
которые по химической структуре не относят к производным
фенилалкиламина, бензотиазепина или дигидропиридина.
среди
других препаратов со сходной химической структурой. Так, не упомянутый
анипимил*, несомненно, следует отнести к блокаторам медленных кальциевых
каналов второго поколения, а лацидипин - к третьей генерации. В
классификации не учитывают блокаторы медленных кальциевых каналов,
которые по химической структуре не относят к производным
фенилалкиламина, бензотиазепина или дигидропиридина.
Фармакокинетика
Основные фармакокинетические параметры блокаторов медленных кальциевых каналов представлены в табл. 12-25.
Фармакокинетические свойства большинства блокаторов медленных кальциевых каналов сходны.
Блокаторы медленных кальциевых каналов, являясь липофильными соединениями, хорошо всасываются в ЖКТ (табл. 12-27).
Таблица 12-26. Абсорбция и время достижения максимальной концентрации блокаторов медленных кальциевых каналов в плазме крови после приёма внутрь
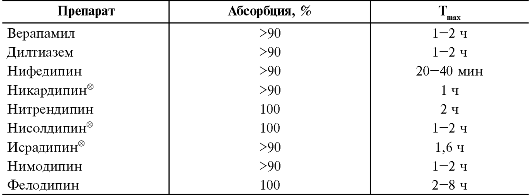 Абсорбция
блокаторов медленных кальциевых каналов зависит от лекарственной формы
препарата. Так, абсорбция нифедипина быстрее происходит после приёма
внутрь желатиновых капсул, содержащих нифедипин в виде раствора, чем
таблеток, покрытых оболочкой. Пик концентрации нифедипина в плазме крови
после приёма таблетки внутрь достигается через 0,5-2 ч из-за задержки
растворения таблетки в ЖКТ; после приёма капсулы внутрь - через 20-60
мин. При исследовании зависимости абсорбции нифедипина от рН желудочного
сока выявлено, что при пониженной кислотности всасывание препарата
повышено.
Абсорбция
блокаторов медленных кальциевых каналов зависит от лекарственной формы
препарата. Так, абсорбция нифедипина быстрее происходит после приёма
внутрь желатиновых капсул, содержащих нифедипин в виде раствора, чем
таблеток, покрытых оболочкой. Пик концентрации нифедипина в плазме крови
после приёма таблетки внутрь достигается через 0,5-2 ч из-за задержки
растворения таблетки в ЖКТ; после приёма капсулы внутрь - через 20-60
мин. При исследовании зависимости абсорбции нифедипина от рН желудочного
сока выявлено, что при пониженной кислотности всасывание препарата
повышено.
Блокаторы медленных кальциевых каналов обладают невысокой степенью абсолютной биодоступности (см. табл. 12-25) из-за выраженного эффекта первого прохождения через печень. Поэтому необ-
ходима особая осторожность при применении этих препаратов у больных с нарушениями функции печени в связи с опасностью резкого усиления их действия. Эффект первого прохождения через печень наиболее характерен для верапамила , галлопамила®, никардипина®, исрадипина®, фелодипина, нисолдипина®. Эффект первого прохождения менее выражен у нифедипина, амлодипина, нитрендипина, поэтому эти препараты обладают большей биодоступностью, которая варьирует в широких пределах. Наибольшей биодоступностью обладает амлодипин (60-80%), наименьшей - нисолдипин® (4-8%).
Блокаторы медленных кальциевых каналов в значительной степени связываются с белками плазмы крови (см. табл. 12-25). Это необходимо учитывать при назначении блокаторов медленных кальциевых каналов пациентам с гипопротеинемией, так как в этом случае возможно значительное увеличение содержания свободной фракции препаратов в крови, а значит, возникает опасность появления побочных эффектов. Также необходимо осторожно назначать блокаторы медленных кальциевых каналов с препаратами, которые обладают высоким сродством к белкам плазмы крови (лидокаин, диазепам, дизопирамид, дигоксин, дигитоксин, непрямые антикоагулянты и др.), так как возможно конкурентное вытеснение этими препаратами блокаторов медленных кальциевых каналов из связи с белками плазмы крови, что приведёт к увеличению содержания свободной фракции блокаторов медленных кальциевых каналов, а значит, возникает опасность появления побочных эффектов.
Важное клиническое значение имеет такой фармакокинетический параметр, как время достижения максимальной концентрации в плазме крови, который позволяет предсказать начало терапевтического действия ЛС (см. табл. 12-25). Время достижения максимальной концентрации в плазме крови после приёма внутрь наименьшее у нифедипина (20-40 мин) и никардипина® (60 мин) и наибольшее у амлодипина (6-12 ч). Быстрое начало терапевтического действия у нифедипина и никардипина® делает именно эти блокаторы медленных кальциевых каналов препаратами выбора в тех случаях, когда, например, необходимо быстро снизить АД, не прибегая к парентеральному введению ЛС. С другой стороны, невозможно ожидать быстрого антигипертензивного и антиангинального эффекта амлодипина, концентрации которого в плазме крови достигают максимума через несколько часов после введения. Равновесную концентрацию амлодипина в плазме крови определяют через 6-7 дней, а максимального антигипертензивного эффекта следует ожидать только через 4-8 нед от начала применения этого препарата. Максимальный антигипертензивный эффект ретардных форм верапамила, дилтиазема и нифедипина
также наступает после нескольких недель. Указанные обстоятельства определяют необходимость увеличения дозы этих препаратов больным с артериальной гипертонией не ранее чем через 2-4 нед непрерывной терапии.
Блокаторы медленных кальциевых каналов I поколения имеют короткие периоды полувыведения (4-6 ч) и небольшую продолжительность действия (6-8 ч), поэтому их назначают 3-4 раза в сутки. В то же время блокаторы медленных кальциевых каналов II поколения имеют гораздо большие периоды полувыведения и значительную продолжительность действия (12-24 ч), поэтому эти препараты назначают 1-2 раза в сутки (см. табл. 12-25).
В метаболизме блокаторов медленных кальциевых каналов принимает участие изофермент цитохрома Р-450 3A4. В метаболизм верапамила, кроме изофермента 3А4, определённый вклад вносит также и изофермент 1А2 (табл. 12-27).
Таблица 12-27. Метаболизм блокаторов медленных кальциевых каналов
 Большинство
блокаторов медленных кальциевых каналов не имеет активных метаболитов,
за исключением верапамила и дилтиазема. Активные метаболиты верапамила:
норверапамил (метаболит, образуемый в результате N-деалкилирования) и
деметилированный метаболит. Активный метаболит дилтиазема
деацетилдилтиазем. Имеются данные о том, что окисление блокаторов
медленных кальциевых каналов изоферментом цитохрома Р-450 3А4 проходит
не только в гепатоцитах, но и в энтероцитах.
Большинство
блокаторов медленных кальциевых каналов не имеет активных метаболитов,
за исключением верапамила и дилтиазема. Активные метаболиты верапамила:
норверапамил (метаболит, образуемый в результате N-деалкилирования) и
деметилированный метаболит. Активный метаболит дилтиазема
деацетилдилтиазем. Имеются данные о том, что окисление блокаторов
медленных кальциевых каналов изоферментом цитохрома Р-450 3А4 проходит
не только в гепатоцитах, но и в энтероцитах.
Побочные эффекты и противопоказания к назначению
Побочные эффекты со стороны сердечно-сосудистой системы кардиоселективных и вазоселективных блокаторов медленных кальциевых каналов значительно отличаются. Поэтому при рассмотрении побочных эффектов будет специально оговорено, какой эффект характерен для каждой из групп препаратов.
Для производных фенилалкиламина и бензотиазепина сердечно-сосудистые побочные эффекты связаны с рефлекторной активацией симпатоадреналовой системы в ответ на системную вазодилатацию, в особенности эти эффекты выражены у дигидропиридинов I поколения.
• Тахикардия, ощущение прилива крови к лицу, покраснение шеи и лица.
• Развитие наджелудочковых аритмий, чаще всего фибрилляции предсердий.
• Есть данные о том, что дигидропиридины I поколения у больных со стенокардией напряжения III, IV функционального класса в 10-20% случаев могут учащать приступы стенокардии и/или провоцировать её возникновение.
• Вазодилатация, возникающая после приёма дигидропиридинов I поколения, вызывает активацию не только симпатоадреналовой системы, но и ренин-ангиотензин-альдостероновой системы. Следствие активации ренин-ангиотензин-альдостероновой системы: появление у больных пастозности на лодыжках, голенях (тибиальные отёки) и иногда на тыльной стороне кистей.
Для дигидропиридиновых блокаторов медленных кальциевых каналов сердечно-сосудистые побочные эффекты связаны с их отрицательным хронотропным, дромотропным и инотропным эффектами.
• Отрицательный хронотропный эффект проявляется брадикардией, вплоть до развития асистолии, особенно часто подобное действие отмечают у пациентов с синдромом слабости синусового узла.
• Отрицательный батмотропный эффект проявляется удлинением интервала P-Q на электрокардиограмме вплоть до формирования атриовентрикулярной блокады. Угнетение атриовентрикулярной проводимости кардиоселективными блокаторами медленных кальциевых каналов неблагоприятно при пароксизме антидромной тахикардии у больных с синдромом Вольфа-Паркинсона-Уайта, так как эти препараты ускоряют антероградное проведение по дополнительным путям и таким образом увеличивают частоту сокращений желудочков.
• Отрицательный инотропный эффект может усугублять имеющуюся сердечную недостаточность вплоть до развития отёка лёгких.
При применении любых блокаторов медленных кальциевых каналов может отмечаться чрезмерное снижение АД с соответствующими клиническими проявлениями: головная боль, шум в ушах, обмороки. Факторы риска возникновения артериальной гипотензии: пожилой возраст, большая доза препарата, сублингвальный приём препарата, высокая температура в помещении, приём препарата после физической нагрузки, комбинация с другими гипотензивными препаратами, сопутствующая сердечная недостаточность.
Нижеперечисленные побочные эффекты встречают при применении всех блокаторов медленных кальциевых каналов, но их частота низка.
• Со стороны ЦНС: депрессия, сонливость, бессонница, повышенная утомляемость, парестезии.
• Со стороны ЖКТ: запор (чаще при применении верапамила), диарея, анорексия, сухость во рту, тошнота, рвота.
• Аллергические реакции при повышенной чувствительности к препаратам.
При длительном применении блокаторов медленных кальциевых каналов возможно развитие толерантности (привыкания).
Показано, что резкое прекращение приёма нифедипина может вызвать синдром отмены: значительное ухудшение состояния больных ИБС (снижение толерантности к физической нагрузке, появление приступов стенокардии в покое). Полагают, что в основе развития синдрома отмены нифедипина лежит активация контррегулирующих систем и гиперчувствительность гладкомышечных клеток коронарных сосудов к кальцию. Поэтому при возникновении необходимости отмены нифедипина следует постепенно уменьшать его дозу в течение 3-5 дней. Данных о наличии синдрома отмены у блокаторов медленных кальциевых каналов длительного действия нет.
Относительные и абсолютные противопоказания к назначению блокаторов медленных кальциевых каналов приведены в табл. 12-28.
Таблица 12-28. Противопоказания к назначению блокаторов медленных кальциевых каналов
 Окончание табл. 12-28
Окончание табл. 12-28
 Показания к применению и режим дозирования
Показания к применению и режим дозирования
ИБС. Блокаторы медленных кальциевых каналов относят к антиангинальным препаратам, одновременно уменьшающим потребность миокарда в кислороде и увеличивающим доставку кислорода к миокарду. Блокаторы медленных кальциевых каналов уменьшают потребность миокарда в кислороде, благодаря следующим механизмам:
• блокаторы медленных кальциевых каналов вызывают периферическую вазодилатацию артерий, что приводит к значительному уменьшению постнагрузки на миокард; этот эффект характерен для всех блокаторов медленных кальциевых каналов;
• производные фенилалкиламина и бензатиазепина снижают сократимость миокарда, что также снижает потребность миокарда в кислороде.
Блокаторы медленных кальциевых каналов увеличивают доставку кислорода к миокарду благодаря следующим механизмам:
• производные дигидропиридина обладают спазмолитическим действием на коронарные сосуды и таким образом увеличивают коронарный кровоток;
• производные фенилалкиламина и бензатиазепина также обладают дилатирующим действием на коронарные сосуды, однако выраженность этого эффекта меньше, чем для дигидропиридиновых блокаторов медленных кальциевых каналов.
При ИБС также благоприяты антиатеросклеротический, гиполипидемический, антиагрегантный эффекты блокаторов медленных кальциевых каналов.
На протяжении двух последних десятилетий появились многочисленные данные о неблагоприятных эффектах блокаторов медленных кальциевых каналов производных дигидропиридина I поколения (короткодействующие нифедипины) при длительном применении у больных с ИБС. Так, короткодействующий нифедипин вызывает ухудшение течения нестабильной стенокардии, сердечной недостаточности.
Приём нифедипина сопровождало увеличение смертности больных в первые 2 нед после возникновения инфаркта миокарда. Метаанализ 16 контролируемых клинических исследований выявил увеличение смертности у больных ИБС при приёме нифедипина в высоких дозах (более 60 мг/сут), при этом коэффициент риска для дозы 20 мг/сут составил 1,01; для дозы 80 мг/сут - 2,83.
В рекомендациях по ведению больных со стабильной стенокардией Американского колледжа кардиологов и Американской ассоциации сердца сказано: «В настоящее время у больных ИБС рекомендуют избегать назначений короткодействующих дигидропиридинов (в частности, нифедипина), так как они потенциально способны повысить риск сердечно-сосудистых осложнений».
Полагают, что основная причина ухудшения прогноза у больных, длительно принимающих короткодействующие нифедипины, - их способность рефлекторно активировать симпатоадреналовую систему. Однако уже имеются данные нескольких больших многоцентровых плацебо-контролируемых клинических исследований, в которых применялись пролонгированные лекарственные формы нифедипина и дигидропиридины II и III поколения у больных ИБС, в которых не было отмечено увеличения смертности.
Международные рекомендации по ведению больных со стабильной стенокардией Американского колледжа кардиологов и Американской ассоциации сердца чётко определяют место блокаторов медленных кальциевых каналов в терапии больных со стабильной стенокардией.
• Лечение больных со стабильной стенокардией начинают с блокаторов медленных кальциевых каналов II и III поколения только в случае наличия противопоказаний к назначению β-адреноблокаторов.
• Блокаторы медленных кальциевых каналов II и III поколения добавляют к β-адреноблокаторам, если монотерапия β-адреноблокаторами не даёт достаточного эффекта.
• Если β-адреноблокаторы вызывают выраженные нежелательные реакции, то их заменяют блокаторами медленных кальциевых каналов II и III поколения.
При вазоспастической стенокардии (вариантная стенокардия, стенокардия Принцметала) для профилактики приступов применяют производные дигидропиридина I, II, III поколений. Дигидропиридины в большей степени, чем другие блокаторы медленных кальциевых каналов, устраняют спазм коронарных артерий (препараты выбора при вазоспастической стенокардии). Данных о неблагоприятном действии короткодействующих нифедипинов на прогноз больных с вазоспасти-
ческой стенокардией нет. Однако скорее всего в этой ситуации следует отдавать предпочтение дигидропиридинам II и III поколения.
При нестабильной стенокардии дигидропиридины не используют так как было показано, что их применение в этой ситуации ухудшает прогноз (увеличивается общая смертность, риск возникновения инфаркта миокарда). В отношении эффективности кардиоселективных блокаторов медленных кальциевых каналов при нестабильной стенокардии ситуация иная: верапамил и дилтиазем обладают выраженным антиангинальным эффектом при нестабильной стенокардии, при этом прогноз больных не ухудшается. Кардиоселективные блокаторы медленных кальциевых каналов могут быть рекомендованы при нестабильной стенокардии при наличии противопоказаний к назначению β-адреноблокаторов.
При остром инфаркте миокарда назначение короткодействующих нифедипинов в остром периоде приводило к значительному ухудшению прогноза. Данных по эффективности и безопасности дигидропиридинов II и III поколения при остром инфаркте миокарда нет. В отличие от дигидропиридинов, применение верапамила и дилтиазема при инфаркте миокарда улучшает прогноз больных, и поэтому эти препараты могут быть рекомендованы при наличии противопоказаний к назначению β-адреноблокаторов.
Артериальная гипертензия. Способность блокаторов медленных кальциевых каналов расслаблять гладкую мускулатуру артерий мышечного типа и артериол и таким образом уменьшать ОПСС послужила основанием для широкого использования этих препаратов при артериальной гипертонии. Кроме того, блокаторы медленных кальциевых каналов обладают рядом эффектов, которые весьма полезны при артериальной гипертонии.
• Способствуют обратному развитию гипертрофии левого желудочка, которая представляет независимый фактор риска возникновения сердечной недостаточности, ИБС, нарушений ритма сердца.
• Производные фенилалкиламина обладают нефропротекторным эффектом, замедляя и приостанавливаяя поражение почек.
• Блокаторы медленных кальциевых каналов не обладают отрицательными метаболическими эффектами. Кроме того, производные фенилалкиламина снижают атерогенность плазмы крови и улучшают толерантность к глюкозе.
• Доказана способность блокаторов медленных кальциевых каналов уменьшать выраженность гипертрофии левого желудочка у больных артериальной гипертонией, которая, по современным представлениям, выступает в качестве серьёзного фактора риска сердечно-сосудистых осложнений.
По гипотензивной активности блокаторы медленных кальциевых каналов не отличаются от других основных групп антигипертензивных препаратов (диуретики, β-адреноблокаторы, ингибиторы АПФ, блокаторы ангиотензиновых рецепторов). Отличительная особенность гипотензивного эффекта блокаторов медленных кальциевых каналов - дозозависимость. Чем выше доза блокатора медленных кальциевых каналов, тем сильнее гипотензивный эффект.
Благодаря своей высокой эффективности и хорошей переносимости блокаторы медленных кальциевых каналов в течение двух десятилетий широко использовали при лечении артериальной гипертонии. Но в середине 90-х годов возникли сомнения в безопасности длительного применения блокаторов медленных кальциевых каналов. Так, в нескольких проспективных исследованиях было обнаружено, что при лечении блокаторами медленных кальциевых каналов сердечно-сосудистые осложнения развиваются у больных артериальной гипертонией чаще, чем при лечении тиазидными диуретиками или ингибиторами АПФ. Дальнейший анализ, однако, показал, что повышенный риск смерти или развития сердечно-сосудистых осложнений связан лишь с применением короткодействующих нифедипинов. В то же время применение блокаторов медленных кальциевых каналов длительного действия не приводит к увеличению риска развития инфаркта миокарда по сравнению с таковым при использовании β-адреноблокаторов.
Таким образом, в настоящее время существуют убедительные доказательства не только высокой антигипертензивной эффективности, но и безопасности блокаторов медленных кальциевых каналов II и III поколения.
Согласно Международным рекомендациям по лечению артериальной гипертензии ВОЗ, блокаторы медленных кальциевых каналов II и III поколения особенно показаны в качестве базисной антигипертензивной терапии в следующих ситуациях:
• при изолированной систолической гипертензии у пожилых больных в тех случаях, когда диуретики противопоказаны, неэффективны или вызывают побочные реакции;
• после перенесённого инфаркта миокарда в тех случаях, когда противопоказаны β-адреноблокаторы, следует применять пролонгированные формы верапамила или дилтиазема;
• у больных с сопутствующей стенокардией в тех случаях, когда противопоказаны β-адреноблокаторы;
• у больных с диабетической нефропатией в тех случаях, когда ингибиторы АПФ противопоказаны или вызывают серьёзные побочные реакции.
Блокаторы медленных кальциевых каналов длительного действия можно применять как в качестве монотерапии, так и в комбинации с другими антигипертензивными препаратами. Если монотерапия не обеспечивает снижения АД ниже 140/90 мм рт.ст., рекомендуют комбинировать блокаторы медленных кальциевых каналов с ингибиторами АПФ или β-адреноблокаторами. При этом следует помнить, что β-адреноблокаторы можно комбинировать лишь с дигидропиридиновыми блокаторами медленных кальциевых каналов, тогда как комбинации β-адреноблокатора и верапамила, дилтиазема считают небезопасными.
В настоящее время блокаторы медленных кальциевых каналов попрежнему широко используют при лечении гипертонической болезни, однако лишь блокаторы медленных кальциевых каналов II и III поколения считают вполне безопасными. Короткодействующие блокаторы медленных кальциевых каналов, и в особенности производные дигидропиридина, не рекомендуют применять для длительной терапии.
Нарушения ритма сердца. См. главу 13 «Антиаритмические лекарственные средства».
Гипертрофическая кардиомиопатия. Основное расстройство функции сердца при гипертрофической кардиомиопатии - нарушение наполнения левого желудочка в диастолу вследствие резкой гипертрофии его стенок и межжелудочковой перегородки - диастолическая дисфункция левого желудочка. Диастолическая дисфункция характерна для обеих форм гипертрофической кардиомиопатии - обструктивной и необструктивной. При обструктивной форме гипертрофической кардиомиопатии, кроме того, имеется обструкция пути оттока крови из левого желудочка в аорту. При гипертрофической кардиомиопатии для улучшения диастолической функции левого желудочка и уменьшения обструкции выходного тракта левого желудочка применяют лекарственные препараты с отрицательным инотропным эффектом: β-адреноблокаторы и кардиоселективные блокаторы медленных кальциевых каналов (верапамил и дилтиазем). Благоприятными при гипертрофической кардиомиопатии считают следующие эффекты кардиоселективных блокаторов медленных кальциевых каналов.
• Улучшение растяжимости миокарда в диастолу, что облегчает наполнение левого желудочка и о чём свидетельствует снижение конечного диастолического давления в его полости.
• Снижение сократительной способности миокарда приводит к увеличению выходного тракта левого желудочка, о чём свидетельствует уменьшение систолического градиента давления между левым желудочком и аортой.
• В отличие от β-адреноблокаторов, блокаторы медленных кальциевых каналов более эффективно предотвращают внезапную смерть у больных с гипертрофической кардиомиопатией, которая чаще всего бывает связана с возникновением аритмии. Другие возможные показания. Производные дигидропиридина оказались эффективны в качестве вазодилататоров при первичной и вторичной лёгочной гипертензии. Дигидропиридины (нифедипин, амлодипин) с успехом применяют для профилактики вазоспастических приступов при синдроме Рейно. Верапамил оказался эффективен для профилактики приступов мигрени. Нимодипин, избирательно расширяющий артерии головного мозга, используют в неврологической практике при лечении ишемического и геморрагического инсульта. Блокаторы медленных кальциевых каналов применяют также при функциональных заболеваниях ЖКТ: нифедипин и дилтиазем используют при ахалазии кардии и диффузном спазме пищевода; верапамил при синдроме раздражённой толстой кишки, клиническом варианте синдрома раздражённого кишечника, протекающем преимущественно с диареей.
Режим дозирования блокаторов медленных кальциевых каналов отражён в табл. 12-29. В некоторых ситуациях необходимо снижение дозы: у пожилых, при заболеваниях печени (например, доза верапамила не должна превышать 120 мг) и при ХПН. Однако при ХПН дозу нифедипина, никардипина®, амлодипина, фелодипина и нисолдипина® не изменяют.
Таблица 12-29. Режим дозирования блокаторов медленных кальциевых каналов
 Окончание табл. 12-29
Окончание табл. 12-29
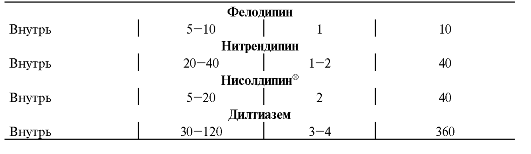 Взаимодействие
Взаимодействие
Существуют сложные взаимодействия между блокаторами медленных кальциевых каналов и другими ЛС, они могут вступать как в фармакокинетическое, так и в фармакодинамическое взаимодействие (прил. 3).
12.8. ВАЗОДИЛАТАТОРЫ СМЕШАННОГО ДЕЙСТВИЯ (НИТРОПРУССИД НАТРИЯ)
Механизм действия и основные фармакодинамические эффекты
Нитропруссид натрия - активный периферический вазодилататор короткого действия, расслабляющий гладкие мышцы артерий и вен. Механизм действия заключается во взаимодействии с сульфгидрильными группами клеточных мембран, что ведёт к нарушению синтеза циклических нуклеотидов со снижением транспорта ионов кальция. Расширяя артерии и вены, препарат снижает ОПСС и уменьшает венозный возврат. При исходно повышенном ОПСС за счёт его снижения уменьшает постнагрузку, повышает эффективность работы левого желудочка, увеличивает сердечный выброс. Снижение ОПСС может приводить к снижению АД. Расширяя периферические вены, препарат уменьшает преднагрузку на сердце, что приводит к улучшению внутрисердечной гемодинамики, снижению давления в малом круге кровообращения. Применение нитропруссида натрия может сопровождать рефлекторная тахикардия. У больных артериальной гипертензией при применении нитропруссида натрия не изменяется почечный кровоток и клубочковая фильтрация, секреция ренина увеличивается. У больных с недостаточностью кровообращения показатели почечной гемодинамики улучшаются не столько за счёт прямого действия препарата, сколько опосредованно в ответ на улучшение центральной гемодинамики. В связи с увеличением сердечного выброса и снижением давления в области устья полых вен у больных с застойной недо-
статочностью кровообращения тахикардия не возникает; в некоторых случаях, наоборот, наблюдают брадикардию.
Фармакокинетика
Нитропруссид натрия метаболизируется ферментами эритроцитов в цианиды, которые при участии ронидазы печени превращаются в тиоцианат. Период полувыведения тиоцианата составляет 84-156 ч, в связи с чем при повторных инфузиях возможно его накопление, особенно при нарушениях функции почек, так как тиоцианат выделяют почки. Тиоцианат вызывает метаболический ацидоз. Действовать препарат начинает через 0,5-1 мин, максимальный эффект наступает через 5 мин, продолжительность действия составляет 5-10 мин.
Побочные эффекты и противопоказания к назначению
Побочные эффекты нитропруссида натрия обусловлены цианидами либо быстро наступающим снижением АД и, следовательно, зависят от режима введения препарата. Признаки отравления тиоцианатом: слабость, гиперрефлексия, смазанная речь, судороги, психоз, кома, делирий. При резком снижении АД возникает холодный пот, мышечные подёргивания, тошнота, рвота, сердцебиение, тревога, спутанность сознания и сонливость. Нитропруссид натрия противопоказан при гипертиреоидизме, тяжёлых нарушениях функции почек и печени.
Показания к применению и режим дозирования
Нитропруссид натрия применяют для купирования тяжёлых гипертонических кризов, проведения управляемой гипотонии во время хирургических вмешательств. Нитропруссид натрия вводят внутривенно капельно в 5% растворе декстрозы . Обычно 50 мг нитропруссида натрия растворяют в 250-500 мл декстрозы. При гипертонических кризах препарат начинают вводить по 0,25-0,5 мкг/(кгхмин). Гипотензивный эффект возникает уже в первые 30-60 с. При необходимости дозу увеличивают до 8 мкг/(кгхмин) так, чтобы систолическое АД не было ниже 90-100 мм рт.ст. После прекращения инфузии гипотензивный эффект сохраняется в течение 5-10 мин. Непрерывное введение препарата можно проводить в течение 12-24 ч.
Взаимодействие
Ганглиоблокаторы и средства для наркоза потенцируют гипотензивный эффект нитропруссида натрия. Метилдопа в сочетании с
нитропруссидом натрия, наоборот, повышает АД и вызывает брадикардию. Брадикардию отмечают также при сочетании нитропруссида натрия с дигоксином. С особой осторожностью применяют у больных, получающих антикоагулянты.
12.9. АРТЕРИАЛЬНЫЕ ВАЗОДИЛАТАТОРЫ
К артериальным вазодилататорам относят миноксидил, диазоксид®, никорандил*, гидралазин.
Механизм действия и основные фармакодинамические эффекты
Сосудорасширяющее действие миноксидила . диазоксида® и нико- рандила* обусловлено активацией калиевых каналов гладкомышечных клеток артериол. Открытие калиевых каналов вызывает выход ионов калия и гиперполяризацию мембраны гладкомышечных клеток сосудов, что нарушает функцию потенциалозависимых калиевых каналов и снижает поступление внутрь клеток ионов кальция. Расширяются, главным образом, артериолы, на тонус венозных сосудов эти препараты практически не влияют. При лечении миноксидилом, диазоксидом® и никорандилом*, как и при назначении других артериальных вазодилататоров, происходит рефлекторное увеличение ЧСС, усиление сократимости миокарда, возрастание ударного и минутного объё- мов сердца. Рефлекторно происходит активация ренин-ангиотензинальдостероновой системы, что обуславливает задержку жидкости и натрия в организме. Кроме того, миноксидил обладает прямым антидиуретическим действием, увеличивая реабсорбцию натрия в почечных канальцах. Диазоксид® снижает скорость клубочковой фильтрации и тормозит экскрецию мочевой кислоты. В результате торможения высвобождения инсулина из поджелудочной железы диазоксид® может вызвать гипергликемический эффект. Миноксидил при местном применении оказывает стимулирующее влияние на рост волос при облысении.
Гидралазин и созданный на его основе эндралазин* продолжительно снижают тонус гладкой мускулатуры артериол и ОПСС посредством угнетения ферментов, участвующих в транспорте и депонировании АТФ. Спазмолитический эффект, возможно, связан с наличием в молекуле препаратов гидразиновой группы, способной задерживать инактивацию эндогенных сосудорасширяющих факторов, в том числе оксида азота. Гидралазин уменьшает ОПСС (на 20-40%), увеличивает минутный объём (на 15-100%). За счёт увеличения ударного объёма и ЧСС гидралазин и эндралазин* улучшают церебральное и периферическое кровообращение, повышают почечный кровоток. В меньшей
степени гидралазин и эндралазин*влияют на сосуды кожи и мышц. Гипотензивный эффект эндралазина*выражен сильнее. Следует помнить, что гипотензивный эффект этих препаратов часто оказывается ограниченным, так как в ответ на вазодилатацию и гипотензию развивается рефлекторная активация симпатической нервной системы, кроме того, это делает опасным применение препаратов у больных стенокардией, так как рефлекторные тахикардия и увеличение сердечного выброса могут значительно повысить потребность миокарда в кислороде.
Фармакокинетика
Абсорбция миноксидила составляет около 95%. Диазоксид® при приёме внутрь не всасывается, вследствие чего применяется только парентерально. Гидралазин и эндралазин* быстро и хорошо всасываются при приёме внутрь, но в результате эффекта первого прохождения их биодоступность составляет 25-55% и 10-15% соответственно. Миноксидил практически не связывается с белками крови, в то время как диазоксид® связывается на 90%, гидралазин - на 85%. Максимальная концентрация миноксидила достигается в течение 30-60 мин. Период полувыведения миноксидила - около 4 ч, но его эффект сохраняется в течение 24-48 ч за счёт накопления в организме активных метаболитов препарата. Действие препарата начинается через 30 мин, максимальная выраженность гипотензивного эффекта - через 2-3 ч. Диазоксид® имеет значительно больший период полувыведения (21- 36 ч), который увеличивается при заболеваниях почек до 52 ч. Около 80% миноксидила выводят почки: в неизменённом виде около 10%, остальное в виде глюкуронидов и полярных метаболитов. При нарушении выделительной функции почек выведение препарата не нарушено и не наблюдают его кумуляцию. Диазоксид® также выводят почки, причём 50% в неизменённом виде, остальное в виде метаболитов. Пик концентрации гидралазина в плазме отмечают через 3-5 ч. Период полувыведения гидралазина - от 1 до 4 ч, эндралазина* - 1,9-4,9 ч. Гидралазин на 75-80% выводят почки, и только 15-25% - ЖКТ. Параметры фармакокинетики и биологическая активность гидралазина во многом зависят от статуса ацетилирования больного, определение которого позволяет дозировать препарат индивидуально. В отличие от гидралазина эндралазин* не метаболизируется в печени, эффективность и частота побочных реакций не связаны со статусом ацетилирования больного. Время наступления эффекта и продолжительность действия гидралазина представлены в табл. 12-30. При местном применении миноксидила для усиления роста волос эффект наступает через 4 мес лечения.
Таблица 12-30. Основные временные характеристики наступления эффекта гидралазина
Путь введения | Начало действия, мин | Время наступления максимального эффекта | Продолжительность действия, ч |
В/в Внутрь | 10-20 20-30 | 30 мин 1-2 ч | 3-8 3-8 |
Побочные эффекты и противопоказания к назначению
Миноксидил и диазоксид® способствуют рефлекторной активации симпатоадреналовой системы, что проявляется тахикардией, увеличением сократимости миокарда, задержкой жидкости, декомпенсацией ХСН за счёт увеличения объёма циркулирующей крови, появлением головной боли, насморка, гиперемии кожных покровов. Развитие указанных побочных эффектов в основном связано с вазодилатацией. Кроме того, при применении этих препаратов возможны инверсия зубца Т вследствие изменения реполяризации миокарда, увеличение уровня креатинина крови у больных с почечной недостаточностью, развитие диспептических явлений. У больных ИБС возможно учащение ангинальных приступов. Описаны случаи развития инфаркта миокарда на фоне применения миноксидила.
Миноксидил может вызывать гипертрихоз без изменения уровня андрогенов.
При введении диазоксида® возможно появление гипергликемии, выраженной артериальной гипотонии (вплоть до коллапса), появление признаков ишемии сердца, мозга, спутанность сознания. Введение диазоксида® в первом периоде родов может привести к прекращеию самостоятельной родовой деятельности.
Гидралазин и эндралазин* также вызывают рефлекторную тахикардию, сердцебиение (особенно в начале лечения), пульсирующую головную боль, отёки разной локализации, обусловленные вазодилатацией, увеличение ударного объёма. Возможны также приступы стенокардии, аритмии, потеря аппетита, тошнота, рвота, лимфоаденопатии. При использовании гидралазина в больших дозах (200-400 мг) примерно у 10% больных возникают симптомы, напоминающие ревматоидный артрит, системную красную волчанку. В крови определяют противоядерные антитела, хотя функция почек не нарушена. Этот гидралазиновый синдром имеет иммунологическую основу и проявляется у больных с генетически замедленной скоростью ацетилирования в печени (медленные ацетиляторы). У таких больных отмечают повышенную концентрацию гидралазина в крови и более выраженный гипотензивный эффект. При длительном лечении возможно появление резистентности к гидралазину. В отличие от гидралазина, эндралазин* не вызывает иммунологических нарушений. В связи с возможностью развития синдрома отмены, гидралазин и эндралазин* отменяют постепенно.
Применение миноксидила и диазоксида® противопоказано при феохромоцитоме, митральном стенозе, вторичной лёгочной гипертензии, беременности, лактации, остром нарушении мозгового кровообращения, в остром периоде инфаркта миокарда.
С осторожностью назначают оба препарата (в том числе и при наружном применении миноксидила) пациентам с выраженным атеросклерозом сосудов головного мозга, сердца, почечной недостаточностью, застойной недостаточностью кровообращения, ИБС, стенокардией, сахарным диабетом, а также пожилым.
Гидралазин и эндралазин* противопоказаны при язвенной болезни желудка, периферической нейропатии (для её профилактики применяют пиридоксин по 100-200 мг в день). С осторожностью следует применять эти препараты у больных со стенокардией. Гидралазин противопоказан для применения у больных с системной красной волчанкой.
Показания к применению и режим дозирования
В настоящее время для длительной терапии артериальной гипертензии и сердечной недостаточности препараты этой группы не используют. Это связано как с большим количеством достаточно опасных побочных эффектов, так и с активацией симпатоадреналовой системы, ухудшающей прогноз у пациентов с сердечно-сосудистыми заболеваниями. Кроме того, не было показано влияние этих ЛС на процессы ремоделирования сердца и сосудов. Диазоксид® назначают исключительно для купирования гипертонических кризов, особенно связанных с острой энцефалопатией, острым гломерулонефритом и эклампсией. Гидралазин может быть эффективен при лечении эклампсии. Гидралазин в небольшой дозе входит в состав иногда используемых в настоящее время комбинированных гипотензивных препаратов, таких как адельфан®, трирезид* (0,1 мг резерпина, гидралазин и гидрохлортиазид по 10 мг). Однако с появлением новых групп эффективных и более безопасных сосудорасширяющих препаратов, таких как ингибиторы АПФ и блокаторы медленных кальциевых каналов, использование гидралазина, входящего в состав адельфана® и трирезида* стало нецелесообразно.
Основные дозы артериальных вазодилататоров представлены в табл. 12-31.
Таблица 12-31. Режим дозирования артериальных вазодилататоров
Препарат и путь введения | Разовая доза | Кратность назначения | Высшая суточная доза, мг |
Диазоксид®, в/в Гидралазин, внутрь | 1-3 мг/кг 10-100 мг | Возможно повторное введение через 5-15 мин 4 раза в день | 150 300 |
Взаимодействие
Гипотензивное действие диазоксида®, гидралазина и эндралазина* также усиливается при сочетанном применении с диуретиками, β-адреноблокаторами и резерпином. β-Адреноблокаторы уменьшают рефлекторную тахикардию, связанную с приёмом артериальных вазодилататоров, подавляя симпатическую стимуляцию сердца. Гидралазин входит в состав комплексных препаратов адельфан-эзидрекс* и трирезид*.
12.10. ИНГИБИТОРЫ АНГИОТЕНЗИНПРЕВРАЩАЮЩЕГО ФЕРМЕНТА
К группе ингибиторов ангиотензинпревращающего фермента относят каптоприл, беназеприл®, эналаприл, цилазаприл, периндоприл, квинаприл* , рамиприл, лизиноприл, фозиноприл, спираприл, трандолаприл. Эти препараты широко используют для лечения артериальной гипертензии и хронической сердечной недостаточности, поскольку в патогенезе этих состояний важную роль играет активация ренин-ангиотензин-альдостероновой системы.
Механизм действия и основные фармакодинамические эффекты
Ренин взаимодействует с α2-глобулином (ангиотензиногеном) с образованием слабоактивного декапептида ангиотензина I. Последний под влиянием АПФ превращается в октапептид ангиотензин II, который оказывает выраженное сосудосуживающее действие, а также стимулирует секрецию альдостерона и способствует задержке натрия в организме, увеличению объёма циркулирующей крови и калийурезу. Кроме того, АПФ усиливает разрушение брадикинина (вазодилатирующее вещество), участвует в биохимических превращениях нейропептидов (метэнкефалина, нейротензина). В норме активации прессорных систем (ренин-ангиотензин-альдостероновой и симпатоадреналовой), вызывающих вазоконстрикцию, противостоит действие депрессорной системы (калликреин-кининовой с главным действующим веществом брадикинином), вызывающей вазодилатацию. АПФ участвует в работе обеих систем: и вазодилатирующей, и вазоконстрикторной. При различных заболеваниях, в том числе артериальной гипертонии, ХСН, нормальная регуляция нарушена и преобладают эффекты прессорных систем.
В различных органах и тканях выявлена тканевая ренин-ангиотензин-альдостероновая система. АПФ содержится в крови (плазменное звено ренин-ангиотензин-альдостероновой системы) и многих клет-
ках, в частности эндотелиальных, нервных (в том числе в головном мозге), сердца, эпителия почечных канальцев, придатков яичка и др. (тканевая ренин-ангиотензин-альдостероновая система). Действие тканевой и плазменной ренин-ангиотензин-альдостероновой системы различно: плазменная ренин-ангиотензин-альдостероновая система активируется быстро, но оказывает кратковременные эффекты. Активность тканевых ренин-ангиотензин-альдостероновых систем нарастает постепенно, однако сохраняется долговременно. Считают, что до 90% всего объёма ренин-ангиотензин-альдостероновой системы приходится на органы и ткани и всего 10% - на плазму.
Ангиотензин II, который может образовываться в результате деятельности как тканевой, так и плазменной ренин-ангиотензин-альдостероновой системы, свой вазоконстрикторный эффект опосредует через несколько механизмов:
• прямое воздействие на рецепторы к ангиотензину;
• усиление выделения норадреналина из симпатических нервных окончаний;
• усиление выделения эндотелиальными клетками ещё одного мощного вазоконстриктора - эндотелина 1;
• увеличение входа в клетку свободного кальция.
Тканевое звено ренин-ангиотензин-альдостероновой системы ответственно за развитие органных поражений. Так, ангиотензин II, синтезируемый в миокарде, активирует протоонкогены и стимулирует гипертрофию и фиброз мышечных волокон. Кроме того, он активирует локальный синтез норадреналина. Аналогичные изменения наблюдают в гладкой мускулатуре периферических сосудов, что приводит к её гипертрофии.
Степень сродства (аффинности) различных ингибиторов АПФ как к тканевому, так и к плазменному АПФ различна. Преимущества имеют ингибиторы АПФ, обладающие высоким сродством к обоим АПФ, особенно к тканевому (поскольку именно тканевой АПФ определяет развитие органных поражений).
Ингибиторы АПФ препятствуют многогранному вазоконстрикторному эффекту ангиотензина II. Они вызывают повышение содержания в плазме крови ренина и снижение концентрации ангиотензина II, а также препятствуют разрушению брадикинина, уменьшают выделение альдостерона. В результате ослабляются вазопрессорный, антидиуретический и антинатрийуретический эффекты ангиотензина II, усиливается сосудорасширяющее и натрийуретическое действие брадикинина. Существуют данные о том, что ингибиторы АПФ активируют простагландины сосудистой стенки и самостоятельно оказывают вазодилатирующее действие. Препараты этой группы вызывают
уменьшение тонуса сосудов, главным образом артериол, вследствие чего происходит снижение АД, ОПСС и, соответственно, постнагрузки (см. табл. 12-32). Снижение содержания альдостерона приводит к уменьшению концентрации натрия и задержке калия (особенно при применении препаратов в больших дозах). В отличие от многих других вазодилататоров, ингибиторы АПФ, как правило, не вызывают рефлекторную тахикардию. Одновременно происходит увеличение концентрации брадикинина (активный вазодилататор). В результате сложного механизма сосудорасширяющего действия ингибиторы АПФ расширяют и венозные сосуды, в связи с чем уменьшают возврат крови к сердцу и давление в малом круге кровообращения. На фоне применения ингибиторов АПФ у пациентов с артериальной гипертонией и нормальной функцией почек практически не изменены или иногда увеличены почечный кровоток и клубочковая фильтрация.
Ингибиторы АПФ не влияют на атриовентрикулярную проводимость, автоматизм синусового узла и сократимость миокарда. Практически не влияют на почечный кровоток, однако увеличивают выработку ренина. Не оказывают влияния на тонус бронхов и моторику ЖКТ (кроме беназеприла®).
К общим для всех ингибиторов АПФ эффектам относят снижение АД, ОПСС, тонуса вен и давления в лёгочной артерии. Ингибиторы АПФ либо не оказывают влияния, либо повышают ЧСС и ударный объём (кроме беназеприла®).
Уменьшая образование ангиотензина II не только в плазме крови, но также, например, в сердце, ингибиторы АПФ препятствуют прогрессированию дилатации левого желудочка (его ремоделированию) и вызывают обратное развитие гипертрофии миокарда.
Ингибиторы АПФ способны улучшать функцию эндотелия, уменьшать агрегацию тромбоцитов, подавлять многие аспекты атерогенеза. Поэтому данные препараты обладают антиишемическим потенциалом.
Препараты этой группы увеличивают объёмную скорость коронарного кровотока и уменьшают напряжение стенок желудочков. Они могут оказать антиаритмическое действие, связанное с влиянием на трофические процессы в миокарде, увеличением содержания ионов калия и магния в крови, снижением содержания адреналина.
В связи с тем, что ангиотензин II активирует симпатические центры продолговатого мозга, усиливая симпатические влияния на сердце и сосуды, а также стимулирует передачу импульсов в симпатических нервных окончаниях и вегетативных ганглиях, стимулирует секрецию адреналина в мозговом слое надпочечников, применение ингибиторов АПФ приводит к уменьшению влияния симпатической нервной системы на тонус сосудов.
Ингибиторы АПФ не оказывают влияния на мозговое кровообращение. Кровоток в сосудах мозга поддерживается на достаточном уровне и на фоне снижения АД. Препараты этой группы не влияют на обмен липидов, мочевой кислоты, предотвращают отрицательное влияние диуретиков на электролитный баланс. Ингибиторы АПФ не вызывают подъёма АД и увеличения постнагрузки сразу после их отмены, т.е. для них не характерен синдром отмены.
Ингибиторы АПФ обладают выраженным нефропротективным действием, поскольку они оказывают благоприятное воздействие на внутрипочечную гемодинамику. При длительном применении эти препараты оказывают благоприятное влияние на два основных фактора прогрессирования почечной недостаточности - внутриклубочковую гипертензию и тубулоинтерстициальный фиброз (ангиотензин II обладает неблагоприятными внутрипочечными гемодинамическими эффектами, а также пролиферативным и профиброгенным эффектом). Кроме того, снижая системное АД и уменьшая протеинурию, ингибиторы АПФ воздействуют на два других фактора прогрессирования поражения почек.
Торможение превращения ангиотензина I в ангиотензин II сопровождает повышение концентрации ренина в плазме крови. Кроме того, образование ангиотензина II всё-таки может происходить под влиянием других ферментов (химазы и др.). К тому же при применении ингибиторов АПФ происходит накопление в крови брадикинина, что, помимо благоприятных для пациентов эффектов, может способствовать развитию и побочных эффектов (например, появлению сухого кашля, ангионевротического отека).
Существует группа ЛС, схожая по фармакологическим эффектам с ингибиторами АПФ, - ингибиторы вазопептидаз. Ингибиторы вазопептидаз, к которым относят омапатрилат*, одновременно блокируют как АПФ, так и нейтральную эндопептидазу. Последняя принимает участие в разрушениии натрийуретических пептидов. Таким образом, ЛС этой группы угнетают превращение ангиотензина I в ангиотензин II, а также способствуют накоплению натрийуретических пептидов, обладающих вазодилатирующим и диуретическим действием.
Классификация
Ингибиторы АПФ, согласно химической структуре части молекулы, связывающейся с АПФ, могут быть разделены на 3 группы, хотя общепринятой классификации не существует:
• ингибиторы АПФ, содержащие сульфгидрильную группу (каптоприл);
• ингибиторы АПФ, содержащие карбоксильную группу или карбоксалкилдипептиды (эналаприл, лизиноприл, рамиприл, пе-
риндоприл, цилазаприл, беназеприл, квинаприл*, трандолаприл, спираприл);
• ингибиторы АПФ, содержащие фосфорильную группу (фозиноприл).
Фармакокинетика
Реальное клиническое значение имеют некоторые осообенности фармакокинетики ингибиторов АПФ: биодоступность, биотрансформация, пути элиминации и продолжительность торможения активности АПФ. Указанные обстоятельства позволяют по фармакокинетическим свойствам разделить ингибиторы АПФ на 2 группы.
• Ингибиторы АПФ - активные вещества (каптоприл, лизиноприл).
• Пролекарства: предшественники ингибиторов АПФ (фозиноприл, все карбоксиалкилдипептиды, за исключением лизиноприла). Пролекарства всасываются из кишечника путём активного транспорта с помощью транспортёра 1 олигопептидов, затем превращаются в активную форму путем гидролиза эфирной связи в энтероцитах и гепатоцитах (например, эналаприл в эналаприлат). Действие препаратов этой группы развивается медленнее и длится дольше. Кроме того, при нарушении функции печени эффективность их снижена.
Каптоприл действует как активный препарат, биодоступность - 60%, быстро всасывается, но всасывание его уменьшено на 30-40% при одновременном приёме пищи, поэтому его следует принимать натощак, за 1-1,5 ч до приёма пищи. После приёма внутрь быстро всасывается из ЖКТ не менее 75% принятой дозы. Максимум концентрации в крови наступает через 1 ч после перорального приёма. Связывание с белками плазмы крови составляет 25-30%. В организме каптоприл (примерно половина поступившего количества) метаболизируется в печени в основном до неактивных дисульфидных конъюгатов. Эти метаболиты способны снова превращаться в каптоприл. Активность каптоприла делает реальным его применение в качестве препарата экстренной помощи, в частности, для купирования гипертонических кризов. Каптоприл имеет короткий период полувыведения (45-120 мин), период полувыведения его метаболитов составляет 9- 12 ч, поэтому необходим трёх-четырёхкратный приём препарата в сутки, выделяется преимущественно с мочой (75-95%). При нарушении функции почек период полувыведения увеличен до 21-32 ч, происходит накопление препарата в крови, поэтому возникает необходимость в коррекции дозы. Каптоприл проникает через фетоплацентарный барьер, в низких концентрациях его обнаруживают в женском молоке. Через ГЭБ не проникает.
Все карбоксиалкилдипептиды превосходят каптоприл по длительности действия, так как имеют более длительный период полувыведения, и поэтому их применяют 1-2 раза в сутки. Они меньше связываются с белками пищи, следовательно, их можно принимать независимо от еды. Все карбоксиалкилдипептиды, за исключением лизиноприла, - пролекарства, т.е. для образования активных метаболитов требуется биотрансформация этих препаратов в печени. Из этого следует, что данные препараты необходимо с осторожностью применять у лиц с печёночной недостаточностью, а также то, что они не могут быть использованы в качестве средств экстренной помощи. Основной путь элиминации практически всех ингибиторов АПФ, а также их активных и неактивных метаболитов - почечная экскреция. Поэтому у больных с явной или скрытой почечной недостаточностью, особенно у пожилых пациентов, дозы ингибиторов АПФ должны быть уменьшены.
Спираприл, фозиноприл, трандолаприл преимущественно инактивируются печенью и выводятся с желчью через кишечник. Следовательно, их можно применять для лечения больных с нарушением функции почек.
Спираприл. После приёма внутрь примерно 45% спираприла абсорбируется из ЖКТ. Максимальной концентрации спираприл в плазме крови достигает через 49-90 мин, а его активный метаболит спираприлат - через 2-3 ч. Абсолютная биодоступность спираприла составляет примерно 50%, а спираприлата примерно 70%. Около 90% спираприла и спираприлата связывается с белками плазмы крови. Спираприл почти полностью гидролизируется в печени до спираприлата. Выведение спираприла из организма происходит двухфазно, первая фаза длится 2 ч, вторая 40 ч. Спираприл и его активный метаболит примерно в одинаковых частях выводится из организма с мочой и калом.
Фозиноприл. После приёма внутрь из ЖКТ абсорбируется около 30-40% активного вещества. Степень абсорбции не зависит от приёма пищи. Максимальной концентрации фозиноприлат (активный метаболит фозиноприла) в плазме достигает через 3 ч. Связывание с белками плазмы - 95%. Фозиноприлат имеет относительно малый объём распределения и в незначительной степени связан с клеточными компонентами крови. Фозиноприлат не проникает через ГЭБ. Гидролиз фозиноприла с образованием фармакологически активного фозиноприлата происходит в слизистой оболочке ЖКТ и частично в печени. Фозиноприлат выводят в неизменённом виде почки и печень. Период полувыведения - 11,5 ч. У пациентов с нарушением функции почек общий клиренс фозиноприлата из организма примерно вдвое ниже, чем у пациентов с нормальной функцией почек, в то время как всасы-
вание, биодоступность и связывание с белками заметно не изменены. Сниженное выведение почками компенсирует повышенное выведение печенью. Клиренс фозиноприлата при гемодиализе и перитонеальном диализе в среднем составляет 2% и 7% соответственно. У пациентов с нарушениями функции печени возможно незначительное увеличение скорости гидролиза фозиноприла без изменения его степени. Относительно этой категории пациентов имеются данные о компенсаторном увеличении выведения активного вещества почками при одновременном снижении печёночного клиренса фозиноприла. У пациентов в возрасте старше 65 лет не наблюдают заметных различий в отношении фармакокинетических параметров фозиноприлата по сравнению с молодыми больными.
Трандолаприл. После приёма внутрь трандолаприл быстро всасывается из ЖКТ. Максимальной концентрации в плазме достигает почти через 30 мин. Абсорбция составляет 40-60% и не зависит от приёма пищи. Трандолаприл очень быстро исчезает из плазмы крови. Трандолаприл в плазме гидролизируется до трандолаприлата. Количество образуемого трандолаприлата не зависит от приёма пищи. Время достижения максимальной концентрации трандолаприлата в плазме крови составляет 4-6 ч. Связывание трандолаприлата с белками плазмы крови составляет более 80%. Период полувыведения трандолаприла из плазмы составляет менее 1 ч, а трандолаприлата 16-24 ч. После приёма внутрь меченного трандолаприлата 33% радиоактивной метки обнаруживают в моче, 66% - в кале. Концентрация трандолаприлата в плазме крови значительно выше у больных с клиренсом креатинина менее или равным 30 мл/мин. Концентрация трандолаприла в плазме у пациентов с циррозом печени по сравнению со здоровыми может быть в 10 раз выше. Концентрация в плазме крови и выведение почками трандолаприлата также увеличено у больных с циррозом печени, хотя и в меньшей степени. Фармакокинетика трандолаприла/трандо- лаприлата не изменена у пациентов с компенсированным нарушением функции печени.
Эналаприл. Пролекарство, которое в печени превращается в активное вещество - эналаприлат. Биодоступность - 40-60%, не изменяется при приёме пищи (можно принимать после еды). В максимальной концентрации обнаруживают через 2-4 ч, период полувыведения - более 11 ч. Эналаприл не образует соединения с белками крови, в отличие от эналаприлата (связь с белками крови 60-80%). Метаболизм препарата происходит в печени. Эналаприл выводят почки, в основном в виде активных метаболитов. Поражение печени или почек увеличивает время начала и длительность действия препарата.
Периндоприл. При пероральном приёме происходит быстрое всасывание препарата. Максимальной концентрации достигает через 1 ч. Биодоступность составляет 65-70%. В процессе метаболизма (в печени) периндоприл биотрансформируется с образованием активного метаболита - периндоприлата (около 20%) и пяти неактивных соединений. Максимальной концентрации периндоприлат в плазме достигает через 3-5 ч после приёма периндоприла. Связывание периндоприлата с белками плазмы крови незначительно - до 30%, зависит от концентрации препарата. Приём пищи замедляет всасывание периндоприла. Периндоприлат выводят из организма почки, период полувыведения - 3-5 ч. Период полувыведения периндоприла составляет 1 ч. У пожилых пациентов при сердечной и почечной недостаточности период полувыведения увеличен, что приводит к накоплению препарата в крови (требуется коррекция дозы).
Цилазаприл. Биодоступность - 45-57%. Всасывание не зависит от приёма пищи (можно принимать после еды). Связь с белками плазмы крови незначительна (25-30%). В печени цилазаприл метаболизируется в активную форму - цилазаприлат. Выводится почками (в основном в виде активных метаболитов).
Лизиноприл. Его отличительные фармакокинетические черты: очень низкая липофильность, отсутствие метаболизма в организме (вследствие низкой липофильности) и экскреция с мочой (100%). Абсорбция - 30% (6-60%). Биодоступность - 25-50%, приём пищи на неё не влияет. Не метаболизируется в печени. Пик концентрации в крови отмечают через 7 (6-8) ч после приёма препарата. Лизиноприл слабо связывается с белками плазмы крови. Период полувыведения препарата составляет 12 ч. Выводят почки в неизменённом виде. При нарушенной функции почек может происходить его накопление в крови, так как период полувыведения удлинён до 50 ч, что требует коррекции дозы. Лизиноприл незначительно проникает через ГЭБ и плацентарный барьер.
Беназеприл®. Биодоступность - 17%. В печени превращается в беназеприлат. Период полувыведения - 11 ч. Выводят почки.
Квинаприл быстро абсорбируется из ЖКТ, приём пищи не влияет на абсорбцию. Максимальной концентрации квинаприл? в плазме достигает в течение 1 ч. В печени препарат гидролизуется в квиналаприлат. Уровень квиналаприлата в крови составляет 38% от принятой внутрь дозы квинаприла . Максимальной концентрации квиналаприлат в плазме достигает через 2 ч после приёма внутрь квинаприла. Примерно 97% квинаприла или квиналаприлата циркулирует в плазме в связанном с белками виде. Выводят препарат и его метаболит почки. Период полувыведения квинаприла составляет примерно 1 ч,
квиналаприлата около 3 ч. У больных с почечной недостаточностью период полувыведения квинаприлата увеличен, что требует коррекции дозы. Выведение квиналаприлата снижено также у пожилых людей, с алкогольным циррозом печени (за счёт нарушения деэтерификации квинаприла).
Рамиприл. Одновременный приём пищи не влияет на абсорбцию препарата. Биодоступность - 28%, для рамиприлата - 40%. В печени происходит превращение в рамиприлат, который выводят главным образом почки в виде активных метаболитов. Частично экскретируется с калом. Период полувыведения рамиприлата составляет 9-18 ч. Рамиприл и рамиприлат связываются (соответственно 73% и 56%) с белками плазмы крови. Период полувыведения 10-11 ч, увеличивается при почечной недостаточности (коррекция дозы). Пути выведения - почки (56%) и ЖКТ (38%).
Основные временные характеристики действия ингибиторов АПФ представлены также в табл. 12-32.
Таблица 12-32. Основные временные характеристики действия ингибиторов ангиотензинпревращающего фермента
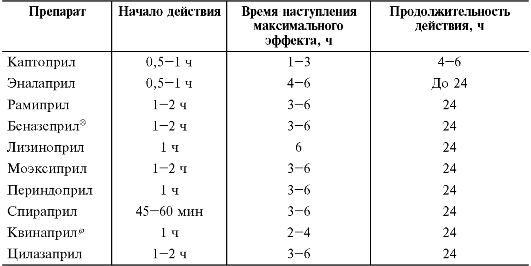 Показания к применению и режим дозирования
Показания к применению и режим дозирования
Ингибиторы АПФ назначают при артериальной гипертензии, особенно с высоким содержанием ренина (почечная и вазоренальная). Однако отмечено выраженное гипотензивное действие этих препаратов и у больных с нормальным содержанием ренина в плазме крови, так как при этом оно связано с повышением содержания брадикинина в крови. В лечении артериальной гипертонии ингибиторы АПФ - препараты первого выбора при наличии диабетической нефропатии (особенно са-
харный диабет 1-го типа), протеинурии, недиабетической нефропатии, хронической сердечной недостаточности, ИБС (острый инфаркт миокарда, постинфарктный кардиосклероз - все ингибиторы АПФ, стенокардия - периндоприл), дисфункции левого желудочка. Каптоприл применяют для лечения гипертонических кризов. Терапию начинают с минимальных доз (табл. 12-34) и потом титруют до средних. Использование в максимальных дозах в настоящее время для лечения считают нецелесообразным, альтернатива такому подходу - применение комбинированной терапии. Оптимальные комбинации при лечении артериальной гипертонии ингибиторов АПФ - сочетание с тиазидными диуретиками или блокаторами медленных кальциевых каналов.
Кроме того, существует препарат эналаприлат для внутривенного введения, применяемый для лечения гипертонических кризов, а также в комплексной терапии отёка лёгких.
Таблица 12-33. Рекомендуемые дозы ингибиторов ангиотензипревращающего фермента для лечения артериальной гипертензии и хронической сердечной недостаточности
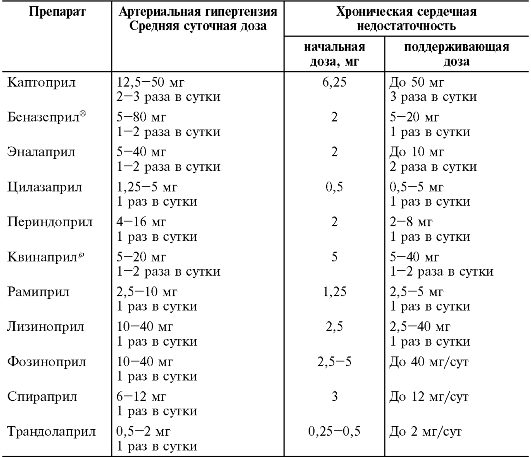 Кроме
того, ингибиторы АПФ - один из основных классов препаратов, применяемых
для лечения ХСН. Они обязательны к назначению для всех пациентов с
сердечной недостаточностью, независимо от исходного уровня АД
(повышенное или нормальное), этиологии и стадии ХСН. Начальная доза у
пациентов с сердечной недостаточностью ниже, чем при лечении
артериальной гипертонии, в дальнейшем необходимо титрование дозы до
максимальной (табл. 12-33). Они не только уменьшают выраженность
симптомов сердечной недостаточности, но, главное, увеличивают среднюю
продолжительность жизни этих пациентов.
Кроме
того, ингибиторы АПФ - один из основных классов препаратов, применяемых
для лечения ХСН. Они обязательны к назначению для всех пациентов с
сердечной недостаточностью, независимо от исходного уровня АД
(повышенное или нормальное), этиологии и стадии ХСН. Начальная доза у
пациентов с сердечной недостаточностью ниже, чем при лечении
артериальной гипертонии, в дальнейшем необходимо титрование дозы до
максимальной (табл. 12-33). Они не только уменьшают выраженность
симптомов сердечной недостаточности, но, главное, увеличивают среднюю
продолжительность жизни этих пациентов.
При наличии ХПН дозу большинства ингибиторов АПФ снижают
(табл. 12-34).
Таблица 12-34. Изменение режима дозирования ингибиторов ангиотензипревращающего фермента при хронической почечной недостаточности
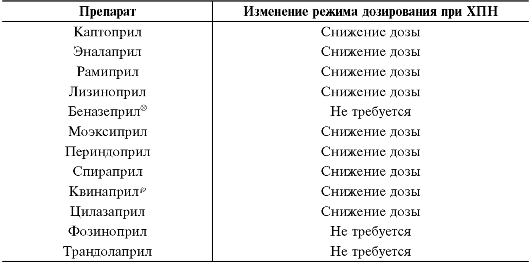 Побочные эффекты и противопоказания к назначению
Побочные эффекты и противопоказания к назначению
Приём ингибиторов АПФ обычно хорошо переносят. Побочные эффекты, в основном, выражены незначительно и быстро исчезают: головокружение, головная боль, усталость, тошнота, снижение аппетита. Однако возможно развитие более тяжёлых побочных эффектов, особенно при применении максимальных доз препаратов.
Отмечены артериальная гипотония вплоть до коллапса (наиболее часто после приёма первой дозы препарата, «гипотония первой дозы»), тахикардия на фоне снижения АД (особенно у больных с гипонатрийемией или получающих диуретики).
Также возможно появление или усиление нарушения функции почек (особенно при сочетании с диуретиками), протеинурия.
Со стороны органов дыхания - сухой кашель, очень редко - бронхит, удушье, синусит, ринит, бронхоспазм. Сухой кашель - один из самых известных побочных эффектов ингибиторов АПФ, хотя его частота и невелика. Его появление связано с накоплением брадикинина, что, в свою, очередь, - следствие блокады АПФ, который участвует в метаболизме брадикинина. В таких ситуациях имеется прямое показание к назначению антагонистов рецепторов ангиотензина II, поскольку они нейтрализуют активность ренин-ангиотензин-альдостероновой системы не за счёт блокады АПФ, а путём воздействия на рецепторы к ангиотензину II, поэтому метаболизм брадикинина не меняется.
Вовлечение печени, поджелудочной железы, ЖКТ - тошнота, боль в эпигастральной области, рвота, диарея, запоры, дисфагия, потеря аппетита (редко); при применении препаратов, метаболизируемых в печени, - повышение содержания в крови ферментов печени, билирубина, а также гепатит, холестатическая желтуха, печёночная недостаточность.
Дерматологические побочные эффекты - сыпь, фотосенсибилизация.
Кроме того, могут возникать тревожность, депрессия, нарушение сна, снижение слуха, нарушение зрения, невралгии, невропатии, парестезии, тремор, головокружение, крапивница, кожный зуд, ангионевротический отек, гиперкалиемия.
Очень редко наблюдают лейкопению, агранулоцитоз (особенно опасен у больных с аутоиммунными заболеваниями), анемию. Ингибиторы АПФ противопоказаны при беременности, лактации, в детском возрасте, при выраженном нарушении функции почек, гиперкалиемии, состоянии после трансплантации почек, первичном гиперальдостеронизме, ангионевротическом отёке при лечении ингибиторами АПФ в анамнезе, двустороннем стенозе почечных артерий, гипертрофической кардиомиопатии. С осторожностью следует назначать эти препараты больным с нарушением функции печени и почек, которым проводят гемодиализ.
Контроль лабораторных показателей. До начала терапии ингибиторами АПФ и систематически во время лечения необходимо проводить общий анализ крови и контролировать содержание электролитов, мочевины и креатинина, а также билирубина и ферментов печени в плазме крови.
Взаимодействие
Основные виды лекарственного взаимодействия представлены в приложении 3 . При использовании в составе комбинирован-
ной терапии с другими антигипертензивными препаратами можно наблюдать аддитивный эффект. Если ингибиторы АПФ используют в сочетании с диуретиком, вызывающим потерю калия, происходит уменьшение гипокалиемии, вызванной диуретиком. Одновременное применение с ингибиторами АПФ калийсберегающих диуретиков, а также препаратов калия у больных с нарушением функции почек может привести к существенному повышению уровня калия в сыворотке. При одновременном назначении ингибиторов АПФ и препаратов лития возможно повышение уровня лития в плазме крови.
12.11. АНТАГОНИСТЫ РЕЦЕПТОРОВ АНГИОТЕНЗИНА II
К представителям этого класса относят лозартан, эпросартан, кандесартан, валсартан, ирбесартан, телмисартан.
Механизм действия и основные фармакодинамические эффекты
Ангиотензин II осуществляет своё воздействие через специальные рецепторы, расположенные, в частности, в стенке сосудов, в нервных окончаниях и т.д. Выделены два основных типа АТ-рецепторов - АТ1 (первого типа) и АТ2 (второго типа).
Физиологические эффекты ангиотензина II, реализуемые на уровне рецепторов 1-го типа, вызывают вазоконстрикцию и повышение АД, реабсорбцию натрия в почечных канальцах и в кишечнике, высвобождение альдостерона, ремоделирование сосудистой стенки и миокарда, активацию симпатоадреналовой системы (центральная на пресинаптическом уровне и периферическая в надпочечниках), повышение чувствительности барорецепторов, задержку воды в организме, высвобождение ренина и др. Все эти эффекты ангиотензина II также вовлечены в регуляцию АД, а также в поддержание его на высоком уровне при артериальной гипертонии. Избирательная блокада АТ1-ре- цепторов позволяет не только устранять патологически возросший тонус сосудистой стенки при артериальной гипертонии и предупреждать патологическое ремоделирование сосудистой стенки и миокарда, но и обеспечивать регресс гипертрофии миокарда и улучшение диастолической функции миокарда (процессы расслабления сердца).
Роль рецепторов ангиотензина 2-го типа у человека пока до конца не установлена. Рецепторы АТ2 представлены в тканях мозга, миокарде, мозговом слое надпочечников, почках, матке и яичниках. АТ2- рецепторы опосредуют развитие вазодилатирующего эффекта, ингибирование клеточного роста, процесс регуляции апоптоза и некоторые другие процессы.
Классификация антагонистов ангиотензиновых рецепторов
В клинической практике используют лишь селективные блокаторы АТ1-рецепторов. Это высокоселективные непептидные соединения, избирательно блокирующие ангиотензиновые рецепторы 1-го типа. По химической структуре антагонисты рецепторов ангиотензина можно разделить на следующие основные группы:
• бифениловые производные тетразола (лозартан, ирбесартан, кандесартан);
• небифениловые нететразоловые соединения (эпросартан);
• небифениловые тетразолы (телмисартан);
• негетероциклические соединения (вальсартан).
Фармакокинетика
По фармакокинетическим свойствам антагонисты рецепторов ангиотензина делят на две группы - активные лекарственные вещества и пролекарства. АТ1-блокаторы можно классифицировать и в зависимости от наличия у них активных метаболитов. АТ1-блокаторы и их активные метаболиты также различаются в зависимости от характера взаимодействия с АТ1-рецепторами. Так, активный метаболит лозартана E-3174 (образуется из лозартана под влиянием CYP2C9), эпросартан обратимо связываются с АТ1-рецепторами, то есть выступают в качестве конкурентных блокаторов рецепторов к ангиотензину. Валсартан, кандесартан, ирбесартан, телмисартан, активный метаболит лозартана E-3174 действуют как неконкурентные блокаторы. Ирбесартан метаболизируется под влиянием CYP2C9 до неактивных метаболитов. Телмисартан - субстрат гликопротеина-Р, который принимает участие в его всасывании, распределении и выведении (главным образом печенью путём активной секреции в желчь). Особенности фармакокинетики антагонистов рецепторов ангиотензина представлены в
табл. 12-35, 12-36.
Таблица 12-35. Фармакокинетика эпросартана, лозартана и вальсартана
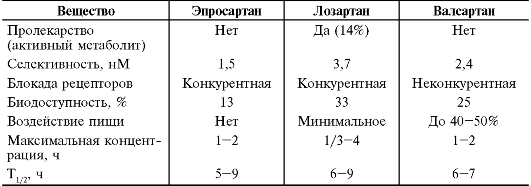 Окончание табл. 12-35
Окончание табл. 12-35
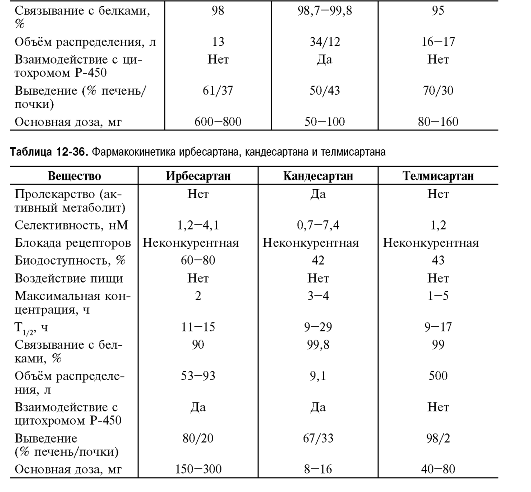 Показания к применению и режим дозирования
Показания к применению и режим дозирования
Показание к назначению препаратов данного класса - артериальная гипертензия. Кроме того, кандесартан и валсартан применяют для лечения сердечной недостаточности (как вместо ингибиторов АПФ в случае их непереносимости, так и вместе с ингибиторами АПФ). Антагонисты рецепторов ангиотензина, также как и ингибиторы АПФ, особенно показаны при сочетании артериальной гипертонии с диабетической нефропатией (сахарный диабет 2-го типа), протеинурией, гипертрофией миокарда левого желудочка.
Побочные эффекты и противопоказания к назначению
Отличительная особенность антагонистов рецепторов ангиотензина - крайне низкая частота побочных эффектов, сопоставимая с плацебо, что отличает их от гипотензивных препаратов других групп. Все нижеперечисляемые побочные эффекты встречают в единичных случаях.
• Сердечно-сосудистая система: ортостатические реакции, сердцебиение.
• ЖКТ: диарея, диспепсия, тошнота.
• ЦНС: головная боль, головокружение, астения, депрессия, судороги.
• Кровь: нейтропения, снижение концентрации гемоглобина и гематокрита.
• Органы дыхания: фарингит, бронхит.
• Аллергические проявления: ангионевротический отёк, крапивница, кожный зуд.
• Костно-мышечная система: миалгии, боль в спине, артралгии. Также отмечены гиперкалиемия, повышение активности аланин
аминотрансферазы. Препараты блокируют рецептор к ангиотензину II, а не АПФ, они не влияют на обмен брадикинина и никогда не вызывают кашель.
Антагонисты рецепторов ангиотензина противопоказаны при беременности, гиперкалиемии, индивидуальной непереносимости препаратов данной группы. Телмисартан также противопоказан больным с обструкцией желчевыводящих путей.
Контроль лабораторных показателей. До начала терапии антагонистами рецепторов ангиотензина и систематически во время лечения необходим контроль содержания электролитов, мочевины и креатинина.
Взаимодействие
Не отмечено взаимодействия препаратов этой группы с индометацином, варфарином, фуросемидом, дигоксином (кроме ирбесартана), атенололом, гидрохлоротиазидом, амлодипином, сахароснижающими препаратами для приёма внутрь, циметидином, ранитидином, кетоконазолом, флуконазолом.
Возможно усиление антигипертензивного эффекта антагонистов рецепторов ангиотензина при одновременном назначении с другими антигипертензивными препаратами.
При одновременном применении с калийсберегающими диуретиками, препаратами калия может произойти увеличение концентрации калия в плазме крови.
При одновременном применении ирбесартана с дигоксином отмечают повышение уровня дигоксина в плазме крови (повышен риск развития побочных эффектов).
12.12. ИНГИБИТОРЫ If-КАНАЛОВ СИНУСОВОГО УЗЛА
Ингибиторы If-каналов синусового узла - препараты, благодаря своему уникальному механизму действия селективно снижающие ЧСС, не влияя на другие параметры геомодинамики.
Механизм действия и основные фармакодинамические эффекты
В настоящее время применяют только один препарат из этой группы - ивабрадин. Ивабрадин не влияет на тонус сосудов, а, селективно снижая ЧСС, снижает потребность миокарда в кислороде, проявляя антиангинальное действие у больных со стенокардией напряжения. Снижение ЧСС под действием ивабрадина связано с тем, что он блокирует If-каналы синусового узла, которые контролируют спонтанную диастолическую деполяризацию в синусовом узле и регулируют ЧСС. Ивабрадин не оказывает влияния на проводимость по предсердиям, желудочкам, не угнетает атривентрикулярное проведение. Ивабрадин не влияет на сократимость миокарда.
Фармакокинетика
Несмотря на то, что ивабрадин хорошо всасывается в ЖКТ, его биодоступность составляет 40%, что обусловлено эффектом первого прохождения через печень, который обусловлен биотрансформацией препарата под влиянием CYP3A4. Это может иметь клиническое значение при применении ивабрадина вместе с ЛС, изменяющими активность CYP3A4 (ингибиторы/индукторы). Кроме того, из-за особенностей биотрансформации ивабрадина возникает необходимость снижения его дозы у больных с нарушением функции печени. Период полувыведения ивабрадина составляет 11 ч, в связи с чем его назначают 2 раза в сутки. Ивабрадин связывается с белками плазмы крови на 70%. Ивабрадин характеризует большой объём распределения - 100 л. В процессе биотрансформации под влиянием CYP3A4 из ивабрадина образуется активный метаболит N-десметиливабрадин (40% от активности ивабрадина). Препарат выводят почки в виде метаболитов, а в неизменённом виде почки выводят только около 4%, поэтому фармакокинетика ивабрадина у больных с ХПН меняется незначительно.
Показания к применению и режим дозирования
Ивабрадин показан больным со стенокардией напряжения в качестве антиангинального средства для профилатики приступов стенокардии в тех случаях, когда β-адреноблокаторы противопоказаны или плохо переносятся. Ивабрадин следует назначать только больным с синусовым ритмом. В настоящее время проводят исследование, посвященное изучению эффективности длительного применения ивабрадина у больных с ХСН.
Ивабрадин назначают внутрь, 2 раза в день (утром и вечером), во время еды. Начальная рекомендуемая суточная доза - 10 мг в сутки (по 5 мг 2 раза в день). В зависимости от терапевтического эффекта, через 3-4 нед суточная доза может быть увеличена до 15 мг (по 7,5 мг 2 раза в сутки). Если на фоне терапии ЧСС уменьшается до менее 50 или возникают симптомы, связанные с брадикардией (головокружение, усталость или снижение АД), необходимо использовать более низкую дозу препарата. Если при снижении дозы ЧСС не нормализуется и остаётся менее 50, препарат отменяют. У пожилых пациентов лечение следует начинать с начальной дозы 2,5 мг (1/2 таблетки по 5 мг) 2 раза в день; возможно увеличение суточной дозы в зависимости от состояния пациента.
Побочные эффекты и противопоказания к назначению
Наиболее часто при применении ивабрадина наблюдают нарушение зрения в виде слабо или умеренно выраженной фотопсии (14,5%), как правило, в течение первых 2 мес лечения. Однако только в 1% случаев фотопсии были причиной отказа от лечения ивабрадином. Эти явления связаны со способностью ивабрадина блокировать Ih- каналы сетчатки глаза, которые сходны с If-каналами сердца, участвующими в возникновении временного изменения системы зрительного восприятия за счёт изменения реакции сетчатки на яркие световые стимулы. Кроме того, при применении ивабрадина возможно развитие брадикардии (3,3%), особенно в первые 2-3 мес терапии, в том числе тяжёлой с ЧСС 40 и ниже (0,5%), АВ-блокады I степени, желудочковой экстрасистолии. Другие нежелательные побочные эффекты при применении ивабрадина развиваются значительно реже.
Противопоказания к назначению ивабрадина: ЧСС в покое ниже 60 (до начала лечения), кардиогенный шок, острый инфаркт миокарда, выраженная артериальная гипотензия (систолическое АД ниже 90 мм рт.ст. и диастолическое АД ниже 50 мм рт.ст.), тяжёлая печё- ночная недостаточность, синдром слабости синусового узла, синоатриальная блокада, искусственный водитель ритма, нестабильная стенокардия, АВ-блокада II-III степени, острое нарушение мозго-
вого кровообращения, одновременный приём сильных ингибиторов цитохрома P-450 CYP3A4 (в том числе кетоконазола , итраконазола , кларитромицина, эритромицина, джозамицина, телитромицина, нелфинавира®, ритонавира , нефазодона*); непереносимость галактозы, дефицит лактазы, глюкозо-галактозная недостаточность (для лекарственных форм, содержащих лактозу), беременность, период лактации, возраст до 18 лет (эффективность и безопасность не установлены).
Взаимодействие
С препаратами, обладающими отрицательным хронотропным эффектом (верапамил , дилтиазем, β-адреноблокаторы, амиодарон и др.) ивабрадин может вступать в фармакодинамическое взаимодействие, при этом может происходить более существенное снижение ЧСС. Клиническое значение может иметь фармакокинетическое взаимодействие ивабрадина на уровне биотрансформации: ЛС-ингибиторы CYP3A4 могут повышать концентрацию ивабрадина в плазме крови, увеличивая риск нежелательных побочных эффектов, а ЛС-индукторы - снижать концентрацию, тем самым снижая эффективность ивабрадина. Поэтому противопоказано применение ивабрадина с сильными ингибиторами CYP3A4, такими, как противогрибковые средства группы азолов (кетоконазол, интраконазол), антибиотики из группы макролидов (кларитромицин, эритромицин, джозамицин, телитромицин), ингибиторы ВИЧ-протеаз (нелфинавир®, ритонавир). Применение ивабрадина с умеренными ингибиторами CYP3A4 (в том числе флуконазол) следует применять с начальной дозы 2,5 мг 2 раза в день. При ЧСС реже 60 необходим тщательный контроль ЧСС. При применении ивабрадина с индукторами CYP3A4 (рифампицин, барбитураты, фенитоин, препараты зверобоя) возможно снижение концентрации ивабрадина, что обуславливает необходимость его применения в более высокой дозе.
12.13. ПРИНЦИПЫ ВЫБОРА ЛЕКАРСТВЕННЫХ СРЕДСТВ,
ПОНИЖАЮЩИХ СОСУДИСТЫЙ ТОНУС
Выбор наиболее эффективного и безопасного ЛС или комбинации препаратов для лечения сердечно-сосудистых заболеваний в основном определяют следующие факторы.
• Нозологическая форма.
• Состояние основных функций миокарда.
• Наличие сопутствующих заболеваний.
• Частота возникновения и опасность побочных эффектов препаратов.
• Функциональное состояние органов выведения и метаболизма.
Выбор лекарственных средств при артериальной гипертензии
Лечение вторичной артериальной гипертензии состоит прежде всего в терапии основного заболевания, ЛС с гипотензивным действием выполняют роль симптоматической терапии. Тактика лечения эссенциальной артериальной гипертензии зависит от уровня АД и степени риска кардиоваскулярных осложнений (табл. 12-37). При этом учитывают следующие факторы риска:
• возраст (мужчины старше 55 лет, женщины старше 65 лет);
• курение;
• уровень общего холестерина более 6,6 ммоль/л;
• наличие сахарного диабета;
• указание на преждевременное развитие сердечно-сосудистых заболеваний в семейном анамнезе.
Основная цель лечения - нормализация уровня АД с целью предупреждения осложнений, при отсутствии или минимальном уровне побочных эффектов. При низком риске развития осложнений лечение начинают с мероприятий, направленных на изменение образа жизни больного. Изменение образа жизни и питания следует рекомендовать всем пациентам независимо от тяжести артериальной гипертензии. Следует попытаться устранить все относительно обратимые факторы, а также повышенные концентрации холестерина и/или глюкозы. Перечисленные меры позволяют, с одной стороны, снизить скорость прогрессирования заболевания, а с другой стороны - уменьшить дозы гипотензивных средств. Если у больного с низким риском осложнений эти мероприятия не позволяют нормализовать уровень АД в течение 6-12 мес (см. таб. 12-37), следует переходить к медикаментозной терапии. У больных с высоким риском развития осложнений медикаментозное лечение начинают немедленно. Начинать лечение необходимо с применения одного ЛС в минимальной суточной дозе (эта рекомендация не касается больных с тяжёлой артериальной гипертензией или лиц, у которых предшествующая терапия была неэффективна). В дальнейшем одновременно следует прибавлять не более одного нового ЛС. Применение новых препаратов следует начинать с использования их в малых дозах. Целью каждого очередного этапа лечения должно быть снижение уровня АД на 5-10 мм рт.ст. Если АД не снижается до желаемого уровня, дальнейшее лечение осуществляют путём постепенного увеличения доз или присоединения новых ЛС. Неэффективные ЛС (не вызывающие снижения АД на 5-10 мм рт.ст.) и препараты, вызывающие нежелательные лекарственные реакции, следует отменить. На всех этапах лечения следует предотвращать перегрузку объёмом жидкости (назначение диеты с низким содержанием поваренной соли и, при необходимости, назначение диуретиков).
Таблица 12-37. Взаимосвязь между величиной артериального давления, степенью риска кардиоваскулярных осложнений и стратегией лечения артериальной гипертензии
 Первый
приём гипотензивных ЛС следует проводить сразу после пробуждения
больного или после 4 часов утра, если больной проснулся раньше. Единых
рекомендаций относительно того, с каких конкретно препаратов следует
начинать лечение больного, не существует. Выбор ЛС зависит от возраста,
пола и наличия сопутствующих заболеваний (табл. 12-39), в целом для
терапии артериальной гипертонии чаще применяют диуретики,
β-адреноблокаторы, ингибиторы АПФ, а у пожилых больных - блокаторы
медленных кальциевых каналов. У больных с тяжёлым течением артериальной
гипертонии и при неэффективности лечения одним препаратом применяют
комбинации ЛС:
Первый
приём гипотензивных ЛС следует проводить сразу после пробуждения
больного или после 4 часов утра, если больной проснулся раньше. Единых
рекомендаций относительно того, с каких конкретно препаратов следует
начинать лечение больного, не существует. Выбор ЛС зависит от возраста,
пола и наличия сопутствующих заболеваний (табл. 12-39), в целом для
терапии артериальной гипертонии чаще применяют диуретики,
β-адреноблокаторы, ингибиторы АПФ, а у пожилых больных - блокаторы
медленных кальциевых каналов. У больных с тяжёлым течением артериальной
гипертонии и при неэффективности лечения одним препаратом применяют
комбинации ЛС:
• диуретик и β-адреноблокатор;
• диуретик и ингибитор АПФ;
• блокатор медленных кальциевых каналов (дигидропиридинового ряда) и β-адреноблокатор;
• блокатор медленных кальциевых каналов и ингибитор АПФ;
• α1-адреноблокатор и β-адреноблокатор;
• менее эффективны комбинации блокатора медленных кальциевых каналов с диуретиком и β-адреноблокатора с ингибитором АПФ.
Гипертонический криз требует неотложной терапии, так как резкое повышение диастолического давления создаёт угрозу нарушения моз-
гового кровообращения. Лечение этого состояния следует начинать с сублингвального приёма нитроглицерина (0,5 мг) или клонидина (0,1-0,2 мг), каптоприла (25-50 мг), нифедипина (10-20 мг) - внутрь. Приём этих ЛС больной может осуществлять самостоятельно, используя инструкции лечащего врача. Однако следует помнить, что при сублингвальном применениии клонидина, нифедипина, каптоприла возможно резкое снижение АД и ухудшение мозгового кровообращения, особенно у пожилых больных. Для купирования гипертонического криза может быть применён эналаприлат внутривенно. При недостаточной эффективности этих средств или при необходимости быстро снизить АД (например, при отёке лёгких или в том случае, когда на фоне криза у пациента возник приступ стенокардии) для купировании криза используют нитропруссид натрия [0,5-1,0 мкг/(кгхмин)], нитроглицерин (5-100 мкг/мин) или сульфат магния (5-20 мл 25% раствора медленно) - внутривенно. Для уменьшения объёма циркулирующей крови часто используют петлевые диуретики (фуросемид). При гипертоническом кризе, возникшем на фоне почечной недостаточности, применяют препараты, снижающие гиперволемию, вазоконстрикцию и усиливающие почечный кровоток (гидралазин, метилдопа). При лечении больных с гипертоническим кризом следует помнить, что быстрое снижение АД может провоцировать развитие недостаточности мозгового кровообращения или другие опасные осложнения.
Выбор лекарственных средств при стенокардии напряжения
Лечение стенокардии преследует несколько главных целей:
• купирование приступов;
• предупреждение приступов стенокардии и безболевых эпизодов ишемии миокарда либо уменьшение их частоты и выраженности;
• вторичная профилактика ИБС и улучшение прогноза жизни;
• улучшение качества жизни.
С целью быстрого купирования приступа стенокардии используют только некоторые лекарственные формы нитратов (нитроглицерин: сублингвальные, буккальные формы, аэрозоли; изосорбида динитрат - аэрозоли, таблетки для разжёвывания).
Большинство лекарственных форм антиангинальных препаратов используют для предупреждения приступов стенокардии и безболевых эпизодов ишемии миокарда. Некоторые препараты можно использовать как с целью профилактики, так и лечения.
В плане вторичной профилактики имеют значение препараты, оказывающие благоприятное влияние на прогноз в отношении жизни, - β-адреноблокаторы и, возможно, ингибиторы If-каналов, верапамил, дилтиазем, дигидропиридиновые блокаторы медленных кальциевых
Таблица 12-38. Рекомендации ВОЗ (1999) по выбору препарата для лечения артериальной гипертензии
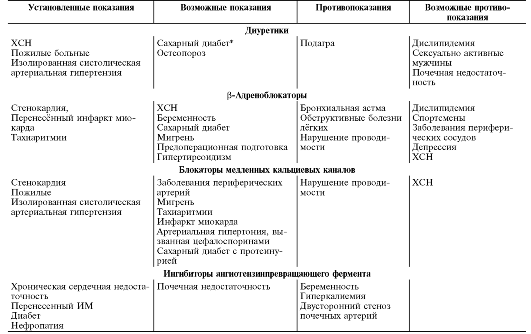 Окончание табл. 12-38
Окончание табл. 12-38
 каналов
IIА и IIБ поколений. К сожалению, в настоящее время отсутствуют данные
больших контролируемых исследований по изучению роли нитратов во
вторичной профилактике ИБС и значения их для прогноза жизни.
каналов
IIА и IIБ поколений. К сожалению, в настоящее время отсутствуют данные
больших контролируемых исследований по изучению роли нитратов во
вторичной профилактике ИБС и значения их для прогноза жизни.
Помимо назначения медикаментозного лечения очень важно выявить и по возможности устранить факторы, провоцирующие приступы: гипоксемию, тиреотоксикоз, анемию, инфекции, а также дать пациенту рекомендации по изменению образа жизни (избегать эмоциональных, физических перегрузок, ограничить потребление алкоголя). Дополнительно необходимо воздействовать на факторы риска ИБС: у больных с артериальной гипертонией необходимо добиться стабилизации уровня АД, при ожирении - снижения массы тела, коррекции нарушений липидного и углеводного обмена. Больным со стенокардией следует рекомендовать бросить курить.
При высоком риске осложнений или неэффективности медикаментозной терапии показано проведение коронароангиографии с последующей баллонной коронарной ангиопластикой или аортокоронарное шунтирование.
Долговременное лечение стенокардии предусматривает применение аспирина и β-адреноблокаторов. Дополнительно (при неэффективности или непереносимости β-адреноблокаторов) могут быть назначены пролонгированные нитраты и/или блокаторы медленных кальциевых каналов.
Рекомендации по лечению стабильной стенокардии (Американский колледж кардиологов, Американская ассоциация сердца)
Класс I. Эффективность вмешательства доказана или не вызывает сомнений у экспертов.
• Ацетилсалициловая кислота при отсутствии противопоказаний (80-325 мг/сут).
• При отсутствии противопоказаний лечение начинают с применения β-адреноблокаторов как при наличии, так и отсутствии инфаркта миокарда в анамнезе.
• При наличии противопоказаний к назначению β-адреноблокаторов лечение начинают с блокаторов медленных кальциевых каналов или длительно действующих нитратов.
• Если терапия β-адреноблокаторами не даёт достаточного эффекта, к ним добавляют блокаторы медленных кальциевых каналов или нитраты.
• Если β-адреноблокаторы вызывают выраженные нежелательные реакции, то их заменяют блокаторами медленных кальциевых каналов или нитратами.
• Нитроглицерин под язык или в виде спрея для купирования приступов стенокардии.
• Гиполипидемическая терапия у больных ИБС при уровне ЛПНП 130 мг/дл и более.
Класс II. Эффективность вмешательства убедительно не доказана или мнения экспертов неоднозначны.
Класс IIa. Больше данных в пользу эффективности.
• Клопидогрел при наличии абсолютных противопоказаний к назначению ацетилсалициловой кислоты.
• Длительно действующие недигидропиридиновые блокаторы медленных кальциевых каналов (верапамил или дилтиазем) в качестве средств первого ряда вместо β-адреноблокаторов.
• Гиполипидемическая терапия у больных ИБС при уровне ЛПНП
100-129 мг/дл.
Класс Иб. Данных, подтверждающих эффективность, недостаточно.
• Применение варфарина в дополнение к ацетилсалициловой кислоте.
Класс III. Вмешательство неэффективно или бесполезно.
• Дипиридамол.
Выбор лекарственных средств при безболевых эпизодах ишемии миокарда
Тактика лечения больных такой формой ИБС зависит от результатов проб с физической нагрузкой, суточного мониторирования ЭКГ. При редких безболевых эпизодах ишемии миокарда и высокой переносимости физических нагрузок рекомендуют ограничиться борьбой с основными факторами риска, уменьшением объёма физических нагрузок. В случае частых безболевых эпизодов ишемии миокарда, возникающих при средних и при малых физических нагрузках, назначают антиангинальные средства под контролем состояния до и после физической нагрузки (велоэргометрия, тредмил). Предпочтение отдают β-адреноблокаторам. При частых безболевых эпизодах ишемии миокарда более рационально назначение β-адреноблокаторов пролонгированного действия. Обсуждают применение антиагрегантов (ацетилсалициловой кислоты), однако в отношении этой группы препаратов получены разноречивые данные.
Выбор лекарственных средств при инфаркте миокарда
Неотложная помощь при инфаркте миокарда должна быть направлена на:
• обезболивание;
• восстановление коронарного кровотока;
• ограничение размеров некроза;
• предупреждение ранних осложнений, прежде всего, опасных для жизни аритмий.
Тактика оказания помощи зависит от времени, прошедшего от начала болевого приступа. Лечение больного с инфарктом миокарда следует начинать с назначения кислорода через носовые катетеры и обеспечения внутривенного доступа (внутривенный катетер). Больному сублингвально назначают нитроглицерин, ацетилсалициловую кислоту внутрь, а при сохранении боли для обезболивания назначают наркотические анальгетики.
Нитроглицерин или изосорбида динитрат применяют внутривенно по следующим показаниям: большой передний инфаркт миокарда, артериальная гипертензия, ХСН, продолжающаяся боль или усиление ишемии миокарда. При наличии показаний проводят фибринолитическую терапию или баллонную ангиопластику.
Лечение в первые сутки включает.
• Ограничение двигательной активности.
• Назначение гепарина натрия.
• В течение 24-48 ч проводят внутривенную инфузию нитроглицерина (если нет гипотензии и/или тахикардии, брадикардии).
• При отсутствии противопоказаний внутривенно назначают β-адреноблокаторы, под контролем АД и ЧСС с последующим переходом на приём внутрь. Эти ЛС способны уменьшать зону инфаркта, снижать вероятность появления аритмий и увеличивать выживаемость больных. Противопоказания к введению β-адреноблокаторов: ЧСС менее 50, систолическое АД менее 100 мм рт.ст., атриовентрикулярная блокада, отёк лёгких, бронхоспазм.
• Всем больным (при отсутствии гипотензии) должны быть назначены ингибиторы АПФ.
• При наличии гипотензии или шока назначают ЛС с положительным инотропным действием.
Больной с перенесённым инфарктом миокарда до выписки из стационара должен получать ацетилсалициловую кислоту , β-адреноблокатор, ингибиторы АПФ.
Выбор лекарственных средств при нестабильной стенокардии
Зависит от тяжести состояния и наличия факторов риска развития инфаркта миокарда. Лечение нестабильной стенокардии проводят в условиях стационара. Быстродействующие формы нитратов назначают под язык, в аэрозолях, внутривенно. Ангинозные боли, не купируемые в течение 20 мин, - показание для внутривенного введения наркотических анальгетиков. При отсутствии противопоказаний назначают β-адреноблокаторы. Важно быстро достичь устранения избыточной
симпатической активации, поэтому в случае высокого риска развития инфаркта миокарда при возможности β-адреноблокаторы вводят внутривенно. Затем переходят на приём поддерживающих доз внутрь. Если риск не столь высок, терапия β-адреноблокаторами сразу начинается с приёма внутрь. Ацетилсалициловую кислоту лучше применять в комбинации с гепарином натрия под контролем протромбинового времени и частичного тромбопластинового времени.
Дополнительное назначение блокаторов медленных кальциевых каналов ограничено и показано пациентам при ишемии, рефрактерной к лечению β-адреноблокаторами, больным с вариантной стенокардией и артериальной гипертензией.
Проведение тромболитической терапии не показано пациентам без острого подъёма сегмента ST.
Переход к неинтенсивной медикаментозной терапии осуществляют при условии:
• гемодинамика стабильна в течение 24 ч;
• ишемия не рецидивирует на протяжении не менее 24 ч.
Переход к неинтенсивной фазе ведения начинают с замены внутривенной инфузии нитратов на лекарственные формы, принимаемые внутрь или наносимые на кожу и слизистые.
При стабилизации состояния больного проводят перфузионную сцинтиграфию или тесты с физической нагрузкой (тредмил). Если эти исследования не выявляют нарушения перфузии миокарда, назначают медикаментозную терапию, а при наличии симптомов ишемии показана ангиография с последующим решением вопроса о проведении аортокоронарного шунтирования или баллонной ангиопластики.
Выбор лекарственных средств при хронической сердечной недостаточности
Современный подход к терапии ХСН предполагает как можно более раннее начало лечения. Только применяя ЛС до того, как сформировались тяжёлые и необратимые изменения структуры сердечной мышцы, можно предотвратить прогрессирование процесса. Поэтому в современных руководствах по клинической практике выделяют группу больных, у которых ХСН отсутствует, но имеются факторы риска её развития: артериальная гипертония, ИБС, сахарный диабет, наследственные факторы (кардиомиопатия у близких родственников). Другая группа, у которой необходимо проводить вторичную профилактику ХСН, - больные со снижением насосной функции сердца при отсутствии клинических признаков заболевания. Больные из этих групп должны получать ингибиторы АПФ и β-адреноблокаторы, то есть ЛС, у которых имеется доказанное профилактическое действие по отноше-
нию к ХСН. Кроме того, все больные ХСН должны получать адекватное лечение своего основного заболевания. Основные цели терапии ХСН:
• уменьшение смертности больных;
• уменьшение числа и тяжести эпизодов декомпенсации ХСН;
• уменьшение выраженности симптомов заболевания (уменьшение функционального класса ХСН).
В настоящее время существуют по крайней мере три группы ЛС, применение которых позволяет вплотную приблизиться к выполнению этих целей (ингибиторы АПФ, β-адреноблокаторы и спиронолактон), однако проблема лечения ХСН ещё очень далека от своего разрешения. Ещё ряд ЛС способен воздействовать на течение заболевания. Это дигоксин, при применении которого уменьшается функциональный класс ХСН и частота декомпенсаций, но, по-видимому, не происходит увеличения продолжительности жизни больных; нитраты обладают положительным влиянием на симптомы ХСН, частоту декомпенсаций и продолжительность жизни больных, однако по всем этим параметрам значительно уступают ингибиторам АПФ и β-адреноблокаторам. Роль блокаторов рецепторов ангиотензина II и амлодипина - ещё более скромная.
Анализ эффективности различных ЛС при длительном применении показывает, что максимальной эффективностью для лечения ХСН обладают β-адреноблокаторы, спиронолактон и ингибиторы АПФ (табл. 12-39), причём одновременное назначение этих ЛС приводит к общему снижению смертности в 1,5-2 раза больше, чем при назначении этих препаратов по отдельности. Отсюда вытекает необходимость назначения больному сразу нескольких (как минимум двух) ЛС. Объ- ём лечения должен отвечать тяжести течения ХСН и выраженности симптомов (табл. 12-40, 12-41). Вместе с тем при лечении ХСН следует отказаться от применения малоэффективных ЛС (вазодилататоры, нитраты) и препаратов с отрицательным инотропным эффектом.
Таблица 12-39. Выбор лекарственных средств в зависимости от функционального класса хронической сердечной недостаточности
 Окончание табл. 12-39
Окончание табл. 12-39
 Таблица 12-40. Лекарственные
средства, эффективность которых у больных хронической сердечной
недостаточностью доказана в ходе клинических исследований
Таблица 12-40. Лекарственные
средства, эффективность которых у больных хронической сердечной
недостаточностью доказана в ходе клинических исследований
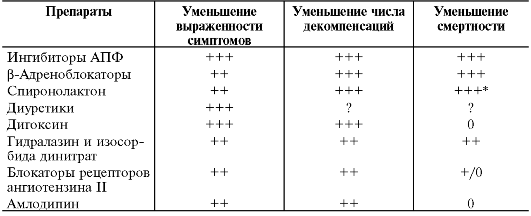 * Только при III-IV функциональном классе ХСН по NYHA.
* Только при III-IV функциональном классе ХСН по NYHA.
Таблица 12-41. Стартовая и целевая доза препаратов с доказанной при хронической сердечной недостаточности эффективностью
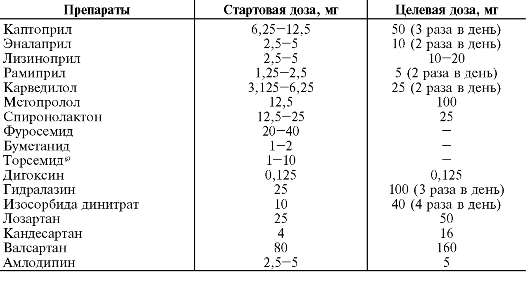 Терапия
больных с декомпенсацией ХСН включает применение высоких доз петлевых
диуретиков, а при необходимости - терапию гидралазином и препаратами с
положительным инотропным действием (допамин) . Подобное лечение следует
проводить в условиях стационара, а при наличии отёка лёгких и гипотонии -
в условиях отделения интенсивной терапии. Больным с декомпенсацией ХСН
не следует вновь назначать β-адреноблокаторы (если они не получали их
раньше), назначение в этой ситуации ингибиторов АПФ также требует
осторожности и предварительной отмены диуретиков.
Терапия
больных с декомпенсацией ХСН включает применение высоких доз петлевых
диуретиков, а при необходимости - терапию гидралазином и препаратами с
положительным инотропным действием (допамин) . Подобное лечение следует
проводить в условиях стационара, а при наличии отёка лёгких и гипотонии -
в условиях отделения интенсивной терапии. Больным с декомпенсацией ХСН
не следует вновь назначать β-адреноблокаторы (если они не получали их
раньше), назначение в этой ситуации ингибиторов АПФ также требует
осторожности и предварительной отмены диуретиков.
Выбор лекарственных средств при отёке лёгких
Отёк лёгких (встречают также у больных с острой ишемией или инфарктом миокарда, аритмией и у больных с гипертоническим кризом), развивается при резком снижении насосной функции сердца. Пропотевание жидкости в лёгочные альвеолы возникает при увеличении давления в малом круге кровообращения и сопровождается дыхательной недостаточностью (снижение площади газообмена в альвеолах). Лечение проводят в условиях отделения интенсивной терапии. Лечебная тактика включает ингаляцию кислорода, лечение основного заболевания, приведшего к отёку лёгких. Всем больным показано назначение фуросемида внутривенно, морфина внутривенно и нитроглицерина.