Клиническая фармакология.: учебник для вузов / Под ред. В.Г. Кукеса.- 4-е издание., перераб. и доп., - 2009. - 1056 с.
|
|
|
|
ГЛАВА 24. ИММУНОМОДУЛЯТОРЫ
Иммунная система человека и высших животных выполняет важную функцию - сохранение постоянства внутренней среды организма путём распознавания и элиминации из организма чужеродных антигенов, как эндогенно возникающих (клетки, изменённые вирусами, ксенобиотиками, злокачественные клетки и др.), так и экзогенно проникающих (прежде всего микробы). Эту функцию иммунная система осуществляет с помощью факторов врождённого (нейтрофилы, моноциты/макрофаги, дендритные клетки, NK- и T-NK-лимфоци- ты) и приобретённого, или адаптивного (Т- и В-лимфоциты) иммунитета. При нарушении количества и функциональной активности клеток иммунной системы возникают заболевания иммунитета: иммунодефициты, аллергические, аутоиммунные и лимфопролиферативные процессы (последние не рассматриваются в данной главе). Их лечение осуществляют с помощью комплекса методов иммунотерапии, один из них - применение иммунотропных лекарственных препаратов.
Иммунотропные ЛС - препараты, лечебный эффект которых связан с преимущественным (или селективным) воздействием на иммунную систему человека. Различают три основные группы иммунотропных лекарственных препаратов: иммуномодуляторы, иммуностимуляторы и иммунодепрессанты.
Иммуномодуляторы - ЛС, в терапевтических дозах восстанавливающие функции иммунной системы (эффективную иммунную защиту). Следовательно, иммунологический эффект иммуномодуляторов зависит от исходного состояния иммунитета больного: они снижают повышенные и повышают сниженные показатели иммунитета.
Иммуностимуляторы - ЛС, преимущественно усиливающие иммунитет, доводя пониженные показатели до нормальных значений.
Иммунодепрессанты - ЛС, подавляющие иммунный ответ. В данной главе рассмотрены только те ЛС, которые обладают способностью восстанавливать иммунитет (иммуномодуляторы и иммуностимуляторы), приведены их классификации, механизмы фармакологического действия и принципы клинического применения.
24.1. КЛАССИФИКАЦИЯ ИММУНОМОДУЛЯТОРОВ
По происхождению выделяют семь групп лекарственных препаратов, обладающих иммуномодулирующими свойствами (табл. 24-1). В известной степени эта классификация базируется на основных принципах функционирования иммунной системы. Главными активаторами врождён- ного и индукторами приобретённого иммунитета в организме человека и высших животных служат антигены микробных клеток, с которых и начались поиски, изучение и создание иммунотропных препаратов (экзогенные препараты). Формирование иммунного ответа происходит под контролем ряда иммунорегуляторных молекул. Именно поэтому другим направлением в разработке иммунотропных лекарственных препаратов послужили поиск, выделение и изучение комплекса тех веществ и молекул, которые синтезируются в организме при развитии иммунного ответа и осуществляют его регуляцию (эндогенные препараты).
Таблица 24-1. Классификация иммуномодуляторов по происхождению
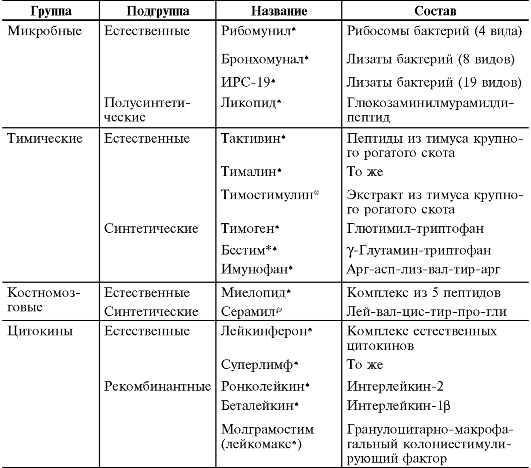 Окончание табл. 24-1
Окончание табл. 24-1
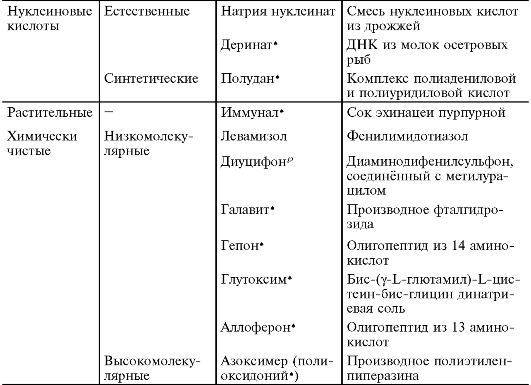 * Препараты, прошедшие 2-ю фазу клинических испытаний.
* Препараты, прошедшие 2-ю фазу клинических испытаний.
24.2. ХАРАКТЕРИСТИКА ОТДЕЛЬНЫХ ГРУПП
ИММУНОМОДУЛЯТОРОВ
Иммуномодуляторы микробного происхождения
Иммуномодуляторы микробного происхождения условно можно разделить на три поколения. Первым препаратом, разрешённым в начале 50-х годов в США и странах Европы для медицинского применения в качестве иммуностимулятора, была вакцина БЦЖ, обладающая выраженной способностью усиливать факторы как врождённого, так и приобретённого иммунитета. В то время главной задачей в применении БЦЖ как иммуностимулятора были активация противоопухолевого иммунитета и лечение злокачественных заболеваний. Решить эту задачу не удалось, исключение - рак мочевого пузыря, при котором внутрипузырное введение БЦЖ даёт выраженный клинический эффект. К микробным препаратам I поколения можно также отнести такие ЛС, как пирогенал* и продигиозан* (полисахариды бактериаль-
ного происхождения). Они довольно широко применялись в клинической практике для стимуляции противобактериального иммунитета. В настоящее время пирогенал* и продигиозан* из-за их высокой пирогенности и других побочных эффектов применяют редко.
Микробные препараты II поколения включают лизаты (бронхому- нал*, бронхо-Ваксом*, ИРС-19*, имудон*) и рибосомы (рибомунил*) бактерий, относящихся в основном к возбудителям респираторных инфекций: Klebsiella pneumoniae, Streptococcus pneumoniae, Streptococcus pyogenes, Haemophilus influezae и др. Эти препараты имеют двойное назначение: специфическое (вакцинирующее) и неспецифическое (иммуностимулирующее). Для усиления иммуностимулирующего эффекта одним из компонентов рибомунила* служит пептидогликан клеточной стенки Klebsiella pneumoniae. Применение экстрактов бактерий и грибов в качестве иммуностимуляторов разрешено в ряде стран Западной Европы и в Японии, например пицибанил - экстракт Streptococcus pyogenes, биостим* - экстракт из Klebsiella pneumoniae, крестин* и лентинан* - полисахариды грибов.
При изучении различных клеточных компонентов БЦЖ было установлено, что наибольшим иммуностимулирующим эффектом обладает мурамил дипептид - минимальный компонент пептидогликана клеточной стенки бактерий. В силу высокой пирогенности мурамил дипептид не нашёл применения в клинике. Однако в России и за рубежом были синтезированы его аналоги, сохраняющие иммуностимулирующие свойства, но не обладающие пирогенной активностью. Таким является ликопид*, который можно отнести к микробным препаратам III поколения. Он состоит из естественного дисахарида - глюкозаминилмурамила и присоединённого к нему синтетического дипептида - L-аланил-D-изоглютамина. Эти структуры входят в состав пептидогликана всех известных грамположительных и грамотрицательных бактерий. Препараты мурамилпептидного ряда разрабатываются и в ряде зарубежных стран. В Японии разрешён к медицинскому применению ромуртид* , представляющий собой мурамил дипептид, к которому через аминокислоту лизин присоединена стеариновая кислота. Основное назначение ромуртида* - восстановление лейкопоэза и иммунитета после радио- и химиотерапии у онкологических больных.
Тимические препараты
Как известно, к центральным органам иммунитета относят тимус и костный мозг, регулирующие развитие клеточного и гуморального иммунного ответа соответственно. Группа российских учёных под руководством академика Р.В. Петрова использовала эти органы для выделения иммунорегуляторных пептидов с целью создания лекар-
ственных препаратов, восстанавливающих клеточный и гуморальный иммунитет. Толчком к их созданию стало открытие нового класса биологически активных соединений - пептидных гормонов тимуса, к которым относят семейство тимозинов, тимопоэтинов и сывороточный тимический фактор - тимулин. Эти пептиды при поступлении в кровь оказывают влияние на всю периферическую иммунную систему, стимулируя рост и пролиферацию лимфоидных клеток.
Родоначальник тимических препаратов I поколения в России - тактивин* (комплекс пептидов, экстрагированных из тимуса крупного рогатого скота). К препаратам, содержащим комплекс тимических пептидов, относят также тималин*, тимоптин* и другие, а к препаратам, содержащим экстракты тимуса, - тимостимулин®, вилозен*. Преимущество тактивина* - присутствие в нём тимического гормона - α1-тимозина. Иммуномодуляторы - пептидные экстракты из тимуса: тимостимулин®, тимомодулин*, тим-уровак* - разрешены к медицинскому применению в ряде стран Западной Европы.
Клиническая эффективность тимических препаратов I поколения не вызывает сомнений, но у них есть один недостаток: они представляют собой неразделённую смесь биологически активных пептидов и их достаточно трудно стандартизовать. Прогресс в области ЛС тимического происхождения шёл по линии создания препаратов II и III поколений - синтетических аналогов естественных гормонов тимуса: α1-тимозина и тимопоэтина или фрагментов этих гормонов, обладающих биологической активностью. Последнее направление оказалось наиболее продуктивным, особенно в отношении тимопоэтина. На основе одного из фрагментов, включающего аминокислотные остатки активного центра тимопоэтина, создан препарат тимопентин* . Имму- нофан* - синтетический гексапептид - аналог участка 32-36 тимопоэтина.
Другим направлением в создании синтетических тимических препаратов послужил анализ активных начал комплекса пептидов и экстрактов из тимуса. Так, при изучении состава лекарственного препарата тималина* был выявлен дипептид, состоящий из триптофана и глутамина. Этот дипептид обладал выраженной иммунотропной активностью и стал основой для создания препарата - тимогена* L-глутамил-L-триптофан). Синтетический препарат, напоминающий тимоген*, - бестим* состоит из таких же аминокислот. Отличие бестима* от тимогена* заключено в наличии у первого γ-пептидной связи и присутствии не L-, а D-глутамина. Эти изменения привели к увеличению удельной биологической активности бестима* в тесте стимуляции дифференцировки костномозговых предшественников лимфоцитов.
Препараты костномозгового происхождения (миелопептиды)
Родоначальник препаратов костномозгового происхождения - миелопид* (комплекс биорегуляторных пептидных медиаторов - миелопептидов - с молекулярной массой 500-3000 D, продуцируемых клетками костного мозга свиней). В настоящее время установлено, что в его состав входит 6 миелопептидов, каждый из которых обладает опредёленным биологическим эффектом. Первоначально предполагалось, что препараты из костного мозга преимущественно будут воздействовать на гуморальный иммунитет. В дальнейшем было установлено, что различные миелопептиды оказывают эффект на разные звенья иммунной системы. Так, миелопептид-1 повышает функциональную активность Т-хелперов, миелопептид-2 подавляет пролиферацию злокачественных клеток и существенно снижает способность опухолевых клеток к продукции токсичных субстанций, миелопептид-3 стимулирует фагоцитарную активность лейкоцитов, миелопептид-4 оказывает влияние на дифференцировку стволовых клеток, способствуя их более быстрому созреванию. Аминокислотный состав миелопептидов полностью расшифрован, что послужило базой для разработки новых синтетических препаратов костномозгового происхождения. Созданы препарат серамил* на основе миелопептида-3 с антибактериальным эффектом и препарат бивален* на основе миелопептида-2 с противоопухолевым эффектом.
Препараты цитокинов
Цитокины - сложный комплекс эндогенных иммунорегуляторных молекул - регулируют развитие иммунного ответа. Они служат основой для создания большого числа как естественных, так и рекомбинантных иммуномодулирующих препаратов. К первой группе относят лейкинферон* и суперлимф*, ко второй - беталейкин*, ронколейкин*, молграмостим. Лейкинферон* - комплекс цитокинов 1-й фазы иммунного ответа в их естественном соотношении, который получают in vitro при индукции лейкомассы здоровых доноров вакцинным штаммом вируса болезни Ньюкастла. Препарат содержит ИЛ-1, ИЛ-6, ИЛ-8, фактор ингибиции макрофагов, фактор некроза опухоли α, комплекс интерферонов α. Суперлимф* также представляет собой комплекс естественных цитокинов, продуцируемых in vitro при индукции мононуклеаров периферической крови свиней Т-митогеном - фитогемагглютинином. Препарат содержит ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-8, ФНО-α, MIF, трансформирующий фактор роста β. Суперлимф* предназначен прежде всего для местного применения и выступает в качестве практически первого цитокинового препарата для локальной иммунокоррекции. Ронколейкин* - лекарственная форма
рекомбинантного ИЛ-2, одного из центральных регуляторных цитокинов иммунной системы человека. Препарат получают с помощью методов иммунной биотехнологии из клеток-продуцентов - рекомбинантного штамма непатогенных пекарских дрожжей, в генетический аппарат которых встроен ген человеческого ИЛ-2. Беталейкин* - лекарственная форма рекомбинантного ИЛ-1 β, играющего важную роль в активации факторов врождённого иммунитета, развитии воспаления и первых этапах иммунного ответа. Препарат получают с помощью методов иммунной биотехнологии из клеток-продуцентов - рекомбинантного штамма кишечной палочки, в генетический аппарат которых встроен ген человеческого ИЛ-1 β.
Препараты нуклеиновых кислот
Для активации деятельности клеток костного мозга и стимуляции лейкопоэза был разрешён к медицинскому применению нуклеинат натрия (натриевая соль нуклеиновой кислоты, полученная из дрожжей путём гидролиза и дальнейшей очистки). Препарат содержит большое количество предшественников нуклеиновых кислот и способствует росту и размножению практически всех делящихся клеток. В дальнейшем было выявлено, что нуклеинат натрия обладает способностью стимулировать факторы как врождённого, так и приобретённого иммунитета. Это вполне естественно, так как развитие иммунного ответа связано с активной пролиферацией Т- и В-лимфоцитов. Это первый препарат в своей группе, получивший разрешение на медицинское применение не только как стимулятор лейкопоэза, но и как стимулятор иммунитета. К препаратам данного ряда относят деринат* (натриевая соль нативной ДНК, выделенной из молок осетровых рыб), полудан* (высокоочищенная смесь натриевых солей ДНК и РНК, также получаемых из молок осетровых рыб), ридостин* (РНК, выделенная из пекарских дрожжей). На основе нуклеиновых кислот разработан ряд синтетических препаратов, например полудан* - комплекс полиаденил-уридиловой кислоты. Условно к данной группе препаратов можно отнести инозин пранобекс (изопринозин*) - комплекс инозина с ацетиламидобензойной кислотой, метилурацил* и инозин (рибоксин*) - комплексное соединение, состоящее из гипоксантин-рибозида. За рубежом некоторые синтетические препараты нуклеиновых кислот: упоминавшийся ранее инозин пранобекс и поли-АУ* (двуспиральный полинуклеотид из адениловой и уридиловой кислот) - разрешены для медицинского применения в качестве иммуностимуляторов. Все препараты из группы нуклеиновых кислот - выраженные индукторы интерферона. Однако следует иметь в виду, что синтетические и естественные препараты нуклеиновых кислот, содержащие предшест-
венники ДНК и РНК, индуцируют рост и размножение и эукариотических, и прокариотических клеток. Так, для натрия нуклеината показана возможность стимуляции роста и размножения бактерий.
Препараты растительного происхождения
В настоящее время за рубежом весьма широко для стимуляции иммунитета используют препараты растительного происхождения, в частности различные производные эхинацеи пурпурной. Некоторые из этих препаратов: иммунал*, эхинацин ликвидум*, эхинацея композитум С, эхинацея-ВИЛАР* - зарегистрированы в России как иммуностимуляторы. Мы полагаем, что препараты подобного рода более целесообразно относить к пищевым добавкам или адаптогенам типа женьшеня, элеутерококка, пантокрина* и др. Все эти соединения в той или иной степени обладают иммуностимулирующим эффектом, но вряд ли их можно отнести к ЛС, обладающим селективным действием на иммунную систему человека.
Химически чистые иммуномодуляторы
Группу химически чистых иммуномодуляторов можно подразделить на две подгруппы - низкомолекулярные и высокомолекулярные. К первым относят ряд известных ЛС, дополнительно обладающих и иммунотропной активностью. Родоначальник таких препаратов - левамизол (декарис*) - фенилимидотиазол, известное противоглистное средство, у которого в последующем были выявлены выраженные иммуностимулирующие свойства. Левамизол, также как и БЦЖ, - одно из первых ЛС, разрешённых к медицинскому применению в США и странах Западной Европы в качестве иммуностимулятора. Близкий по химической структуре к левамизолу дибазол* (производное имидазола) обладает некоторыми иммуностимулирующими свойствами. Это, по всей видимости, служит основанием для некоторых исследователей рекомендовать дибазол* в качестве профилактического средства при гриппе и других респираторных инфекциях. Однако профилактическое применение данного препарата не обосновано, так как не было проведено плацебо-контролируемых исследований по изучению его способности уменьшать развитие респираторных инфекций. Интересный препарат из данной подгруппы - диуцифон* , первоначально создававшийся как противотуберкулёзное средство. Основа этого препарата - производные сульфоновой кислоты, обладающие выраженными антимикобактериальными свойствами. Присоединение к этой кислоте метилурацила не понизило её антибактериального эффекта, но привело к появлению у препарата иммуностимулирующей активности. Создание ЛС, сочетающих антимикробные и иммуностимули-
рующие свойства, - очень перспективное направление в учении об иммуномодуляторах. Некоторые антибиотики последнего поколения: спирамицин (ровамицин*), рокситромицин (рулид*) и др. - обладают способностью стимулировать фагоцитоз и индуцировать синтез некоторых цитокинов. Другое перспективное ЛС из подгруппы низкомолекулярных иммуномодуляторов - галавит* (производное фталгидразида). Особенность этого препарата - наличие, помимо иммуномодулирующих, выраженных противовоспалительных свойств. К данной подгруппе относят также три синтетических олигопептида: гепон*, глутоксим* и аллоферон*. Гепон* - олигопептид, состоящий из 14 аминокислот: Thr-Glu-Lys-Lys-Arg-Arg-Glu-Thr-Val-Glu-Arg-Glu-LysGlu. Его особенность - наличие, помимо иммуномодулирующих, выраженных противовирусных свойств.
К высокомолекулярным химически чистым иммуномодуляторам, полученным с помощью направленного химического синтеза, относят полиоксидоний*. Это N-оксидированное производное полиэтиленпиперазина с молекулярной массой около 100 kD. По химическому строению полиоксидоний* близок к веществам природного происхождения. N-оксидные группировки, служащие основой препарата, широко встречаются в организме человека, поскольку через образование N-оксидов происходит метаболизм азотистых соединений. Препарат обладает широким спектром фармакологического воздействия на организм: иммуномодулирующим, детоксицирующим, антиоксидантным и мембранопротекторным.
Интерфероны и индукторы интерферонов
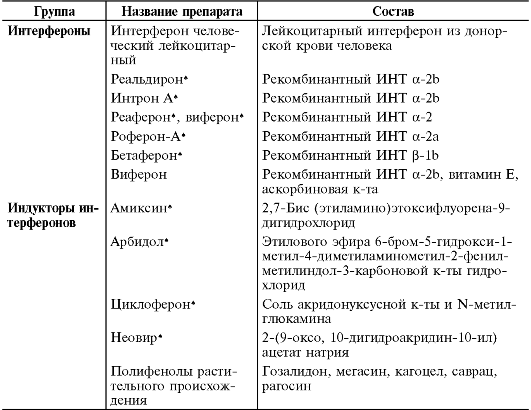
К ЛС, обладающим выраженными иммуномодулирующими свойствами, без сомнения, следует отнести интерфероны и индукторы интерферонов (табл. 24-2). Мы сочли возможным выделить эти препараты в отдельный раздел, так как их основное фармакологическое свойство - противовирусный эффект. Однако интерфероны, как составная часть общей цитокиновой сети организма, выступают в качестве иммунорегуляторных молекул, оказывающих действие на все клетки иммунной системы. Например, интерферон α и ФНО, синтезируемые на первых этапах иммунного ответа, - мощные активаторы NK-клеток, служащих, в свою очередь, главным источником продукции γ-интерферона задолго до начала его синтеза Т-лимфоцитами. Можно привести и много других примеров иммуномодулирующего действия интерферонов, поэтому все они и их индукторы являются противовирусными и иммуномодулирующими препаратами. Как отмечалось выше, также активными индукторами интерферонов служат нуклеиновые кислоты и их различные производные, особенно полудан* и ридостин*.
Таблица 24-2. Интерфероны и индукторы интерферонов
 Иммуноглобулины
Иммуноглобулины
К ЛС, обладающим иммуномодулирующими свойствами, относят препараты иммуноглобулинов: иммуноглобулин человеческий, интраглобин*, октагам*, пентаглобин*, сандоглобулин* и др. Однако их главное действие - заместительная терапия, поэтому они входят в группу жизненно необходимых ЛС.
24.3. ФАРМАКОЛОГИЧЕСКОЕ ДЕЙСТВИЕ ИММУНОМОДУЛЯТОРОВ
При анализе фармакологического действия иммуномодуляторов необходимо учитывать особенность функционирования иммунной системы, заключающуюся в том, что она «работает» по системе сообщающихся весов, т.е. наличие груза на одной из чашек приводит в движение всю систему [Петров Р.В., 1987]. Именно поэтому вне зависимости от исходной направленности под влиянием иммуномодулятора в той или иной степени изменяется функциональная активность
всей иммунной системы в целом. Иммуномодулятор может обладать избирательным эффектом на соответствующий компонент иммунитета, но конечный эффект его воздействия на иммунную систему всегда будет многогранным. Например, вещество Х индуцирует образование только одного ИЛ-2, но этот цитокин усиливает пролиферацию Т-, В- и NK-клеток, повышает функциональную активность макрофагов, NK-клеток, Т-киллеров и т.д. ИЛ-2 - не исключение в этом плане. Все цитокины - главные регуляторы иммунитета, опосредующие влияние на иммунную систему как специфических, так и неспецифических стимулов, - обладают множественными и разнообразными эффектами в отношении иммунной системы. В настоящее время не выявлено цитокинов со строго специфическим действием. Такие особенности функционирования иммунной системы делают практически невозможным существование иммуномодулятора с абсолютно селективным конечным эффектом на иммунитет. Это положение позволяет сформулировать следующий принцип.
Любой иммуномодулятор, избирательно действующий на соответствующий компонент иммунитета (фагоцитоз, клеточный или гуморальный иммунитет), помимо эффекта на этот компонент, будет в той или иной степени оказывать воздействие и на все другие компоненты иммунной системы.
Учитывая данное положение, тем не менее можно выделить ведущие направления фармакологического действия основных иммуномодуляторов, относимых в соответствии с представленной классификацией к различным группам.
Фармакологическое действие иммуномодуляторов микробного происхождения
Главная мишень в организме для иммуномодуляторов микробного происхождения - фагоцитарные клетки. Под их влиянием происходит усиление функциональных свойств фагоцитов: повышается фагоцитоз и внутриклеточная гибель поглощённых бактерий; продукция провоспалительных цитокинов, необходимых для инициации гуморального и клеточного иммунитета. Следствием этого могут быть усиление продукции антител, активация образования антигенспецифических Т-хелперов и Т-киллеров. Наиболее полно изучено фармакологическое действие на иммунитет полусинтетического иммуномодулятора ликопида*, минимального компонента клеточной стенки всех бактерий.
Главной мишенью ликопида* в организме выступают клетки моноцитарно-макрофагального ряда. Он усиливает практически все функции клеток этой системы:
• поглощение и гибель микроорганизмов за счёт активации лизосомальных ферментов и образования активных форм кислорода;
• гибель чужеродных клеток (опухолевых и вирусинфицированных);
• экспрессию HLA-DR-антигенов, вследствие чего происходит усиление презентации антигенов клеткам иммунной системы;
• синтез цитокинов (ИЛ-1, колониестимулирующих факторов).
Именно поэтому ликопид* обладает антиинфекционным, противовоспалительным, репарационным, лейкопоэтическим, противоопухолевым (в эксперименте), детоксицирующим и гепатопротекторным действием.
Фармакологическое действие мммуномодуляторов тимического происхождения
Главная мишень в организме для иммуномодуляторов тимического происхождения - Т-лимфоциты. При исходно пониженных показателях препараты этого ряда повышают количество Т-клеток и их функциональную активность.
Фармакологическое действие синтетического тимусного дипептида, тимогена*, заключается в увеличении уровня циклических нуклеотидов по аналогии с эффектом тимусного гормона тимопоэтина, что ведёт к стимуляции дифференцировки и пролиферации предшественников Т-клеток в зрелые лимфоциты. При этом происходят нормализация иммунорегуляторного индекса (соотношения CD4/CD8), повышение способности Т-лимфоцитов давать пролиферативный ответ на Т-митогены и увеличение продукции соответствующих цитокинов. Следствие этого - усиление функциональной активности факторов врождённого иммунитета: нейтрофилов, моноцитов/макрофагов и NK-клеток. В частности, возрастает способность моноцитов и нейтрофилов захватывать бактерии и образовывать активные формы кислорода. Механизм действия сходного по химическому строению с тимогеном* синтетического пептидного иммуномодулятора, бестима*, заключается в индукции дифференцировки предшественников Т-лимфоцитов с преимущественной стимуляцией образования Тh1-клеток и усилением их пролиферации. Это, по всей видимости, связано с индукцией бестимом* образования ИЛ-2 и интерферона γ - индикаторных цитокинов Тh1-клеток.
Фармакологическое действие синтетического иммуномодулятора тимического происхождения - имунофана* заключено в:
• восстановлении продукции тимического гормона - тимулина - у тимэктомированных мышей до значений, характерных для нормальных животных;
• усилении в опытах in vivo и in vitro продукции ИЛ-2 лимфоцитами, стимулированными Т-митогенами;
• иммуномодулирующем действии на продукцию провоспалительного цитокина - ФНО: повышении сниженного и снижении повышенного его образования;
• стимуляции in vitro образования IgG, IgA, IgM, причём стимуляция синтеза IgA происходит в культуре лимфоцитов, полученных от больных с селективным IgA-дефицитом;
• повышении поглощения и гибели захваченных бактерий лейкоцитами;
• угнетении in vitro образования IgE в культурах лимфоцитов, полученных из периферической крови больных с аллергиями;
• адъювантном эффекте, что проявляется в повышении иммуногенности вакцин против клещевого энцефалита и гепатита А.
Помимо иммунологических эффектов, важное свойство имунофана* - способность усиливать антиоксидантную защиту организма путём стимуляции синтеза церулоплазмина и лактоферрина и повышения активности каталазы. Он нормализует перекисное окисление липидов, подавляет распад фосфолипидов в мембране клеток и образование арахидоновой кислоты. При этом происходит снижение продукции медиаторов воспаления.
Фармакологическое действие иммуномодуляторов костномозгового происхождения
Фармакологическое действие на организм иммуномодулятора костномозгового происхождения, миелопида*, многогранно. В соответствии с названием его мишенью в организме служат В-лимфоциты. При нарушении иммуноили гемопоэза введение миелопида* ведёт к усилению общей митотической активности клеток костного мозга и направлению их дифференцировки в сторону зрелых В- лимфоцитов. Происходят усиление экспрессии пан-В-клеточных антигенов, HLA-DR-антигенов, снижение экспрессии ранних В- клеточных маркёров (Sc-1-антигена). Благодаря наличию в составе препарата компонента МП-1, действующего на Т-хелперы, также происходит усиление дифференцировки костномозговых клеток в сторону зрелых Т-лимфоцитов. Компонент МП-3, входящий в состав миелопида*, оказывает воздействие на фагоцитоз, вследствие чего усиливается гранулоцитопоэз и повышается функциональная активность фагоцитарных клеток. Таким образом, введение миелопида* даёт повышение количества Т-, В-клеток и фагоцитов в периферической крови. Увеличение их функциональной активности проявляется в способности миелопида* стимулировать гуморальный иммунный ответ, существенно повышая уровень антител. Важно отметить, что введение препарата восстанавливает антителообразова-
ние у животных, подвергнутых облучению, воздействию цитостатиков и антибиотиков.
Фармакологическое действие препаратов цитокинов
Для препаратов цитокинов естественного происхождения: лейкинферона* и суперлимфа*, содержащих довольно большой набор цитокинов воспаления и 1-й фазы иммунного ответа, - характерны многогранные эффекты. Эти препараты действуют на клетки, участвующие в воспалении, процессах регенерации и в иммунном ответе.
Фармакологический эффект суперлимфа* заключён в преимущественном воздействии на клетки-эффекторы врождённого иммунитета: нейтрофилы, моноциты/макрофаги и NK-клетки, что, возможно, обусловлено его способностью повышать уровень внутриклеточного кальция - одного из главных медиаторов активации клеток. Препарат регулирует миграцию фагоцитов в воспалительный очаг, усиливает поглощение лейкоцитами бактерий и их внутриклеточную гибель, повышает цитотоксические свойства макрофагов, оказывая тем самым в эксперименте противоопухолевый эффект. Усиливая продукцию мо- ноцитами/макрофагами ИЛ-1 и фактора некроза опухоли, суперлимф* активирует механизмы как клеточного, так и гуморального иммунитета. По всей видимости, препарат содержит ростовые факторы для фибробластов, так как он регулирует синтез коллагена и пролиферативную активность фибробластов кожи и пародонта. За счёт этих свойств он стимулирует регенерацию и предупреждает образование грубых рубцов. Суперлимф* обладает также антиоксидантной активностью. Недавно было установлено наличие у препарата прямых противовирусных и антибактериальных свойств, что, возможно, связано с действием входящих в его состав дефензинов, кателицидинов и других бактерицидных веществ первичных и вторичных гранул лейкоцитов, выделяемых при культивировании лейкоцитов in vitro.
Отечественные рекомбинантные цитокиновые препараты: беталейкин* и ронколейкин*, содержащие в своём составе только один цитокин, - так же, как и комплексные по цитокиновому составу естественные препараты (лейкинферон* и суперлимф*), обладают плейотропным воздействием на организм человека. Это ещё раз подтверждает принцип работы иммунной системы по типу сообщающихся весов.
Главное фармакологическое свойство беталейкина* - усиление лейкопоэза и восстановление костномозгового кроветворения после действия цитостатиков и рентгеновского облучения. Применение препарата позволяет в короткие сроки нормализовать число лейкоцитов периферической крови и проводить радио- и химиотерапию в соответствии с планируемыми сроками. Этот эффект беталейкина* обуслов-
лен его способностью стимулировать синтез колониестимулирующих факторов - главных индукторов лейкопоэза и стимуляторов иммунитета. Препарат обладает выраженным иммуностимулирующим эффектом, так как ИЛ-1β - активатор всех клеток врождённого иммунитета и в то же время инициатор развития первых фаз приобретённого иммунитета. Под его влиянием происходит усиление функциональной активности нейтрофилов (поглощение бактерий, их внутриклеточная гибель, образование активных форм кислорода). Происходит также активация и клеточного иммунитета: повышается продукция γ-интерферона, ИЛ-2, колониестимулирующих факторов и других цитокинов, усиливается экспрессия рецепторов ИЛ-2, увеличиваются пролиферация лимфоцитов и функциональная активность NK-клеток.
Главное фармакологическое свойство ронколейкина*, содержащего ИЛ-2 (основной фактор роста и дифференцировки Т- и NK- лимфоцитов), - активация и индукция пролиферации клеток-мишеней - Т-, В- и NK-клеток, содержащих рецептор CD25. На другие клетки иммунной системы ронколейкин* действует опосредованно, через цитокины, синтезируемые клетками-мишенями. В итоге это проявляется в:
• функциональной активации CD4 Т-хелперов, активно продуцирующих γ-интерферон;
• усилении цитотоксической активности CD8 Т-киллеров;
• дифференцировке in vitro NK- и опухольинфильтрирующих лимфоцитов в лимфокинактивированные клетки;
• усилении пролиферации В-лимфоцитов с последующей их дифференцировкой в плазматические клетки;
• усилении синтеза плазматическими клетками иммуноглобулинов большинства изотипов;
• повышении функциональной активности антигенпрезентирующих клеток, что проявляется в улучшении переработки и презентации антигенов;
• повышении функциональной активности моноцитов, что проявляется в кислородном взрыве;
• ускорении образования эозинофилов и тромбоцитов.
Фармакологическое действие нуклеиновых кислот
Как уже отмечалось выше, главное фармакологическое свойство нуклеиновых кислот - стимуляция лейкопоэза, процессов регенерации и репарации, функциональной активности практически всех клеток иммунной системы. Препараты этой группы стимулируют функциональную активность нейтрофилов и моноцитов/макрофагов, повышая их способность поглощать и вызывать гибель поглощённых бактерий, уве-
личивают антиинфекционную устойчивость к заражению патогенными микроорганизмами, вероятно, за счёт активации фагоцитоза, стимулируют функциональную активность Т-хелперов и Т-киллеров, усиливают пролиферацию В-лимфоцитов и синтез антител. Препараты нуклеиновых кислот обладают антиоксидантным эффектом, что проявляется в их способности удалять из организма свободные радикалы, благодаря чему препараты нуклеиновых кислот могут снижать повреждающее действие на организм радио- и химиотерапии.
Фармакологическое действие химически чистых иммуномодуляторов
В этом разделе представлены данные о фармакологической активности трёх отечественных иммуномодуляторов последнего поколения: галавите*, гепоне* и полиоксидонии*.
Низкомолекулярный иммуномодулятор галавит* обладает иммуномодулирующим и противовоспалительным эффектами, что связано с воздействием на функциональную активность макрофагов. При гиперактивации этих клеток галавит* обратимо ингибирует продукцию ими провоспалительных цитокинов (фактор некроза опухоли и ИЛ-1) и активных форм кислорода. Происходят нормализация функционального состояния макрофагов, восстановление нормальной продукции цитокинов и антигенпрезентирующей функции. Галавит* стимулирует функциональную активность нейтрофилов, увеличивая поглощение и внутриклеточную гибель бактерий, вследствие чего повышается неспецифическая устойчивость организма к инфекциям. Галавит* не влияет на нормальный уровень цитотоксичности естественных киллеров. Однако при исходно низких значениях препарат восстанавливает цитотоксичность до нормы. Показана способность галавита* индуцировать продукцию ИЛ-2-подобного фактора, причём более интенсивно, чем конканавалин А. У мышей с генетически детерминированным высоким и низким гуморальным ответом на эритроциты барана данный препарат подавляет и стимулирует соответственно образование антител.
Главное фармакологическое свойство синтетического пептида гепона* заключено в иммуномодулирующем и противовирусном действии, что проявляется в:
• мобилизации и активации клеток моноцитарно-макрофагального ряда;
• повышении антиинфекционной резистентности организма к бактериям, грибам и вирусам;
• индукции синтеза интерферонов α и β;
• подавлении репликации вирусов в клетке;
• ингибировании продукции провоспалительных цитокинов: ИЛ-1,
ИЛ-6, ИЛ-8, ФНО;
• стимуляции синтеза антител к различным антигенам инфекционной природы.
Это фармакологическое действие гепона* особенно чётко выражено у ВИЧ-инфицированных больных, у которых препарат увеличивает в периферической крови содержание CD4 Т- и NK-лимфоцитов, повышает функциональную активность CD8 Т-киллеров, играющих важную роль в защите организма от вирусной инфекции, повышает уровень антител к ВИЧ и возбудителям оппортунистических инфекций. В результате этого происходит снижение уровня ВИЧ в крови больных.
Высокомолекулярный иммуномодулятор полиоксидоний* обладает широким спектром фармакологического воздействия на организм, включающего иммуномодулирующий, антиоксидантный, детоксицирующий и мембранопротекторный эффекты.
Иммуномодулирующий эффект полиоксидония* заключён в:
• повышении способности нейтрофилов поглощать и убивать по- глощённый Staphylococcus aureus, причём препарат повышает киллинг бактерий нейтрофилами периферической крови как здоровых доноров, так и больных с хронической гранулематозной болезнью;
• воздействии на продукцию провоспалительных цитокинов мононуклеарами периферической крови здоровых доноров, что проявляется в снижении повышенных и повышении сниженных уровней ИЛ-1, ИЛ-6, фактора некроза опухоли;
• усилении цитотоксической активности NK-клеток, особенно при их исходно сниженных уровнях;
• активации резидентных макрофагов ретикулоэндотелиальной системы, что ведёт к более быстрой элиминации из организма чужеродных частиц;
• повышении естественной резистентности организма к экспериментальным бактериальным и вирусным инфекциям;
• усилении антителообразования к Т-зависимым и Т-независимым антигенам как животного, так и микробного происхождения.
В эксперименте было показано, что полиоксидоний* активирует иммунные реакции у животных с тяжёлыми формами иммунодефицитов: в частности, усиливает антителообразование у:
• мышей с врождённой аплазией тимуса (мыши nude);
• мышей с искусственно созданным дефицитом Т-системы иммунитета (В-мыши);
• мышей с искусственно индуцированной введением циклофосфамида деструкцией В-системы иммунитета;
• старых мышей с возрастным иммунодефицитом.
Детоксицирующие свойства полиоксидония* проявляются в его способности снижать концентрацию токсичных веществ в крови, например уровень липополисахарида энтеробактерий у больных с ожоговой болезнью. У больных с острым панкреонекрозом данный препарат значительно снижает уровень малонового диальдегида и диеновых кислот. Детоксицирующие свойства полиоксидония* связаны с его высоким молекулярным весом и наличием на поверхности молекулы большого количества различных активных групп, поэтому он активно адсорбирует на своей поверхности циркулирующие в крови как растворимые токсичные субстанции, так и микрочастицы.
Антиоксидантные свойства полиоксидония* заключены в:
• перехвате в водной среде активных форм кислорода: супероксидного аниона, перекиси водорода, гидроксильного радикала;
• уменьшении концентрации каталитически активного двухвалентного железа, что ведёт к ингибиции перекисного окисления липидов;
• подавлении спонтанной и индуцированной люминол- и люцегенинзависимой хемилюминесценции.
Мембранопротекторные свойства полиоксидония* проявляются в защите клеток от повреждающего действия ряда токсичных веществ.
24.4. КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ ИММУНОМОДУЛЯТОРОВ
Выше отмечалось, что существуют три основные группы заболеваний иммунной системы: иммунодефициты, аллергические и аутоиммунные процессы. Рассмотрим вопрос, при каких заболеваниях целесообразно применение иммуномодуляторов.
Аллергические заболевания
При аллергических заболеваниях использование иммуномодуляторов целесообразно в тех случаях, когда они осложнены какимилибо проявлениями вторичной иммунологической недостаточности (например, атопический дерматит с пиодермией, бронхиальная астма с явлениями хронического гнойно-обструктивного бронхита, рецидивирующей герпетической или цитомегаловирусной инфекции и т.д.). Как видно из приведённых примеров, в этих случаях эффект иммуномодуляторов направлен на ликвидацию у больного с аллергическим процессом инфекционного очага. В ряде случаев это может существенно улучшить клиническую картину основного заболевания. Например, применение иммуномодулирующей терапии у больных бронхиальной астмой может удлинять продолжительность ремиссии до одного года. Однако во всех этих случаях иммуномодулирующая терапия не направлена на основную причину заболевания,
т.е. не является этиотропной. Как известно, при аллергических процессах происходит активация Тh2-лимфоцитов и повышена продукция цитокинов: ИЛ-4, ИЛ-5, ИЛ-13. ИЛ-5 способствует созреванию эозинофилов и их активации. ИЛ-4 и ИЛ-13 индуцируют В-клетки к синтезу IgE. Следовательно, с иммунологических позиций причиной аллергического процесса, если не главной, то очень существенной, служит повышенная активность Тh2-клеток. Отсюда очевидно, что одно из направлений в иммуномодулирующей терапии этих процессов - применение препаратов, снижающих активность Th2- и повышающих активность Тh1-клеток, т.е. иммуномодуляторов. Однако настоящее время не существует препаратов с доказанной селективной способностью изменять баланс Тh1/Тh2-лимфоцитов в указанном направлении и разрешённых к медицинскому применению при аллергических заболеваниях.
Аутоиммунные заболевания
При аутоиммунных заболеваниях в настоящее время довольно широко применяют иммунотропные препараты из группы иммунодепрессантов, подавляющих аутоиммунный воспалительный процесс. Их использование, как правило, даёт быстрый и хороший клинический эффект, тем не менее такое лечение, вероятно, нельзя считать этиотропным, так как оно направлено на симптоматику, а не на причину заболевания. Так, применение гормональных препаратов при рассеянном склерозе, являющемся Тh1-опосредованным заболеванием, даёт хороший клинический эффект, но не удлиняет продолжительность ремиссии - важный показатель эффективности терапии.
В основе этиопатогенеза многих аутоиммунных заболеваний, как и аллергических процессов, лежит дисбаланс Тh1/Тh2-лимфоцитов. При рассеянном склерозе, ревматоидном артрите, аутоиммунных тиреоидитах и некоторых других заболеваниях выявлена повышенная активность Th1-; при системной красной волчанке, аутоиммунных васкулитах, некоторых видах анемий - Тh2-клеток. Если учитывать эти данные, становится очевидно, что иммуномодулирующая терапия при аутоиммунных заболеваниях должна включать препараты, понижающие активность ТЫ- и повышающие активность Тh2-лимфоци- тов. Однако в настоящее время нет препаратов, разрешённых к медицинскому применению при данных заболеваниях и обладающих способностью изменять баланс Th1/Тh2-клеток в указанном направлении. Именно поэтому основание для применения иммуномодуляторов при аутоиммунных заболеваниях, как и при аллергии, - инфекционные процессы, осложняющие их течение.
Иммунодефициты
Повышенная инфекционная заболеваемость - главное проявление как первичных, так и вторичных иммунодефицитов. Возникает вопрос: целесообразно ли применение иммуномодулирующих препаратов при первичных иммунодефицитах, в основе которых лежит генетический дефект? Естественно, что с помощью их исправить генетический дефект практически невозможно. Однако антиинфекционная защита многокомпонентна, и можно ожидать, что при некотором повышении с помощью иммуномодуляторов функциональной активности нормально работающего компонента иммунной системы будет скомпенсирована, хотя бы частично, «плохая работа» дефектного компонента. Существенное улучшение клинического состояния и показателей иммунного статуса наблюдают у больных с пониженным уровнем всех классов иммуноглобулинов (общая вариабельная иммунологическая недостаточность) при лечении их иммуномодулирующими препаратами, активирующими фагоцитоз, в частности полиоксидонием*. Именно поэтому хорошо продуманное применение иммуномодулирующей терапии у больных с первичными иммунодефицитами может дать хороший клинический результат.
Главная мишень применения иммуномодулирующих препаратов - вторичные иммунодефициты, проявляющиеся в частых, рецидивирующих, трудно подающихся лечению инфекционно-воспалительных заболеваниях всех локализаций и различной этиологии. В основе любого хронического инфекционно-воспалительного процесса лежат те или иные изменения в иммунной системе, которые и выступают одной из причин существования этого процесса. Исследование параметров иммунной системы не всегда может выявить данные изменения. Именно поэтому при наличии в организме хронического инфекционно-воспалительного процесса можно назначать больному иммуномодулирующие препараты, даже в том случае, если иммунодиагностическое исследование не выявит существенных отклонений в иммунном статусе.
Как правило, при данных процессах в зависимости от вида возбудителя врач назначает антибиотики, противогрибковые, противовирусные средства или другие химиотерапевтические препараты. Мы считаем, что во всех случаях, когда показано применение противомикробных средств, при наличии явлений вторичной иммунологической недостаточности следует назначать и иммуномодулирующую терапию. При лечении таких процессов иммуномодуляторы применяют в основном в комплексе с этиотропными химиотерапевтическими средствами.
Таким образом, основным критерием при назначении иммуномодулятора служит клиническая картина заболевания, проявляющаяся в наличии хронического инфекционно-воспалительного процесса, трудно подающегося адекватному антимикробному лечению.
Хронические инфекции
Возникает вопрос, как применять иммуномодуляторы в комплексном лечении хронических инфекций. Их следует назначать не после и не перед приёмом антибиотиков или противовирусных препаратов, а одновременно с ними. В этом случае по возбудителю наносится «двойной» удар: антибиотик или другое химиотерапевтическое средство воздействует на микроорганизм, а иммуномодулятор повышает функциональную активность клеток иммунной системы, за счёт чего достигается более эффективная элиминация возбудителя из организма. Следует избегать «модного» утверждения о негативном действии антибиотиков на иммунную систему. В настоящее время на вооружении у врачей есть ряд антибиотиков, оказывающих не ингибирующее, а стимулирующее влияние на иммунитет. При прочих равных условиях врач должен отдавать предпочтение последним.
Острые бактериальные и вирусные инфекции
Отдельно стоит вопрос о применении иммуномодуляторов при острых бактериальных и вирусных инфекциях. Как правило, их не рекомендуют назначать при острых процессах, так как это повышает риск более тяжёлого течения заболевания. Например, при вирусной инфекции активация Т-киллеров может вызвать фатальный конец за счёт массивного разрушения тканей, инфицированных вирусом. Это, вероятно, необходимо иметь в виду при назначении тимических препаратов, а также препаратов бактериального происхождения - мощных индукторов провоспалительных цитокинов. Применение иммуномодуляторов при острых инфекционных процессах, особенно бронхолёгочного аппарата, может быть оправдано у иммунологически компрометированных людей, например, из группы часто и длительно болеющих. Иммуномодуляторы в этих случаях применяют, чтобы предупредить развитие постинфекционных осложнений. Наличие у полиоксидония* детоксицирующих и антиоксидантных свойств делает возможным его применение при острых инфекционных заболеваниях. Клиническая практика показывает эффективность и безопасность применения этого препарата при острых инфекциях. Мы полагаем, что не только полиоксидоний*, но и другие иммуномодуляторы с антиоксидантными и детоксицирующими свойствами можно применять при острых инфекционных процессах у иммунологически компрометированных людей.
Иммунореабилитация
Нередко возникает вопрос, можно ли проводить иммуномодуляцию в виде монотерапии. Р.В. Петров впервые сформулировал понятие
«иммунореабилитация», под которым понимают комплекс медикаментозных и немедикаментозных лечебных мероприятий, направленных на восстановление функциональной активности иммунной системы и здоровья человека. Мы полагаем, что при иммунореабилитационных мероприятиях иммуномодуляторы можно применять в виде монотерапии и в комплексе с различными общеукрепляющими средствами. Это оправдано у следующего контингента больных:
• людей, не полностью выздоровевших (наличие бронхита, ларингита, трахеита и других явлений) после перенесённого острого инфекционного заболевания;
• часто и длительно болеющих людей перед началом осенне-зимнего сезона, особенно в экологически неблагоприятных регионах;
• онкологических больных для улучшения качества жизни.
Другое направление использования иммуномодуляторов в виде монотерапии - иммунореабилитация онкологических больных. Опыт применения полиоксидония* показал возможность существенного улучшения качества жизни таких больных за счёт иммуностимулирующих, антиоксидантных и детоксицирующих свойств этого препарата. Мы считаем, что использование иммуномодуляторов в комплексном лечении онкологических больных - перспективное направление клинической иммунологии и онкологии.
Принципы применения иммуномодуляторов
В заключение целесообразно сформулировать некоторые общие принципы применения иммуномодуляторов у больных с недостаточностью антиинфекционной защиты.
• Иммуномодуляторы назначают в комплексной терапии одновременно с антибиотиками, противогрибковыми, противопротозойными или противовирусными средствами.
• Целесообразно раннее назначение иммуномодуляторов, с первого дня применения химиотерапевтического этиотропного средства.
• Иммуномодуляторы, действующие на фагоцитарное звено иммунитета, можно назначать больным как с выявленными, так и с невыявленными нарушениями иммунного статуса, т.е. основанием для назначения препарата служит клиническая картина.
• При наличии в лечебно-профилактическом учреждении соответствующей материально-технической базы применение иммуномодуляторов целесообразно сочетать с иммунологическим мониторингом, который следует проводить вне зависимости от наличия или отсутствия исходных изменений в иммунной системе.
• Иммуномодуляторы можно применять в виде монотерапии при проведении иммунореабилитационных мероприятий, в частности
• при неполном выздоровлении после перенесённого острого инфекционного заболевания. Снижение какого-либо параметра иммунитета, выявленное при иммунодиагностическом исследовании у практически здорового человека, не обязательно служит основанием для назначения ему иммуномодулирующей терапии. Такие люди должны находиться на учёте в соответствующем лечебно-профилактическом учреждении и составлять группу наблюдения по иммунному статусу.