Клиническая фармакология.: учебник для вузов / Под ред. В.Г. Кукеса.- 4-е издание., перераб. и доп., - 2009. - 1056 с.
|
|
|
|
ГЛАВА 23. ВИТАМИНЫ. СРЕДСТВА, АКТИВИРУЮЩИЕ И КОРРИГИРУЮЩИЕ МЕТАБОЛИЗМ. ПРЕПАРАТЫ ЖЕЛЕЗА
23.1. ВИТАМИННЫЕ И КОФЕРМЕНТНЫЕ ЛЕКАРСТВЕННЫЕ
СРЕДСТВА
Витамины - низкомолекулярные органические вещества, необходимые для обеспечения биохимических и физиологических процессов в организме.
Классификация витаминных препаратов
• Монокомпонентные.
- Водорастворимые.
- Жирорастворимые.
• Поликомпонентные.
- Комплекс водорастворимых витаминов.
- Комплекс жирорастворимых витаминов.
- Комплекс водо- и жирорастворимых витаминов.
- Витаминные препараты, содержащие макро- и(или) микроэлементы:
■ комплексы витаминов с макроэлементами;
■ комплексы витаминов с микроэлементами;
■ комплексы витаминов с макро- и микроэлементами.
- Витаминные препараты с компонентами растительного происхождения.
• Комплекс водо- и жирорастворимых витаминов с компонентами растительного происхождения.
• Комплекс водо- и жирорастворимых витаминов с микроэлементами и компонентами растительного происхождения.
• Фитопрепараты с высоким содержанием витаминов.
Механизм действия и основные фармакодинамические эффекты
Витамины - непластический материал или энергетический субстрат. Они участвуют в регуляции биохимических процессов. Многие
витамины используются в организме для построения коферментов или представляют собой готовые коферменты и, следовательно, осуществляют процессы биологического катализа (табл. 23-1).
Таблица 23-1. Функции витаминных и коферментных препаратов
 Окончание табл. 23-1
Окончание табл. 23-1
 Известно, что преимущественное влияние на белковый обмен оказывают витамины B12, BC, B6, A, E, K, B5; на углеводный - B1, B2, C, B5, А и липоевая кислота; на жировой - B6, B12, PP, B5, холин, карнитин и липоевая кислота.
Известно, что преимущественное влияние на белковый обмен оказывают витамины B12, BC, B6, A, E, K, B5; на углеводный - B1, B2, C, B5, А и липоевая кислота; на жировой - B6, B12, PP, B5, холин, карнитин и липоевая кислота.
Витамины необходимы организму в относительно небольших количествах. В большинстве случаев они - элементы пищи, в организме не образуются или синтезируются в недостаточных количествах (табл. 23-2).
Таблица 23-2. Суточная потребность в витаминах и минералах
 Молекулярные механизмы абсорбции водорастворимых витаминов
Молекулярные механизмы абсорбции водорастворимых витаминов
В последнее время изучен молекулярный механизм абсорбции и распределения ряда водорастворимых витаминов. Показана роль транспортёров в их абсорбции и распределении. Изучена регуляция процесса на генном уровне.
Аскорбиновая кислота (C). Сайты её абсорбции обнаружены на всём протяжении тонкой кишки. Процесс осуществляется при помощи Na-аскорбатного котранспортёра (вторичный активный транспорт). Транспорт молекулы кислоты осуществляется по градиенту концентрации Na+, поддерживаемого работой Na+-К+-АТФазы. При перемещении 2Na+ всасывается один аскорбат-анион.
Большие дозы витамина, в отличие от малых количеств вещества, абсорбируются не полностью, что, возможно, связано с ограниченной способностью энтероцитов к использованию транспортной системы.
Na-аскорбатный котранспортёр обладает стереоселективностью: более высокая аффинность отмечена к L-форме. Клонированы две его изоформы: SVCT1 и SVCT2 (закодированные в генах SLC23A1 и SLC23A2 соответственно).
У людей более старшего возраста выявлена более низкая экспрессия SVCT, вследствие чего отмечают ухудшение способности клеток к захвату витамина.
Контроль Na-аскорбатного котранспорта может осуществляться путём посттрансляционных модификаций и перераспределения SVCT- белков.
Биотин (B8). Na-зависимый мультивитаминный транспортёр (SMVT) с одинаковой аффинностью участвует в переносе биотина, пантотеновой, липоевой кислот. Предполагают, что молекулы SMVT содержат два сайта фосфорилирования протеинкиназы C, по-видимому, участвующих в регуляции его захвата. Клонированы и изучены 5'-регуля- торные отрезки SMVT-гена.
Фолиевая кислота (B9). Доказано, что кишечная абсорбция фолата регулируется внеклеточным уровнем субстрата, внутриклеточной протеинкиназой и онтогенетически. Пищевой дефицит фолиевой кислоты ведёт к значительному повышению её транспорта с помощью переносчиков. Последние данные позволяют предполагать участие механизмов регуляции транскрипции в усилении процесса.
Тиамин (B1). Исследования молекулярной природы транспортной системы тиамина в кишечнике позволили клонировать 2 транспортёра SLC19A2 и SLC19A3.
Тиаминзависимая мегалобластная анемия (синдром Роджерса) - заболевание с аутосомно-рецессивным типом наследования, его клинические проявления: мегалобластная анемия, нейросенсорная туго-
ухость и сахарный диабет. В настоящее время считают, что её причина - генетический дефект транспортёра тиамина SLC19A2.
Открытие большого числа транспортёров витаминов позволяет осуществлять научные исследования в направлении поиска их мутаций; объяснять и корректировать причину некоторых наследственных состояний пониженного всасывания витаминов; изучать различные виды взаимодействия витаминов, макро- и микроэлементов в организме.
Фармакокинетика витаминов
Витамин B1 (тиамин) хорошо всасывается в кишечнике. Проникает в кишечный эпителиоцит при помощи переносчика (активный транспорт), а при больших концентрациях - диффузией. Определён- ное количество витамина циркулирует из эпителиальных клеток в полость тонкой кишки и обратно. Через 15 мин тиамин обнаруживают в плазме крови, а через 30 мин - в тканях. Витамин накапливается в мозге, сердце, почках, надпочечниках, печени, скелетных мышцах. Около 50% всего количества содержится в мышечной ткани. Максимальную его концентрацию при оральном приёме монопрепарата или в составе витаминных комплексов отмечают приблизительно через 1,5 ч (см. табл. 23-3), её значения практически равны в обоих случаях. При приёме тиамина в той же дозе в составе витамино-минерального комплекса максимальная концентрация значительно ниже. Аналогичные данные получены и для AUC-тиамина. В печени витамин B1 превращается в активные метаболиты - дифосфо- и трифосфотиамин. Элиминация тиамина осуществляется за счёт метаболизма в печени со средней скоростью 1 мг/сут. Период полувыведения эндогенного тиамина - 9-18 сут, введённого в составе витаминных препаратов - 4-5,5 ч (см. табл. 23-3).
Витамин B6. Все три формы (пиридоксин, пиридоксаль и пиридоксамин) легко всасываются в ЖКТ путём простой диффузии. В крови происходит неферментативное превращение пиридоксина в пиридоксамин, после чего образуется один из конечных продуктов обмена - 4-пиридоксиловая кислота. В тканях пиридоксин путём фосфорилирования превращается в пиридоксинфосфат, пиридоксальфосфат и пиридоксаминфосфат. Конечные продукты обмена (4-пири- доксиловая и 5-фосфопиридоксиловая кислота) выделяются с мочой. Наибольшие концентрации витамина обнаруживают в печени, миокарде (вероятно - депо), высокие - в почках. При оральном приёме витаминных комплексов в сравнении с монопрепаратом не отмечено уменьшения максимальной концентрации витамина B6 и уменьшения площади под кривой «концентрация-время». Однако при оральном приёме витаминных комплексов в сочетании с макро- и микроэлемен-
тами происходит уменьшение максимальной концентрации и AUC. Время достижения максимальной концентрации при приёме витамина B6 в составе комплексов несколько больше, чем при приёме его в той же дозе в виде монопрепарата (см. табл. 23-3).
Витамин B2 (рибофлавин) . Его молекулы всасываются в проксимальной части тонкой кишки путём активного транспорта. В связи с тем, что в пище он находится в фосфорилированном состоянии и связан с белками, для всасывания в кишке должны пройти процессы расщепления и дефосфорилирования. Оральное применение синтетического рибофлавина в избыточных дозах не ведёт к увеличению его всасывания, однако содержание свободного витамина в жёлчи и просвете кишки возрастает. Рибофлавин в организме подвержен энтерогепатической циркуляции. Наибольшие количества рибофлавина обнаруживают в миокарде, печени, почках, мозге. На динамику его всасывания не влияет состав витаминного препарата. Использование для орального приёма витамино-минеральных и поливитаминных комплексов не приводит к уменьшению максимальной концентрации и площади под кривой «концентрация-время» (см. табл. 23-3). Метаболизм рибофлавина начинается в стенке кишки, где он фосфорилируется. Затем в печени образуется рибофлавин-5γ-монофосфат, затем - флавинадениндинуклеотид. За сутки с мочой выделяется около 10% принятой дозы, остальная часть реабсорбируется в канальцах.
Витамин C (аскорбиновая кислота) всасывается в тонкой кишке. По данным различных авторов, время достижения максимальной концентрации в плазме крови - 1,5-4 ч (большие значения получены при приёме кислоты в составе комплексных препаратов). Рядом авторов установлено, что всасывание витамина C зависит от количества компонентов в препарате: чем их меньше, тем лучше всасывание. Поэтому при использовании многокомпонентных лекарственных форм необходимо увеличение дозы аскорбиновой кислоты. Для насыщения тканей требуется превращение кислоты в дегидроаскорбиновую форму (проникает через мембрану энтероцита без затрат энергии). В клетках при участии тиоловых и дисульфидных групп дегидроаскорбиновая кислота быстро восстанавливается в аскорбиновую. Витамин C избирательно накапливается в задней доле гипофиза и надпочечниках. Метаболизм его происходит главным образом в печени (преобразование в дезоксиаскорбиновую и дикетогулоновую кислоту). Последняя затем превращается в щавелево-уксусную кислоту. Выделение метаболитов аскорбиновой кислоты происходит в почках. Скорость её метаболизма - 5-20 мг/сут. При приёме аскорбиновой кислоты в сверхвысоких дозах она сразу выводится почками в неизменённом виде.
Витамин E. Его свойствами обладают 8 различных токоферолов естественного происхождения. Из кишечника всасывается приблизительно половина витамина E, принятого с пищей. Его абсорбция требует присутствия жирных кислот. Витамин E проникает в кровь через лимфу, связываясь сначала с хиломикронами, а затем с β-липопротеинами плазмы. Часть выводимого из организма витамина (α-токоферола) экскретируется в жёлчь, а остальное количество - в мочу в виде глюкуронидов. Основной путь выведения γ-токоферола из организма - выделение с мочой в виде конъюгированного глюкуронида. Депо витамина - в гипофизе, семенниках, надпочечниках и ряде других органов. По данным некоторых авторов, биодоступность натурального витамина E по сравнению с искусственным токоферолом - 1,36.
Литературные данные по фармакокинетическим параметрам витаминов ограничены информацией, полученной при использовании монопрепаратов. В ответ на тенденцию последнего времени - назначение преимущественно поликомпонентных или витамино-минеральных комплексов - в табл. 23-3 приведены данные о фармакокинетике витаминов B1, B2, B6, C, E при приёме их в одинаковой дозе в виде монопрепарата, поливитаминного и витамино-минерального комплекса.
Витамин B12 (цианокобаламин) - единственный водорастворимый витамин, обладающий способностью к кумуляции. Поэтому весьма высок риск передозировки при использовании его как в виде монопрепарата, так и в составе различных комплексов.
Показания к применению и режим дозирования
При недостаточном обеспечении организма витаминами возникают специфические патологические состояния: гипо- и авитаминозы, расстройства обмена всех видов веществ (различной степени) и нарушения различных функций организма.
Причины развития гипо- и авитаминозов.
• Уменьшение алиментарного поступления:
- длительное самопроизвольное (анорексия, тошнота, рвота или боли, связанные с приёмом пищи) или ятрогенное ограничение диеты;
- искусственное вскармливание с первых недель жизни или сниженная концентрация витаминов в молоке матери;
- несбалансированная диета ребёнка: преобладание углеводов, дефицит или избыток белка;
- низкий уровень жизни.
• Нарушение всасывания:
- взаимодействие с препаратами, нарушающими обмен витаминов (оральные контрацептивы - пиридоксин; метотрексат,
Таблица 23-3. Фармакокинетические параметры водорастворимых витаминов
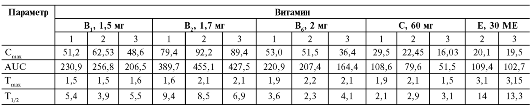 Примечания. 1 - монопрепарат; 2 - поливитаминный комплекс; 3 - витамино-минеральный комплекс.
Примечания. 1 - монопрепарат; 2 - поливитаминный комплекс; 3 - витамино-минеральный комплекс.
этанол, триметоприм - фолаты; противосудорожные средства - витамин D);
- генетические дефекты ферментативных систем, их возрастная или являющаяся следствием тяжёлой почечно-печёноч- ной патологии неполноценность - нарушение или неполноценный метаболизм;
- заболевания, сопровождающиеся стеатореей (жирорастворимые витамины), длительная диарея (водорастворимые витамины); глистные инвазии;
- лечение препаратами, нарушающими всасывание витаминов (слабительные, оральные контрацептивы, противосудорожные средства);
- уменьшение количества белка в пище - страдает транспорт. Следует учитывать, что потребность в витаминах значительно
возрастает при многих заболеваниях, особенно инфекционных, а также при применении химиотерапевтических средств. Кроме того, и у практически здоровых людей суточная потребность в витаминах значительно варьирует в зависимости от климатических и других внешних условий, а также интенсивности физической и умственной работы, нервно-психического напряжения. Дефицит витаминов возникает по многим причинам. Однако главные причины - недостаточное содержание витаминов в пище, увеличенная потребность организма в них. Характер питания также может оказывать существенное влияние на всасывание витаминов. При повышенном содержании углеводов в рационе человека растёт потребность в витаминах B1 B6, C. При недостатке белка происходит ухудшение всасывания витаминов B2, C, PP, уменьшается синтез витамина A. Потребность в витаминах в большой степени зависит от калорийности суточного рациона и соотношения его отдельных компонентов - возрастает с повышением калорийности, с увеличением потребления белков.
При недостаточном поступлении витаминов организм сначала расходует резервы, а при их истощении возникают субклинические и клинические признаки витаминной недостаточности. Выделяют следующие стадии витаминной недостаточности:
• субклиническая - снижение концентрации в плазме и моче, тканях и клетках, гипофункция ферментов, проявляющиеся при стрессах функциональные дефекты;
• клинических проявлений - симптомы дисфункций и повреждение тканей и органов, развёрнутый клинический синдром.
Клинические признаки гипо- и авитаминозов, недостаточности различных минералов представлены в табл. 23-4 и 23-5.
Таблица 23-4. Проявления гипо- и авитаминоза
 Таблица 23-5. Проявления снижения содержания минералов в организме
Таблица 23-5. Проявления снижения содержания минералов в организме
 Окончание табл. 23-5
Окончание табл. 23-5
 Учитывая
механизм действия витаминов, их сбалансированное применение оказывает
положительный эффект на течение большинства заболеваний. Фармакодинамика
витаминов при различной патологии представлена в табл. 23-6-23-8.
Учитывая
механизм действия витаминов, их сбалансированное применение оказывает
положительный эффект на течение большинства заболеваний. Фармакодинамика
витаминов при различной патологии представлена в табл. 23-6-23-8.
Таблица 23-6. Использование витаминов в лечении заболеваний сердечно-сосудистой системы
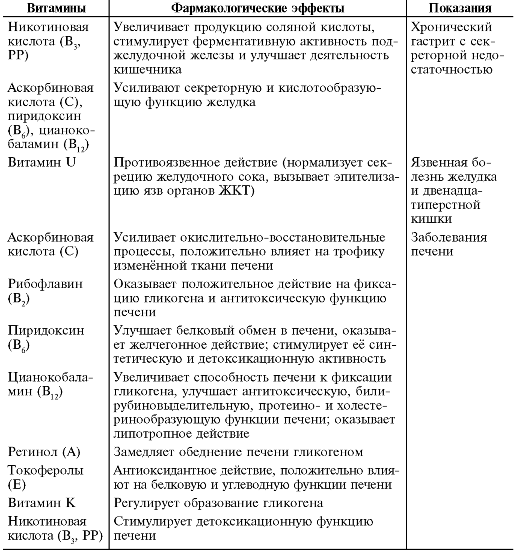
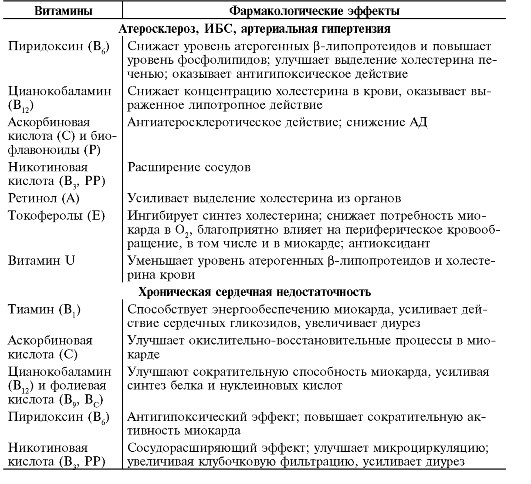 Таблица 23-7. Использование витаминов в лечении заболеваний желудочно-кишечного тракта
Таблица 23-7. Использование витаминов в лечении заболеваний желудочно-кишечного тракта
 Важное
показание к применению витаминных препаратов - необходимость
направленного воздействия в сочетании с другими средствами на течение
анаболических, восстановительных процессов в период реабилитации. В
таких случаях кроме комплексной витаминизации назначают дополнительно
один или несколько витаминных препаратов, выбор которых основывают на
преимущественном влиянии отдельных витаминов на тот или иной вид обмена.
Важное
показание к применению витаминных препаратов - необходимость
направленного воздействия в сочетании с другими средствами на течение
анаболических, восстановительных процессов в период реабилитации. В
таких случаях кроме комплексной витаминизации назначают дополнительно
один или несколько витаминных препаратов, выбор которых основывают на
преимущественном влиянии отдельных витаминов на тот или иной вид обмена.
Таблица 23-8. Использование витаминов в лечении инфекционных и аллергических заболеваний
 Продолжительность
курса зависит от скорости достижения клинического эффекта.
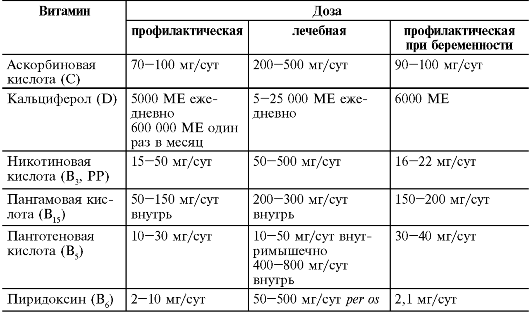
Профилактические и лечебные дозы витаминов представлены в табл. 23-9.
Беременным без риска можно назначать аскорбиновую кислоту (C), витамины
группы B и небольшие дозы витамина K1
Продолжительность
курса зависит от скорости достижения клинического эффекта.
Профилактические и лечебные дозы витаминов представлены в табл. 23-9.
Беременным без риска можно назначать аскорбиновую кислоту (C), витамины
группы B и небольшие дозы витамина K1
Таблица 23-9. Средние дозы витаминов для взрослых
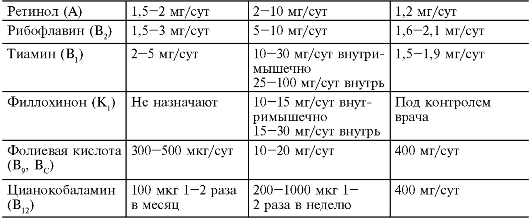
 Окончание табл. 23-9
Окончание табл. 23-9
 Побочные эффекты
Побочные эффекты
Аскорбиновая кислота (C). У здоровых людей, принимающих витамин C в рекомендуемой дозе, очень редко возникают побочные эффекты.
Наиболее частые побочные эффекты при превышении дозы - расстройство деятельности органов ЖКТ (в том числе тошнота, боль в животе, диарея). Такие реакции - следствие осмотических эффектов неабсорбированного витамина C, проходящего через кишечник. Описаны случаи закупорки илеоцекальной заслонки камнями, образованными аскорбиновой кислотой.
При употреблении 4-12 г витамина C в сутки возможно образование камней в почках, так как промежуточный продукт его метаболизма - щавелевая кислота. Приём витамина C в высоких дозах может также способствовать обострению ацидоза при хронических почечных заболеваниях и почечного тубулярного ацидоза.
Аскорбиновую кислоту широко используют на практике для усиления действия препаратов, способствующих выведению из организма с мочой избытка железа, особенно при талассемии и врождённой сидеробластической анемии. Однако существует мнение, что витамин C повышает токсичность железа, также у некоторых пациентов отмечают ухудшение состояния миокарда (в частности, функции левого желудочка). В настоящее время считают, что применять витамин C для повышения эффективности дефероксаминовой терапии если вообще и стоит, то с максимальной осторожностью, особенно при лечении людей пожилого возраста.
В 1999 г. впервые были опубликованы данные о том, что клетки опухоли содержат большое количество аскорбиновой кислоты. Хотя её роль в опухолевых тканях не выяснена до сих пор, существует мнение, что приём витамина C может снизить эффективность противоопухо-
левой терапии. Действуя как антиоксидант, он частично нейтрализует вызываемый химиотерапией оксидантный стресс в клетках опухоли.
Тиамин (B1). Побочные реакции аллергической природы (встречают редко), их симптомы - слабость, боли в области сердца, тахикардия, гипотензия, сердцебиение, одышка, боли в эпигастральной области, тошнота, рвота, зуд, эритема, покраснение кожи лица, кожная сыпь, пурпура, прекоматозное состояние и даже летальный анафилактический шок.
При быстром внутривенном введении тиамина может возникнуть чрезвычайно редкое тяжёлое осложнение - синаптоплегия (образование комплексов с медиаторами нервных импульсов и нарушение их функции). Её проявления - нарушение функции скелетных мышц, падение АД, аритмии, угнетение деятельности ЦНС. Описана дыхательная недостаточность после парентерального введения высоких доз тиамина.
Анафилактические реакции наблюдали после парентерального введения только в тех случаях, когда тиамин вводили изолированно; их не встречают при совместном введении тиамина с другими витаминами группы B. Поскольку витамин B1 усиливает эффекты ацетилхолина, некоторые кожные реакции иногда ошибочно оценивают как аллергические.
Пиридоксин (B6). При длительном приёме препарата описаны случаи тошноты, рвоты, болей в животе, снижения аппетита, возникновения фоточувствительности (фотосенсибилизации на пиридоксин) (редко).
В настоящее время известно, что витамины группы B - синергисты, и поэтому их надо применять вместе. Многие исследователи сообщают, что приём повышенной дозы одного из них приводит к усилению выведения из организма других витаминов группы B. Так, при употреблении больших (не токсических) доз пиридоксина возникают побочные эффекты (чувство «песка» в глазах, глоссит и ангулярный стоматит), полностью купирующиеся после назначения рибофлавина.
При быстром внутривенном введении пиридоксина иногда возникают судороги. Приём препарата в высоких дозах может угнетающе действовать на секрецию молочных желёз.
Никотиновая кислота (B3, PP). Побочные реакции могут возникать после введения высоких доз препарата (например, лечение гиперхолестеринемии). Никотиновая кислота способствует освобождению гистамина и активации системы кининов.
Описаны различные типы кожных реакций. Наиболее частая - резкое покраснение лица вследствие сосудорасширяющего эффекта (при дальнейшем применении выраженность реакции уменьшается). Также
возможно возникновение преходящей или стойкой сыпи, зуда и, иногда, волдырей, сухости и шелушения эпидермиса, дерматоза (редко).
Никотиновая кислота ослабляет эффект оральных антидиабетических средств, а длительное её применение может оказывать диабетогенный эффект или вызывать декомпенсацию ранее стабильного сахарного диабета. При продолжительном лечении никотиновой кислотой также отмечено некоторое повышение концентрации мочевой кислоты.
Пантотеновая кислота (B15). Её приём практически не вызывает побочных эффектов. Редко возможно возникновение быстро проходящей изжоги, тошноты, рвоты. При местном использовании пантотеновой кислоты зарегистрированы случаи контактных дерматитов.
Цианокобаламин (B12). При оральном приёме пациенты хорошо переносят даже высокие дозы. Есть сообщения о реакциях повышенной чувствительности (в основном - при парентеральном введении): сыпь, краснота, крапивница. Ведущую роль в возникновении таких явлений отводят кобальту и компонентам среды культуры, используемой для получения витамина. В 0,76% случаев при приёме витамина B12 возможно развитие анафилактического шока.
Кальциферол (D) и ретинол (A). Побочные эффекты возникают при передозировке.
Симптомы превышения дозы витамина D: тошнота, сонливость, недомогание, потеря аппетита, запор, жажда и боли в животе (редко) - обусловлены увеличением концентрации кальция в плазме крови. При приёме высоких доз кальциферола описаны случаи повышения концентрации фосфатов, особенно в ткани почек. Симптомы передозировки витамина A: снижение аппетита (вплоть до анорексии), недомогание, поражение кожи, гепатоспленомегалия, припухлость суставов, выпадение волос, увеличение концентрации липидов в крови. У детей иногда наблюдают повышение температуры тела, рост внутричерепного давления (из-за гиперпродукции спинномозговой жидкости) и развитие гидроцефалии. Необходимо отметить, что у детей не только передозировка ретинола, но и нарушение соотношения между витамином A и D может вызвать кожные изменения, возникновение глазных симптомов, нарушение деятельности органов ЖКТ, повышение выработки ликвора.
Токоферолы (E). При приёме витамина E в пищевых дозах описаны случаи возникновения болезненности молочных желёз, повышенной утомляемости, болей в животе, диареи, эмоциональных нарушений, тромбофлебитов, ретинурии, а также изменения концентрации тиреоидных гормонов. Длительное применение витамина может привести к повышению концентрации холестерина в плазме крови.
Некоторые авторы отмечают возможную связь между приёмом витамина E и возникновением тромбофлебитов. При длительном приёме высоких доз препарата у предрасположенных пациентов или на фоне терапии эстрогенами могут возникнуть тромбозы.
Противопоказания к назначению
Индивидуальная непереносимость - общее противопоказание к применению витаминов в профилактических целях; для витамина D дополнительно - идиопатическя гиперкальциемия, саркоидоз.
При беременности противопоказано назначение высоких доз витамина K1 (возможны функциональные нарушения у плода) и жирорастворимых витаминов (A и D) (тератогенный эффект).
Влияние на результаты лабораторных исследований
При высокой концентрации аскорбиновой кислоты в моче результат определения концентрации глюкозы может быть ложноотрицательным. Кроме того, факт глюкозурии и гипергликемии у лиц, получавших витамин C, необходимо подтверждать специфическими (хроматографическими) тестами.
Витамин C также влияет на активность сывороточных трансаминаз и лактатдегидрогеназы; под действием аскорбиновой кислоты уменьшается концентрация билирубина, что может маскировать заболевания печени. После приёма высоких доз витамина C описаны ложноотрицательные результаты проб на скрытое кровотечение.
Взаимодействие
Для витаминных препаратов важно фармацевтическое взаимодействие не только в растворах, но и в «твёрдых» лекарственных формах:
• тиамина гидрохлорид окисляется в присутствии рибофлавина на выпадающие в осадок тиохром и хлорофлавин (аскорбиновая кислота в определённой степени предотвращает осаждение тиохрома, однако это может привести к ещё большему образованию хлорофлавина; взаимодействие между тиамином и рибофлавином усиливается под действием никотинамида);
• фолиевая кислота разрушается под действием тиамина и рибофлавина (при pH=5 реакция протекает значительно медленнее);
• цианокобаламин разрушается в присутствии дегидроаскорбиновой кислоты (предотвратить реакцию можно, остановив окисление аскорбиновой кислоты - необходимо присутствие ионов меди);
• рибофлавин усиливает аэробное разрушение аскорбиновой кислоты (защита от света и кислорода позволяет предотвратить реакцию);
• аскорбиновая кислота уменьшает стабильность сухих порошков β-каротина в твёрдых лекарственных формах;
• эргокальциферол изомеризуется под воздействием аскорбиновой и фолиевой кислоты, тиамина гидрохлорида и пиридоксина гидрохлорида.
Фармацевтическое взаимодействие витаминов более выражено в жидких лекарственных формах. В твёрдых его легче избежать, заключая некоторые вещества (например, цианокобаламин) в желатин. Уменьшение содержания воды также способствует снижению вероятности фармацевтического взаимодействия. Другая возможность - использование многослойных или ламинированных таблеток, а также заключение отдельных витаминов в покрытия или капсульные оболочки. Есть несколько методов предотвращения фармацевтического взаимодействия между витаминами в жидких лекарственных формах: использование двухкамерных ампул, лиофилизация; для препаратов, используемых для орального приёма, - приготовление порошков или растворимых гранул.
Включение микроэлементов в витаминные продукты также часто приводит к нестабильности, так как некоторые из них - тяжёлые металлы, катализирующие окислительное разрушение витаминов. Для повышения стабильности лекарственной формы изготавливают отдельные гранулы витаминов и микроэлементов, а затем объединяют их в таблетку (обычную, двухслойную или ламинированную). Наиболее трудоёмко, но эффективно производство капсул, содержащих витамины и микроэлементы отдельно, с последующим объединением их в единой упаковке.
По данным некоторых авторов, тяжёлые металлы (Pb, Cd, Fe, Co, Cu, Mg, Ni) могут в определённой степени снижать стабильность витамина B6. Даже незначительное количество их ионов оказывает каталитическое воздействие на окислительное разрушение многих витаминов (ретинол и его эфиры; тиамина гидрохлорид; рибофлавин; пантотеновая и аскорбиновая кислота и их соли; пиридоксина гидрохлорид; фолиевая кислота; колекальциферол; эргокальциферол; рутин*). Для тиамина основной катализатор - Cu (нежелательные эффекты других металлов слишком слабы). Неблагоприятным эффектам тяжёлых металлов на стабильность витаминов противопоставляют добавление хелатного агента (образует комплексы с ионами металлов).
Одна из сложнейших проблем фармации - разработка стабильного, комбинированного с микроэлементами мультивитаминного продукта. Особенно сложно достигнуть указанной цели для водных растворов. Поэтому предпочтение отдают таблеткам, капсулам, растворимым гранулам, двухкамерным ампулам и лиофилизатам. Большинство
публикаций о подобных продуктах не раскрывает сложности проблемы, а лишь освещает её отдельные аспекты. Сейчас самые стабильные формы мультивитаминных препаратов, по-видимому, мягкие желатиновые капсулы и таблетки, покрытые сахарной оболочкой. Однако при любой форме выпуска не исключена возможность взаимодействия компонентов в организме человека.
Наиболее важный для витаминных препаратов уровень фармакокинетического взаимодействия - метаболизм. Достоверно установлено, что при недостаточном или дополнительном введении некоторых витаминов (например, тиамина и рибофлавина) происходит изменение активности ферментов метаболизма ксенобиотиков.
К введению витаминов чувствительны следующие микросомальные ферменты: в большей степени - деметилаза и гидроксилаза, в меньшей - НАДН-редуктаза и эстераза. Индометацин и напроксен подвергаются в организме деметилированию. Установлено, что под влиянием больших доз пиридоксина гидрохлорида (0,2 г/сут) возможны уменьшение концентрации фенитоина в крови и уменьшение его противосудорожного действия (витамин B6 индуцирует некоторые изоферменты цитохрома P-450, участвующие в его биотрансформации).
Существуют данные о влиянии ЛС на фармакокинетику и фармакодинамику витаминов. Так, результаты многочисленных исследований показали, что анаболические стероиды (ретаболил*, силаболин*) повышают активность транспорта аскорбиновой кислоты в тонкой кишке, увеличивают процент её всасывания, вызывают снижение концентракции восстановленной и повышение - окислённой формы.
При приёме ацетилсалициловой кислоты увеличивается экскреция почками витамина C (вплоть до развития гиповитаминоза с характерной клинической картиной). В то же время при одновременном приё- ме салицилатов и аскорбиновой кислоты (более 2 г/сут) может увеличиваться кислотность мочи, возрастать реабсорбция воды в почечных канальцах (у пациентов возникают жалобы на шум в ушах, головокружение, снижение слуха; возможны рвота, возбуждение).
Хлорпромазин блокирует флавинокиназу - при сочетанном применении с рибофлавином тормозит его превращение в флавинмононуклеотид. Аналогичным антивитаминным эффектом обладают мепакрин (акрихин*), галактофлавин, изорибофлавин. Метаболизм рибофлавина, особенно в миокарде, ухудшают трициклические антидепрессанты - имипрамин и амитриптилин.
У женщин, принимающих содержащие эстрогены оральные контрацептивы, обнаруживают дефицит пиридоксина. Дефицит витамина B6 возникает при длительном применении антибиотиков, сульфаниламидов, фтивазида, изониазида, циклосерина, дезоксипиридоксина.
Эстрогены, содержащиеся в контрацептивных препаратах, могут повышать концентрацию в крови ретинолсвязывающего протеина, поэтому при их применении вместе с препаратами витамина A может возникнуть его гипервитаминоз. При длительном совместном применении тетрациклинов с препаратами витамина A возможно развитие внутричерепной гипертензии. Дефицит Zn в организме нарушает превращение ретинола в активную форму. Витамин A обладает антагонистическими свойствами к адреналину и кортизону. Приём больших доз кортизона ведёт к уменьшению содержания витамина A в организме.
В настоящее время известен ряд антагонистов витаминов (табл. 23-10).
Таблица 23-10. Антагонисты витаминов
 В
результате многочисленных клинико-экспериментальных наблюдений
установлено, что в человеческом организме есть межвитаминные
взаимодействия: в процессе обмена физиологическое действие каждого
витамина осуществляется в комплексе с воздействием других. Рассматривая
взаимодействие тиамина с пиридоксином, следует отметить, что большинство
авторов отмечают антагонистический характер взаимоотношений между этими
витаминами. При введении витамина B6 наблюдают повышение
экскреции тиамина, снижение концентрации тиаминдисульфида в крови и
общего тиамина в тканях. При введении тиамина отмечают резкое снижение
концентрации в крови коферментной формы пиридоксина и увеличение
экскреции 4-пиридоксовой кислоты, что, по мнению некоторых авторов,
можно расценивать как обеднение организма пиридоксином. Конкурентные
взаимоотношения между витаминами B1 и B6
обусловливают необходимость введения пиридоксина в период использования
тиамина (их применяют поочерёдно - через день). В связи с тем что
конкурен-
В
результате многочисленных клинико-экспериментальных наблюдений
установлено, что в человеческом организме есть межвитаминные
взаимодействия: в процессе обмена физиологическое действие каждого
витамина осуществляется в комплексе с воздействием других. Рассматривая
взаимодействие тиамина с пиридоксином, следует отметить, что большинство
авторов отмечают антагонистический характер взаимоотношений между этими
витаминами. При введении витамина B6 наблюдают повышение
экскреции тиамина, снижение концентрации тиаминдисульфида в крови и
общего тиамина в тканях. При введении тиамина отмечают резкое снижение
концентрации в крови коферментной формы пиридоксина и увеличение
экскреции 4-пиридоксовой кислоты, что, по мнению некоторых авторов,
можно расценивать как обеднение организма пиридоксином. Конкурентные
взаимоотношения между витаминами B1 и B6
обусловливают необходимость введения пиридоксина в период использования
тиамина (их применяют поочерёдно - через день). В связи с тем что
конкурен-
ция между витаминами может осуществляться на путях фосфорилирования, целесообразно применять вместо тиамина его коферментную форму - тиаминдисульфид (кокарбоксилаза).
Приём больших ежедневных доз аскорбиновой кислоты ухудшает усвоение витамина B12 из пищи или пищевых добавок. Недостаток в рационе витамина E способствует развитию гиповитаминоза A.
23.2. АКТИВАТОРЫ И КОРРЕКТОРЫ МЕТАБОЛИЗМА
Фармакологические свойства и терапевтическая эффективность ЛС данной группы определяются в основном биологической ролью нуклеотидов, фосфатов, аминокислот и других субстратов, активаторов, регуляторов метаболических реакций. Одни из них обладают выраженным антиоксидантным действием, другие улучшают метаболизм и энергообеспечение тканей, восстанавливают трофику и стимулируют процессы регенерации, уменьшают гипоксию, активируют обмен веществ в тканях (прил. 5).
Однако следует отметить, что эффективность подобных препаратов при различных заболеваниях внутренних органов, и в частности ИБС, продемонстрирована лишь в небольших исследованиях. Поэтому их применение часто относят к лечебным мероприятиям с недоказанной эффективностью.
К метаболическим препаратам для системного применения можно также отнести биогенные стимуляторы: женьшень, пантокрин, элеутерококка корневища и корни, алоэ древовидного листья, гумизоль*, маточное молочко (апилак*), мелатонин и др.
Аденозина фосфат
Аденозина фосфат (АМФ) - компонент адениловой системы; его биологическая роль:
• активация в анаэробных условиях ряда ферментов цикла Кребса, усиление ресинтеза АТФ с одновременным торможением гликолиза;
• в качестве пуринового нуклеотида способствует синтезу нуклеиновых кислот и, следовательно, синтезу белков;
• входит в состав важнейших дыхательных коферментов-перенос- чиков электронов и протонов в начальных звеньях цепи тканевого дыхания (НАД, НАДФ и ФАД);
• энергетическое обеспечение процессов синтеза - предшественник макроэргических соединений (образование АДФ и АТФ происходит при фосфорилировании АМФ);
• участвует в регуляции углеводного обмена.
Он способен проникать в клетки. Поступая в организм, аденозина фосфат (фосфаден*) не может сразу включиться в макроэргический пул - вначале метаболизируется до аденозина. Последний обладает биологической активностью - происходит расширение артериальных капилляров, что влечёт активацию обмена за счёт повышения притока кислорода, увеличение синтеза АТФ. Кроме того, аденозин может включаться в синтез макроэргов.
В то же время при достаточном количестве АТФ в клетке происходит переход аденозина фосфата не в аденозин, а в инозинмонофосфат, метаболизирующийся иначе. По совокупности свойств аденозин можно отнести к анаболическим веществам.
Показания к применению. Препарат применяют с целью улучшения периферического кровообращения, а также для восстановления анаболических процессов и микроциркуляции при острых и хронических заболеваниях миокарда.
Способ приёма и дозы. Назначают per os в таблетках в разовой дозе 25-50 мг, при суточной - до 300 мг. Продолжительность курса - 15-30 дней (при необходимости лечение повторяют с интервалом в 5-7 дней).
Инозин
Инозин (рибоксин*) - нуклеотид, содержащий в качестве пуринового основания гипоксантин. При введении в организм препарат расщепляется на рибозу и гипоксантин. Последний затем реагирует с пирофосфорилированной рибозой с образованием нуклеотида - инозинмонофосфата. Не исключена возможность и прямого его образования фосфорилированием инозина (хотя фермент, необходимый для такой реакции, пока не обнаружен).
Инозинмонофосфат занимает особое место в процессе биосинтеза пуриновых нуклеотидов в организме: образуется первым и служит предшественником синтеза остальных пуриновых нуклеотидов (АМФ, гуаниловая и ксантиловая кислота).
Инозин, поступая в плазму крови, может разрушаться до гипоксантина. Он, захватываясь эритроцитами, повышает в них содержание 2,3-ДФГ, тем самым облегчая диссоциацию кислорода из оксигемоглобина, что способствует улучшению обмена кислорода в организме. В тех случаях, когда в клетках недостаточно сорбита, инозин может служить источником его синтеза. Разрушаясь в печени до гипоксантина, инозин включается в энергетический пул как его субстрат, улучшая функцию гепатоцитов.
Показания к применению. Инозин, подобно аденозина фосфату, применяют как корректор анаболических процессов при острых и хронических заболеваниях миокарда.
Способ приёма и дозы. Назначают per os по 0,2-0,4 г 3 раза в сутки, часто - в сочетании с калия оротатом. При необходимости используют 2% раствор в ампулах по 10 и 20 мл. Содержимое ампул вводят внутривенно медленно или капельно один раз в день.
Трифосаденин
Трифосаденин (кислота аденозинтрифосфорная, АТФ) - трифосфорный эфир аденозина, содержащий аденин, рибозу и три остатка фосфорной кислоты. Сложен и многообразен путь включения экзогенного АТФ в биоэнергетические процессы организма. Во-первых, большое количество фермента АТФазы сразу подвергает его метаболизму. Во-вторых, в процессе дальнейшей биотрансформации, зависящей от состояния ферментных систем организма, происходит включение метаболитов экзогенно введённого АТФ по пути или аденозина фосфата, или инозина. Эффект от введения стандартной дозы трифосаденина (20 мг) ниже, чем от чем описанных ранее нуклеотидов. Так как при её метаболизме образуется меньше активных продуктов, АТФ в больших дозах вводить нельзя из-за роста числа побочных реакций. Наиболее эффективна АТФ, как и другие нуклеотиды, в комплексе с коферментами и витаминными препаратами.
Показания к применению - ИБС, астенические состояния, вегетативно-сосудистая дистония, т.е. тогда, когда необходима умеренная коррекция процессов микроциркуляции путём изменения капиллярного кровообращения, активации синтеза адениловых нуклеотидов в неизменённых системах.
Способ приёма и дозы. Препарат вводят внутримышечно по 1- 2 мл/сут 1% раствора в течение 2-4 нед.
Триметазидин
Препарат поддерживает метаболизм клетки во время ишемии за счёт сохранения её энергетического потенциала, коррекции нарушений ионного транспорта, препятствия действию свободных радикалов. Способствует сохранению энергетического потенциала митохондрий, уменьшает внутриклеточный ацидоз, вызванный гипоксией, сохраняет внутриклеточный Ca2+, препятствует увеличению его концентрации в цитозоле. Значительно снижает перекисное окисление мембранных липидов. Триметазидин оказывает действие только на клетки, вовлечённые в патологический процесс. В физиологических условиях заметного действия на ткани не выявлено. В терапевтической концентрации увеличивает электрический потенциал ишемизированного миокарда и уменьшает выход креатинфосфокиназы. Триметазидин уменьшает величину некроза
и степень структурных изменений ткани при инфильтрационном
отёке от сильной гипоксии.
Показания к применению. В отличие от других ЛС указанной группы в ряде многоцентровых контролируемых исследований у триметазидина обнаружена антиангинальная эффективность при стабильной стенокардии напряжения.
Способ приёма и дозы. Начальная доза препарата - per os 20 мг 3 раза в сутки. Создана пролонгированная форма триметазидина (предуктал МВ*) - принимают по 35 мг 2 раза в сутки. Пациенты хорошо переносят лечение, побочные эффекты возникают крайне редко и слабо выражены. Отсутствуют данные о несовместимости триметазидина с другими ЛС. Он не взаимодействует с антикоагулянтами, гликозидами, диуретиками. В настоящее время не выявлено противопоказаний к применению препарата.
23.3. АНТИОКСИДАНТЫ
Наиболее интенсивно процессы свободнорадикального окисления происходят в фосфолипидном среднем слое мембраны клеток. Процессы перекисного окисления липидов в здоровом организме протекают сбалансированно. В норме образование свободных радикалов происходит в небольшом количестве. Однако их концентрация возрастает при любом патологическом процессе прямо пропорционально тяжести состояния. Под влиянием различных повреждающих факторов происходит разобщение процессов окислительного фосфорилирования и тканевого дыхания. Атомарный кислород утрачивает роль акцептора электронов в дыхательной цепи, снижается выработка АТФ и креатинфосфата в тканях - возникает дефицит энергии. Снижается поляризация клеточных мембран, увеличивается проницаемость цитоплазматических и лизосомальных мембран, что приводит к выходу в межклеточную жидкость ионов K+ и лизосомальных ферментов, деполяризации клеточной мембраны. Снижение её заряда способствует активации потенциалзависимых Ca2+-каналов и поступлению ионов Ca2+ внутрь клетки. Изза недостатка АТФ происходит нарушение работы кальциевого насоса, обычно удаляющего ионы из клетки, не происходит их депонирования в ЭПР, митохондриях и т.д. Ионы свободного внутриклеточного Ca2+ увеличивают активность протеаз, липаз, в частности фосфолипазы A2 (под её влиянием из фосфолипидов мембраны происходит высвобождение свободных жирных кислот, особенно арахидоновой).
В здоровом организме действует защитный механизм (например, ферменты: каталазы, пероксидазы, супероксидизмутазы - и так назы-
ваемые «ловушки радикалов»: витамины A, C, E, глутатион, серосодержащие соединения, биогенные амины, эссенциальные микроэлементы).
Оценить интенсивность процесса перекисного окисления липидов можно, определяя концентрацию малонового диальдегида в плазме крови и мембранах клеток.
Антиоксидантный статус клетки зависит от интенсивности свободнорадикального окисления и антиокислительной активности.
К антиоксидантам относят соединения различной химической природы, способные тормозить или устранять свободнорадикальное окисление органических веществ молекулярным кислородом в организме человека.
Механизмы действия антиоксидантных препаратов:
• изменения структуры мембраны, приводящие к ограничению доступа окислителей к ненасыщенным жирным кислотам;
• повышение активности эндогенных антиоксидантных систем (глутатионредуктазы, каталазы);
• прямое взаимодействие со свободными радикалами кислорода с устранением их активности;
• связывание катализирующих свободнорадикальные реакции ионов Fe2+ и Cu2+.
В медицинской практике в качестве антиоксидантов наиболее часто используют витамины A, C, E, препараты, содержащие фосфолипиды и микроэлементы (Se, Zn).
Витамин A
Антиоксидантные свойства ретинола: препятствует окислению цистеина; обеспечивает нормальное функционирование поверхностного эпителия (не допускает чрезмерного ороговения); препятствует канцерогенному действию бензпирена путём торможения микросомального окисления; замедляет фотохимические свободнорадикальные реакции.
Витамин C
Аскорбиновая кислота во взаимодействии с токоферолом и глутатионом - главный компонент биологической антиоксидантной системы. Обеспечивает движение восстановленных пиридиннуклеотидов через токоферол на «гашение» свободных радикалов (реакция - нейтрализация первичного радикала). Витамин C - физиологический антиоксидант, защищающий организм человека от «простудных» заболеваний и старения. Особенно его антиоксидантный эффект заметен при поражениях лёгких, протекающих с усилением свободнорадикального
окисления (пневмония, бронхиальная астма, хронические неспецифические заболевания).
Витамин E
Молекулы витамина E взаимодействуют с пероксидными радикалами липидов, восстанавливая их в гидропероксиды, но сами при этом превращаются в токоферолхинон, экскретируемый затем почками. Таким образом, витамин E сохраняет целостность и функциональную активность клеточных мембран, останавливая процесс образования перекисей липидов. Молекулы витамина в комплексе с Se и полиненасыщенными жирными кислотами (преимущественно с арахидоновой) входят в состав биологических мембран. Сохраняя жирные кислоты в мембранах тромбоцитов и препятствуя образованию эндоперекисей и предшественников простагландинов, витамин E ограничивает процесс их агрегации (тем самым снижает риск прогрессирования заболеваний сердечно-сосудистой системы).
Кофермент Q10
Кофермент Q10 (КoQ10), увеличивая синтез АТФ, стимулирует процессы клеточного дыхания в кардиомиоцитах. Оказывает клинически значимое антиоксидантное защитное действие. Предохраняет мембраны кардиомиоцитов от перекисного окисления. Сокращает зону повреждения миокарда в условиях ишемии и реперфузии. КoQ10 активирует Na+-К+-АТФазу, что нормализует процесс реполяризации мембран и, таким образом, препятствует удлинению интервала Q-T.
Водорастворимая форма убихинона обладает более высокой биодоступностью по сравнению с жирорастворимой.
Сочетание кофермента Q10 и витамина E препятствует развитию атеросклероза, воздействуя на липопротеиды низкой плотности. Препарат стимулирует метаболические процессы, повышает переносимость физических нагрузок.
Янтарная кислота
Янтарная кислота повышает активность антиоксидантной системы клетки за счёт восстановления глутатиона и активности витамина E и КoQ10, ферментов антиоксидантной защиты (глутатионпероксидазы и каталазы).
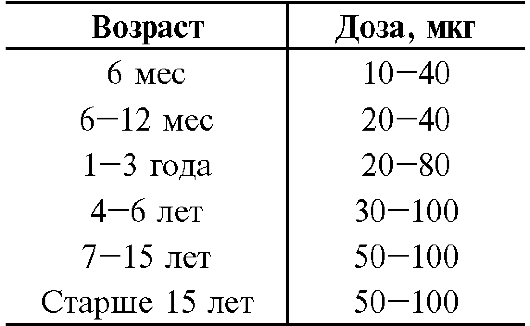
Селен
Se - компонент глутатионпероксидазы, разрушающей эндоперекиси, образовавшиеся при перекисном окислении липидов (табл. 23-11). Витамин E не заменяет Se, так как тот и другой действуют на различ-
Таблица 23-11. Суточная доза Se в зависимости от возраста
 ные
звенья патогенеза перекисного окисления липидов. Однако они обладают
синергизмом и при совместном назначении их дозы можно снижать. В
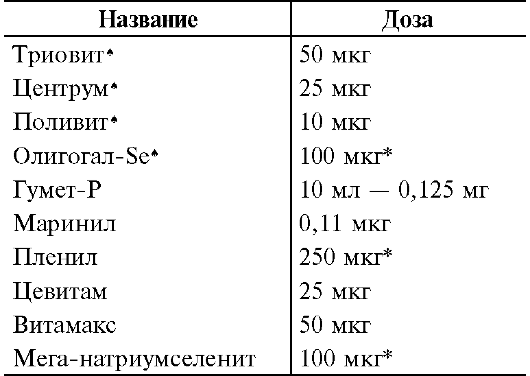
настоящее время приоритетную позицию занимают препараты, в которых Se
содержится в виде комплекса с биолигандами (природными носителями
микроэлементов): в дрожжах - триовит*; в водорослях - спирулина, с
гуминовыми кислотами (табл. 23-12).
ные
звенья патогенеза перекисного окисления липидов. Однако они обладают
синергизмом и при совместном назначении их дозы можно снижать. В
настоящее время приоритетную позицию занимают препараты, в которых Se
содержится в виде комплекса с биолигандами (природными носителями
микроэлементов): в дрожжах - триовит*; в водорослях - спирулина, с
гуминовыми кислотами (табл. 23-12).
Таблица 23-12. Se-содержащие лекарственные препараты, пищевые добавки и витамины
 * Дозы препарата, требующие контроля селена в организме при курсовом назначении.
* Дозы препарата, требующие контроля селена в организме при курсовом назначении.
Свойства антиоксидантов обнаружены у некоторых микроэлементов: Mo, Ni, W, Zn.
Препараты различных групп с антиоксидантным эффектом
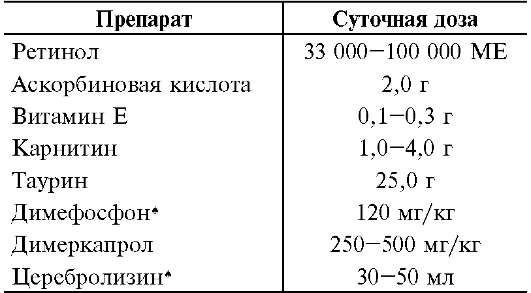
Наряду с витаминами и микроэлементами антиоксидантными свойствами обладают лекарственные препараты различных групп: карнитин, таурин, карнозин*, силибинин (карсил*), эссенциале*, аллопуринол, димефосфон*, димеркапрол (унитиол*), церебролизин*, биофлавоноиды, коэнзим Q (табл. 23-13).
Карнитин нормализует жировой обмен, ограничивает окисление липидов, тормозит образование гидроперекисей жирных кислот и этим способствует сохранению целостности клеточных мембран.
Таурин - 2-аминоэтилсульфониевая кислота (β-аминокислота). Механизм действия связан с вмешательством в активность ряда катионов. Препарат защищает лёгочную ткань от повреждения раздражающими веществами.
Димефосфон* повышает активность антиоксидантной системы крови, увеличивает активность окислительно-восстановительной системы глутатиона, предотвращая окисление его тиоловой группы.
Димеркапрол (унитиол*). Сульфгидрильные группы, входящие его в состав, отвлекают на себя различные окисляющие радикалы и тем самым сохраняют активность аналогичных групп различных биологически активных веществ (например, глутатиона). Поэтому препарат широко применяют в качестве антиоксиданта в акушерско-гинекологической практике.
Церебролизин* уменьшает лактат-ацидоз в головном мозге, замедляет процесс формирования высокореактивных форм свободных радикалов кислорода и снижает концентрацию продуктов перекисного окисления мембранных липидов. Препарат обладает свойствами стабилизатора клеточных мембран, способствует поддержанию гомеостаза Ca2+ и уменьшает нейротоксическое действие высоких концентраций возбуждающих аминокислот (например, глутаминовой).
Таблица 23-13. Режим дозирования антиоксидантов
 23.4. ПРЕПАРАТЫ ЖЕЛЕЗА
23.4. ПРЕПАРАТЫ ЖЕЛЕЗА
Механизм действия и основные фармакодинамические эффекты
Железо (Fe) - компонент, необходимый для нормальной деятельности различных геминовых и негеминовых субстратов: гемоглобина, миоглобина, цитохромов, пероксидаз и каталаз. Указанные ферментные системы участвуют в транспорте кислорода, тканевом дыхании, удалении перекисей свободнорадикальных реакций. Адекватные ко-
личества Fe необходимы для эффективного эритропоэза (образование гемоглобина в эритробластах). Передача Fe вызревшим эритроцитам происходит в основном при высвобождении его из трансферрина в области рецептора на мембране-предшественнице.
При курсовом применении препаратов Fe происходит постепенная регрессия клинических проявлений (слабость, повышенная утомляемость, головокружение, тахикардия, болезненность и сухость кожных покровов) и лабораторных показателей анемии.
Фармакокинетика оральных препаратов железа
Всасывание железа в ЖКТ может происходить двумя путями:
• быстро насыщающийся ферритиновый активный транспорт обеспечивает поступление небольших количеств пищевого, органического Fe (до 3-4 мг/сут) (всасывание Fe3+ происходит значительно хуже, чем восстановленного Fe2+) - физиологический механизм;
• пассивный транспорт - простая диффузия по градиенту концентрации (наблюдают при приёме Fe в дозах, существенно превышающих его содержание в обычной пище).
Физиологическое всасывание Fe2+ происходит главным образом в двенадцатиперстной кишке и в верхнем отделе тощей кишки за счёт ферритинового механизма. Содержащийся в слизистой оболочке ЖКТ белок апоферритин связывает часть всасывающегося Fe2+, образуя комплекс Fe2+-ферритин. После прохождения кишечного барьера Fe2+ вступает в плазме крови в связь с β1-глобулином - трансферрином. Связанное с трансферрином Fe2+ поступает в различные ткани, где вновь освобождается. В тканевых депо Fe2+ также находится в связанном состоянии (в виде ферритина или гемосидерина).
Пассивная абсорбция происходит на протяжении всего кишечника, но её интенсивность ослабевает по направлению к толстой кишке. Под воздействием соляной кислоты происходит ионизация молекулярного Fe, что увеличивает его всасывание. Однако указанный механизм практически не влияет на абсорбцию лекарственного Fe2+. Всасывание Fe3+ улучшается в присутствии веществ, обладающих свойствами восстановителей (аминокислоты, пептиды, фруктоза, аскорбиновая, янтарная кислота и др.) , переводящих его в двухвалентную форму.
Серин (α-аминокислота) способствует более эффективному всасыванию железа и его поступлению в системный кровоток.
Абсорбция Fe2+ зависит от дозы препарата: по мере увеличения разовой дозы с 40 до 400 мг его всасывание снижается с 30-35% до 5-7%. Таким образом, при разовых дозах больше 130-150 мг и суточных - больше 400-450 мг не происходит существенного увеличения
поступления в организм Fe2+. Максимальное количество, способное абсорбироваться в организм за сутки, - около 100 мг. Полнота всасывания железа зависит также от степени его дефицита в организме: когда запасы в организме близки к норме, всасывается не более 3-7% Fe2+. При латентном железодефиците без анемии значение увеличивается до 15-17%, а при появлении анемии - до 25-30%. Кроме того, отмечают дозозависимое снижение абсорбции препарата в течение 4-6 ч после приёма предшествующей дозы. Всасывание препаратов железа лучше происходит натощак.
Фармакокинетика парентеральных препаратов железа
Внутривенное введение. Применяют стабильный комплекс FeOH3 с высокомолекулярным декстраном. Связь железа с декстраном отличается большой устойчивостью, поэтому ионизированное железо в плазму почти не поступает и практически не происходит насыщения трансферрина.
Внутримышечное введение. Используют комплекс FeOH3 с частично гидролизованным декстраном низкого молекулярного веса. После введения препарата происходит медленная его абсорбция из мышечной ткани, преимущественно путём лимфатического дренажа. Так, при введении FeOH3 декстрана (КосмоФер*) за 72 ч в организм попадает около 50% препарата, до 25% его остаётся в месте инъекции до 3 нед, а 5-10% - дольше.
При внутримышечном введении Fe-сорбитолового комплекса за первые 12 ч происходит всасывание около 85% препарата. Максимум концентрации Fe2+ (с почти полным насыщением трансферрина) определяют через 2-8 ч, а через 12-24 ч его первые порции уже обнаруживают в эритроцитах. До 30-40% препарата выводится за 24 ч с мочой в неизменённом виде. В течение 10 сут препарат выводится полностью.
После внутримышечного введения железо-сорбитолового комплекса (фербитол*) за 12 ч происходит всасывание до 85% препарата, 20- 30% выводится почками в неизменённом виде. Полностью препарат выводится за 20 сут.
Внутривенное введение. Используют сахарат Fe3+ (феррум лек*, фер- ковен*) - организм усваивает 90% введённого вещества, остальное выводится из организма с мочой.
После применения парентеральных препаратов железа уже через 12-24 ч первые его порции обнаруживают в эритроцитах. Однако большая часть железа для синтеза гемоглобина поступает из ферритинового комплекса (Fe2+-апоферритин) ЭПР печени, селезёнки и костного мозга, где оно депонируется после поглощения макрофагами из кровяного русла.
Краткая характеристика препаратов железа, применяемых для парентерального введения, представлена в табл. 23-14.
Таблица 23-14. Препараты железа, применяемые для парентерального введения
 Показания к примененению и режим дозирования
Показания к примененению и режим дозирования
Показания к применению:
• железодефицитные анемии;
• латентный железодефицит без анемии от чрезмерных потерь Fe (кровопотери, постоянное донорство) или при повышенной по-
требности в нём (беременность, лактация, определённые стадии лечения В12-дефицитной анемии). Относительные показания к парентеральному применению:
• анемия перед операцией в III триместре беременности;
• выраженная истинная непереносимость оральных препаратов (тяжёлые формы энтеритов, язвенных колитов, обострений язвенной болезни);
• истощение запасов Fe в организме;
• нарушения всасывания оральных препаратов (длительный, частый понос, синдром мальабсорбции);
• тяжёлые, хронические неустранимые полностью кровотечения. Расчёт суточной дозы. Минимальная суточная доза Fe должна быть
такой, чтобы всосавшаяся часть обеспечивала оптимальный среднесуточный рост гемоглобина (табл. 23-15).
Таблица 23-15. Суточные дозы Fe в зависимости от способа введения
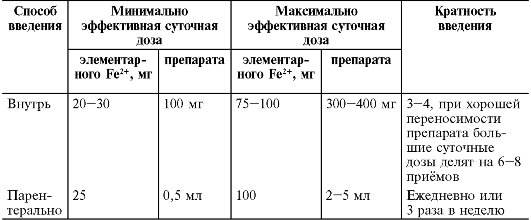 В зависимости от массы тела, пола, конституции больного обычно необходимо вводить минимум 20-30 мг Fe2+ в сутки (что можно обеспечить оральным приёмом 100 мг Fe2+).
При хорошей переносимости суточную дозу препарата постепенно
увеличивают. Подобная тактика благоприятна у больных со скоростью
эритропоэза выше средней, например 3-3,5 г/л/сут. Тогда при хорошей
переносимости необходимо вводить в организм Fe2+ в дозе 75-100 мг/сут (т.е. - 300-400 мг препарата). Если не всё абсорбировавшееся Fe2+
организм использует для эритропоэза, то оставшаяся часть уже на
начальных этапах откладывается в депо, что приводит к общему сокращению
времени лечения. Увеличивать дозу Fe2+ выше 300-400 мг/сут
бессмысленно, поскольку это не приводит к дальнейшему увеличению
абсорбции. Следовательно, минимально эффективная суточная доза
препаратов Fe2+ для взрослого - 100 мг (реже - 60-80 мг), а максимальная целесообраз-
В зависимости от массы тела, пола, конституции больного обычно необходимо вводить минимум 20-30 мг Fe2+ в сутки (что можно обеспечить оральным приёмом 100 мг Fe2+).
При хорошей переносимости суточную дозу препарата постепенно
увеличивают. Подобная тактика благоприятна у больных со скоростью
эритропоэза выше средней, например 3-3,5 г/л/сут. Тогда при хорошей
переносимости необходимо вводить в организм Fe2+ в дозе 75-100 мг/сут (т.е. - 300-400 мг препарата). Если не всё абсорбировавшееся Fe2+
организм использует для эритропоэза, то оставшаяся часть уже на
начальных этапах откладывается в депо, что приводит к общему сокращению
времени лечения. Увеличивать дозу Fe2+ выше 300-400 мг/сут
бессмысленно, поскольку это не приводит к дальнейшему увеличению
абсорбции. Следовательно, минимально эффективная суточная доза
препаратов Fe2+ для взрослого - 100 мг (реже - 60-80 мг), а максимальная целесообраз-
ная - до 300-400 мг. В этом выбор дозы зависит только от индивидуальной переносимости.
Режим дозирования и продолжительность лечения. Детям младше 6 лет предпочтительно назначать оральные препараты в виде сиропа или капель.
• Оральные препараты. Суточную дозу делят на 3-4 части так, чтобы интервал между приёмами был не менее 4 ч, а при разовой дозе 50 мг - не менее 6-8 ч. При отличной переносимости Fe большие суточные дозы делят на 6-8 приёмов. Иногда более частые приёмы меньших доз могут улучшить переносимость лечения. Препараты Fe употребляют за 1 ч до или через 2 ч после еды.
Общая продолжительность лечения оральными препаратами - минимум 2-3 мес, а нередко - до 4-6 мес (требуется время для заполнения депо). После достижения концентрации гемоглобина 120 г/л лечение продолжают ещё минимум 1,5-2 мес. После нормализации концентрации гемоглобина, особенно у лиц, плохо переносящих препараты, дозу можно уменьшить до уровня профилактической (30-60 мг/сут). При продолжающихся потерях Fe (обильные менструации) профилактический приём можно продолжать более 6 мес после того, как нормализуется концентрация гемоглобина.
• Парентеральные препараты. Перед их применением не позже чем за 2-3 сут необходимо отменить приём оральных форм. Максимальное количество вводимого Fe2+ - не более 100 мг/сут, так как большие дозы вызывают полное насыщение трансферрина плазмы, а избыток Fe2+ может оказать токсическое действие. Лучше (особенно у лиц с аллергическими реакциями в анамнезе) постепенно увеличивать разовую дозу с 25 до 100 мг ежедневно или с интервалом в несколько дней до достижения суммарной расчётной. Для внутривенного введения категорически запрещено использовать препараты, вводимые внутримышечно. Раствор вводят со скоростью не более 20-50 мг/мин (в течение 3-5 мин, а лучше - 8-10 мин), инъекции выполняют только в стационаре. Общую дозу препаратов для парентерального введения рассчитывают по специальным номограммам и формулам, учитывающим массу тела больного, степень дефицита Fe2+ (в зависимости от концентрации гемоглобина).
Побочные эффекты и противопоказания к назначению
Считают, что в пересчёте на единицу массы растворённого вещества все препараты Fe2+ обладают одинаковой токсичностью.
Препараты для приёма внутрь. Недостаток быстро всасывающихся препаратов - растворение большого числа ионов Fe2+ на коротком отрезке ЖКТ. Пролонгированные препараты (даже с большим количеством Fe2+ в суточной дозе) отличаются лучшим соотношением усвое- ние/побочные эффекты. При средней суточной дозе Fe2+ 180-200 мг примерно у 10% больных возникают побочные эффекты, ведущие к отказу от дальнейшего приёма. Наиболее частые из них - покраснение кожных покровов, тошнота, снижение аппетита вплоть до анорексии, запор (связывание ионами железа сероводорода - физиологического стимулятора моторики кишечника), реже понос, боли в эпигастральной области, кишечная колика, отрыжка.
При увеличении дозы Fe2+ до 300 мг/сут нарушения со стороны органов ЖКТ встречают в 25% случаев, возможно обострение язвенной болезни, регионального энтерита, язвенного колита. Хорошую переносимость дозы 400 мг/сут отмечают в отдельных случаях, а для детей такое количество введённого Fe2+ может оказаться фатальным.
Тактика при появлении побочных эффектов зависит от их выраженности:
• лёгкие (тошнота, незначительный дискомфорт, умеренная дисфункция кишечника) - целесообразны уменьшение дозы, приём препарата во время или сразу после еды или замена на другую соль Fe, пролонгированный препарат;
• умеренные - возможен переход на парентеральное введение препаратов;
• тяжёлые (присоединяются проявления резорбтивного действия) - дальнейшее лечение противопоказано.
Запор, понос, небольшое покраснение лица, тошнота, рвота, тём- ная моча (образование сульфида железа при приёме больших доз) требуют внимания в тех случаях, когда они продолжительны или выражены. Боли в животе или груди и глотке, особенно при глотании, наличие в стуле свежей или переваренной крови могут быть связаны с язвой или эрозией слизистой оболочки. Ранние признаки отравления Fe - понос, тошнота, боли в желудке,
кишечная колика, повторная рвота, иногда с кровью. При употреблении препаратов возможны окрашивание кала и, реже, мочи в чёрный цвет за счёт образования сульфида железа; ложноположительная реакция на скрытую кровь - проба с гваяковой настойкой (результаты бензидинового теста при этом не меняются); ложноположительный ортотолуидиновый тест; почернение зубов (образование сульфида железа в полости рта, особенно у лиц с кариесом). Длительное применение препаратов железа, особенно в больших дозах, влияет на ассимиляцию фосфора, что может вызвать у детей тяжёлый
рахит; при использовании некоторых пролонгированных препаратов (ферроградумет*) в стуле обнаруживают пористый пластик. Организм не может экскретировать избыток железа более 6 мес, поэтому при отсутствии кровопотери длительный приём препаратов железа может приводить к развитию гемосидероза.
Парентеральные препараты. При их применении возможны общие (резорбтивные) и местные побочные эффекты. Скорость выхода ионизированного Fe зависит от прочности его связи с носителем. Она меньше у сорбитола, чем у декстрана, что и определяет меньший риск применения последнего при внутривенном введении. В то же время более прочная связь способствует задержке Fe в месте инъекции, что небезопасно при внутримышечном введении.
При внутримышечном введении иногда отмечают локальную болезненность, инфильтраты; описаны местные воспалительные реакции с паховой лимфоаденопатией, болями в нижней части живота. Возможно коричневое окрашивание кожи в месте инъекции, сохраняющееся от нескольких месяцев до двух лет.
Побочные эффекты по тяжести проявлений подразделяют на:
• лёгкие - умеренная слабость, чувство прилива крови к лицу, небольшое головокружение, недомогание, лёгкая головная боль, умеренная тахикардия;
• умеренные - неприятные ощущения в мышцах, интенсивная боль в пояснице, тошнота, рвота, понос, сильная слабость и головная боль, головокружение, озноб, лихорадка, слезотечение, потливость, уртикарная сыпь, сжимающие боли в груди;
• тяжёлые - одышка, кашель, сжимающие боли в груди, выраженная тахикардия и потливость, анафилактический шок, острая сосудистая недостаточность, описаны случаи энцефалопатии с судорожным синдромом.
По частоте выявления побочные эффекты разделяют на:
• частые (их отмечают больше 5% пациентов) - чувство прилива крови к лицу, тошнота, головокружение, незначительная головная боль, вялость, разбитость, чувство несильного давления за грудиной, окклюзия вен, местная болезненность и инфильтраты;
• редкие - прочие.
Риск развития побочных эффектов значительно выше при внутривенном введении препарата, особенно методом «тотальной» дозы.
Побочные эффекты чаще возникают при первых введениях, по времени возникновения различают ранние (10-30 мин после инъекции) и поздние (1-24 ч). Позже возникают лихорадка, сыпь, болевые синдромы, артралгия, генерализованные лимфоадено-
патии, лейкоцитоз (вплоть до лейкемоидной реакции), гемолиз. Частота возникновения анафилактического шока и фатальных осложнений -1 на 4 млн инъекций. Высокие концентрации ионизированного Fe в крови способствуют преципитации белка, снижению тонуса и увеличению проницаемости мелких сосудов, разрушению эритроцитов.
Выделение Fe-сорбитолового комплекса со слюной может вызвать металлический вкус во рту или (до 3%) утрату вкусовых ощущений на 2-3 ч. Препараты могут оказывать нефротоксический эффект. Возможны лейкоцитурия, обострение мочевых инфекций. Иногда (чаще у детей) отмечают снижение иммунитета, увеличение частоты бактериальных инфекций, гемолиз при пароксизмальной гемоглобинурии. После введения больших доз FeOH3 декстрана могут возникать ложные реакции на билирубин в сыворотке. Поскольку излишки железа не выводятся из организма, риск развития гемосидероза при нарушении режима дозирования выше при парентеральном, чем при оральном, способе введения. Ранние симптомы передозировки - боль в животе, диарея, рвота (иногда с кровью), головокружение, слабость, затем возникают цианоз, спутанность сознания, симптомы гипервентиляции. Лечение передозировки. При незначительной передозировке препаратов железа необходимо сразу назначить диету, обогащённую молочными продуктами; полезно употребление сырых куриных яиц.
Специфическую терапию тяжёлых отравлений проводят дефероксамином (десферал*), препарат назначают внутрь и парентерально:
• при острых отравлениях для связывания ещё не всосавшихся из ЖКТ ионов железа - per os 5-10 г (растворяют содержимое 10- 20 ампул в воде);
• для удаления всосавшегося железа - внутримышечно 1-2 г каждые 3-12 ч;
• в случае развития шока - внутривенно капельно 1 г, проводят симптоматическую терапию.
Противопоказания к назначению препаратов железа:
• гипохромная анемия при нормальном или избыточном содержании Fe в организме;
• нарушение утилизации уже находящегося в организме Fe при нормальной или повышенной концентрации его в плазме.
Парентеральное применение железа, кроме того, противопоказано при тяжёлой коронарной недостаточности, артериальной гипертензии, аллергических заболеваниях кожи и лёгких (и при выраженной предрасположенности к ним), остром гломерулонефрите, активном пиелонефрите и гепатите, выраженных нарушениях функции печени и почек.
Сравнение и выбор препаратов железа для перорального применения Классификация препаратов железа (табл. 23-16-23-18).
• Монокомпонентные - содержат одну какую-либо соль Fe:
- содержащие Fe3+ - FeOH3 полимальтозный комплекс (маль- тофер*);
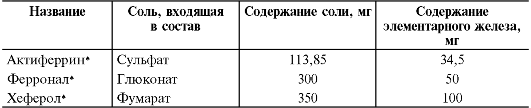
- содержащие Fe2+ - глюконат (ферронал*), сульфат (гемофер пролангатум*, актиферрин*, тардиферон*, ферроградумет*), фумарат (хеферол*), хлорид (гемофер*).
• Комбинированные - в состав кроме соли железа входит:
- аскорбиновая кислота (витамин C переводит Fe3+ в двухвалентное состояние, что способствует улучшению всасывания) - сорбифер дурулес*;
- фолиевая кислота - Мальтофер Фол* [железа (III) гидроксид полимальтозат], Гино-Тардиферон* (железа сульфат), ферретаб* (железа фумарат).
В детском возрасте (особенно младше 6 лет) предпочтительно применять препараты железа в виде сиропа (актиферрин*), капель для приёма внутрь (гемофер*), суспензии.
Таблица 23-16. Препараты железа
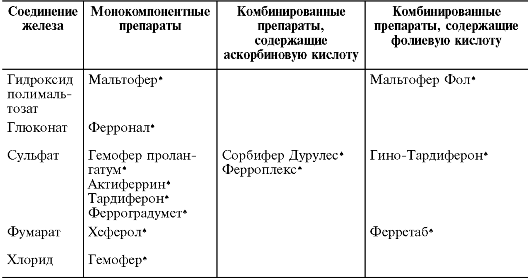 Таблица 23-17. Содержание элементарного железа в пролонгированных препаратах для орального приёма
Таблица 23-17. Содержание элементарного железа в пролонгированных препаратах для орального приёма
 Таблица 23-18. Содержание железа в препаратах для орального приёма
Таблица 23-18. Содержание железа в препаратах для орального приёма
 Взаимодействие
Взаимодействие
Ферменты поджелудочной железы в течение 1-2 ч угнетают всасывание препаратов Fe. В течение 3 ч нарушают их всасывание некоторые антациды (ионы Ca, Mg, Al, входящие в их состава, образуют с железом плохо растворимые комплексы). Аналогичным эффектом обладает колестирамин.
При одновременном приёме Fe и тетрациклинов образуются плохо всасывающиеся хелаты (в то же время 200 мг FeSO4 в течение 3 ч значительно снижают абсорбцию терапевтических доз тетрациклинов). В случае необходимости комбинации тетрациклинов с препаратами, содержащими ионы железа, последние должны быть приняты только после того, как будет достигнут максимальный уровень концентрации антибиотика в плазме крови. Аналогичным способом следует поступать при необходимости одновременного назначения пациенту препаратов железа и ципрофлоксацина, ломефлоксацина и богатых кальцием продуктов питания. Степень взаимодействия меньше при использовании препаратов Fe с энтеральным покрытием.
С другой стороны, аскорбиновая, янтарная кислота и их соли, лактоза, фруктоза, декстроза (глюкоза*), серосодержащие аминокислоты (цистеин, метионин), инозин при одновременном приёме с Fe2+ предохраняют его от окисления (перехода в Fe3+) и увеличивают всасывание. Оптимальная доза аскорбиновой кислоты, обеспечивающая наибольшее всасывание, - 200 мг на каждые 30 мг Fe2+.
Хлорамфеникол может замедлить реакцию костного мозга на ионы железа. Этанол, особенно в высоких дозах и при длительном применении, увеличивает абсорбцию и печёночное накопление Fe. Препараты железа не следует запивать чаем (с танином образуются плохо всасывающиеся соединения). Пища уменьшает всасывание Fe2+ на 30-80% (наибольшим эффектом обладают твёрдая пища, хлеб, сырые злаки, молоко и молочные продукты, мороженое, яйца, овощи).
Оценка эффективности лечения
Показатели эффективности лечения препаратами железа указаны в табл. 23-19.
При лечении первого (манифестного) этапа железодефицитной анемии контроль над количеством эритроцитов и ретикулоцитов, концентрацией гемоглобина, цветовым показателем проводят 1-2 раза в неделю. Эффект считают хорошим, если прирост гемоглобина составляет 1-2 (г/л)/сут, а эритроцитов - 0,04х1012/сут. Достижение концентрации гемоглобина 115-120 г/л - критерий ликвидации первого этапа болезни.
При лечении латентного этапа железодефицитной анемии дополнительно контролируют концентрацию сывороточного железа (после 5-7-дневного перерыва в приёме препаратов). Нормализация концентрации сывороточного железа и достижение индивидуальной нормы гемоглобина и эритроцитов - ликвидация латентного этапа.
Для выявления прелатентной фазы железодефицитной анемии необходимы более тонкие исследования, в частности тест с дефероксамином, радиоиммунное определение ферритина, определение степени абсорбции радиоактивного железа и др.
Таблица 23-19. Показатели эффективности лечения препаратами железа