Клиническая фармакология.: учебник для вузов / Под ред. В.Г. Кукеса.- 4-е издание., перераб. и доп., - 2009. - 1056 с.
|
|
|
|
ГЛАВА 3. ВЗАИМОСВЯЗЬ МЕЖДУ ФАРМАКОДИНАМИКОЙ И ФАРМАКОКИНЕТИКОЙ
Фармакологический эффект зависит от дозы ЛС. Чем выше доза ЛС, тем более выраженный (до определённого предела) эффект регистрируют. Однако эта связь - не всегда прямая и однозначная, поскольку непосредственное воздействие на чувствительные к ЛС рецепторы оказывает только связавшееся с ним ограниченное количество вещества. Это объясняет наличие тесной взаимосвязи между фармакодинамикой ЛС и их фармакокинетикой.
ОСОБЕННОСТИ ФАРМАКОКИНЕТИКИ И ФАРМАКОДИНАМИКИ КЛАССИЧЕСКИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Транспорт лекарственных веществ в организме
Рассмотрим простейшую схему транспорта ЛС в организме. При внутривенном введении, фаза всасывания отсутствует, и, следовательно, величину первичного эффекта определяет концентрация препарата в области чувствительных к нему рецепторов. Если рецепторы локализованы в органе (органах), интенсивно снабжаемом кровью, то поступление ЛС к месту его действия происходит достаточно быстро. При этом, как показали исследования, содержание ЛС в месте предполагаемого воздействия пропорционально его концентрации в плазме крови. Однако многие вещества медленно достигают органов (где производят необходимый эффект), поэтому концентрация ЛС в месте его действия и в плазме крови в начале и середине фазы распределения существенно различается. Постепенно это соотношение изменяется, а к концу фазы распределения определяют равновесие концентраций ЛС в плазме крови и в соответствующем органе. Считают, что в этот период содержание препарата в плазме крови действительно отражает его фармакологический эффект.
Содержание ЛС в организме зависит не только от дозы, его определяют процессы всасывания и распределения, биологической трансформации (метаболизма) и выведения. Цепочка включения биологических реакций характеризует фармакодинамические этапы взаимодействия вещества и организма. При этом при повышении концентрации, ЛС может производить не только требуемый эффект (на
определённый орган), но и действовать на другие молекулы-мишени, вызывая развитие нежелательных лекарственных реакций. Примеры фармакодинамических эффектов ЛС, наблюдаемых при приёме различных концентраций ЛС (исключены FDA из регистрационного списка вследствие высокой вероятности развития опасных для жизни нежелательных лекарственных реакций, особенно при употреблении больших доз данных препаратов) приведены в табл. 3-1.
Таблица 3-1. Фармакодинамические эффекты различных доз некоторых лекарственных средств (регистрировали различные концентрации веществ в плазме крови)
 Полагают,
что начало действия ЛС совпадает с моментом достижения такой его
концентрации, при которой наблюдают величину максимального эффекта,
равную 50% (ЕД50). Интервал концентраций лекарственного
вещества от минимальной терапевтической дозы до такого количества
препарата, при котором отмечают появление первых признаков
положительного действия, называют терапевтическим диапазоном (синонимы:
«коридор безопасности», «терапевтическое окно»). Отношение величин
верхней и нижней границ терапевтического диапазона представляет
терапевтическую широту ЛС, средним терапевтическим уровнем можно считать
середину терапевтического диапазона. Чем шире терапевтический диапазон,
тем реже отмечают развитие побочных эффектов ЛС и тем большую
возможность изменения дозы препарата имеет врач (например, при
назначении фуросемида или бензилпенициллина).
Полагают,
что начало действия ЛС совпадает с моментом достижения такой его
концентрации, при которой наблюдают величину максимального эффекта,
равную 50% (ЕД50). Интервал концентраций лекарственного
вещества от минимальной терапевтической дозы до такого количества
препарата, при котором отмечают появление первых признаков
положительного действия, называют терапевтическим диапазоном (синонимы:
«коридор безопасности», «терапевтическое окно»). Отношение величин
верхней и нижней границ терапевтического диапазона представляет
терапевтическую широту ЛС, средним терапевтическим уровнем можно считать
середину терапевтического диапазона. Чем шире терапевтический диапазон,
тем реже отмечают развитие побочных эффектов ЛС и тем большую
возможность изменения дозы препарата имеет врач (например, при
назначении фуросемида или бензилпенициллина).
Терапевтический индекс - показатель, равный отношению средней летальной и средней терапевтической дозы (LD50/ED50).Чем больше величина терапевтического индекса, тем безопаснее ЛС.
После однократного приёма препарата регистрируют постепенное увеличение концентрации ЛС в плазме крови. После достижения мак-
симального значения, отмечают снижение концентрации лекарственного вещества в крови. Выраженный терапевтический эффект возникает только при установлении концентрации ЛС в плазме крови в пределах терапевтического диапазона. Эффект сохраняется до тех пор, пока кривая, отражающая зависимость концентрации ЛС от времени, не опустится ниже минимального терапевтического значения. Таким образом, чем дольше концентрацию лекарственного вещества поддерживают в пределах терапевтического диапазона, тем продолжительнее будет фармакологический эффект. Простейший способ продления фармакологического действия препарата - увеличение дозы лекарственного вещества (в пределах регламентированных инструкцией колебаний). Однако возможности этого способа ограничены: при использовании дозы ЛС, превышающей значение верхней границы терапевтического диапазона, нередко отмечают возникновение побочных эффектов. Следовательно, величину первичного эффекта определяет концентрация ЛС в области чувствительных к нему рецепторов и их состояние. Если рецепторы распложены в органах, интенсивно перфузируемых кровью, а обмен ЛС между органом и кровью происходит достаточно быстро, то, как показали исследования, концентрация препарата в области рецепторов будет пропорциональна его концентрации в плазме крови. При этом величина фармакологического эффекта также пропорциональна концентрации ЛС в плазме крови. В свою очередь, концентрация ЛС в плазме крови, как правило, зависит от введённой дозы.
В некоторых случаях наблюдают значительные индивидуальные различия чувствительности к ЛС, причём средние значения границ терапевтического диапазона не имеют большого значения для индивидуализации терапии. К таким ЛС относят многие β-адреноблокаторы.
Образование активных метаболитов - ещё один фактор, нередко осложняющий выбор дозы для установления терапевтического диапазона (см. главу 1 «Клиническая фармакокинетика»). В данном случае необходимо определить концентрацию в плазме крови не только лекарственных веществ, но также и метаболитов. Однако эффекты метаболитов нередко отличаются от действия исходного ЛС; это осложняет процедуру анализа границ терапевтического диапазона.
Знание границ терапевтического диапазона и фармакокинетических параметров ЛС позволяют рассчитать режим его дозирования, обеспечивающий поддержание средней концентрации препарата в необходимых пределах. Например, нередко у пациента регистрируют значительное снижение клиренса (по сравнению с его средним значением в популяции) ЛС. Такому больному назначают пропорционально
более низкую поддерживающую дозу препарата (для предотвращения развития побочных эффектов).
В то же время при укорочении периода полувыведения ЛС следует обеспечить более частый приём препарата, в противном случае лечение может быть неэффективным.
При многократном применении ЛС через 5-7 периодов полувыведения регистрируют стационарную концентрацию вещества. Контроль стационарной концентрации у конкретного пациента называют терапевтическим лекарственным мониторингом. При значительном отклонении данного показателя от терапевтического уровня производят индивидуальную коррекцию дозы ЛС. Цель проведения терапевтического лекарственного мониторинга - повышение эффективности и безопасности применения ЛС.
Причины выполнения терапевтического лекарственного мониторинга
• Узкая терапевтическая широта ЛС.
• Невозможность достижения терапевтического эффекта при использовании известных схем дозирования препаратов.
• Эффективность и безопасность лекарственного вещества сложно оценить с помощью клинических методов.
• Уровень ЛС в плазме крови достоверно коррелирует с эффектами препарата
• Концентрация препарата в плазме крови свидетельствует о повышении вероятности возникновения нежелательных лекарственных реакций.
• При наличии индивидуальных особенностей пациента или патологии наблюдают изменение фармакокинетики ЛС, снижение эффективности лечения, а также повышение риска развития нежелательных лекарственных реакций.
• Необходимость длительного применения лекарства. Использование аминогликозидов при почечной недостаточности
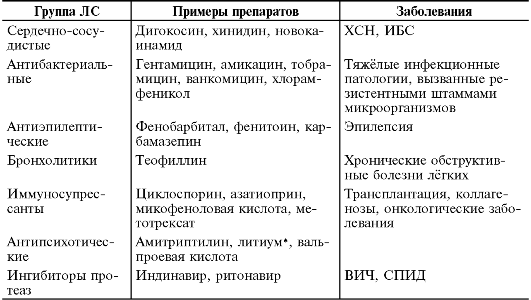
или назначение новокаинамида (как препарата с узким терапевтическим диапазоном) - ситуации, требующие обязательного проведения терапевтического лекарственного мониторинга (табл. 3-2). Если в процессе лечения необходимо использовать пролекарства, то терапевтический лекарственный мониторинг не выполняют (как правило, фармакологические эффекты пролекарств не зависят от их концентрации). Например, нуклеозидные ингибиторы обратной транскриптазы трансформируются в активную форму путём внутриклеточного фосфорилирования. Внутриклеточная концентрация активной формы вещества напрямую влияет на фармакодинамику препарата, но техническая возможность мониторинга в массовом порядке в настоящий момент невозможна.
Таблица 3-2. Основные группы лекарственных средств, назначаемых в сочетании с терапевтическим лекарственным мониторингом
 Правильный
выбор фармакокинетического критерия для проведения терапевтического
лекарственного мониторинга до сих пор представляет определённую
проблему. Даже для препаратов, давно внедрённых в клиническую практику,
существуют проблемы при выборе оптимального критерия для мониторинга. До
сих пор не известно, какой из фармакокинетических параметров наилучшим
образом отражает отдалённый ответ человеческого организма на
антиретровирусную терапию. Например, как показали результаты
исследований, проведённых некоторыми авторами, клинические эффекты
протеазных ингибиторов зависят от длительности их применения; при этом
показатель минимальной концентрации (Сmin) - наиболее
объективный параметр вирусного ответа. В то же время внедрение концепции
фармакокинетического-фармакодинамического анализа при оценке
эффективности антибактериальных средств, позволило выделить две большие
группы препаратов, антимикробный эффект которых зависит от концентрации
вещества в плазме крови или от времени экспозиции бактерий в среде с
минимальной ингибирующей концентрацией. Активность аминогликозидов и
фторхинолонов как антибиотиков, относящихся к первой группе, отражает
максимальная концентрация (Сmах). При использовании
β-лактамных антибактериальных препаратов важно время подержания
минимальной ингибирующей концентрации в крови. Другими словами,
рациональная антибиотикотерапия и стратегия дозирования с помощью
терапевтического лекарственно-
Правильный
выбор фармакокинетического критерия для проведения терапевтического
лекарственного мониторинга до сих пор представляет определённую
проблему. Даже для препаратов, давно внедрённых в клиническую практику,
существуют проблемы при выборе оптимального критерия для мониторинга. До
сих пор не известно, какой из фармакокинетических параметров наилучшим
образом отражает отдалённый ответ человеческого организма на
антиретровирусную терапию. Например, как показали результаты
исследований, проведённых некоторыми авторами, клинические эффекты
протеазных ингибиторов зависят от длительности их применения; при этом
показатель минимальной концентрации (Сmin) - наиболее
объективный параметр вирусного ответа. В то же время внедрение концепции
фармакокинетического-фармакодинамического анализа при оценке
эффективности антибактериальных средств, позволило выделить две большие
группы препаратов, антимикробный эффект которых зависит от концентрации
вещества в плазме крови или от времени экспозиции бактерий в среде с
минимальной ингибирующей концентрацией. Активность аминогликозидов и
фторхинолонов как антибиотиков, относящихся к первой группе, отражает
максимальная концентрация (Сmах). При использовании
β-лактамных антибактериальных препаратов важно время подержания
минимальной ингибирующей концентрации в крови. Другими словами,
рациональная антибиотикотерапия и стратегия дозирования с помощью
терапевтического лекарственно-
го мониторинга должна быть направлена либо на увеличение Сmaxдо верхней границы терапевтического интервала, либо на максимально длительное поддержание пороговой концентрации ЛС между интервалами его введения. Сmax гентамицина (составляет 10 мг/л); применение такой дозы позволяет достичь наилучшего бактерицидного эффекта. При использовании традиционной схемы дозирования препарата (1,5 мг/кг 3 раза в сутки) подобной пиковой концентрации не регистрируют. В то же время при назначении препарата в дозе 5-7 мг/кг 1 раз в сутки существует возможность превышения дозы Стах, равной 10 мг/л. При применении ванкомицина, напротив, стараются поддерживать минимальную (5-10 мг/л) его концентрацию (trough). Такая минимальная концентрация ванкомицина в 2-4 раза превышает МИК. Для правильного терапевтического лекарственного мониторинга необходимы чёткие количественные критерии фармакокинетического параметра с установленными референтными интервалами. При выборе терапевтического лекарственного мониторинга обращают внимание на физико-химические свойства веществ, входящих в состав готовой лекарственной формы и обусловливающих характер взаимодействия с биологическим объектом.
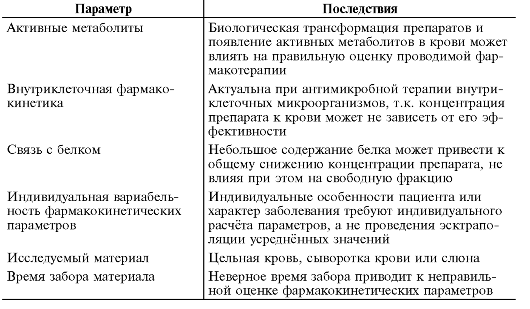
Материалом для терапевтического лекарственного мониторинга обычно служит цельная кровь или её плазма. Если получение крови затруднено, то для определения несвязанной фракции препарата используют слюну. На результаты исследований, несомненно, влияет время получения материала, в том числе интервалы между точками забора. При анализе важно установить взаимоотношение между эффектами препарата и его концентрацией в плазме крови. Уровень Сmin некоторых препаратов измеряют по точкам в конце интервала дозирования (противоэпилептические средства), для антибиотиков определяют пиковые значения и время их нахождения в области, расположенной выше минимальной ингибирующей концентрации (табл. 3-3).
Правильное время забора образцов - очень важный практический пункт терапевтического лекарственного мониторинга, так как неверный расчёт приводит к возникновению ошибок в анализе и снижению эффективности данного метода. При длительном лечении образцы крови получают с момента достижения равновесной концентрации препарата, то есть по прошествии примерно четырёх периодов полувыведения. В общем, минимальную концентрацию (trough) измеряют в образце, полученном за полчаса до введения следующей поддерживающей дозы.
Таблица 3-3. Некоторые ключевые факторы, влияющие на интерпретацию результатов терапевтического лекарственного мониторинга
 Особенности
фармакокинетики каждого конкретного препараты существенно влияют на
стратегию терапевтического лекарственного мониторинга. При длительном
лечении нельфинавиром® концентрация препарата в плазме (из-за
отсроченной абсорбции) может снижаться еще в течение двух часов после
очередного приёма лекарства. Поэтому невозможно точно определить Сmin на протяжении всего периода лечения (необходимо учитывать при интерпретации результатов).
Особенности
фармакокинетики каждого конкретного препараты существенно влияют на
стратегию терапевтического лекарственного мониторинга. При длительном
лечении нельфинавиром® концентрация препарата в плазме (из-за
отсроченной абсорбции) может снижаться еще в течение двух часов после
очередного приёма лекарства. Поэтому невозможно точно определить Сmin на протяжении всего периода лечения (необходимо учитывать при интерпретации результатов).
У препаратов, характеризующихся коротким периодом полувыведения, мониторинг осуществляют по Сmax, так как минимальные концентрации определить нельзя. У рифампицина период полувыведения составляет 1-4 ч, а пиковую концентрацию обнаруживают через два часа. Но если пациенты страдают мальабсорбцией или всасывание замедлено по другим причинам, то только повторные заборы крови, проводимые каждые шесть часов, позволяют правильно определить пиковую концентрацию.
Объём распределения вещества также влияет на правильную интерпретацию данных. При назначении дигоксина терапевтический лекарственный мониторинг выполняют наиболее часто. Необходимо помнить, что распределение дигоксина в организме - длительный процесс, и, следовательно, при выполнении преждевременного теста определяют повышенную концентрацию, а не равновесную (Css составляет 8-2 мг/л через шесть часов после введения).
Конечная цель терапевтического лекарственного мониторинга - создание минимальной эффективной концентрации препарата в крови путём подбора дозы. Очень трудно правильно скорректировать дозу лекарственного вещества без терапевтического лекарственного мониторинга, особенно при проведении длительной терапии с использованием, например, иммуносупрессантов (или при лечении больных, которым постоянно производят гемодиализ). Непрерывная инфузия антисинегнойных β-лактамных антибиотиков - один из самых рас- пространённых в настоящее время методов лечения респираторных обострений муковисцидоза. Назначение адекватной дозы препарата позволяет создать концентрацию ЛС в крови, в 4-5 раз превышающую минимальную пиковую концентрацию. При проведении исследований обнаружили, что значения объёма распределения и общего клиренса β-лактамов (за счёт почечного компонента) у пациентов, страдающих муковисцидозом, нередко превышают величины данных показателей, измеренных у здоровых субъектов. Введение высоких доз антибактериальных препаратов позволяет обеспечить диффузию в гнойные полости лёгких лекарственного вещества, а также его проникновение через слизистый барьер, окружающий микроколонии Pseudomonas spp. Введение суточной дозы цефтазидима , составляющей 100 мг/кг (используют при проведении инфузионной терапии), позволяет достигать средней концентрации препарата в крови не менее 29 мг/л (это в 7 раз выше значения минимальной пиковой концентрации для синегнойной палочки). Однако при муковисцидозе общая концентрация цефтазидима, определяемая в плазме крови, вдвое ниже, чем у здоровых добровольцев.
Таким образом, изменение дозы ЛС не приводит к значительному изменению фармакокинетических процессов и выраженности фармакологических эффектов. С другой стороны, «слепой» подбор препарата (с узким терапевтическим диапазоном) повышает вероятность возникновения нежелательных лекарственных реакций (в особенности у больных с нарушением функций печени и почек) и делает терапевтический лекарственный мониторинг незаменимой для подбора адекватного режима дозирования процедурой.
Правильное применение терапевтического лекарственного мониторинга представляет не просто механическое измерение концентрации ЛС. Терапевтический лекарственный мониторинг подразумевает проведение динамического наблюдения, начиная с введения первой дозы препарата, а также оценку результатов исследований (с учётом конкретного заболевания), индивидуальных особенностей и сопутствующей терапии. При интерпретации данных необходимо принимать во внимание соотношение времени забора образцов и дозы препарата,
достижение равновесной концентрации и наблюдаемые на фоне лечения клинические эффекты. По результатам терапевтического лекарственного мониторинга проводят подбор дозы, позволяющей получить оптимальное соотношение эффективности и безопасности.
Пациенту с нарушениями функций почек необходимо назначать только полностью (или, в крайнем случае, большей частью) выводящиеся с мочой в неизменённом виде лекарства. Применение других препаратов (даже в терапевтической дозе) может привести к накоплению лекарственных веществ в организме и развитию токсических реакций. Поэтому при снижении креатининового клиренса необходимо уменьшить дозу ЛС, чтобы равновесные концентрации применяемого препарата в крови больного, страдающего почечной недостаточностью и в крови пациента с нормальной функцией почек, выровнялись. Режим дозирования ЛС при снижении клиренса креатинина разработан практически для всех препаратов и указан в соответствующих справочниках и инструкциях к применению.
При заболеваниях печени корректируют дозы ЛС, биотрансформирующихся в печени. Необходимо учитывать, что изменение клиренса ЛС при циррозе или гепатите может уменьшаться или увеличиваться. Однако степень изменений невозможно рассчитать или предсказать по результатам обычных измерений функций печени. Как показали исследования, при значительном снижении печёночного кровотока всегда отмечают уменьшение клиренса ЛС в 2-5 раз. Поэтому косвенное определение печёночного кровотока позволяет предположить возможный характер изменения клиренса ЛС. Оценка клинической реакции и определение концентрации лекарственного препарата в плазме крови - наиболее достоверный метод оценки степени изменений печени.
При остром и хроническом нарушении кровообращения обнаруживают снижение перфузии кровью тканей, уменьшение кровотока в печени и почках, приводящее к снижению клиренса ЛС и накоплению их в организме. При заболеваниях печени нередко регистрируют изменение соотношения венозного и артериального обмена (венозный обмен более интенсивный). Учитывая данный факт, концентрация ЛС в артериальной крови, определяемая в первые дни применения, невысока. С течением времени отмечают постепенное повышение уровня ЛС (при этом нередко развиваются токсические реакции). При изучении рецепторов обнаружили степень изменения их функционального состояния в условиях гипоксии, а также невозможность прогнозирования развивающихся фармакологических эффектов препаратов.
Особое внимание необходимо уделить вопросу фармакотерапии болевых синдромов. При боли наблюдают уменьшение адсорбции ве-
Таблица 3-4. Особенности терапевтического лекарственного мониторинга, проводимого при использовании некоторых наиболее распространённых лекарственных средств
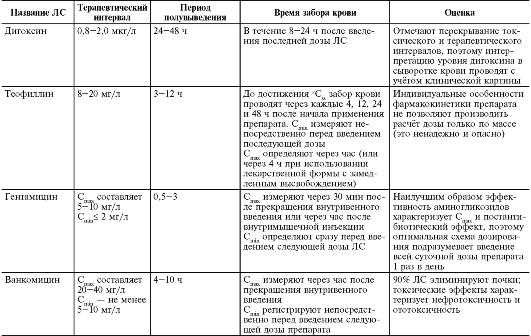 Окончание табл. 3-4
Окончание табл. 3-4
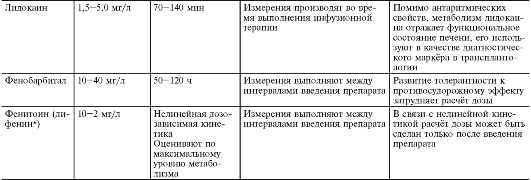 xCss - равновесная концентрация.
xCss - равновесная концентрация.
ществ и объёма венозной крови во внутренних органах; поступление в системное кровообращение ЛС, применяемых внутрь, также снижено, а следовательно, фармакологический ответ может отсутствовать.
При заболеваниях, связанных с развитием гипоальбуминемии при поражении печени и почек, регистрируют снижение связывания ЛС (особенно кислых и нейтральных) и повышение концентрации свободной их фракции. При этом возрастает вероятность возникновения токсических реакций. Для предотвращения развития побочных эффектов дозу ЛС, связывающихся с белком в плазме крови более чем на 85%, уменьшают (см. главу 1 «Клиническая фармакокинетика»).
Таблица 3-5. Терапевтический диапазон лекарственных средств
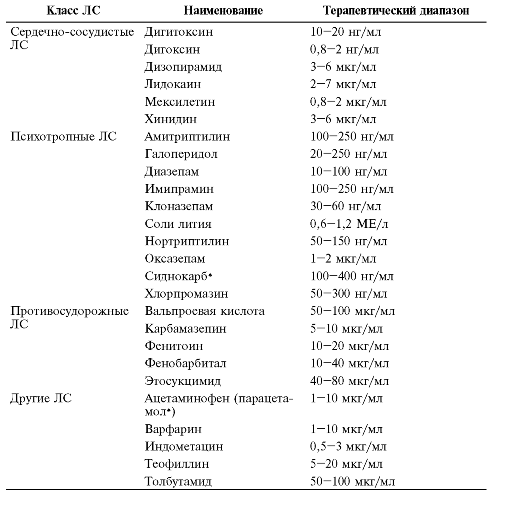 Индивидуальные
и средние границы терапевтического диапазона некоторых ЛС сравнительно
мало отличаются друг от друга. Это позволяет назначать дозы препаратов в
соответствии со значениями средних границ (для индивидуализации
терапии).
Индивидуальные
и средние границы терапевтического диапазона некоторых ЛС сравнительно
мало отличаются друг от друга. Это позволяет назначать дозы препаратов в
соответствии со значениями средних границ (для индивидуализации
терапии).
Определение границ терапевтического диапазона ЛС и оценка средних значений фармакокинетических параметров на стадии разработки препаратов позволяют рассчитать режим дозирования, обеспечивающий поддержание средней концентрации ЛС в пределах значений терапевтического диапазона. Проблему индивидуализации терапии сводят к расчёту режима дозирования в соответствии со значениями фармакокинетических параметров ЛС у конкретных больных.
Таким образом, основная задача фармакокинетики и фармакодинамики заключается в составлении обоснованных рекомендаций в отношении режимов назначения ЛС, величины поддерживающих доз и периодичности приёма. Данные рекомендации, как правило, обеспечивают быстрое достижение и длительное поддержание концентрации ЛС в пределах терапевтического диапазона.
ОСОБЕННОСТИ ФАРМАКОКИНЕТИКИ И ФАРМАКОДИНАМИКИ ИММУНОБИОЛОГИЧЕСКИХ ПРЕПАРАТОВ
Поиск новых ЛС, обладающих принципиально иными механизмами действия, обусловлен ограниченной эффективностью препаратов, созданных путём традиционного химического синтеза. Об этом свидетельствуют эпидемиологические данные, указывающие на отсутствие позитивных изменений уровня и структуры смертности в популяции на протяжении последних десятков лет. Разработка ЛС с применением биотехнологий - одно из главных достижений современной фармакологии и фармации. Биотехнологии подразумевают использование микроорганизмов, растений и животных для получения требуемых субстанций. Биотехнология - научная дисциплина, объединяющая физику, химию и биологию. С другой стороны, биотехнология -от- расль производства, реализующая научные разработки в промышленных масштабах. Раздел биотехнологии, относящийся к биофармацевтике, занимается изучением и созданием биологических продуктов, обладающих терапевтическим потенциалом. FDA разделяет понятия классических лекарств и иммунобиологических препаратов и определяет последние как вирусы, токсины, антитоксины, препараты плазмы крови и их аналоги, используемые для профилактики и лечения заболеваний и травм у человека. К основным биотехнологическим приё-
мам, актуальным для фармакологии и фармации, относят микробиологический синтез, генную инженерию и клеточную инженерию.
Первым биотехнологическим продуктом, совершившим революцию не только в фармакологии, но и в клинической медицине, стал пенициллин, полученный в 1940 г. в культуре плесневых грибков рода Penicillium. Инсулин - первый генно-инженерный препарат, дошедший до стадии промышленного производства. В 1982 г. компания «Эли Лили» начала производство рекомбинантного инсулина (хумули- на*), в процессе получения которого в клетку микроорганизма (E. coli) встраивали молекулу человеческой ДНК, отвечающей за синтез инсулина. Достижения клеточной инженерии позволяют создавать ЛС, применяя не только клеточные культуры прокариотических и эукариотических клеток, а также используя трансгенных животных. Например, разработка технологии производства гуманизированных моноклональных антител, производимых путём слияния фрагментов мышиных и человеческих антител, позволила компании «Хоффман Ля Рош» в 2004 г. впервые зарегистрировать (для клинического применения) и начать промышленный выпуск ингибитора ангиогенеза - препарата бевацизумаб (авастин*), назначаемого при терапии колоректального рака.
Место иммунобиологических препаратов в современной медицине Область применения уже зарегистрированных, например, в США, иммунобиологических препаратов характеризуется широчайшим спектром таких жизнеугрожающих состояний, как ВИЧ, злокачественные новообразования различной локализации, рассеянный склероз, неспецифический язвенный колит, ревматоидный артрит и многие другие тяжёлые заболевания. Лишь 8% препаратов, полученных традиционными способами и дошедших до стадии клинических испытаний в период с 1996 по 1998 г., попали на рынок. Этот показатель, опре- делённый для иммунобиологических препаратов, составил 37% (за тот же период времени). В 2004 г. в стадии разработки находилось 324 ЛС, а в 2006 г. - уже 418. При этом список иммунобиологичесих препаратов, разрешённых к применению FDA, также расширился со 108 препаратов до 150. К 2010 г. почти половина всех новых ЛС будут принадлежать к группе иммунобиологических препаратов. Увеличение объёма использования иммунобиологических препаратов сопровождается значительным ростом затрат на лечение. Применение только препарата ремикейд* (при ревматоидном артрите) составляет примерно 15 000 долларов в год. Поэтому в начале 2000 г. разработали стратегию по разработке и внедрению так называемых биодженериков (воспроизведённые ЛС). Последовательное выполнение предписаний позволит сбалансировать затраты и обеспечить доступность высоких технологий для значительного количества пациентов.
Таблица 3-6. Примеры доступных для пациентов с 2004-2006 гг. биотехнологических препаратов
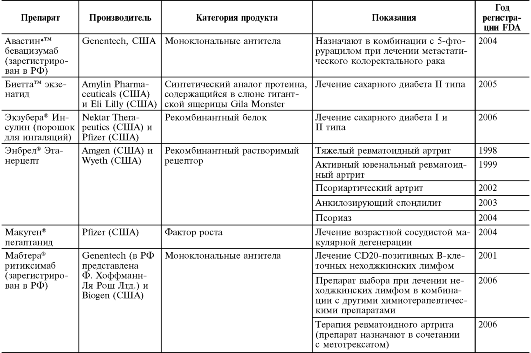 ОБЩАЯ ХАРАКТЕРИСТИКА ФАРМАКОКИНЕТИКИ И ФАРМАКОДИНАМИКИ ИБП
ОБЩАЯ ХАРАКТЕРИСТИКА ФАРМАКОКИНЕТИКИ И ФАРМАКОДИНАМИКИ ИБП
Исследования в области продуктов биотехнологий привели к трансформации классических взглядов на фармакокинетику и фармакодинамику.
Иммунобиологические препараты
• Продукты, получаемые из донорской крови.
• Вакцины.
• Белки человеческого, животного и растительного происхождения.
• Рекомбинанты, включая моноклональные антитела, цитокины и факторы роста.
• Нуклеиновые кислоты.
• Генотерапевтические препараты.
Изучение иммунобиологических препаратов проводят с использованием основных принципов фармакокинетики и фармакодинамики. Основные различия между продуктами химического синтеза и биотехнологическими ЛС заключаются, прежде всего, в строении данных веществ. Иммунобиологические субстанции - почти всегда белки; отличаются от традиционных синтетических соединений высокой молекулярной массой. С другой стороны, структура иммунобиологических препаратов, как правило, идентична строению эндогенных субстанций (дополнительное отличие иммунобиологических препаратов от классических ЛС). Обнаружение подобных различий требует разработки новых методов фармакокинетического и фармакодинамического исследований, а также создания аналитических методик и внесения изменений в стандартные протоколы дополнительных клинических испытаний.
Особенности фармакокинетики ИБП
Для клинического применения созданы препараты для внутривенного введения. Это обусловлено строением и низкой системной биодоступностью иммунобиологических препаратов при приёме внутрь. Например, в клинической практике широко используют такие рекомбинанты (пептиды), как тканевый активатор плазминогена (алтеплаза) и эритропоэтин* (эпоэтин) для внутривенного введения. В определённых ситуациях (как правило, если цель терапии - создание равновесной концентрации) назначают подкожные или внутримышечные инъекции (инсулин длительного действия). При этом адсорбция в кровоток крупных молекул (величиной более 16 кДа) происходит через лимфатические сосуды, а молекулы меньшего размера проникают через кровеносные сосуды. Данный факт особенно важен при необходимости достижения высоких локальных концентраций
Таблица 3-7. Основные отличия биотехнологических препаратов от лекарственных средств, полученных традиционными путями
 в
лимфатической системе. Так, назначение подкожных инъекций (в
амбулаторных условиях) рекомбинантных пептидов интерлейкина- 2 и
α-интерферона-2а при метастатическом раке почки производит благоприятный
эффект, равный по величине агрессивной внутривенной терапии, проводимой
в стационаре. Разработан инновационный путь введения
иммунобиологических препаратов - ингаляционный.
в
лимфатической системе. Так, назначение подкожных инъекций (в
амбулаторных условиях) рекомбинантных пептидов интерлейкина- 2 и
α-интерферона-2а при метастатическом раке почки производит благоприятный
эффект, равный по величине агрессивной внутривенной терапии, проводимой
в стационаре. Разработан инновационный путь введения
иммунобиологических препаратов - ингаляционный.
В 2006 г. впервые зарегистрировали рекомбинантный препарат инсулина (экзубер) для ингаляционного применения, характеризующийся быстрым наступлением эффекта и коротким периодом действия (по сравнению с традиционным инсулином).
Необходимо отметить влияние пути введения на выраженность иммуногенных свойств белковых препаратов. Внутрисосудистое введение - более слабый стимул для иммунной реакции на препарат, чем подкожные инъекции (объясняют образованием агрегатов в месте укола).
Характер распределения иммунобиологических препаратов в организме также обладает рядом отличительных особенностей. Прежде всего, объём распределения иммунобиологических препаратов практически равен объёму внеклеточного пространства (в связи с низкой липофильностью и крупной молекулярной массой веществ). В результате проблемы аккумуляции в тканях и длительного выведения для иммунобиологических препаратов не существует. При внутривенном введении распределение ограничивают два пространства (компартмента) - внутрисосудистое и интерстициальное пространство тканей с хорошей перфузией (почки и печень) и интерстициальное пространство тканей с плохой перфузией (кожа). Например, объём распределения α-эпоэтина составляет 0,59 кг/л, у тенектеплазы показатель достигает 4,2-6,3 л (в целом приравнивают к объёму плазмы, составляющему 3-8 л, в пересчёте на 70 кг).
В отличие от классических препаратов, распределение, элиминация и фармакодинамика иммунобиологических препаратов тесно связаны между собой. Небольшой объём распределения не свидетельствует о низких концентрациях препарата в периферических тканях, так как прохождение через билипидные мембраны даже гидрофильных соединений может быть опосредовано специфическими рецепторами и переносчиками.
Традиционный двухфазный путь биологической трансформации в печени, свойственный классическим препаратам, в данной ситуации менее актуален. Компоненты ретикуло-эндотелиальной системы и купфферовские клетки - ключевые эффекторные структуры, определяющие фармакокинетические процессы иммунобиологических препаратов в печени. Поэтому, например, исследования взаимодействия иммунобиологических препаратов на уровне цитохрома Р-450 не проводят.
Роль традиционных неметаболических способов элиминации иммунобиологических препаратов зависит от размера молекулы. Если размер молекулы не превышает 60 кДа, то путь выведения интерлей- кина-2, моноцитарного фактора роста, интерферона-α - ренальная экскреция. Обычно после фильтрации и реабсорбции происходит
гидролиз белка до аминокислот (существуют различные механизмы). Молекулы типа тканевого активатора плазминогена попадают в гепатоциты за счёт рецептор-опосредованного транспорта. Печёночный клиренс небольших молекул обеспечивает работа соответствующих ферментов (после захвата гепатоцитами и протеолиза).
В процессе биологической трансформации и элиминации участвуют разнообразные пептидазы и протеазы, обеспечивающие клиренс белков; причём скорость деградации иногда превосходит показатель сердечного выброса (3-5 л/мин). Возможность введения посредством взаимодействия с клеточной мишенью - характерная фармакокинетическая особенность иммунобиологических препаратов. Если число таких мишеней сравнимо с количеством молекул иммунобиологических препаратов, то данный путь утилизации может играть доминирующую роль. Подобный способ элиминации не является органоспецифическим и может происходить практически везде. Более того, данный факт подтверждает взаимозависимость процессов фармакокинетики и фармакодинамики. В то время как в традиционной ситуации концентрация ЛС зависит от фармакокинетических характеристик и определяет выраженность эффекта, процессы превращения иммунобиологических препаратов одновременно подчиняются зависимости концентрация-эффект, числу фармакологических мишеней и выраженности внутриклеточных процессов. Нелинейная фармакокинетика иммунобиологических препаратов, требующая особого подхода к подбору доз - следствие подобных закономерностей.
Особенности фармакодинамики ИБП
Пути развития определённого специфического биологического ответа в организме, вызванного введением иммунобиологических препаратов.
• Нейтрализация терапевтической мишени.
• Активация рецептора.
• Доставка токсинов к специфическим клеткам.
• Структурное и функциональное модулирование терапевтической мишени.
С одной стороны, концентрация иммунобиологических препаратов в области рецептора определяет выраженность фармакологического эффекта и характеризуется линейной зависимостью; с другой, фармакологические модели описывают более сложные соотношения между концентрацией и эффектом. Учитывая особые свойства иммунобиологических препаратов, одновременный фармакокинетический и фармакодинамический анализ позволил обнаружить парадоксальные взаимоотношения концентрация-эффект.
Как показали сравнительные исследования фармакокинетики инсулина при различных способах введения, существуют чётко опре- делённые различия фармакодинамических процессов (концентрация глюкозы - суррогатный биологический маркёр). Фармакокинетические кривые разных форм инсулина не одинаково пропорциональны колебаниям степени гликемии. Однако если анализ проводят с учё- том фармакокинетических особенностей препаратов, то регистрируют сходство динамики глюкозы. Другими словами, адекватный подбор схем дозирования иммунобиологических препаратов возможен только при комплексной оценке фармакокинетики и фармакодинамики.
ТЕРАПЕВТИЧЕСКИЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА
За открытие моноклональных антител в 1984 г. Ц. Мильштейн и Г. Кёлер получили нобелевскую премию. Предполагают, что основу половины всех активных субстанций (разработанных в течение следующих 10-15 лет) составит исследование моноклональных антител. Моноклональные антитела активны в отношении специфических антигенов. О перспективах применения в клинической практике свидетельствует успех препаратов ремикейда* (инфликсимаба) и мабтеры* (ритуксимаба), назначаемых для лечения ревматоидного артрита и рака, соответственно.
Таблица 3-8. Виды терапевтических моноклональных антител (МАТ)
Тип моноклональных антител | Препарат | Производитель |
Мышиные Химерные Гуманизированные Человеческие | Муромонаб (Orthoclone) Ритуксимаб (Rituxan) Алемтузумаб (Campath) Адалимумаб (Humira) | OrtoBiotech Biogen-Genetech Genezyme Abbott |
Первые моноклональные антитела были получены путём иммунизации мышей определённым антигеном, дальнейшим выделением В-лимфоцитов и получением гибридомных клеток, продуцирующих специфические иммуноглобулины. Проблему высокой иммунореактивности данного типа препаратов решили созданием химерных молекул: с помощью рекомбинантных технологий производили замену Fv-фрагмента мышиного антитела человеческим. В дальнейшем содержание мышиного компонента в моноклональных антителах снизили до 5-10%; это позволило создать гуманизированные моноклональные антитела. Учёные предполагали, что развитие резистентности к моноклональным антителам будет полностью преодолено с внедрением человеческих антител. В 2002 г. зарегистрировали полностью чело-
веческий препарат моноклональных антител - адалимумаб (humira*), используемый против фактора некроза опухоли.
Биологические эффекты, стимулируемые применением моноклональных антител
• Цитотоксичность, опосредованная NK-клетками моноклональных антител.
• Комплементзависимая цитотоксичность.
• Нейтрализация экзотоксинов и вирусов.
• Образование мембран-атакующего комплекса.
• Опсонизация.
• Агглютинация микроорганизмов.
Для успешной реализации эффектов моноклональные антитела должны обладать высокой аффинностью (во избежание формирования перекрёстных реакций). Клеточные мишени также должны быть высокоспецифичны (например, для злокачественных клеток опре- делённого типа), а сами антигенные участки - гомогенны.
Эффективная фармакотерапия подразумевает анализ фармакокинетических и фармакодинамических свойств моноклональных антител, описываемых нелинейными моделями, и требует разработки подробного описания конкретного препарата.
РЕКОМБИНАНТНЫЕ ВАКЦИНЫ
Успех профилактической работы в области инфекционных заболеваний продемонстрировал важность выполнения превентивных мер для увеличения продолжительности и улучшения качества жизни. Разработки рекомбинантных вакцин начались ещё в прошлом веке. Их основу составляла идея стимуляции иммунной системы и инициирования цитотоксических реакций. С одной стороны, основная функция вакцины - предотвращение развития заболеваний, а с другой стороны, существует группа терапевтических вакцин, обладающих лечебными свойствами. В июне 2006 г. в США разработали первую вакцину (гардасил*), используемую в клинической практике для профилактики рака шейки матки и остроконечных генитальных кондилом. Как показали исследования, примерно 70% всех случаев рака шейки матки вызывают вирусы XVI и XVIII серотипов, а около 90% развития остроконечных кондилом ассоциируют с размножением VI и XI серотипов. Вакцина представляет рекомбинантный белок, активный против четырёх серотипов вируса папилломы человека. Данная вакцина обладает высокой иммуногенностью, и через семь месяцев у привитых пациенток определяют высокий «защитный» титр противовирусных антител (по сравнению с плацебо). Три мультицентровых исследования гардасила*, проведённые при участии нескольких десят-
ков тысяч женщин разного возраста, доказали 100% эффективность препарата для предупреждения прекарциноматозных изменений шейки матки (при условии отсутствия инфицирования перечисленными серотипами до введения препарата).
Другой тип вакцин, находящийся в настоящее время в стадии разработки, относят к терапевтическим вакцинам. В 2007 г. проводили вторую и третью фазы клинических испытаний примерно двадцати различных противораковых вакцин. Так, для создания трансгенной вакцины против вируса папилломы человека (TG40101) в штамм аттенуированного вируса с помощью генноинженерных технологий включают последовательность ДНК, кодирующую антиген, ассоциированный с раком шейки матки (HPV19), а также интерлейкин-2 (в качестве иммуностимулятора). Смысл подобного введения состоит в стимуляции направленной пролиферации линии цитотоксических иммунокомпетентных клеток, тропных к данному антигену. У 10 женщин из 21 во второй фазе испытаний через шесть месяцев после вакцинации TG40101, обнаружили полную регрессию рака шейки матки и отсутствие необходимости в хирургическом вмешательстве или химиотерапии.
БИОДЖЕНЕРИКИ
Основная цель создания и разработки дженериков, или воспроиз- ведённых препаратов, - снижение материальных затрат на лечение и обеспечение доступности дорогих ЛС для массового применения. Основные требования к данным ЛС - химическая, фармацевтическая и терапевтическая эквивалентность аналогам. Регистрацию дженериков разрешают только после окончания срока патентов на препарат-бренд, составляющего обычно 20-25 лет (табл. 3-9).
Таблица 3-9. Иммунобиологические препараты (ИБП) с истёкшим в 2006 г. сроком действия патентов
 При
производстве классических препаратов небольшое изменение требований к
клиническим испытаниям дженериков выполняют только на основании
химического и структурного анализа. Проблема создания дженериков
иммунобиологических препаратов заключается в крайне сложной оценке
идентичности основного и воспроизведённого препаратов. Учитывая
комплексность биофармацевтических продуктов, установление химической
эквивалентности практически невозможно. Кроме того, чистота продукта,
конформация белка и степень его гликозилирования зависят от технологии
изготовления ЛС. То есть во многом свойства препарата определяет
производственный процесс (уникальный у каждого производителя). Некоторые
исследователи используют термин «терапевтически-эквивалентные»
иммунобиологические препараты, а в Европейском союзе - «биоидентичные»
препараты или иммунобиологических препаратов второго поколения.
При
производстве классических препаратов небольшое изменение требований к
клиническим испытаниям дженериков выполняют только на основании
химического и структурного анализа. Проблема создания дженериков
иммунобиологических препаратов заключается в крайне сложной оценке
идентичности основного и воспроизведённого препаратов. Учитывая
комплексность биофармацевтических продуктов, установление химической
эквивалентности практически невозможно. Кроме того, чистота продукта,
конформация белка и степень его гликозилирования зависят от технологии
изготовления ЛС. То есть во многом свойства препарата определяет
производственный процесс (уникальный у каждого производителя). Некоторые
исследователи используют термин «терапевтически-эквивалентные»
иммунобиологические препараты, а в Европейском союзе - «биоидентичные»
препараты или иммунобиологических препаратов второго поколения.
Иммунобиологические препараты исследуют с точки зрения фармацевтической и биологической эквивалентности. Фармацевтическая эквивалентность двух иммунобиологических препаратов подразумевает идентичность активных ингредиентов, способов введения, дозирования, эффективности, чистоты и качества. Биологическая эквивалентность - сходство фармакокинетических характеристик активных ингредиентов двух препаратов. Однако для оценки биоэквивалентности необходимо установить фармакокинетические критерии для конкретного иммунобиологического препарата, актуальные как in vitro, так и in vivo.