Фармацевтическая технология. Изготовление лекарственных препаратов : учебник / А. С. Гаврилов. 2010. - 624 с. : ил.
|
|
|
|
ГЛАВА 4. БИОФАРМАЦИЯ - ОСНОВА ТЕХНОЛОГИИ ЛЕКАРСТВЕННЫХ ФОРМ
С точки зрения фундаментальной фармакологии основной задачей технологии лекарственных форм является создание препарата, отличающегося максимальной эффективностью, безопасностью и стабильностью. Чтобы оказывать биологическую активность, лекарственное вещество должно найти путь к биологической цели. Чаще всего биологической целью является фермент или рецептор на поверхности клетки.
Кроме того, лекарственное вещество должно присутствовать в клетке-мишени в достаточно высокой концентрации, чтобы про- извести желательное действие, но концентрация не должна быть выше той, при которой наблюдаются побочные эффекты. Чаще всего связывание лекарственных веществ с целевыми макромолекулами определяется концентрацией препарата в плазме и описывается уравнением ферментативной реакции Михаэлиса-Ментен.
Если учесть, что целью технологии лекарственных форм является создание препаратов, обеспечивающих оптимальную концентрацию вещества в течение заданного времени в плазме того органа, лечение которого проводится, то биофармация является составной частью технологии лекарственных форм, которая занимается изучением и проектированием лекарственных форм в соответствии с ограничениями и требованиями биологии, биохимии и фармакологии. Поэтому изучение, взаимодействия между биологическими факторами и физико-химическими свойствами лекарственных средств и препаратов, их содержащих, является основой биофармации.
Таким образом, биофармация в современной технологии лекарственных форм является научной основой поиска, создания и исследования высокоэффективных лекарственных препаратов. Она изучает зависимость действия лекарственных препаратов от фармацевтических факторов, влияющих на терапевтическую эффективность и, в конечном счете, решает вопрос, как получить эффективный и безопасный лекарственный препарат, стабильный при производств и хранении.
Как выше упоминалось, существует 2 класса лекарственных препаратов по месту их нанесения или употребления:
1. Энтеральные (растворы, суспензии, сиропы, эмульсии, гели, порошки, гранулы, капсулы, таблетки).
2. Парентеральные:
2.1. Инъекции (растворы, суспензии, эмульсии):
- подкожные;
- внутримышечные;
- внутривенные.
2.2. Ректальные: суппозитории, мази, кремы, порошки, растворы.
2.3. Наружные: мази, кремы, пасты, лосьоны, гели, растворы, аэрозоли.
2.4. Дыхательные: аэрозоли (растворы, суспензии, эмульсии, порошки), ингаляции, газы.
2.5. Препараты для носа: растворы, ингаляции.
2.6. Лекарственные формы для глаз: растворы, мази, эмульсии.
2.7. Препараты для ушей: растворы, суспензии, мази, эмульсии.
2.8. Влагалищные: суппозитории, мази, кремы, растворы, аэрозоли, пены, таблетки, капсулы.
Каждый из способов применения отличается путем прохождения лекарственного средства (ЛС) через защитные барьеры организма и определяется последовательностью стадий перехода лекарственного вещества (ЛВ) из лекарственной формы.
4.1. ВСАСЫВАНИЕ ДЕЙСТВУЮЩИХ ВЕЩЕСТВ
Всасывание - это процесс поступления действующего вещества (ДВ) из места введения в кровь. Всасывание ЛВ зависит от пути введения его в организм, вида лекарственной формы, физико-химических свойств ЛВ (растворимости в липидах или гидрофильности вещества), а также от интенсивности кровотока в месте введения.
ЛС, принятые перорально, подвергаются всасыванию, проходя через ряд физиологических барьеров. Рассмотрим подробно механизмы всасывания (поступления) ДВ лекарственных препаратов.
4.2. РАСПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ В ОРГАНИЗМЕ; БИОЛОГИЧЕСКИЕ БАРЬЕРЫ
Рассмотрим, каким путем достигается лечебный эффект. Действие ЛВ наступает после прохождения следующих стадий:
1. Высвобождение ЛВ из лекарственной формы (таблетки, суппозитория, мази и др.).
2. Переход ЛВ в биологическую жидкость и его всасывание (рис.
4.1, 4.2).
3. Распределение ЛВ между кровью, межклеточной жидкостью и клетками тканей.
4. Поступление молекул ЛВ в целевой орган (клетку) и связывание с белком-мишенью.
Организм человека является совершенным устройством, позволяющим защитить себя от повреждения чужеродными веществами. Природа предусмотрела 3 барьера, ограничивающих поступление химических веществ:
1. Селективная проницаемость стенок желудочно-кишечного тракта.
2. Разрушение чужеродных молекул гепатоцитами печени.
3. Селективная проницаемость гистогематической системы.
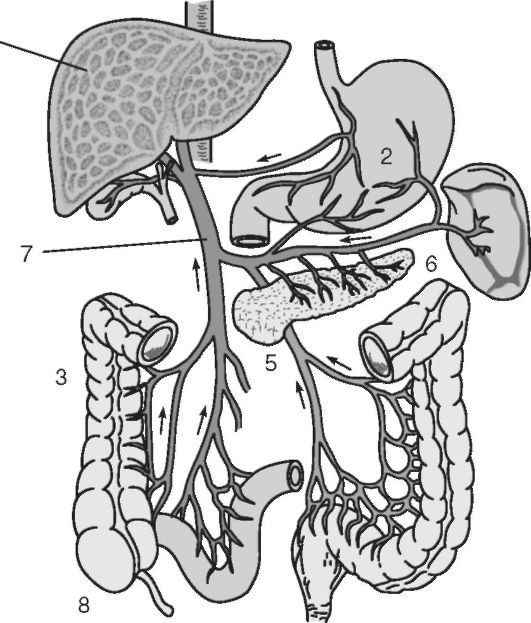
Рис. 4.1. Схема поступления лекарственных средств из желудочно-кишечного тракта в системный кровоток:
1 - печень; 2 - желудок; 3 - печеночная артерия; 4 - желчный пузырь; 5 - поджелудочная железа; 6 - почка; 7 - ствол портальной вены; 8 - кишечник
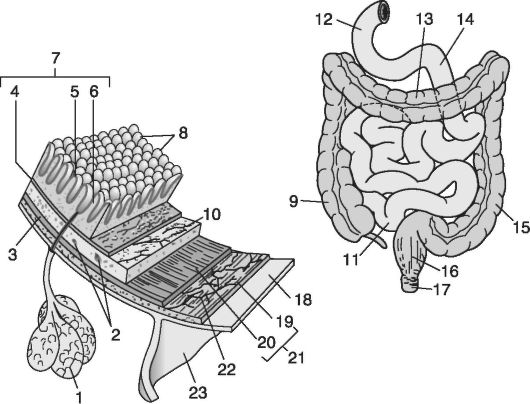
Рис. 4.2. Первый барьер всасывания вещества - кишечник. Структура кишечника:
1 - железы; 2 - кровеносные сосуды; 3 - железы в субмукозе; 4 - стенка мукозы; 5 - эпителий; 6 - наружный слой эпителия; 7 - мукозная мембрана; 8 - ворсинки; 9 - кишечник; 10 - субмукоза; 11 - тонкий кишечник; 12 - двенадцатиперстная кишка; 13 - поперечная кишка; 14 - тощая кишка; 15 - нисходящая кишка; 16 - прямая кишка; 17 - анус; 18 - серозный слой; 19-21 - мышечные волокна
ЛС при пероральном приеме сначала поступает в желудок, где находится в течение около 1 ч в среде желудочного сока при рН около 2-3. Это приводит к разрушению кислотонеустойчивых лекарственных средств. Затем вещества попадают в кишечник.
Слизистая оболочка кишечника имеет бархатистую поверхность, образованную мельчайшими выростами - кишечными ворсинками, длина которых составляет ~0,2-1,2 мм. Наличие складок и мно- гочисленных (~4-5 млн) ворсинок на их поверхности обусловливает громадную площадь поверхности слизистой оболочки тонкой кишки. Это способствует эффективному пристеночному (мембранному) всасыванию ЛВ. Поверхность ворсинок образована одним слоем клеток эпителия тонкой кишки. Ворсинки имеют хорошо раз- витую сеть кровеносных и лимфатических сосудов. В кровеносные и
лимфатические сосуды ворсинки всасываются ЛВ и затем поступают в портальную вену (рис. 4.3). Барьером на пути лекарств в кишечнике является селективное всасывание и разрушение части веществ пище- варительными ферментами.
Затем через воротную вену ЛВ попадает в печень (см. рис. 4.3). Печень - это самый большой внутренний орган, выполняющий в организме жизненно важные функции. Печень участвует в метаболизме всех питательных веществ, пищеварении, синтезе и резервировании ряда необходимых организму веществ, расщеплении, детоксикации и экскреции ненужных или вредных для организма субстанций, кроветворении и осуществлении ряда других функций.
В ворота печени входят собственная печеночная артерия и воротная вена. Воротная вена несет венозную кровь от желудка, тон-
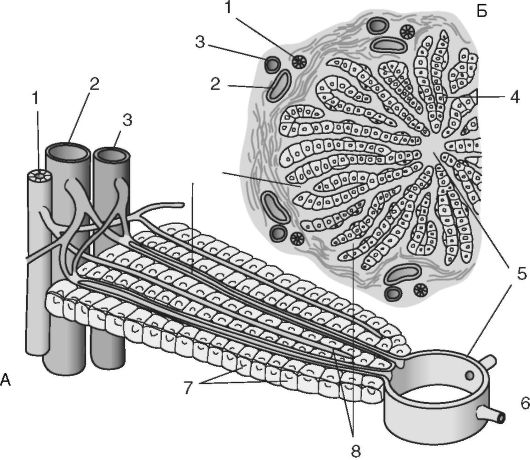
Рис. 4.3. Второй защитный барьер прохождения лекарственного средства - печень:
А - схематическая диаграмма печеночной дольки; Б - поперечный разрез печеночной доли; 1 - желчный проток; 2 - портальная (воротная) вена; 3 - артерия; 4 - купферовские клетки; 5 - канальцы; 6 - центральная вена; 7 - клетки печени; 8 - синусоиды
кой кишки и толстой кишки, поджелудочной железы и селезенки. Собственная печеночная артерия несет артериальную кровь. В печени артерия и воротная вена разветвляются до междольковых артерий и междольковых вен. Они располагаются между дольками печени (гепатоциты) вместе с желчными междольковыми проточками. Гепатоциты по форме напоминают многогранник диаметром ~10- 30 мкм. На поверхности мембраны гепатоцита имеется множество микроворсинок. Здесь происходит фильтрация и очистка крови от неблагоприятных факторов и лекарственных веществ, которые выводятся в состав желчи. Именно ферментные системы гепатоцита разрушают и выводят из крови большинство лекарственных веществ (см. рис. 4.3.)
За сутки гепатоцитами печени непрерывно образуется 1000- 1800 мл желчи (15 мл на
Прохождение веществ через печень сопровождается многочисленными биохимическими реакциями. Оставшиеся вещества поступают в нижнюю полую вену, затем в правое предсердие и, как следствие, в системный кровоток. Если ЛС снова попадает в печень, то происходит дополнительное его разрушение.
Остаток лЛВ поступает в кровеносные сосуды (системный кровоток).
Попадая в системный кровоток, ЛС начинает распределяться по различным органам и тканям организма. Естественно, что в его распределении в организме бoльшoе значение имeeт интенсивность кровоснабжения органов и тканей.
При поступлении в кровяное русло ЛС прежде всего достигают богато васкуляризованные (хорошо кровоснабжаемых) органы - сердце, мозг, легкие, печень, почки, а затем уже происходит их перераспределение по так называемой вoднoй фазе организма, в том числе и по тканям с относительно замедленным кровотоком - скелетной мускулатуре, подкожной клетчатке, костной ткани и т.д.
В дальнейшем распределение лекарственных средств в организме обусловлено, с oднoй стороны, их липофильностью (способностью растворяться в жирах), а с другой стороны, сродством тех или иных лекарственных средств к определенным тканям и(или) органам. Однако действие ЛВ на тот или иной орган или ткань определяется главным образом не его концентрацией, а чувствительностью к ним этих образований. Сродство ЛВ к биологическим субстратам и определяет специфичность их действия.
Доказано, что подавляющее большинство ЛС распределяется в организме неравномерно. Это во многом обусловлено тем, что для того чтобы достичь клеток-мишеней, ЛС должно покинуть сосудистое русло, преодолев гистогематический барьер (от греч. histos - ткань, haima - кровь), т.е. барьер между кровью и клеткамимишенями.
В настоящее время выделяют несколько гистогематических барьеров - собственно гистогематический барьер - барьер между кровью и внеклеточной жидкостью; гематоэнцефалический барьер - барьер между кровью и тканями мозга; плацентарный барьер - барьер между кровью матери и организмом плода; офтальмический барьер - барьер между кровью и тканями и жидкостями глаза и т.д.
Наиболее просто устроен барьер между кровью и внеклеточной жидкостью, т.е. собственно гистогематический барьер. В качестве гистогематического барьера выступают стенки капилляра, кoтopые разграничивают плазму крови (примерно
Стенка капилляров представляет собой липидопористую мембрану, пронизанную порами. В артериальном отделе капилляров давление крови превосходит осмотическое. Именно в этом отделе капилляров происходит выход в ткани водорастворимых веществ, находящихся в плазме крови, в том числе и ЛС. В венозном отделе капилляров давление меньше, чем осмотическое давление интерстициальной жидкости, что и обусловливает переход в обратном направлении (внеклеточная жидкость - кровь) воды, электролитов, ЛС, т.е. венозный отдел капилляров осуществляет выведение веществ в венозную кровь.
Через липидный бислой стенки капилляров лeгко проходят вce жирорастворимые ЛС, тогда как водорастворимые ЛС преодолевают гистогематический барьер через поры, пронизывающие стенку капилляров.
В отличие от гистогематического барьера гематоэнцефалический барьер (рис. 4.4) - барьер между кровью и тканями мозга - практически не проходим для водорастворимых ЛС, что обусловлено особенностями его структурно-функционального строения.
Капилляры мозга по своему строению принципиально отличаются от капилляров, локализованных в дpyгих областях организма, отсутствием в их стенке каналов (пор), обусловливающих про- хождение через стенку капилляров водорастворимых соединений. Эндотелиальные клетки, образующие капилляры мозга, соединены между собой плотными контактами, кoтopые не позволяют водорастворимым веществам перемещаться из крови в ткани мозга и обратно. Помимо этого, наружную поверхность капилляров мозга охва- тывают отростки астроцитов (астроциты - разновидность клеток нервной системы, имеющая звездчатую форму с многочисленными отростками, расширенными на концах). Астроциты выполняют роль опорной структуры в нервной ткани. Полагают, что эти отростки не составляют механические препятствия для проникновения в мозг
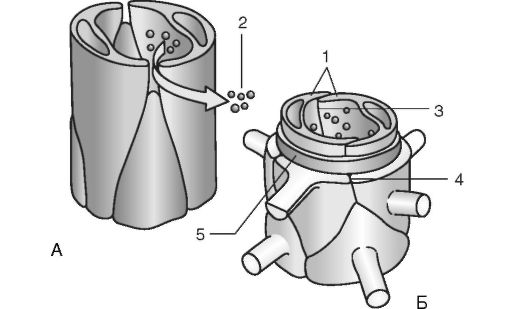
Рис. 4.4. Схема поступления лекарственных средств из сосудов в межклеточное пространство. Гематоэнцефалический барьер:
А - контролируемое прохождение ионов и молекул через барьер эндотелиальной оболочки мембраны эндотелия сосудов; Б - нейроцеллюлярный контроль тонуса мышечной оболочки в отношении проницаемости по ионам и молекулам лекарственных веществ; 1 - клетки эндотелия; 2 - ионы и молекулы; 3 - эндотелиальная оболочка; 4 - фиброзная оболочка и астроциты; 5 - мышечная оболочка
водорастворимых ЛС, однако выделяемые астроцитами вещества повышают плотность контактов между эндотелиальными клетками капилляров мозга.
Липофильные, т.е. жирорастворимые, вещества в отличие от водорастворимых легко проникают через гематоэнцефалический барь- ер посредством простой диффузии. В результате ЛВ проникают в межклеточное пространство, а затем, преодолев барьер клеточной мембраны посредством диффузии или активного транспорта, непосредственно в клетку.
В клетках ЛС накапливается в местах расположения определенных ферментов, реагирует с ключевыми молекулами (рис. 4.5), изменяя их структуру, влияя на биохимические процессы. Например, молекула лизиноприла, присоеденяясь к ангиотензинпревращающему ферменту, изменяет его конформацию, что впоследствии приводит к снижению артериального давления.
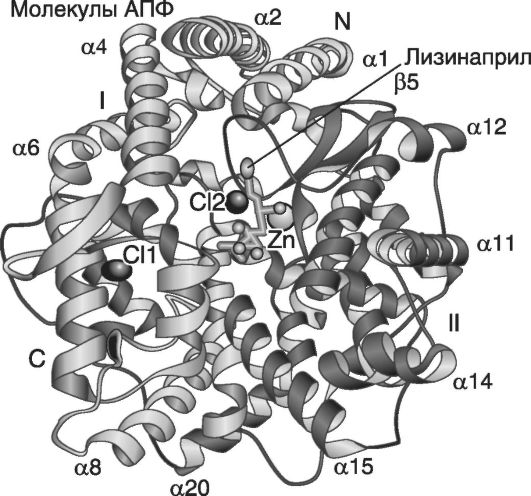
Рис. 4.5. Схема взаимодействия вещества (лизиноприл) с молекулой-мишенью (ангиотензинпревращающий фермент) Lisinopril (Prinivil, Zestril) bound to ... (Natesh et. al. // Nature. - 2003. - Vol. 421. - P. 551-554)
Таким образом, действие ЛВ на организм является чрезвычайно сложным процессом, эффективность которого зависит от множества факторов, начиная от структуры молекулы вещества и заканчивая видом и технологией изготовления лекарственной формы.
4.3. БИОДОСТУПНОСТЬ
Биодоступность отражает количество неизмененного ДВ, достигающего системного кровотока (степень всасывания) относительно исходной дозы лекарственного средства. Определяют путем срав- нительного изучения динамики концентраций ЛВ в плазме крови и(или) в моче после приема исследуемой и стандартной лекарственной формы.
При внутривенном введении биодоступность различных ЛВ оказывается максимальной, т.е. равной 100%. При любых других путях введения она никогда не достигает максимума, поскольку полнота и скорость всасывания зависят от многих факторов биологического и фармацевтического характера.
К биологическим факторам относят индивидуальные особенности организма больного (пол, возраст, масса тела), состояние систем всасывания (в зависимости от места введения), особенности распределения, биотрансформации и экскреции ЛВ.
Из фармацевтических факторов основное значение имеют химические и физико-химические свойства ЛВ, лекарственная форма, в которой оно назначается, природа используемых для изготовления лекарственной формы вспомогательных веществ, особенности технологии производства лекарственной формы и др.
Поступление ЛВ в системный кровоток происходит путем освобождения его из лекарственной формы и последующего всасывания через биологические мембраны (см. рис. 4.1). Высвобождение ЛВ определяется скоростью дезинтеграции лекарственной формы и временем растворения вещества в биологических жидкостях.
Как правило, между скоростью растворения ЛВ в биологических жидкостях и его биодоступностью имеется линейная зависимость. Наиболее объективные данные дает метод прямого измерения концентраций лекарственного вещества в плазме крови и(или) в моче. Например, абсолютную биодоступность можно определить, сравнивая концентрации какого-либо ЛВ в плазме после внутривенного введения его раствора и после введения другим путем. Биодоступность
можно также определить, сопоставляя концентрации ЛВ, вводимого одним и тем же путем в разных лекарственных формах, одна из которых является эталонной.
Оценка биодоступности является одним из важных этапов в процессе разработки и при внедрении новых ЛС и препаратов.
На биодоступность ЛС влияют следующие факторы:
- путь введения препарата (энтеральный, парентеральный);
- особенности организма больного;
- биофармацевтические факторы (структура ЛВ, состав лекарственной формы, особенности технологии производства).
Динамика изменения концентрации любого ЛВ характеризуется примерно одинаковой зависимостью (рис. 4.6).
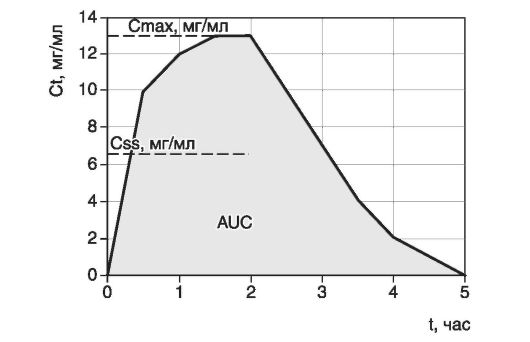
Рис. 4.6. Динамика концентрации лекарственного вещества в сыворотке крови
4.4. ВИДЫ БИОДОСТУПНОСТИ
Абсолютная биодоступность (F) применяется для оценки общего количества ЛВ, поступившего из данного лекарственного препарата в кровь больного, по сравнению с раствором того же вещества, введенного внутривенно.
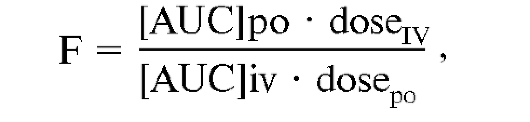

Относительную биодоступность измеряют в сравнении с эталонным препаратом при одном и том же пути введения ЛС. Относительную биодоступность используют для сравнения различных серий препаратов, для ЛС при изменении технологии про- изводства, для препаратов, выпущенных различными производителями, для разных лекарственных форм.
Относительную биодоступность (RF) вычисляют по формуле:

4.5. БИОЭКВИВАЛЕНТНОСТЬ
Эквивалентность - общий термин естествознания, обозначающий соответствие одних и тех же параметров одних объектов другим изучаемым объектам, нормам и правилам. В фармации приняты 3 вида эквивалентности: химическая, терапевтическая и биологическая. Соответствующая эквивалентность обозначает равенство, в пределах допустимых отклонений, химического состава, терапевтического действия и биологических свойств лекарственных средств и препаратов, их содержащих.
Оценка биологической эквивалентности (фармакокинетической эквивалентности) ЛС проводится по методическим указаниям, утвержденным МЗ РФ 10.08.2004 г. Данный показатель является основным видом медико-биологического контроля воспроизведенных (генерических) ЛС, не отличающихся лекарственной формой и содержанием ДВ от соответствующих лекарственных средств. Исследования биоэквивалентности позволяют сделать обоснованные заключения о качестве сравниваемых препаратов по относительно
меньшему объему первичной информации и в более сжатые сроки, чем при проведении клинических исследований.
Два лекарственных препарата являются биоэквивалентными, если они обеспечивают одинаковую биодоступность ЛС по следующим критериям:
- статистически одинаковые площади под концентрационной кривой (рис. 4.7);
- геометрические характеристики кривой «концентрация действующего вещества - время», в том числе: максимальная концентрация (см. рис. 4.7), время достижения максимальной кон- центрации (см. рис. 4.7).
Дополнительно динамику биодоступности оценивают по:
- максимальной, минимальной, средней, текущей концентрации действующего вещества: Спах; Cmin; Css; Ct;
- времени:
• достижения максимальной концентрации действующего ве- щества
• полувыведения ЛС Xs;
• периода, в течение которого концентрация ЛС превышает среднюю концентрацию Xss;
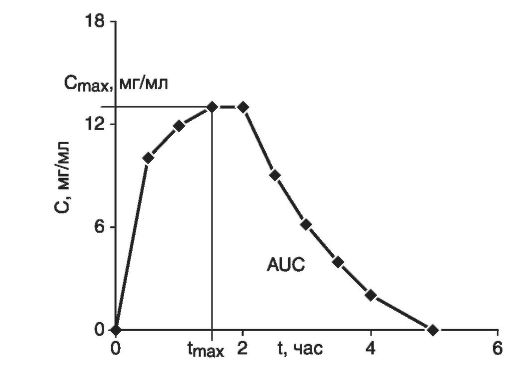
Рис. 4.7. Динамика концентрации вещества из лекарственных форм в плазме крови:
Стах - максимальная концентрация; tmax - время достижения максимальной концентрации; AUC - площадь под кривой «концентрация - время»
• периода, в течение которого концентрация ЛС превышает 75% от Стах.
На рис. 4.8 2 кривые изображают кинетику концентрации в крови одного и того же ЛВ, введенного в разных лекарственных формах (1 и 2). Горизонтальной линией отмечена минимальная эффективная концентрация, при которой данное вещество оказывает терапевтическое действие (например, 4 мкг/ мл). При этом очевидно, что при применении лекарственной формы (2) ЛВ хотя и полностью всасывается, но не достигает терапевтической концентрации и, следовательно, не оказывает терапевтического действия.
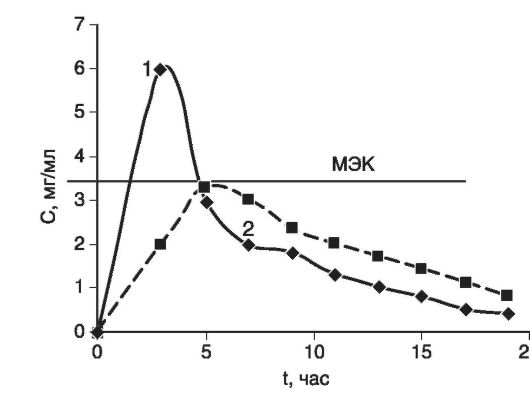
Рис. 4.8. Динамика концентрации в крови одного и того же лекарственного вещества, введенного в разных лекарственных формах:
МЭК - минимальная эффективная концентрация, при которой данное вещество оказывает терапевтическое действие; 1 - лекарственная форма А; 2 - лекарственная форма Б
Лекарственная форма 1 оказывает терапевтическое действие, так как превышает пороговую концентрацию МЭК.
На рис. 4.9. 2 кривые имеют разную форму, разные пики и неодинаковое время достижения максимальной концентрации, но площади под этими кривыми одинаковы, и, следовательно, обе лекарственные формы обеспечивают поступление в кровь одинакового количества ЛС.
При использовании лекарственной формы 1 концентрация ЛВ превышает минимальную токсическую и, следовательно, оказывает

Рис. 4.9. Кинетика лекарственного вещества, имеющего минимальную эффективную концентрацию (МЭК) 6 мкг/мл и минимальную токсическую концентрацию (МТК) 8 мг:
Площади под кривыми AUCA = 334,4 (мкг/мл) ? ч; AUCB = 334,2 (мкг/мл) ? ч; 1 - лекарственная форма А; 2 - лекарственная форма Б
токсическое действие. При применении лекарственной формы 2 ЛВ содержится в крови в терапевтической концентрации, но не достигает токсической концентрации и не оказывает повреждающего действия на организм больного.
На рис. 4.9 видно, что максимальная концентрация вещества при использовании лекарственной формы 1 достигается через 1 ч, а лекарственной формы 2 - через 3 ч.
ЛВ является снотворным средством. Оно достигнет минимальной терапевтической концентрации и окажет снотворное дейст- вие при использовании лекарственной формы 1 через 1 ч, а лекарственной формы 2 - только через 3 ч. С другой стороны, действие снотворного вещества при использовании первой лекарственной формы продолжается 5,5 ч, а второй - 8 ч. Следовательно, в связи с особенностями фармакокинетики одного и того же снотворного средства, приготовленного в разных лекарственных формах, различаются показания к их применению. Лекарственная форма 1 более пригодна при нарушениях засыпания, а лекарственная форма 2 - при снижении продолжи- тельности сна.
4.6. ТЕРАПЕВТИЧЕСКАЯ НЕЭКВИВАЛЕНТНОСТЬ
Терапевтическая неэквивалентность - различная лечебная эффективность лекарственных препаратов, полностью соответствующих требованиям ГФ, содержащих равные количества одного и того же ЛВ в одних и тех же лекарственных формах, но отличающихся методом изготовления или используемыми вспомогательными веществами.
4.7. ФАРМАЦЕВТИЧЕСКИЕ ФАКТОРЫ
Биофармация в современной технологии лекарственных форм является научной основой поиска, создания и исследования высокоэффективных лекарственных препаратов. Она изучает зависимость действия лекарственных препаратов от фармацевтических факторов, влияющих на терапевтическую эффективность. В специальной литературе термин «фармацевтические факторы» получил распространение в последние 3 десятилетия прежде всего в связи с клиническим подтверждением экспериментальных данных о существовании зависимости между эффективностью лекарственных препаратов и методами их получения.
В настоящее время рассматриваются следующие фармацевтические факторы, влияющие на терапевтическую эффективность ЛС:
- вид лекарственной формы и пути ее введения;
- вспомогательные вещества, их природа, физическое состояние, количество;
- химическая природа лекарственного вещества (соль, кислота, основание, количество гетероциклов, эфирные связи, комплексные соединения и т.д.);
- физическое состояние ЛВ (размер частиц, форма кристаллов, наличие или отсутствие заряда на поверхности частиц и др.);
- фармацевтическая технология и субмодальные факторы.
4.7.1. Вид лекарственной формы
Этот фактор является решающим при назначении лекарственного препарата врачом и выборе лекарственной формы препарата безрецептурного отпуска при консультации провизором. Например, в фармации применяют дротаверина гидрохлорид в виде таблеток и инъекционных растворов. В том случае когда
требуется мгновенное действие ЛВ, более рационально использовать дротаверина гидрохлорид в виде раствора для инъекций. Наоборот, применение дротаверина, используемого при лечении мигрени, целесообразно в виде таблеток. Таким образом, правильный выбор лекарственной формы - необходимое условие обеспечения оптимального действия ЛВ.
4.7.2. Влияние вспомогательных веществ, их природа, физическое состояние, количество
Вспомогательные вещества не только определяют вид и характеристики лекарственной формы, но и определяют интенсивность высвобождения ЛС из соответствующей лекарственной формы, а также динамику поступления ЛС в организм больного человека.
Пример влияния вспомогательных веществ (ПАВ) на эффективность лекарственных форм (суппозитории стрептомицина сульфата) представлен ниже (рис. 4.10).
Стрептомицина сульфат ограниченно всасывается при ректальном введении суппозиториев, изготовленных на масле какао, - не более 10 мкг/мл сыворотки крови (см. рис. 4.10, кривая 1).
Добавление поверхностно-активных веществ (наилучший эффект обеспечивает твин-80 (кривая 5) позволяет создать в крови кроликов

Рис. 4.10. Уровень стрептомицина сульфата в крови кроликов после введения его в виде суппозиториев с различными ПАВ:
1 - без ПАВ (контроль); 2 - с сорбитанолеатом; 3 - с натрия лаурилсульфатом; 4 - с эмульсионным воском; 5 - с твином-80
терапевтические концентрации антибиотиков (выше 20 мкг/мл) и в течение 4 ч обеспечить противотуберкулезное действие.
Особое значение для научного понимания роли вспомогательных веществ имеет изучение их взаимодействия с ЛВ и другими компонентами лекарственного препарата: образование водородных связей, соединения-включения, ван-дер-ваальсовые силы, ковалентные связи (свободнорадикальные взаимодействия, реакции, связанные с переносом элементарных частиц). Однако независимо от природы связи в подавляющем большинстве случаев конечным результатом в системе «лекарственное вещество - вспомогательное вещество» являются реакции комплексообразования и адсорбции. Это может быть обнаружено только с помощью специальных исследований. Образующиеся комплексы могут быть весьма прочными или, наоборот, легко распадаться, характеризоваться высокой поверхностной активностью, могут усиливать или ослаблять основную фармакологическую реакцию ЛВ.
Другим наглядным примером является использование твина-80 в качестве растворителя неполярных (нерастворимых в воде) веществ, например бета-каротина. Сплавление последнего с твином приво- дит к получению раствора, который может растворяться в воде, т.е. удается растворить в воде практически нерастворимые вещества в достаточно высоких концентрациях.
Таким образом, правильный выбор вспомогательных веществ позволяет снизить концентрацию ЛВ при сохранении терапевтического эффекта.
4.7.3. Химическая природа лекарственного вещества
Обычно химическая природа ЛВ, так же как и лекарственная форма, регламентируется прописью рецепта, где врач указывает ЛВ (соль, кислоту и т.д.) и форму.
Провизор-технолог в своей практической деятельности обязательно должен анализировать влияние химической формы вещества (соль, кислота, основание, количество гетероциклов, эфирные связи, комплексные соединения и т.д.) на возможность взаимодействия лекарственных и вспомогательных веществ, а также с факторами окружающей среды.
Например, соли всегда лучше растворяются в полярных растворителях, более устойчивы при хранении, чем основания. Вещества с большим количеством ненасыщенных двойных связей легко окисля-
ются кислородом воздуха. Таким образом, при изготовлении лекарственных препаратов обязательно учитывают химическую природу ЛВ, ее влияние на совместимость и стабильность.
4.7.4. Физическое состояние лекарственного вещества (размер частиц, форма кристаллов, наличие
или отсутствие заряда на поверхности частиц и др.)
Вопросам измельчения в фармацевтической технологии придается особое значение. Известно, что с уменьшением размера частиц резко увеличивается поверхностная энергия измельчаемого ЛВ. При тонком измельчении ЛВ лучше растворяются, быстрее и полнее участвуют в химических реакциях и т.д. Измельчение может существенным образом влиять на терапевтическую активность ЛВ вследствие изменения процессов их всасывания. Это происходит при растворении ЛВ, скорость которого прямо пропорциональна площади поверхности и обратно пропорциональна величине частиц вещества. Например, при уменьшении размера частиц ацетилсалициловой кислоты до микронизированных увеличивалось приблизительно в 2 раза ее анальгетическое, жаропонижающее и противовоспалительное действие.
Одновременно провизор-технолог должен учитывать, что чрезмерное измельчение приводит к разрушению и снижению стабильности ЛВ. В частности, измельчение ацетилсалициловой кислоты до размера частиц менее 1 мкм приводит к росту содержания салициловой кислоты выше пределов, допустимых в фармакопее. Кроме того, порошки чрезмерно измельченных субстанций утрачивают свойство сыпучести, что недопустимо по требованиям ГФ.
4.7.5. Фармацевтическая технология и субмодальные факторы
Интенсивность технологических процессов при производстве лекарственных препаратов может существенно влиять на эффектив- ность и стабильность, изменяя их в лучшую или худшую сторону. Особенно важными в этом отношении являются стадии растворения и фильтрования, плавления, смешивания и другие, при которых происходит изменение агрегатного состояния лекарственного и вспомогательного веществ, интенсификация и рост числа кон- тактов между ними. Даже кажущаяся на первый взгляд маловажной
такая операция, как порядок смешивания растворов, может определять эффективность и безопасность лекарственного препарата. Например, добавление водных растворов к спиртовым настойкам, а не наоборот, как принято в фармации, приводит к выпадению осадков лекарственных веществ, нарушая однородность дозирования.
Важную роль в эффективности медикаментозного лечения играют удобство приема, внешний вид лекарственной формы, органо- лептические свойства, называемые в литературе субмодальными факторами.
В 1990-е годы в США проводилось исследование, в котором все больные получали лактозное плацебо различной формы, массы и цвета. Несмотря на то что все таблетки не содержали ЛВ, больные статистически достоверно указали на наличие положительного эффекта таблеток треугольной формы, большого размера, синего цвета, с глянцевой и однородной поверхностью. Этот пример наглядно показывает, что изготовленные в аптеке препараты должны быть аккуратно оформлены, иметь красивый внешний вид, да и сам провизор, их отпустивший, должен хорошо выглядеть (элегантная одежда, коротко остриженные ногти, минимум косметики, приветливое выражение лица).
Таким образом, при разработке состава и технологии любого лекарственного препарата особое внимание следует уделять фармацевтическим факторам, от которых в значительной степени зависят их эффективность, безопасность и стабильность при хранении.
Контрольные вопросы
1. Какова роль биофармации в разработке терапевтически эффективных лекарственных препаратов?
2. Какова зависимость между фармацевтическими факторами и эффективностью лекарственных форм?
3. Как влияет размер частиц лекарственных веществ на кинетику их высвобождения?
4. Какова взаимосвязь между эффективностью действия лекарственных препаратов и физическим состоянием лекарственных веществ?
5. От каких условий зависит оптимальное измельчение лекарственных веществ?
6. Каково влияние вспомогательных веществ на терапевтическую эффективность лекарственных препаратов?
7. Какова взаимосвязь факторов, от которых зависит рациональный выбор основ для мазей и суппозиториев, и максимальное высвобождение лекарственных веществ?
8. Какие факторы с точки зрения биофармации обеспечивают в аптечной практике рациональную технологию лекарственных препаратов?
Тесты
1. Биофармация решает вопрос:
1. Как получить эффективный и безопасный лекарственный препарат?
2. Как получить стабильный при производстве, хранении и применении лекарственный препарат?
3. Как получить соответствующий требованиям контрольно-разрешительной системы Минздрава РФ лекарственный препарат?
2. Биодоступность отражает:
1. Количество неизмененного действующего вещества, достигающего системного кровотока (степень всасывания) относительно исходной дозы лекарственного средства.
2. Количество действующего вещества, достигающего системного кровотока.
3. Количество неизмененного действующего вещества, достигающего системного кровотока (степень всасывания) относительно его метаболитов.
3. Биодоступность определяют:
1. Путем изучения динамики концентрации лекарственного вещества в плазме крови и(или) в моче после приема исследуемой лекарственной формы.
2. Путем сравнительного изучения динамики концентраций лекарственного вещества в плазме крови и/или в моче после приема исследуемой и стандартной лекарственной формы.
3. Путем сравнительного изучения динамики концентраций лекарственного вещества в плазме крови и в моче.
4. При внутривенном введении биодоступность оказывается равной:
1. 0%.
2. 30%.
3. 50%.
4. 100%.
5. На биодоступность влияют следующие факторы:
1. Путь введения препарата.
2. Особенности организма больного.
3. Способ получения лекарственного вещества.
4. Биофармацевтические факторы.
6. Относительная биодоступность:
1. Измеряется в сравнении с эталонным препаратом при различных способах введения лекарственных средств.
2. Измеряется в сравнении с эталонным препаратом при одном и том же пути введения лекарственных средств.
3. Используется для сравнения различных серий препаратов при изменении технологии производства.
4. Используется для сравнения препаратов, выпущенных различными производителями.
7. Терапевтическая неэквивалентность - различная лечебная эффективность лекарственных препаратов, полностью соответствующих требованиям Государственной фармакопеи, содержащих равные количества одного и того же лекарственного вещества в одних и тех же лекарственных формах, но отличающихся:
1. Методом изготовления.
2. Фирмой-производителем.
3. Используемыми вспомогательными веществами.
8. Фармацевтические факторы, влияющие на терапевтическую эффективность лекарственных средств:
1. Вид лекарственной формы и пути ее введения.
2. Вспомогательные вещества, их природа, физическое состояние, количество.
3. Химическая природа лекарственного вещества.
4. Физическое состояние лекарственного вещества.
5. Фармацевтическая технология и субмодальные факторы.