Фармацевтическая технология. Изготовление лекарственных препаратов : учебник / А. С. Гаврилов. 2010. - 624 с. : ил.
|
|
|
|
ГЛАВА 2. СТАНДАРТИЗАЦИЯ И НОРМИРОВАНИЕ В ФАРМАЦИИ
В учебнике значительное внимание уделено вопросам организации фармацевтической деятельности. Это обосновано тем, что сегодня существенно изменяется роль провизора в аптечном учреждении. Основную часть рабочего времени специалист вынужден посвящать вопросам организации фармацевтической деятельности, анализу соответствия санитарного и фармацевтического режима, требованиям нормативной документации.
Для качественного обучения студентов правилам изготовления лекарственных препаратов необходимо сначала сформировать у учащихся представление о правилах выписывания, приемки, учета рецептов, организации фармацевтического порядка, а затем переходить к вопросам изготовления лекарственных препаратов.
Лекарственные препараты - это своеобразные предметы потребления, особенность которых состоит в том, что в них нуждаются больные люди. Поэтому требования, предъявляемые к лекарственным препаратам, особенно высоки, так как от их качества зависят не только сила лечебного эффекта, но и наличие побочного, нередко токсического действия.
Вопросы нормирования качества имеют значение в любой отрасли производства. Установление правил проведения отдельных опера- ций, норм качества и расхода сырьевых материалов, требований к готовому продукту не только способствует получению препаратов высокого качества, но и уменьшает материальные потери, которые особенно возрастают при нарушении технологического режима.
2.1. ОСНОВЫ СТАНДАРТИЗАЦИИ
Стандарт (от англ. - норма, образец) в широком смысле слова - образец, эталон, модель, принимаемые за исходные для сопоставления с ними других подобных объектов.
Стандарт - нормативный документ по стандартизации, разра- ботанный, как правило, на основе согласия, характеризующегося
отсутствием возражений по существенным вопросам у большинства заинтересованных сторон, принятый (утвержденный) признанным органом (предприятием) (ГОСТ Р. 1.0-92 «Государственная система стандартизации РФ. Основные положения»).
Стандартизация - это деятельность по установлению норм, правил и характеристик (далее - требования) в целях обеспечения: безопасности продукции, работ и услуг для окружающей среды, жизни, здоровья и имущества; технической и информационной совместимости, а также взаимозаменяемости продукции; качества продукции, работ и услуг в соответствии с уровнем развития науки, техники и технологии; единства измерений; экономии всех видов ресурсов; безопасности хозяйственных объектов с учетом риска возникновения природных и техногенных катастроф и других чрезвычайных ситуаций; обороноспособности и мобилизационной готовности страны (Федеральный закон «О стандартизации» от 27.12.1995 г. ? 211-ФЗ, ст. 1.).
2.2. ВИДЫ СТАНДАРТОВ
В зависимости от сферы действия различают стандарты разного статуса или категории: международный стандарт, межгосударс- твенный стандарт (ГОСТ), Государственный стандарт Российской Федерации (ГОСТ Р.), стандарт отрасли (ОСТ), технические условия (ТУ), стандарт организации (СТО). Последний является новым качественным шагом в развитии нормативной документации. Если раньше в технических условиях устанавливались параметры качества изделия и методы их контроля, то в СТО дополнительно установлен перечень контрольных точек внутрипроизводственного контроля, позволяющий гарантировать стабильность качественных характеристик продукции в процессе серийного производства.
В дополнение к стандартам на территории Российской Федерации действуют:
- правила (ПР) - документ, устанавливающий обязательные для применения организационно-технические и(или) общетехнические положения, порядки, методы выполнения работ (ГОСТ
Р. 1.10);
- рекомендации (Р) - документ, содержащий добровольные для применения организационно-технические и(или) общетехнические положения, порядки, методы выполнения работ (ГОСТ Р. 1.10);
- нормы - положения, устанавливающее количественные или качественные критерии, которые должны быть удовлетворены (ИСО/МЭК 2).
Примерами норм являются:
1. Санитарно-пищевые нормы и правила «Гигиенические требования к качеству и безопасности сырья и пищевых продуктов»
(СанПиН 2.3.2.1078).
2. Нормы радиационной безопасности (Госсанэпиднадзор РФ,
1996):
- регламент - документ, содержащий обязательные правовые нормы и принятый органом власти. При стандартизации продукции (услуг) и обязательной сертификации указанных объектов широко используют технические регламенты.
Технический регламент - нормативно-технический документ, который устанавливает характеристики продукции (услуги) и связанные с ней процессы и методы производства (ГОСТ 1.0).
Термин «технический регламент», как и термин «нормативный документ», является родовым понятием. К техническим регламентам относятся:
- законодательные акты, постановления Правительства Российской Федерации, содержащие требования, нормы, технические характеристики;
- государственные стандарты РФ и межгосударственные стандарты в части устанавливаемых в них обязательных требований;
- нормы и правила федеральных органов исполнительной власти, в компетенцию которых (в соответствии с законодательством РФ) входит установление обязательных требований (например, строительные нормы и правила - СНиП Госстроя России; санитарные правила и нормы - СанПиН Минздрава России, правила по стандартизации, метрологии и сертификации Госстандарта России и пр.).
Для упорядочения ввозных пошлин, правильного налогообложения (НДС) и сертификации все товары разделяются на категории в нижеуказанных классификаторах.
Общероссийский классификатор технико-экономической и социальной информации (ОКТЭСИ) - официальный документ, представляющий собой систематизированный свод наименований и кодов классификационных группировок и(или) объектов классификации в области технико-экономической и социальной информации.
Общероссийский классификатор продукции (ОКП) - официальный документ, представляющий собой классификатор товаров и услуг, содержащий все возможные виды продукции и кодированное их обозначение.
2.3. НОРМАТИВНЫЕ ДОКУМЕНТЫ ПО СТАНДАРТИЗАЦИИ В ОБЛАСТИ ЗДРАВООХРАНЕНИЯ
Согласно приказу МЗ РФ от 4.06.2001 г. ? 181 «О введении в действие отраслевого стандарта "Система стандартизации в здравоохранении. Основные положения"», документами, нормирующими деятельность в сфере здравоохранения, являются:
- государственные стандарты Российской Федерации (ГОСТ Р.) на объекты стандартизации в области здравоохранения;
- международные (региональные) стандарты, правила, нормы и рекомендации по стандартизации в области здравоохранения;
- общероссийские классификаторы технико-экономической информации;
- отраслевые стандарты и классификаторы в области здравоохранения;
- стандарты и классификаторы в области здравоохранения, принимаемые на административно-территориальном уровне субъ- ектом Российской Федерации;
- стандарты и классификаторы в области здравоохранения, принимаемые на уровне медицинских организаций, предприятий и учреждений;
- стандарты и классификаторы в области здравоохранения, принимаемые на уровне научных обществ и общественных органи- заций;
- руководящие документы, правила и нормы, рекомендации в области здравоохранения, принимаемые на отраслевом уров- не, на уровне субъекта Российской Федерации, учреждений и предприятий, осуществляющих медицинскую, фармацевтическую деятельность в том числе связанную с медицинской техникой, научных, общественных организаций а также ас- социаций.
Согласно административной реформе, в РФ Федеральной службой по надзору в сфере здравоохранения и социального развития
разработаны следующие административные регламенты исполнения государственных функций/предоставления государственных услуг:
- АР.3.1 (УЛ) «Выдача лицензий на осуществление фармацевтической деятельности»;
- АР.3.2 (УЛ) «Выдача лицензий на осуществление деятельности по производству лекарственных средств»;
- АР.3.5 (УК/УЛ) «Выдача заключений о соответствии организации производства лекарственных средств требованиям законодательства»;
- АР.3.6 (УР) «Государственная регистрация лекарственных средств»;
- АР.3.14 (УМ) «Проведение аттестации и сертификации специалистов, занятых в сфере обращения лекарственных средств»;
- АР.3.16 (УЛ) «Осуществление в установленном порядке проверок деятельности аптечных учреждений...».
Данные административные регламенты определяют порядок и срок рассмотрения органами государственной власти обращений и заявлений субъектов фармацевтической деятельности.
Таким образом, система стандартизации в здравоохранении предусматривает разработку и принятие стандартов следующих видов в зависимости от специфики объектов стандартизации:
- основополагающие стандарты;
- стандарты на продукцию (услуги);
- стандарты на работы (процессы);
- стандарты на методы контроля (испытаний, измерений, анализа).
2.4. ЦЕЛИ И ЗАДАЧИ СТАНДАРТИЗАЦИИ В ФАРМАЦИИ
Целями организации и проведения работ по стандартизации в фармации являются создание и развитие системы стандартизации в данной отрасли как основы повышения качества фармацевтической деятельности при решении задач сохранения и улучшения здоровья населения.
2.5. СИСТЕМА СТАНДАРТИЗАЦИИ В ФАРМАЦИИ
Система стандартизации в фармации направлена на совершенствование управления отраслью, обеспечение ее целостности за счет единых подходов к планированию, нормированию, лицензированию
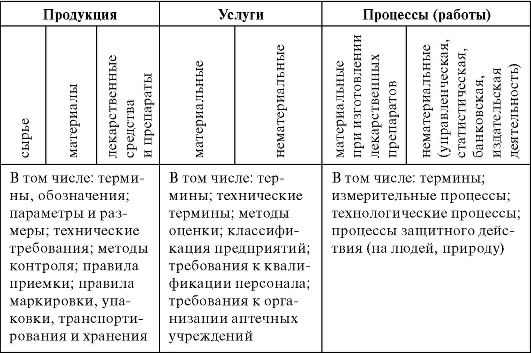
и сертификации, на повышение качества фармацевтических препаратов и услуг, рациональное использование кадровых и материальных ресурсов, оптимизацию лечебно-диагностического процесса, интег- рацию отечественной фармации в мировую медицинскую практику. Перечень объектов стандартизации представлен в табл. 2.1.
Таблица 2.1. Объекты стандартизации фармацевтической деятельности
2.6. ГОСУДАРСТВЕННОЕ НОРМИРОВАНИЕ ПРОИЗВОДСТВА И ИЗГОТОВЛЕНИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Нормирование (в любой отрасли промышленности) - установление правил проведения отдельных операций, норм качества и расхода сырьевых материалов, требований к готовому продукту. Нормирование способствует получению товаров высокого качества и уменьшает материальные потери, которые особенно возрастают при нарушении технологического режима.
Как выше упоминалось, лекарственные препараты - это своеобразные предметы потребления, особенность которых состоит в том,
что в них нуждаются больные люди. Поэтому установление норм их качества является необходимым условием для безопасности и эффективности.
Регламентация качества лекарственных препаратов в России началась еще в XVIII в. Циркуляры по оценке качества и руководства по изготовлению лекарственных препаратов с течением времени менялись. В настоящее время в Российской Федерации осуществляется непрерывный и исчерпывающий государственный контроль за производством и изготовлением лекарственных препаратов.
В любой отрасли экономики для эффективного контроля за деятельностью любого предприятия необходимо:
- создание норм или параметров, которым должно отвечать предприятие и выпускаемая им продукция;
- установление методов проверки соответствия показателей установленным нормам.
Государственное нормирование производства лекарственных препаратов представляет собой комплекс требований (узаконенных соответствующими документами) к качеству лекарственных средств, препаратов, вспомогательных технологических веществ и материалов, а также к процессу производства и изготовления лекарственных препаратов.
Необходимость государственного нормирования производства лекарственных препаратов связана с тем, что:
- в них нуждаются больные люди;
- невозможен контроль их качества со стороны самих больных. Законом о лекарственных средствах установлены следующие направления нормирования изготовления лекарственных препаратов:
- нормирование состава прописей лекарственных препаратов;
- ограничение круга лиц, которым разрешается изготавливать лекарственные препараты (право на фармацевтическую деятельность);
- установление норм качества для лекарственных и вспомогательных веществ, используемых для изготовления лекарственных препаратов;
- нормирование условий изготовления и технологических процессов производства лекарственных препаратов.
Разберем последовательно перечисленные направления нормирования изготовления лекарственных препаратов.
2.6.1. Нормирование состава прописи лекарственных препаратов
Состав лекарственных препаратов определяется соответствующими прописями. Прописи подразделяются на стандартные и нестан- дартные.
Нормирование состава стандартных прописей
Стандартные прописи создаются после проверки органами Министерства здравоохранения и социального развития эффективности лечебного действия лекарственных препаратов. Стандартные прописи подразделяются на официнальные и мануальные.
А. Официнальные - прописи, утвержденные Государственным фармакологическим комитетом и ФГК MЗ РФ, имеющие фармакопейную статью (ФС), фармакопейную статью на лекарственные средства (препарат) (ФСП). Официнальные прописи - это составы таблеток, растворов, мазей, суппозиториев, выпускаемых в про- мышленности. Прописи установлены в Государственной фармакопее, в фармакопейных статьях предприятия-изготовителя, приказах МЗ РФ. Нормирование состава официнальной прописи осуществляется в соответствии с ОСТ 91500.05.001-00 «Стандарты качества лекарственных средств. Основные положения», приказ МЗ РФ ? 388 от 01.11.2001. Государственные стандарты качества лекарственных средств разрабатываются и утверждаются в следующих видах:
1) общая фармакопейная статья (ОФС);
2) ФС;
3) ФСП конкретного предприятия-производителя лекарственных средств.
ОФС включает в себя перечень нормируемых показателей или методов испытания для конкретной лекарственной формы, описа- ние физических, физико-химических, химических, биохимических, биологических, микробиологических методов анализа лекарственных средств, требования к используемым реактивам, титрованным растворам, индикаторам.
ФС разрабатывается на лекарственное средство (препарат) под международным непатентованным названием, если оно имеется (для монокомпонентных лекарственных средств) и содержит обязательный перечень показателей и методов контроля качества (с учетом его лекарственной формы), соответствующих положениям ведущих зарубежных фармакопей.
ФСП конкретного предприятия-производителя лекарственных средств содержит перечень показателей и методов контроля качества лекарственного средства производства конкретного предприятия и разрабатывается с учетом требований Государственной фармакопеи и ОСТ
91500.05.001-00.
Государственная фармакопея (ГФ) (pharmacopea от греч. pharmacon - лекарство и poieо - делать) - сборник ФС (ФЗ ? 86).
Б. Мануальные прописи - тоже стандартные, многократно проверенные. Они широко применяются на практике, но описание их приведено не в фармакопее, а в специальных сборниках (мануалах). В мануальных прописях часто указаны название или фамилия автора-разработчика: например капли Вотчала, микстура Павлова, капли Зеленина, линимент Вишневского. Множество мануальных прописей представлено в мануале «Рецептурные прописи лекарственных средств, известные под фамилиями авторов» (Министерство здравоохранения СССР, 1965).
Нормирование состава мануальных прописей установлено приказом Министерства здравоохранения СССР ? 223 от 12.08.1991 г. «Об утверждении сборника унифицированных лекарственных прописей». Сборник утвержден в целях повышения качества обеспечения населения лекарствами, сокращения малопроизводительного ручного труда в аптечных учреждениях и организации серийного производства часто повторяющихся прописей лекарственных средств в аптеках и на промышленных предприятиях.
Сборник содержит следующие разделы:
- микстуры (витаминные, стимулирующие метаболические процессы, регулирующие кислотно-щелочное равновесие, седатив- ные, НПВС, антигистаминные, местно-анестезирующие, отхаркивающие);
- растворы (спазмолитические, ферментные, ветрогонные, солевые, для электрофореза);
- стерильные растворы для инъекций, инфузий, промывания;
- капли для внутреннего применения (сердечные, спазмолитические);
- капли в нос, глазные капли, капли в уши;
- жидкости для наружного применения (антисептические, антимикробные);
- суспензии для наружного и внутреннего применения;
- пасты, мази, линименты;
- порошки.
Всего в сборнике приведено более 1000 прописей, в том числе именных, указаны технология изготовления, показания, противопоказания, дозировка с учетом возраста больного.
Нормирование состава нестандартных прописей
Помимо стандартных используются нестандартные (индивидуальные) прописи - рецепты, назначаемые врачом определенному больному. Они называются врачебными, или магистральными (formulae magistrales от лат. magistr - мастер).
Согласно приказу МЗ РФ ? 110, все лекарственные препараты выписываются на специальном бланке, называемом рецептом.
Рецепт (от лат. recipere - брать, принимать; receptum - отглагольное существительное - «взятое») - письменное предписание врача об изготовлении лекарственного препарата или отпуске готового препарата с указанием способа применения (медицинское значение рецепта). Рецепт является указанием об изготовлении определенного лекарственного препарата. Помимо медицинского и технологического значений, рецепт имеет хозяйственное и юридическое значение. Лица, выписывающие рецепты и готовящие по ним лекарственные препараты, несут юридическую ответственность.
Нормирование состава нестандартных прописей состоит в установлении правил и норм оформления и выдачи рецепта приказом МЗ СР РФ ? 110 от 12.02.2007 г.
Согласно приказу, все лекарственные препараты, за исключением поименованных в «Перечне лекарственных средств, разрешенных к отпуску без рецепта врача», должны отпускаться только по рецептам.
Врачи при наличии соответствующих показаний обязаны выдать больным рецепты, заверенные своей подписью и личной печатью. Рецепты должны выписываться (с учетом оплаты лекарственного препарата и характера действия входящих в их состав лекарственных веществ) на бланках, отпечатанных типографским способом, по формам, утвержденным настоящим приказом. Рецепты выписываются четко и разборчиво чернилами или шариковой ручкой с обязательным заполнением всех предусмотренных в бланке граф. Исправления в рецепте не допускаются.
Структура рецепта
Рецепт состоит из следующих разделов и граф: - Inscriptio (от лат. inscribere - надписывать). В надписи указывают наименование, адрес и телефон лечебного учреждения, в котором
был выписан рецепт. Код лечебно-профилактического учреждения печатается полностью или ставится штамп. На рецепте частнопрактикующего врача должны быть указаны его фамилия, домашний адрес и номер телефона, наименование организации, выдавшей лицензию, дата выдачи и срок ее действия;
- Nomen aegroti - фамилия и инициалы больного. В рецепте указывают фамилию и инициалы больного, для детей и лиц старше 60 лет - возраст;
- D (t) - дата выдачи рецепта (число, месяц, год);
- Nomen medici - фамилия и инициалы врача;
- Invocatio - обращение (от лат. invocare - взывать, умолять). В рецепте эта часть представлена одним словом Recipe - возьми, которое обычно пишется сокращенно: Rp.; Rec.; R. Это юридически характеризует предписание врача фармацевту и показывает, что данный документ является рецептом и на него распространяются все законоположения о рецепте;
- Desi natio materiarum, или Ordinatio, - перечисление на латинском языке лекарственных веществ, из которых готовят лекарственный препарат;
Правило 1
Если в рецепте прописаны наркотические вещества и вещества, отнесенные к спискам А и Б, то сначала указывают нарко- тические средства, затем вещества списка А (ядовитые), списка Б (сильнодействующие), а затем все остальные.
Если в рецепте прописаны НС, ПВ и вещества списков А и Б в смеси с другими ингредиентами, то запрещается отпускать их вне состава изготовленного лекарственного препарата.
- Adjuvans (помогающее, содействующее) - вспомогательные вещества, содействующие основному лекарственному средству в проявлении должного лечебного эффекта;
- Corrigens (корриген) constituens (наполнитель) - корригирующие вещества. К корригенам относится группа вспомогательных веществ, применение которых дает возможность исправлять вкус, цвет, запах различных лекарственных веществ. Корригирующие вещества имеют большое значение в детской практике;
- Praescriptio или subscriptio - предписание, подпись. После перечисления лекарственных веществ указывается лекарственная форма, которая должна быть изготовлена.
Для обозначения лекарственной формы должны использоваться только принятые сокращения (табл. 2.2):
- Signatura - сигнатура, обозначение. Начинается словами signa или signetur (обозначь, пусть будет обозначено), которые сокращенно обозначаются одной буквой S. Содержание сигнатуры предназначено для больного. В ней указывают, как следует применять лекарственный препарат. Поэтому сигнатура пишется на русском языке или русском и национальном языках;
- Subcriptio medici - личная подпись врача. Рецепт заканчивается личной подписью и печатью врача. Все сокращения, возможные при выписывании рецепта, нормируются приказом МЗ РФ ?
110 (см. табл. 2.2).
Таблица 2.2. Важнейшие рецептурные сокращения
Сокращение | Полное написание | Перевод |
aa | ana | по; поровну |
ac. acid. | acidum | кислота |
amp. | ampulla | ампула |
aq. | aqua | вода |
aq. pur. | aqua purificata | вода очищенная |
but. | butyrum | масло (твердое) |
comp, cps | compositus (a, um) | сложный |
D. | Da (Detur, Dentur) | выдай (пусть выдано, пусть будет выдано) |
D.S. | Da, Signa Detur, Signetur | выдай; обозначь, пусть будет выдано; обозначено |
D.t.d. | Da (Dentur) tales doses | выдай (пусть будут выданы) такие дозы |
Dil. | dilutus | разведенный |
div. in p. aeq. | divide in partes aequales | раздели на равные части |
extr. | extractum | экстракт; вытяжка |
f. | fiat (fiant) | пусть образуется (образуются) |
Окончание табл. 2.1
Сокращение | Полное написание | Перевод |
qtt. | qutta, guttae | капля, капли |
inf. | infusum | настой |
in amp. | in ampullis | в ампулах |
in tabl. | in tab(u)lettis | в таблетках |
lin. | linimentum | жидкая мазь |
liq. | liquor | жидкость |
m. pil. | massa pilularum | пилюльная масса |
M. | Misce, Misceatur | смешай (пусть будет смешано) |
N. | numero | числом |
ol. | oleum | масло (жидкое) |
past. | pasta | паста |
Pil. | pilula | пилюля |
p.aeq. | partes aequales | равные части |
ppt., praec. | praecipitatus | осажденный |
pulv. | pulvis | порошок |
q.s. | quantum satis | сколько потребуется; сколько надо |
r., rad. | radix | корень |
Rp. | Recipe | возьми |
Rep. | Repete, Repetatur | повтори (пусть будет повторено) |
rhiz. | rhizoma | корневище |
S. | Signa, Signetur | обозначь (пусть будет обозначено) |
sem. | semen | семя |
simpl. | simplex | простой |
sir. | sirupus | сироп |
sol. | solutio | раствор |
supp. | suppositorium | свеча |
tabl. | tab(u)letta | таблетка |
t-ra, tinct. | tinctura | настойка |
unq. | unquentum | мазь |
vitr. | vitrum | склянка |
Виды рецептов
Приказом МЗ и СР РФ ? 110 от 12.02.2007 г. установлены 5 видов бланков для выписывания рецептов:
- рецепт на право получения лекарства, содержащего наркотическое вещество (рис. 2.1);
- бланки форм ? 148-1/у-88 и ? 148-1/у-04(л), ? 148-1/у-06(л) - для льготного отпуска (рис. 2.2, 2.3);
- бланк формы 107/y (рис. 2.4).

Рис. 2.1. Бланк рецепта для выдачи наркотического средства
На специальных рецептурных бланках на наркотическое лекарственное средство отпускают наркотические средства и психотропные вещества, внесенные в список II перечня ПККН.
Особенности бланка рецепта на наркотическое средство
1. Форма «Специальный рецептурный бланк на наркотическое средство и психотропное вещество» изготавливается на бумаге розового цвета с водяными знаками и имеет серийный номер.
2. В графе «Rp.:» указываются на латинском языке международное непатентованное наименование, торговое или иное название лекарственного средства, его дозировка. Количество выписываемого вещества указывается прописью.
3. На рецептурном бланке указывается полностью наименование ЛПУ, адрес, телефон, фамилия, имя, отчество врача. Рецепт подписывается врачом и заверяется его личной печатью. Дополнительно рецепт подписывается главным врачом лечебно-профилактического учреждения или его заместителем (заведующим отделением) и заверяется круглой печатью лечебно-профилактического учреждения.
4. На 1 рецептурном бланке выписывается только 1 наименование лекарственного средства. Исправления в рецептурном бланке не допускаются. Рецепты на наркотические средства и психотропные вещества, внесенные в список II перечня, действительны в течение 5 дней.
5. Рецепты на наркотические средства и психотропные вещества, внесенные в список II перечня, хранят 10 лет.
Особенности бланка рецепта ? 148-1/у-88
По рецептам, выписанным на рецептурных бланках формы ? 148- 1/у-88, отпускаются: психотропные вещества, внесенные в список III перечня; лекарственные средства, подлежащие предметно-количественному учету в аптечных учреждениях; анаболические стероиды.
1. Рецепты на психотропные вещества, внесенные в список III перечня; лекарственные средства, подлежащие предметно-количественному учету; анаболические стероиды действительны в течение 10 дней. Рецепты на психотропные вещества, внесенные в список III перечня, хранят 10 лет.
2. Рецепты на лекарственные средства, подлежащие предметноколичественному учету, за исключением наркотических средств и психотропных веществ, внесенных в список II перечня, психотропных

Рис. 2.2. Бланк рецепта формы 148-1/у-88
веществ, внесенных в список III перечня, и анаболические стероиды хранят 3 года.
3. Рецепты на лекарственные средства, включенные в перечень лекарственных средств, отпускаемых по рецептам врача, а также иные лекарственные средства, отпускаемые бесплатно или со скидкой, хранят 5 лет.
Рецепты на лекарственные средства (за исключением подлежащих предметно-количественному учету), выписанные на рецептур-
ных бланках формы ? 148-1/у-04 (л) и формы ? 148-1/у-06 (л) (см. рис. 2.3) для амбулаторного лечения граждан, имеющих право

Рис. 2.3. Бланк рецепта формы 148-1/у-06(л)

Рис. 2.4. Бланк рецепта формы 107-у
на получение лекарственных средств бесплатно и со скидкой, действительны в течение 1 мес со дня выписки. Рецепты на все остальные лекарственные средства действительны в течение 2 мес со дня выписки. Рецепты на производные барбитуровой кислоты, эфедрин, псевдоэфедрин в чистом виде и в смеси с другими лекарственными веществами, анаболические стероиды, клозапин, тианептин для лечения больных с затяжными и хроническими заболеваниями могут выписываться на курс лечения до 1 мес. В этих случаях на рецептах должна быть надпись «По специальному назначению», скрепленная
подписью врача и печатью лечебно-профилактического учреждения «Для рецептов».
При выписывании хроническим больным рецептов на готовые лекарственные средства и лекарственные препараты индивидуального изготовления врачам разрешается устанавливать срок действия рецепта в пределах до 1 года, за исключением:
- лекарственных средств, подлежащих предметно-количественному учету;
- лекарственных препаратов, обладающих анаболической активностью;
- лекарственных средств, отпускаемых из аптечных учреждений по рецептам для амбулаторного лечения граждан, имеющих право на получение лекарственных средств бесплатно и со скидкой;
- спиртосодержащих лекарственных средств индивидуального изготовления. При выписывании таких рецептов врач должен сделать пометку «Хроническому больному», указать срок действия рецепта и периодичность отпуска лекарственных средств из аптечного учреждения (еженедельно, ежемесячно и т.п.), заверить это указание своей подписью и личной печатью, а также печатью лечебно-профилактического учреждения «Для рецептов».
Правила выписывания рецептов на бланке формы ? 148-1/у-04 (л) и формы ? 148-1/у-06 (л)
Рецепт выписывается врачом (фельдшером) в 3 экземплярах, с 2 экземплярами которого больной обращается в аптечное учреж- дение (организацию). Последний экземпляр рецепта подклеивается в амбулаторную карту больного.
Наркотические средства и психотропные вещества списка II для амбулаторного лечения граждан, имеющих право на получе- ние лекарственных средств бесплатно и со скидкой, выписываются на специальном рецептурном бланке на наркотическое средство и психотропное вещество, к которому дополнительно выписываются рецепты на рецептурном бланке формы ? 148-1/у-04 (л) или формы ? 148-1/у-06 (л).
Психотропные вещества списка III, иные лекарственные средства, подлежащие предметно-количественному учету, анаболические стероиды, предназначенные для амбулаторного лечения граждан, имеющих право на получение лекарственных средств бесплатно и
со скидкой, выписываются на рецептурном бланке ? 148-1/у-88, к которому дополнительно выписываются рецепты на рецептурном бланке формы ? 148-1/у-04 (л) или формы ? 148-1/у-06 (л).
Ранее до введения в действие приказа МЗ ? 110 рецепт оставался в аптеке, а взамен его больному выдавалась сигнатура.
Все остальные лекарственные средства, не включенные в перечень лекарственных средств, отпускаемых без рецепта врача, выписывают на рецептурных бланках формы ? 107/у.
Примечание 1. Перечень лекарственных средств, подлежащих пред- метно-количественному учету в аптечных учреждениях (организациях), организациях оптовой торговли лекарственными средствами, лечебнопрофилактических учреждений и частнопрактикующими врачами.
Предметно-количественному учету подлежат:
1. Наркотические средства и психотропные вещества, внесенные в список II, и психотропные вещества, внесенные в список III перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации. Кроме того, данные препараты запрещены для использования частнопрактикующими врачами.
2. Вещества, внесенные в перечень прекурсоров. Кроме того, данные препараты запрещены для использования частнопрактикующими врачами.
3. Лекарственные средства, входящие в список ? 1 «Сильнодействующие вещества» Постоянного комитета по контролю наркотиков.
4. Лекарственные средства, входящие в список ? 2 «Ядовитые вещества» Постоянного комитета по контролю наркотиков.
5. Субстанции апоморфина гидрохлорида, атропина сульфата, дикаина, гоматропина гидрохлорида, серебра нитрата, пахикарпина гидройодида.
6. Этиловый спирт.
7. Раствор медицинский антисептический.
8. Клозапин (лепонекс, азалептин).
9. Буторфанол (стадол, морадол).
Примечание 2. Рецепты на лекарственные средства с пометкой «statim» (немедленно) обслуживаются в срок, не превышающий 1 рабочий день с момента обращения больного в аптечное учреждение (организацию).
Рецепты на лекарственные средства с пометкой «cito» (срочно) обслуживаются в срок, не превышающий 2 рабочих дней с момента обращения больного в аптечное учреждение (организацию).
Рецепты на лекарственные средства, входящие в минимальный ассортимент лекарственных средств, обслуживаются в срок, не пре- вышающий 5 рабочих дней с момента обращения больного в аптечное учреждение.
Рецепты на лекарственные средства, включенные в перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера), и не вошедшие в минимальный ассортимент лекарственных средств, обслуживаются в срок, не превышающий 10 рабочих дней с момента обращения больного в аптечное учреждение (организацию).
Рецепты на лекарственные средства, назначаемые по решению врачебной комиссии, утвержденной главным врачом лечебно-профилактического учреждения, обслуживаются в срок, не превышающий 15 рабочих дней с момента обращения больного в аптечное учреждение.
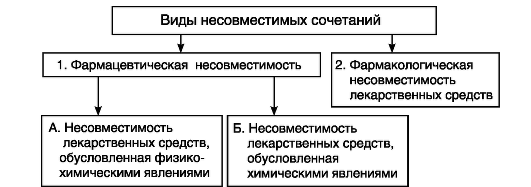
Несовместимость лекарственных средств - ослабление, потеря или извращение лечебного эффекта лекарственных средств или усиление их побочного или токсического действия. Различают фармацевтическую и фармакологическую несовместимость.
Фармацевтической несовместимостью называют такое сочетание ингредиентов, при котором в результате взаимодействия лекарственных веществ между собой или со вспомогательными веществами существенно изменяются их физические и химические свойства и терапевтическое действие.
Изменения, происходящие при совместном применении лекарственных средств, относят к фармакологической несовместимости и рассматривают в курсе фармакологии.
Несовместимость по характеру процессов, ее вызывающих, делят на 2 группы:
Юридические аспекты проблемы фармацевтической несовместимости
Приказом МЗ и СР РФ ? 110 от 12.02.2007 г. «рецепт, содержащий несовместимые лекарственные вещества, считается недействи- тельным...».
Согласно приказу министра здравоохранения, провизор обязан проверить совместимость ингредиентов в лекарственной форме.
Приказ Минздрава ? 214 от 6.07.1997 г. предусматривает «тщательный просмотр поступающих в аптеку рецептов и требований лечебно-профилактических учреждений в целях проверки совместимости веществ, входящих в состав лекарственного средства». Этим приказом введено принципиально новое правило изготовления инъекционных растворов. Изготовление растворов для инъекций не может проводиться при отсутствии данных о составе, режиме стерилизации и химической совместимости входящих в них лекарственных веществ.
При поступлении в аптеку неправильно выписанного рецепта с него снимается копия в 2 экземплярах. Подлинник рецепта погашается аптекой отметкой «рецепт недействителен» и возвращается больному.
Один экземпляр копии немедленно направляется главному врачу лечебного учреждения, откуда поступил рецепт, или руководителю местного органа здравоохранения - в случае выдачи рецепта средним медперсоналом или частнопрактикующим врачом.
Второй экземпляр копии хранится в аптеке отдельно от прочих документов в течение 1 года».
2.6.2. Ограничение круга лиц, которым
разрешается изготавливать лекарственные препараты
(право на фармацевтическую деятельность)
Право на занятие медицинской
и фармацевтической деятельностью
Право на изготовление лекарственных препаратов ограничивается Федеральным законом Российской Федерации ? 5487-1 «Об охране здоровья граждан» от 22.07.1993 г. и приказом МЗ и СР РФ ? 156. Пункт 2 приказа гласит: «Право на занятие медицинской и фармацевтической деятельностью в Российской Федерации имеют лица, получившие высшее или среднее медицинское и фармацевтическое
образование в Российской Федерации, имеющие диплом и специальное звание, а также сертификат специалиста и лицензию на осуществление медицинской или фармацевтической деятельности».
Сертификат специалиста выдается на основании послевузовского профессионального образования (аспирантура, ординатура), или дополнительного образования (повышение квалификации, специализация), или проверочного испытания, проводимого комиссиями профессиональных медицинских и фармацевтических ассоциаций, по теории и практике избранной специальности, вопросам законодательства в области охраны здоровья граждан.
Лица, не имеющие законченного высшего медицинского или фармацевтического образования, могут быть допущены к занятию медицинской или фармацевтической деятельностью в должностях работников со средним медицинским образованием в порядке, устанавливаемом федеральным органом исполнительной власти в области здравоохранения.
Врачи или провизоры, не работавшие по своей специальности более 5 лет, могут быть допущены к практической медицинской или фармацевтической деятельности после прохождения переподготовки в соответствующих учебных заведениях или на основании проверочного испытания, проводимого комиссиями профессиональных медицинских и фармацевтических ассоциаций.
Работники со средним медицинским или фармацевтическим образованием, не работавшие по своей специальности более 5 лет, могут быть допущены к практической медицинской или фармацевтической деятельности после подтверждения своей квалификации в соответствующем учреждении государственной или муниципальной системы здравоохранения либо на основании проверочного испытания, проводимого комиссиями профессиональных медицинских и фармацевтических ассоциаций.
Лица, незаконно занимающиеся медицинской и фармацевтической деятельностью, несут уголовную ответственность в соответствии с законодательством Российской Федерации.
Сертификат специалиста - это документ единого образца, подтверждающий соответствие подготовки специалиста согласно государственным образовательным стандартам по избранной специальности. Сертификат специалиста свидетельствует о достижении его обладателем определенного уровня теоретических знаний, практических навыков и умений, достаточных для самостоятельной медицинс-
кой и фармацевтической деятельности по избранной специальности согласно требованиям, предъявляемым к подготовке специалистов.
Сертификат специалиста выдают государственные и муниципальные медицинские (фармацевтические) образовательные и научно- исследовательские учреждения, осуществляющие послевузовскую или дополнительную подготовку. Сертификат специалиста действует на всей территории Российской Федерации и подтверждается каждые 5 лет после соответствующей подготовки в государственной или муниципальной системах дополнительного профессионального образования по результатам квалификационного экзамена. Специалист может иметь сертификаты по нескольким специальностям.
Квалификационный экзамен, проводимый для получения сертификата специалиста, имеет целью определить готовность специалиста к самостоятельной медицинской и фармацевтической деятельности. К квалификационному экзамену допускаются лица, прошедшие полный курс обучения в соответствии с программой послевузовского профессионального образования (аспирантура, ординатура, интернатура), дополнительного профессионального образования (повышение квалификации в объеме не менее 144 ч очной части) или профессиональной переподготовки в объеме свыше 500 ч.
Экзамен включает в себя 3 части: тестовый контроль, определение практических навыков специалиста и заключительное собеседование. Каждый экзаменуемый получает из тестовой программы по специаль- ности 100 вопросов по всем разделам специальности. На тестовый экзамен отводится 2 ч. Тестовый экзамен засчитывается, если соискатель правильно выполнил не менее 70% тестовых заданий.
Оценка практических навыков специалиста проводится по результатам послевузовского, дополнительного профессионального образования или на основании личного отчета экзаменуемого, заверенного непосредственным руководителем, отражающего умения и практические навыки. На заключительном собеседовании оцениваются профессиональное мышление специалиста, его умение решать профессиональные задачи (диагностические, тактические, организационные), анализировать имеющуюся информацию и принимать по ней соответствующее решение.
Целевые виды деятельности провизора-технолога
Провизор-технолог обязан осуществлять проверку рецептов в отношении правильности написания и оформления, совместимости ингредиентов, разовых и суточных доз лекарственных средств списков А
и Б. Провизор-технолог также руководит работой фармацевтов при изготовлении лекарственных препаратов и внутриаптечных заготовок, контролирует выполнение всех технологических требований. Он конт- ролирует соблюдение санитарного режима в производственных помещениях, исправность и точность всех весоизмерительных приборов.
Обязанности провизора-технолога
Провизор-технолог должен:
- знать фармацевтическое дело, законодательные акты, методические и нормативные документы, определяющие порядок деятельности аптечного предприятия (организации) по оказанию лекарственной помощи населению;
- знать управленческую, организационную, производственную и экономическую деятельность аптечного учреждения. Должен ор- ганизовать производственный процесс по лекарственному обеспечению населения и лечебно-профилактических учреждений;
- уметь изготавливать лекарственные формы всех видов и оформлять их к отпуску в соответствии с существующими требованиями и обучать персонал аптеки правильным методам изготовления лекарственных препаратов;
- уметь проверять качество лекарственных форм, изготовляемых в аптеках, с использованием современных методов контроля;
- знать все нормативные документы, регламентирующие фармацевтическую деятельность; вести работы по контролю соблюдения законодательства в аптечном учреждении;
- знать правила реализации лекарственных средств и оказывать квалифицированную консультацию по надлежащему хранению и применению лекарственных препаратов.
2.6.3. Нормирование условий производства и изготовления лекарственных препаратов
2.6.3.1. Производство и изготовление лекарственных средств
Производство лекарственных средств (препаратов) - серийное изго- товление, хранение с целью последующей реализации и реализация организацией-производителем произведенных лекарственных средств. К производству лекарственных средств предъявляются особые требования правилами надлежащего производства (GMP) и соответствующим отраслевым стандартом (ГОСТ).
Стандарт GMP («Good Manufacturing Practice», Надлежащая производственная практика) - система норм, правил и указаний в отношении производства лекарственных средств, медицинских устройств, изделий диагностического назначения, продуктов питания, пищевых добавок и активных ингредиентов. В отличие от процедуры контроля качества путем исследования выборочных образцов таких продуктов, которая обеспечивает пригодность к использованию лишь самих этих образцов (и, возможно, партий, изготовленных в ближайшее к данной партии время), стандарт GMP отражает целостный подход, регулирует и оценивает собственно параметры производства и лабораторной проверки.
Российский стандарт GMP был подготовлен Ассоциацией инженеров по контролю микрозагрязнений (АСИНКОМ) и в
Настоящий ГОСТ представляет собой свод правил по организации производства и контроля качества лекарственных средств меди- цинского назначения. Отдельные положения настоящего документа распространяются также на производство лекарственных веществ, предназначенных для приготовления готовых лекарственных средств. Стандарт распространяется на все предприятия, выпускающие готовые лекарственные средства медицинского назначения и лекарственные вещества, предназначенные для производства готовых лекарс- твенных средств, независимо от их ведомственной подчиненности и форм собственности.
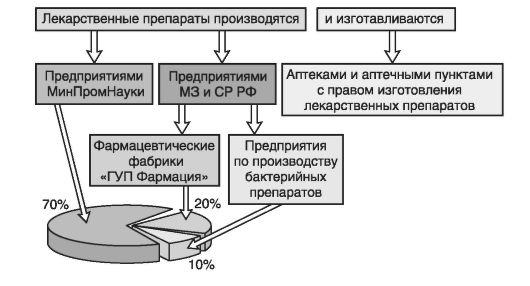
Производство лекарственных средств осуществляется на основе соответствующих лицензий предприятиями-производителями лекарственных средств (схема 2.1.), а изготовление - аптеками с рецептурно-производственным отделом.
Лицензия на производство лекарственных средств
Лицензия на производство лекарственных средств выдается предприятию-производителю лекарственных средств федеральным органом исполнительной власти, в компетенцию которого входит лицензирование производства лекарственных средств. Лицензия выдается на срок не менее чем 5 лет. Лицензия на производство лекарственных средств содержит:
- перечень лекарственных средств, разрешенных к производству предприятием-производителем лекарственных средств;
- данные об условиях производства лекарственных средств, включая размещение оборудования и количество производственных помещений;
- фамилии, имена, отчества лиц, ответственных за производство, качество и маркировку лекарственных средств.
Схема 2.1. Производители лекарственных средств и их доля в общем объеме
2.6.3.2. Изготовление лекарственных препаратов
Изготовление лекарственных препаратов - комплекс технических, технологических и организационных мероприятий, включающий получение лекарственных препаратов, проверку их качества, подготовку персонала и рабочего места, само изготовление лекарственного препарата в соответствии с требованиями нормативных документов, фасовку и упаковку, проверку качества и отпуск препарата больному.
Изготовление лекарственных препаратов осуществляется только в аптеке с рецептурно-производственным отделом, имеющей соответствующую лицензию по:
- рецептам врачей;
- требованиям лечебно-профилактических учреждений;
- стандартным прописям с последующей их реализацией в пределах юридического лица по рецептам и без рецептов врача.
Изготовление лекарственных препаратов проводится из лекарственных средств, зарегистрированных в Российской Федерации. При этом аптечное учреждение должно иметь лицензию на фармацевтическую деятельность, выданную в установленном порядке органом исполнительной власти субъекта Российской Федерации, на основании заключения территориального органа контроля качества лекарственных средств о соответствии условий изготовления лекарственных средств в аптечном учреждении требованиям федерального закона.
При изготовлении лекарственных препаратов аптечные организации в своей работе должны руководствоваться определенными требованиями, установленными государственными стандартами, санитарными, противопожарными правилами и другими нормативными документами (далее - стандарты), правилами охраны труда и техники безопасности.
В соответствии с ОСТ 91500-007 по характеру деятельности аптечные организации подразделяется на 3 вида:
- изготавливающие лекарственные препараты по рецептам врачей, требованиям учреждений здравоохранения, стандартным прописям, с последующей их реализацией в пределах юридического лица по рецептам и без рецептов врача;
- осуществляющие реализацию готовых лекарственных препаратов и других товаров, разрешенных к отпуску из аптечных организаций, населению по рецептам или без рецептов врача и учреждениям здравоохранения, просвещения, социального обеспечения по требованиям или заявкам (аптека с производственным отделом, аптечный пункт с правом изготовления лекарственных препаратов);
- осуществляющие реализацию готовых лекарственных препаратов и других товаров, разрешенных к отпуску из аптечных организаций, населению по рецептам или без рецептов врача и учреждениям здравоохранения по требованиям или заявкам (аптека готовых форм, аптечный пункт без права изготовления лекарственных препаратов, аптечный киоск, аптечный магазин).
Аптечные организации могут осуществлять следующие функции:
- реализацию населению готовых лекарственных препаратов (в том числе гомеопатических препаратов) по рецептам и без рецептов врача, учреждениям здравоохранения по требованиям или заявкам;
- изготовление лекарственных препаратов по рецептам врачей и требованиям учреждений здравоохранения, изготовление внут-
риаптечной заготовки в соответствии с утвержденными прописями и фасовку лекарственных препаратов и лекарственного растительного сырья с последующей их реализацией;
- отпуск лекарственных препаратов бесплатно или со скидкой отдельным группам населения в соответствии с действующим законодательством Российской Федерации и на основании заключенных договоров с территориальными органами управления здравоохранением, лечебно-профилактическими учреждениями и страховыми компаниями;
- аптечные организации наряду с лекарственными препаратами имеют право приобретать и продавать изделия медицинского назначения, дезинфицирующие средства, предметы личной гигиены, оптику, натуральные и искусственные минеральные воды, лечебное, детское и диетическое питание, косметическую и парфюмерную продукцию.
Приложением к приказу Министерства здравоохранения и социального развития Российской Федерации ? 319 от 03.05.2005 г. установлены следующие виды аптечных учреждений:
1. Аптека:
- готовых лекарственных форм;
- производственная;
- производственная с правом изготовления асептических препаратов;
- больничная;
- межбольничная;
- гомеопатическая.
2. Аптечный пункт:
- с правом изготовления лекарственных средств;
- без права изготовления лекарственных средств.
3. Аптечный киоск.
4. Аптечный магазин.
2.6.4. Нормирование условий и технологических процессов изготовления лекарственных препаратов
Включает следующие составные части:
- нормирование санитарного режима и условий асептики;
- нормирование условий приемки, хранения лекарственных средств, препаратов и изделий медицинской техники;
- нормирование правил работы с сильнодействующими, ядовитыми, наркотическими лекарственными средствами;
- нормирование процесса изготовления лекарственных препаратов, выполнения правил упаковки и оформления;
- нормирование показателей и порядка контроля качества изготовленных лекарственных препаратов с постадийным контролем.
2.6.4.1. Нормирование процесса изготовления лекарственных препаратов в части санитарного режима и условий асептики
Основные требования и нормативы установлены в приказе MЗ РФ ? 309 от 21.10.1997 г. «Об утверждении инструкции по санитарному режиму аптечных организаций».
Приказ включает инструкцию по санитарному режиму аптечной организации. Настоящая инструкция содержит основные требова- ния, предъявляемые к санитарному режиму аптечного производства и личной гигиене работников аптек. Действие инструкции распространяется на все аптеки независимо от их формы собственности и ведомственной подчиненности, находящиеся на территории Российской Федерации. Инструкция содержит 10 разделов:
1. Общие положения.
2. Термины и определения.
3. Санитарные требования к помещениям и оборудованию аптек.
4. Санитарные требования к помещениям и оборудованию асептического блока.
5. Санитарное содержание помещений, оборудования и инвентаря.
6. Санитарно-гигиенические требования к персоналу аптек.
7. Санитарные требования к получению, транспортировке и хранению воды очищенной и воды для инъекций.
8. Санитарные требования при изготовлении лекарственных средств в асептических условиях.
9. Санитарные требования при изготовлении нестерильных лекарственных форм.
10. Объекты микробиологического контроля в аптеках и 11 приложений:
1. Рекомендуемые состав и площади помещений аптек, обслуживающих население.
2. Максимальный перечень рабочих мест производственной аптеки.
3. Освещенность рабочих помещений, источники света, тип ламп в аптеках.
4. Расчетные температуры, кратности воздухообменов аптечных организаций (аптек).
5. Подготовка персонала к работе в асептическом блоке.
6. Правила поведения, обработка рук персонала, правила эксплуатации бактерицидных ламп.
7. Средства и режимы дезинфекции различных объектов.
8. Обработка укупорочных средств и вспомогательного материала.
9. Обработка аптечной посуды.
10. Режимы и методы стерилизации различных объектов.
11. Требования к микробиологической чистоте лекарственных средств.
2.6.4.2. Нормирование процесса изготовления лекарственных препаратов в части условий приемки, хранения лекарственных средств, препаратов и изделий медицинской техники
Основные положения и требования установлены в приказе МЗ РФ от 13.11.1996 г. ? 377 «Об утверждении инструкции по организации хранения в аптечных учреждениях различных групп лекарственных средств и изделий медицинского назначения».
Настоящая инструкция устанавливает требования к организации хранения различных групп лекарственных средств и изделий меди- цинского назначения на аптечных складах и в аптеках.
Инструкция распространяется на все аптечные склады и аптеки независимо от их ведомственной подчиненности и форм собст- венности.
Требования, устанавливаемые настоящей инструкцией, являются обязательными при проектировании и строительстве новых, реконструкции и эксплуатации действующих аптечных складов и аптек.
Экземпляр настоящей инструкции должен находиться у администрации, а также у лиц, несущих ответственность за ее выполнение.
Инструкция содержит следующие разделы:
1. Вводная часть.
2. Требования к устройству и эксплуатации помещений хранения.
3. Общие требования к организации хранения лекарственных средств и изделий медицинского назначения.
4. Требования, предъявляемые к организации хранения различных групп лекарственных средств и изделий медицинского назначения.
5. Особенности хранения лекарственного растительного сырья.
6. Дезинфицирующие средства.
7. Общие правила подготовки лекарственных средств и изделий медицинского назначения к использованию после хранения.
8. Хранение изделий медицинского назначения.
9. Пластмассовые изделия.
10. Перевязочные средства и вспомогательный материал.
11. Изделия медицинской техники.
12. Медицинские пиявки.
13. Требования к таре для лекарственных средств и изделий медицинского назначения.
2.6.4.3. Нормирование процесса изготовления лекарственных препаратов в части правил работы с сильнодействующими, ядовитыми, наркотическими лекарственными средствами
Приказ МЗ РФ ? 330 от 12.11.1997 г. «О мерах по улучшению учета, хранения, выписывания и использования наркотических лекарственных средств» предусматривает мероприятия по технической укрепленности и определяет основные принципы создания многорубежных систем охранно-пожарной сигнализации для защиты помещений (специальных хранилищ) с наркотическими средствами, внесенными в списки, издаваемые Постоянным комитетом по контролю наркотиков.
Кроме того, приказ определяет мероприятия по надлежащему учету и хранению наркотических лекарственных средств и содержит 11 приложений:
1. Типовые требования по технической укрепленности и оснащению средствами охранно-пожарной сигнализации помещений с хранением наркотических средств.
2. Форма специального рецептурного бланка на наркотическое лекарственное средство.
3. Расчетные нормативы потребности наркотических лекарственных средств для амбулаторных и стационарных больных.
4. Правила хранения и учета наркотических лекарственных средств в аптеках.
5. Правила хранения и учета наркотических лекарственных средств и специальных рецептурных бланков в лечебно-профилактических учреждениях.
6. Положение о списании и уничтожении наркотических лекарственных средств и специальных рецептов, не использованных онкологическими больными.
7. Правила хранения, учета и отпуска наркотических лекарственных средств и специальных рецептурных бланков на наркотические средства в аптечных складах (базах).
8. Правила хранения и учета наркотических средств в контрольноаналитических лабораториях.
9. Правила хранения и учета наркотических средств в научноисследовательских институтах, лабораториях и учебных заведениях.
10. Акт на уничтожение использованных ампул из-под наркотических лекарственных средств.
11. Форма внеочередного донесения, представляемого Министерству здравоохранения Российской Федерации, о хищении и краже наркотиков из аптечных и лечебно-профилактических учреждений.
2.6.4.4. Нормирование процесса изготовления лекарственных препаратов в части выполнения правил упаковки и оформления
В частности, нормирование условий изготовления жидких лекарственных форм установлено в приказе МЗ РФ от 21.10.1997 г. ? 308 «Об утверждении инструкции по изготовлению в аптеках жидких лекарственных форм».
Настоящая инструкция содержит основные методы и правила изготовления в аптеках жидких лекарственных форм для внутреннего и наружного применения, качество которых должно соответствовать требованиям, регламентированным действующей ГФ, нормативными документами, приказами и инструкциями Министерства здравоохранения Российской Федерации. Действие инструкции распространяется на все аптеки, находящиеся на территории России, независимо от форм собственности и ведомственной принадлежности.
Инструкция содержит следующие разделы:
1. Общие положения.
2. Основные правила изготовления жидких лекарственных форм.
3. Концентрированные растворы.
4. Аптечные бюреточные установки и мерная посуда. Справочные приложения:
- значения плотности некоторых жидких лекарственных средств;
- соотношение между плотностью и концентрацией водорода перекиси в растворе;
- перечень стандартных спиртовых растворов, разрешенных к изготовлению в аптеке;
- список концентрированных растворов и жидких лекарственных средств, рекомендуемых для отмеривания из бюреток;
- список растворов и жидких лекарственных средств, рекомендуемых для отмеривания из аптечных пипеток;
- список концентрированных растворов, рекомендуемых для изготовления глазных капель;
- данные для изготовления
- содержание спирта в некоторых жидких лекарственных средствах; коэффициенты увеличения объема (КУО);
- количества воды очищенной и спирта этилового концентрации 96,1-96,9% в граммах (г), которые необходимо смешать при 20 ?С, чтобы получить
30, 40, 50, 60, 70, 80, 90, 95, 96%;
- соответствие объемов (мл) спирта этилового различной концентрации массе (г) 96% спирта 20 ?С;
- коэффициенты водопоглощения лекарственного растительного сырья;
- особенности изготовления некоторых жидких препаратов;
- состав эмульсии бензилбензоата.
2.6.4.5. Нормирование процесса изготовления лекарственных препаратов в части показателей и порядка контроля качества изготовленных лекарственных препаратов с постадийным контролем
Контроль качества готового продукта включает систему мероприятий по обеспечению НД, реактивами и приборами, обучение персонала, проведение физико-химического анализа, регистрацию результатов, проверку и самоконтроль.
Приказ МЗ РФ ? 214 «О контроле качества лекарственных средств, изготавливаемых в аптечных организациях (аптеках)» устанавливает инструкцию «По контролю качества лекарственных средств, изготав- ливаемых в аптечных организациях (аптеках)».
Настоящая инструкция предусматривает мероприятия, обеспечивающие изготовление в аптеках лекарственных препаратов, качество которых соответствует требованиям, регламентированным ГФ, дейс- твующими нормативными документами Минздрава России.
Действие инструкции распространяется на все аптеки (в том числе гомеопатические), находящиеся на территории России, независимо от организационно-правовых форм и ведомственной принадлежности.
В инструкции имеются следующие разделы:
1. Общие положения
В соответствии с данным разделом приказа все лекарственные средства, изготовленные в аптеках (в том числе гомеопатических) по индивидуальным рецептам или требованиям лечебных организаций, в виде внутриаптечной заготовки, фасовки, а также концентраты и полуфабрикаты подвергаются внутриаптечному контролю: письменному, органолептическому и контролю при отпуске - обязательно; опросному и физическому - выборочно; химическому - в соответствии с требованиями главы VIII настоящей инструкции.
2. Приемочный контроль
Все ЛС и вспомогательные материалы при поступлении в аптеку подвергаются приемочному контролю. Приемочный контроль проводится с целью предупреждения поступления в аптеку некачественных лекарственных средств. Заключается в проверке поступающих лекарственных средств на соответствие требованиям по показателям: «Описание», «Упаковка», «Маркировка», в проверке правильности оформления расчетных документов (счетов), а также наличия сертификатов соответствия производителя и других документов, подтверждающих качество лекарственных средств в соответствии с действующими нормативными документами.
3. Виды обязательного контроля Письменный
Заключается в оформлении паспорта письменного контроля (ППК). В ППК должны быть указаны: дата изготовления, ? рецепта, наименование взятых лекарственных веществ и их количество, число доз, подписи изготовившего, расфасовавшего и проверившего лекарственную форму.
Правило 2
Паспорт заполняется немедленно после изготовления лекарственной формы, по памяти, на латинском языке, в соответствии с последовательностью технологических операций. В паспорте следует указывать формулы расчета и использованные при этом коэффициенты. Общая масса пилюль или суппозиториев, концентрация и объем изотонирующего и стабилизирующего веществ, добавленных в глазные капли, растворы для инъекций и инфузий, должны быть указаны не только в ППК, но и на рецептах. ППК сохраняются в аптеке в течение 2 мес.
Органолептический
Заключается в проверке лекарственных препаратов по показателям: «Описание» (внешний вид, цвет, запах), однородность, отсутствие видимых механических включений (в жидких лекарственных формах). На вкус проверяются выборочно лекарственные формы, предназначенные для детей.
Контроль при отпуске
Данному контролю подвергаются все изготовленные в аптеках лекарственные препараты (в том числе гомеопатические) при их отпуске. При этом проверяется соответствие:
- упаковки лекарственных средств физико-химическим свойствам входящих в них лекарственных веществ;
- указанных в рецепте доз НСПВ, А и Б возрасту больного;
- номера на рецепте и номера на этикетке;
- фамилии больного на квитанции, фамилии на этикетке и рецепте или его копии;
- копий рецептов прописям рецептов;
- оформления лекарственных средств действующим требованиям.
4. Виды выборочного контроля Физический
Заключается в проверке общей массы или объема лекарственного препарата, количества и массы отдельных доз (не менее 3 доз), входящих в данную лекарственную форму. Проверяются:
- качество укупорки каждой серии фасовки и внутриаптечной заготовки в количестве не менее 3 упаковок;
- лекарственные формы, изготовленные по индивидуальным рецептам (требованиям), не менее 3% от количества лекарс- твенных форм, изготовленных за день;
- каждая серия лекарственных форм, требующих стерилизации, после расфасовки до их стерилизации в количестве не менее 5 флаконов (бутылок).
Опросный
Проверяется каждый 5-й лекарственный препарат. Провизор-технолог называет первое, входящее в лекарственную форму вещество, а в лекарственных формах сложного состава указывает также его количество, после чего фармацевт называет все взятые лекарственные вещества и их количества.
5. Химический контроль
Химический контроль заключается в оценке качества изготовления лекарственного средства по показателям: «Подлинность»,
«Испытания на чистоту и допустимые пределы примесей» (качественный анализ) и «Количественное определение» (количественный анализ) лекарственных веществ, входящих в его состав. Качественному анализу подвергаются обязательно:
- вода очищенная, вода для инъекций ежедневно на отсутствие хлоридов, сульфатов и солей кальция;
- вода для изготовления стерильных растворов на отсутствие хлоридов, сульфатов, солей кальция, восстанавливающих веществ, солей аммония и углерода диоксида по ГФ;
- все лекарственные средства, концентраты и полуфабрикаты, поступающие из помещений хранения в ассистентскую;
- концентраты, полуфабрикаты и жидкие лекарственные средств в бюреточной установке и в штангласах с пипетками проверяются при заполнении;
- каждая серия лекарственных препаратов промышленного производства, расфасованная в аптеке, и внутриаптечная заготовка.
Качественному анализу подвергается выборочно лекарственный препарат у каждого фармацевта в течение рабочего дня (не менее 10% от общего количества). Особое внимание уделяется лекарственным препаратам для детей, глазным лекарственным формам, а также препаратам, содержащим НСПВ и А.
Качественному и количественному анализу (полный химический контроль) подвергаются обязательно:
1. Все растворы для инъекций и инфузий до стерилизации и после стерилизации.
2. Стерильные растворы для наружного применения.
3. Глазные капли и мази, содержащие наркотические вещества и вещества списка А.
4. Все лекарственные формы для новорожденных.
5. Растворы атропина сульфата и кислоты хлористо-водородной (для внутреннего употребления), растворы коллоидного серебра, в том числе нитрата.
6. Все концентраты, полуфабрикаты, тритурации.
7. Вся внутриаптечная заготовка лекарственных средств (каждая серия).
8. Стабилизаторы, применяемые при изготовлении растворов для инъекций, и буферные растворы, применяемые при изготовлении глазных капель.
9. Концентрация спирта этилового при разведении в аптеке.
Качественному и количественному анализу (полный химический контроль) подвергаются выборочно:
- лекарственные формы, изготовленные в аптеке по индивидуальным рецептам, в количестве не менее 3 лекарственных форм. Особое внимание уделяют лекарственным препаратам для детей, глазным лекарственным формам, содержащим НС и ПВ и вещества списка А, и растворам для лечебных клизм.
2.7. НАПРАВЛЕНИЯ ГОСУДАРСТВЕННОГО КОНТРОЛЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Законом о лекарственных средствах в Российской Федерации установлен приоритет государственного контроля:
- производства;
- изготовления;
- качества;
- эффективности;
- безопасности лекарственных средств.
Государственное регулирование отношений в сфере обращения лекарственных средств осуществляется путем:
- государственной регистрации лекарственных средств;
- лицензирования деятельности в сфере обращения лекарственных средств;
- аттестации и сертификации специалистов;
- государственного контроля производства, изготовления, качества, эффективности, безопасности лекарственных средств;
- государственного регулирования цен на лекарственные средства. Для осуществления государственного регулирования отношений
в сфере обращения лекарственных средств существует государственная система контроля качества, эффективности, безопасности лекарственных средств, которая включает:
- федеральный орган исполнительной власти и органы исполнительной власти субъектов Российской Федерации;
- научно-исследовательские учреждения, институты, лаборатории;
- этические советы, действующие при учреждениях здравоохранения;
- экспертные советы по обращению лекарственных средств при Правительстве Российской Федерации;
- информационную систему.
Государственный контроль качества лекарственных средств определен в приказе Минздрава РФ от 4.04.2003 г. ? 137 «Об утверждении порядка осуществления государственного контроля качества лекарственных средств на территории Российской Федерации». Настоящий документ определяет порядок проведения государственного контроля качества лекарственных средств на территории Российской Федерации (за исключением радиофармацевтических, иммунобиологических лекарственных средств, препаратов крови и кровезаменителей) и является обязательным для всех субъектов обращения лекарственных средств.
Государственный контроль качества лекарственных средств осуществляется в виде:
- предварительного контроля качества лекарственных средств;
- выборочного контроля качества лекарственных средств;
- повторного выборочного контроля качества лекарственных средств;
- контроля качества веществ растительного, животного или синтетического происхождения, обладающих фармакологической активностью и предназначенных для производства лекарствен- ных средств;
- проведения периодических проверок предприятий - производителей лекарственных средств, находящихся на территориях субъектов Российской Федерации, с целью инспектирования качества выпускаемых ими лекарственных средств.
Приказ ? 137 содержит следующие разделы:
I. Общие положения.
II. Предварительный контроль качества лекарственных средств.
III. Выборочный контроль качества лекарственных средств.
IV. Повторный выборочный контроль качества лекарственных средств.
V. Контроль качества веществ растительного, животного, микробного или синтетического происхождения, обладающих фармакологической активностью и предназначенных для производства лекарственных средств.
VI. Порядок отбора, направления и хранения образцов лекарственных средств для осуществления государственного контроля качества лекарственных средств.
Приложение 1. Решение о выпуске лекарственных средств. Приложение 2. Акт отбора образцов лекарственных средств.
В заключение данной главы следует сказать, что изготовление лекарственных препаратов является отдельной отраслью экономи- ки, имеющей как социальную, так и экономическую значимость. Поэтому практически все работы подлежат государственному нормированию и регулированию. Провизор в аптечном учреждении большую часть своего времени должен контролировать соответствие фармацевтического и санитарного порядка нормам законодательства. Только полное соответствие позволит изготавливать качественные, эффективные и безопасные лекарственные средства.
Контрольные вопросы
1. Что представляет собой государственное нормирование производства лекарственных препаратов?
2. Какие имеются направления нормирования? Какова их обоснованность?
3. Кто и на каком основании имеет право готовить лекарственные препараты?
4. Как формируется состав лекарственного препарата? Что представляют собой стандартные и нестандартные прописи?
5. Что такое рецепт? Какова его структура?
6. Можно ли готовить лекарственный препарат по рецепту, если в рецепте завышена разовая доза веществ списка А и Б? Как должен поступить провизор-технолог?
7. Что представляет собой Государственная фармакопея, фармакопейная
и временная фармакопейная статьи?
8. Каковы особенности ГФ ? Какие изменения имеются в ГФ по сравнению с ГФ Х?
9. Как нормируются условия производства лекарственных препаратов?
10. Каковы временные нормы непатогенных микроорганизмов в нестерильных лекарственных препаратах? Какие микроорганизмы должны в них отсутствовать и почему?
11. Объектами выборочного бактериологического контроля служили: воздух производственных помещений, лекарственные и вспомогательные материалы. Правильно ли это?
12. Какими приказами нормируется технологический процесс изготовления лекарственных препаратов?
13. Каковы основные правила оформления лекарственных препаратов? Перечислите основные этикетки и дополнительные надписи.
14. Какими приказами нормируется качество лекарственных препаратов?
Тесты
1. К занятию фармацевтической деятельностью допускаются лица, получившие:
1. Высшее или среднее медицинское и фармацевтическое образование, имеющие диплом и специальное звание, а на занятие определенными видами деятельности, перечень которых устанавливается Министерством здравоохранения и социального развития Российской Федерации, - также сертификат специалиста и лицензию.
2. Высшее или среднее медицинское фармацевтическое образование, имеющие диплом и специальное звание.
2. Сертификат специалиста свидетельствует о достижении его обладателем определенного уровня:
1. Теоретических знаний, практических навыков и умений, достаточных для самостоятельной медицинской и фармацевтической деятельности.
2. Определенного уровня знаний, достаточных для самостоятельной медицинской и фармацевтической деятельности.
3. Определенного уровня знаний.
3. Сертификат специалиста подтверждается:
1. Каждые 5 лет после соответствующей подготовки в государственной или муниципальной системах дополнительного профессионального образования по результатам ква лификационного экзамена.
2. Каждые 7 лет после соответствующей подготовки в государственной или муниципальной системах дополнительного профессионального образования по результатам квалификационного экзамена.
3. Каждые 5 лет.
4. Диплом о среднем фармацевтическом образовании первые:
1. Пять лет после его получения приравнивается к сертификату специалиста, за исключением специальностей, требующих дополнительной подготовки.
2. Десять лет после его получения приравнивается к сертификату специалиста, за исключением специальностей, требующих дополнительной подготовки.
5. Студенты, окончившие 4 и более курса высших медицинских или фармацевтических образовательных организаций:
1. Могут заниматься профессиональной деятельностью под контролем специалиста.
2. Не могут заниматься профессиональной деятельностью под контролем специалиста.
6. Лицам, имеющим ученую степень доктора фармацевтических наук, сертификат специалиста по соответствующей специальности:
1. Выдается.
2. Не выдается.
7. Выберите верное утверждение:
1. Медицинские и фармацевтические работники, не работавшие по своей специальности более 5 лет, могут быть допущены к профессиональной деятельности после дополнительной подготовки и подтверждения сертификата специалиста.
2. Медицинские и фармацевтические работники, не работавшие по своей специальности более 3 лет, могут быть допущены к профессиональной деятельности после дополнительной подготовки и подтверждения сертификата специалиста.
8. Квалификационный экзамен, проводимый для получения сертификата специалиста, имеет целью определить:
1. Готовность специалиста к самостоятельной медицинской и фармацевтической деятельности.
2. Уровень теоретических и практических знаний по медицинской и фармацевтической деятельности.
3. Уровень теоретических знаний по изучаемым дисциплинам, практические навыки, а также знание законодательства Российской Федерации.
9. Наркотические средства, психотропные вещества и их прекурсоры вносятся в следующие списки:
1. Список наркотических средств и психотропных веществ, оборот которых запрещен, - список I.
2. Список наркотических средств и психотропных веществ, оборот которых ограничен и в отношении которых устанавливаются меры контроля, - список II.
3. Список психотропных веществ, оборот которых ограничен и в отношении которых допускается исключение некоторых мер, - список III.
4. Список наркотических средств и психотропных веществ, оборот которых в Российской Федерации разрешен, - список V.
5. Список прекурсоров, оборот которых ограничен и в отношении которых устанавливаются меры контроля.
10. Принципы государственной политики в сфере оборота наркотических средств, психотропных веществ:
1. Государственная монополия на основные виды деятельности, связанные с оборотом наркотических средств, психотропных веществ.
2. Лицензирование всех видов деятельности, связанных с оборотом наркотических средств, психотропных веществ.
3. Координация деятельности федеральных органов исполнительной власти, органов исполнительной власти субъектов Российской Федерации, органов местного самоуправления.
4. Ограничение перечня лиц, имеющих допуск к работе с наркотическими веществами.
11. Выберите неверный ответ:
1. Изготовление наркотических средств или психотропных веществ, внесенных в список II, осуществляется государственными или муниципальными унитарными предприятиями.
2. Производство и изготовление психотропных веществ, внесенных в список III, осуществляются предприятиями и учреждениями независимо от форм собственности.
3. Производство и изготовление психотропных веществ, внесенных в список II, осуществляются предприятиями и учреждениями независимо от форм собственности.
4. Изготовление наркотических средств или психотропных веществ, внесенных в список III, осуществляется государственными или муниципальными унитарными предприятиями.
12. Производство и изготовление наркотических средств и психотропных веществ, внесенных в список II, осуществляется:
1. В пределах государственных квот государственными унитарными предприятиями и государственными учреждениями.
2. Учреждениями, находящимися в федеральной собственности.
3. При наличии лицензий на производство конкретных наркотических средств и психотропных веществ.
4. Предприятиями других форм собственности при получении соответствующих разрешительных документов МЗ и МВД РФ.
13. Наркотические средства и психотропные вещества, внесенные в списки II и III, отпускаются:
1. По рецепту.
2. Без рецепта.
3. По рецепту, выписанному менее 5 дней назад.
14. При осуществлении деятельности, связанной с оборотом прекурсоров, внесенных в список IV, любые операции, при которых изменяется количество прекурсоров, подлежат:
1. Регистрации в специальных журналах.
2. Предметно-количественному учету.
15. Наркотические средства должны храниться в сейфах, при этом:
1. Сейфы должны находиться в закрытом состоянии.
2. После окончания рабочего дня они должны опечатываться или пломбироваться. Ключи от сейфа, печать и пломбир должны хранить при себе материально ответственные лица, уполномоченные на то приказами по учреждениям здравоохранения.
3. Сейфы должны быть прикручены к стенам или установлены так, чтобы дверь отпиралась внутрь помещения на угол не более 30?.