Фармацевтическая технология. Изготовление лекарственных препаратов : учебник / А. С. Гаврилов. 2010. - 624 с. : ил.
|
|
|
|
ГЛАВА 3. АСЕПТИКА, СТЕРИЛИЗАЦИЯ
Асептика - условия и комплекс мероприятий, направленных на предотвращение микробного и другого загрязнения при получении стерильной продукции на всех этапах технологического процесса.
Согласно приказу МЗ ? 308 от 21.10.1997 г., в асептических условиях изготавливают:
- растворы для инъекций и инфузий;
- ирригационные растворы, вводимые в полости, не содержащие микроорганизмов;
- жидкие лекарственные формы для новорожденных и детей до 1 года;
- препараты в жидкой лекарственной форме, содержащие антибиотики и другие антимикробные вещества, а также предназначенные для нанесения на раны и ожоговые поверхности;
- капли глазные, офтальмологические растворы для орошений и примочки;
- концентрированные растворы (в том числе гомеопатические разведения);
- жидкие лекарственные препараты в виде внутриаптечной заготовки.
ГФ предъявляет особые требования к стерильным и асептически изготовляемым лекарственным формам.
Требования изложены в:
- фармакопейных статьях: «Formic medicamentorum pro injectionibus», «Guttae ophthalmicae», «Aqua pro injectionibus»;
- приложениях: «Стерилизация», «Проверка стерильности», «Проверка на микробиологическую чистоту», «Испытание на пирогенность».
Необходимость асептического изготовления лекарственных форм связана со следующими обстоятельствами:
- способом введения перечисленных растворов: нарушение защитных барьеров организма (кожа, слизистые оболочки), нане-
сение растворов на поверхности или в полости организма, не содержащие микроорганизмов, или на слизистую оболочку глаза, характеризуемую повышенной чувствительностью к микроорганизмам;
- низкой сопротивляемостью организма детей до 1 года к инфицированию;
- разрушением действующих веществ (антибиотики) ферментами микроорганизмов, попавших в лекарственные формы, и, следовательно, потерей эффективности лекарственных препаратов.
Для обеспечения асептики необходимо учитывать источники микробной контаминации лекарственных препаратов, которыми являются:
- воздух;
- поверхность оборудования и помещений;
- персонал;
- вспомогательные и упаковочные материалы;
- лекарственные вещества.
Поэтому в аптеке, изготавливающей стерильные лекарственные формы, необходимо наличие:
- помещений асептического блока;
- оборудования для поддержания асептических условий, в том числе воздушного шлюза, ламинарного бокса, бактерицидных облучателей, ковриков для обеспыливания обуви;
- устройств кондиционирования, фильтрации и стерилизации воздуха.
Должен соблюдаться порядок:
- обработки помещений и оборудования;
- подготовки персонала к работе в асептических условиях;
- обработки, мойки тары и вспомогательных материалов;
- стерилизации лекарственных препаратов, вспомогательных веществ, тары и материалов.
3.1. АСЕПТИЧЕСКИЙ БЛОК
Для изготовления лекарственных препаратов в асептических условиях в аптеке имеется асептический блок.
Асептический блок - территория аптеки, специально выделенная, оборудованная и используемая таким образом, чтобы снизить про-
никновение, образование и задержку в ней микробиологических и других загрязнений.
Асептические блоки включают:
- моечную;
- стерилизационную для посуды;
- ассистентскую (асептическую);
- фасовочную (асептическую);
- стерилизационную для лекарственных препаратов;
- контрольно-маркировочную комнату.
В блоке предусмотрены следующие мероприятия:
- стерильная фильтрация нагнетаемого воздуха;
- облучение бактерицидными лампами поверхностей;
- уборка 1 раз в смену всех поверхностей и оборудования;
- ношение стерильной спецодежды;
- хранение только стерильных материалов.
Помещения асептического блока должны размещаться в изолированном отсеке и исключать перекрещивание «чистых» и «грязных» потоков (рис. 3.1).
Асептический блок должен иметь отдельный вход или отделяться от других помещений производства воздушным шлюзом.
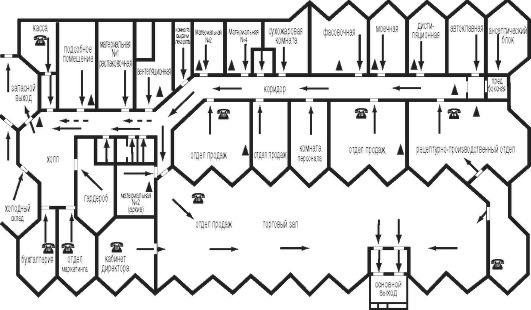
Рис. 3.1. Экспликация помещений аптеки с правом изготовления стерильных лекарственных форм
Требования к помещениям для производства лекарственных препаратов в асептических условиях
Производство и изготовление стерильных препаратов предъявляют особые требования к организации производственного процесса, помещениям и оборудованию. Эти требования установлены в международном стандарте «Good Manufacturing Practices» (GMP) - «Правила правильного производства».
GMP - это единая система требований по организации производства и контролю качества лекарственных средств от начала переработки сырья до производства готовых продуктов, включая общие требования к организации и ведению технологического процесса.
В нашей стране действует ГОСТ Р. 52249-2004 «Правила производства и контроля качества лекарственных средств», разработан и готовится к внедрению одноименный технический регламент.
В соответствии с ГОСТ все этапы технологического процесса изготовления лекарственных средств (препаратов) проводятся в чистых помещениях и подлежат обязательному освидетельствованию на соответствие определенным требованиям.
«Чистое» помещение - производственное помещение и(или) зона для изготовления лекарственных средств (препаратов) с чистотой воздуха, нормируемой по содержанию механических частиц определенного размера и жизнеспособных микроорганизмов, сконструированное и используемое таким образом, чтобы свести к минимуму проникновение, распространение, образование и сохранение механических частиц и микроорганизмов внутри этих помещений.
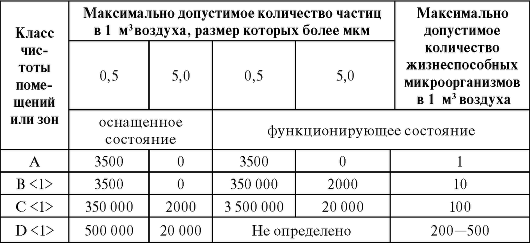
Все чистые помещения в зависимости от содержания микроорганизмов и механических частиц подразделяются на 4 класса чистоты (А, В, С, D) (табл. 3.1).
Класс чистоты помещения - степень чистоты воздуха, характеризуемая содержанием механических частиц определенного размера и микробных частиц в
1-й класс чистоты А достигается установкой в помещениях 2-го класса «чистых» камер - локальных чистых зон с подачей ламинарного потока стерильного чистого воздуха (ламинарные боксы). В этих помещениях проводят асептическое приготовление растворов, розлив стерильных растворов, укупорку флаконов, выгрузку стерильных флаконов, пробок и другие операции, требующие особой чистоты воздуха.
2-й и 3-й классы чистоты В, С обеспечиваются стерильной приточной вентиляцией, увеличением кратности воздухообмена, специ-
Таблица 3.1. Классификация помещений для производства лекарственных средств
альной санитарной подготовкой помещения, оборудования и персонала, применением бактерицидных ламп, установкой рециркуляционных очистителей воздуха.
В помещениях 2-го класса В проводятся операции стерильной фильтрации растворов, сушка, фасовка стерильных порошков, выгрузка стерильных флаконов и пробок, выгрузка и хранение стерильной технологической одежды.
В помещениях 3-го класса С чистоты проводятся мойка флаконов, пробок, кассет, загрузка их на стерилизацию, предварительная фильтрация растворов, подготовка стерилизующих фильтров; находятся лаборатории.
4-й класс чистоты D включает помещения, в которых установлены аппараты распылительной сушки, проводится приготовление дезинфицирующих растворов, просмотр, этикетирование ампул, упаковка и хранение готовой продукции; бытовые помещения.
Асептические блоки проектируют и изготавливают в 3 модификациях:
1. Из стандартных строительных материалов (рис. 3.2.). Монтаж занимает от нескольких недель до месяцев. Стоимость - не менее 2000/м2долл.
2. Сборные из алюминиевых и стеклянных профилей (рис. 3.3.). Такие блоки могут встраиваться в существующие производст- венные площади. Монтаж занимает до 2 нед. Стоимость - до
1000/м2 долл.
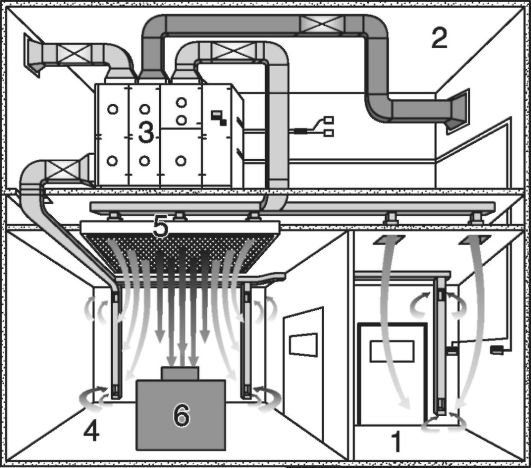
Рис. 3.2. Твердостенный вариант устройства чистых помещений Hardwal Clean room. Устройство и распределение воздушных потоков: 1 - тамбур-шлюз; 2 - технический этаж; 3 - кондиционер; 4 - ассистентская- асептическая; 5 - стерилизующий фильтр воздуха; 6 - оборудование (ламинарный бокс)

Рис. 3.3. Модульный вариант устройства чистых комнат
3. Из полимерной пленки (временные чистые комнаты) (рис. 3.4.). Данные конструкции характеризуются низкой стоимостью.

Рис. 3.4. Организация зон различной чистоты с помощью полимерных пленок
Монтаж осуществляется быстро, при этом используются существующие здания и коммуникации. Размер комнат - 4x6 м. Общий размер - не более 30x30 м.
3.2. УСТРОЙСТВА И ОБОРУДОВАНИЕ ДЛЯ ПОДДЕРЖАНИЯ АСЕПТИЧЕСКИХ УСЛОВИЙ
В связи с особенностью работы в асептических блоках должны быть устройства, необходимые для поддержания асептических условий.
А. Воздушный шлюз - установленное в замкнутом пространстве устройство, предотвращающее проникновение механических частиц или микроорганизмов, или замкнутое пространство между помещениями различной чистоты, отделенное от них дверьми (см. поз. 1 на рис. 3.2.).
В шлюзе создается подпор воздуха (повышенное давление) на 1-
В шлюзе должны быть предусмотрены:
- скамья для переобувания с ячейками для спецобуви;
- шкаф для халата и биксов с комплектами стерильной одежды;
- раковина (кран с локтевым приводом);
- одноразовые гигиенические салфетки и зеркало; гигиенический набор для обработки рук;
- инструкции о порядке переодевания и обработке рук, правила поведения в асептическом блоке.
Б. Коврики для обеспыливания обуви. Коврики располагают перед входом в воздушный шлюз, пропитывают дезинфицирующими средствами. Рекомендуются вязаные коврики из полиэфирной нити, которая имеет абразивную структуру, позволяющую быстро и полно чистить обувь, в том числе сильно загрязненную. Дополнительно для очистки подошвы обуви от микрочастиц пыли применяются липкие циновки, изготовленные из тонких слоев пластыря на пленке из полиэтилена (рис. 3.5.).
В. Ламинарный бокс. Ламинарный бокс - специальное оборудование для создания горизонтальных или вертикальных ламинарных (однонаправленное без перемешивания движение молекул и частиц) потоков чистого воздуха в отдельных локальных зонах для защиты наиболее ответственных участков или операций внутри чистых помещений (рис. 3.6.). Стерильная зона создается ламинарным потоком воздуха, поступающего от вентилятора через стерилизующий фильтр. Ламинарные боксы имеют рабочие поверхности и колпак из гладкого прочного материала. Скорость ламинарного потока - в пределах 0,3-0,6 м/с. При работе необходим регулярный контроль стерильности воздуха не реже 1 раза в месяц.
Г. Бактерицидные облучатели. Для дезинфекции различных поверхностей и воздуха внутри чистых помещений применяют стационарные или передвижные облучатели с открытыми или экранированными лампами. Облучатели бактерицидные представляют собой газоразрядные лампы, излучающие ультрафиолетовые лучи с длиной волны 254 нм, соответствующей области наибольшего бактерицидного действия лучистой энергии.
Количество и мощность бактерицидных ламп должны подбираться из расчета не менее 2-2,5 Вт мощности неэкранированного излучателя на

Рис. 3.5. Пластырь и ковры

Рис. 3.6. Ламинарный бокс; схема распределения воздушных потоков. Устройство:
1 - стерилизующий фильтр; 2 - фильтр грубой очистки воздуха; 3 - вентилятор. Стрелками показано направление движения воздуха
бактерицидных лампах 1 Вт на
Открытые бактерицидные лампы применяются в отсутствие людей в перерывах между работой, ночью или в специально отведенное время - до начала работы на 1-2 ч. Средний срок службы бактерицидной лампы составляет 2100 ч. Необходимо учитывать продолжительность работы каждого облучателя в специальном журнале, фиксируя время включения и выключения лампы. Облучатель бактерицидный передвижной также предназначен для специального облу- чения каких-либо поверхностей. Его необходимо максимально приблизить

Рис. 3.7. Бактерицидный облучатель настенный или потолочный
к поверхности для проведения облучения в течение не менее 20 мин.
Экранированные бактерицидные лампы (рис. 3.9) могут работать до 8 ч в сутки. Принцип их действия основан на перемещении воздуха внутри пространства, облучаемого бактерицидными лампами. Если после 1,5-2 ч непрерывной работы ламп при отсутствии достаточной вентиляции в воз- духе будет ощущаться характерный запах озона, рекомендуется выключить лампы на 30-60 мин.
3.3. УСТРОЙСТВА КОНДИЦИОНИРОВАНИЯ, ФИЛЬТРАЦИИ И СТЕРИЛИЗАЦИИ ВОЗДУХА
Для исключения поступления воздуха из коридоров и производственных помещений в асептический блок в последнем необходимо предусмотреть приточно-вытяжную вентиляцию, при которой движение очищенных от пыли и микроорганизмов воздушных потоков должно быть направлено из асептического блока в прилегающие к нему помещения, с преобладанием притока воздуха над вытяжкой.
В настоящее время для подготовки воздуха используют системы кондиционирования, которые позволяют одновременно с подачей воздуха проводить его фильтрование от пыли и микроорганизмов, охлаждать или нагревать его до температуры 18-20 ?С, снижать влажность до 65%.

Рис. 3.8. Облучатель бактерицидный передвижной

Рис. 3.9. Экранированный ультрафиолетовый облучатель- рециркулятор бактерицидный передвижной
В зависимости от мощности кондиционеры разделяют на 2 класса: настенные (рис. 3.10.) и крышные (рис. 3.11.).
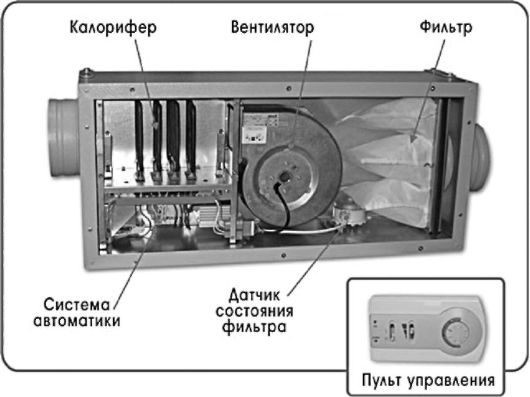
Рис. 3.10. Устройство настенного кондиционера

Рис. 3.11. Крышной кондиционер
Крышные системы центрального кондиционирования с переменным расходом фреона блочного типа совмещают в одном устройстве приточную, вытяжную вентиляцию, очистку и кондиционирование воздуха (рис. 3.12.). Система позволяет подключение к одному наружному блоку до 20 внутренних приточно-вытяжных устройств (рис. 3.13.), работающих в различных режимах. Из смесительной камеры (рис. 3.14.) воздух проходит через фильтр и подается к теплообменнику (испарителю или конденсатору) холодильной машины, где он охлаждается или
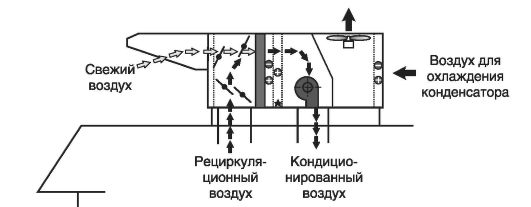
Рис. 3.13. Принцип крышного кондиционирования
нагревается. После теплообменников воздух с требуемой температурой подается центробежным вентилятором в систему распределительных воздуховодов. Воздух забирается из атмосферы и фильтруется через фильтры грубой и тонкой очистки (рис. 3.15.). В результате в помещения подается воздух, соответствующий требованиям GMP и ОСТ по количеству пыли и микроорганизмов.
Кондиционеры выпускаются в широком диапазоне мощности - от 8 до 140 кВт по холоду и теплу и соответствующим расходом воздуха - от 2100 до 25 000 м3/ч. Достоинствами систем крышного кондиционирования являются простота монтажа и установки, компактность. Единая система автоматики позволяет при задании необходимой температуры в помещении автоматически поддерживать не только ее, но и влажность, кратность воздухообмена в каждом помещении отдельно.

Рис. 3.14. Приточно-вытяжное устройство внутри помещения

Рис. 3.15. Фильтры грубой, тонкой и стерилизующей фильтрации воздуха
3.4. ПОРЯДОК И ОБОРУДОВАНИЕ ДЛЯ ОБРАБОТКИ ПОМЕЩЕНИЙ И ОБОРУДОВАНИЯ
Уборку помещений асептического блока (полов и оборудования) проводят не реже 1 раза в смену в конце работы с использованием дезинфицирующих средств. Один раз в неделю проводят генеральную уборку - по возможности с освобождением от оборудования.
Необходимо строго соблюдать последовательность стадий при уборке асептического блока. Начинать следует с асептической. Вначале моют стены и двери от потолка к полу. Движения должны быть плавными, обязательно сверху вниз. Затем моют и дезинфицируют стационарное оборудование и в последнюю очередь полы. Все оборудование и мебель, вносимые в асептический блок, предварительно обрабатывают дезинфицирующим раствором. В качестве химических дезинфектантов применяют хлорсодержащие, кислородсодержащие, поверхностно-активные вещества, альдегиды, спирты.
1. Хлорсодержащие дезинфектанты
К этим средствам относятся: хлорамин-Б, ди- или трихлоризоциануровая кислота, ее натриевые соли. Хлорсодержащие средства применяют в основном для дезинфекции изделий медицинского назначения из стекла, пластмассы, резины и других коррозионностойких материалов.
Высокой активностью обладают электрохимически активированные растворы хлора, полученные на установках группы СТЭЛ. Принцип работы установки заключается в электрохимическом преобразовании низкоминерализованного раствора хлорида натрия в метастабильный раствор хлора.
2. Кислородсодержащие дезинфектанты
Это препараты, в которых активным компонентом является водорода пероксид. В медицинской практике применяется не только, собственно, водорода пероксид (и для дезинфекции, и для стерилизации), но и другие производные пероксида в неорганической (персульфат натрия) или органической (мочевины пероксид «Гидропирит») формах.
3. Поверхностно-активные соединения
Антисептической активностью обладают дезинфектанты, содержащие соли четвертичного аммония в комбинации с другими химическими средствами. Например, препарат «Эрисан-ДЕЗ» в качестве действующих веществ содержит 9,5-10,5% додецилдиметиламмоний хлорида (ЧАС) и другие компоненты; рН 10,6-11,6.
4. Альдегидсодержащие препараты
Их преимуществом является наличие дезинфицирующих, а у некоторых (формальдегид) - стерилизующих свойств, при отсутствии коррозирующего воздействия на обрабатываемые предметы. Применяют для обработки изделий из термолабильных материалов.
5. Спирты
Для дезинфекции используют этиловый спирт 70% концентрации (время обеззараживания - не менее 30 мин) и ряд дезинфицирующих средств, содержащих пропанолы, изопропанол. Наиболее эффективны растворы четвертичных солей в спирте.
Порядок проведения дезинфекции
Дезинфекцию проводят в соответствии с требованиями приказа ? 309. Режимы и средства дезинфекции представлены в табл. 3.2 и 3.3. Для уборки и дезинфекции поверхностей рекомендуются материалы с минимальным ворсоотделением.
Таблица 3.2. Дезинфекция помещений и инвентаря
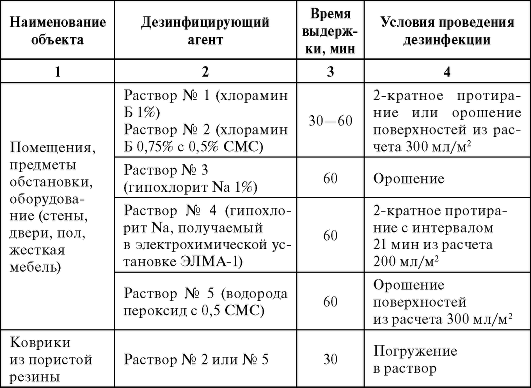
Окончание табл. 3.2
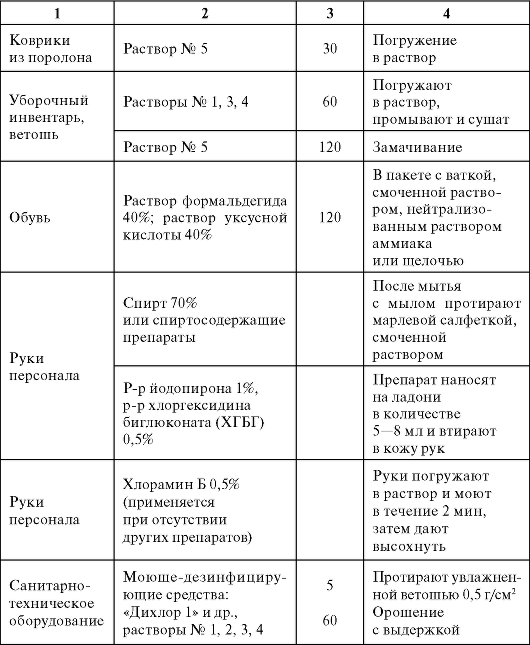
В настоящее время для обработки асептического блока применяют устройство для мойки стен и потолков. Прибор состоит из ручки, поворачивающейся на 360?, и основания, покрытого безворсовым полиэфирным тканевым полотном (рис. 3.16).
Таблица 3.3. Дезинфекция вспомогательных материалов
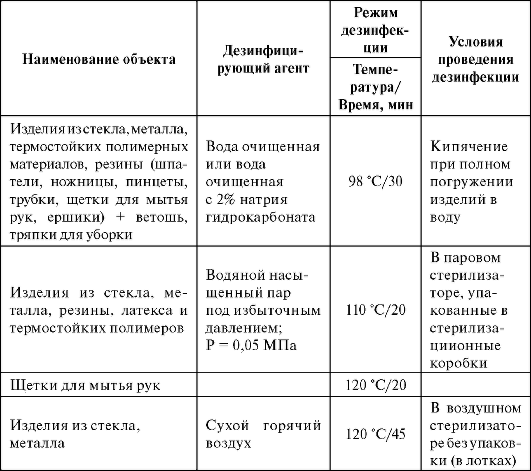

Рис. 3.16. Устройство для мойки стен и потолков
3.5. ПОДГОТОВКА ПЕРСОНАЛА К РАБОТЕ В АСЕПТИЧЕСКИХ УСЛОВИЯХ
Особое внимание в производственной аптеке должно уделяться подбору и подготовке производственного персонала для работы в асептических условиях.
Персонал асептического блока должен обладать кроме специальных знаний и опыта практической работы знаниями по основам гигиены и микробиологии для осознанного выполнения санитарных требований и правил, должен быть готов к возможным неудобствам в работе, связанным с систематической обработкой рук и строго определенной последовательностью переодевания, использованием воздухопроницаемой повязки на лице, резиновых перчаток на руках и др.
Комплект специальной одежды для персонала, работающего в асептических условиях, предназначен для защиты медикаментов, вспомогательных веществ и материалов, готовой продукции и воздушной среды от вторичной контаминации микроорганизмами и механическими частицами, выделяемыми персоналом.
В комплект входят комбинезон, шапочка, бахилы из материала с минимальным ворсоотделением, маска, состоящая из 3 слоев: наружный - для грубой фильтрации воздуха, затем микроволоконный - для тонкой фильтрации и гладкий внутренний слой для максимального комфорта; оптически прозрачный пластмассовый щиток лица обеспечивает защиту для лица и глаз
(рис. 3.17).
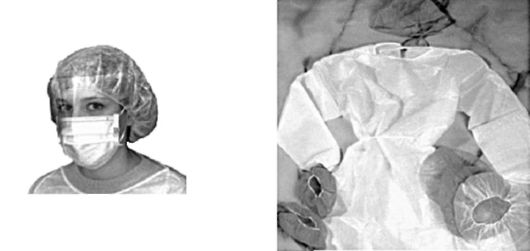
Рис. 3.17. Комплект одежды для асептического блока

Рис. 3.18. Автоматический дозатор жидкого мыла, реагирующий на движение рук
Для мытья рук персонала в шлюзах асептического блока должны быть установлены раковины, которые целесообразно оборудовать педальными кранами, кранами с локтевыми приводами или фотоэле- ментами.
Тщательное мытье рук с моющим средством удаляет с поверхности рук до 99% транзиторной микрофлоры. Для механического удаления загрязнений и микрофлоры руки моют теплой проточной водой с мылом в течение 1-2 мин, обращая внимание на околоногтевые пространства.
Для мытья рук наиболее предпочтительно применение жидкого мыла в дозаторах с флаконами однократного применения (рис. 3.18). Затем руки ополаскивают водой для удаления мыла и обрабатывают дезсредствами.
В асептическом блоке (в шлюзе) руки после ополаскивания вытирают насухо одноразовыми полотенцами (применение элект- росушилок запрещается), надевают стерильную одежду, затем руки промывают специально подготовленной водой и обрабатывают дезсредствами. Обработку повторяют, если работа длится более 4 ч.
3.6. ОБРАБОТКА, МОЙКА ТАРЫ И ВСПОМОГАТЕЛЬНЫХ МАТЕРИАЛОВ
Все материалы, тара и упаковка, поступающие в асептический блок, подлежат обработке.
А. Обработка укупорочных средств и вспомогательных материалов
Включает следующие технологические операции:
- мойку и ополаскивание;
- сушку и стерилизацию;
- контроль качества обработки.
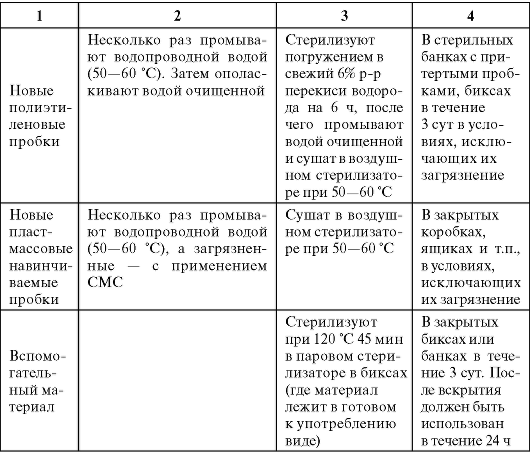
Режимы подготовки вспомогательных материалов представлены в табл. 3.4.
Таблица 3.4. Обработка вспомогательных материалов
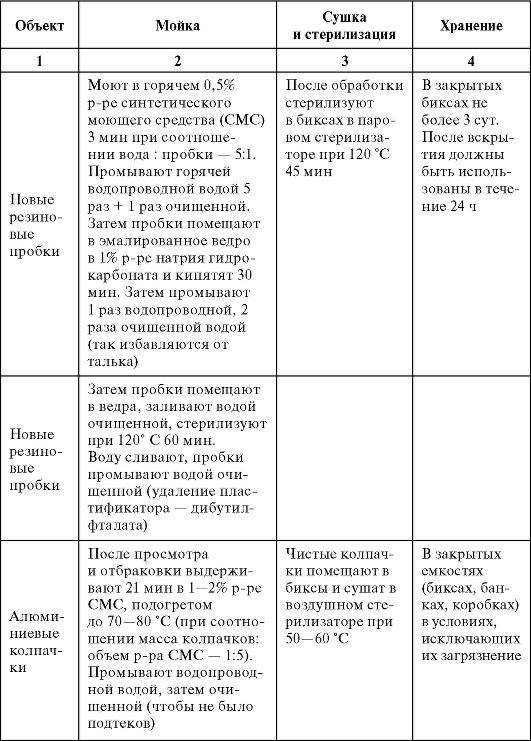
Окончание табл. 3.4.
Б. Обработка аптечной посуды
Включает следующие технологические операции:
- дезинфекцию;
- замачивание и мойку (или моюще-дезинфицирующую обработку);
- предстерилизационную очистку;
- ополаскивание;
- сушку (или стерилизацию);
- контроль качества обработки.
Последовательность обработки аптечной посуды представлена в табл. 3.5.
В. Предстерилизационная очистка
Очистка проводится после дезинфекции и отмывки изделий от дезинфектанта.
Таблица 3.5. Обработка аптечной посуды
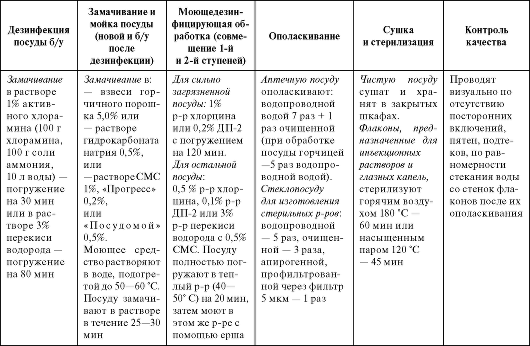
Окончание табл. 3.5
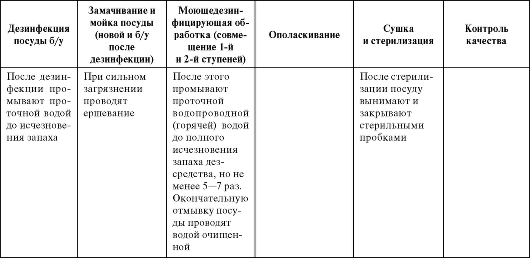
Целью предстерилизационной очистки является окончательное удаление остатков белковых, жировых, механических загрязнений.
Проведение предстерилизационной очистки снижает риск пирогенных реакций у пациента. На данной стадии используют толь- ко разрешенные МЗ РФ моющие средства. От полноты и качества проведения предстерилизационной очистки напрямую зависит эффективность последующей стерилизации, поэтому нормативами в практику введен обязательный контроль качества предстерилизационной очистки, осуществляемый как самим лечебно-профилактическим учреждением, так и специалистами санэпидслужбы. Это, в частности, пробы, регистрирующие остатки крови на инструментах - азопирамовая, бензидиновая и амидопириновая, а также выявляющие остаточные количества моющих средств: фенолфталеиновая и определение рН (для аптечной посуды).
В настоящее время существует и ряд комбинированных средств, позволяющих совмещать мойку, дезинфекцию и предстерилизационную очистку на одном этапе обработки.
Для предстерилизационной очистки рекомендуется применение машинной мойки стекла и изделий взамен ручной. Преимуществами этого способа являются ограничение контакта персонала с инфици- рованным материалом и возможность более качественной очистки при сочетании нескольких режимов мойки, ополаскивания и сушки. Особенно машинная мойка рекомендуется для инструментов, материалов, имевших контакт с инфицированными объектами.
Моечная машина имеет 5 различных программ мойки и(или) дезинфекции. Температура воды при мойке легко регулируется, что позволяет проводить очистку медицинских изделий из любых материалов: металла, резины, пластмассы и стекла. Время цикла дезинфекции и температура программируются от 1 до 10 мин и от 80 до 93 ?С соответственно путем использования специальных кодов. Машина имеет вращающиеся моющие рычаги с форсунками и автоматические клапаны инжекторных стоек, чтобы обеспечить попадание воды в инструменты сложной конструкции, пробирки, шланги и бутылки. Конструкция гарантирует полный контакт воды и моющего средства со всеми частями обрабатываемых изделий (рис. 3.19).
Для обработки загрязненных изделий небольшого объема эффективны ультразвуковые моечные ванны (рис. 3.20). Кавитация, созда- ваемая ультразвуковым свистком, способствует более полному отделению прочных загрязнений.

Рис. 3.19. Моечная машина

Рис. 3.20. Ультразвуковая моечная ванна
3.7. СТЕРИЛИЗАЦИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ВСПОМОГАТЕЛЬНЫХ ВЕЩЕСТВ, ТАРЫ И МАТЕРИАЛОВ
Стерилизация (от лат. sterilis - бесплодный) - полное уничтожение в том или ином объекте живых микроорганизмов и их спор.
Стерилизация имеет большое значение при изготовлении всех лекарственных форм и особенно инъекционных. В данном случае следует стерилизовать посуду, вспомогательные материалы, растворители и готовый раствор. Таким образом, работа по изготовлению растворов для инъекций должна начинаться со стерилизации и ею заканчиваться.
Сложность проблемы стерилизации заключается, с одной стороны, в высокой жизнеспособности и большом разнообразии микроорганизмов, с другой - термолабильностью многих лекарственных веществ и лекарственных форм (эмульсий, суспензий и др.). Отсюда исходят требования к методам стерилизации: сохранение свойств лекарственных форм и освобождение их от микроорганизмов.
В фармации используются следующие методы стерилизации:
- термическая стерилизация;
- стерилизация фильтрованием;
- стерилизация ультрафиолетовой радиацией;
- химическая стерилизация;
- радиационная стерилизация.
В табл. 3.6 представлены различные методы стерилизации и их сравнительная эффективность для различных объектов.
3.7.1. Термическая стерилизация
Стерилизация термическая - технологический процесс умерщвления всех микроорганизмов, включая споры, за счет их разрушения при высокой температуре. Термическую стерилизацию разделяют на 2 класса:
- воздушная стерилизация;
- стерилизация водяным паром. А. Воздушная стерилизация
Эффективность воздушной стерилизации зависит от температуры и времени ее проведения. Равномерность прогрева объектов зави- сит от степени их теплопроводности и правильности расположения внутри стерилизационной камеры для обеспечения свободной циркуляции горячего воздуха. Стерилизуемые объекты должны быть расфасованы в соответствующую тару, плотно укупорены и свободно размещены в стерилизаторах. В связи с тем что воздух обладает невысокой теплопроводностью, прогрев стерилизуемых объектов происходит довольно медленно, поэтому загрузка должна производиться в ненагретые стерилизаторы или тогда, когда температура внутри них не превышает 60 ?С.
Воздушная стерилизация осуществляется горячим воздухом в воздушных стерилизаторах при температуре 180-200 ?С (табл. 3.7.). В аптеках используют шкаф сушильный стерилизационный марки ШСС-250, стерилизатор сухожаровой СС-200, а также воздушные стерилизаторы ШСС-500, ШСС-1000П, ШСС-500П и ШСС-100П (проходного типа).
Стерилизатор воздушный (рис. 3.21) предназначен для стерилизации изделий медицинского назначения путем воздействия горячим воздухом заданной температуры в течение заданного времени. Стерилизатор состоит из корпуса, теплонагревающих элементов, вентилятора и термореле. Высокий уровень автоматики, оптимальная принудительная циркуляция горячего воздуха в камере, качественная термоизоляция из базальтового волокна гарантируют устойчивость в работе и безопасность для персонала.
Таблица 3.6. Сравнительная эффективность методов стерилизации

Таблица 3.7. Режим воздушной стерилизации термостабильных порошков (натрия хлорида, цинка оксида, талька, глины белой и др.)
Масса образца, г | Температура, ?С | Минимальное время стерилизационной выдержки, мин |
До 25 | 180-200 | 30-10 |
От 25 до 100 | 180-200 | 40-20 |
От 100 до 200 | 180-200 | 60-30 |

Рис. 3.21. Стерилизатор воздушный
Преимуществом воздушной стерилизации является простота технологических операций и обслуживания используемого оборудования, недостатками - высокая температура и продолжительность стерилизации вследствие низкой теплопроводности воздуха.
Правило 1
Растворы нельзя стерилизовать в воздушных стерилизаторах, так как из-за плохой теплопроводности воздух, не обеспечивает быстрый прогрев растворов до нужной температуры.
Пример 1
Раствор натрия хлорида (объем 200 мл), помещенный в стерилизатор с температурой 120 "С, через 1 ч прогревается всего лишь до 60 "С.
Правило 2
Вязкие жидкости не могут быть надежно простерилизованы паром. Поэтому масла, вазелин, воск, ланолин подлежат воз- душной стерилизации (табл. 3.8, а). Для надежной стерилизации вещества предварительно расфасовывают по
Таблица 3.8, а. Режим воздушной стерилизации масел, вазелина, ланолина, воска
Масса образца, г | Температура, ?С | Минимальное время стерилизационной выдержки, мин |
До 100 | 180-200 | 30-20 |
От 100 до 500 | 180-200 | 40-20 |
Правило 3
Воздушной стерилизации подлежат стеклянные флаконы и бутылки, установленные вниз горлышком на поддоны или в биксы. Изделия из стекла, металла, силиконовой резины, фарфора, установки для стерилизации фильтрованием с фильтрами и приемники фильтрата стерилизуют при 180 ?С в течение 60 мин (табл. 3.8, б). Мелкие стеклянные и металлические предметы (воронки, пипетки и др.) помещают в стерилизаторы в специальных биксах.
Термостабильные порошки предварительно должны быть упакованы в коробки или биксы. Предельная масса упаковки не должна превышать
Примечание. Аптечную посуду после снижения температуры в сте- рилизаторе до 60-70 ?С вынимают и тотчас закрывают стерильными пробками. Контроль воздушной стерилизации осуществляют с помощью индикаторной бумаги (на основе термоиндикаторной краски ? 6), которая изменяет цвет при 160 ?С, или используют химические термотесты: сахарозу, тиомочевину; температура плавления 180 ?С; гидрохинон, температура плавления 170 ?С.
Б. Стерилизация водяным паром под давлением
Преимуществом метода является быстрый и равномерный прогрев всего объема стерилизуемой камеры, так как плотность и теплопро-
Таблица 3.8, б. Воздушный метод стерилизации (сухой горячий воздух)
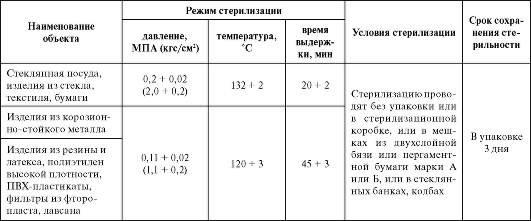
Наименование объекта | Режим стерилизации | Условия стерилизации | Срок сохранения стерильности | |
Температура, ?С | Время выдержки, мин | |||
Стеклянная посуда, изделия из стекла, металла, силиконовой резины | 1) 180 + 2 ?С 2) 160 + 2 ?С | 1) 60 + 5 мин 2) 210 + 10 мин | Стерилизации подвергают сухие изделия. Стерилизацию проводят без упаковки, в открытых емкостях или в упаковке из бумаги (мешочной непропитанной или влагопрочной) | В упаковке 3 дня. Без упаковки должны быть использованы непосредственно после стерилизации |
водность пара равна таковым показателям для воды. Поэтому продолжительность и температура стерилизации водяным паром ниже, чем нагретым воздухом.
Паровая стерилизация насыщенным паром проводится в 2 режимах:
- при избыточном давлении: 0,11 + 0,02 мПа (1,11 + 0,2 кгс/см2) - температура (120 + 2) ?С;
- при избыточном давлении: 0,2+0,02 мПа (2,2 + 0,2 кгс/см2) - температура (132 + 2) ?С.
Стерилизацию паром при температуре (132+2) ?С рекомендуют для растворов термостабильных лекарственных веществ (табл. 3.10).
Таблица 3.9. Время стерилизационной выдержки в зависимости от объема раствора
Объем образца, мл | Минимальное время стерилизационной выдержки, мин при 120 ?С |
До 100 | 8 |
От 100 до 500 | 12 |
От 500 до 1000 | 15 |
Таблица ЗЛО. Паровой метод (водяной насыщенный пар под давлением)
Контроль температурного режима паровой стерилизации осуществляют максимальным термометром со шкалой на 210 ?С или термопарами. В качестве химического термотеста используют смесь бензойной кислоты с фуксином (10:1), температура плавления - 121 ?С.
Стерилизацию паром под давлением проводят в паровых стерилизаторах различной конструкции (рис. 3.22, 3.23). По форме стерилизаторы паром под давлением делятся на цилиндрические (круговые, буква К в обозначении) и прямоугольные (буква П). Цилиндрические могут располагаться горизонтально и вертикально (буквы ГиВ соответственно). Пример обозначения стерилизаторов:
- ВК - вертикальный круговой электрический;
- ГП - горизонтальный прямоугольный электрический односторонний;
- ГПД - горизонтальный прямоугольный электрический двусторонний.
Цифры обозначают диаметр стерилизационной камеры. Стерилизатор состоит из 3 цилиндров. Первый (наружный) цилиндр называется кожухом. Он предохраняет паровой котел сте-

Рис. 3.22. Стерилизатор паровой ГП-400

Рис. 3.23. Стерилизатор паровой ВК-75
рилизатора от возможных механических повреждений, а обслуживающий персонал - от ожогов.
Второй (средний) цилиндр - главная часть стерилизатора, называемая водопаровой камерой. Она изготовляется из высококачественной стали и предназначена для получения пара из воды.
Третий (внутренний) цилиндр называется стерилизационной камерой. Ее назначение - вмещать стерилизуемый материал, ограждая его от воды. В верхней части стерилизационной камеры расположены отверстия для прохождения в нее пара. Кроме того, они служат сепаратором, отделяя пар от капель воды, чтобы стерилизуемый материал не увлажнялся (пар захватывает частички воды). Крышка с резиновой прокладкой и центральным затвором служит для того, чтобы наглухо закрывать водопаровую камеру. Через эту же крышку загружают стерилизуемый материал. Пар в стерилизационную камеру поступает из котелка (или из водопаровой камеры), имеющего внутри электронагревательный элемент. Водопаровая камера заполняется водой очищенной через воронку. За наполнением следят по водомерному стеклу.
Стерилизаторы под давлением снабжены электроконтактным манометром, мановакуумметром, водоструйным эжектором, насо- сом и предохранительным клапаном. Электроконтактный манометр обеспечивает автоматическое поддержание заданного давления.
Мановакуумметр служит для контроля давления в стерилизационной камере. С помощью водоструйного эжектора достигаются быстрый отсос пара после каждой стерилизации, создание вакуума в стерилизационной камере и сушка стерилизуемых материалов, что особенно важно при стерилизации бумаги, ваты и др. Предохранительный клапан служит для предохранения стерилиза- тора от чрезмерного повышения давления пара в нем.
Наиболее удобны настольные паровые стерилизаторы (рис. 3.24), в которых автоматически поддерживаются заданные давление и температура, а также предусмотрена возможность просушивания вспо- могательного материала после стерилизации (вата, фильтровальная бумага, марля и т.п.). Для удаления воздуха из камеры, быстрой сушки материала после стерилизации имеется встроенный вакуум-насос.
Стерилизатор имеет жидкокристаллический дисплей с сенсорной клавиатурой, позволяющий выбирать:
- 3 стерилизационные программы для запакованного и открытого инструментария при 134 ?С;

Рис. 3.24. Полуавтоматический стерилизатор паровой
- 2 стерилизационных программы для запакованного и открытого инструментария при 121 ?С;
- программу с настраиваемыми параметрами;
- быстрый цикл (134 ?С - 4 мин, общее время - 14 мин).
В. Контроль эффективности термических методов стерилизации
Контроль эффективности термических методов стерилизации осуществляют с помощью:
- контрольно-измерительных приборов (термопары, термометры, манометры);
- химических и биологических тестов.
В качестве химического теста используют вещества, изменяющие свой цвет или физическое состояние при определенных параметрах стерилизации: это кислота бензойная (температура плавления 122-124,5 ?С), сахароза (180 ?С), динитрофенилгидразин (195 ?С), расфасованные в ампулы из нейтрального стекла.
В настоящее время наиболее широко применяются индикаторные полоски. Их размещают в середине упаковки или контейнера с инструментом (материалом). Контролируют проникновение стерилянта и достижение в упаковке достаточной экспозиции действующих факторов стерилизации. При достижении заданных режимов стерилизации полоски изменяют цвет красителя с белого на черный,
который сравнивается с эталонной шкалой. Для документализации полоски наклеивают в журнал стерилизации.
Секторный индикатор с ламинированной поверхностью для периодического контроля упаковки или загрузки дает возможность диагностировать отклонения от необходимого режима в работе стерилизационного оборудования, последовательно реагирует на все критические параметры цикла (температура, продолжительность).
Бактериологический контроль качества стерилизации осуществляют с помощью стерилизации объекта, обсемененного тест-микроорганизмами (культуры спорообразующих микроорганизмов типа Bacillus subtilis, Bacillus mesenterius, Bacillus stearothermophilus и др.), нане- сенными на стерилизуемый материал (рис. 3.25). Уникальность биологических индикаторов - в подтверждении реального факта гибели микробных спор в камере стерилизатора. Индикаторы представляют собой пластиковые флаконы, которые содержат легко ломающуюся стеклянную запаянную ампулу с питательной средой и полоску с дозированным количеством спор тест-культуры. После стерилизации индикаторы устанавливают в термостат и по окончании 48 ч просматривают на отсутствие роста микроорганизмов.
3.7.2. Стерилизация фильтрованием
Микробные клетки и споры можно рассматривать как нерастворимые образования с очень малым (1-2 мкм) размером частиц. Подобно другим включениям, они могут быть отделены от жидкости фильтрованием сквозь мелкопористые фильтры. Этот метод стерилизации включен в ГФ для стерилизации термолабильных растворов. Такими фильтрами могут быть перегородки из неглазурованного фарфора (керамики), асбеста, стекла, пленок, пропитанных коллодием, и другого пористого материала.
По конструкции фильтры подразделяют на 2 вида:
- глубинные (погружаемые в среду);
- мембранные.
Глубинные фильтры редко используются для стерилизации. Они построены из беспорядочно ориентированных волокон или частиц

Рис. 3.25. Биоиндикаторы паровой стерилизации; внешний вид и устройство
(например, стекловолокно, фарфор, асбест), спрессованных с целью создания длинных извилистых каналов. Микроорганизмы или частицы застревают в объеме фильтрующего материала. Стерилизующие глубинные фильтры изготавливают из пористого стекла (фильтры Шотта), керамики (свечи Шамберлена), фарфора (фильтры Беркефельда), полимеров (лавсан, капрон, фторопласт).
Для предварительной фильтрации, которая необходима для очистки растворов от крупных механических частиц, применяют бумажно-асбестовые фильтры в виде пластин. В качестве фильтродержателя используют фильтр Сальникова, который представляет собой металлическую раму, зажатую между 2 сферическими дисками.
Микрофильтрация (МФ) - технологический процесс разделения систем «жидкость-твердые частицы» через мембранный фильтр с целью получения фильтрата, очищенного от коллоидных или взвешенных микрочастиц размером 0,05-10 мкм, а также микроорганизмов.
В фармацевтической промышленности мембранная микрофильтрация является неотъемлемым этапом технологий переработки на стадиях осветления и стерилизации жидких лекарственных форм.
Мембранные микрофильтры широко применяют в процессах получения стерильной воды, офтальмологических растворов, диаг- ностических реагентов, инфузионных и инъекционных форм, антибиотиков, культуральных сред, препаратов крови, биологических жидкостей.
Мембранные фильтры - тонкие (100-210 мкм) микропористые пластинки, изготовленные из различных пластмасс, характеризу- ющиеся строго постоянным размером пор и ситовым механизмом задержания микроорганизмов.
Промышленность выпускает фи-
льтры со стандартными порами от 0,11 до 10 мкм. Мембранные фильтры с размером пор 0,22 мкм или меньше используются для стерилизации.
В зависимости от площади фильтрующей поверхности мембранные фильтры разделяют на 2 класса: плоские пластины (рис. 3.26), фильтроэлементы, изготовленные из мембран, свернутых в гофрированную

Рис. 3.26. Плоскопластинчатый мембранный фильтр

Рис. 3.27. Стерилизующая мембрана. Увеличение 1:1000
поверхность. Обычно фильтроэлементы запаивают в фильтрующие блоки (свечи).
Полимерные микропористые мембраны являются тонкими (до 210 мкм) полимерными пленками, имеющими на микроскопическом уровне вид капиллярного, сетчатого или губчатого каркаса, отдельные элементы которого представляют собой неразрывное целое, а порами являются просветы между звеньями этого высокопористого каркаса (рис. 3.27). Исключение составляют ядерные
(трековые) мембраны, полученные путем облучения тонких (10- 20 мкм) полимерных пленок частицами высокой энергии и их после- дующей физико-химической обработкой.
Полимерные мембранные фильтры имеют разброс размеров пор в гораздо более узком интервале, чем глубинные, что позволяет достигать требуемой эффективности разделения, в том числе частиц размерами, аналогичными размерам бактерий (<0,2 мкм). Другим важным достоинством мембранных фильтров является возможность многократного использования неразрушающего метода контроля их качества.
Для стерилизующей фильтрации малых объемов растворов используются специальные насадки-фильтродержатели (рис. 3.28). Подключив насадку к вакуум-насосу и к стерильному флакону, получают стерильный раствор требуемого состава. Конечно, операции проводят в условиях ламинарного бокса (см. рис. 3.6).
Для фильтрации больших объемов жидкостей используются фильтроэлементы (рис. 3.29) с различной поверхностью фильтрации.
Фильтроэлементы имеют общепринятую в мировой практике конструкцию в виде цилиндра, который состоит из фильтрующего пакета, содержащего гофрированную мембрану

Рис. 3.28. Насадка на бутылку для стерилизации растворов в микр околичествах


Рис. 3.29. Фильтроэлементы (внешний вид) и укладка мембраны
в 1 или 2 слоя. Она расположена между 2 слоями нетканого полипропиленового или лавсанового полотна. Укладка мембраны М-образным профилем (рис. 3.30) исключает эффект «мертвой» площади, недоступной для потока.

Рис. 3.30. Принцип укладки материала мембраны
Прочностные характеристики, химическая стойкость мембраны и ее смачиваемость определяются именно свойствами материала, из которого она изготовлена. Основными современными материалами для изготовления стерилизующих мембран являются: нейлон, фторопласт, полисульфон, эфиры целлюлозы. Каждый из них имеет свои преимущества. По химической стойкости материалами-лидерами являются фторопласт, а также нейлон и полисульфон. Мембраны из эфиров целлюлозы менее прочны и нестойки к промывкам таким доступным, дешевым и эффективным регенерирующим средством, как раствор щелочи.
Наилучшие результаты прочности показывают патроны, собранные по технологии термопластической сварки (ни в коем случае
не склеивания). Фильтропатрон скреплен по краям термосваркой, помещен между 2 перфорированными опорными корпусами из полипропилена и герметизирован по торцам расплавом полипропилена. Фильтропакет должен выдерживать гарантированно минимум 10-кратную стерилизацию в автоклаве, а еще лучше - текучим паром.
3.7.3. Стерилизация ультрафиолетовой радиацией
Применяется для обеззараживания воздуха, воды и предметов помещения. УФ-радиация - невидимая коротковолновая часть сол- нечного света с длиной волны меньше 300 нм. Предполагают, что она вызывает фотохимическое нарушение ферментных систем микробной клетки, действует на ее протоплазму с образованием ядовитых органических пероксидов, а также приводит к фотодимеризации тиаминов. Наибольшей стерилизующей способностью обладают лучи с длиной волны 254-257 нм. В качестве источников УФ-радиации в аптеках применяют специальные лампы БУВ (бактерицидная увиолевая): БУВ-20, БУВ-30, БУВ-60 и др. (цифра обозначает мощность в ваттах).
В фармации применяют прямые (см. рис. 3.7-3.9) и рециркуляционные воздухоочистители, которые обеспечивают быструю и эффективную очистку воздуха за счет механической фильтрации его через фильтр из ультратонких волокон и обеззараживания УФрадиацией.
Ультрафиолетовое облучение также проводится в передаточных шлюзах, в которых сырье и материалы передаются в ассистентскую- асептическую.
3.7.4. Радиационная стерилизация
Принцип стерилизующего эффекта этих излучений основан на способности вызывать такие изменения в живых клетках при определенных дозах поглощенной энергии, которые неизбежно приводят их к гибели за счет нарушения метаболических процессов. Чувствительность микроорганизмов к ионизирующему излучению зависит от многих факторов: наличия влаги, температуры и др.
Радиоактивная стерилизация является высокоэффективной для крупных производств.

Рис. 3.31. Химический стерилизатор
3.7.5. Химическая стерилизация
В фармации применяются 2 метода химической стерилизации: растворами и газами (рис. 3.31).
А. Химический метод стерилизации растворами
Приказом МЗ ? 309 установлен единственный метод химической стерилизации 6% раствором перекиси водорода (табл. 3.11). Метод применяется для стерилизации термонестабильных полимеров и изделий на их основе.
Б. Химический метод стерилизации газами
Применяется для стерилизации изделий медицинской техники, зубных боров и инструмента. Для стерилизации газами используют: оксиды этилена и пропилена, оксиды пропиллактона, полиэтилен- оксиды, смесь этилена оксида с углерода диоксидом или метилом бромистым и др.
Химический способ позволяет стерилизовать любые изделия, чувствительные к высокой температуре: пластики, имплантаты, медицинскую оптику, включая эндоскопическую аппаратуру, дорогостоящий инструментарий.
Таблица 3.11. Стерилизация раствором перекиси водорода
Наименование объекта | Стерилизующий агент | Режим стерилизации | Условия стерилизации | Срок сохранения стерильности | |
температура, ?С | время выдержки, мин | ||||
Изделия из стекла, коррозионностойких металлов и сплавов, полимерных материалов, резины | 6% раствор перекиси водорода (ГОСТ 177) | 18 50 + 2 | 360 + 5 180 + 5 | Закрытые емкости из стекла, пластмассы, эмаль без повреждений. Стерилизацию проводят при полном погружении изделия в раствор на время стерилизационной выдержки, после чего промывают стерильной водой в стерильной емкости | В стерильной емкости, выложенной стерильной, простыней - 3 сут |
Современные химические стерилизаторы характеризуются следующими техническими особенностями:
- наличие видеоэкрана с показом статуса цикла;
- одноразовые дозированные картриджи, которые прокалываются внутри камеры с отрицательным давлением только при достижении должных условий в камере;
- в процессе стерилизации осуществляется постоянный контроль относительной влажности в стерилизационной камере в подготовительную фазу, непрерывный контроль температуры с допустимым отклонением 3 ?С для выбранного цикла и автоматическим отключением при отклонении температуры на 4 ?С от заданного режима;
- программируемые коды доступа позволяют контролировать и отслеживать работу оператора;
- встроенный аэратор включается автоматически по завершении стерилизации и удаляет стерилизующий агент.
Контрольные вопросы
1. Что такое стерилизация и в чем ее отличие от дезинфекции?
2. Какие методы используются для дезинфекции объектов и стерилизации растворов?
3. Почему вязкие жидкости стерилизуют сухожаровым методом, а растворы - в паровых стерилизаторах?
4. Какие температурные режимы стерилизации воздухом и паром одобрены ГФ?
5. Какова эффективность стерилизации газами и радиацией? Какие преимущества и недостатки в сравнении со стерилизацией паром?
6. Как стерилизуют термолабильные вещества?
Тесты
1. Перепланировка помещений аптеки может проводиться только по согласованию с местными органами:
1. Санэпиднадзора.
2. Организации, выдавшей лицензию на фармацевтическую деятельность.
3. Местного самоуправления.
2. Санитарный режим:
1. Распорядок дня.
2. Действия и условия деятельности, направленные на проведение санитарно-гигиенических, противоэпидемических мероприятий.
3. Санитарная одежда предназначена для защиты:
1. Медикаментов, материалов и готовой продукции от дополнительных загрязнений, выделяемых персоналом.
2. Персонала от вредного влияния лекарственных веществ или продуктов их переработки, а также вредных производственных выбросов.
4. Комплект технологической одежды для асептического блока предназначен для защиты:
1. Медикаментов.
2. Вспомогательных веществ и материалов.
3. Готовой продукции.
4. Персонала.
5. Воздушной среды.
6. Воздушной среды от загрязнения микроорганизмами.
7. От вторичной контаминации микроорганизмами.
8. От загрязнения механическими частицами, выделяемыми персоналом.
9. От загрязнения механическими частицами из атмосферного воздуха.
5. Асептический блок - территория аптеки, специально выделенная, оборудованная и используемая таким образом, чтобы снизить:
1. Проникновение микробиологических и других загрязнений.
2. Образование микробиологических и других загрязнений.
3. Задержку в ней микробиологических и других загрязнений.
4. Умерщвление микроорганизмов.
6. Дезинфекция - это:
1. Процесс умерщвления на изделии, или в изделии, или на поверхности патогенных и других видов микроорганизмов.
2. Процесс умерщвления на изделиях, или в изделиях, или удаление из объекта микроорганизмов всех видов, находящихся на всех стадиях развития, включая споры.
7. Мойка и моюще-дезинфицирующая обработка изделий и объектов:
1. Определяет эффективность стерилизации.
2. Повышает чистоту изделий и объектов.
3. Снижает риск пирогенных реакций у пациента.
8. Очистка приспособлений для чистки обуви должна проводиться:
1. По мере необходимости.
2. Не реже 1 раза в день.
3. 5 раз в день.
9. В помещении аптек использование гипсокартонных полых перегородок:
1. Допускается.
2. Не допускается.
10. Места примыкания стен к потолку и полу не должны иметь:
1. Углубления.
2. Выступы.
3. Карнизы.
11. Полы покрываются:
1. Неглазурованными керамическими плитками.
2. Глазурованными керамическими плитками.
3. Линолеумом или релином с обязательной сваркой швов.
12. Оборудование, используемое в аптеках:
1. Должно быть зарегистрировано в МЗ.
2. Должно быть разрешено к применению в установленном порядке.
3. Должно соответствовать эргономическим требованиям.
4. Должно иметь сертификат соответствия.
13. В моечной комнате должны быть выделены и промаркированы раковины (ванны) для мытья посуды, предназначенной для приготовления:
1. Инъекционных растворов и глазных капель.
2. Внутренних лекарственных форм.
3. Наружных лекарственных форм.
4. Стирки санитарной одежды.
5. Мойки рук.
14. В шлюзе стерильного блока должны быть предусмотрены:
1. Скамья для переобувания с ячейками для спецобуви.
2. Шкаф для халата и биксов с комплектами стерильной одежды.
3. Раковина (кран с локтевым приводом).
4. Воздушная электросушилка и зеркало.
5. Полотенце.
6. Гигиенический набор для обработки рук.
7. Инструкции о порядке переодевания и обработки рук.
8. Правила поведения в асептическом блоке.
15. В ассистентской-асептической подводка воды и канализации:
1. Не допускается.
2. Допускается при условии обеспечения доступности для обработки.
16. Движение воздушных потоков должно быть направлено:
1. В асептический блок.
2. Из асептического блока.
3. С преобладанием притока над вытяжкой.
4. С преобладанием вытяжки над притоком.
17. Количество и мощность бактерицидных ламп подбирают из расчета: не менее 2-2,5 Вт мощности на:
1. 1 м3 объема помещения.
2. На
18. Перед началом работы необходимо провести:
1. Сухую уборку помещений.
2. Влажную уборк у.
19. Генеральная уборка производственных помещений должна проводиться не реже:
1. 1 раза в день.
2. 1 раза в 1 нед.
3. 1 раза в 1 мес.
20. Медицинское обследование проходят работники аптеки:
1. Занимающиеся изготовлением лекарственных средств.
2. Занимающиеся контролем лекарственных средств.
3. Занимающиеся расфасовкой лекарственных средств.
4. Занимающиеся обработкой аптечной посуды.
5. Контактирующие с готовой продукцией.
6. При поступлении на работу.
7. Все работники.
21. Смена санитарной одежды должна проводиться не реже:
1. 1 раза в неделю.
2. 2 раз в неделю
3. 1 раза в 2 недели.
22. Срок хранения воды очищенной:
1. Не более 3 сут.
2. Не более 5 сут.
3. 10 сут.
23. Количество микроорганизмов в 1 мл воды очищенной должно быть:
1. Равно 0.
2. Не более 10.
3. Не более 100.
24. Воду для инъекций используют свежеприготовленной или хранят:
1. При температуре от 5 до 10 ?С.
2. При температуре от 18 до 20 ?С.
3. При температуре от 80 до 95 ?С.
4. В закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды.
5. В емкостях, защищающих ее от попадания механических включений.
6. В емкостях, защищающих ее от микробиологических загрязнений.
7. Не более 24 ч.
8. Не более 48 ч.
9. Не более 3 сут.
25. Трубопроводы из полимерных материалов и стекла можно стерилизовать:
1. 3% раствором формальдегида в течение 3 ч.
2. 6% раствором перекиси водорода в течение 6 ч.
3. Раствором перманганата калия в серной кислоте.
4. С последующим тщательным промыванием водой очищенной.
5. С последующей проверкой на отсутствие восстанавливающих веществ.
6. С последующей проверкой на микробиологическую чистоту.
26. Для очистки от пирогенных веществ стеклянные трубки и сосуды обрабатывают:
1. Подкисленным раствором калия перманганата в течение 25-30 мин.
2. Для приготовления раствора к 10 частям 1% раствора калия перманганата добавляют 6 частей 1,5% раствора кислоты серной.
3. Затем промывают свежеприготовленной водой для инъекций.
27. В начале и в конце каждой смены весы, шпатели, ножницы и другой мелкий аптечный инвентарь протирают:
1. 3% раствором перекиси водорода.
2. Спиртоэфирной смесью (1:1).
3. Водой очищенной.
28. Бюреточные установки и пипетки не реже 1 раза в 10 дней:
1. Освобождают от концентратов.
2. Моют горячей водой со взвесью горчичного порошка.
3. Моют 3% раствором перекиси водорода с 0,5% раствора моющего средства.
4. Моют очищенной водой.
5. Контролируют на отсутствие моющих средств.
6. Сливные краны бюреточных установок перед началом работы очищают от налетов солей, протирают спиртоэфирной смесью (1:1).
29. Горловину и пробку штангласа, а также ручные весы вытирают салфеткой из марли:
1. После каждого отмеривания или отвешивания лекарственного вещества.
2. В начале и в конце смены.
3. Салфетка употребляется 1 раз.
4. Салфетка употребляется 5 раз.
30. Используемые для работы бумажные и вощаные капсулы, шпатели, нитки, резинки обхваточные и другие хранят:
1. В биксах.
2. В ящиках фасовочного стола.
3. На поверхности ассистентского стола.
31. Объектами микробиологического контроля в аптеках являются:
1. Исходные продукты.
2. Промежуточные продукты.
3. Готовые продукты.
4. Вспомогательные вещества и материалы.
5. Руки и санитарная одежда персонала.
6. Воздушная среда.
7. Поверхности помещений и оборудования.
32. Комплект одежды стерилизуют в биксах:
1. В паровых стерилизаторах при 120 ?С в течение 45 мин.
2. При 132 ?С 20 мин.
3. В сухожаровых шкафах при 180 ?С.
4. Хранят в закрытых биксах.
5. Хранят не более 1 сут.
6. Хранят не более 3 сут.
33. В асептическом блоке руки после ополаскивания:
1. Вытирают насухо.
2. Надевают стерильную одежду.
3. Омывают водой.
4. Обрабатывают дезинфицирующими средствами.
5. Обработку повторяют, если работа длится более 4 ч.
34. Открытые бактерицидные лампы применяются:
1. В присутствии людей.
2. В отсутствие людей.
3. В перерывах между работой.
4. Ночью или в специально отведенное время - до начала работы в течение 1-2 ч.
35. Необходимо учитывать продолжительность работы каждого облучателя в специальном журнале, фиксируя:
1. Время включения.
2. Время выключения лампы.