Фармацевтическая технология. Изготовление лекарственных препаратов : учебник / А. С. Гаврилов. 2010. - 624 с. : ил.
|
|
|
|
ГЛАВА 25. ИНЪЕКЦИОННЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ
Идея введения лекарственных веществ через кожный покров принадлежит врачу Фуркруа (1785), который с помощью скарифика- торов делал на коже насечки и в полученные ранки втирал лекарственные вещества. Впервые подкожное впрыскивание лекарственных растворов было осуществлено в начале
25.1. ЛЕКАРСТВЕННЫЕ ФОРМЫ
Инъекционные лекарственные формы (от лат. injectio - впрыскивание) - стерильные водные и неводные растворы, суспензии, эмульсии и сухие твердые вещества (порошки, пористые массы и таблетки), которые растворяют стерильной водой непосредственно перед введением в организм при помощи шприца с нарушением целости кожных покровов или слизистых оболочек.
Инъекционные растворы объемом 100 мл и более относятся к инфузионным (от лат. infusio - вливание).
Преимущества инъекционного способа введения:
1. Быстрота действия (иногда через несколько секунд).
2. Возможность введения лекарственных препаратов больному, находящемуся в бессознательном состоянии.
3. 100% биодоступность, так как лекарственные вещества вводятся, минуя желудочно-кишечный тракт, печень - органы, способные изменять и разрушать лекарственные вещества, для которых невозможны другие способы введения (препараты инсулина, антибиотики, гормоны и др.).
4. Локализация действия лекарственных веществ в зоне укола (например, анестезия местная, проводниковая, инфильтрационная);
5. Отсутствие ощущений, связанных с неприятным запахом и вкусом лекарственных препаратов.
Недостатки инъекционного способа введения:
1. Нарушаются защитные барьеры организма, возникает серьезная опасность внесения инфекции.
2. Возникает опасность эмболии вследствие попадания твердых частиц или пузырьков воздуха, возможен летальный исход.
3. Введение инфузионных растворов непосредственно в ткани может вызвать сдвиги осмотического давления, рН, возникает резкая боль, жжение, иногда лихорадочные явления.
4. Инъекционный способ введения требует высокой квалификации медицинского персонала. Неумелое введение приводит к повреждению нервных окончаний, стенок кровеносных сосудов или другим опасным последствиям.
5. Высокая стоимость - всегда выше энтеральных лекарственных форм одного и того же наименования.
Виды инъекционных манипуляций
В зависимости от места и глубины введения лекарственных препаратов применяют инъекции следующих видов: внутрикожные, подкожные, внутримышечные, внутрисосудистые, спинномозговые, внутричерепные, внутрибрюшинные, внутриплевральные, внутрисуставные, инъекции в сердечную мышцу и др.
А. Внутривенные вливания
Внутривенные вливания осуществляют в поверхностные вены области локтевого или коленного сгиба. Внутривенные вливания обеспечивает мгновенное наступление действия лекарства и практически 100% биодоступность.
Следует знать, что внутривенные вливания могут сопровождаться серьезными осложнениями: тромбообразованием, воспалением вен с последующей тромбоэмболией легочной артерии.
Причинами таких осложнений могут быть:
- некачественное внутривенное вливание (попадание пузырька газа или кусочка резины, пробки в вену);
- некачественный раствор препарата (высокое значение рН раствора, механические включения, присутствующие в растворе);
- выбор слишком маленькой вены для объема введенного раствора.
Внутривенные вливания осуществляют с помощью трансфузионных систем (рис. 25.1).

Рис. 25.1. Внутривенное вливание и трансфузионные системы
Б. Внутримышечные инъекции
Основные места для инъекций: дельтовидная мышца руки, большая ягодичная и латеральная мышцы (рис. 25.2). Внутримышечный путь введения считается менее опасным и более легким в исполнении, чем внутривенный. Действие препарата наступает несколько позже в сравнении с внутривенным, но быстрее подкожного. Процедура наиболее болезненна в сравнении с другими.
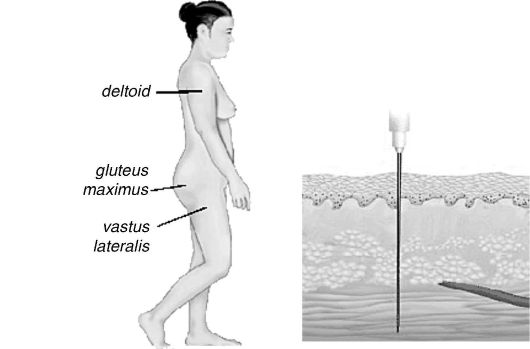
Рис. 25.2. Внутримышечные инъекции
Для внутримышечных инъекций необходим правильный выбор длины иглы. Длина иглы должна быть больше толщины жировой прослойки пациента.
Максимальный объем вводимого раствора - 2,0 мл в мышцы руки или бедра и не более 5,0 мл - в ягодицу. Место инъекции должно быть в максимально возможной степени удалено от главных нервов и кровеносных сосудов, чтобы избежать повреждения нервных окончаний и случайного внутривенного введения.
Для замедления (пролонгирования) действия препарата применяют его масляные растворы или эмульсии.
В. Внутрикожные (интрадермальные) инъекции
Инъекции делаются в основном в область предплечья. Лекарственные вещества вводят в пространство между эпидермисом и дермой на глубину 1-5 мм (рис. 25.3). Максимальный объем вводимого раствора - 0,1 мл.
Чаще всего этим методом вводят диагностические, иммунологические и косметологические препараты. Используются тонкие иглы, специальные шприцы.
Г. Подкожные инъекции
Подкожное введение - универсальный метод введения лекарственных средств как скоропомощного, так и пролонгированного действия. Инъекцию делают во внутреннюю поверхность руки, бедра, нижнюю часть живота. Максимальное количество вводимого раствора - 2 мл. Иногда при так называемых капельных инъекциях под кожу вводят, не вынимая иглы, в течение 30 мин до 500 мл жидкости (рис. 25.4).
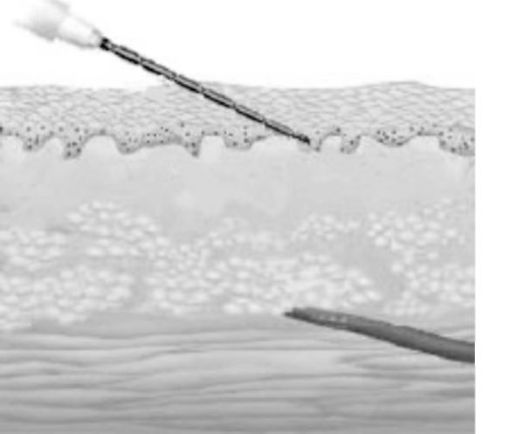
Рис. 25.3. Внутрикожные инъекции
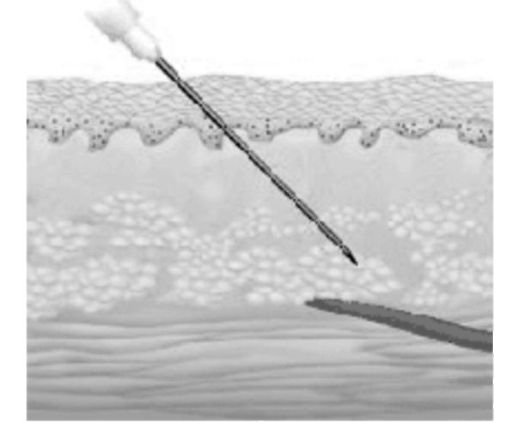
Рис. 25.4. Подкожные инъекции
Фармакокинетика подкожного введения примерно равна внутримышечному, с некоторым замедлением.
Для ускорения действия лекарств применяют 2 способа:
- перед введением массируют кожу в месте укола;
- вводят одновременно вазодилататоры, увеличивающие всасываемость веществ.
Множество лекарственных средств назначают подкожно. Наиболее важными являются гепарины и инсулины. Для снижения объема инъекции важно, чтобы растворимость субстанций была максимальной.
Пролонгирование действия лекарств, например морфина, инсулина, гепарина, достигается или введением препарата в виде растворов в масле, суспензий, эмульсий, или установкой под кожей специальных устройств, содержащих микрокапсулы препарата в сетке-дозаторе (рис. 25.5).
Подкожная ткань - идеальный участок для внедрения таких устройств. Внедрение часто требует хирургической процедуры. Материал устройства биологически совместим с тканями. Примеры вживляемых устройств: Norplant ?, Oreton ?, Percorten ? и осмотически управляемый мини-насос (Alzet ?), который может выделять молекулы препарата в течение 21 дня.
В последние годы предложен безболезненный безыгольный метод введения лекарственного препарата. Он основан на способнос- ти струи вещества с большой кинетической энергией преодолевать сопротивление и проникать в ткани. При безыгольной инъекции раствор лекарственного вещества вводится в ткани очень тонкой струей (диаметром в десятые и сотые доли миллиметра) под высоким давлением (до 300 кгс/см). Способ такого введения лекарственных веществ по сравнению с обычными инъекциями с помощью иглы имеет преимущества: безболезненность инъекций, быстрое наступление эффекта, уменьшение требуемой дозы, невозможность передачи «шприцевых инфекций», более редкая стерилизация инъектора, увеличение количества инъекций, проводимых в единицу времени (до 1000 инъекций в час).

Рис. 25.5. Подкожные устройства-дозаторы (увеличено)
Шприцы для подкожных и внутримышечных инъекций
По способу крепления иглы все шприцы подразделяют на 3 вида: Slip-Tip?, эксцентриковый Slip-Tips? и Luer-Lok?. По конструкции шприцы разделяют на 2 класса:
- двухкомпонентные (корпус и плунжер) (рис. 25.6);
- трехкомпонентные (корпус, плунжер и резиновый уплотнитель поршня). Резиновый уплотнитель позволяет снизить силу трения частей шприца друг о друга при введении лекарственных препаратов. Ход поршня стал плавным, а укол - менее болезненным (рис. 25.7).

Рис. 25.6. Шприцы Луер двух- и трехкомпонентные
Рис. 25.7. Игла, 5 типоразмеров
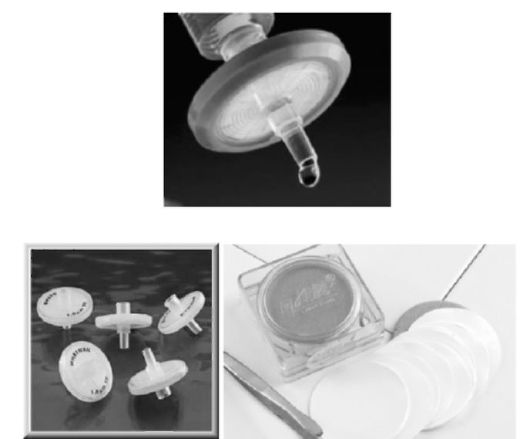
Рис. 25.8. Шприц Луер, оснащенный мембранным фильтром для дополнительной фильтрации раствора. Фильтродержатель. Фильтрующая мембрана (увеличено)
25.2. РАСТВОРИТЕЛИ, ЛЕКАРСТВЕННЫЕ СРЕДСТВА И ВСПОМОГАТЕЛЬНЫЕ МАТЕРИАЛЫ, ПРИМЕНЯЕМЫЕ ДЛЯ ИЗГОТОВЛЕНИЯ ИНЪЕКЦИОННЫХ РАСТВОРОВ
Для изготовления инъекционных растворов используют: лекарственные средства, растворители, вспомогательные вещества, тару и упаковку.
Качество и квалификация всех перечисленных компонентов должны быть указаны в нормативной документации (ГФ, ФС, ФСП), утвержденной МЗ РФ.
А. Растворители
Основные требования, предъявляемые к растворителям
В качестве растворителей применяют: воду для инъекций, жирные масла и этилолеат. В качестве комплексного растворителя могут быть использованы этанол, глицерин, пропиленгликоль, ПЭО-400, спирт бензиловый, бензилбензоат или их смеси.
1. Вода для инъекций. Для изготовления растворов для инъекций используют воду для инъекций, которая должна выдерживать испытания на воду очищенную, а также быть апирогенной (см. главу 11). Воду для инъекций получают в асептических условиях с учетом требований приказа Минздрава ? 309.
2. Неводные растворители
2.1. Масла растительные (Olea pinguia).
Наиболее широко используются масла персиковое, оливковое, касторовое.
Масло для инъекций должно быть рафинированным, дезодорированным, иметь кислотное число менее 2,5, перекисное менее 10,0 (табл. 25.1).
К недостаткам масляных растворов следует отнести их высокую вязкость, болезненность инъекций, трудное рассасывание масла и возможность образования гранулем в месте введения.
Для уменьшения вязкости в некоторых случаях добавляют этиловый или этилптиколевый эфир.
Растворимость некоторых веществ в маслах увеличивают путем добавления сорастворителей (спирт бензиловый, бензилбензоат и др.). В РФ растительные масла применяются для приготовления инъекционных растворов камфоры, дезоксикортикостерона ацетата, диэтилстильбэстрола пропионата, ретинола ацетата, синэстрола (см. табл. 25.1).
Таблица 25.1. Примеры использования масел растительных в инъекционных растворах
Наименование | Масло | Категория |
Димеркапрол | Кокосовое | Антидот мышьяка и ртути |
Эстрадиола капронат | Хлопковое | Эстроген |
Эстрадиола валерианат | Сезамовое или касторовое | Эстроген |
Флуфеназина деканоат | Сезамовое | Антипсихолитик |
Гидроксикортизона капроат | Касторовое | Прогестин |
Тестостерона капронат | Хлопковое | Андроген |
2.2. Этилолеат (Ethylii oleas) - сложный эфир ненасыщенных жирных кислот с этанолом:
СН3 - (СН2)3 - СН = СН - (СН2)7 - СО - О - С2Н5.
В сравнении с маслами обладает большей растворяющей способностью, меньшей вязкостью, имеет постоянный химический состав, легко проникает в ткани, хорошо рассасывается, сохраняет однородность при пониженной температуре. В этилолеате хорошо растворяются витамины, гормональные вещества.
2.3. Этанол (С2Н5ОН) (Spiritus aethylicus). Применяют для улучшения растворимости труднорастворимых в воде соединений и используют как антисептик и сорастворитель при изготовлении растворов сердечных гликозидов: конваллятоксина, строфантина К. Применяют для улучшения растворимости веществ путем их растворения в этаноле, смешения с маслом с последующей отгонкой (онкопрепараты).
2.4. Глицерин улучшает растворимость в воде сердечных гликози- дов. В составе трехкомпонентной системы «вода-этанол-глицерин» он используется для получения раствора целанида и лантозида. В качестве сорастворителя глицерин используют при изготовлении инъекционных растворов мезатона, фетанола, дибазола и др.
2.5. Спирт бензиловый (С6Н5 - СН2ОН) (Spiritus benzylicus) используется в качестве сорастворителя в концентрации 1-10% при изготовлении масляных растворов.
2.6. Пропиленгликоль (СН2 - СНОН - СН2ОН) (Propylenglycolum) является хорошим растворителем для сульфаниламидов, барбитуратов, антибиотиков, витаминов А и D, оснований алкалоидов и других лекарственных веществ.
2.7. Бензилбензоат (Benzylii benzoas) - бензиловый эфир бензойной кислоты. Бензилбензоат значительно увеличивает растворимость в маслах некоторых труднорастворимых веществ, главным образом стероидных гормонов. Кроме того, бензилбензоат предотвращает кристаллизацию веществ из масел в процессе хранения.
2.8. Смешанные растворители (сорастворители) обладают большей растворяющей способностью, чем каждый растворитель в отдельности. В настоящее время сорастворители широко используют для получения инъекционных растворов веществ, труднорастворимых в индивидуальных растворителях (гормонов, витаминов, антибиотиков, барбитуратов и др.) (табл.25.2).
Таблица 25.2. Инъекционные растворы, содержащие в составе сораство- ритель
Наименование ЛС | Применяемый сорастворитель |
Кармустин | Спирт 10% |
Хлордиазепоксид | Пропиленгликоль 20% |
Циклоспорин | Спирт 33% |
Диазепам | Пропиленгликоль 40%, спирт 10% |
Дигоксин | Пропиленгликоль 40%, спирт 10% |
Этомидат | Пропиленгликоль 35% |
Кеторлак | Спирт 10% |
Лоразепам | ПЭГ-400 18%, пропиленгликоль 82% |
Мультивитамины | Пропиленгликоль 30% |
Нитроглицерин | Пропиленгликоль 0,5%, спирт 70% |
Фенобарбитал натрия | Пропиленгликоль 40%, спирт 10% |
Секобарбитал натрия | Пропиленгликоль 50% |
Тенопсид | Спирт 42,7%, ДМА 6% |
Триетоприм сульфат | Пропиленгликоль 40%, спирт 10% |
Б. Лекарственные средства
Лекарственные средства (субстанции), используемые для изготовления инъекционных растворов, должны отвечать требованиям ГФ, ФС, ВФС. Некоторые вещества подвергают дополнительной очистке и выпускают повышенной чистоты, квалификации «годен для инъекций» (глюкоза, желатин, пенициллин и др.).
В частности, в глюкозе и желатине (благоприятные среды для размножения микроорганизмов) могут содержаться пирогенные вещества. Поэтому для них определяют тест-дозу на пирогенность в соответствии со статьей ГФ «Проверка пирогенности». Глюкоза не должна давать пирогенный эффект при внутривенном введении 5% раствора из расчета 10 мг/кг массы кролика, желатин - 10% раствора. Бензилпенициллина калиевую соль также проверяют на пирогенность (тест-доза не должна превышать 5000 ЕД в 1 мл воды на
Пригодность некоторых лекарственных веществ для инъекционных растворов определяют на основании дополнительных иссле- дований на чистоту. Кальция хлорид проверяют на растворимость в этаноле (органические примеси) и содержание железа; гексаметилентетраамин - на отсутствие аминов, солей аммония и хлороформа; кофеин-бензоата натрия - на отсутствие органических примесей (раствор не должен мутнеть или выделять осадок при нагревании в течение 30 мин). Магния сульфат для инъекций не должен содержать марганца и других веществ, что отмечено в нормативной документации.
Натрия гидрокарбонат квалификации х.ч., ч.д.а., «годен для инъекций», отвечающий требованиям ГОСТа 4201, должен выдерживать дополнительное требование на прозрачность и бесцветность 5% рас- твора. Ионов кальция и магния должно быть не более 0,05%, иначе в процессе термической стерилизации раствора будет появляться опалесценция карбонатов этих катионов.
Эуфиллин для инъекций должен содержать повышенное количество этилендиамина (18-22%) как стабилизатор этого вещества вместо 14-18% при использовании его для пероральных растворов и выдерживать дополнительное испытание на растворимость.
Натрия хлорид (х.ч.), выпускаемый по ГОСТу 4233, должен соответствовать требованиям ГФ, калия хлорид (х.ч.) должен отвечать требованиям ГОСТа 4234 и ГФ. Натрия ацетат квалификации ч.д.а. должен отвечать требованиям ГОСТа 199.
Натрия бензоат не должен содержать более 0,0075% железа.
Тиамина бромид для инъекций должен выдерживать дополнительное испытание на прозрачность и бесцветность раствора.
Лекарственные вещества, используемые для приготовления инъекционных растворов, хранят в отдельном шкафу, в стерильных небольших штангласах, закрытых притертыми пробками. Штангласы
перед каждым заполнением лекарственными веществами моют и стерилизуют в соответствии с приказом Минздрава. В. Вспомогательные вещества
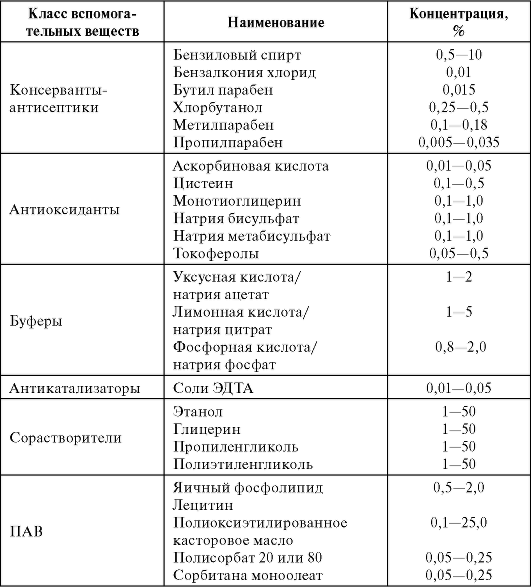
При изготовлении лекарственных средств для парентерального применения могут быть добавлены консерванты, антиоксиданты, стабилизаторы, эмульгаторы, солюбилизаторы и другие вспомогательные вещества, указанные в частных статьях.
В качестве вспомогательных веществ - ингибиторов физикохимических процессов, препятствующих гидролизу и окислению лекарственных средств, используют: аскорбиновую, хлористо-водородную, винную, лимонную, уксусную кислоты, натрия карбонат, натрия бикарбонат, натр едкий, натрия или калия сульфит, бисульфит или метабисульфит, натрия тиосульфат, натрия цитрат, натрия фосфат одно- и двузамещенный, натрия хлорид, метиловый эфир оксибензойной кислоты, пропиловый эфир оксибензойной кислоты, ронгалит, динатриевую соль этилендиаминтетрауксусной кислоты, спирт поливиниловый, хлоробутанол, крезол, фенол и др.
Количество добавляемых вспомогательных веществ, если нет других указаний в частных статьях, не должно превышать следующих концентраций: для веществ, подобных хлорбутанолу, крезолу, фенолу, - до 0,5%; для сернистого ангидрида или эквивалентных количеств сульфита, бисульфита или метабисульфита калия или натрия - до 0,2%.
Консерванты (табл. 25.3) применяют в многодозовых лекарственных средствах для парентерального применения, а также в однодозовых препаратах в соответствии с требованиями частных статей.
Лекарственные средства для внутриполостных, внутрисердечных, внутриглазных или других инъекций, имеющих доступ к спинномозговой жидкости, а также при разовой дозе, превышающей 15 мл, не должны содержать консервантов.
Правило 1
Приказ ? 214 требует указания концентрации и объема (или массы) изотонирующих и стабилизирующих веществ, добавленных в растворы для инъекций и инфузий, не только в паспортах, но и на рецептах.
Г. Тара и упаковка
Растворы для инъекций упаковывают во флаконы, укупоривают пробками и закатывают колпачками.
Таблица 25.3. Вспомогательные вещества и их концентрация в растворах для инъекций
Сосуды и укупорочные средства должны обеспечивать герметичность, быть индифферентными к содержимому, сохранять его стабильность при стерилизации, хранении и транспортировании. Марки стекла и других укупорочных средств (резины, пластмассы) должны быть указаны в частных статьях. Сосуды изготавливают из материалов, не затрудняющих визуальный контроль содержимого.
Рис. 25.9. Бутылка для крови, трансфузионных и инфузионных препаратов, ГОСТ 10782
Бутылки для инфузионных растворов и кровезаменителей с гладким горлом (рис. 25.9) изготавливаются из медицинского стекла марки МТО. Они предназначены для расфасовки и хранения крови, кровезаменителей, инфузионных и трансфузионных растворов. Емкость - 100, 250 и 450 мл. Внутренняя поверхность бутылок обработана для обеспечения химической стойкости. Бутылки с внутренним химически стойким покрытием нельзя использовать повторно после хранения в них препаратов в течение гарантийного срока годности. Гарантийный срок хранения - 1 год с даты изготовления.
В настоящее время широко применяются бутылки из полиэтилена или полипропилена (рис. 25.10). Преимуществом данной тары явля- ется совместимость с любыми растворами и возможность стерилизации паром в стандартных условиях.
Бутылки укупоривают пробками резиновыми для бутылок с кровью, кровезаменителями и инфузионными растворами (рис. 25.11). Материал пробки должен быть достаточно прочным и эластичным, чтобы обеспечивать отбор содержимого без удаления пробки, отделения ее частиц и герметизацию сосуда после удаления иглы.

Рис. 25.10. Бутылки из полиэтилена высокого давления для инфузионных препаратов
Для фиксации пробки на нее и горло бутылки устанавливают алюминиевый колпачок (рис. 25.12), который завальцовывают. Одновременно с обеспечением плотной укупорки достигается контроль вскрытия инъекционных растворов. Колпачки изготовлены из алюминиевой фольги толщиной
25.3. ВЗАИМНАЯ НЕСОВМЕСТИ МОСТЬ ИНЪЕКЦИОННЫХ РАСТВОРОВ

Рис. 25.11. Пробки резиновые 4Ц для укупоривания бутылок с кровью, кровезаменителями и инфузионными растворами
Несовместимость - явление утраты качественных и количественных характеристик препарата в результате взаимодействия с другим препаратом или вспомогательными веществами.
По современным данным, за время одной госпитализации больной получает в среднем 8-14 различных препаратов, большинство из которых многокомпонентные. При этом весьма вероятны реакции взаимодействия препаратов друг с другом, происходящие при смешивании в одном шприце или в организме больного. По данным печати, более 20% лекарственных осложнений связаны с взаимодействием препаратов в процессе политерапии.
Работник аптечного или лечебно-профилактического учреждения обязан своевременно выявлять несовместимые сочетания лекарственных средств. Если факт несовместимости неизвестен, фармацевт обязан предвидеть и предотвращать данные явления. Для того чтобы предвидеть несовместимые сочетания, фармацевт должен знать фармацевтическую химию, чтобы прогнозировать возможные реакции.

Рис. 25.12. Колпачки алюминиевые
Наиболее часто происходят реакции гидролиза (эфиров, амидов, лактамов) и окисления (катехинов, фенолов, непредельных соединений), осаждение слабых электролитов или нейтральных, гидрофобных оснований в результате изменения рН концентрации сорастворителей, ПАВ.
Образование осадка при изменении рН определяет стабильность растворов практически всех лекарственных веществ. Например, раствор пенициллина содержит буферный раствор калиевой соли лимонной кислоты в области рН 6,5. Раствор стабилен в течение 24 ч при таком рН; однако при смешивании с раствором препарата кислотного характера рН изменяется, пенициллин теряет активность в течение 1 ч.
Правило 2
Растворы для внутривенных вливаний не рекомендуются смешивать с лекарственными препаратами. Категорически запрещается смешивание любых препаратов со следующими внутривенными растворами:
- плазмозаменители;
- гидролизаты белка;
- растворы аминокислот;
- кровь, плазма и другие препараты крови;
- гидрокарбонат натрия;
- жировая эмульсия.
Эти вливания непостоянны по своей природе, и введение препаратов может вызвать неблагоприятные реакции коагуляции, гидро- лиза с образованием потенциально опасных продуктов.
При смешивании фармацевт должен помнить, что растворимость слабой кислоты или основания зависит от рН: амины (дофамин, адреналин, морфин) являются основаниями и растворимы в кислой среде, тогда как карбоксильные и другие кислоты (пенициллины, цефалоспорины, 5-фтороурацил) растворимы в щелочной среде. Смешивание в одном флаконе веществ, обладающих свойствами кислоты и основания, всегда приводит к реакции взаимодействия.
Правило 3
Запрещается смешивать в одном флаконе лекарственные средства с различающимся рКа.
Возможно образование осадка в результате снижения концентрации сорастворителей или ПАВ.
Особое внимание фармацевт должен уделять совместимости растворов неэлектролитов (типа дигоксина, фенитоина и бензодиазепина), которые возможны только в неводном растворителе. Если к раствору препарата добавить водный раствор другого препарата, произойдет осаждение крайне токсичных соединений.
Большое внимание необходимо уделять возможной адсорбции препарата. В частности, растворы неполярных веществ, особенно низ- кой концентрации, способны адсорбироваться полярными стенками поливинилхлоридных сосудов или систем для переливания крови.
Классический пример - нитроглицерин. Нитроглицерин плохо растворяется в воде - менее 0,1%. Если водный раствор нитроглицерина поместить в ПВХ-мешок, то потери вещества будут зна- чительными в результате сорбции препарата поливинилхлоридом. Это явление наблюдается для растворов витамина А (ретинола ацетат), варфарина, метгекситала, тербуталина, лоразепама и инсулина. Оптимальным материалом для изготовления флаконов, в которые будут помещены данные препараты, является стекло.
Следует учитывать и взаимодействие лекарственных средств с антиокислителями. Некоторые инъекционные растворы содержат в составе антиокислителя натрия сульфид. Фармацевту нужно помнить, что сульфиды реагируют с другими лекарствами, например со фторурацилом, тиамина хлоридом.
Фармацевту следует знать, что большинство одновалентных катионов совместимо. Однако двухвалентные катионы, подобно кальцию и магнию, могут осаждаться в присутствии бикарбоната, солей лимонной кислоты и фосфата. Кальций образует комплексы с тетрациклинами, приводящие к его инактивации.
25.4. СТАБИЛИЗАЦИЯ ИНЪЕКЦИОННЫХ РАСТВОРОВ
Стабильность - свойство препарата сохранять качественные и количественные характеристики при хранении в течение срока годности и при введении в организм больного.
Существует 3 фактора, определяющие стабильность инъекционных растворов:
1. Химическая стабильность - способность лекарственного препарата противостоять 4 реакциям разрушения:
- гидролизу;
- окислению;
- фотолизису;
- другим, например рацемизации.
2. Физическая стабильность - способность сохранить физические характеристики, включая цвет, прозрачность, растворимость.
3. Микробиологическая стабильность - способность поддерживать стерильность или определенный ее уровень.
Утрата стабильности происходит из-за воздействия неблагоприятных факторов окружающей среды и зависит от:
- физико-химических свойств лекарственных веществ;
- значения рН раствора;
- присутствия ионов тяжелых металлов, попадающих в раствор из лекарственных веществ, воды или стекла;
- кислорода, содержащегося в воде и в воздухе над раствором;
- температуры (в том числе при стерилизации).
По сравнению с другими изготовляемыми в аптеках лекарственными формами (растворы для внутреннего и наружного применения, порошки, мази и т.д.), для которых лишь на отдельные препараты имеются частные статьи в ГФ Х, ФС, ВФС, составы всех растворов для инъекций, а также способы обеспечения их стерильности и стабильности регламентированы. Поэтому обязательным до приготовления раствора для инъекций является ознакомление с вышеуказанной документацией.
Правило 4
Изготавливать растворы для инъекций без имеющихся утвержденных указаний о составе, технологии приготовления и стерилизации запрещено.
Технология стабилизации растворов для инъекций
Выбор стабилизатора в первую очередь зависит от химической природы веществ, которые ориентировочно можно разделить на 3 группы:
1. Растворы солей слабых оснований и сильных кислот.
2. Растворы солей сильных оснований и слабых кислот.
3. Растворы легкоокисляющихся веществ.
25.4.1. Стабилизация растворов солей слабых оснований и сильных кислот (растворы солей алкалоидов и синтетических азотистых оснований)
Для стабилизации растворов этих веществ рекомендуется снижение рН раствора.
Увеличение рН раствора приводит к следующим взаимодействиям:
- осаждению оснований из солей стрихнина нитрата, папаверина гидрохлорида, дибазола, новокаина, констатируемому по замасливанию стенок сосуда;
- изменению окраски растворов вследствие их разрушения, так как соли всегда стабильнее основания; например, раствор мор- фина желтеет, апоморфина - зеленеет, адреналина - розовеет, дротаверина - темнеет.
Прибавление к этим растворам свободной кислоты, т.е. избытка ионов ОН+з, понижает степень диссоциации воды и подавляет гидролиз, вызывая сдвиг равновесия влево:
Alc HCl + Н2О = А1с + ОН3+ + Cl-; HCl + Н2О = ОН3+ + Cl-.
Уменьшение концентрации ионов ОН3+ в растворе, например, вследствие щелочности стекла, сдвигает равновесие вправо. Нагревание раствора во время стерилизации, увеличивающее степень диссоциации воды и повышение рН раствора за счет выщелачивания стекла, вызывает в значительной степени усиление гидролиза соли, что приводит к накоплению в растворе труднорастворимого азотистого основания.
Правило 5
Растворы солей слабых оснований и сильных кислот стабилизируют добавлением
Количество кислоты хлористо-водородной, необходимое для стабилизации раствора, зависит от свойств лекарственного вещества. Если нет указаний в ГФ или ФС, то добавляют 10 мл
ных эфиров, окислению фенольных, альдегидных или лактонных групп. Пример 1
Раствор новокаина 1% (приказ МЗ РФ от 16.07.1997 г. ? 214).
Состав: новокаина 10,0; раствора кислоты хлористо-водородной
Введение кислоты предотвращает омыление сложного эфира, сопровождающееся изменением фармакологического действия (образование анилина из новокаина).
25.4.2. Стабилизация растворов солей слабых кислот и сильных оснований
К солям слабых кислот и сильных оснований относятся: натрия тиосульфат, кофеин-бензоат натрия, теофиллин и др. В водных растворах соли слабых кислот и сильных оснований легко гидролизуются, образуя слабощелочную реакцию среды. Это приводит к образованию труднорастворимых соединений, дающих в растворах муть или осадок. Катализирует процесс кислая среда, которая может создаваться за счет растворения в воде углерода диоксида (рН воды для инъекций - 5,0-6,8).
Правило 6
Для стабилизации растворов солей слабых кислот и сильных оснований необходимо добавление
Пример 2
Раствор натрия нитрита, который по ГФ Х готовят с добавлением 2 мл 0,1 Мраствора натрия гидроксида на
(18-22% вместо 14-18%).
Правило 7
Вода для инъекций должна освобождаться от углерода диоксида путем кипячения.
25.4.3. Стабилизация растворов легкоокисляющихся веществ
К легкоокисляющимся веществам относятся: кислота аскорбиновая, адреналина гидротартрат, этилморфина гидрохлорид, вика- сол, новокаинамид, производные фенотиазина и другие лекарственные вещества, содержащие карбонильные, фенольные, этанольные, аминные группы с подвижными атомами водорода.
Для стабилизации используют:
1. Прямые антиоксиданты, сильные восстановители, обладающие более высокой способностью к окислению. Действие их основано на быстром окислении серы низкой валентности:
- Na2SO3 - натрия сульфит;
- Na2S203 - натрия метабисульфит;
- NaHS03 - натрия сульфит кислый;
- тиомочевина;
- ронгалит (натрия формальдегидсульфоксилат);
- унитиол (2, 3-димеркаптопропансульфонат натрия).
2. Органические вещества, содержащие альдегидные, этанольные и фенольные группы:
- парааминофенол;
- кислота аскорбиновая и др.
Механизм действия антиоксидантов изложен в разделе «Вспомогательные вещества».
3. Антикатализаторы.
Влияние на процесс окисления лекарственных веществ оказывает присутствие следов тяжелых металлов (Fe3+, Cu+, Mn2+ и др.), которые являются катализаторами процессов окисления. Установлено, что изменение цвета растворов салицилатов обусловлено окислением фенольного гидроксила в присутствии следов ионов марганца.
Ионы тяжелых металлов, участвуя в цепной окислительно-восстановительной реакции, способны отрывать электроны от при- сутствующих вместе с ними в растворах различных ионов, переводя последние в радикалы.
Для стабилизации легкоокисляющихся веществ используют комплексоны:
- ЭДТА - этилендиаминтетрауксусная кислота;
- трилон Б - динатриевая соль этилендиаминтетрауксусной кислоты;
- тетацин-кальций;
- кальций-динатриевая соль этилендиаминтетрауксусной кислоты.
Общим свойством комплексонов является способность образовывать прочные внутрикомплексные водорастворимые соединения с большим числом катионов, в том числе и тяжелых металлов.
Важным средством стабилизации растворов является кипячение или дегазирование. В воде очищенной, обычно содержащей до 9 мг кислорода на
Окисление лекарственных веществ может быть уменьшено также за счет устранения действия света, температуры. Иногда растворы некоторых лекарственных веществ (например, фенотиазина) готовят при красном свете, некоторые растворы хранят в упаковке из светозащитного стекла.
Пример 3
Комплексный подход к стабилизации лекарственных препаратов на примере 1% раствора апоморфина. Для получения устойчивого раствора апоморфина используют комплекс стабилизаторов, состоящий из анальгина, обрывающего цепи окисления путем связывания пероксидных радикалов, и цистерна - вещества, разрушающего гидропероксиды. Для устранения каталитического действия ионов гидроксила раствор готовят с добавлением кислоты хлористо-водородной. Заполнение флаконов или бутылок в токе инертного газа позволяет получить растворы, устойчивые при термической стерилизации и хранении в течение нескольких лет.
25.4.4. Примеры стабилизации растворов для инъекций
Пример 4
Стабилизация растворов глюкозы
Стабилизируют
Rp.: Natrii chloridi 5,2
Ас. Hydrochloric dil. 4,4 ml
Воды для инъекций до 1000 ml
При изготовлении растворов глюкозы независимо от ее концентрации, добавляют 5% от объема этого стабилизатора.
Пример 5
Стабилизация растворов кислоты аскорбиновой
Применяют антиоксидант натрия метабисульфит в количестве
вору добавляют натрия гидрокарбонат в эквивалентных количествах. Наполняют флакон почти под пробку для уменьшения количества кислорода. Раствор готовят на свежепрокипяченной воде для инъекций.
Пример 6
Стабилизация растворов новокаина высокой концентрации Rp.: Novocaini 50,0 Natrii metabisulfitis 3,0 Ас. citrici 0,2
Ac. hydrochlorici
Раствор стерилизуют при температуре 120+2 "С в течение 8 мин. Срок хранения растворов - до 30 дней.
Пример 7
Особенности приготовления растворов натрия гидрокарбоната Применяют сырье квалификации х.ч., ч.д.а., отвечающее требованиям ГОСТа 4201, также квалификации «годен для инъекций». Натрия гидрокарбонат должен выдерживать дополнительное требование на прозрачность и бесцветность 5% раствора. Ионов кальция и магния должно быть не более 0,05%, иначе в процессе термической стерилизации раствора будет появляться опалесценция карбонатов этих катионов. Во избежание потери углерода диоксида, образующегося при гидролизе, растворение проводят при температуре не выше 20 "С в закрытом сосуде, избегая взбалтывания. Раствор стерилизуют при температуре 120+2 "С 8 мин (объем до 100 мл) и 12-15 мин (объем более 100 мл). Во избежание разрыва флаконов из-за выделения углерода диоксида разгрузку стерилизатора следует производить не ранее чем через 20-30 мин после того, как давление внутри стерилизационной камеры упадет до нуля.
25.5. ТЕХНОЛОГИЯ ИЗГОТОВЛЕНИЯ РАСТВОРОВ ДЛЯ ИНЪЕКЦИЙ
Процесс изготовления состоит из следующих стадий:
1. Подготовительная, в том числе: проведение расчетов, подготовка условий асептического изготовления, мойка и стерилизация тары и упаковки, получение воды для инъекций.
2. Получение растворов для инъекций, в том числе операции: растворение, фильтрация, розлив, укупорка, проверка на отсутст-
вие механических включений, полный химический анализ, стерилизация.
3. Маркировка готовой продукции.
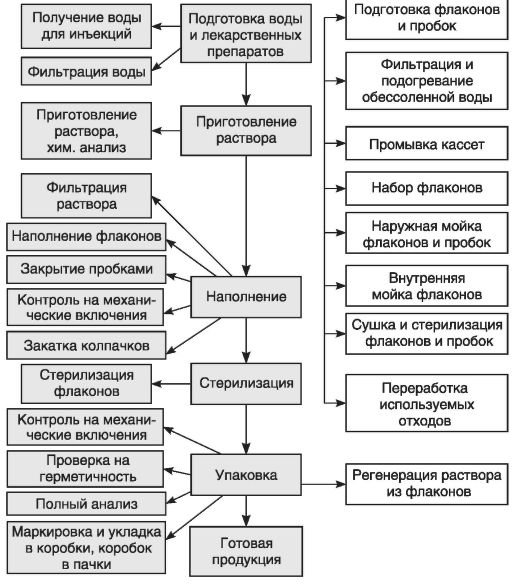
Типовая технологическая схема изготовления инъекционных растворов представлена на схеме 25.1. Технологический процесс изготовления разделяется на 3 потока:
- подготовка тары и упаковки;
- подготовка раствора;
- стерилизация, контроль качества, упаковка и маркировка готовой продукции.
Для получения растворов для инъекций и инфузий используют флаконы из нейтрального стекла марки НС-1 (для медицинских препаратов, антибиотиков) и НС-2 (сосуды для крови). В порядке исключения (после освобождения от щелочности) используют флаконы из стекла марки АБ-1 и МТО. Срок хранения растворов в них не должен превышать 2 сут.
При обработке флаконы из щелочного стекла заполняют водой очищенной, стерилизуют при температуре 120 ?С 30 мин. После обработки проводят контроль ее эффективности (потенциометрическим или ацидиметрическим методом). Изменение значения рН воды до и после стерилизации во флаконе не должно быть более 1,7.
Новую посуду снаружи и внутри обмывают водопроводной водой, замачивают на 20-25 мин в моющих растворах, подогретых до температуры 50-60 ?С. Используют также взвесь горчицы 1:20, 0,25% раствор «Дезмола», 0,5% растворы «Прогресса», «Лотоса», «Астры», 1% раствор СПМС (смесь сульфанола с натрия триполифосфатом 1:10). При сильном загрязнении посуду на 2-3 ч замачивают в 5% взвеси горчицы или растворе моющих средств в соответствии со специальной инструкцией.
Вымытую посуду стерилизуют горячим воздухом при температуре 180 ?С 60 мин. Посуду, бывшую в употреблении, дезинфицируют: 1% раствором активированного хлорамина - 30 мин; 3% свежеприготовленным раствором водорода пероксида с добавлением 0,5% моющих средств - 80 мин или 0,5% раствором «Дезмола» - 80 мин.
Для укупорки флаконов с инъекционными растворами используют пробки специальных сортов резины: ИР-21 (силиконовая); 25 П (натуральный каучук); 52-369, 52-369/1, 52-369/П (бутиловый каучук); ИР-119, ИР-119А (бутиловый каучук). Новые резиновые пробки
Схема 25.1. Типовая технологическая растворов
обрабатывают с целью удаления с их поверхности серы, цинка и других веществ в соответствии с инструкцией.
Пробки, бывшие в употреблении, промывают водой очищенной и кипятят в ней 2 раза по 20 мин, стерилизуют при температуре 121+2 ?С 45 мин.
Для изготовления растворов используют воду для инъекций (см. главу 21) и лекарственные средства квалификации «Для инъек- ций» или другие, если имеется указание в соответствующих ФС.
Фильтрование растворов для инъекций проводят через глубинные, чаще мембранные фильтры (см. главу «Асептика, стерилизация фильтрованием»).
В случае приготовления малых объемов инъекционных растворов применяют фильтр «Грибок» (рис. 25.13), представляющий собой воронку, обтянутую фильтровальным материалом, и работающий под разрежением. Фильтровальный пакет состоит из шелковой ткани в 2 слоя, фильтровальной бумаги в 3 слоя, марлевой прокладки и шелковой ткани в 2 слоя. Полностью заполненную воронку обвязывают сверху парашютным шелком. Фильтруют под вакуумом.
Профильтрованный раствор с помощью дозаторов разливают в подготовленные бутылки для инъекционных растворов. Закрывают пробками.
Флаконы с растворами для инъекций, укупоренные резиновыми пробками, контролируют на отсутствие механических включений. При обнаружении механических включений при первичном контроле раствора его перефильтровывают.
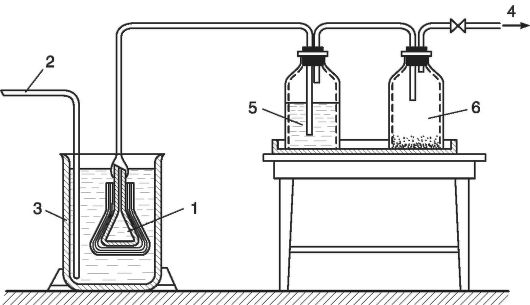
Рис. 25.13. Фильтр «Грибок»:
1 - воронка, обтянутся слоем фильтровальных материалов; 2 - линия подачи растворов; 3 - стакан с фильтруемым раствором; 4 - вакуум; 5 - приемник с профильтрованным раствором; 6 - ловушка на вакуумной линии
После изготовления растворы для инъекций подвергают химическому анализу, заключающемуся в определении подлинности (качественный анализ) и количественного содержания лекарственных веществ, входящих в состав лекарственной формы (количественный анализ). Количественному и качественному анализам провизоры-аналитики подвергают первично все серии инъекционных растворов, которые готовят в аптеке (до стерилизации). В аптеках, где нет провизора-аналитика, количественному анализу подвергают растворы атропина сульфата, новокаина, глюкозы, кальция хлорида и изотонический раствор натрия хлорида. Контроль путем опроса провизора-технолога проводят немедленно после изготовления инъекционного раствора. При положительном результате обкатывают металлическими колпачками.
Закатанные бутылки с растворами для инъекций маркируют по алюминиевому колпачку, указывая наименование, номер серии.
Маркированные флаконы помещают в автоклав и стерилизуют в соответствии с указаниями ГФ, учитывая объем раствора в сосуде. После стерилизации растворы анализируют на содержание механических включений в соответствии с приказом ? 308. Забракованные флаконы переработке не подлежат.
Отбракованные флаконы направляют на полный анализ в соответствии с требованиями ГФ или ФС.
Отбирают пробу на анализ стерильности и отсутствие пирогенных веществ. В случае положительного результата маркируют и упаковывают в гофрокоробки.
25.6. КОНТРОЛЬ РАСТВОРОВ НА ОТСУТСТВИЕ МЕХАНИЧЕСКИХ ВКЛЮЧЕНИЙ
В процессе изготовления растворы подвергаются первичному и вторичному контролю.
Первичный контроль осуществляется после фильтрования и фасовки раствора. При этом просматривается каждая бутылка или флакон с раствором. При обнаружении механических включений раствор повторно фильтруют, вновь просматривают, укупоривают, маркируют и стерилизуют. Растворы, изготовленные асептически, просматривают 1 раз после розлива или стерилизующего фильтрования.
Вторичному контролю подлежат также 100% бутылок и флаконов с растворами, прошедших стадию стерилизации перед их оформлением

Рис. 25.14. Устройство для контроля растворов на механические включения
и упаковкой. Для просмотра бутылок используют «Устройство для контроля растворов на отсутствие механических загрязнений» (УК-2) (рис. 25.14) и др. Контроль растворов осуществляется путем их просмотра невооруженным глазом на черном и белом фоне, освещенном электрической матовой лампой в 60 ватт или лампой дневного света 20 ватт, для окрашенных растворов - соответственно в 100 и 30 ватт. Расстояние от глаза до просматриваемого объекта должно быть 25-30 см, а угол оптической оси просмотра к направлению света - около 90 ?. Линия зрения должна быть направлена книзу при вертикальном положении головы.
В зависимости от объема бутылки или флакона просматривают одновременно от 1 до5 штук. Бутылки или флаконы берут в одну или обе руки за горловины, вносят в зону контроля, плавным движением перевора- чивают в положение вверх донышками и просматривают на черном и белом фоне. Затем плавным движением, без встряхивания переворачивают в первоначальное положение вниз донышками и также просматривают.
Время контроля соответственно составляет: 1 бутылки (флакона) вместимостью 100-500 мл - до 20 с, 2 бутылок (флаконов) вмести-
мостью 50-100 мл - 10 с, от 2 до 5 бутылок (флаконов) вместимостью 5- 50 мл - 8-10 с. Визуальным осмотром могут быть идентифицированы частицы размером более 50 мкм.
Фармакопеей США USP 24/NF19 установлен инструментальный контроль за содержанием механических частиц в инъекционных растворах: не более 12 частиц/мл - размером более 10 микрон и не более 2 частиц/мл - размером более 25 микрон (рис. 25.15).
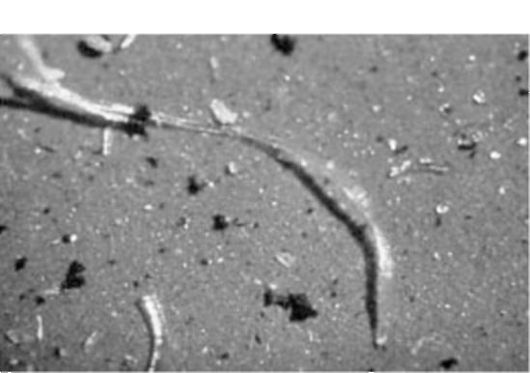
Рис. 25.15. Примеси, отфильтрованные из инфузионного раствора (увеличено 1 . 700)
25.7. ОБЩИЕ ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К ИНЪЕКЦИОННЫМ ЛЕКАРСТВЕННЫМ ФОРМАМ
Растворы для инъекций должны быть прозрачными по сравнению с водой для инъекций. Объем инъекционных растворов в сосудах должен быть больше номинального (табл. 25.5).
Таблица 25.5. Объем инъекционных растворов в сосудах
Номинальный объем, мл | Объем заполнения, мл | Количество сосудов для контроля запол- нения, шт. | |
невязкие растворы | вязкие растворы | ||
1,0 | 1,10 | 1,15 | 20 |
2,0 | 2,15 | 2,25 | 20 |
5,0 | 5,30 | 5,50 | 20 |
10,0 | 10,50 | 10,70 | 10 |
20,0 | 20,60 | 20,90 | 10 |
50,0 | 5l,0 | 51,50 | 5 |
Более 50 | На 2 мл более номинального | На 3% более номинального | |
Растворы для инъекций должны быть стерильными, не иметь видимых механических включений.
Растворы для инъекций должны быть нетоксичными согласно требованиям и тест-дозам, указанным в частных статьях.
Растворы для инъекций должны быть апирогенными согласно требованиям и тест-дозам, указанным в частных статьях.
Испытанию подлежат все лекарственные средства для парентерального применения при объеме одноразовой дозы 10 мл и более, а также при меньшей дозе, если есть указание в частной статье.
Растворы для инъекций должны выдерживать испытание на отсутствие механических включений.
Отклонение массы содержимого одного сосуда от средней массы не должно превышать нормативов ГФ.
Содержание действующего вещества не должно отклоняться от номинального более чем на значение, установленное действующей фармакопеей.
25.8. МАРКИРОВКА РАСТВОРОВ ДЛЯ ИНЪЕКЦИЙ
На всех этикетках для оформления лекарственных препаратов, приготовляемых для лечебно-профилактических учреждений, должны быть следующие обозначения:
- местонахождение аптечного учреждения (предприятия)...;
- наименование аптечного учреждения (предприятия)...;
- больница ?...;
- отделение... ;
- дата (приготовления)... ;
- срок годности ... дней;
- приготовил... проверил... отпустил... ;
- анализ ?... ;
- подробный способ применения: «Внутривенно», «Внутривенно (капельно)», «Внутримышечно» («Для инъекций»);
- состав лекарственного препарата (предусматривается пустое место для указания состава).
25.9. ХРАНЕНИЕ РАСТВОРОВ ДЛЯ ИНЪЕКЦИЙ
Лекарственные формы для инъекций следует хранить в прохладном, защищенном от света месте, в отдельном шкафу или изолированном помещении и с учетом особенности тары (хрупкость), если нет других указаний на упаковке.
Плазмозамещающие и дезинтоксикационные растворы хранят изолированно при температуре в пределах от 0 до 40 ?С в защищенном от света месте. В некоторых случаях допускается замерзание раствора, если это не отражается на качестве препарата (приказ MЗ РФ ? 377).
Контрольные вопросы
1. Какой процент в рецептуре аптек составляют растворы для инъекций?
2. Какие дисперсионные среды используют для инъекционных лекарственных форм?
3. Каковы условия получения воды для инъекций в аптеках?
4. Какие аквадистилляторы используются для получения воды для инъекций?
5. Цель использования сепарирующего устройства. Его разновидности.
6. Какие неводные и комплексные растворители используются для инъекционных растворов? Их номенклатура.
7. Каковы требования, предъявляемые к лекарственным веществам для
инъекционных растворов?
8. Чем обусловлена стабилизация растворов для инъекций?
9. Каков принцип стабилизации растворов солей слабых оснований и сильных кислот? Приведите примеры.
10. Каков принцип стабилизации растворов солей слабых кислот и сильных оснований? Приведите примеры.
11. Как используется перекисная теория окисления академика Н.Н. Семенова при стабилизации инъекционных растворов?
12. Каков основной механизм действия антиоксидантов?
13. Каков механизм стабилизирующего действия ПАВ?
14. В чем заключается отличие стабилизации растворов новокаина низких и высоких концентраций?
15. Какова технология изготовления стабильного раствора глюкозы?
16. Какие факторы и технологические приемы способствуют стабилизации инъекционных растворов?
17. Чем объяснить необходимость тщательного фильтрования растворов для инъекций и контроля их чистоты?
18. Какова взаимосвязь между использованием средств малой механизации и требованиями, предъявляемыми к растворам для инъекций при их фильтровании?
Тесты
1. Инъекционные растворы относятся к инфузионным, если их объем более:
1. 10 мл.
2. 50 мл.
3. 100 мл.
2. Для замедления (пролонгирования) действия препарата применяют его:
1. Спиртовые растворы.
2. Водные растворы.
3. Масляные растворы или эмульсии.
3. В качестве растворителей не применяют:
1. Воду для инъекций.
2. Воду очищенную.
3. Жирные масла.
4. Этилолеат.
4. В качестве комплексного растворителя может быть использовано все, кроме:
1. Этанола.
2. Глицерина.
3. Метанола.
4. Пропиленгликоля.
5. ПЭО-400.
5. Предотвращает кристаллизацию веществ из масел в процессе хранения:
1. Глицерин.
2. Этанол.
3. Пропиленгликоль.
4. Бензилбензоат.
6. Лекарственные вещества, используемые для приготовления инъекционных растворов, хранят:
1. В штангласах.
2. Стерильных небольших штангласах.
3. В стерильных больших штангласах.
7. Эуфиллин для инъекций должен содержать повышенное количество:
1. Этилендиамина (18-22%).
2. Этилендиамина (14-18%).
3. Теофиллина.
8. Лекарственные средства для внутриполостных, внутрисердечных, внутриглазных или других инъекций, имеющих доступ к спинномозговой жидкости, а также при разовой дозе, превышающей 15 мл, должны содержать:
1. Количество консервантов не более 0,5%.
2. Количество консервантов не более 0,2%.
3. Не должны содержать консервантов.
9. Разрешается смешивание лекарственных препаратов в одном флаконе со следующими внутривенными растворами:
1. Плазмозаменителями.
2. Гидролизатами белка.
3. Растворами аминокислот.
4. Кровью, плазмой и другими препаратами крови.
5. Бикарбонатом натрия.
6. Натрия хлоридом.
7. Жировой эмульсией.
10. Смешивание в одном флаконе веществ, обладающих свойствами кислоты и основания, приводит к реакции взаимодействия:
1. Всегда.
2. Иногда.
3. Никогда.
11. По сравнению с другими изготовляемыми в аптеках лекарственными формами (растворы для внутреннего и наружного применения, порошки, мази и т.д.), для которых лишь на отдельные препараты имеются частные
статьи в ГФ Х, ФС, ВФС, составы всех растворов для инъекций, а также способы обеспечения их стерильности и стабильности:
1. Не регламентированы.
2. Регламентированы.
12. Увеличение рН раствора приводит к:
1. Осаждению оснований из солей.
2. Растворению солей.
13. Растворы солей слабых оснований и сильных кислот стабилизируют добавлением:
1. 0,1 М раствора кислоты хлористо-водородной.
2. 0,1 М раствора натрия гидрокарбоната.
3. 0,1 М раствора пероксида водорода.
14. Прямые антиоксиданты - это:
1. Na2S203 - натрия метабисульфит.
2. Тетацин-кальций.
3. Кальций-динатриевая соль этилендиаминтетрауксусной кислоты.
15. На флаконах с какими растворами при оформлении их к стерилизации делают пометку о времени изготовления - с учетом того, что интервал времени от изготовления этих растворов до начала стерилизации регламентируется?
1. С антибиотиками.
2. Для офтальмологии.
3. Для инъекций.
4. Для новорожденных.
16. Интервал времени от начала изготовления инъекционных и инфузионных растворов до начала стерилизации не должен превышать:
1. 1,5 ч.
2. 2 ч.
3. 3 ч.
4. 6 ч.
5. 12 ч.
17. Объем инъекционных растворов в сосудах должен быть:
1. Больше номинального.
2. Меньше номинального.
3. Равен номинальному.