Лабораторные и инструментальные исследования в диагностике: Справочник / Пер. с англ. В.Ю. Халатова; Под ред. В.Н. Титова. - М.: ГЭОТАР-МЕД, 2004. - 960 с.
|
|
|
|
Глава 8 ПОСЕВ И КУЛЬТИВИРОВАНИЕ
ПОСЕВ И КУЛЬТИВИРОВАНИЕ ПРИ ИНФЕКЦИИ ПОЛОВЫХ ПУТЕЙ
ПОСЕВ МАТЕРИАЛА ПРИ ГОНОРЕЕ
Гонорея почти всегда является результатом передачи половым путем Neisseria gonorrhoeae. Исследование окрашенных мазков материала, взятого из половых путей, позволяет подтвердить диагноз гонореи у 90% мужчин с клинической картиной этого заболевания, однако обычно для установления диагноза, особенно у женщин без характерных проявлений гонореи, прибегают к посеву. Обычным местом взятия материала для посева являются уретра (у мужчин), шеечный канал (у женщин), а также анальный канал и ротоглотка. Цель - подтвердить диагноз гонореи.
Подготовка
• Следует объяснить пациенту, что исследование выполняют для подтверждения диагноза гонореи.
• Пациент должен знать, кто и когда будет выполнять исследование.
• Пациенток просят в течение 24 ч до исследования не прибегать к спринцеванию.
• Мужчин просят не мочиться в течение 1 ч до исследования. Следует предупредить их о возможности появления тошноты, холодного липкого пота, слабости вплоть до обморока в результате стресса или неприятных ощущений, возникающих при введении в уретру ватного тампона или проволочной петли для взятия материала.
Оборудование. Стерильные перчатки, стерильные ватные там-
поны, шпатель, проволочная петля или тонкие урогенитальные альгинатные тампоны (для мужчин), вагинальное зеркало, модифицированная среда Тейера-Мартина в чашках (или флаконы со средой «Transgrow», если лаборатория расположена далеко), окончатый зажим, ватные шарики.
Процедура и последующий уход
Материал из шеечного канала
• Пациентку укладывают, как при литотомии, промежность изолируют стерильным бельем и просят дышать спокойно и глубоко.
• Надев перчатки, вводят вагинальное зеркало, смоченное теплой водой (смазочные средства применять не следует). С помощью ватных шариков, заправленных в окончатый зажим, вытирают слизь с шейки матки.
• В шеечный канал вводят сухой стерильный ватный тампон, вращают его из стороны в сторону и оставляют на несколько секунд для абсорбции на нем микроорганизмов.
• При воспалительных заболеваниях матки и придатков иногда материал берут с эндометрия или аспирируют во время лапароскопии или кольпоскопии. Для взятия материала с эндометрия в шеечный канал вставляют узкий катетер и через него вводят в полость матки тонкий стент.
Материал из уретры
• Пациента укладывают на спину, промежность изолируют стерильным бельем.
• Наружное отверстие уретры вытирают стерильной марле-
вой салфеткой или ватным шариком, в уретру вводят тонкий урогенитальный альгинатный тампон или проволочную петлю размером 1-2 см, вращают из стороны в сторону и оставляют на несколько секунд для абсорбции на них микроорганизмов. Иногда пациента просят сдаивающим движением выдавить уретральное отделяемое, которое собирают ватным тампоном. Материал из прямой кишки
• После взятия материала из шеечного канала или из уретры пациенту, пока он еще находится на диагностическом столе, в анальный канал вводят стерильный ватный тампон на глубину 2,5 см, вращают в обе стороны и оставляют на несколько секунд для абсорбции на нем микроорганизмов.
• Если тампон загрязняется калом, его выбрасывают и материал берут снова чистым тампоном.
Материал из зева
• Пациента усаживают на стул, голову откидывают назад.
• С помощью шпателя осматривают полость рта и глотки. Стерильным ватным тампоном, не касаясь зубов, языка или щек, берут материал из зева, потирая тампон о нёбные миндалины, включая воспаленные и покрытые налетом участки.
После взятия материала
• Штриховым движением, напоминающим букву Z, взятый материал с ватного тампона наносят на среду ТейераМартина. Затем стерильной проволочной петлей или стержнем тампона прочерчивают волнистую линию в поперечном направлении и чашку Петри закрывают (см. Посев материала при гонорее).
• На маркировке указывают фамилию пациента, номер палаты (если пациент лечится в стационаре), дату и время взятия материала.
• Для окраски по Граму следует сразу приготовить мазок. Оставшуюся часть материала инокулируют в селективную культуральную среду или в среду для транспортировки. Последняя содержит активированный уголь, который нейтрализует содержащиеся в материале токсические вещества.
• Если лаборатория находится далеко, поступают следующим образом. Открывают флакон со средой «Transgrow». Флакон держат прямо, чтобы уменьшить потери содержащегося в нем углекислого газа. Тампоном впитывают избыток жидкости во флаконе и, проткнув им среду «Transgrow», делают несколько вращательных движений. Тампон выбрасывают. Флакон закрывают крышкой и маркируют.
• Пациенту рекомендуют воздержаться от половой жизни до получения результатов исследования.
• Следует объяснить пациенту, что лечение обычно начинают при положительном результате посева, подтверждающем диагноз, за исключением тех случаев, когда у пациента явные симптомы гонореи или он имел половые сношения с партнером, больным гонореей.
• Через 1 нед после лечения для оценки его эффективности желательно посев повторить.
• Следует предупредить пациента, что при положительном результате посева об этом сообщают в медицинское учреждение по месту жительства.
Меры предосторожности
• Взятие материала и его отправку следует осуществлять в перчатках.
• Материал у мужчин следует брать, уложив их на спину, так как при введении ватного тампона или проволочной петли в уретру возможны развитие вазовагального обморока и падение пациента. Следует внимательно отнестись к появлению таких симптомов, как падение артериального давления, брадикардия, бледность, холодный липкий пот.
• Материал следует брать по меньшей мере через 1 ч после мочеиспускания, так как отделяемое уретры обычно вымывается с мочой.
• После взятия материала перчатки, тампоны выбрасывают согласно правилам безопасного хранения, а инструменты изолируют во избежание инфицирования персонала.
• Материал следует сразу отправить в лабораторию или перенести во флакон со средой «Transgrow» для транспортировки, из которого в течение 24-48 ч делают пересев культуры.
Нормальная картина. В норме в материале, взятом из половых путей, N. gonorrhoeae не высевается.
Отклонение от нормы. Положительный результат посева подтверждает диагноз гонореи. Факторы, влияющие на результат исследования
• Проведение противомикробной терапии перед исследованием.
• Загрязнение материала из анального канала калом.
• Неправильная техника взятия материала (загрязнение материала или ложноотрицательный результат).
• Взятие материала у мужчин в течение 1 ч после мочеиспускания, у женщин - в течение 24 ч после спринцевания (уменьшение количества микроорганизмов для посева).
Посев материала при гонорее.
Для посева при гонорее необходима модифицированная среда
Тейера-Мартина (МТМ). Если
лаборатория расположена далеко и предстоит длительная транспортировка, то используют среду «Transgrow». Модифицированная среда Тейера-Мартина. МТМ содержит гемоглобин, химические вещества, ускоряющие рост гонококков, и противомикробные средства, подавляющие рост микрофлоры шеечного канала, уретры и прямой кишки. Для инокуляции возбудителей и перехода их из слизи или секрета в МТМ следует:
• Нанести материал на поверхность среды штриховым движением тампона в виде буквы Z (слева).
• Сразу после этого стерильной проволочной петлей или стержнем тампона прочертить волнистую линию в поперечном направлении (справа). Посев инкубируют в течение 15 мин.
Среда «Transgrow». Для отправки материала в отдаленную лабораторию разработан транспортный содержащий углекислый газ вариант МТМ, которую разливают во флакон с плотно закручивающейся крышкой. Для инокуляции материала на эту среду следует:
• Во избежание потери двуокиси углерода флакон со средой во время инокуляции держать прямо.
• Сразу после отвинчивания крышки во флакон вводят тампон и дают впитаться в него избытку жидкости.
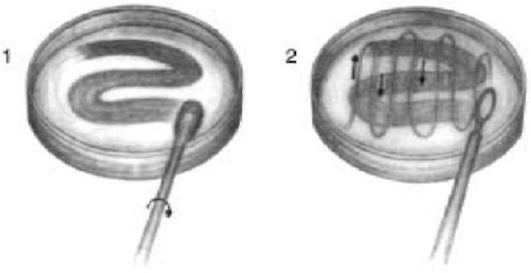
Метод инокуляции материала в модифицированную среду Тейера-Мартина в два приема.
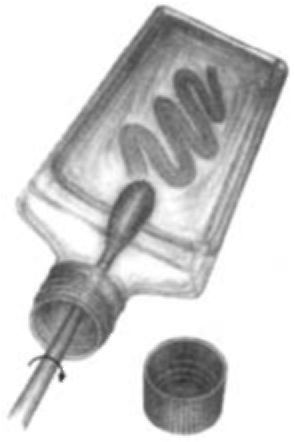
Метод инокуляции материала в среду «Transgrow» в один прием.
• Начиная от дна флакона волнообразным движением тампона инокулируют материал в среду.
• Флакон закрывают крышкой и сразу отправляют в лабораторию. Пересев культуры из него делают в течение 24-48 ч.
КУЛЬТИВИРОВАНИЕ ВОЗБУДИТЕЛЯ ПРИ ГЕРПЕТИЧЕСКОЙ ИНФЕКЦИИ
Спектр клинических проявлений простого герпеса широк. К ним относятся такие поражения, как кератит, гингивостоматит, энцефалит. У пациентов с ослабленным иммунитетом возможно развитие генерализованной формы инфекции. К возбудителям герпетической инфекции относятся вирус Эпштейна-Барр, цитомегаловирус (ЦМВ), вирус varicella-zoster, герпес-вирусы человека типов 6, 7 и 8 и два родственных вируса простого герпеса (ВПГ) типов 1 и 2. В стандартных клеточных культурах, применяющихся в диагностических лабораториях, размножаются лишь ЦМВ, вирус varicellazoster и ВПГ типов 1 и 2. Примерно 50% штаммов ВПГ можно выявить в лаборатории
по характерному цитопатическому эффекту в течение 24 ч. Для выявления остальных штаммов требуется от 5 до 7 дней (см. Ускоренная диагностика цитомегаловирусной инфекции с помощью моноклональных антител).
Другой метод диагностики заключается в выявлении раннего антигена ВПГ в однослойной культуре клеток с помощью моноклональных антител. Метод имеет такую же чувствительность и специфичность, как в случае использования обычной культуры клеток в пробирке, и позволяет получить ответ в течение 16 ч после доставки материала в лабораторию.
Ускоренная диагностика цитомегаловирусной инфекции с помощью моноклональных антител. В прошлом лабораторная диагностика цитомегаловирусной инфекции основывалась на выявлении цитопатического эффекта вируса на обычную культуру клеток в пробирке. При таком методе исследования результат можно было получить в среднем лишь через 9 дней. Ускоренная диагностика. При ускоренной диагностике материал инокулируют в однослойную
культуру клеток. После инкубации в течение 16 ч с помощью специфических моноклональных антител выявляют ранний антиген ЦМВ, представляющий собой белок с молекулярной массой 72 кД и синтезирующийся сразу после начала репликации вируса.
С помощью реакции непрямой иммунофлюоресценции инфицированные ЦМВ фибробласты распознают по интенсивному гомогенному окрашиванию их ядер. Правильная форма ядер и их гладкие края позволяют легко отличить инфицированные клетки от неспецифической фоновой флюоресценции, наблюдаемой в некоторых препаратах. Метод позволяет диагностировать цитомегаловирусную инфекцию в короткие сроки, особенно у пациентов с ослабленным иммунитетом, у которых имеются системные инфекционные осложнения или высокий риск их развития.
Взятие материала. Материал следует брать, ознакомившись с инструкциями лаборатории, в продромальном или остром периоде инфекции, когда вероятность выявления возбудителя особенно высока. Методика взятия материала зависит от характера материала:
• Зев: микробиологический тампон.
• Моча и СМЖ: стерильная пробирка или флакон с завинчивающейся крышкой.
• Смыв из бронхов: стерильная банка с закручивающейся крышкой.
• Кровь: стерильная пробирка с антикоагулянтом (гепарин).
ЦМВ может быть обнаружен в зеве и моче пациентов, не имеющих симптомов заболевания. Это свидетельствует об актив-
ной инфекции, протекающей бессимптомно, которая, однако, может проявиться клинически при снижении иммунитета. Выявление ЦМВ в крови и смыве из бронхов - признак системной инфекции.
Цель - на основе культурального исследования материала подтвердить диагноз простого герпеса.
Подготовка
• Пациенту объясняют, что исследование выполняют для диагностики простого герпеса.
• Пациенту объясняют, что материал следует брать из подозрительных участков в продромальный и острый периоды инфекции.
Процедура и последующий уход
• Материал помещают в контейнер. Содержимое везикул можно получить с помощью иглы 27-го калибра, насаженной на туберкулиновый шприц. Если содержимого мало, то для получения клеток следует потереть тампоном дно вскрытой везикулы.
• Для взятия материала из зева, глаз, половых органов и с кожи используют микробиологический тампон.
• Для взятия биологических жидкостей и смывов используют стерильные банки с закручивающейся крышкой.
• Материал следует отправить в лабораторию сразу после взятия. Если время между взятием материала и его инокуляцией в культуру клеток может превысить 3 ч, то его охлаждают и транспортируют при температуре 4 °С.
Меры предосторожности
• Взятие материала и его отправку осуществляют в перчатках.
• Подсыхание материала недопустимо.
Нормальная картина. ВПГ редко удается выявить у пациентов с ненарушенным иммунитетом при отсутствии клинических проявлений герпетической инфекции.
Отклонение от нормы
Выявление ВПГ из очагов поражения на коже, из глаз, СМЖ имеет важное клиническое значение. Выявление ВПГ в верхних дыхательных путях часто свидетельствует о периодическом обострении инфекции, особенно у пациентов с ослабленным иммунитетом. Как и другие герпес-вирусы, ВПГ можно периодически обнаруживать у пациентов с ослабленным иммунитетом при отсутствии явных клинических проявлений. Исходя из эпидемиологических соображений, ВПГ, выявленный по цитопатическому эффекту в обычной культуре клеток в пробирке, следует идентифицировать (ВПГ типа 1 или 2).
Факторы, влияющие на результат исследования. Получение пациентом противовирусных препаратов перед взятием материала.
КУЛЬТИВИРОВАНИЕ ВОЗБУДИТЕЛЯ ПРИ УРОГЕ-
НИТАЛЬНОМ ХЛАМИДИОЗЕ
Наиболее частое заболевание в США, передающееся половым путем, вызывается микроорганизмами Chlamydia trachomatis. Идентификация этих паразитов требует культивирования в лаборатории. После инкубации инфицированные хламидиями клетки выявляют с помощью моноклональных антител, конъюгированных с флюоресцеинизотиоцианатом, или окрашивания йодом. Для выявления C. psittaci и C. pneumoniae необходимы специальная методика
и реактивы. У женщин, у которых подозревают хламидиоз, независимо от того, проявляется он клинически или нет, для диагностики прибегают к выявлению ДНК возбудителя. Культивирование является методом выбора для выявления хламидий, однако применяются также некультуральные методы лабораторной диагностики (выявление антигена возбудителя), отличающиеся быстротой. Цель - подтвердить диагноз хламидиоза.
Подготовка
• Следует объяснить пациенту цель исследования.
• Следует ознакомить пациента с методикой взятия материала для культурального исследования.
• Если материал предполагается взять из половых путей, пациента просят не мочиться в течение 3-4 ч до исследования.
• Женщин просят не выполнять спринцевание в течение 24 ч до исследования.
• Мужчин следует предупредить о появлении жжения или ощущения распирания при взятии материала и заверить, что эти явления пройдут через несколько минут.
Оборудование. Перчатки, стерильные ватные тампоны, проволочная петля или тонкие урогенитальные альгинатные тампоны (для мужчин), вагинальное зеркало, транспортная среда (2SP), содержащая фосфат сахарозы, микробиологические тампоны или щеточка.
Процедура и последующий уход
• Для исследования следует получить клетки из очага воспаления. У взрослых воспалительный процесс может затрагивать глаза, уретру, шеечный канал и прямую кишку.
• Материал берут с помощью аппликатора с ватой на конце, вводимого в уретру на глубину от 2 до 5 см.
• Для получения материала из шеечного канала используют щеточку.
• Материал переносят на транспортную среду 2SP.
• Материал, взятый из зева, глаз или носоглотки, и аспираты от младенцев следует инокулировать в транспортную среду 2SP. Материал отправляют в лабораторию охлажденным (4 °C).
• Если время между взятием материала и его инокуляцией в культуру клеток может превысить 24 ч, транспортную среду 2SP замораживают и материал отправляют в лабораторию контейнере с сухим льдом.
Предостережение. Если возникает подозрение на изнасилование, материал следует исследовать методом культивирования, а не выявления антигена.
• Пациенту следует воздержаться от половой жизни до получения результата.
• При подтверждении диагноза следует объяснить пациенту необходимость лечения полового партнера.
• Материал у мужчин следует брать, уложив их на спину, так как при введении ватного тампона или проволочной петли в уретру возможны развитие вазовагального обморока и падение пациента. Следует внима-
тельно отнестись к появлению таких симптомов, как падение АД, брадикардия, бледность, холодный липкий пот.
• Взятие матриала и его отправку следует осуществлять в перчатках.
• Материал следует брать по меньшей мере через 1 ч после мочеиспускания, так как отделяемое уретры обычно вымывается с мочой.
• После взятия материала перчатки, тампоны выбрасывают согласно правилам безопасного хранения, а инструменты изолируют во избежание инфицирования персонала.
Нормальная картина. В норме в исследуемом материале C. trachomatis не обнаруживают. Отклонение от нормы. Выявление C. trachomatis подтверждает диагноз хламидиоза.
Факторы, влияющие на результат исследования
• Проведение противомикробной терапии перед взятием материала (С. trachomatis можно не обнаружить).
• Взятие материала у мужчин в течение 1 ч после мочеиспускания; у женщин - в течение 24 ч после спринцевания (уменьшение количества микроорганизмов для посева).
• Неправильная техника взятия материала (загрязнение материала или ложноотрицательный результат).
• Загрязнение материала из анального канала калом.
ПОСЕВ МАТЕРИАЛА, ПОЛУЧЕННОГО ИЗ ДРУГИХ ОРГАНОВ
ПОСЕВ МОЧИ
Лабораторное исследование и посев мочи необходимы для ди-
агностики инфекции мочевых путей, особенно инфекции мочевого пузыря. В норме моча в почках и мочевом пузыре стериль-
на, но в пробе мочи, которую берут на исследование, обнаруживают различную микрофлору, обусловленную присутствием бактерий в уретре и на наружных половых органах. При бактериурии обычно превалирует какой-либо один вид бактерий, наличие двух и более видов бактерий скорее всего свидетельствует о загрязнении мочи при взятии пробы. Отсутствие бактерий в моче при однократном исследовании не позволяет исключить инфекцию; при сомнительных результатах посева необходим подсчет колоний в 1 мл мочи.
Цель
• Диагностика инфекции мочевых путей.
• Контроль за обсемененностью мочи после катетеризации мочевых путей.
Подготовка
• Следует объяснить пациенту, что исследование позволяет выявить инфекцию мочевых путей.
• Следует предупредить пациента, что для исследования необходимо собрать мочу и что каких-либо ограничений в диете и режиме питания перед исследованием не требуется.
• Пациенту объясняют, как собрать среднюю порцию мочи. Следует подчеркнуть важность тщательного туалета наружных половых органов перед взятием мочи.
• При необходимости катетеризации мочевого пузыря или надлобковой аспирации мочи следует предупредить пациента о возможности неприятных ощущений во время исследования.
• При подозрении на туберкулез мочу берут утром в течение 3 последовательных дней.
• Следует выяснить, получает ли пациент противомикробную терапию.
Оборудование. Перчатки, стерильная банка для мочи, салфетки, смоченные антисептическим раствором (в продаже имеются готовые наборы принадлежностей для взятия мочи с инструкцией на нескольких языках).
Процедура и последующий уход
• Собирают мочу с соблюдением необходимых требований.
• При наличии постоянного катетера его пережимают, протирают спиртовым шариком и с помощью стерильной иглы аспирируют 4 мл мочи, которую сливают в стерильную банку.
• Банку блотно закрывают стерильной крышкой и сразу отправляют в лабораторию. Если отправка задерживается более чем на 30 мин, банку с мочой хранят в холодильнике при температуре 4 °C или помещают в контейнер со льдом, если нет контейнера - с консервантом для транспортировки.
• Пациенту объясняют, что для взятия мочи ему следует помыть руки, протереть салфеткой, смоченной раствором антисептика, область наружного отверстия уретры, затем помочиться сначала в унитаз, затем в стерильную банку, не касаясь ее внутренней поверхности.
• На бланке направления в лабораторию отмечают предварительный диагноз, время и метод взятия мочи, сведения о проводимой пациенту противомикробной терапии и приеме диуретиков.
Меры предосторожности
• Взятие и отправку мочи следует осуществлять в перчатках.
• Количество мочи не должно быть менее 3 мл, однако не следует наполнять банку больше чем наполовину.
Нормальная картина. Результат посева стерильной мочи обозначают как «отсутствие роста бактерий», что позволяет исключить инфекцию мочевых путей. Отклонение от нормы. Если число колоний бактерий одного вида в 1 мл мочи превышает 100 000, то это свидетельствует об инфекции мочевых путей. При бактериальном числе менее 100 000 мл-1 диагноз инфекции ставят, учитывая возраст пациента, его пол, анамнез и другие факторы. Бактериальное число 10 000 мл-1 и менее является признаком загрязнения мочи при взятии, если у пациента нет клинических проявлений инфекции или других заболеваний мочевых путей и если моча взята через уретру. Выявление кислотоустойчивых бактерий при окраске по Цилю-Нильсену позволяет диагностировать туберкулез мочевых путей. Выделение из мочи двух и более видов микроорганизмов или микроорганизмов, обитающих во влагалище или на коже, указывает на ее загрязнение при взятии и требует повторения анализа. Длительная катетеризация мочевого пузыря или отведение мочи приводят к развитию полимикробной инфекции мочевых путей.
Факторы, влияющие на результат исследования
• Неправильная техника взятия мочи.
• Неправильное хранение мочи или несвоевременная доставка ее в лабораторию.
• Стимуляция диуреза и проведение противомикробной терапии перед исследованием.
ПОСЕВ КАЛА
Нормальная микрофлора кала содержит несколько видов патогенных микроорганизмов. Для диагностики инфекционных заболеваний ЖКТ, а также выявления носительства бактерий тифо-паратифозной группы и дизентерии важную роль играет бактериологическое исследование. После выделения возбудителя можно определить его чувствительность к антибактериальным препаратам. С помощью культурального исследования можно выявить также некоторые вирусы, например энтеровирусы, которые вызывают асептический менингит.
Цель
• Идентифицировать возбудитель инфекции ЖКТ.
• Выявить носительство патогенных микроорганизмов.
Подготовка
• Следует объяснить пациенту, что исследование позволяет идентифицировать возбудителя заболевания ЖКТ и выявить носительство патогенных микроорганизмов.
• Каких-либо ограничений в диете и режиме питания перед исследованием не требуется.
• Следует предупредить пациента, что для исследования берут пробу кала после акта дефекации в течение 3 последовательных дней.
• Следует выяснить у пациента особенности его питания, принимал ли он недавно или продолжает принимать противомикробные препараты, совершал ли он путешествия в районы, которые могут быть эндемичными по тем или иным инфекционным или паразитарным заболеваниям.
Оборудование. Перчатки, водонепроницаемый контейнер с герметичной крышкой, стерильный ватный тампон и коммерческая система сбора и транспортировки материала, шпатель, подкладное судно (при необходимости).
Процедура и последующий уход
• Пробу кала собирают непосредственно в контейнер. Если пациент не может передвигаться, под него подкладывают чистое сухое подкладное судно, из которого затем берут пробу кала и переносят в контейнер.
• При взятии материала из прямой кишки ватный тампон вводят в анальный канал выше анального сфинктера, осторожно поворачивают в обе стороны, извлекают и помещают в контейнер.
• При вирусологическом исследовании кала следует уточнить в лаборатории методику взятия материала.
• Контейнер маркируют с указанием фамилии пациента, номера палаты, даты и времени взятия материала.
• На бланке направления указывают предполагаемый возбудитель энтерита и проводимую пациенту противомикробную терапию.
Меры предосторожности
• Взятие материала и его отправку следует осуществлять в перчатках.
• При использовании подкладного судна или пеленки следует избегать контаминации кала мочой.
• В пробе должен содержаться материал, взятый из начальной, средней и конечной порций кала и желательно из участков, содержащих примесь слизи или крови.
• Пробу хранят в герметичном контейнере.
• Контейнер с калом следует отправить в лабораторию сразу после взятия. Нагревание, охлаждение, а также задержка пробы могут вызвать разрушение трофозоитов и цист паразитов.
• Пробу кала следует брать до назначения противомикробной терапии.
Нормальная картина. Значительная часть микрофлоры, содержащейся в кале, образована анаэробными бактериями, в том числе не образующими спор, клостридиями и анаэробными стрептококками. Остальная часть представлена аэробами, включая грамотрицательные палочки (преимущественно Escherichia coli и другие энтеробактерии, а также небольшое количество Pseudomonas spp.), грамположительные кокки (в основном энтерококки) и дрожжевые грибы.
Отклонение от нормы. Наиболее часто из ЖКТ высевают Shigella spp., Salmonella spp. и Campy-
lobacter jejuni. Реже встречаются Vibrio cholerae, V. parahaemolyticus, Clostridium botulinum, C. difficile, C. perfringens, Staphylococcus aureus энтеротоксигенные штаммы E. coli и Yersinia enterocolitica. Выявление некоторых патогенных микроорганизмов у пациентов с диареей указывает на бактериальную инфекцию и требует определения чувствительности к антибактериальным препаратам. В норме в кале могут содержаться С. difficile, E. coli и другие микроорганизмы, поэтому при их обнаружении необходимы дополнительные исследования, чтобы выяснить их инвазивность и способность образовывать токсин. Выявление таких патогенных бактерий, как С. botulinum ука-
зывает на пищевое отравление; в этом случае они должны быть обнаружены также в зараженной пище. Выявление большого количества S. aureus или дрожжеподобных грибов у пациентов, получающих длительное время противомикробную терапию, указывает на возможную инфекцию (возможно также носительство этих патогенных кишечных микроорганизмов). Выделение энтеровирусов свидетельствует об асептическом менингите. Если при посеве кала патогенные бактерии не обнаруживают, для исключения небактериального гастроэнтерита выполняют иммунологическое исследование кала или электронную микроскопию. Значительное количество полиморфно-ядерных лейкоцитов в кале указывает на наличие инвазивной патогенной микрофлоры. Факторы, влияющие на результат исследования
• Неправильная техника взятия материала.
• Загрязнение пробы мочой (возможно разрушение патогенных кишечных микроорганизмов).
• Проведение противомикробной терапии до исследования (подавление роста бактерий).
• Несвоевременная отправка материала в лабораторию (потеря части патогенных микроорганизмов или чрезмерный рост непатогенных). Если материал невозможно сразу отправить, его переносят в транспортную среду, содержащую забуференный раствор глицерина, который обеспечивает стабильный pH.
ПОСЕВ ИЗ ЗЕВА
Посев из зева используют главным образом для выявления патогенных микроорганизмов и их
идентификации. Результат посева интерпретируют с учетом клинической картины, принимаемых пациентом противомикробных препаратов и интенсивности роста нормальной микрофлоры. Цель
• Изолировать и идентифицировать бета-гемолитические стрептококки группы A.
• Выявить носители патогенных микроорганизмов, в частности Neisseria meningitidis.
Подготовка
• Следует объяснить пациенту, что исследование выполняют с целью идентификации возбудителя, явившегося причиной его заболевания, а также для выявления носительства.
• Каких-либо органичений в диете или режиме питания перед исследованием не требуется.
• Пациенту объясняют, что материал будут брать из зева, а также сообщают, кто и когда будет его брать.
• Следует предупредить пациента, что взятие материала может вызвать рвотный рефлекс.
• Следует выяснить, проводилась ли недавно пациенту противомикробная терапия и когда были выполнены прививки, если они имеют отношение к подозреваемому у пациента заболеванию.
Оборудование. Перчатки, стерильный тампон и пробирка с транспортной средой (имеются также коммерческие наборы с перечисленными принадлежностями).
Процедура и последующий уход
• Пациента просят откинуть голову назад и закрыть глаза.
• При хорошем освещении осматривают, пользуясь шпателем, горло.
• Потирают ватным тампоном нёбные миндалины, особенно
воспаленные и покрытые налетом участки.
• Не следует касаться тампоном языка, щек или зубов.
• При пользовании коммерческим набором и транспортной средой следует сломать ампулу и внедрить тампон в среду, чтобы предотвратить его высыхание.
• На бланке направления указывают противомикробные препараты, которые пациент недавно получал. На маркировке указывают, откуда взят материал, фамилии пациента и врача, дату и время взятия материала, подозреваемую инфекцию, особенно вызываемую С. diphtheriae (необходимы два тампона и специальная среда), Bordetella pertussis (необходимы посев материала из носоглотки и специальная среда) и N. meningitidis (необходима обогащенная селективная среда).
• Для выявления стрептококков группы A вначале прибегают к экспресс-анализу на специфический антиген (5 мин) и лишь при отрицательном результате берут материал на посев.
Меры предосторожности
• Посев из зева следует выполнить до проведения противомикробной терапии.
• Взятие материала и его отправку следует осуществлять в перчатках.
• Материал следует отправить в лабораторию сразу после взятия. Во время транспортировки материала (если она осуществляется не с помощью коммерческой транспортной системы) контейнер следует удерживать в вертикальном положении.
Предостережение. При взятии материала у пациента с дифтерией или эпиглоттитом воз-
можен ларингоспазм, поэтому следует иметь наготове принадлежности для реанимации.
• Материал из зева следует брать до начала противомикробной терапии.
Нормальная картина. В норме микрофлора глотки содержит негемолитический и альфа-гемолитический стрептококк, Neisseria spp., стафилококки, дифтероиды, некоторы штаммы Haemophilus, пневмококки, дрожжевые грибы, грамотрицательные кишечные палочки, Veillonella spp., Micrococcus spp. Отклонение от нормы. К патогенным микроорганизмам, которые могут быть изолированы при посеве из зева, относятся бета-гемолитический стрептококк группы A (S. pyogenes), который вызывает скарлатину и фарингит, С. albicans, вызывающий кандидозный стоматит, С. diphtheriae - возбудитель дифтерии и B. pertussis - возбудитель коклюша. В результате, выдаваемом лабораторией, должны быть указаны преобладающая микрофлора и количество патогенных микроорганизмов.
Факторы, влияющие на результат исследования
• Отсутствие указаний о проводимой пациенту противомикробной терапии на бланке направления в лабораторию (возможность ложноотрицательного результата).
• Отсутствие подходящей транспортной среды.
• Доставка материала в лабораторию более чем через 15 мин после взятия.
ПОСЕВ ИЗ НОСОГЛОТКИ
Для выявления патогенных микроорганизмов в носоглоточном
секрете выполняют его посев. Перед посевом исследуют под микроскопом мазок, окрашенный по Граму. Результаты микроскопии являются предварительными и позволяют построить план дальнейшего обследования пациента. Чтобы выбрать антибиотик, определяют чувствительность выделенного возбудителя.
Цель
• Идентифицировать возбудитель инфекции дыхательных путей.
• Идентифицировать нормальную микрофлору носоглотки, которая может проявить патогенные свойства у пациентов с ослабленным иммунитетом.
• Идентифицировать B. pertussis и N. meningitidis, особенно у маленьких детей, а также взрослых с ослабленным иммунитетом и носителей.
• Изолировать вирусы (иногда), особенно для выявления носителей вируса гриппа A и B.
Подготовка
• Следует объяснить пациенту, что исследование выполняют для выделения возбудителя инфекции дыхательных путей.
• Следует предупредить пациента, что для исследования с помощью ватного тампона берут носоглоточный секрет из заднего отдела носовых ходов и глотки, и сообщить ему, кто будет брать материал.
• Следует предупредить пациента, что взятие материала может вызвать у него неприятные ощущения и даже рвотный рефлекс, но что оно займет не более 15 с.
Оборудование. Перчатки, ручка-фонарик, стерильный гнущийся ватный тампон, стерильная стеклянная трубка или
носовое зеркало, шпатель, транспортная среда (бульон), стерильная вода или 0,9% раствор хлорида натрия. Процедура и последующий уход
• Надевают перчатки.
• Тампон смачивают стерильной водой или 0,9% раствором натрия хлорида.
• Пациента просят покашлять перед взятием материала.
• Пациента усаживают, голову откидывают назад.
• С помощью шпателя и ручкифонарика осматривают полость рта.
• Осторожно вводят тампон через ноздрю в носоглотку, придерживаясь перегородки носа и дна носового хода. Быстрым вращательным движением тампон извлекают.
• При другом способе в ноздрю вставляют стеклянную трубку и через нее в носоглотку вводят тампон, вращают его в течение 5 с, после чего опускают в пробирку с транспортной средой. Стеклянную трубку выбрасывают.
• Материал маркируют с указанием фамилий пациента и врача, даты и времени взятия, места взятия и подозреваемого возбудителя.
• Материал, который предположительно содержит B. pertussis, следует инокулировать в свежую питательную среду, так как возбудитель коклюша чувствителен к влиянию внешних воздействий.
• Если исследование выполняют с целью изоляции вируса, при взятии материала следует придерживаться рекомендаций лаборатории.
Меры предосторожности
• Взятие материала и его отправку следует осуществлять в перчатках.
• При взятии материала не следует касаться ноздрей и языка пациента.
Предостережение. При взятии материала у пациента с дифтерией или эпиглоттитом возможен ларингоспазм, поэтому следует иметь наготове принадлежности для реанимации.
• На бланке направления следует указать противомикробные или химиопрепараты, которые получал или получает пациент.
• Контейнер следует держать прямо.
• Если предполагаемыми возбудителями являются Corynebacterium diphtheriae или B. pertussis, следует предупредить сотрудников лаборатории, так как для роста этих возбудителей необходимы специальные среды.
• Материал, предположительно содержащий вирусы, охлаждают, следуя рекомендациям лаборатории.
• При подозрении на коклюш для взятия материала следует использовать дакроновый или альгинатный тампон.
• Если материал невозможно сразу перенести на питательную среду, то для его отправки в лабораторию в транспортную среду добавляют антибиотики для подавления роста обычной микрофлоры.
Нормальная картина. Микрофлора носоглотки обычно включает негемолитические стрептококки, альфа-гемолитический стрептококк, N. spp. (за исключением N. meningitidis и N. gonorrhoeae), коагулазоотрицательные стафилококки, например S. epidermidis, и иногда коагулазоположительный S. aureus.
Отклонение от нормы. К патогенным микроорганизмам, выявляемым в носоглотке, относят-
ся бета-гемолитические стрептококки группы A, иногда групп В,СиG, B. pertussis, C. diphtheriae, S. aureus, многие штаммы пневмококков, Haemophilus influenzae, Mixovirus influenzae, парамиксовирусы, Candida albicans, Mycoplasma spp., M. tuberculosis.
Факторы, влияющие на результат исследования
• Недавно проведенная противомикробная терапия (скудный рост микрофлоры).
• Неправильная техника взятия материала.
• Неправильная транспортировка материала.
• При предполагаемом вирусологическом исследовании хранение материала без охлаждения.
• Несвоевременная отправка материала в лабораторию.
ПОСЕВ МОКРОТЫ
Бактериологическое исследование мокроты (материал, полученный из легких и бронхов) занимает важное место в лечении пациентов с легочными заболеваниями. Обычно мокроту получают путем отхаркивания при кашле или аспирации из трахеи и бронхоскопии. Для лучшего отхаркивания прибегают к вдыханию аэрозолей, рекомендуют обильное питье, назначают физиотерапию. Цель - изолировать и идентифицировать возбудитель легочной инфекции (обычно бронхит, туберкулез, абсцесс легкого, пневмония).
Подготовка
• Следует объяснить пациенту, что исследование выполняют для идентификации возбудителя инфекции дыхательных путей.
• Следует предупредить пациента, что для исследования берут мокроту, и сообщить ему, кто будет проводить исследование.
• Если у пациента подозревают туберкулез, мокроту берут утром в течение 3 последовательных дней.
• Если целью исследования является диагностика туберкулеза, пациента предупреждают, что результат будет готов через несколько недель, поэтому диагностика этого заболевания обычно основывается на клинической картине, результате микроскопического исследования мазков мокроты по ЦилюНильсену, данных рентгенологического исследования грудной клетки и кожной пробе с очищенным белковым дериватом.
• Если мокроту получают путем отхаркивания, пациенту рекомендуют накануне исследования обильное питье (при отсутствии противопоказаний) для увеличения ее образования, объясняют, как эффективнее отхаркивать (энергичный кашель после 3 глубоких вдохов), подчеркивают важность получения именно мокроты, а не слюны. Перед взятием мокроты пациент должен почистить зубы щеткой и прополоскать рот, чтобы уменьшить бактериальную обсемененность полости рта.
• Если мокроту получают путем аспирации из трахеи, пациента предупреждают о неприятных ощущениях при введении катетера в трахею.
• Если мокроту получают путем бронхоскопии, пациент должен воздержаться от приема пищи в течение 6 ч до исследования. Необходимо проследить, чтобы он или его родные дали письменное согласие на иссле-
дование. Пациента предупреждают, что перед введением бронхоскопа слизистую оболочку глотки смазывают раствором местного анестетика для уменьшения неприятных ощущений. Оборудование. Для отхаркивания: чистые перчатки, стерильные герметичные контейнеры для разового пользования, 0,9% раствор натрия хлорида, аэрозоль с раствором ацетилцистеина или пропиленгликоля на стерильной или дистиллированной воде для стимуляции кашля, непроницаемый пакет. Для аспирации: катетер 16F или 18F для аспирации, водорастворимая смазка, стерильные перчатки, стерильный контейнер для мокроты или ловушка, присоединенная к катетеру, 0,9% раствор натрия хлорида. Для бронхоскопии: бронхоскоп, раствор местного анестетика, стерильные игла и шприц, стерильный контейнер для мокроты, 0,9% раствор натрия хлорида, бронхиальная щеточка, стерильные перчатки.
Процедура и последующий уход Отхаркивание
• Надевают перчатки.
• Пациента просят глубоко покашлять и сплюнуть мокроту в контейнер. Если мокроты нет, прибегают к физиотерапии или вдыханию теплого аэрозоля. Контейнер плотно закрывают с соблюдением стерильности.
• Перед отправкой в лабораторию контейнер запечатывают в непроницаемый пакет, а остальные принадлежности убирают, соблюдая правила безопасного хранения.
Аспирация
• При необходимости до и после процедуры пациенту делают ингаляции кислорода.
• Ловушку для мокроты присоединяют к катетеру. В стерильных перчатках смачивают катетер 0,9% раствором натрия хлорида и вводят через ноздрю в трахею. При прохождении катетера через гортань у пациента появляется кашель. Аспирация материала не должна длиться более 15 с.
• После аспирации катетер осторожно извлекают. Катетер и перчатки выбрасывают в специальный контейнер. Ловушку с мокротой отсоединяют от шприца и закрывают.
Бронхоскопия
• Глотку пациента орошают раствором местного анестетика или просят пациента прополоскать им горло. Бронхоскоп через глотку и трахею вводят в бронх.
• С помощью щеточки или путем аспирации через внутренний канал бронхоскопа (при необходимости с орошением бронха 0,9% раствором натрия хлорида) собирают бронхиальный секрет.
• После взятия материала бронхоскоп извлекают.
Предостережение. Во время и после бронхоскопии возможно развитие гипоксемии (появление спутанности сознания), ларингоспазма (стридор), бронхоспазма (пароксизм кашля), пневмоторакса (одышка, цианоз, боль в грудной стенке, тахикардия), а также перфорация трахеи или бронха (подкожная эмфизема) и другие повреждения органов дыхания (примесь крови в мокроте или отхаркивание чистой крови). Следует внимательно отнестись также к затруднению дыхания и глотания. Прием жидкостей можно разрешить только после восстановления рвотного рефлекса.
При всех методах получения мокроты
• Обязателен тщательный туалет полости рта.
• Следует промаркировать контейнер с мокротой, указав фамилию пациента, а на бланке направления в лабораторию указать характер материала, дату и время его взятия, предварительный диагноз и получаемые пациентом противомикробные препараты.
Меры предосторожности
• Аспирация мокроты из трахеи противопоказана пациентам с варикозным расширением вен пищевода.
• Пациенты с бронхиальной астмой и хроническим бронхитом склонны к бронхоспазму при вдыхании аэрозоля с раствором ацетилцистеина или 0,9% раствором натрия хлорида.
Предостережение. Отсасывать мокроту следует не более 5- 10 с. Длительность отсасывания не должна превышать 15 с. Если у пациента появляются признаки гипоксии и цианоз, катетер следует немедленно удалить и дать пациенту подышать кислородом.
• Взятие материала и его отправку следует осуществлять в перчатках.
• Учитывая возможность разбрызгивания бронхиального секрета при энергичном кашле, с профилактической целью следует надеть маску, а при необходимости также халат.
• Если мокроту берут для исследования на туберкулез, концентрация водного раствора пропиленгликоля, используемого для стимуляции кашля, не должна превышать 20%, так как при больших концентрациях происходит подавление роста M. tuberculosis (при от-
сутствии пропиленгликоля используют 10-20% раствор ацетилцистеина, приготовленный на воде или 0,9% растворе натрия хлорида).
• Материал следует отправить в лабораторию сразу после взятия.
Нормальная картина. Обычно в мокроте выявляют альфа-гемолитический стрептококк, Neisseria spp., дифтероиды. Обнаружение лишь нормальной микрофлоры не означает отсутствия инфекции. Отклонение от нормы. В связи с тем что в мокроте, как правило, присутствует микрофлора ротоглотки, результат посева следует интерпретировать с учетом клинической картины и общего состояния пациента. К выявлению M. tuberculosis всегда следует отнестись со всей серьезностью. Факторы, влияющие на результат исследования
• Неправильная техника взятия материала.
• Отсутствие указаний о проводимой пациенту противомикробной терапии на бланке направления в лабораторию (возможность ложноотрицательного результата).
• Задержка отправления материала в лабораторию (возможны скудный рост патогенных микроорганизмов и чрезмерный рост комменсалов).
ПОСЕВ КРОВИ
Посев крови выполняют для изоляции и идентификации патогенных микроорганизмов при бактериемии (проникновение бактерий в кровеносное русло) и септицемии (генерализация инфекции). При посеве кровь пациента инокулируют в питательную среду и инкубируют ее.
Цель
• Подтвердить бактериемию.
• Идентифицировать микроорганизмы, циркулирующие в крови при бактериемии и септицемии.
Подготовка
• Следует объяснить пациенту, что исследование выполняют с целью идентифицировать возбудители инфекции.
• Каких-либо ограничений в диете и режиме питания перед исследованием не требуется.
• Следует сообщить пациенту, сколько проб крови у него возьмут, а также кто и когда будет брать кровь.
• Следует предупредить о возможных неприятных ощущениях во время наложения жгута на руку и пункции вены.
Оборудование. Перчатки, резиновый жгут, спиртовой шарик, лейкопластырь, тампон, смоченный йодом, 10-20-миллилитро- вый шприц (при взятии крови у взрослых), 6-миллилитровый шприц (при взятии крови у детей), 3 или 4 стерильных иглы, 2 флакона с питательной средой (в один обеспечивают поступление воздуха для обнаружения аэробов, в другом среда не контактирует с воздухом, что необходимо для роста анаэробов) - обогащенным бульоном и полиэтанолсульфонатом натрия или флаконы со смолой либо пробирки для лизис-центрифугирования.
Подготовка
• Надевают перчатки.
• Круговыми движениями от центра к периферии место предстоящей венепункции протирают вначале спиртом, затем повидон-йодом.
• Выжидают примерно 1 мин, давая коже подсохнуть, затем удаляют остатки йода спирто-
вым шариком (это можно сделать и после венепункции).
• На руку накладывают жгут.
• Пунктируют вену. У взрослых забирают от 10 до 20 мл крови, у детей - 6 мл.
• Крышки флаконов со средой обрабатывают спиртом или повидон-йодом и на шприце меняют иглу.
• Если используется обогащенный бульон, кровь добавляют в соотношении 1:5 или 1:10, например к 100 мл среды добавляют 10 мл крови. Размер флаконов зависит от предпочтений лаборатории.
• При использовании смолы после добавления крови флакон осторожно переворачивают для перемешивания.
• Если пользуются методикой лизис-центрифугирования, кровь переносят сразу в центрифужную пробирку.
• На бланке направления в лабораторию следует указать предполагаемый диагноз и сведения о противомикробной терапии.
• Место венепункции придавливают ватным шариком до остановки кровотечения.
• При образовании гематомы в месте венепункции прибегают к согревающим компрессам.
Меры предосторожности
• Взятие крови и ее отправку следует осуществлять в перчатках.
• Пробу крови отправляют в лабораторию сразу после взятия.
• Не следует брать кровь из введенного пациенту внутривенного катетера. Для взятия крови необходимо пунктировать вену ниже уровня введения катетера либо на другой
руке.
• Посев крови следует выполнять по возможности до начала противомикробной терапии.
Нормальная картина. В норме патогенные микроорганизмы в крови отсутствуют. Отклонение от нормы. Положительный результат посева еще не является подтверждением септицемии. Нерезко выраженная преходящая бактериемия наблюдается при многих инфекционных заболеваниях и состояниях. Стойкая или рецидивирующая бактериемия - достоверный признак серьезного инфекционного заболевания. Для выявления патогенных микроорганизмов в большинстве случаев кровь берут в течение 2 последовательных дней. Для изоляции большинства возбудителей требуется 72 ч. Если в течение этого времени роста микрофлоры не происходит, то заключение о стерильности крови дают лишь по истечении 1 нед наблюдения за гемокультурой. К наиболее часто высеваемым патогенным микроорганизмам относятся Streptococcus pneumoniae и другие виды стрептококков, H. influenzae, S. aureus, Pseudomonas aeruginosa, Bacteroides spp., Brucella spp., энтеробактерии, кишечные бактерии, C. albicans. Хотя в 2-3% случаев гемокультура оказывается загрязненной микрофлорой кожи, в частности S. epidermidis, дифтероидами, Propionibacterium spp., клиническое значение ее возрастает при многократном выявлении и у пациентов с ослабленным иммунитетом. Посев крови у таких пациентов может выявить также C. albicans. У пациентов с ВИЧинфекцией могут обнаруживаться M. tuberculosis, комплекс M. avium-intracellulare, реже - другие виды микобактерий.
Факторы, влияющие на результат исследования • Проведение противомикробной терапии в период взятия
крови (возможны ложноотрицательные результаты).
• Неправильная техника взятия крови.
• Снятие крышки с флакона, предназначенного для культивирования анаэробов, у постели больного (подавление роста анаэробов).
• Неправильный выбор питательной среды (отсутствие роста аэробов).
ПОСЕВ РАНЕВОГО ОТДЕЛЯЕМОГО
Посев раневого отделяемого выполняют для подтверждения раневой инфекции. В поверхностных инфицированных ранах обычно обнаруживаются аэробные микроорганизмы, в то время как из ран с ограниченным доступом кислорода (например, послеоперационных), а также язв и тканей в области сложных переломов чаще высеваются анаэробы. Показаниями для посева из ран являются повышение температуры тела, появление отделяемого. Цель - идентифицировать возбудитель, вызвавший нагноение раны.
Подготовка
• Следует объяснить пациенту, что исследование выполняют для идентификации возбудителя раневой инфекции.
• Следует объяснить пациенту, что материал для исследования берут из раны с помощью стерильного ватного тампона или отсасыванием с помощью стерильного шприца.
• Следует сообщить пациенту, кто будет брать материал для исследования.
Оборудование. Стерильные ватные тампоны и стерильная про-
бирка для раневого отделяемого или коммерческая стерильная транспортная система (для аэробных микроорганизмов), стерильные ватные тампоны или 10-миллилитровый шприц с иглой 21-го калибра и специальная пробирка, содержащая углекислый газ или азот (для культивирования анаэробов), стерильные перчатки, стерильные салфетки, спирт, раствор повидон-йода.
Процедура и последующий уход
• Надевают перчатки, обрабатывают кожу вокруг раны раствором антисептика.
• Для культивирования аэробов следует, выдавив экссудат из раны, собрать его тампоном или ввести тампон глубоко в рану, осторожно вращая его. Тампон с отделяемым сразу переносят в пробирку со средой.
• Для культивирования анаэробов тампон вводят глубоко в рану, осторожно вращая его, и сразу переносят в пробирку со средой для анаэробов (см. Пробирка для культивирования анаэробов). Можно также ввести в рану иглу, аспирировать 1-5 мл экссудата и сразу перенести его в пробирку для анаэробов. Если игла имеет колпачок, то материал можно отправить в лабораторию в шприце.
• На бланке направления в лабораторию следует привести сведения о проводимой противомикробной терапии, месте, откуда взят материал, и предполагаемом возбудителе. На контейнере указывают фамилии пациента и врача, номер палаты, локализацию раны и время взятия материала.
Пробирка для культивирования анаэробов. Некоторые виды анаэробов погибают при доступе
кислорода. Для транспортировки материала в бескислородных условиях применяют пробирки с углекислым газом или азотом. На рисунке показана такая пробирка. Пробирка закрывается резиновой пробкой и заполнена углекислым газом. Она состоит из внутренней стеклянной трубки и пластмассового плунжера с прикрепленным к нему тампоном. Слева показана пробирка до взятия материала. Внутренняя трубка, в которой находится тампон, удерживается на месте резиновой пробкой. После взятия материала (рисунок справа) тампон быстро вводят во внутреннюю трубку и плунжер опускают. Это приводит к отделению трубки от пробки, которая погружается в пробирку, и материал оказывается в среде, обогащенной углекислым газом.
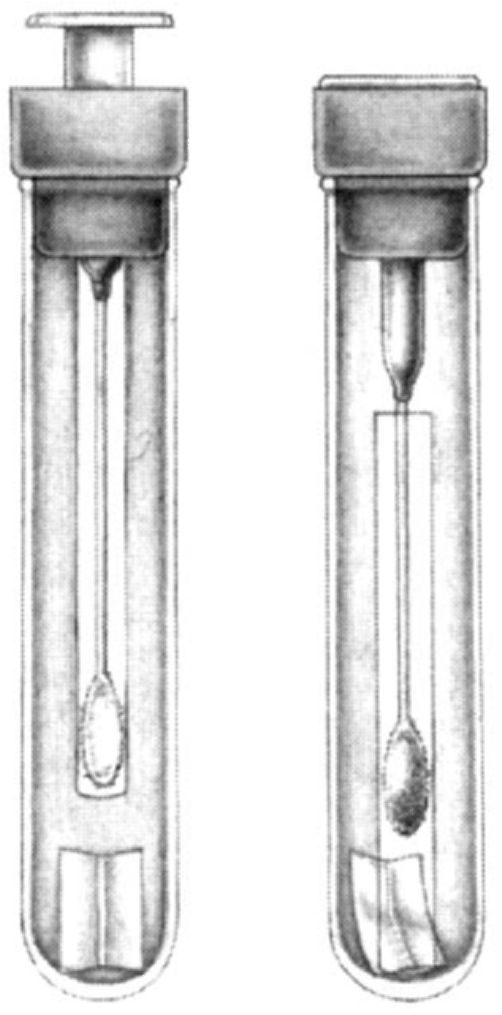
Пробирку следует держать прямо.
Меры предосторожности
• Кожу вокруг раны следует тщательно обработать раствором антисептика, чтобы избежать попадания нормальной микрофлоры кожи (дифтероиды, альфа-гемолитический стрептококк, S. epidermidis) в исследуемый материал. Кожу вокруг раны, расположенной в области промежности, не обрабатывают.
• Обрабатывать кожу следует осторожно, чтобы не допустить попадания раствора антисептика в рану.
• Некоторые анаэробы погибают в присутствии даже небольшого количества кислорода, поэтому материал следует перенести в пробирку как можно быстрее, так, чтобы туда не проник воздух, и надежно закрыть ее.
• Пробирку следует держать прямо и отправить ее в лабораторию в течение 15 мин.
• Взятие материала и его отправку следует осуществлять в перчатках и с соблюдением мер, направленных на недопущение распространения инфекции.
Нормальная картина. В «чистой» ране микрофлора обычно отсутствует.
Отклонение от нормы. К наиболее часто высеваемым патогенным аэробным микроорганизмам относятся S. aureus, бета-гемолитические стрептококки группы A, Proteus spp., E. coli и другие энтеробактерии, некоторые виды Pseudomonas. Из анаэробов наиболее часто выявляют Clostridium spp., Peptococcus spp. Bacteroides spp. Streptococcus spp.
Факторы, влияющие на результат исследования
• Проведение противомикробной терапии в период взятия материала.
• Неправильная техника взятия материала.
• Выбор неподходящей среды для отправки материала, что приводит к высыханию материала или угнетению роста микрофлоры.
ПОСЕВ СОДЕРЖИМОГО ЖЕЛУДКА
Желудочное содержимое для посева берут путем аспирации. Обычно исследование выполняют в сочетании с рентгенографией органов грудной клетки и туберкулиновой пробой очищенным белковым дериватом. Значение посева желудочного содержимого особенно возрастает при невозможности получить для исследования мокроту. Исследование желудочного содержимого с окраской по Граму у новорожденного с септицемией также позволяет быстро идентифицировать возможный возбудитель.
Цель
• Диагностика туберкулеза.
• Выявление возбудителя сепсиса у новорожденного.
Подготовка
• Следует объяснить пациенту (или родителям ребенка), что посев желудочного содержимого позволяет диагностировать туберкулез.
• Пациент должен воздержаться от приема пищи в течение 8 ч перед исследованием.
• Следует сообщить пациенту, кто будет проводить исследование, и предупредить его, что материал берут утром в течение 3 последовательных дней.
• Утром до взятия материала пациент должен оставаться в постели, так как активизация способствует быстрой эвакуации желудочного содержимого.
• Следует предупредить пациента, что введение в желудок назогастрального зонда может вызвать у него рвотный рефлекс и другие неприятные ощущения, которые, однако, быстро проходят, если пациент следует инструкциям врача.
• Перед исследованием определяют насыщение артериальной крови кислородом, ЧСС и ритм сердца. Пациента укладывают в высокое положение Фаулера.
• Пациента (или родителей ребенка) предупреждают, что результат посева будет готов не скоро.
• Следует сообщить врачу сведения о приеме пациентом противомикробных препаратов; при необходимости врач может отменить их.
Оборудование. Водорастворимый гель для смазывания назогастрального зонда, стерильная вода, пластиковый назогастральный зонд для одноразового использования 16F или 18F, 50- миллилитровый стерильный шприц, стерильный контейнер для хранения материала, стерильные перчатки, таз на случай рвоты, фонендоскоп, зажим.
Процедура и последующий уход
• Исследование проводят сразу, как только пациент проснулся. Надевают перчатки, вводят назогастральный зонд и получают смыв из желудка.
• Зонд пережимают и быстро извлекают из желудка.
• На бланке направления указывают характер материала и время его взятия, а также сведения о получаемой пациентом противомикробной терапии.
• Контейнер маркируют с указанием фамилий пациента и врача, а также номера палаты.
• После исследования пациент может перейти на обычный для него режим питания и возобновить прием препаратов, если они были отменены.
• Пациента просят не сморкаться в течение 4 ч во избежание носового кровотечения.
Меры предосторожности
• Введение назогастрального зонда противопоказано беременным, а также при заболеваниях пищевода (варикозное расширение вен, дивертикул), злокачественных опухолях, недавнем профузном желудочном кровотечении, аневризме аорты, сердечной недостаточности, инфаркте миокарда.
• Исследование следует выполнить во возможности до начала противомикробной терапии.
• Следует помнить об опасности попадания назогастрального зонда в трахею, на которое указывают появление цианоза, уменьшение насыщения артериальной крови кислородом и признаки удушья.
Предостережение. Не следует вливать воду через назогастральный зонд, не убедившись, что он находится в желудке. Лаваж желудка выполняют стерильной водой во избежание загрязнения смыва сапрофитными микобактериями.
• При введении назогастрального зонда необходимо следить за ритмом сердца, а при появлении признаков гипоксии принять срочные меры.
• Взятие материала и его отправку осуществляют в перчатках.
• Материал хранят в герметичном контейнере, который про-
тирают снаружи дезинфицирующим раствором и помещают в пластиковый пакет.
• Материал следует отправить в лабораторию сразу после взятия.
• После взятия материала использованные принадлежности выбрасывают или обрабатывают согласно инструкции во избежание инфицирования персонала.
Нормальная картина. В норме при посеве желудочного содержимого патогенные микобактерии не выявляют. Отклонение от нормы. Выявление и изолирование M. tuber-culosis указывают на активный туберкулезный процесс. Возбудителями легочной инфекции, неотличимой клинически от туберкулеза, могут быть также другие виды микобактерий (M. bovis, M. kansasii, M. avium). Такая инфекция трудно поддается лечению и требует определения чувствительности возбудителя к антибиотикам. С помощью посева желудочного содержимого можно также идентифицировать возбудитель сепсиса у новорожденных.
Факторы, влияющие на результат исследования
• Прием пищи незадолго до исследования.
• Прием антибиотиков тетрациклинового ряда и аминогликозидов (возможны ложноотрицательные результаты).
• Присутствие сапрофитных микобактерий в желудочном содержимом, которые трудно отличить при микроскопическом исследовании от патогенных микобактерий (ложноположительный результат исследования мазков по ЦилюНильсену).
ПОСЕВ СОДЕРЖИМОГО
ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ
Для проведения исследования в двенадцатиперстную кишку вводят дуоденальный зонд, аспирируют содержимое двенадцатиперстной кишки и переносят его на питательную среду. Посев позволяет изолировать пагенные микроорганизмы, которые могут быть причиной дуоденита, холецистита или холангита. Иногда материал берут во время хирургического вмешательства.
Цель
• Выявить возбудитель инфекции двенадцатиперстной кишки и желчных путей.
• Отдифференцировать инфекцию желчных путей от неосложненной желчнокаменной болезни.
• Исключить роль инфекции как причину поражения ЖКТ (боль в эпигастральной области, тошнота, рвота, понос).
Подготовка
• Следует объяснить пациенту, что исследование выполняют для выяснения причины его заболевания.
• Пациенту следует воздержаться от приема пищи и жидкости в течение 12 ч до исследования.
• Следует сообщить пациенту, кто и где будет проводить исследование.
• Следует объяснить пациенту суть процедуры и заверить его, что она неопасна, хотя и может вызвать у него неприятные ощущения. Следует предупредить пациента, что введение зонда может вызвать у него рвотный рефлекс, но если следовать инструкциям врача, то он быстро проходит и слабо выражен.
• Перед исследованием пациента просят помочиться.
Оборудование. Перчатки, двухпросветный назоэнтеральный зонд с оливой на конце, водорастворимый гель, 30-миллилит- ровый стерильный шприц, таз на случай рвоты, стерильный контейнер для хранения материала, лейкопластырь.
Процедура и последующий уход
• После введения назоэнтерального зонда пациента укладывают на левый бок, под ноги подкладывают валик. Такое положение способствует продвижению зонда в двенадцатиперстную кишку.
• Для того чтобы удостовериться в правильном положении зонда, аспирируют небольшое количество содержимого и определяют его pH. Если зонд находится в желудке, pH бывает меньше 7,0, при нахождении зонда в двенадцатиперстной кишке pH превышает 7,0.
• Положение зонда можно проконтролировать также рентгеноскопически.
• Аспирируют содержимое двенадцатиперстной кишки.
• Иногда материал на посев берут во время дуоденоскопии (см. главу 10. Эзофагогастродуоденоскопия).
• Материал переносят в стерильный контейнер и маркируют с указанием фамилий пациента и врача, а также даты и времени взятия.
• После исследования за пациентом наблюдают, проявляя особую настороженность к симптомам перфорации, таким, как дисфагия, боль в эпигастральной области и плече, одышка, повышение температуры тела.
• После дуоденоскопии определяют основные физиологичес-
кие показатели до стабилизации состояния пациента.
• Пациент должен оставаться в постели до полного восстановления сознания, борта кровати при этом должны быть подняты.
• После исследования пациент может вновь перейти на обычные для него диету и режим питания.
Меры предосторожности
• Взятие и отправку материала следует осуществлять в перчатках.
• Введение дуоденального зонда противопоказано беременным, а также при остром панкреатите и холецистите, варикозном расширении вен пищевода и его стенозе, дивертикуле и раке пищевода, недавнем профузном желудочном кровотечении, аневризме аорты, сердечной недостаточности, инфаркте миокарда.
• Материал желательно брать до начала противомикробной терапии.
• Зонд следует удалять медленно (на 15,5-20,5 см каждые 10 мин), пока он не достигнет пищевода, затем пережать его и быстро извлечь. Если зонд поддается с трудом, не следует форсировать его извлечение.
Нормальная картина. В норме в содержимом двенадцатипер-
стной кишки обнаруживают небольшое количество полиморфно-ядерных лейкоцитов и эпителиальных клеток, патогенные микроорганизмы отсутствуют. Количество бактерий обычно не превышает 100 000 в 1 мл дуоденального содержимого. Отклонение от нормы. Обычно наличие патогенных микроорганизмов или более 100 000 бактерий в 1 мл указывает на инфекцию. В этих случаях определяют чувствительность возбудителей к антибиотикам.
Большое количество полиморфно-ядерных лейкоцитов, слизи и окрашенных желчью эпителиальных клеток свидетельствует о воспалении желчных путей, значительное количество сегментоядерных лейкоцитов и слущенного эпителия указывает на воспаление поджелудочной железы, двенадцатиперстной кишки или желчных путей. Наличие желчной замазки является признаком желчнокаменной болезни. Для дифференциальной диагностики необходимо дальнейшее обследование.
Факторы, влияющие на результат исследования
• Прием пищи перед исследованием.
• Неправильная техника взятия материала.