Клиническая фармакокинетика: теоретические, прикладные и аналитические аспекты: руководство / Под ред. В.Г. Кукеса. - 2009. - 432 с
|
|
|
|
ГЛАВА 7 ОСОБЕННОСТИ ФАРМАКОКИНЕТИКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ У ДЕТЕЙ
В.Г. Кукес, Д.А. Сычёв
Более 100 лет назад доктор Абрахам Якоби, «отец» современной американской педиатрии, подчеркивая необходимость особого подхода к фармакотерапии у детей, писал: «Педиатрия имеет дело не с "маленькими" мужчинами и женщинами, для которых требуется "механическое" снижение дозы». И действительно, фармакологический ответ у детей может значительно отличаться от взрослых, прежде всего, из-за «незрелости» систем распределения, метаболизма и выведения ЛС. Именно поэтому возрастные изменения фармакокинетических процессов оказывают значительное влияние на чувствительность к ЛС, что необходимо учитывать как при выборе самого препарата, так и при режиме его дозирования.
В педиатрической практике существовали подходы к разработке режимов дозирования ЛС на основе антропометрических характеристик ребёнка. Однако развитие ребёнка - нелинейный процесс; морфологические и функциональные изменения организма могут идти непараллельно, особенно во время первого десятилетия жизни,
поэтому упрощённые подходы к расчёту режимов дозирования ЛС не адекватны для детей различных возрастов. Для проведения эффективной и безопасной фармакотерапии у детей необходимо фундаментальное понимание возрастных аспектов фармакокинетики ЛС.
7.1. ОСОБЕННОСТИ ВСАСЫВАНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ У ДЕТЕЙ
Существует множество способов применения ЛС у детей. Наиболее распространены внесосудистые пути введения, когда препарат преодолевает химические, физические, механические и биологические барьеры. На скорость и полноту всасывания ЛС могут оказывать влияние различные возрастные особенности ребёнка.
При применении внутрь ЛС изменения внутрипросветной рН в различных отделах пищеварительного тракта могут оказывать влияние как на стабильность, так и на степень ионизации ЛС. У ново- рождённых величина внутрижелудочного рН повышена (более 4,0), прежде всего, из-за снижения базальной секреции соляной кислоты, поэтому применение в рот кислотонеустойчивых ЛС (бензилпенициллин) приводит к большей биодоступности у новорождённых, чем у детей младшего и более старшего возраста. И наоборот, для ЛС - слабых кислот (фенобарбитал), у детей младшего возраста могут потребоваться более высокие дозы для достижения терапевтической концентрации в плазме крови. На способность к растворению и последующему всасыванию липофильных ЛС влияют также возрастные особенности состава жёлчи. У детей отмечают «незрелость» процессов конъюгации и транспорта жёлчных солей в просвет кишечника, что приводит к более низкому их содержанию, по сравнению с взрослыми пациентами.
Опорожнение желудка и перистальтики кишечника - основные детерминанты процесса контактирования ЛС с поверхностью слизистой оболочки тонкой кишки. При рождении происходит усиление сокращений антрального отдела желудка, что приводит к ускорению опорожнения органа в течение первой недели жизни. Двигательная активность кишечника также «созревает» на протяжении раннего периода детства, при этом увеличивается частота, амплитуда и продолжительность сокращений. К сожалению, проведено ограниченное количество исследований, посвящённых влиянию данных изменений на всасывание ЛС у детей. Несколько подобных исследований с
дигоксином и фенобарбиталом свидетельствуют о том, что процессы как пассивного, так и активного транспорта полностью «созревают» примерно к четвёртому месяцу жизни.
Итак, скорость всасывания большинства ЛС замедлена у ново- рождённых, по сравнению с детьми более старшего возраста, а время достижения максимальной концентрации ЛС наиболее длительно у детей самого раннего возраста. Ряд других возрастных особенностей детей могут значительно влиять на всасывание ЛС. Хотя площадь поверхности кишечника снижена в первые месяцы жизни, средняя длина кишечника в процентном отношении к значениям у взрослых превышает другие антропометрические показатели. Образование ворсинок начинается на 8-й неделе гестационного срока и заканчивается к 20-й неделе, делая маловероятным, что сокращение площади поверхности тонкой кишки вносит вклад в сниженное всасывание. Более того, возрастные изменения в висцеральном кровотоке во время первых 2-3 нед жизни могут влиять на скорость всасывания.
Возрастные различия активности ферментов клеток слизистой оболочки кишечника, участвующих в метаболизме ЛС, а также специфических транспортёров, которые могут значительно изменить биодоступность ЛС, изучены недостаточно. Исследования биопсийных образцов двенадцатиперстной и тонкой кишки новорождённых и детей младшего школьного возраста свидетельствует о том, что активность эпоксидгидролазы и глютатионпероксидазы характеризуется незначительной зависимостью от возраста, в то время как кишечная активность изофермента цитохрома P-450 1А1 (CYP1A1) увеличивается с возрастом. И наоборот, результаты биопсии дистального отдела двенадцатиперстной кишки говорят о том, что активность глутатион- S-трансферазы снижается с раннего детского возраста на протяжении подросткового возраста, что было продемонстрировано по снижению биотрансформации, являющегося субстратом для данного фермента. Нет данных о возрастной экспрессии транспортера ЛС гликопротеина-Р (также известного как MDR1) в кишечнике человека. Об особенностях кишечной микрофлоры у новорождённых свидетельствует и тот факт, что выделение с мочой метаболитов дигоксина, образующихся в кишечнике под действием бактериальных ферментов, значительно снижено.
При других путях введения возраст пациента также может изменять действие ЛС. Усиленное всасывания ЛС через кожу у новорож- дённых можно частично объяснить наличием более тонкого рогового слоя, а также более высокой степенью кожной перфузии и гидратации
эпидермиса (по сравнению со взрослыми). Таким образом, системное действие ЛС при их местном применении у детей выражено больше, чем у взрослых.
Сниженный кровоток в мышцах и недостаточная сократительная способность мышц, в которые осуществляются инъекции, могут уменьшать скорость всасывания ЛС у новорождённых при их внутримышечном применении. Однако влияние этих факторов на биодоступность ЛС может быть компенсировано сравнительно более высокой плотностью мышечных капилляров у детей старшего возраста. Именно поэтому внутримышечное всасывание таких ЛС, как амикацин и цефалотин, более эффективно у новорождённых и детей первого года жизни, по сравнению с детьми старшего возраста.
Биодоступность ЛС, вводимых ректально, может быть усилена у новорождённых и детей первого года жизни. Однако у детей младшего возраста отмечают более высокое количество высокоамплитудных пульсирующих сокращений в прямой кишке, чем у взрослых, что может вызвать «изгнание» твёрдых форм ЛС. Это продемонстрировано для суппозиториев с эритромицином и парацетамолом.
7.2. ОСОБЕННОСТИ РАСПРЕДЕЛЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ У ДЕТЕЙ
Возрастные изменения состава организма изменяют «физиологические пространства», в которые ЛС может попадать при распределении. Сравнительно большие по размеру внеклеточные пространства и количество межклеточной жидкости у новорождённых и детей младшего возраста, по сравнению со взрослыми, приводят к более низким концентрациям ЛС в плазме крови, когда режим дозирования ЛС проводят на кг веса. Следует отметить, что влияние возраста на объём распределения липофильных ЛС незначительно.
Изменения состава и количества циркулирующих в плазме крови белков, таких, как альбумин и а1-кислый гликопротеин могут также влиять на распределение ряда ЛС. Низкий уровень белков в плазме крови (включая альбумин) у новорождённых и детей младшего возраста вызывает увеличение «свободной» фракции препарата, которая и обладает фармакологической активностью. Наличие фетального альбумина (обладает пониженным сродством к ЛС-слабым кислотам) и увеличение содержания эндогенных соединений (билирубин, свободные жирные кислоты), способных вытеснить ЛС из мест связы-
вания у новорождённых, может также вносить определённый вклад в формирование более высоких уровней «свободной» фракции ЛС.
Хотя большая часть ЛС проникает в ткани из крови путём пассивной диффузии по градиенту концентрации, функционирование специфических транспортёров может вносить вклад в проникновение некоторых ЛС к молекулам-мишеням. Одним из таких транспортёров является уже упомянутый гликопротеин-Р, принадлежащий к так называемому АТФ-связывающему кассетному семейству переносчиков, которое функционирует в качестве насоса, способного «выкачивать» ЛС (как и другие ксенобиотики) из клеток. Гликопротеин-Р эндотелиоцитов гематоэнцефалического барьера препятствует проникновению ЛС в ЦНС, выкачивая их из эндотелиоцитов в просвет сосуда. Получены ограниченные данные о возрастных особенностях экспрессии гликопротеина-Р у человека. Единственное исследование экспрессии гликопротеина-Р в ЦНС, полученного при вскрытии погибших новорождённых, появившихся на свет в срок от 23 до 42 нед гестационного возраста, говорит о сходной с таковой у взрослых локализации гликопротеина-Р, однако уровень экспрессии оказался ниже.
Результаты небольших исследований свидетельствуют о том, что у новорождённых пассивная диффузия ЛС в ЦНС носит зависимый от возраста характер. Это подтверждается увеличением соотношения содержания фенобарбитала в головном мозге и плазме крови в срок от 28 до 39 нед гестационного возраста, отражая увеличение транспорта фенобарбитала в ЦНС. Хотя эксперименатальные исследования говорят о том, что наблюдаемые изменения кровотока в головном мозге и плотности пор (а не размер пор) гематоэнцефалического барьера играют определённую роль в увеличении проницаемости ЛС в ЦНС у новорождённых и детей младшего возраста.
7.3. ОСОБЕННОСТИ БИОТРАНСФОРМАЦИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ У ДЕТЕЙ
Незрелость системы метаболизма (биотрансформации) ЛС может отвечать за возникновение нежелательных лекарственных реакций у детей младшего возраста. При этом наиболее ярким примером является развитие сосудистого коллапса, ассоциированного с «серым» синдромом у новорождённых, при применении хлорамфеникола. Возрастные особенности системы биотрансформации ЛС обуславливают необходимость тщательного подбора режимов дозирования
широко используемых у новорождённых и детей младшего возраста ЛС, таких, как метилксантины, пенициллины, цефалоспорины третьего поколения, каптоприл и морфин. Возрастные особенности ферментов I фазы биотрансформации значительно отличаются от особенностей ферментов II фазы.
Экспрессия ферментов I фазы биотрансформации ЛС, таких, как изоферменты цитохрома Р-450 (CYP), заметно меняется в процессе развития ребёнка (табл. 7-1). CYP3А7 - преобладающий изофермент CYP в печени плода и может защищать плод путём детоксикации таких соединений, как дегидроэпиандростерона сульфата и потенциально тератогенных производных ретиноевой кислоты. Экспрессия CYP3А7 достигает максимального значения вскоре после рождения и затем постепенно снижается до очень низких уровней, невыявляемых у большинства взрослых. В течение нескольких часов после рождения активность CYP2E1 значительно возрастает. Активность CYP2D6 можно обнаружить также после рождения, активность CYP3А4 и CYP2C (CYP2C9 и CYP2Cl9) - в течение первой недели жизни, активность CYP1A2 - лишь в течение трёх месяцев жизни.
Таблица 7-1. Активность ферментов I фазы биотрансформации лекарственных средств в печени
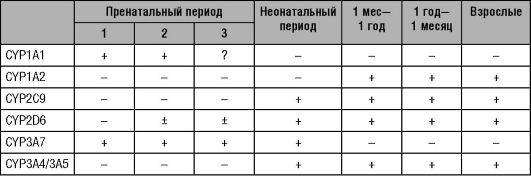 «+» - обнаружена активность; «±» - обнаружена низкая активность; «-» - активность не обнаружена; «?» - нет данных.
«+» - обнаружена активность; «±» - обнаружена низкая активность; «-» - активность не обнаружена; «?» - нет данных.
Информацию по «возрастной» динамике метаболизма ЛС можно также получить по фармакокинетическим исследованиям ЛС, метаболизирующихся определёнными изоферментами CYP у детей различного возраста. CYP2С9 и в меньшей степени CYP2C19 несут основную ответственность за биотрансформацию фенитоина. У недоношенных новорождённых отмечается удлиненный период полувыведения фени-
тоина (примерно до 75 ч), но и он укорачивается примерно до 20 ч у доношенных младенцев в течение первой недели жизни и приблизительно до 8 ч по истечении второй недели жизни. Максимальная скорость выведения фенитоина (которая отражает степень активности CYP2С9) снижается со среднего значения, равного 14 мг/кг в сутки у детей первого года жизни, до 8 мг/кг в сутки у подростков, что вызывает значительные возрастные различия в подборе суточной дозы препарата.
Кофеин и теофиллин (субстраты CYP1A2) - наиболее часто назначаемые препараты новорождённым и детям раннего возраста. У детей старше 4 мес выведение кофеина из плазмы крови главным образом отражает активность деметилирования, опосредованного CYP1A2, и приближается к этому времени к значениям у взрослых. Что касается теофиллина, то к 6 мес (как показано по выведению теофиллина из плазмы крови) скорость может превышать значения у взрослых. Далее, скорость деметилирования кофеина у девушек-подростков (стадия Таннера 2) снижается до уровня ниже, чем у взрослых, в то время как у юношей-подростков это происходит в стадии 4 и 5 Таннера, демонстрируя половые различия онтогенеза CYP1A2.
Онтогенез реакций II фазы биотрансформации изучен гораздо хуже, чем онтогенез реакций I фазы. Результаты небольшого количества исследований указывают на то, что индивидуальные изоферменты глюкуронизилтрансферазы (UGT) обладают уникальными профилями созревания, что приводит к соответствующим фармакокинетическим последствиями. Например, глюкуронизация парацетамола (субстрата для UGT1A6 и в меньшей степени - для UGT1A9) у ново- рождённых и детей раннего возраста ниже, чем у подростков и взрослых. Глюкоронизацию морфина (субстрата UGT2B7) можно выявить у недоношенных младенцев в гестационном возрасте - 24 нед.
Феномен более интенсивной элиминации ряда ЛС у детей младше 10 лет постоянно наблюдают при проведении клинических исследованиях ЛС, метаболизирующихся в печени. Существование этого феномена диктует необходимость применения более высоких доз в пере- расчёте на массу тела. Механизмы, лежащие в основе этого явления, в большинстве своём не известны. В единственном небольшом экспериментальном исследовании in vitro не удалось выявить возрастных различий экспрессии изоферментов цитохрома Р-450 печенью. Однако в исследовании S-варфарина (субстрата CYP2С9) было подтверждено, что выведение перорально принятого S-варфарина было достоверно выше у детей препубертатного возраста, чем у детей пубертатного возраста или взрослых после внесения поправок на массу тела или пло-
щадь поверхности тела, но без учёта веса печени. Однако элиминация антипирина, которая зависит от нескольких изоферментов цитохрома Р-450, достоверно коррелирует с возрастом, даже после поправок на вес печени. Следовательно, маловероятно, что более интенсивная элиминация ЛС у новорождённых и детей раннего возраста можно приписать исключительно диспропорциональному увеличению массы печени, учитывая, что вес печени в процентном отношении к общей массе тела достигает максимального значения в возрасте между 1-м и 3-м годами жизни и к подростковому возрасту снижается до значений у взрослых. Это утверждение относится особенно к ЛС, метаболизирующихся ферментами со значительной внепечёночной экспрессией (например, CYP3А4, CYP3A5 и изоферменты UGT).
7.4. ОСОБЕННОСТИ ВЫВЕДЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ У ДЕТЕЙ
Возрастное увеличение скорости клубочковой фильтрации зависит от нормального нефрогенеза - процесса, который начинается в 9 нед гестационного срока и завершается к возрасту 36 нед гестации с последующими постнатальными изменениями почечного и внутрипочечного кровотока. Скорость клубочковой фильтрации у доношеных новорож- дённых составляет 2-4 мл/мин на 1,73 м2, но может быть очень низкой, составляя всего 0,6-0,8 мл/мин на 1,73 м2 у недоношенных. При этом скорость клубочковой фильтрации быстро увеличивается в течение первых двух недель жизни и затем постоянно увеличивается, достигая к первому году жизни уровня взрослых. Канальцевая секреция также незрелая при рождении и достигает значений у взрослых в течение первого года жизни. В настоящее время стало известно, что канальцевую секрецию осуществляют специализированные транспортёры органических анионов (ОАТР-С, ОАТ-1, ОАТ-3 и т.д.) и катионов (ОСТ-1), а также уже упоминавшийся гликопротеин-Р. Однако отсутствуют данные о том, как происходит созревание данных транспортёров.
Описанные выше онтогенетические изменения функций почек могут в значительной степени изменять выведение ЛС и быть одним из определяющих факторов выбора режима дозирования у детей с учё- том возраста. В фармакокинетических исследованиях таких ЛС, как цефтазидим и фамотидин, которые выводятся преимущественно путём клубочковой фильтрации, была найдена сильная корреляция между выведением данных ЛС и нормальными возрастными изменениями
функций почек. Например, тобрамицин выводится преимущественно посредством клубочковой фильтрации, при этом требуется, чтобы интервалы между введениями составляли от 36 до 48 ч у недоношенных новорождённых и до 24 ч у доношенных. Применение аминогликозидов у детей без учёта возрастных изменений функций почек может приводить к тяжёлым нежелательным лекарственным реакциям. Более того, одновременное введение бетаметазона и индометацина может вызвать поражение почек у новорождённых. Именно поэтому при назначении ЛС, выводимых преимущественно почками, педиатры должны подбирать индивидуальные схемы лечения, принимая во внимание возрастные и связанные с лечением изменения функции почек.
7.5. СХЕМЫ НАЗНАЧЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЕТЯМ
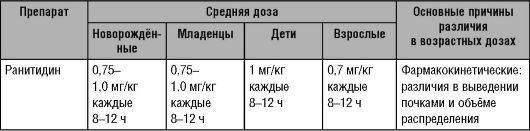
Современные пробелы в наших знаниях (например, отсутствие полных данных о возрастной динамике экспрессии ферментов биотрансформации и транспортёров ЛС) препятствуют использованию простых лекарственных «анропометрических» подходов к выбору режимов дозирования ЛС у детей младшего возраста. Однако такие подходы могут иметь важное клиническое значение у детей старше восьми лет и у подростков, у которых функции органов приближены к таковым у взрослых. Примеры схем лечения и доз для наиболее часто применяемых ЛС в педиатрии с учётом возрастных различий в фармакокинетике и фармакодинамике ЛС приведены в табл. 7-2. Представленные схемы применения ЛС, выбранные в качестве примеров, были взяты из широко используемого руководства по педиатрической фармакологии, которое вместе с другими общепризнанными рекомендациями представляет современные подходы к выбору режимов дозирования ЛС у детей.
Значительный прогресс в педиатрической клинической фармаколо - гии за последние 10 лет был достигнут благодаря пониманию влияния возрастных изменений на фармакокинетику ЛС. Совершенствованию фармакотерапии у детей будет также способствовать возрастающий объём клинических исследований с участием детей, что стало возможным с принятием нескольких регуляторных документов, принятых в последние годы. Изучение онтогенеза ферментов биотрансформации, транспортёров ЛС, а также молекул-мишеней (рецепторов, ферментов, ионных каналов и др.) позволют пролить свет на особенности
фармакокинетики и фармакодинамики ЛС у детей. Таким образом, в настоящее время есть все предпосылки для дальнейшего совершенствования фармакотерапии у детей.
Таблица 7-2. Режимы дозирования некоторых лекарственных средств у детей и взрослых
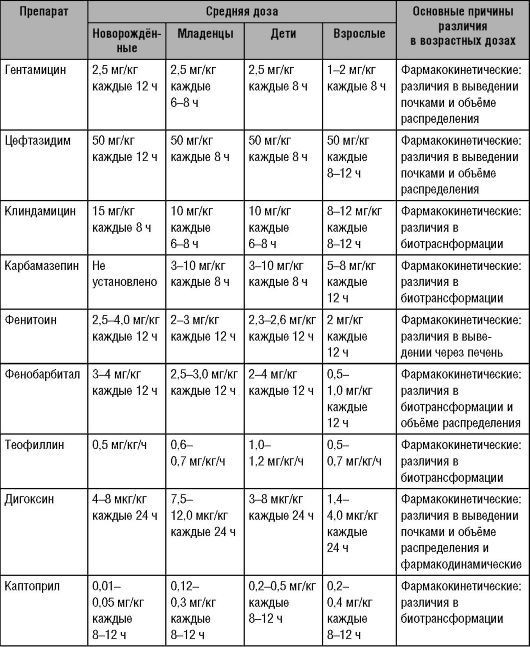 Окончание таблицы 7-2
Окончание таблицы 7-2
 Литература
Литература
Kearns G.L. Impact of developmental pharmacology on pediatric study design: overcoming the challenges // J. Allergy Clin. Immunol. - 2000. - Vol. 106, suppl. - S128-S138.
Tsai C., Ahdab-Barmada M., Daood M.J., Watchko J.F. P-glycoprotein expression in the developing human central nervous system: cellular and tissue localization // Pediatr. Res. - 2001. - Vol. 47, suppl. - P. 436A. abstract.
McCarver D.G., Hines R.N. The ontogeny of human drug metabolizing enzymes: phase II conjugation enzymes and regulatory mechanisms // J. Pharmacol. Exp. Ther. - 2002. - Vol. 300. - P. 361-366.
Chen H., Fantel A.G., Juchau M.R. Catalysis of the 4-hydroxylation of retinoic acids by CYP3A7 in human fetal hepatic tissues // Drug Metab. Dispos. - 2000. - Vol. 28. - P. 1051-1057.
Blanco J.G., Harrison P.L., Evans W.E., Relling M.V. Human cytochrome P450 maximal activities in pediatric versus adult liver // Drug Metab.
Dispos. - 2000. - Vol. 28. - P. 379-382.
Takahashi H., Ishikawa S., Nomoto S. et al. Developmental changes in pharmacokinetics and pharmacodynamics of warfarin enantiomers in Japanese
children // Clin. Pharmacol. Ther. - 2000. - Vol. 68. - P. 541-555.
Alcorn J., McNamara P.J. Ontogeny of hepatic and renal systemic clearance pathways in infants // Clin. Pharmacokinet. - 2002. - Vol. 41. -
P. 1077-1094.
Taketomo C.K., Hodding J.H., Kraus D.M. Pediatric Dosage Handbook. - 6th ed. - Hudson, Ohio: Lexi-Comp, 2000.
Steinbrook R. Testing medications in children // N. Engl. J. Med. -
2002. - Vol. 347. - P. 1462-1470.