Клиническая фармакокинетика: теоретические, прикладные и аналитические аспекты: руководство / Под ред. В.Г. Кукеса. - 2009. - 432 с
|
|
|
|
ГЛАВА 11 ВЛИЯНИЕ КАЧЕСТВА СУБСТАНЦИЙ НА ФАРМАКОКИНЕТИКУ ЛЕКАРСТВЕННЫХ СРЕДСТВ
И.Г. Смирнова, В.В. Чистяков
11.1. ВЗАИМОСВЯЗЬ МЕЖДУ ОПТИЧЕСКОЙ
ИЗОМЕРИЕЙ И ФАРМАКОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Введение
В основе всех биологических процессов (взаимообусловленности, высокой эффективности, строгой избирательности) лежит тонкое структурное соответствие взаимодействующих молекул, определяемое, прежде всего, спецификой пространственной организации молекул.
Стереоспецифичность - характерная особенность большинства биомолекул, играющая исключительно важную роль во многих биохимических процессах (например, при взаимодействии каталитических центров ферментов с субстратами). Для обеспечения биологических функций молекулы фермента и субстрата должны быть комплементарны, т.е. их структуры должны точно соответствовать друг другу. Строгая комплементарность необходима для связывания молекулы гормона с его рецептором на поверхности клетки, для
репликации ДНК и многих других процессов, протекающих в клетке (Ленинджер А. и соавт., 1993).
Молекулы биологически активных веществ соединяются со специфическими рецепторами - участками клеточных мембран, содержащими сложные органические молекулы, чувствительные к определённым веществам. Каждый рецептор обладает характерной пространственной структурой участка, взаимодействующего с биологически активным веществом, и их структуры должны соответствовать друг другу по принципу «ключ-замок». Кроме того, для большинства препаратов характерна тесная взаимосвязь между пространственной структурой и фармакологической активностью, т.е. стереоспецифичность действия.
Многие синтетические препараты существуют в виде двух или нескольких пространственных изомеров. Фармакологическая активность рацемических ЛС обычно связана с действием лишь одного энантиомера. Второй или обладает менее выраженной активностью, или совсем не активен, или обнаруживает другие фармакологические эффекты. Известны примеры использования в терапевтической практике рацематов, когда один из стереоизомеров лекарственного вещества обладал сильным токсическим эффектом, что приводило к трагическим случаям. Например, левовращающий изомер талидомидар - мощный транквилизатор, а присутствующий в смеси в равных количествах правовращающий изомер обладает тератогенным действием, т.е. приводит к развитию уродств у новорождённых. В некоторых случаях количественные различия в биологической активности двух энантиомеров одного и того же соединения выражены очень значительно. Например, действие D-изомера изопротеренолаp (препарат, применяемый при лёгких приступах астмы) в качестве бронхорасширяющего средства в 50-70 раз сильнее, чем L-изомера (Ленинджер A. и соавт., 1993). Распознавание стереоизомеров вещества, вводимого в организм, можно осуществлять на разных стадиях: при связывании с ферментами и рецепторами, при транспортировке через мембраны, в процессе поглощения в клетках и распределения между тканями. Все эти процессы изучает фармакокинетика.
Изучение фармакокинетических особенностей отдельных изомеров лекарственных веществ открывает перспективное направление совершенствования уже известных ЛС. Лишь 15% синтетических препаратов на европейских рынках производят в виде отдельных стереоизомеров, остальные 85% представляют собой смеси изомеров.
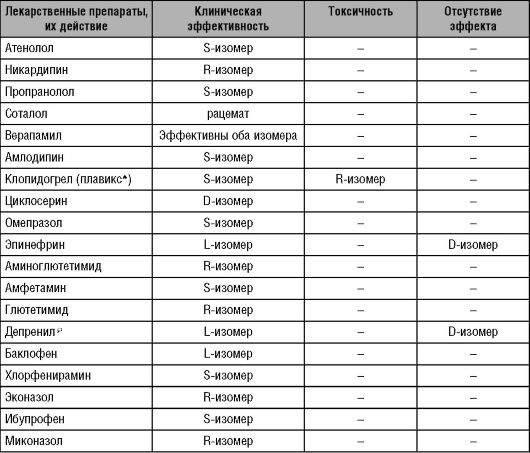
В то же время современные методы позволяют получать в чистом виде отдельные изомеры и выбирать те из них, которые обладают наиболее выраженными эффектами и (или) наименьшей токсичностью (табл. 11-1).
Таблица 11-1. Клиническая эффективность изомеров лекарственных препаратов
 Оптическая активность
Оптическая активность
Оптическая активность молекул связана с отсутствием у них опре- делённого элемента симметрии. Например, оптическая активность соединения возрастает при расположении его хромофора (карбонильная группа, ароматический заместитель и др.) рядом с асимметричным атомом углерода.
Во всех случаях, когда в молекуле органического соединения атом углерода связан с четырьмя разными атомами или функциональными группами, говорят, что этот атом асимметричен, так как может существовать в двух изомерных формах с различной пространственной конфигурацией, называемых «энантиомеры». Они связаны друг с другом как предмет и его зеркальное отражение, несовместимое с ним. Энантиомеры (оптические изомеры или стереоизомеры) в химических реакциях ведут себя одинаково, но различаются по весьма характерному физическому свойству - способности вращать плоскость плоскополяризованного света. Угол вращения плоскости поляризации для обоих изомеров одинаков, но направление вращения противоположно. Если один изомер вращает плоскость поляризации вправо, то второй (при равной толщине слоя и одинаковой концентрации исследуемого вещества) вращает её на такой же угол влево (Ленинджер A. и соавт., 1993).
Аминокислота аланин (рис. 11-1) представляет собой асимметричную молекулу, поскольку её центральный атом углерода имеет четыре различных заместителя: метильную группу, аминогруппу, карбоксильную группу и атом водорода. Два энантиомера аланина в структурном отношении отличны друг от друга как левая и правая рука, которые несовместимы в пространстве. Существуют две формы соединений с асимметрическими атомами углерода, которые можно
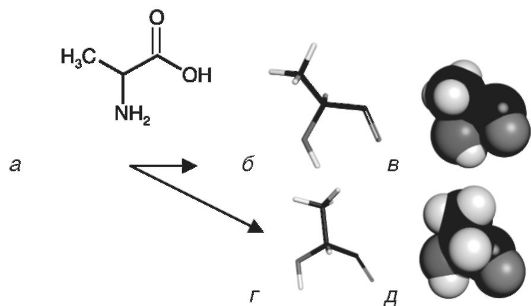 Рис. 11-1. Модели, показывающие строение аминокислоты аланина: а - структурная формула аланина; б, в - модели из стержней, показывающие ковалентный скелет молекул L- и D-аланина; г, д - пространственные модели L- и D-аланина
Рис. 11-1. Модели, показывающие строение аминокислоты аланина: а - структурная формула аланина; б, в - модели из стержней, показывающие ковалентный скелет молекул L- и D-аланина; г, д - пространственные модели L- и D-аланина
рассматривать как левые и правые; их называют «хиральных» (греч. chiros - рука). Центральный (асимметрический) атом хиральных соединений называют «хиральный атом» («хиральный центр»). Две разные хиральные формы аланина называют «D-аланин» и «L-ала- нин». Смесь равного числа молекул обоих энантиомеров называют «рацемат». Суммарное оптическое вращение такой смеси равно нулю. Разделить две хиральные формы в такой смеси можно лишь при помощи специальных методов, которые будут рассмотрены далее.
Стереохимические формулы
Условный способ обозначения конфигурационных взаимоотношений, принятый в настоящее время, был впервые предложен Э. Фишером (1891), несколько видоизменён Розановым (1906) и подробно изучен Хадсоном (1949).
В качестве относительного стандарта был избран правовращающий глицериновый альдегид HOCH2-CH(OH)-CHO, которому была произвольно приписана конфигурация (рис. 11-2), изображённая при помощи перспективной тетраэдрической модели (а) и эквивалентной ей симметрично ориентированной модели (б).
В обоих случаях сплошная линия, соединяющая H и OH, представляет собой ребро тетраэдра, расположенное над плоскостью чертежа, а пунктирная линия между CHO и CH2OH изображает то ребро, которого не видно в непрозрачной механической модели. Для удобства написания Фишер предложил использовать вместо трёхмерных моделей их плоские проекции, для построения которых он установил следующие правила: сначала модель ориентируют таким образом, чтобы углеродная цепь была расположена вертикально в задней части тетраэдра, а заместители (H и OH) - в его передней части. Затем модель мысленно сплющивают, в результате чего все группы лежат в плоскости чертежа в том же порядке, в каком находились в модели (в). Следует помнить, что проекционная формула (в) соответствует настоящей модели (H и OH выступают вперёд); её можно поворачивать в плоскости чертежа, но нельзя мысленно вывести из этой плоскости и перевернуть. Если углеродная цепь содержит два или более асимметрических атома углерода, связанных друг с другом, то проекционную формулу строят аналогичным образом, исходя из модели, в которой CHO или эквивалентная ей группа расположена вверху; CH2OH или группа, заменяющая её, - внизу; углеродная цепь ориентирована вертикально и изогнута от наблюдателя, а H- и OH-группы выступают вперёд.
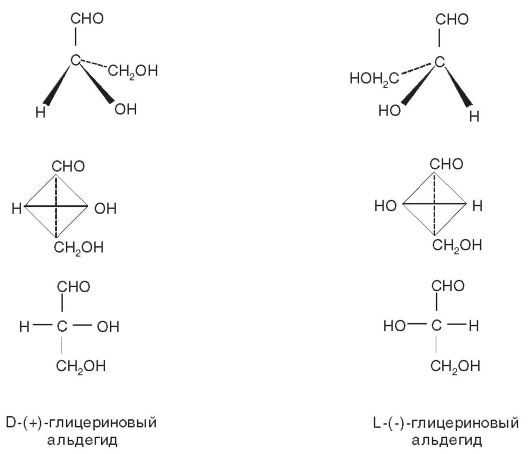 Рис. 11-2. Конфигурационные, схематизированные конфигурационные и проекционные формулы глицеринового альдегида
Рис. 11-2. Конфигурационные, схематизированные конфигурационные и проекционные формулы глицеринового альдегида
Конфигурацию правовращающего глицеринового альдегида обозначают латинской буквой D, а противоположную конфигурацию - L. С этих позиций глицериновый альдегид, изображённый выше, можно назвать D-глицериновым альдегидом или, более полно, D-(d)-глицериновым альдегидом, причем D обозначает конфигурацию, а (d) - правое вращение. То же самое можно выразить при помощи названия «D-(+)-глицериновый альдегид», которое более понятно и предпочтительнее предыдущего.
Все соединения, для которых экспериментально установлена сходная конфигурация асимметрического центра, принадлежат к D-ряду.
D-глицериновый альдегид был избран в качестве относительного стандарта, так как он - простейший член ряда сахаров и соответствует по своей конфигурации одному из четырёх асимметрических атомов углерода глюкозы.
Решение Фишера приписать природному (+)-глицериновому альдегиду D-конфигурацию было произвольным. Только через шестьдесят лет, когда был разработан метод рентгеноструктурного анализа, удалось установить, что соединения D-ряда, действительно, обладают приписанной им конфигурацией. Выбор, сделанный Фишером, оказался правильным и, таким образом, конфигурации, установленные для D-глицеринового альдегида, теперь считают абсолютными конфигурациями.
Более систематический способ обозначения конфигураций (система Канна-Ингольда-Прелога) основан на правилах, устанавливающих последовательность старшинства заместителей при асимметрическом центре. Пусть углеродный атом связан с четырьмя различными заместителями A, B, C, и D, которым мы придадим следующий порядок старшинства: A старше B, B старше C, C старше D. Конфигурация будет определена тем, как расположены эти группы при взгляде на тетраэдр, образованный заместителями, со стороны, наиболее удалённой от младшего заместителя (D). Если последовательность A→B→C→D следует движению по часовой стрелке, то конфигурацию обозначают буквой R, а если против часовой стрелки - буквой S (лат. rectus - правый; sinister - левый).
Старшинство отдают атомам, имеющим наибольший атомный номер. Так, галогены размещены в следующий ряд (по убыванию): I, Br, Cl, F. То же правило применяют и в случаях, когда в качестве заместителей выступают группы атомов, например, CH3, NH2, OH, SO3H; старшинство отдают группам, в которых первый атом имеет наибольший атомный номер. Следовательно, общая последовательность упомянутых здесь заместителей будет такой: I, Br, Cl, SO3H, F, OH, NH2, CH3. В тех случаях, когда в двух или более заместителях первые атомы одинаковы, то преимущество отдают тем заместителям, в которых второй атом имеет больший атомный номер. Кроме того, карбоксильная группа CO2H имеет преимущество перед альдегидной группой CHO, поскольку сумма атомных номеров вторых атомов в CO2H больше (три связи с кислородом), чем в CHO (две связи с кислородом и одна с водородом). В том случае, когда первые и вторые атомы для двух или более заместителей одинаковы, необходимо сравнить атомные номера третьих атомов цепи и др.
Применяя эти правила к некоторым хорошо известным оптически активным соединениям, получим, что D-глицериновый альдегид может быть назван R-глицериновым альдегидом, а L-аланин - S-ала- нином (рис. 11-3).
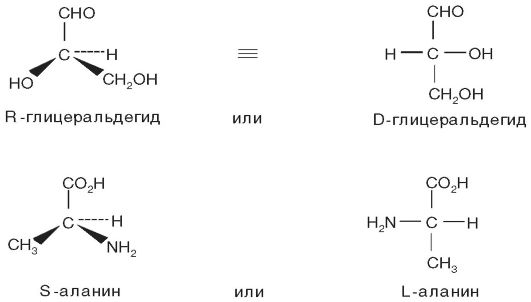 Рис. 11-3. Определение оптических изомеров биологически активных веществ методом спектрополяриметрии
Рис. 11-3. Определение оптических изомеров биологически активных веществ методом спектрополяриметрии
Впервые явление оптической активности было замечено в 1811 году при изучении влияния кварцевой пластинки на поляризованный свет. Несколько лет спустя было доказано, что это свойство присуще не только кристаллическим веществам. Растворы некоторых природных соединений также обладают свойством вращения плоскости поляризации плоскополяризованного света. После детального изучения физических законов этого явления было показано, что угол вращения изменяется линейно, в зависимости от толщины слоя раствора, через который проходит свет, концентрации активного соединения и длины волны света.
Вскоре было обнаружено, что величина оптического вращения - существенная характеристика многих органических соединений. Самым значительным достижением того времени было открытие Пастером разделения рацематов из солей винной кислоты на оптические антиподы. Возможность разделения рацематов на активные энантиомеры очень важна для органического синтеза. Пастер не только обнаружил, но и объяснил гемиэдрию (существование в двух формах, соотносимых как предмет и его зеркальное отображение) кристаллов солей винной кислоты, указав на связь их макроскопической асим-
метрии с асимметрией самой молекулы, тем самым положив начало науке об оптической изомерии. В результате исследований был сделан вывод о том, что вращательная способность связана с существованием собственной асимметрии в молекуле.
Оптическую активность, определяемую при помощи поляриметра, выражают величиной удельного вращения, которую можно определить измерением угла поворота плоскости поляризации при прохождении света через раствор с известной концентрацией в кювете поляриметра при заданной длине пути света в растворе (λ=589 нм).
Сравнительно недавно техника поляриметрических исследований позволила систематически изучать оптически активные молекулы в областях поглощения тех хромофорных групп (ароматических циклов, кратных связей и др.), в которых заключён источник эффекта.
В настоящее время для изучения хиральных соединений широко используют методы спектрополяриметрии: дисперсию оптического вращения (ДОВ) и кругового дихроизма (КД). С помощью этих методов измеряют способность оптически активного хромофора вращать плоскополяризованный свет (ДОВ) в зависимости от длины волны, а также по-разному поглощать свет, поляризованный по кругу вправо и влево (КД). В основе ДОВ и КД лежат одни и те же физические законы и оба эти метода - два разных способа изучения одного и того же явления: взаимодействия поляризованного света с оптически активными молекулами.
Использование методов ДОВ и КД для получения информации о макромолекулах зависит от доступности необходимой аппаратуры. Сначала были доступны только приборы для измерения ДОВ. Кроме того, приблизительно до 1960 года на этих приборах можно было работать только в области значительно больших длин волн, чем таковые, соответствующие полосам поглощения белков и нуклеиновых кислот.
Усовершенствование аппаратуры позволило расширить интервал измерений ДОВ до ультрафиолетового спектра и работать в областях поглощения белков и нуклеиновых кислот, т.е. наблюдать эффекты Коттона.
В конце 60-х годов стали доступны приборы для измерения КД и, ввиду простоты кривой КД, по сравнению с кривой ДОВ, метод КД стали использовать более широко, чем ДОВ. В настоящее время ДОВ применяют редко.
Изучить взаимосвязь ДОВ, КД и ультрафиолетового спектра поглощения для типичного (бесцветного) органического вещества можно
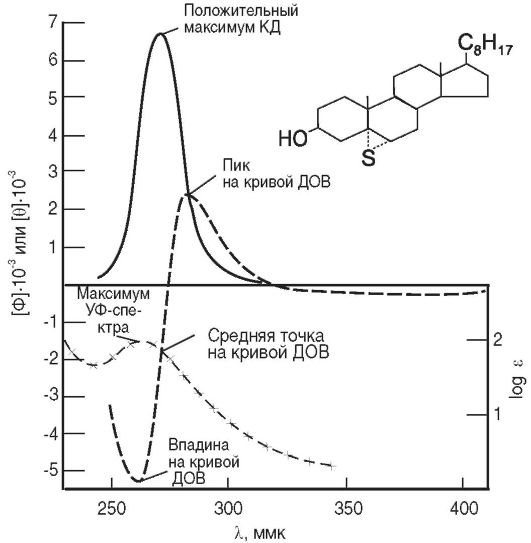 Рис. 11-4. Кривые
дисперсии оптического вращения, кругового дихроизма и поглощения в
ультрафиолетовой области 5α-, 6 α-эписульфида холеста- нола-3β
Рис. 11-4. Кривые
дисперсии оптического вращения, кругового дихроизма и поглощения в
ультрафиолетовой области 5α-, 6 α-эписульфида холеста- нола-3β
на примере кривой с положительным эффектом Коттона для 5α, 6а-эписульфида холестанола-3β (λ=264 нм). Необходимо отметить, что знак вращения видимой области отличен от знака первого эффекта Коттона (рис. 11-4). Можно наблюдать положительный эффект Коттона в ультрафиолетовой области спектра и отрицательное вращение в видимой области. Кривые ДОВ выражены в единицах молекулярного вращения (Φ), а кривые КД - в единицах молекулярной эллиптичности (θ).
Методы ДОВ и КД успешно применяют для решения аналитических задач.
Изучение конформационных особенностей асимметричных молекул методом кругового дихроизма
КД оптически активных веществ обусловлен различным поглощением веществом света, поляризованного по кругу влево и вправо:
 где εl и εr -
коэффициенты поглощения для света, поляризованного по кругу влево и
вправо; Δε - мера КД, имеющая заметную величину только в узкой области
частот (вблизи от максимума полосы поглощения оптически активного
хромофора).
где εl и εr -
коэффициенты поглощения для света, поляризованного по кругу влево и
вправо; Δε - мера КД, имеющая заметную величину только в узкой области
частот (вблизи от максимума полосы поглощения оптически активного
хромофора).
В этой же области частот имеет заметную величину и другой показатель, характеризующий КД, - молекулярная эллиптичность:
 где θ - угол, характеризующий эллиптичность света, прошедшего через оптически активное вещество, градусы; C - концентрация вещества, моль/л; l - длина пути, дм.
где θ - угол, характеризующий эллиптичность света, прошедшего через оптически активное вещество, градусы; C - концентрация вещества, моль/л; l - длина пути, дм.
Молекулярная эллиптичность (θ) связана с величиной Δε уравнением:
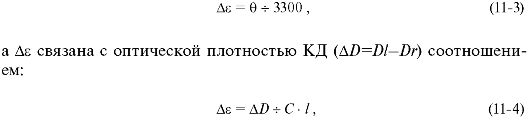 где C - концентрация вещества, моль/л; l - длина пути света, см.
где C - концентрация вещества, моль/л; l - длина пути света, см.
График зависимости величины КД (Δε) от длины волны (λ) имеет вид колоколообразной кривой, аналогичной обычным кривым поглощениям (см. рис. 11-4).
Кроме того, Δε может иметь положительный и отрицательный знак. Учитывая перечисленные свойства КД, можно отметить, что его спектры легко интерпретировать, а изучая КД в области полосы поглощения определённого хромофора, можно анализировать только его свойства, не принимая во внимание другие хромофорные группы.
С помощью метода КД можно разделить вклады в суммарную оптическую активность отдельных полос поглощения изучаемых изомеров химического соединения (лекарственного вещества). Спектры КД исследуемых веществ сравнивают с реперными спектрами КД, полученными для гипотетических структур L- и D-конфигураций. Таким образом получают качественную и количественную картину состава изучаемой субстанции. Большое преимущество метода КД - высокая чувствительность. Для анализа в отдельных случаях можно ограничиться сотыми долями миллиграмма субстанции.
Разделение оптически недеятельных веществ на оптические антиподы
На примере виноградной кислоты Пастер создал ряд классических методов, с помощью которых можно отделить оптические антиподы друг от друга.
Первый метод основан на способности микроорганизмов потреблять лишь одну из двух антиподных конфигураций вещества, обычно ту, которую можно встретить в качестве естественного продукта в растительном или животном мире. Так, при прорастании и размножении чернильной плесени (Penicillium glaucum) на разбавленных растворах виноградной кислоты или её солей, они вскоре приобретают левое вращение. Через некоторое время в растворах можно обнаружить лишь одну левовращающую кислоту, которая может быть получена путём выпаривания раствора и кристаллизации твёрдого остатка.
Второй метод Пастера основан на различной растворимости солей, образованных оптически противоположными кислотами с одним и тем же оптически деятельным основанием.
Так, виноградная кислота может быть разделена на оптические изомеры в виде солей оптически деятельного алкалоида цинхонина. Цинхониновая соль левовращающей виноградной кислоты плохо растворима в воде, а соль правой кислоты растворяется значительно легче, поэтому их можно разделить кристаллизацией.
По этому методу i-молочная кислота (в виде солей стрихнина, хинина или морфина) была разделена на d- и l-молочные кислоты; кристаллизацией цинхониновых солей была разделена i-яблочная кислота и др. Аналогичным путём, т.е. кристаллизацией солей оптически недеятельных оснований с оптически деятельными кислотами, можно разделить i-основания на d- и 1-изомеры.
Стереохимическая теория впоследствии дала следующее объяснение способу разделения оптических антиподов при помощи оптически деятельных соединений. Ввиду того, что молекулы оптических антиподов вполне подобны друг другу и отличны лишь как зеркальные изображения, они обладают одинаковыми свойствами (за исключением различного вращения плоскости поляризации и кристаллизации в энантиоморфных формах). Если в молекулы двух оптических антиподов ввести новую оптически деятельную группу, вращающую плоскость поляризации только в левую или только в правую сторону, то из двух антиподов можно получить две конфигурации, также несовместимые друг с другом, но уже не относящиеся друг к другу, как предмет к зеркальному изображению.
Из сказанного ясно, что расщепление недеятельных веществ вторым способом Пастера представляет лишь частный случай возможных реакций этого рода. Действительно, не только при получении солей оптически деятельных оснований, но при всякой иной реакции, когда с оптически деятельным веществом взаимодействует недеятельное вещество, представляющее собой смесь антиподов, из него получают вещества с различными физическими свойствами, допускающими их лёгкое разделение.
В ходе дальнейшего изучения стереохимических отношений антиподов с оптически активными соединениями было высказано предположение, что оптические антиподы должны с неодинаковой лёгкостью реагировать с другими оптически активными соединениями. Действительно, исследование этерификации рацемических кислот активными спиртами показало, что этерификация антиподов происходит с неодинаковой скоростью и этим способом можно достичь, по крайней мере, частичного расщепления оптических изомеров.
Третий метод расщепления оптически недеятельных веществ, которым Пастеру удалось выделить оба антипода виноградной кислоты, - кристаллизация одной из сегнетовых солей, а именно - натрийаммониевой соли состава C4H4O6Na(NH4)×4H2O. Как показали дальнейшие исследования, лишь при температуре ниже 28 °С из растворов сегнетовой соли кристаллизуется не рацемат, а смесь солей правой и левой виноградной кислоты. Каждая из этих солей образует гемиэдрические энантиоморфные кристаллы. Пастер разделил их отборкой, причём одни из них представляли собой d-кислоту, а другие - 1-кислоту.
Разделения изомеров в некоторых случаях можно достичь внесением в перенасыщенный раствор кристаллика одного из изомеров, вызывающего кристаллизацию только ему подобной соли. Такую «прививку» можно проводить с помощью других изоморфных кристаллов, образующих энантиоморфные формы. Например, кристаллы I-аспарагина вызывают кристаллизацию d-сегнетовой соли.
По-видимому, такую кристаллизацию можно вызвать и «прививкой» энантиоморфных кристаллов вещества, не содержащего асимметрического атома углерода. Например, внесением в насыщенный раствор i-аспарагина энантиоморфного кристалла гликоколя удалось вызвать кристаллизацию одного из оптически изомерных аспарагинов.
Энзиматическое разделение рацематов
Использование этого метода ограничено тем, что при разделении происходит потеря наиболее интересного природного энантиомера. Иногда, вместо разрушения природного субстрата при помощи ферментов, удаётся осуществить лишь такое изменение его специфической функциональной группы, которого достаточно для определения неизменного изомера. Разработан удобный метод ферментативного разделения рацематов аминокислот. Например, DL-аланин ацетилируют; полученное ацетильное производное DL-аланина обрабатывают раствором фермента, катализирующего деацетилирование. В результате указанной ферментативной обработки получают смесь природного L-аланина и N-ацетил-D-аланина. Смесь легко разделить, так как свободная аминокислота нерастворима в этиловом спирте, а ацетильное производное легко растворяется в нём.
Второй метод энзиматического разделения основан на дезаминировании аминокислот с помощью оксидаз (например, антибиотик хлорамфеникол - N-дихлорацетильное производное амина, иногда называемого основанием хлорамфеникола).
Разделение основания путём внесения затравки в его перенасыщенный раствор, частично нейтрализованный соляной кислотой, представляет особый интерес, так как для этого достаточно однажды внести затравку одного из оптически чистых энантиомеров. После этого оба энантиомера выделяют попеременно, так как каждый раз выкристаллизовывается только тот изомер, которым раствор перенасыщен в большей степени.
Методы разделения оптически активных соединений и применяемые реагенты
Разделение неорганических комплексов (например, электролитов) легко выполнить с помощью большинства перечисленных ниже реагентов. Алкалоиды используют в протонированном виде, а кислоты (камфорсульфокислота, винная кислота и др.) - в виде анионов. Для этой цели можно также применять уже разделённые комплексы металлов, например, Co(En)33+, Ni(Phen)32+ цис-Со(Еп)2(NO)2+ и Co(EDRA)-. Помимо этого, используют и другие методы: хроматографию, асимметрический синтез, зонную плавку и диффузию.
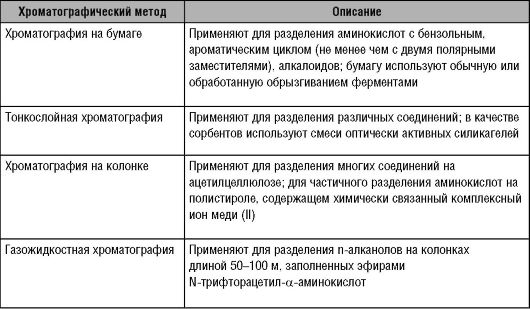
Хроматографические методы разделения оптически активных соединений
Эти способы применяют для разделения соединений, не имеющих удобных для расщепления функциональных групп. Существует множество методов, использующих адсорбционную, газожидкостную и ионообменную хроматографию на дисимметрических сорбентах. Дополнительные примеры дают представление о современных хроматографических методах разделения оптически активных соединений (табл. 11-2).
Таблица 11-2. Методы хроматографического разделения оптически активных соединений
 Оптическая чистота
Оптическая чистота
Многие способы определения оптической чистоты тесно связаны с методами разделения оптически активных веществ.
Оптическую чистоту вещества определяют по формуле:
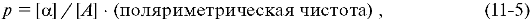 где α - удельное вращение вещества; A - удельное вращение чистого энантиомера.
где α - удельное вращение вещества; A - удельное вращение чистого энантиомера.
Энантиомерной чистотой вещества называют меру превышения одного энантиомера над другим, которую определяют отношением:
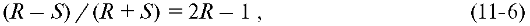 где R и S - соответствующие мольные доли энантиомеров (R+S=1).
где R и S - соответствующие мольные доли энантиомеров (R+S=1).
На практике используют термин «оптическая чистота», так как она обычно совпадает с энантиомерной чистотой вещества.
Методы определения оптической чистоты, включающие действительное разделение энантиомеров или диастереомерных производных
• Кинетическое разделение - метод, основанный на различии скоростей реакций энантиомеров с хиральными реагентами.
• Газовая хроматография - метод, основанный на разделении и количественном анализе диастереомерных производных.
Методы определения оптической чистоты, не включающие разделения. Изотопное разбавление
Обычно m граммов меченого (например, 14С, 2Н) рацемического материала с активностью So добавляют к n граммам немеченого материала, имеющего вращение α. При последующем разделении (оптическом фракционировании) получают образец с новым значением вращения ai и новым значением активности S:
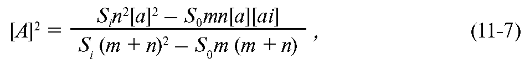 что позволяет найти величину р:
что позволяет найти величину р:
 Следует
отметить, что в последнее время разработана очень чувствительная
методика радиоактивного анализа содержания рацематов в пептидах (для
концентраций 0,001-1%).
Следует
отметить, что в последнее время разработана очень чувствительная
методика радиоактивного анализа содержания рацематов в пептидах (для
концентраций 0,001-1%).
Дифференциальная микрокалориметрия
Для энантиомеров R и S, которые образуют рацематы с теплотой плавления Δ Hp и температурой плавления Тр, смесь неизвестного R, S-состава с температурой плавления Т обладает оптической чистотой, определяемой следующим соотношением:
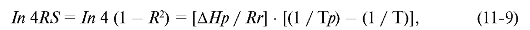 где Rr - газовая постоянная; R и S - мольные доли энантиомеров.
где Rr - газовая постоянная; R и S - мольные доли энантиомеров.
Спектроскопия (ядерный магнитный резонанс)
Метод основан на определении интегральной интенсивности сигнала ядерного магнитного резонанса для диастереомерных производных в ахиральном (оптически неактивном) растворителе или для смеси энантиомеров в хиральном растворителе (например,в α-фенэтиламине, 2,2,2-трифтор-1-фенилэтаноле; в различных карбинолах). Есть сообщения об усовершенствовании этого метода, основанном на использовании оптически активных реагентов, сдвигающих ядерный магнитный резонанс.
На основании изложенного материала можно сделать вывод, что изучение конформационных особенностей оптически активных субстанций с помощью точных физических методов составляет важную часть современных исследований, направленных на повышение эффективности препаратов. Изучение фармакокинетических особенностей отдельных изомеров открывает новые направления совершенствования ЛС.
Литература
Алексеев В.В. Соросовский образовательный журнал. - 1998. - ?1. - С. 49-55.
Веллюз Л., Легран М., Трожан М. Оптический круговой дихроизм. -
М.: Мир, 1967.
Дунина В.В., Белецкая И.П. - Журн. Орган. Химии. - 1992. - ? 128. - 1929 с.
Тордон А., Форд Р. Спутник химика. - М.: Мир. - 1976. - 246 с. Кантор Ч., Шиммел П. Биофизическая химия. М.: Мир. - 1984. -
Т. 2. - С. 63-77.
Моррисон Дж., Мошер Т. Асимметрические органические реакции. - М.: Мир. - 1973.
Неницеску К.Д. Органическая химия. - М.: Иностранная литература. - 1967. - Т. 2. - С. 148-155.
Робертс Дж., Касерио М. Основы органической химии. М.: Мир. -
1978. - Т. 1. - С. 608-611.
Рогожин С.В, Даванков В.А. Усп. хим., 37, 1327 (1968); Buss D., Vermeulen Т. Ind.Eng. Chem., 60, 12 (1968).
Снацке Т., Джерасси K. Дисперсия оптического вращения. Применение в органической химии. - М. - 1962.
Физер Л., Физер М. Органическая химия. Углубленный курс. - М.:
Химия. - 1966. - С. 80-108.
Фрайфельдер Д. Физическая биохимия. - М.: Мир. - 1980. Чичибабин А.Е. Основные начала органической химии. - М.:
Госхимиздат. - 1953. - Т. 1. - С. 506-508.
Adler A.I., Greenfield N.I., Fasman G.D. Circular Dichroism and Optical Rotatory Dispersion of Proteins and Polypeptides, in Methods in Enzymology // Academic Press. - 1973. - P. 675-735.
Boyle P.H. Methods of Optical resolution // Quart. Rev. - 1971. - 323 p.
Lehninger A., Cox N. Principles of Biochemistry // World Publishers. -
1993. - P. 58-67.
Nakano T., Hasegawa M., Djerassi C. Chem..Pharm. - Bull (Tokyo). - 1963. - Vol. 11. - P. 465.
Raban M., Mislow K. Topics in Stereochemistry. - 1967. - 199 p.
Sargeson A.M. Chelating Agents and Metal Chelates. - New York: Academic Press. - 1964. - P. 193-198.
Wilen S. Resolving Agents and Resolutions in Organic Chemistry, Topics in Stereochemistry. - 1971. - P. 107.
11.2. ВЗАИМОСВЯЗЬ КРИСТАЛЛИЧЕСКОЙ СТРУКТУРЫ СУБСТАНЦИИ ВЕЩЕСТВА, ФАРМАКОКИНЕТИКИ И ЭФФЕКТИВНОСТИ ЛЕКАРСТВЕННОГО СРЕДСТВА
В нашей стране и за рубежом всё большее внимание уделяют качеству фармацевтических препаратов (исходных материалов, активных и вспомогательных веществ), используемых в производстве ЛС. В интересах обеспечения безопасности больных должен быть минимизиро-
ван любой риск, который может возникнуть в результате использования недоброкачественных исходных материалов.
В структуре мирового потребления ЛС основную часть (по некоторым оценкам - до 95%) составляют готовые формы промышленного или мелкосерийного аптечного изготовления. Экстемпоральная рецептура составляет малую долю (несколько процентов); а чистые субстанции в настоящее время практически не применяют. Вследствие этого, со стороны органов нормативного контроля ЛС-субстанциям уделяют значительно меньше внимания, нежели фармацевтическим продуктам. Основная ответственность за выбор надлежащих исходных веществ и проверку их качества возложена на производителей готовых препаратов.
Между тем терапевтическая (клиническая) неэквивалентность при производстве дженериков (воспроизведённых препаратов) во многом определена их фармакокинетической неэквивалентностью.
Свойства субстанций (даже одной и той же фирмы) отличаются по многим технологическим и некоторым физико-химическим показателям, контроль которых не предусмотрен фармакопеями ведущих стран или стандартами фирм. Некоторые из них выпускают более десяти видов ацетилсалициловой кислоты, четыре вида парацетамола, пять видов аскорбиновой кислоты, что не всегда известно предприятиям, закупающим субстанции.
С практической точки зрения, возрастает роль биофармации, изучающей биологическое действие ЛС, в зависимости от их физико-химических свойств, лекарственных форм и технологии приготовления.
Прежде чем оценить влияние качества субстанций на фармакокинетику ЛС, необходимо рассмотреть варианты их физико-химического состояния.
Физико-химическое состояние вещества
Физико-химическое состояние лекарственного вещества оказывает значительное влияние на его биологическую активность. Известно, что различия в структуре химических соединений (различие координационного числа, типа плотнейшей упаковки; изменения мотива расположения катионов; различие в повороте некоторых структурных групп в процессе полиморфного превращения; многообразные размеры и формы граней) обеспечивают специфическую совокупность свойств. Всё это приводит к различию внешней формы кристаллов - габитуса. Твёрдые вещества с близким габитусом называют «изо-
морфным». Многие вещества способны существовать в разных кристаллических формах, каждую из которых называют «полиморфная модификация», а само явление - «полиморфизм». Геометрическая форма и состав кристаллов существенно зависят от характера растворителя, скорости кристаллизации, температуры процесса, примесей, величины давления и других факторов. Например, 30-60% сульфаниламидов, 70% барбитуратов считают полиморфными; одна треть всех органических соединений имеет, по крайней мере, две кристаллические формы. Накоплено достаточное количество экспериментального материала о зависимости структуры веществ от их биологической доступности. Он позволяет более детально рассмотреть взаимозависимость биологической активности от кристаллической решетки и конформации молекул органического вещества не только в твёрдой фазе, но и в растворе.
Полиморфные изменения лекарственных веществ могут быть причиной быстрой инактивации препаратов, изменений физических показателей готовых ЛС, химической несовместимости ингредиентов в составе одной лекарственной формы. Полиморфные модификации ряда широко применяемых лекарственных веществ различны по химической стабильности, гигроскопичности, прессуемости. В зависимости от типа связей в кристалле, окружающих условий, химической структуры они могут переходить в свои менее активные стабильные аналоги.
В Соединённых Штатах Америки тесты на полиморфизм включены в требования администрации по контролю над продуктами питания и ЛС по аналитическому контролю новых ЛС; утверждён набор методик его обнаружения и изучения.
Физико-химические свойства полиморфных модификаций
Изменение кристаллического состояния вещества в значительной степени оказывает влияние на его физико-химические, фармакотехнологические и биофармацевтические свойства. Физико-химические свойства формируются на этапе кристаллизации из растворов или расплавов.
Наиболее чувствительны к полиморфизму: размер кристаллов, плотность, растворимость, температура плавления, удельная теп- лоёмкость, электропроводность, угол смачивания, показатель преломления, коэффициент рассеяния света, степень деполяризации света, инфракрасные спектры, термограммы, рентгеновские диф-
рактограммы. Например, растворимость барбитала, формы кристаллов которого соответствуют Государственной фармакопее СССР одиннадцатого издания, на 6,6% выше растворимости образцов, соответствующих Фармакопее ГДР седьмого издания, и на 11,8% выше растворимости образцов, соответствующих Венгерской фармакопее шестого издания. Растворимость трёх полиморфных модификаций кодеина при температуре 200 °С составляет 2,41, 3,19 и 25,7х102 моль/л. Температура плавления трёх различных модификаций рибофлавина составляет 291, 278 и 1830 °С. Хорошо известен полиморфизм тетракаина (дикаина♠). В Фармакопее Соединённых Штатов Америки описаны четыре его кристаллические модификации, отличающиеся лишь температурой плавления. Многие коммерческие субстанции - смесь этих форм. В нашей стране получена кристаллографически чистая модификация (β-форма) тетракаина - леокаин*. При этом рентгеновская дифрактограмма, термограмма, инфракрасная спектрограмма, показатели преломления, рассеяния и степень деполяризации света этих двух препаратов заметно различаются.
Влияние полиморфизма на фармакотехнологические, биофармацевтические и фармакокинетические свойства лекарственных веществ
Физико-химические свойства кристаллов обусловливают опре- делённую прессуемость, сыпучесть, гигроскопичность, химическую стабильность и биодоступность лекарственных веществ. Например, кубические кристаллы парацетамола прессуются лучше, чем игольчатые, что можно объяснить их лёгкой перегруппировкой, лучшим контактом и более прочными связями. Различие в гигроскопичности можно проиллюстрировать на примере леокаина* и тетракаина, для которых потеря в массе при высушивании составляет до 3,5, и 0,5% соответственно.
Различие в биодоступности обусловливает биофармацевтическую, а следовательно, и терапевтическую (клиническую) неэквивалентность химически идентичных лекарственных веществ. Например, скорость растворения аморфной модификации новобиоцина® (кислоты) в десять раз выше кристаллической формы. Именно поэтому при назначении обоих форм новобиоцина® из расчёта 12,5 мг/кг в плазме крови определяют только его аморфную модификацию.
Кристаллическая форма новобиоцина® практически не всасывается в организме. Официнальный препарат поглощается гораздо менее интенсивно, чем его аморфная форма (метастабильная). В водной среде (например, в суспензии) аморфная модификация медленно превращается в кристаллическую, что проводит к исчезновению терапевтического эффекта.
В группе снотворных лекарственных веществ (барбитуратов) также обнаружена физико-химическая и биофармацевтическая неэквивалентность. Например, доказано влияние кристаллического строения бензобарбитала на характер судорог и продолжительность снотворного эффекта.
Хлорамфеникол существует в четырёх полиморфных модификациях: в трёх кристаллических (А, В, С) и одной аморфной. Последняя фактически не выказывает биологической активности, так как очень медленно гидролизуется in vivo в свободный хлорамфеникол. Наибольшей активностью обладает форма В. Только она обеспечивает надёжную и самую значительную концентрацию антибиотика. Открыты также две полиморфные формы метилпреднизолона ацетата, обладающие различной растворимостью.
Опубликованы работы по выделению и идентификации трёх полиморфных форм сульфаметоксидиазинар: аморфной и двух кристаллических. Изучена абсорбция второй и третьей кристаллических форм. Скорость всасывания второй формы в 1,4 раза выше, чем таковая третьей формы. Кроме того, вторая форма обладает более высокой биологической доступностью (рис. 11-5).
При изучении фармакокинетики двух форм ацетилсалициловой кислоты было показано существенное различие в концентрации салицилата на участке всасывания (рис. 11-6).
Многочислены примеры влияния псевдополиморфизма на растворимость и биодоступность лекарственных веществ. Например, безводная форма ампициллина при 37 °С примерно на 50% более растворима в воде, чем его тригидрат: 10,8 и 5,4 мг/мл, соответственно
(рис. 11-7).
В опытах in vivo была изучена фармакокинетика этих двух форм ампициллина при однократном внутрижелудочном применении добровольцами дозы 250 мг в виде суспензии. Обнаружено различие в площадях под кривыми «концентрация-время» при применении двух форм (рис. 11-8). Степень и скорость всасывания (биодоступность) безводной формы выше, чем у ампициллина тригидрата.
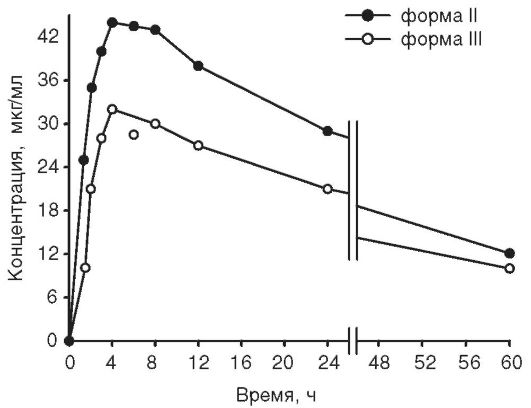 Рис. 11-5. Фармакокинетические кривые сульфаметоксидиазинаp после внутрижелудочного применения второй и третьей форм
Рис. 11-5. Фармакокинетические кривые сульфаметоксидиазинаp после внутрижелудочного применения второй и третьей форм
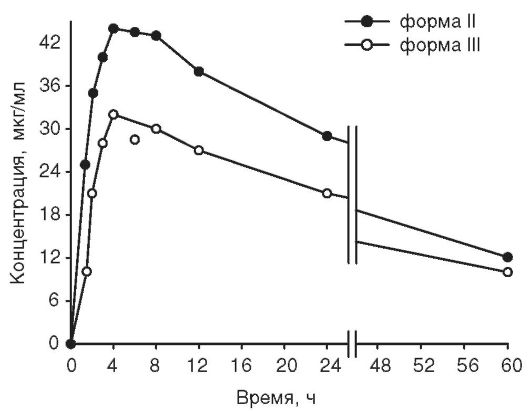 Рис. 11-6. Концентрация ацетилсалициловой кислоты после внутрижелудочного применения первой и второй форм
Рис. 11-6. Концентрация ацетилсалициловой кислоты после внутрижелудочного применения первой и второй форм
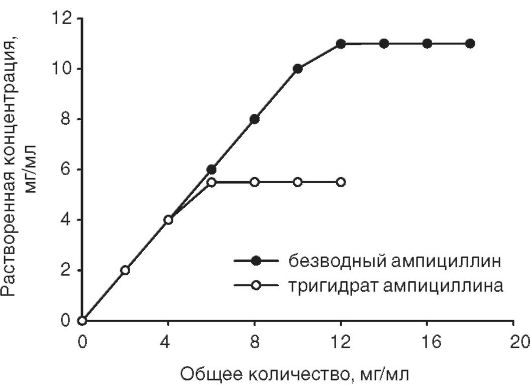 Рис. 11-7. Профили растворения безводного ампициллина и ампициллина тригидрата
Рис. 11-7. Профили растворения безводного ампициллина и ампициллина тригидрата
Соответственно при назначении безводной формы антибиотика в виде суспензий и капсул отмечают более раннее достижение пиковой концентрации в плазме крови и более высокое его содержание, чем при применении тригидрата.
Оценка биодоступности двух форм ампициллина по кинетике его выведения с мочой была проведена на добровольцах. Показано, что биодоступность безводной формы выше, чем тригидрата (рис. 11-9).
Различной биодоступностью обладают кристаллические полиморфные формы преднизолона. В опытах при имплантации формы l-фторпреднизолона атрофия коры надпочечников развивалась в 1,5 раза быстрее, чем при применении его d-моногидрата. Подобное обстоятельство, несомненно, нужно учитывать в клинической практике. Скорость растворения безводных форм кофеина, теофиллина, глютетимида значительно выше, чем их сольватных форм. И наоборот, сольватные формы фторкортизонар и сукцинилфатиазолар растворяются легче их несольватных форм. Трибутилацетат гидрокортизона в виде моноэтанолсольвата всасывается в четыре раза быстрее его безводного аналога.
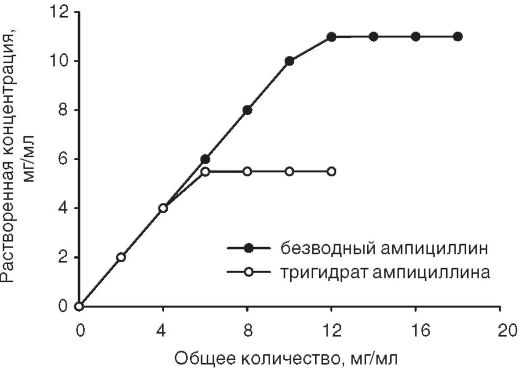 Рис. 11-8. Концентрация ампициллина после внутрижелудочного применения безводной формы и ампициллина тригидрата
Рис. 11-8. Концентрация ампициллина после внутрижелудочного применения безводной формы и ампициллина тригидрата
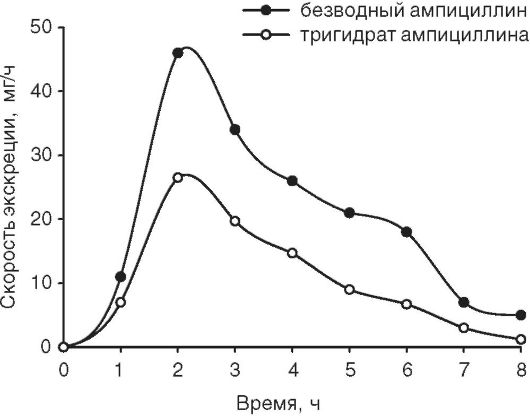 Рис. 11-9. Скорость экскреции ампициллина после внутрижелудочного применения безводной формы и тригидрата
Рис. 11-9. Скорость экскреции ампициллина после внутрижелудочного применения безводной формы и тригидрата
Применяя ту или иную полиморфную форму лекарственного вещества, можно влиять не только на уровень абсорбции и фармакотерапевтической активности препарата, но и изменять время его действия.
В результате реакции с хлоридом цинка осаждённый инсулин превращается в труднорастворимый комплекс, который, в зависимости от рН, может быть аморфным или кристаллическим. Аморфный инсулин-цинк действует быстро и непродолжительно, кристаллический всасывается значительно медленнее. Сочетание в инъекции обеих форм обеспечивает сбалансированное поступление гормона в организм, характеризующееся средним значением времени действия аморфной и кристаллической форм. Различие в продолжительности местноанестезирующей активности обнаружено у тетракаина и леокаина♠: 0,3% раствор леокаина* обеспечивает длительность анестезии не менее 40 мин, а раствор тетракаина той же концентрации - не более 15 мин.
Изменяя фармакокинетику лекарственного вещества, полиморфизм может оказывать влияние на его токсичность. Например, токсичность тетракаина в три раза превышает таковую его полиморфной модификации.
Таким образом, полиморфизм имеет исключительное значение для клинической практики, с точки зрения повышения эффективности препаратов, нивелирования их побочных действий, а также сокращения экономических затрат. Выбор, основанный на биофармацевтических исследованиях наиболее активных полиморфных модификаций лекарственного вещества, позволяет снизить дозы применяемых препаратов.
Стабильность полиморфных модификаций
При кристаллизации твёрдого тела из раствора или расплава первой образуется наименее устойчивая фаза, которая по величине свободной энергии наиболее близка к раствору (правило Оствальда). Именно поэтому метастабильные модификации обладают меньшим внутренним сцеплением молекул, что выражено в их повышенной растворимости. Растворимость лекарственного вещества в воде - наиболее важное физическое свойство препарата.
Растворение играет роль лимитирующей стадии в абсорбции ЛС из желудочно-кишечного тракта, поэтому именно метастабильные формы вызывают особый интерес при создании фармацевтической субстанции.
Существует большой арсенал различных методов и средств, с помощью которых можно затормозить переход метастабильных кристаллических модификаций в стабильные. Устойчивость метастабильных полиморфных форм повышают некоторые вспомогательные вещества (метилцеллюлоза, поливинилпирролидон, натрия альгинат, пропиленгликольальгинат), которые, наряду с формообразующими функциями, могут обладать и стабилизирующим действием.
Если для превращения одной полиморфной формы в другую необходимо малое количество энергии, то в условиях in vivo они легко переходят друг в друга. Именно поэтому, если вместо одной полиморфной модификации лекарственного вещества применяют другую, биодоступность препарата не претерпевает существенных изменений.
Размер кристаллов лекарственных субстанций и биодоступность
Вопросам измельчения в фармацевтической технологии придают особое значение. Известно, что уменьшение размера частиц резко увеличивает поверхностную энергию измельчаемого лекарственного вещества. При тонком измельчении препараты лучше растворяются, быстрее и полнее участвуют в химических реакциях и др. Измельчение может существенным образом влиять на терапевтическую активность ЛС вследствие изменения процесса их всасывания. Скорость растворения лекарственных веществ прямо пропорциональна площади поверхности, на которой происходит всасывание, и обратно пропорциональна величине частиц вещества. Обнаружено, что при назначении одинаковых доз сульфадимезидар, микронизированного и полученного в заводском производстве без дополнительного измельчения, в первом случае в плазме крови людей содержание вещества на 40% выше, достижение максимальной концентрации происходит на 2 ч раньше, а общее количество всосавшегося вещества на 20% больше, чем во втором случае. Уменьшение размера частиц ацетилсалициловой кислоты до микронизированных способствует усилению приблизительно в два раза её анальгетического, жаропонижающего и противовоспалительного действия. На рис. 11-10 показано влияние размера частиц леупролидацетатар на фармакокинетику препарата в крови.
Подробно изучено влияние размера кристаллов субстанции гризеофульвина на его биодоступность у людей. Если для получения таблеток используют гризеофульвин с размером частиц 5 мкм и менее,
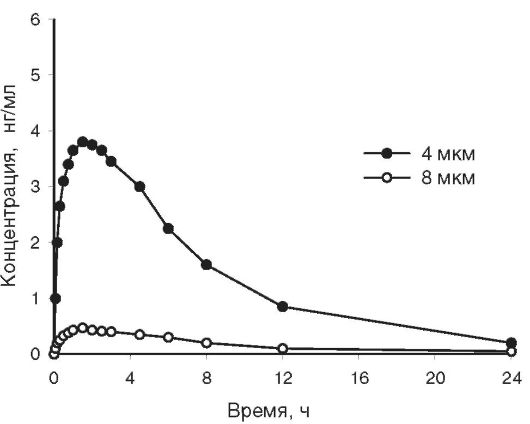 Рис. 11-10. Фармакокинетические кривые леупролидацетатар после применения спрея с различным размером кристаллов
Рис. 11-10. Фармакокинетические кривые леупролидацетатар после применения спрея с различным размером кристаллов
то такой препарат в 2-3 раза эффективней обычного (размер частиц около 100 мкм).
Через 3 ч после приёма порошка спиронолактона со степенью измельчения около 80 мкм его концентрация в крови существенно меньше, чем после приёма микронизированного (2 мкм) порошка. Опубликована работа, где изучена связь между скоростью растворения субстанции хиназолидинар различной размерности и степенью её всасывания в системный кровоток обезьян при приёме внутрь (рис. 11-11). Для препарата, у которого лимитирующей стадией считают растворение, обнаружена чёткая корреляция: с уменьшением размера кристаллов субстанции растёт скорость растворения (in vitro) и площадь под фармакокинетической кривой «концентра- ция-время».
При изучении фармакокинетики двух твёрдых лекарственных форм циннаризина (размер кристаллов субстанции 50 и 15 мкм) установлено, что биодоступность препарата с более крупными частицами составила 52% от таковой препарата в микронизированной форме.
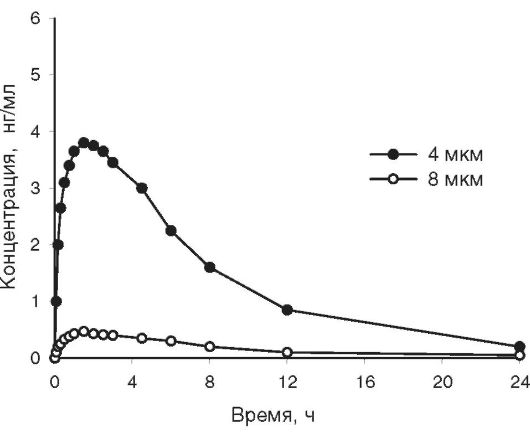 Рис. 11-11. Фармакокинетические кривые хиназолидинар после приёма внутрь субстанции с различным размером кристаллов
Рис. 11-11. Фармакокинетические кривые хиназолидинар после приёма внутрь субстанции с различным размером кристаллов
Все вышеперечисленные примеры подтверждают, что физикохимическое состояние субстанции ЛС влияет как на его фармакокинетику, так и в конечном счёте, на эффективность лечения.
Литература
Агафонов В.Н., Леонидов Н.Б. Тез. докл. 2-го Всесоюз. совещ. по орг. кристаллохимии. - Звенигород, 1978. - 131 с.
Казаринов Н.А. Итоги и перспективы развития производства твердых лекарственных форм // Специальный выпуск к V съезду фармацевтов Украины. - Харьков, 1999.
Леонидов Н.Б., Селезнёв Н.Г. Сб. ст. 4-го Всесоюз. съезда фармацевтов. - Казань, 1986. - С. 353-354.
Леонидов Н.Б. Фармакология и научно-технический прогресс: 6-й Всесоюз. съезд фармакологов. - Ташкент, 1988. - С. 217-218.
Леонидов Н.Б. Тез. докл. 5-й Московской конф. по органической химии и технологии. - М., 1989. - Ч. 1. - 119 с.
Лукьянова М.С., Иванова Р.А., Куриленко В.М. и др. Сравнительная биодоступность двух таблетированных форм циннаризина: 3-я Всесоюзная конф. по фармакокинетике. - М., 1991. - 162 с.
Мешковский А.П. Обеспечение качества фармацевтических субстанций за рубежом - сегодня и завтра // Фарматека. - 2000. - ? 1(37). -
С. 29-34.
Успенская С.И., Нестерова Г.А., Боковикова Т.Н. и др. Анализ и стандартизация лекарственных препаратов, полученных методом полиморфного модифицирования // Рос. хим. журн. - 1997. - Т. XLI, ? 5. - С. 130-135.
Adjei A., Garren J. Pulmonary delivary of peptide drugs: effect of particle size on bioavailability of leuprolide acetate in healthy male volunteers // Pharm. Res. - 1990. - Vol. 7. - ? 6. - P. 565-569.
Ali A.A., Farouk A. Comparative studies on the bioavailability of ampicillin anhydrate and trihydrate // Int. J. Pharm. - 1981. - Vol. 9, ? 3. - P. 239- 243.
Atkinson R.M., Bedford C, Child K.J., Tomich E.G. The effect of griseofulvin particle size on blood levels in man // Antibiot. Chemother. - 1962. - Vol. 12. - P. 232-238.
Ballard B., Biles J. Effect of crystallizing solvent on absorption rates of steroid implants // Steroids. - 1964. - Vol. 4, ? 2. - P. 273-278.
Byrn S., Pfeiffer R., Ganey M. et al. Pharmaceutical solids: A strategic approach to regulatory considerations // Pharm. Res. - 1995. - Vol. 1. -
? 7. - P. 945-954.
Chawla G., Bansal A.K. Challenges in polymorphism of pharmaceuticals //
Crips. - 2004. - Vol. 5. - ? 1. - P. 9-12.
Haleblian J.K. Characterisation of habits and crystalline modifination of solid and their pharmaceutical application // J. Pharm. Sci. - 1975. -
Vol. 6. - ? 8. - P. 1269-1288.
Khalil S., Moustafa M., Ebian A., Motawi M. GI absorption of two crystal forms of sulfameter in man // J. Pharm. Sci. - 1972. - Vol. 6. - ? 10. - P. 1615-1617.
Kraml M., Dubic J., Gaudry R. Gastrointestinal absorption of griseofulvin. II. Influence of particle size in man // Antibiot. Chemother. - 1962. - Vol. 12. - P. 239-242.
Lui C., Chang T., Wu S., Chiang H. Total solubility determination of mixtures containing ampicillin anhydrate and ampicillin trihydrate // J. Chines
Chem. Soc. - 2006. - Vol. 53. - P. 851-856.
McInnes G.T., Asbury M.J., Ramsay L.E., Shelton J.R. Effect of micronization on bioavailability and pharmacologic activity of spironolactone // J. Clin. Pharmacol. - 1982. - Vol. 22. - P. 410-417.
Moustafa M., Ebian A., Khalil S., Motawi M. Sulphamethoxydiazine crystal forms // J. Pharm. Pharmacol. - 1971. - Vol. 23. - ? 11. - P. 868-874.
Mullins J., Macek T. Some pharmaceutical properties of novobiocin // J. Am. Pharm. Assoc. Sci. - 1960. - Vol. 49. - P. 245 -248.
Nimmerfall F., Rosenthaller J. Dependence of area under the curve on proquazone particle size and in vitro dissolution rate // J. Pharm. Sci. -
1980. - Vol. 69. - ? 5. - P. 605-607.
Poole J., Owen G., Silverio J. et al. Physiochemical factors influencing the absorption of the anhydrous and trihydrate forms of ampicillin // Curr. Ther.
Res. - 1968. - Vol. 10. - ? 6. - P. 292-303.
Tawashi R. Gastrointestinal absorption of two polymorphic forms of aspirin // J. Pharm. Pharmacol. - 1969. - Vol. 21. - ? 10. - P. 701-702.