Клиническая фармакокинетика: теоретические, прикладные и аналитические аспекты: руководство / Под ред. В.Г. Кукеса. - 2009. - 432 с
|
|
|
|
ГЛАВА 17 ПРИКЛАДНЫЕ АСПЕКТЫ ФАРМАКОКИНЕТИКИ ИНГИБИТОРОВ ПРОТОННОГО НАСОСА
С.Ю. Сереброва, С.Н. Кондратенко, А.К. Стародубцев
Общие представления об ингибиторах протонного насоса
В настоящее время ингибиторы протонного насоса - наиболее эффективная группа препаратов, подавляющих образование HCl париетальными клетками, которые применяют при лечении кислотозависимых заболеваний пищевода, желудка и двенадцатиперстной кишки. Механизм их действия заключается в блокаде Н+-/К+-АТФазы (протонного насоса), - фермента, переносящего ионы водорода в просвет секреторных канальцев париетальных клеток, т.е. ответственного за основную фазу образования HCl. Необратимой (или длительной) блокадой кислотопродукции объясняется продолжительность эффекта ингибиторов протонного насоса, которая, таким образом, мало зависит от времени нахождения препаратов в крови.
Являясь производными бензимидазола, блокаторы Н+-/К+-АТФазы представляют собой пролекарства, то есть должны образовывать активную форму (сульфена-
мид) только в секреторных канальцах париетальных (обкладочных) клеток, просвет которых контактирует с молекулами фермента - транспортёра ионов водорода и калия. Ингибиторы протонного насоса неустойчивы в кислой среде, вероятность проникновения их из полости желудка в секреторные канальцы огромной массы париетальных клеток ничтожна, по сравнению с транспортными возможностями микроциркуляторного русла слизистой оболочки желудка. Однако активные формы блокаторов Н+-/К+-АТФазы разрушаються в ЖКТ. Решение проблемы минимизации потерь при доставке неактивного вещества к париетальной клетке обеспечивает повышение клинической эффективности препаратов данной фармакологической группы. Защиту ингибиторов протонного насоса от соляной кислоты технически решают применением кишечнорастворимых лекарственных форм, обеспечивающих высвобождение действующего вещества в щелочной среде просвета тонкой кишки, а активация производных бензимидазола требует последовательного протонирования пиридинового и бензимидазольного колец, имеющих различные значения pKa.
Многоэтапность высвобождения - активация ингибиторов протонного насоса, различие состава, физико-химических свойств и качества кишечнорастворимых лекарственных форм обусловливают различия их фармакокинетики и клинической эффективности. Неактивные в щелочной среде ингибиторы протонного насоса считают относительно безопасными препаратами, хотя случаи возникновения побочных эффектов при их применении иногда встречают, а одна из версий происхождения нежелательных явлений говорит о возможной активации производных бензимидазола в умеренно кислых тканях.
Феномен развивающейся у ряда гастроэнтерологических больных рефрактерности к ингибиторам протонного насоса объяснить трудно, учитывая универсальность их механизма действия: имеются попытки объяснить данное явление полиморфизмом CYP2C19, индивидуальной неадекватностью супрессии кислотопродукции, эмоциональными, психологическими расстройствами, гиперчувствительностью слизистых оболочек к соляной кислоте. Большая часть работ, посвя- щённых фармакокинетике и продолжительности антисекреторного эффекта блокаторов Н+-/К+-АТФазы, содержит данные, относящиеся к первому дню приёма препаратов здоровыми лицами, или к четвер-
тому дню и более применения у больных кислотозависимыми заболеваниями. Известно, что фармакокинетика одного и того же препарата может изменяться у пациентов с различными заболеваниями желудочно-кишечного тракта. Парадокс заключается в том, что допускается и остаётся без персональной оценки вероятность достаточно длительного периода низкой клинической эффективности ингибиторов протонного насоса, применяемых для лечения заболеваний, лидирующих количеством смертельно опасных осложнений (кровотечение, перфорация). Актуален всесторонний анализ имеющихся данных и обоснованное представление проблемы взаимосвязи клиникофизиологических и фармакокинетических аспектов, в итоге определяющих выраженность основного фармакодинамического эффекта. Цель лекарственного мониторинга, если речь идёт об ингибиторах протонного насоса, - не оценка безопасности, а предупреждение неэффективности лечения в начале применения и при курсовом при- ёме препаратов.
Фармакокинетика ингибиторов протонного насоса у здоровых добровольцев
Омепразол и лансопразол - первые представители группы блокаторов Н+-/К+-АТФазы, появление которых на фармацевтическом рынке ознаменовало революционный прорыв в лечении кислотозависимых заболеваний желудочно-кишечного тракта, так как, в отличие от блокаторов Н2-рецепторов, эффективность их не зависит от преобладающего у больного нервно-рефлекторного или гуморального механизмов кислотообразования (индивидуального типа рецепции обкладочных клеток желудка).
Используемые в России препараты омепразола выпускают, в основном, в виде заключённых в желатиновые капсулы кишечнорастворимых гранул (пеллет). Исключение составляет Лосек МАПС* (омепразол), выпускаемый в виде таблеток, покрытых кишечнорастворимой оболочкой, содержащих кишечнорастворимые гранулы омепразола магния. Данные о фармакокинетике этого препарата не представлены.
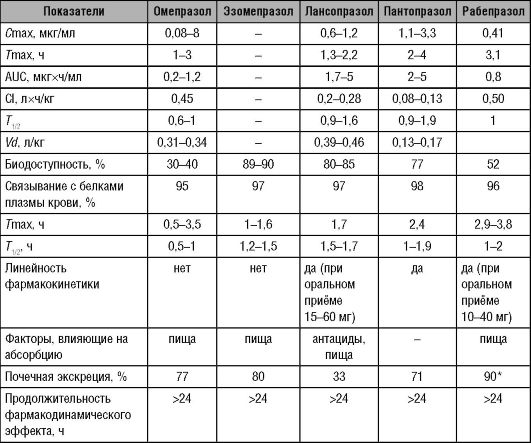
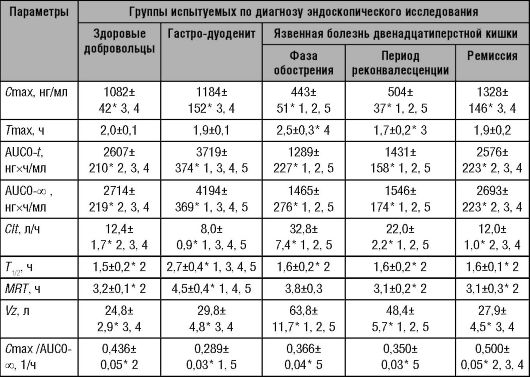
Фармакокинетические параметры основных представителей группы ингибиторов протонного насоса у здоровых добровольцев представлены в табл. 17-1.
Таблица 17-1. Фармакокинетика ингибиторов протонного насоса
 * В виде неактивных метаболитов.
* В виде неактивных метаболитов.
При повторных назначениях омепразола биодоступность его увеличивается от 35 до 60%. Отмечают значительное увеличение Сmax и AUC. Увеличение биодоступности омепразола некоторые исследователи объясняют тем, что при курсовом приёме, вследствие подавления кислотопродукции, кишечнорастворимые лекарственные формы могут разрушаться раньше.
Генетически обусловленные различия фармакокинетики ингибиторов протонного насоса
Блокаторы Н+-/К+-АТФазы - пролекарства, подвергающиеся метаболизму в печени, однако его метаболиты неактивны и выводятся из организма, а активная форма образуется только в секреторных
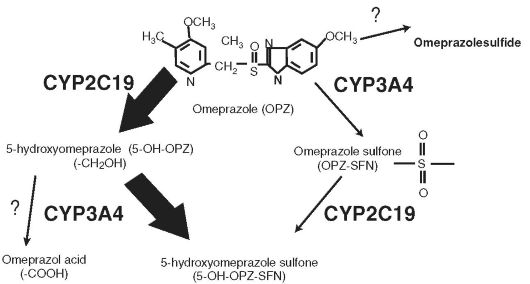 Рис. 17-1. Метаболизм омепразола
Рис. 17-1. Метаболизм омепразола
канальцах париетальных клеток. Поэтому, чем меньше препарата метаболизируется в печени, тем большее его количество попадет в париетальные клетки.
Большая часть омепразола метаболизируется с помощью CYP2C19 c образованием 5-гидроксиомепразола, меньшая часть - с помощью CYP3A4 с образованием омепразола сульфона. Оба метаболита превращаются в гидроксисульфон. Аффинность омепразола к CYP2C19 в 10 раз выше, чем к CYP3A4.
Существуют генетически обусловленные различия в активности CYP2C19. В соответствии с вариантами генотипа CYP2C19, различают три группы метаболизаторов: «экстенсивные» (ЕМ: «промежуточные» (IM: *1/*X) и «медленные» (PM: *X/*X); *1 и X - «дикий тип» и мутантный аллель соответственно. Фармакокинетика и фармакодинамика блокаторов Н+-/К+-АТФазы будет зависеть от скорости метаболизма. Концентрации ингибиторов протонного насоса и уровень защелачивания среды желудка при их применении будут более низкими у ЕМ, чем у IM, и ещё более низкими, чем у PM.
Известно, что омепразол образует два стереоизомера, активность которых в отношении протонного насоса одинакова. Доказано, что взаимодействие фермента и субстрата стереоселективно: S-изомер и R-изомер омепразола по-разному взаимодействуют с цитохромом
Р-450. Доля метаболизируемого CYP2C19 S-изомера существенно ниже (73%), чем R-изомера (98%). Поэтому концентрация S-изомера в крови в меньшей степени зависит от функциональной активности метаболизирующих систем печени и полиморфизма гена CYP2C19.
Был создан препарат эзомепразол (Nexium, AstraZeneca) на основе только S-изомера омепразола. Продемонстрирована большая его биодоступность (90%), по сравнению с омепразолом (30-40%). Стереоселективная зависимость фармакокинетики от полиморфизма гена CYP2C19 была показана и для лансопразола.
Метаболизм рабепразола в меньшей степени, чем у омепразола и лансопразола, зависит от полиморфизма гена CYP2C19, но эта зависимость также стереоселективна, более выражена у R-рабепразола. По другим данным, фармакокинетика рабепразола не зависит от генетического полиморфизма CYP2C19.
Фармакокинетика ингибиторов протонного насоса при кислотозависимых заболеваниях желудочно-кишечного тракта
Данные о фармакокинетике ингибиторов протонного насоса при заболеваниях желудочно-кишечного тракта немногочисленны и противоречивы. Трудности исследования фармакокинетики препаратов у гастроэнтерологических больных связаны с необходимостью быстрого назначения курсового приёма препаратов, с быстро и выраженно изменяющимися функциональными особенностями слизистых оболочек и клинико-физиологическим состоянием организма в целом. Проведение фармакокинетического исследования в промежутке времени, от момента установления диагноза «Обострение язвенной болезни» до назначения лечения, представляет собой огромную проблему, а проведение исследования биоэквивалентности препаратов практически невозможно. Поэтому в основном доступны данные о фармакокинетике блокаторов Н+-/К+-АТФазы у пациентов, не нуждающихся в экстренном назначении терапии: с гасродуоденитами, эзофагитами, ремиссией язвенной болезни. Так, существуют сведения, что у пациентов с эзофагитом увеличивается биодоступность и уменьшается выведение омепразола. По некоторым данным, у детей, страдающих гастроэзофагеальной рефлюксной болезнью, ускорена абсорбция омепразола.
В одном из исследований изучена фармакокинетика омепразола у 18 здоровых добровольцев и 12 больных с гастродуоденитом после
однократного перорального приёма препарата натощак в дозе 20 мг. Представленные в табл. 17-2 фармакокинетические параметры омепразола свидетельствуют о том, что на абсорбцию и фармакокинетику оказывает существенное влияние воспалительный процесс слизистой оболочки желудочно-кишечного тракта, поскольку фармакокинетические параметры препарата у больных с гастродуоденитом статистически достоверно отличаются от таковых у практически здоровых лиц: отмечено увеличение максимальной концентрации, площади под фармакокинетической кривой и снижение общего клиренса препарата, по сравнению со здоровыми добровольцами. Это свидетельствует об увеличении степени абсорбции омепразола у больных с гастродуоденитом.
Таблица 17-2. Фармакокинетические параметры препаратов омепразол
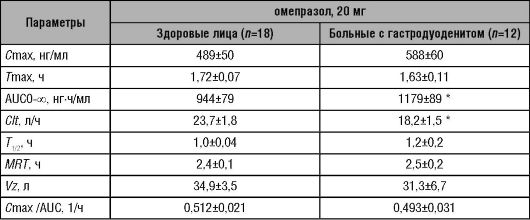 * - Статистически достоверные различия, по сравнению со здоровыми добровольцами.
* - Статистически достоверные различия, по сравнению со здоровыми добровольцами.
У значительной части пациентов с обострением язвенной болезни отмечают рефрактерность к применению первых доз препаратов. По некоторым данным, при приёме стандартных доз омепразола и лансопразола у лиц с дуоденальными язвами продолжительность антисекреторного эффекта препаратов не превышает 8 ч. Оказалось, что выраженное уменьшение продолжительности антисекреторного эффекта препаратов связано с уменьшением их биодоступности у данной категории лиц. Фармакокинетические параметры и данные мониторирования желудочного pH при приёме стандартной дозы лансопразола представлены на рис. 17-2 и в табл. 17-3.
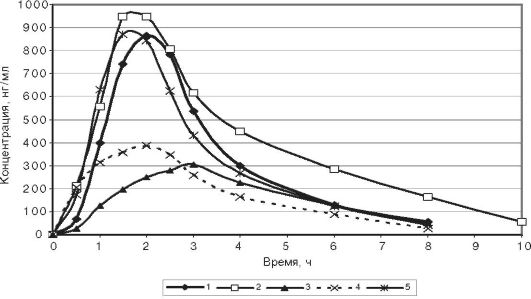 Рис. 17-2. Динамика
концентраций лансопразола в плазме здоровых лиц (1), больных
гастродуоденитом (2), язвенной болезнью двенадцатиперстной кишки в фазе
обострения (3), реконвалесценции менее 2 мес (4) и ремиссии (5)
Рис. 17-2. Динамика
концентраций лансопразола в плазме здоровых лиц (1), больных
гастродуоденитом (2), язвенной болезнью двенадцатиперстной кишки в фазе
обострения (3), реконвалесценции менее 2 мес (4) и ремиссии (5)
Таблица 17-3. Фармакокинетические параметры лансопразола
 * - Статистически достоверные различия по группам (p<0,05).
* - Статистически достоверные различия по группам (p<0,05).
При сопоставлении данных фармакокинетического и фармакодинамического исследования лансопразола и омепразола было продемонстрировано, что антисекреторный эффект препаратов у больных с обострением и непродолжительной ремиссией язвенной болезни развивается до достижения Cmax. При приёме 30 мг лансопразола у здоровых лиц Стах=1082±42 нг/мл достигалась через 2,0±0,1 ч; уровень pH >3 - через 2,3±0,8 ч, максимальный уровень pH - через 2,9±0,7 ч. У больных с обострением язвенной болезни двенадцатиперстной кишки повышение pH >3 наблюдалось через 1,4 ± 0,4 ч, pHmax - через 2,0±0,3 ч (до наступления Стах при концентрации препарата, равной 224 нг/мл), при этом Стах=443±51 ч наблюдалась через 2,5±0,3 ч. Обращало на себя внимание то, что при достижении Стах уровень pH начинал снижаться. От Стах зависела только продолжительность антисекреторного эффекта: у здоровых лиц она превышала 24 ч, у пациентов с обострением и непродолжительной ремиссией язвенной болезни она составляла 6,3±2,2 ч и 9,8±1,0 ч соответственно.
Было предположено, что возникновение ранней фазы антисекреторного эффекта лансопразола и низкая продолжительность действия его первых доз при обострении язвенной болезни двенадцатиперстной кишки связаны с частичным растворением препарата в кислой среде и его местным эффектом на слизистую оболочку желудка (не зависит от концентрации препарата в крови). При этом вероятность проникновения достаточного для адекватной блокады кислотопродукции количества частично растворённого вещества, быстро активирующегося при низких значениях pH, в секреторные канальцы париетальных клеток, практически равна нулю. Однако не исключена возможность действия на хеморецепторы слизистой оболочки желудка растворенного ингибитора протонного насоса, который быстро инактивируется в кислой среде (следовательно, снижается его биодоступность).
При производстве лекарственных форм ингибиторов протонного насоса (таблетки и пеллеты) используют различные кишечнорастворимые полимеры, от толщины и качества которых зависит эффективность контроля кислотообразования препаратом. Качество полимерного покрытия в данном случае - понятие, включающее устойчивость к пенетрации ионов водорода и сохранность при pH, равном 3 и 4. Ингибиторы протонного насоса могут частично растворяться даже в сильнокислой среде (допустимым считается растворение <10% вещества при pH=1,2). На фоне постоянного приёма препаратов, когда pH в желудке постоянно удерживается выше 3,
то вероятность раннего разрушения кишечнорастворимых лекарственных форм повышается. У гастроэнтерологических больных также дискоординирована секреторная и моторная деятельность желудка и тонкой кишки (высокая интенсивность желудочной кислотопродукции, декомпенсация ощелачивания в антральном отделе, удлинение сроков эвакуации желудочного содержимого, нарушение антродуоденального тормоза, патологическая эвакуация «вперёд», хроническое нарушение дуоденальной проходимости, еюнодуоденальный, дуоденогастральный рефлюксы). Всё это ведёт к высокоамплитудным колебаниям pH, которые могут приводить к растворению большего количества кишечнорастворимого препарата уже в желудке, кишечнорастворимая плёнка при этом должна обеспечивать сохранность доставки производных бензимидазола в двенадцатиперстную кишку. Таким образом, при подъёме pH во время дуоденогастрального рефлюкса может частично растворяться кишечнорастворимая оболочка, а при последующем закислении, более интенсивном при язвенной болезни, препарат активируется, образуя невсасывающийся сульфенамид.
При рассмотрении механизма превращения в активную форму производных бензимидазола говорят о двух сайтах протонирования их молекул, имеющих разные значения pKa. При приближении pH среды к более высокому щелочному значению происходит протонирование пиридинового кольца, что приводит к ускорению реакции во втором сайте, однако максимальной скорость этой реакции будет в среде с pH, близкой ко второму кислому значению
Таблица 17-4. pKa сайтов протонирования производных бензимидазола
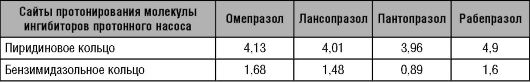 Можно
предположить, что при высокоамплитудных колебаниях pH последовательно
могут достигаться значения, приближенные к двух сайтов протонирования
молекул ингибиторов протонного насоса, что приводит к их активации уже в
просвете желудка.
Можно
предположить, что при высокоамплитудных колебаниях pH последовательно
могут достигаться значения, приближенные к двух сайтов протонирования
молекул ингибиторов протонного насоса, что приводит к их активации уже в
просвете желудка.
Растворённое в полости органа вещество теоретически может действовать на хеморецепторы. Хеморецепторную функцию слизистых оболочек гастродуоденального тракта связывают с утолщенными
микроворсинками на апикальной поверхности энтерохромаффинных клеток. Эти клетки синтезируют до 95% всего серотонина, который обладает эндокринными, паракринными и аутокринными свойствами. Аутокринное действие, в частности, заключается в саморегуляции образования серотонина по механизму положительной (с помощью 5-НТ3-рецепторов) и отрицательной обратной связи (с помощью 5-HT4-рецепторов).
Нутриенты, прежде чем подействовать на чувствительные окончания, адсорбируются на поверхности слизистых оболочек. До абсорбции они вызывают высвобождение молекул-мессенджеров (холецистокинина и серотонина) из энтероэндокринных клеток. Эти молекулы, в свою очередь, действуют на чувствительные окончания n. vagus, которые находятся в lamina propria.
Большинство EC-клеток тесно примыкает к нейронам. Действуя паракринно, серотонин влияет на серотониновые, в частности, 5-НТ3-рецепторы окончаний чувствительных нейронов.
Серотонин блокирует кислотопродукцию в желудке и усиливает образование слизи и бикарбонатов в желудке и кишечнике, участвует в репаративных процессах, действует на различные подтипы чувствительных окончаний n. vagus, а в эксперименте на животных показана его вероятная подавляющая роль в отношении гликопротеина P, субстрат которого - ингибиторы протонного насоса - принимает участие в возникновении висцеральной чувствительности, регулирует моторные (наиболее изученные) и секреторные процессы в желудочно-кишечном тракте. При язвенной болезни количество серотонина резко повышается.
Таким образом, нарушение всасывания и клинически значимое искажение основного фармакодинамического эффекта ингибиторов протонного насоса могут быть обусловлены влиянием неучитываемых патофизиологических факторов.
Целью нашего исследования влияния селективного ингибитора 5-НТ3-рецепторов гранисетрона на фармакодинамику и фармакокинетику омепразола была оценка вероятности участия серотонина в развитии антисекреторного эффекта омепразола у здоровых добровольцев и пациентов с язвенной болезнью с помощью метода клинико-фармакологического моделирования с медикаментозной блокадой положительной обратной связи механизма образования серотонина и передачи сигнала чувствительным окончаниям n. vagus. Мы провели двукратное мониторирование желудочного pH у здоровых добро-
вольцев и пациентов с непродолжительной (менее 2 мес) ремиссией язвенной болезни двенадцатиперстной кишки на фоне приёма 20 мг омепразола с предварительным (за 1 ч до исследования) применением 1 мг гранисетрона и без него.
Анализ результатов pH-метрии показал, что у добровольцев повышение внутрижелудочного pH после приёма омепразола наступает через 1,6±0,4 ч, а при предварительном применении гранисетрона - через 1,7±0,5 (p >0,05); в обоих случаях время сохранения pH≥3 превышало время суточного мониторирования pH. Таким образом, приём гранисетрона не оказывал существенного влияния на фармакодинамический эффект в пределах времени исследования. У пациентов с язвенной болезнью время наступления эффекта (повышение pH >3) было 1,19±0,37 без приёма гранисетрона и 2,88±0,79 с приёмом гранисетрона, p=0,0014. Мы учитывали, что у некоторых больных защелачивание происходило лишь на фоне приёма пищи, что говорило об отсутствии фармакологической блокады кислотопродукции. При подсчёте статистических параметров, тем не менее, 4 ч мы считали временем защелачивания у этих пациентов. Время восстановления гиперацидности от момента приёма омепразола составило 7,6±0,9 ч при приёме омепразола и 6,6±1,2 при приёме омепразола после гранисетрона; p=0,1269. Среднее время от момента повышения pH>3 до времени восстановления гиперацидности после приёма омепразола без гранисетрона и с ним составило соответственно 5,9±0,9 и 3,2±1,7; p=0,0054. Максимальный уровень pH в исследовании без гранисетрона был несколько выше, чем при его применении: соответственно 4,9±0,3 и 4,4±0,5; p=0,0455. Следует также отметить, что через 1 час после приёма стандартной дозы гранисетрона не наблюдалось достоверной динамики исходного уровня pH: он был равен 1,5±0,2 в обоих случаях. В целом можно констатировать, что у пациентов, предварительно принявших 1 мг гранисетрона, после приёма 20 мг омепразола повышение pH либо не происходит, либо происходит позже, чем в исследовании без гранисетрона, при этом время от момента приёма омепразола до восстановления гиперацидности не изменяется или уменьшается. Примеры вариантов динамики pH у больных на фоне применения омепразола с гранисетроном и без него представлены на рис. 17-3, 17-4 и 17-5.
Мы также изучали фармакокинетику омепразола в плазме крови здоровых добровольцев и пациентов с ремиссией продолжительностью не более 2 мес после однократного приёма внутрь 20 мг омепразола с предварительным применением 1 мг гранисетрона и без него
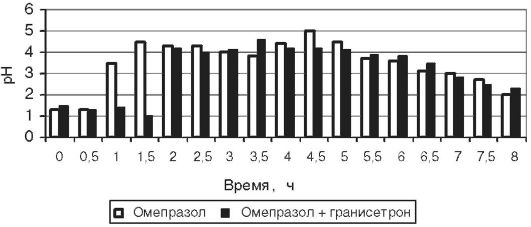 Рис. 17-3. Динамика внутрижелудочного pH у пациента Х на фоне применения 20 мг омепразола с предварительным приёмом 1 мг гранисетрона и без него
Рис. 17-3. Динамика внутрижелудочного pH у пациента Х на фоне применения 20 мг омепразола с предварительным приёмом 1 мг гранисетрона и без него
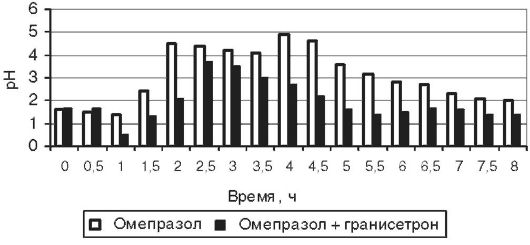 Рис. 17-4. Динамика внутрижелудочного pH у пациента Y на фоне применения 20 мг омепразола с предварительным приёмом 1 мг гранисетрона и без него
Рис. 17-4. Динамика внутрижелудочного pH у пациента Y на фоне применения 20 мг омепразола с предварительным приёмом 1 мг гранисетрона и без него
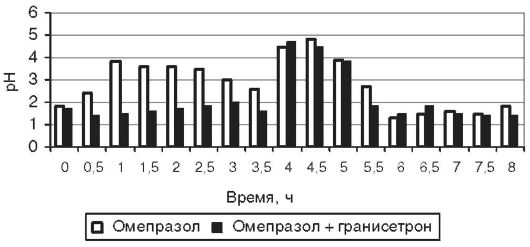 Рис. 17-5. Динамика внутрижелудочного pH у пациента Z на
фоне применения 20 мг омепразола с предварительным приёмом 1 мг
гранисетрона и без него; в исследовании с гранисетроном наблюдается
непродолжительное повышение pH после приёма пищи
Рис. 17-5. Динамика внутрижелудочного pH у пациента Z на
фоне применения 20 мг омепразола с предварительным приёмом 1 мг
гранисетрона и без него; в исследовании с гранисетроном наблюдается
непродолжительное повышение pH после приёма пищи
(рис. 17-6). Продемонстрировано, что профили фармакокинетических кривых у волонтеров и больных резко отличаются.
Анализ фармакокинетических параметров в исследованиях без применения гранисетрона показал, что у здоровых добровольцев и пациентов с язвенной болезнью двенадцатиперстной кишки имелись достоверные различия значений Cmax (639,8+155,7 и 299,0+64,7 нг/мл соответственно), AUC0-t (946,6+122,0 и 578,5+26,5 нгхч/мл соответственно), Clt (20,8+2,3 и 33,0+2,5 л/ч соответственно) и Vz (41,4+8,3 и 52,4+2,3 л соответственно),p < 0,01.
При предшествующем приёме гранисетрона у здоровых добровольцев и у пациентов с язвенной болезнью наблюдали противоположную динамику большинства фармакокинетических показателей; в первой группе биодоступность омепразола увеличивалась, во второй - снижалась. В обеих группах наблюдали уменьшение Tmax. Отмечено, что различную направленность вызванной блокатором 5-НТ3-рецепто- ров динамики основных фармакокинетических параметров наблюдали между группами, в которых описаны резко выраженные различия концентраций плазменного серотонина (5-НТ): в течение 1,5 ч после приёма 20 мг омепразола у здоровых добровольцев и у больных с непродолжительной ремиссией язвенной болезни концентрации серотонина в плазме крови изменялись от 9,26+2,14 до 12,78+2,86 нг/мл и от ≥152,25 до ≥200,75 нг/мл [Серотонин иммуноферментного анализа, - диагностической in vitro иммуноферментной тест-системы, Labor Diagnostika Nord GmbH & Co. KG, Nordhorn. Постановка иммуноферментного анализа ручная, результаты считываются аппаратом Alisey. Референтные значения 1,8-7,50 нг/мл, максимальная тестируемая концентрация серотонина - 208,30 нг/мл]. Значение этого фактора было продемонстрировано у единственного пациента с язвенной болезнью, у которого концентрация серотонина в плазме была 23,76 нг/мл: после применения гранисетрона биодоступность омепразола увеличилась также, как у здоровых лиц, но динамика фармакокинетических параметров была более выраженной (87,6 Δ% (Спгах); 286,6 Δ% (AUC0-t); -74,8 Δ% (Clt); 200 Δ% (Tl/2); 78,3 Δ% (MRT); -21,6 Δ% (Vz)). Можно предположить, что разнонаправленный эффект гранисетрона на биодоступность омепразола связан с тем, что разные концентрации серотонина могут действовать на различные подтипы рецепторов с возможным противоположным эффектом, что описано, например, для влияния этого медиатора на моторику желудочно-кишечного тракта.
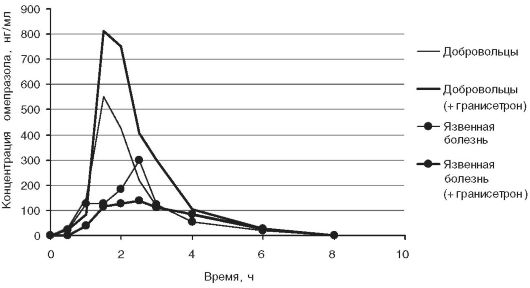 Рис. 17-6. Усреднённые
фармакокинетические кривые омепразола у волонтеров и у пациентов с
язвенной болезнью при исследовании на фоне предварительного приёма
гранисетрона и без него
Рис. 17-6. Усреднённые
фармакокинетические кривые омепразола у волонтеров и у пациентов с
язвенной болезнью при исследовании на фоне предварительного приёма
гранисетрона и без него
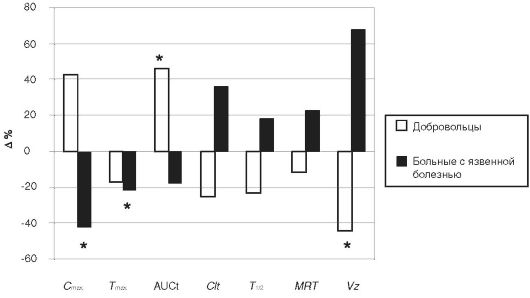 Рис. 17-7. Динамика
фармакокинетических параметров омепразола на фоне предварительного
применения гранисетрона у здоровых добровольцев и пациентов с язвенной
болезнью двенадцатиперстной кишки
Рис. 17-7. Динамика
фармакокинетических параметров омепразола на фоне предварительного
применения гранисетрона у здоровых добровольцев и пациентов с язвенной
болезнью двенадцатиперстной кишки
Снижение Cmax у пациентов с язвенной болезнью должно приводить к уменьшению количества заблокированных протонных помп, и этот показатель более важен, чем AUC, для прогностической оценки продолжительности антисекреторного эффекта омепразола, так как время полуэлиминации блокированных молекул фермента Н+/К+- АТФазы значительно превышает период полувыведения препарата. В этой исследуемой группе отрицательная динамика Сmax на фоне приёма гранисетрона определила ещё более выраженное уменьшение продолжительности антисекреторного эффекта омепразола.
При сопоставлении показателей времени достижения максимальной концентрации омепразола и времени повышения желудочного pH>3 у пациентов с язвенной болезнью было выявлено, что феномен раннего защелачивания внутрижелудочного pH (7max=2,3±0,3 ч; T↑pH>3=1,19±0,37 ч) не повторяется при применении гранисетрона, блокирующего механизм положительной обратной связи регуляции образования серотонина (7max=1,8+0,2 ч; T↑pH>3=2,88±0,79 ч), что позволяет предположить участие серотонина в развитии этого эффекта.
Фармакокинетика ингибиторов протонного насоса при заболеваниях кишечника
Имеются данные, что абсорбция омепразола снижается при резекции >50% тонкой кишки.
Фармакокинетика ингибиторов протонного насоса при заболеваниях печени
В исследовании с 14С-омепразолом было показано, что биодоступность препарата у больных с циррозом печени увеличивается до 100% (в контрольной группе она составила 56%), препарат обнаруживался в крови в течение 24 часов, T1/2=2,8 ч (у здоровых добровольцев - 0,7 ч).
Изучалась фармакокинетика омепразола у пациентов с циррозом печени, в зависимости от функционального класса заболевания (по Чайлд-Пью). Обнаружено, что период полувыведения препарата был значительно повышен (р <0,05) при циррозе печени классов A (2,38+0,16 ч), B (3,26+0,12 ч) и С (3,58+0,31 ч), по сравнению со здоровыми лицами (1,05+0,10 ч). Также выявлено двукратное повышение (р <0,05) AUC, а Cmax была достоверно повышена только у больных с циррозом печени класса C (400,40+27,89 нг/мл), по сравнению со здоровыми добровольцами (303,50+36,42 нг/мл). В то же время при при-
ёме эзомепразола у больных с циррозом печени AUC повышается на 76%, а T1/2 - на 29% только при наличии функционального класса C. Таким образом, если у всех больных с циррозом печени, независимо от функционального класса, доза омепразола должна быть снижена, то корректировать приём эзомепразола нужно только у больных с тяжё- лой печёночной недостаточностью (класс C по Чайлд-Пью). Однако некоторые авторы предупреждают о возможности неконтролируемого повышения концентрации эзомепразола вследствие нарушений метаболизма при циррозе печени, что увеличивает вероятность возникновения нежелательных явлений.
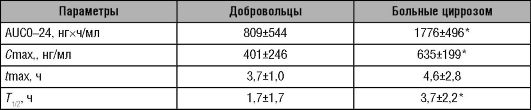
Изменения фармакокинетических параметров рабепразола при циррозе печени представлены в табл. 17-5.
Таблица 17-5. Показатели фармакокинетики у здоровых добровольцев (n=10) и больных циррозом печени (n=10) после однократного приёма рабепразола 20 мг
 * р < 0,05.
* р < 0,05.
Фармакокинетика ингибиторов протонного насоса при заболеваниях почек
У больных с почечной недостаточностью ингибиторы протонного насоса, выводящиеся посредством непочечных механизмов, имеют преимущества перед блокаторами Н2-рецепторов (выводятся почками), препаратами висмута, антацидами и сукральфатом (аккумуляция входящих в их состав катионов может увеличивать риск развития токсических реакций). Рабепразол, кроме независимости от энзиматических путей биотрансформации, имеет ещё одно преимущество, по сравнению с другими представителями группы Н+-/К+-АТФазы: он не вступает в фармакокинетическое взаимодействие с иммуносупрессорами, что имеет большое значение для пациентов с рядом тяжёлых почечных заболеваний.
Зависимость фармакокинетики ингибиторов протонного насоса от возраста
Необходимость и принципы применения ингибиторов протонного насоса в педиатрии определены недостаточно. Основная проблема - отсутствие лекарственных форм с малыми дозами препаратов, при этом дети испытывают трудности при проглатывании имеющихся кишечнорастворимых таблеток и капсул. Известно, что у детей наблюдают интенсивный метаболизм ингибиторов протонного насоса, максимальная их концентрация достигается через 1-3 ч, T1/2 - около 1 ч, а соотношение AUC у медленных и экстенсивных метаболизаторов составляет 6-10 ч.
В исследовании, проведённом у детей с симптомами гастроэзофагеальной рефлюксной болезни, показано, что фармакокинетика эзомепразола зависит от возраста пациента: чем младше ребёнок, тем выше скорость метаболизма эзомепразола (в пересчёте на 1 кг массы тела).
У пожилых пациентов генетически обусловленные различия метаболизма ингибиторов протонного насоса менее выражены: фармакокинетика омепразола у EM приближается к таковой у PM.
Таблица 17-6. Изменения фармакокинетики ингибиторов протонного насоса у пожилых пациентов, больных дисфункцией почек и печени (Swan S.K., Hoyumpa A.M., Merritt G.J., 1999)
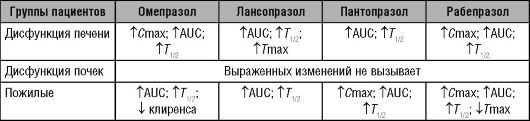 Этнически обусловленные изменения фармакокинетики ингибиторов протонного насоса
Этнически обусловленные изменения фармакокинетики ингибиторов протонного насоса
Соотношения быстрых, средних и медленных метаболизаторов в популяциях будут обусловливать этнические различия фармакокинетики ингибиторов протонного насоса. Количество слабых метаболизаторов (PM) CYP2C19 в европейской популяции составляет 3-5%,
в азиатской популяции - 13-23%, а среди, например, иорданских арабов - до 24,3%.
Фармакокинетическое взаимодействие с ингибиторами протонного насоса
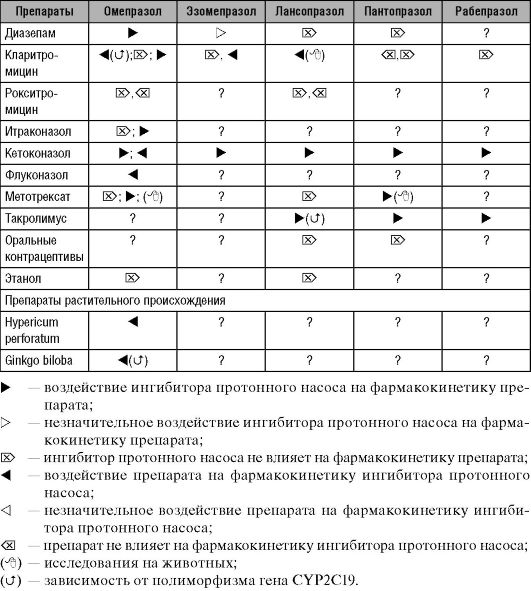
При совместном применении блокаторов Н+-/K+-АТФазы с препаратами других фармакологических групп может наблюдаться влияние на биодоступность друг друга вследствие изменений pH среды желудка, скорости транзита по тонкому кишечнику, влияния на системы биотрансформации и транспорта ксенобиотиков и другие физиологические механизмы, индивидуализирующие фармакокинетику взаимодействующих ЛС. Возможное искажение фармакокинетики препаратов, обладающих способностью кумулировать, малой широтой терапевтического действия и дозозависимыми нежелательными эффектами, должно быть изучено, описано в доступной литературе и учитываться в работе практикующего врача. Следует также оценивать потенциальный риск в связи с совместным приёмом препаратов, токсичность которых без учёта возможности индуцированного повышения биодоступности характеризуется как минимальная. Так, например, в ряде руководств рекомендуется и достаточно часто используется совместное использование ингибиторов протонного насоса с препаратами висмута, в норме практически не всасывающимися. При этом не учитывается, что ЛС данной фармакологической группы образуют защитную плёнку на поврежденных слизистых оболочках только при низких значениях pH, кроме того, было доказано, что омепразол усиливает абсорбцию тяжёлого металла висмута с увеличением его токсического потенциала. Сведения о фармакокинетических взаимодействиях с ингибиторами протонного насоса, в ряде случаев противоречивые и нуждающиеся в уточняющих исследованиях, представлены в табл. 17-7.
Таблица 17-7. Данные о фармакокинетическом взаимодействии блокаторов Н+-/К+-АТФазы с препаратами других фармакологических групп
 Окончание таблицы 17-7
Окончание таблицы 17-7
 Лекарственный
мониторинг ингибиторов протонного насоса, как достаточно безопасных
препаратов, в настоящее время не проводят. Тем не менее, при
необходимости (эрадикационная терапия инфекции Helicobacter pylori, синдром
Золлингера-Эллисона) рекомендуют увеличение суточной дозы препарата.
Признают, что возможно фармакокинетическое взаимодействие с блокаторами Н+-/К+-АТФазы, а у большой части больных с язвенной болезнью, нуждающихся в
Лекарственный
мониторинг ингибиторов протонного насоса, как достаточно безопасных
препаратов, в настоящее время не проводят. Тем не менее, при
необходимости (эрадикационная терапия инфекции Helicobacter pylori, синдром
Золлингера-Эллисона) рекомендуют увеличение суточной дозы препарата.
Признают, что возможно фармакокинетическое взаимодействие с блокаторами Н+-/К+-АТФазы, а у большой части больных с язвенной болезнью, нуждающихся в
срочном начале антисекреторной терапии, в первые дни применения ингибиторов протонного насоса она оказывается малоэффективной. При этом проведение фармакокинетического исследования и мониторирование внутрижелудочного pH у этих больных позволило бы оптимизировать режим дозирования препаратов, а анализ результатов исследований у большого количества пациентов позволил бы обеспечить более гибкий, рациональный и индивидуализированный подход к дозированию препаратов данной фармакологической группы, обеспечивающий преодоление рефрактерности к первым дозам.
Литература
Белоусов С.С., Муратов С.В., Ахмат А.М. Гастроэзофагеальная рефлюксная болезнь и дуоденогастральный рефлюкс. - Н. Новгород: Изд-во Нижегородской государственной медицинской академии, 2005. - 120 с.
Васильев Ю.В. Омепразол в терапии гастроэзофагеальной рефлюксной болезни и язвенной болезни желудка и двенадцатиперстной кишки // РМЖ. - 2007. - Т. 15.
Витебский Я.Д. Основы клапанной гастроэнтерологии. - Челябинск: Южно-Уральское книжное изд-во, 1999. - 303 с.
Волков А.И. Клинико-морфологические варианты прогнозирования течения и лечения хронических гастродуоденитов и язвенной болезни у детей: Дис. ... д-ра мед. наук. - М., 1986. - 307 с.
Ивашкин В.Т., Шептулин А.А. Перспективы применения блокаторов протонного насоса в гастроэнтерологии // Рус. мед. журн. Болезни органов пищеварения. - 2001. - Т. 3. - ? 1.
ГилманА.Г. КлиническаяфармакологияпоГудмануиГилману:В 4т.: Пер. с англ. - М.: Практика, 2006. - 520 с.
Комаров Ф.И., Рапопорт С.И., Малиновская Н.К. и др. Продукция мелатонина у больных язвенной болезнью двенадцатиперстной кишки в разные стадии течения заболевания // Клин. мед. - 1998. - ? 3. -
С. 15-18.
Кондратенко С.Н., Стародубцев А.К., Белякова Г.А. и др. ВЭЖХ определение, фармакокинетика и относительная биодоступность Омепразола-
Акри // Хим.-фарм. журн. - 2002. - Т. 36. - ? 10. - С. 49-50.
Макаров Ю.С. Суточное интрагастральное pH-мониторирование в оценке вариантов клинического течения язвенной болезни двенадцатиперстной кишки и антисекреторной активности ингибиторов протонного насоса: Дис. ... канд. мед. наук. - М., 2004. - 132 с.
Опарин А.Г., Опарин А.А. Эндотелиальная дисфункция в патогенезе язвенной болезни // Клин. мед. - 2002. - ? 1. - С. 53-54.
Охлобыстин А.В. Внутрижелудочная pH-метрия в оценке эффективности ингибиторов секреции НС1 у больных язвенной болезнью двенадцатиперстной кишки: Дис. ... канд. мед. наук. - М., 1996. - 239 с.
Раков А.Л., Макаров Ю.С., Горбаков В.В. и др. Сравнительная оценка антисекреторной активности фамотидина, омепразола и рабепразола (париета) при язвенной болезни, по данным суточного pH-монитори- рования // Воен.-мед. журн. - 2001. - ? 9. - С. 54-58.
Сацукевич В.Н., Сацукевич Д.В. Факторы риска осложнений гастродуоденальных язв. - М.: Либерея, 1999. - 416 с.
Сергеев П.В. Рецепторы. - Волгоград, 1999. - 640 с.
Сереброва С.Ю. Фармакокинетикаифармакодинамикалансопразола у пациентов с язвенной болезнью двенадцатиперстной кишки: Дис. ... канд. мед. наук. - М., 2002. - 146 с.
Симоненков А.П., Фёдоров В.Д., Клюжев В.М. и др. Уточнение классификации гипоксических состояний // Вестн. РАМН. - 2004. - ? 1. -
С. 46-48.
Ступин В.А., Силуянов С.В. Нарушения секреторной функции желудка при язвенной болезни // Рос. журн. гастроэнтерол., гепатол., колопроктол. - 1997. - Т. 7. - ? 4. - С. 23.
Сычёв Д.А., Раменская Г.В., Игнатьев И.В., Кукес В.Г. Клиническая фармакогенетика: учебное пособие / Под ред. В.Г. Кукеса, Н.П. Бочкова. -
М.: ГЭОТАР-Медиа, 2007. - 248 с.
Успенский В.М. Предъязвенное состояние как начальная стадияязвенной болезни двенадцатиперстной кишки (патогенез, клиника, диагностика, лечение, профилактика) // Тер. арх. - 1981. - Т. 53. - ? 2. -
С. 7-12.
Филимонов P.M., Широкова К.И. О значении дуоденогастрального рефлюкса жёлчи при язвенной болезни двенадцатиперстной кишки у подростков // Клин. мед. - 1981. - ? 3. - C. 56-57.
Abelo A., Andersson Т., Bredberg E. et al. Stereoselective metabolism by human liver CYP enzymes of a substituted benzimidazole // Drug Metab. Dispos. - 2000. - Vol. 28. - P. 58-64.
Andersson T., Cederberg C., Heggellund A., Lundborg P. The pharmacokinetics of single and repeated once-daily doses of 10, 20 and 40 mg omeprazole as enteric-coated granules // Drug Invest. - 1991. - Vol. 3. -P. 45-52.
Andersson T., Hassan-Alin M., Hasselgren G., Rhss K. Drug interaction studies with esomeprazole, the (S)-isomer of omeprazole // Clin.
Pharmacokinet. - 2001. - Vol. 40. - ? 7. - P. 523-537.
Andersson T., Olsson R., Regrdh C.G., Sknberg I. Pharmacokinetics of [14C]omeprazole in patients with liver cirrhosis // Clin. Pharmacokinet. - 1993, Jan. - Vol. 24. - ? 1. - P. 71-78.
Barclay M.L., Begg E.J., Robson R.A. et al. Lansoprazole pharmacokinetics differ in patients with oesophagitis compared to healthy volunteers // Aliment. Pharmacol. Ther. - 1999. - Vol. 13. - ? 9. - Р. 1215-1219.
Basic Science in Gastroenterology // Structure of the Gut / Ed. J.M. Polak, S.R. Bloom, N.A. Wright, M.J. Daly. - Glaxo Group Research Limited, Ware, Herts, U.K. Royal Postgraduate Medical School, 1982.
Battiston L., Tulissi P., Moretti M., Pozzato G. Lansoprazole and ethanol metabolism: comparison with omeprazole and cimetidine // Pharmacol. Toxicol. - 1997, Dec. - Vol. 81. - ? 6. - P. 247-252.
Berthoud H.R., Kressel M., Raybould H.E., Neuhuber W.L. Vagal sensors in the rat duodenal mucosa: distribution and structure as revealed by in vivo Di1- tracing // Anat. Embryol. (Berl.). - 1995. - Vol. 191. - Р. 203-212.
Bertilsson L., Tybring G., Widn J., Chang M. et al. Carbamazepine treatment induces the CYP3A4 catalysed sulphoxidation of omeprazole, but has no or less effect on hydroxylation via CYP2C19 // Br. J. Clin. Pharmacol. - 1997, Aug. - Vol. 44. - ? 2. - P. 186-189.
Bielefeldt K., Gebhart G.F. Pathophysiology of the Enteric Nervous System: a basis for understanding functional diseases. - USA, Nov. 2004. - 272 p.
Blume H., Donath F., Warnke A., Schug B.S. Pharmacokinetic drug interaction profiles of proton pump inhibitors // Drug Saf. - 2006. - Vol. 29. - ? 9. - P. 769-784.
Bttiger Y., Tybring G., Gtharson E., Bertilsson L. Inhibition of the sulfoxidation of omeprazole by ketoconazole in poor and extensive metabolizers of S-mephenytoin // Clin. Pharmacol. Ther. - 1997, Oct. - Vol. 62. - ? 4. -
P. 384-391.
Breedveld P., Zelcer N., Pluim D., Snmezer O. et al. Mechanism of the pharmacokinetic interaction between methotrexate and benzimidazoles: potential role for breast cancer resistance protein in clinical drug-drug interactions // Cancer Res. - 2004, Aug. 15. - Vol. 64. - ? 16. - P. 5804-
5811.
Brown A.S., James O.F. Omeprazole, ranitidine, and cimetidine have no effect on peak blood ethanol concentrations, first pass metabolism or area under the time-ethanol curve under «real-life» drinking conditions // Aliment. Pharmacol. Ther. - 1998, Feb. - Vol. 12. - ? 2. - P. 141-145.
Brunnel A., Mder K., Gpferich A. pH and Osmotic Pressure Inside Biogradable Micrispheres During Erosion // Pharm. Res. - 1999. - Vol. 16. - ? 6. - Р. 847-853.
Bubenik G.A., Pang S.F. The role of serotonin and melatonin in gastrointestinal physiology: ontogeny, regulation of food intake, and mutual serotoninmelatonin feed back // J. Pineal Res. - 1994. - Vol. 16. -
Р. 91-99.
Calabresi L., Pazzucconi F., Ferrara S. et al. Pharmacokinetic interactions between omeprazole/pantoprazole and clarithromycin in health volunteers //
Pharmacol Res. - 2004, May. - Vol. 49. - ? 5. - P. 493-499.
Capodicasa E., De-Bellis F., Pelli M.A. Effect of lansoprazole on human leukocyte function // Immunopharmacol. Immunotoxicol. - 1999. - Vol. 21. - ? 2. - P. 357-377.
Cederberg C., Andersson T., Skanberg I. Omeprazole: pharmacokinetics and metabolism in man // Scand. J. Gastroenterol. - 1989. - Vol. 166, suppl. -
P. 33-42.
Chan J. Acid-peptic therapy // Handbook of Clinical Drug Data. - 10th ed. / Eds P.O. Anderson, J.E. Knoben, W.G. Troutman. - Toronto: McGraw-
Hill, 2002. - P. 528-552.
Cianciolo G., Feliciangeli G., Comai G., Stefoni S. Protonic pump inhibitors in kidney transplant patients: efficacy and safety // Minerva Urol. Nefrol. -
2007, Jun. - Vol. 59. - ? 2. - P. 207-215.
Ciurzynska G., Dzierzkowska J., Maslinski S. Gastric cytoprotective activity of endogenous 5-HT // J. Physiol. Pharmacol. - 1994. - Vol. 45. - ? 4. -
Р. 517-532.
Dhasmana K.M., Zhu Y.N., Cruz S.L., Villaton C.M. Gastrointestinal effects of 5-hydroxytryptamine and related drugs // Life Sci. - 1993. - Vol. 53. -
Р. 1651-1661.
Dixit R.K., Chawla A.B., Kumar N., Garg S.K. Effect of omeprazole on the pharmacokinetics of sustained-release carbamazepine in healthy male volunteers // Methods Find. Exp. Clin. Pharmacol. - 2001, Jan. -Feb. -
Vol. 23. - ? 1. - P. 37-39.
Fegely K.A., Young C.J., Rege P.R., Rajabi-Siahboomi A.R. The Influence of Intermediate pH Gastric Media (In Vitro) on the Performance of Delayed Release Proton Pump Inhibitor Dosage Forms. AAPS Annual Meeting and Exposition. November, 2005.
Ferron G.M., Paul J.C., Fruncillo R.J. et al. Lack of pharmacokinetic interaction between oral pantoprazole and cisapride in healthy adults // J. Clin. Pharmacol. - 1999, Sep. - Vol. 39. - ? 9. - P. 945-950.
Fuchs W., Sennewald R., Klotz U. Lansoprazole does not affect the bioavailability of oral contraceptives // Br. J. Clin. Pharmacol. - 1994, Oct. -
Vol. 38. - ? 4. - P. 376-380.
Furuta T., Ohashi K., Kobayashi K. et al. Effects of clarithromycin on the metabolism of omeprazole in relation to C YP2C19 genotype status in humans // Clin. Pharmacol. Ther. - 1999, Sep. - Vol. 66. - ? 3. - P. 265-274.
Furuta T., Sugimoto M., Shirai N., Ishizaki T. CYP2C19 pharmacogenomics associated with therapy of Helicobacter pylori infection and gastro-esophageal reflux diseases with a proton pump inhibitor // Pharmacogenomics. - 2007, Sep. - Vol. 8. - ? 9. - P. 1199-1210.
Gershon M.D. Serotonin, its role and receptors in enteric neurotransmission. Kynirenine and Serotonergic Pathways (Schwarcz R., ed.) // Adv. Exp. Med.
Biol. - 1991. - Vol. 294. - P. 221-230.
Gidener S., Kalkan S., Kupelioglu A., Gure A. The effect of acute bilateral adrenalectomy on serotonin-induced inhibition of gastric acid secretion and acute gastric mucosal injury in rats // Int. J. Exp. Pathol. - 1996. - Vol. 77. - ? 4. - P. 163-166.
Gladziwa U., Koltz U. Pharmacokinetic optimisation of the treatment of peptic ulcer in patients with renal failure // Clin. Pharmacokinet. - 1994, Nov. - Vol. 27. - ? 5. - P. 393-408.
Gonlachanvit S., Fongkam P., Wittayalertpanya S., Kullavanijaya P. Red chili induces rectal hypersensitivity in healthy humans: possible role of 5HT-- 3 receptors on capsaicin-sensitive visceral nociceptive pathways // Aliment.
Pharmacol. Ther. - 2007. - Vol. 26. - ? 4. - Р. 617-265.
Grundy D., Al-Chaer E.D., Aziz O. et al. Fundamentals of Neurogastroenterology: Basic Science // Gastroenterology. - 2006. - Vol. 130. - Р. 1391-1411.
Gugler R., Hartmann M., Rudi J., Brod I. Lack of pharmacokinetic interaction of pantoprazole with diazepam in man // Br. J. Clin. Pharmacol. -
1996, Aug. - Vol. 42. - ? 2. - P. 249-252.
Gustavson L.E., Kaiser J.F., Edmonds A.L. et al. Effect of omeprazole on concentrations of clarithromycin in plasma and gastric tissue at steady
state // Antimicrob. Agents Chemother. - 1995, Sep. - Vol. 39. - ? 9. - P. 2078-2083.
Hartmann M., Huber R., Bliesath H. et al. Lack of interaction between pantoprazole and digoxin at therapeutic doses in man // Int. J. Clin. Pharmacol. Ther. - 1996, May. - Vol. 34. - ? 1. - Suppl. - P. S67-S71.
Higashi H., Nishi S. 5-Hydroxytryptamine receptors of visceral primary afferent neurons on rabbit nodose ganglia // J. Physiol. (Lond.). - 1982. -
Vol. 323. - Р. 543-567.
Hiraoka H., Kimura N., Furukawa Y., Ogawara K. et al. Up-Regulation of P-Glycoprotein Expression in Small Intestine under Chronic Serotonin-
Depleted Conditions in Rats // J. Pharmacol. Exp. Ther. - 2005. - Vol. 312. - ? 1. - P. 248-255.
Horn J. Review article: relationship between the metabolism and efficacy of proton pump inhibitors - focus on rabeprazole // Aliment. Pharmacol.
Ther. - 2004, Nov. - Vol. 20, suppl. 6. - P. 11-19.
Hoyumpa A, Trevino-Alanis H., Grimes I. etal. Rabeprazole: pharmacokinetics in patients with stable compensated cirrhosis // Clin. Ther. - 1999. - Vol. 21. - ? 4. - P. 691-701.
Huber R., Bliesath H., Hartmann M., Steinijans V.W. et al. Pantoprazole does not interact with the pharmacokinetics of carbamazepine // Int. J. Clin. Pharmacol. Ther. - 1998, Oct. - Vol. 36. - ? 10. - P. 521-524.
Huber R., Kohl B., Sachs G. et al. Review article: the continuing development of proton pump inhibitors with particular reference to pantoprazole // Aliment. Pharmacol. Ther. - 1995. - Vol. 9. - P. 363-378.
Hutchison T.A., Shahan D.R. // Drugdex system. - Vol. 116. Greenwood Village (CO): Micromedex; edition expires 2003.06.
Ishizaki T., Horai Y. Review article: cytochrome P450 and metabolism of proton pump inhibitors - emphasis on rabeprazole // Aliment. Pharmacol. Ther. - 1999. - Vol. 13, suppl. 3. - P. 27-36.
Ishizawa Y., Yasui-Furukori N., Takahata T. et al. The effect of aging on the relationship between the cytochrome P450 2C19 genotype and omeprazole pharmacokinetics // Clin. Pharmacokinet. - 2005. - Vol. 44. - ? 11. -
P. 1179-1189.
Itagaki F., Homma M., Yuzawa K. et al. Effect of lansoprazole and rabeprazole on tacrolimus pharmacokinetics in healthy volunteers with CYP2C19 mutations // J. Pharm. Pharmacol. - 2004, Aug - Vol. 56. - ? 8. - P. 1055-1059.
Iwakiri K., Kawami N., Tanaka Y. et al. Management of gastroesophageal reflux disease (GERD) with refractory to standard dose of proton pump
inhibitor // Nippon Rinsho. - 2007. - Vol. 65. - ? 5. - Р. 913-920.
Jaruratanasirikul S., Sriwiriyajan S. Effect of omeprazole on the pharmacokinetics of itraconazole // Eur. J. Clin. Pharmacol. - 1998, Apr. -
Vol. 54. - ? 2. - P. 159-161.
Johnson M.D., Hamilton C.D., Drew R.H. et al. A randomized comparative study to determine the effect of omeprazole on the peak serum concentration of itraconazole oral solution // J. Antimicrob. Chemother. - 2003, Feb. -
Vol. 51. - ? 2. - P. 453-457.
Jones H.M., Hallifax D., Houston J.B. Quantitative prediction of the in vivo inhibition of diazepam metabolism by omeprazole using rat liver microsomes
and hepatocytes // Drug Metab. Dispos. - 2004, May. - Vol. 32. - ? 5. - P. 572-580.
Kang B.C., Yang C.Q., Cho H.K. et al. Influence of fluconazole on the pharmacokinetics of omeprazole in healthy volunteers // Biopharm. Drug
Dispos. - 2002, Mar. - Vol. 23. - ? 2. - P. 77-81.
Kees F., Holstege A., Ittner K.P. et al. Pharmacokinetic interaction between proton pump inhibitors and roxithromycin in volunteers // Aliment.
Pharmacol. Ther. - 2000, Apr. - Vol. 14. - ? 4. - P. 407-412.
Kendall M.J. Review article: esomeprazole - the first proton pump inhibitor to be developed as an isomer // Aliment. Pharmacol. Ther. - 2003. - Vol. 17, suppl. 1. - P. 1-4.
Klotz U. Clinical impact of CYP2C19 polymorphism on the action of proton pump inhibitors: a review of a special problem // Int. J. Clin.
Pharmacol. Ther. - 2006. - Vol. 44. - ? 7. - Р. 297-302.
Kromer W., Kruger U., Huber R. et al. Differences in pH-dependent activation rates of substituted benzimidazoles and biological in vitro correlates //
Pharmacology. - 1998. - Vol. 56. - Р. 57-70.
Kumar R., Chawla Y.K., Garg S.K. et al. Pharmacokinetics of omeprazole in patients with liver cirrhosis and extrahepatic portal venous obstruction //
Methods Find. Exp. Clin. Pharmacol. - 2003. - Vol. 25. - ? 8. - P. 625.
Lefebvre R.A., Flouvat B., Karolac-Tamisier S. et al. Influence of lansoprazole treatment on diazepam plasma concentrations // Clin. Pharmacol. Ther. - 1992, Nov. - Vol. 52. - ? 5. - P. 458-463.
Lepard K.J., Chi J., Mohammed J.R. et al. Gastric antisecretory effect of serotonin: quantitation of release and site of action // Am. J. Physiol. - 1996. - Vol. 271. - ? 4. - Pt 1. - P. E669-E677.
Litalien C., Thort Y., Faure C. Pharmacokinetics of proton pump inhibitors in children // Clin Pharmacokinet. - 2005. - Vol. 44. - ? 5. - P. 441-466.
Majewski M., Jaworski T., Sarosiek I. et al. Significant enhancement of esophageal pre-epithelial defense by tegaserod: implications for an esophagoprotective effect // Clin. Gastroenterol. Hepatol. - 2007. - Vol. 5. - ? 4. - Р. 430-438.
Marier J.F., Dubuc M.C., Drouin E. et al. Pharmacokinetics of omeprazole in healthy adults and in children with gastroesophageal reflux disease // Ther.
Drug Monit. - 2004. - Vol. 26. - ? 1. - Р. 3-8.
Masa K., Arimori K., Nakayama T. et al. Effect of clarithromycin and other macrolides on the sulfoxidation and 5-hydroxylation of lansoprazole in dogs // Biol. Pharm. Bull. - 1999, May. - Vol. 22. - ? 5. - P. 504-509.
Middle M.V., Mller F.O., Schall R. et al. No influence of pantoprazole on the pharmacokinetics of phenytoin // Int. J. Clin. Pharmacol. Ther. - 1996, May. - Vol. 34. - ? 1. - Suppl. - P. S72-S75.
Miura M., Kagaya H., Tada H. et al. Enantioselective disposition of rabeprazole in relation to CYP2C19 genotypes // Br. J. Clin. Pharmacol. -
2006, Mar. - Vol. 61. - ? 3. - P. 315-320.
Miura M., Tada H., Yasui-Furukori N. et al. Pharmacokinetic differences between the enantiomers of lansoprazole and its metabolite, 5-hydroxylansoprazole, in relation to CYP2C19 genotypes // Eur. J. Clin.
Pharmacol. - 2004, Nov. - Vol. 60. - ? 9. - P. 623-628.
Oosterhuis B., Jonkman J.H., Andersson T. et al. Minor effect of multiple dose omeprazole on the pharmacokinetics of digoxin after a single oral dose // Br. J. Clin. Pharmacol. - 1991, Nov. - Vol. 32. - ? 5. - P. 569-572.
Ormsbee H.S. 3rd, Fondacaro J.D. Action of serotonin on the gastrointestinal tract // Proc. Soc. Exp. Biol. Med. - 1985. - Vol. 178. - ? 3. - P. 333-338.
Reid T., Yuen A., Catolico M., Carlson R.W. Impact of omeprazole on the plasma clearance of methotrexate // Cancer Chemother. Pharmacol. - 1993. - Vol. 33. - ? 1. - P. 82-84.
Reilly J.P. Safety profile of the proton-pump inhibitors // Am. J. Health Syst. Pharm. - 1999. - Vol. 56, suppl. 4. - P. s11-s17.
Schwrer H., Lorf T., Ringe B., Ramadori G. Pantoprazole and cyclosporine or tacrolimus // Aliment. Pharmacol. Ther. - 2001, Apr. - Vol. 15. - ? 4. - P. 561-562.
Severijnen R., Bayat N., Bakker H. et al. Enteral drug absorption in patients with short small bowel: a review // Clin. Pharmacokinet. - 2004. - Vol. 43. - ? 14. - P. 951-962.
Shilbayeh S., Tutunji M.F. Possible interethnic differences in omeprazole pharmacokinetics: comparison of Jordanian Arabs with other populations //
Clin. Pharmacokinet. - 2006. - Vol. 45. - ? 6. - P. 593-610.
Shimatani T., Kuroiwa T., Moriwaki M. et al. Acid-suppressiveeffectsofvarious regimens of omeprazole in Helicobacter pylori-negative CYP2C19 homozygous extensive metabolizers: which regimen has the strongest effect? // Dig. Dis.
Sci. - 2007. - Vol. 52. - ? 10. - Р. 2826-2832.
Sjovall H. et al. Pharmacokinetics of esomeprazole in patients with liver cirrhosis // Gastroenterology. - 2000. - Vol. 118. - ? 4. - Suppl. 2. -
P. A346.
Spnard J., Aumais C., Massicotte J. et al. Influence of omeprazole on bioavailability of bismuth following administration of a triple capsule of bismuth biskalcitrate, metronidazole, and tetracycline // J. Clin. Pharmacol. -
2004, Jun. - Vol. 44. - ? 6. - P. 640-645.
Stedman C.A.M., Barclay M.L. Review article: comparison of the pharmacokinetics, acid suppression and efficacy of proton pump inhibitors // Aliment. Pharmacol. Ther. - 2000. - Vol. 15. - ? 4. - P. 561-562.
Steinijans V.W., HuberR., Hartmann M., Zech K. Lack of pantoprazole drug interactions in man // Int. J. Clin. Pharmacol. Ther. - 1994, Aug. - Vol. 32. - ? 8. - P. 385-399.
Swan S.K., Hoyumpa A.M., Merritt G.J. Review article: the pharmacokinetics of rabeprazole in health and disease // Aliment. Pharmacol. Ther. - 1999. - Vol. 13, suppl. 3. - P. 11-17.
Tonini M. 5-Hydroxytryptamine effects in the gut: the 3, 4, and 7 receptors //
Neurogastroenterol. Motil. - 2005. - Vol. 17. - P. 637-642.
Treiber G., Walker S., Klotz U. Omeprazole-induced increase in the absorption of bismuth from tripotassium dicitrato bismuthate // Clin. Pharmacol. Ther. - 1994, May. - Vol. 55. - ? 5. - P. 486-491.
Vakily M., Amer F., Kukulka M.J., Andhivarothai N. Coadministration of lansoprazole and naproxen does not affect the pharmacokinetic profile of methotrexate in adult patients with rheumatoid arthritis // J. Clin.
Pharmacol. - 2005, Oct. - Vol. 45. - ? 10. - P. 1179-1186.
van Zanten S.V., Thompson K. Should the presence of polymorphisms of CYP2C19 enzymes influence the choice of the proton pump inhibitor for treatment of Helicobacter pylori infection? // Am. J. Gastroenterol. - 2006. - Vol. 101. - ? 7. - Р. 1476-1478.
Whelan J., Hoare D., Leonard P. Omeprazole does not alter plasma methotrexate clearance // Cancer Chemother. Pharmacol. - 1999. - Vol. 44. - ? 1. - P. 88-89.
Yacyshyn B.R., Thomson A.B.R. The Clinical Importance of Proton Pump Inhibitor Pharmacokinetics // Digestion. - 2002. - Vol. 66. - P. 67-78.
Yin O.Q., Tomlinson B., Waye M.M. et al. Pharmacogenetics and herbdrug interactions: experience with Ginkgo biloba and omeprazole // Pharmacogenetics. - 2004, Dec. - Vol. 14. - ? 12. - P. 841-850.
Zhao J., Li J., Hamer-Maansson J.E. et al. Pharmacokinetic properties of esomeprazole in children aged 1 to 11 years with symptoms of gastroesophageal reflux disease: a randomized, open-label study // Clin. Ther. -
2006, Nov. - Vol. 28. - ? 11. - 1868-1876.
Zhou G., Zhu B., Wu J. et al. St John's wort induces both cytochrome P450 3A4-catalyzed sulfoxidation and 2C19-dependent hydroxylation of
omeprazole // Clin. Pharmacol. Ther. - 2004, Mar. - Vol. 75. - ? 3. -
P. 191-197.