Клиническая фармакокинетика: теоретические, прикладные и аналитические аспекты: руководство / Под ред. В.Г. Кукеса. - 2009. - 432 с
|
|
|
|
ГЛАВА 13 ТЕРАПЕВТИЧЕСКИЙ МОНИТОРИНГ ЛЕКАРСТВЕННЫХ СРЕДСТВ
А.А. Игонин
Терапевтический лекарственный мониторинг - контроль над концентрацией ЛС в плазме крови с целью подбора индивидуального режима дозирования препарата.
Первые сообщения об успешном применении ТЛМ у больных эпилепсией возникли ещё в начале 70-х годов. Исследователи назначали, по их мнению, адекватную дозу препарата, однако обнаруживали большие индивидуальные вариации концентрации ЛС в крови. В работе предположили взаимосвязь данного феномена с особенностями абсорбции, распределения, метаболизма и элиминации препарата у разных пациентов. Следствием этого было обнаружение субтерапевтических и токсических значений концентрации противоэпилептических препаратов в крови у больных исследуемых групп. Динамическое изучение показателей концентрации ЛС позволило скорректировать режим дозирования и достичь терапевтического эффекта.
Таким образом, существует две основные предпосылки для проведения ТЛМ: повышение эффективности и безопасности фармакотерапии. Потребность в ТЛМ возникает в ситуациях, когда:
• ЛС обладает узкой терапевтической широтой;
• невозможно достичь терапевтического эффекта, используя известные схемы дозирования препарата;
• эффективность и безопасность препарата сложно оценить клиническими методами;
• содержание ЛС в крови достоверно коррелирует с эффектами препарата или способствует риску возникновения нежелательных лекарственных реакций;
• под влиянием индивидуальных особенностей пациента или патологии изменена фармакокинетика ЛС, снижена эффективность лечения или повышен риск нежелательных лекарственных реакций;
• препарат назначают длительный период времени.
Примером ситуаций, когда необходим ТЛМ, может быть лечение аминогликозидами при почечной недостаточности или назначение новокаинамида в качестве препарата с узким терапевтическим диапазоном (табл. 13-1).
Таблица 13-1. Основные группы лекарственных средств, при лечении которыми используют терапевтический лекарственный мониторинг
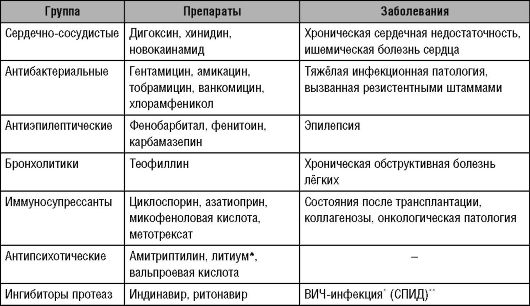 * - ВИЧ - вирус иммунодефицита человека.
* - ВИЧ - вирус иммунодефицита человека.
** - СПИД - синдром приобретённого иммунодефицита.
ТЛМ не проводят при лечении пролекарствами, так как обычно их концентрация не коррелирует с фармакологическими эффектами.
Например, нуклеозидные ингибиторы обратной транскриптазы переходят в активную форму путём внутриклеточного фосфорилирования. Внутриклеточная концентрация такой формы напрямую влияет на фармакодинамику препарата, но в настоящее время отсутствуют технические возможности для ТЛМ.
13.1. ВЫБОР ФАРМАКОКИНЕТИЧЕСКОГО ПАРАМЕТРА ДЛЯ ТЕРАПЕВТИЧЕСКОГО ЛЕКАРСТВЕННОГО
МОНИТОРИНГА
Правильный выбор фармакокинетического критерия для проведения ТЛМ до сих пор проблематичен. Даже для препаратов, уже давно внедрённых в клиническую практику, до сих пор не определён оптимальный критерий для мониторинга. Например, неясно, какой из фармакокинетических параметров наилучшим образом отражает отдалённый ответ на антиретровирусную терапию. Некоторые авторы показывают, что клинические эффекты ингибиторов протеаз зависят от длительности назначения и указывают на минимальную концентрацию, как на наиболее объективный параметр оценки вирусного ответа.
В то же время внедрение концепции фармакокинетического (фармакодинамического) анализа при оценке эффективности антибактериальных средств позволило выделить две большие группы препаратов, у которых антибактериальное действие зависит либо от концентрации, либо от времени экспозиции бактерий в среде с минимальной ингибирующей концентрацией ЛС. Активность аминогликозидов и фторхинолонов зависит от Qmax, а для β-лактамных антибиотиков важно время поддержания минимальной ингибирующей концентрации в крови. Другими словами, рациональная антибиотикотерапия и стратегия дозирования с помощью ТЛМ должна быть направлена или на увеличение максимальной концентрации до верхней границы терапевтического интервала (диапазон между минимальной эффективной концентрацией препарата в плазме и минимальной токсической концентрацией), или на максимально длительное поддержание пороговой концентрации ЛС в интервале между введениями. Максимальная концентрация гентамицина (10 мг/л) позволяет добиться выраженного бактерицидного эффекта. Традиционная схема дозирования по 1,5 мг/кг три раза в сутки не даёт подобной пиковой концентрации, в то же время доза 5-7 мг/кг однократно в сутки приводит к превышению максимальной кон-
центрации. Напротив, для ванкомицина предложено поддерживать минимальную концентрацию в крови, составляющую 5-10 мг/л, что в 2-4 раза выше МИК.
Несомненно, что для правильного ТЛМ нужны чётко определён- ные количественные фармакокинетические параметры с установленными референтными интервалами. На выбор критерия ТЛМ влияют физико-химические свойства веществ, входящих в состав готовой лекарственной формы, которые обусловливают характер взаимодействия с биологическим объектом.
13.2. ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ
Материалом для ТЛМ обычно служит цельная кровь или сыворотка. Если забор крови затруднён, то проводят определение несвязанной фракции препарата в слюне. На результаты исследований, несомненно, влияет время и частота забора материала. При анализе важно установить зависимость между концентрацией препарата и его эффектом. Для некоторых препаратов минимальную концентрацию измеряют в конце интервала дозирования (противоэпилептические средства); для антибактериальных препаратов важны пиковые значения концентрации и продолжительность их пребывания в области, превышающей МИК (табл. 13-2).
Таблица 13-2. Некоторые ключевые факторы, способные повлиять на интерпретацию результатов терапевтического лекарственного мониторинга
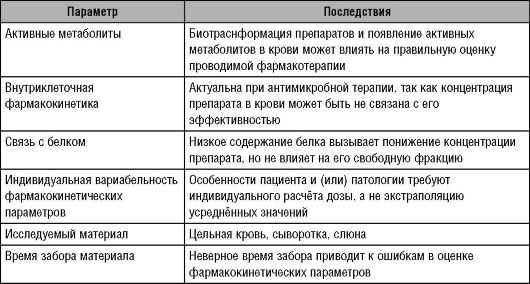 Правильное
время забора образцов очень важно для ТЛМ, так как неправильный расчёт
ведет к ошибкам в анализе и к снижению эффективности метода. При
длительном лечении образцы крови забирают с момента достижения
равновесной концентрации препарата, т.е. примерно через четыре периода
полувыведения. Таким образом, минимальную концентрацию измеряют в
образце, полученном за 30 мин до введения следующей поддерживающей дозы.
Правильное
время забора образцов очень важно для ТЛМ, так как неправильный расчёт
ведет к ошибкам в анализе и к снижению эффективности метода. При
длительном лечении образцы крови забирают с момента достижения
равновесной концентрации препарата, т.е. примерно через четыре периода
полувыведения. Таким образом, минимальную концентрацию измеряют в
образце, полученном за 30 мин до введения следующей поддерживающей дозы.
Особенности фармакокинетики конкретного ЛС существенно влияют на стратегию ТЛМ. При регулярной терапии нелфинавиром концентрация его в плазме из-за отсроченной абсорбции может снижаться ещё в течение 1-2 ч после очередного приёма препарата. В результате минимальная концентрация не будет чётко воспроизводиться на протяжении всего времени лечения, что необходимо учитывать при интерпретации результатов.
При исследовании препаратов с коротким периодом полувыведения мониторинг осуществляют по максимальной концентрации, так как минимальное содержание ЛС определить невозможно. Период полувыведения рифампицина составляет 1-4 ч, а пиковую концентрацию обнаруживают через 2 ч, но если пациент страдает мальабсорбцией или всасывание замедлено по другим причинам, то только повторные заборы крови через 6 ч позволят правильно определить пиковую концентрацию препарата.
Объём распределения также может влиять на правильную интерпретацию данных. Дигоксин относят к препаратам, наиболее часто мониторируемым в рутинной практике. Необходимо помнить, что его распределение занимает достаточно большой промежуток времени, поэтому преждевременный анализ может отражать завышенную концентрацию, по сравнению с равновесной (Css = 8 - 2 мг/л через 6 ч после введения).
13.3. ОЦЕНКА ЭФФЕКТИВНОСТИ ВЫБРАННОГО РЕЖИМА
ДОЗИРОВАНИЯ
Конечная цель ТЛМ - создание минимальной эффективной концентрации препарата в крови путём подбора дозы.
При необходимости длительной фармакотерапии (например, при лечении иммуносупрессантами или у больных, находящихся на хроническом гемодиализе), адекватная корректировка дозы без ТЛМ крайне затруднительна (табл. 13-3). Один из подходов к лечению
респираторных обострений муковисцидоза - непрерывная инфузия антисинегнойных β-лактамных антибиотиков. Адекватная доза препарата позволяет достичь его концентрации в крови, превышающей минимальную подавляющую концентрацию в 4-5 раз. Показано, что у пациентов с муковисцидозом объём распределения и общий клиренс β-лактамов (за счёт почечного компонента) может быть больше, чем у здоровых субъектов. Только в высоких дозах антибиотик способен проникнуть через слизистый барьер, окружающий микроколонии Pseudomonas aeruginosa (синегнойная палочка), и диффундировать в гнойные полости в лёгких. Доза цефтазидима для инфузионной терапии, составляющая 100 мг/кг массы тела пациента в сутки, позволяет достичь средней концентрации в крови около 29 мг/л, что в семь раз выше минимальной подавляющей концентрации синегнойной палочки. Однако общая концентрация цефтазидима в крови при муковисцидозе вдвое ниже, чем у здоровых добровольцев.
Таблица 13-3. Особенности терапевтического лекарственного мониторинга некоторых наиболее распространённых препаратов
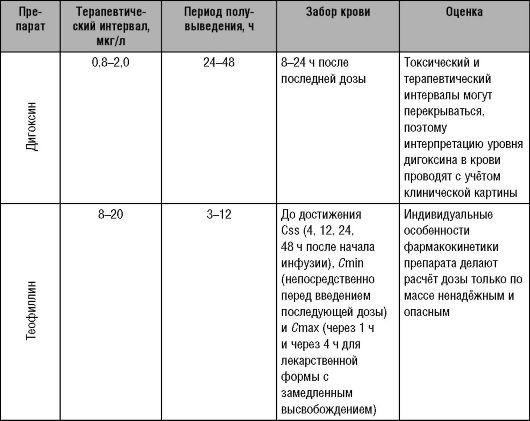 Окончание таблицы 13-3
Окончание таблицы 13-3
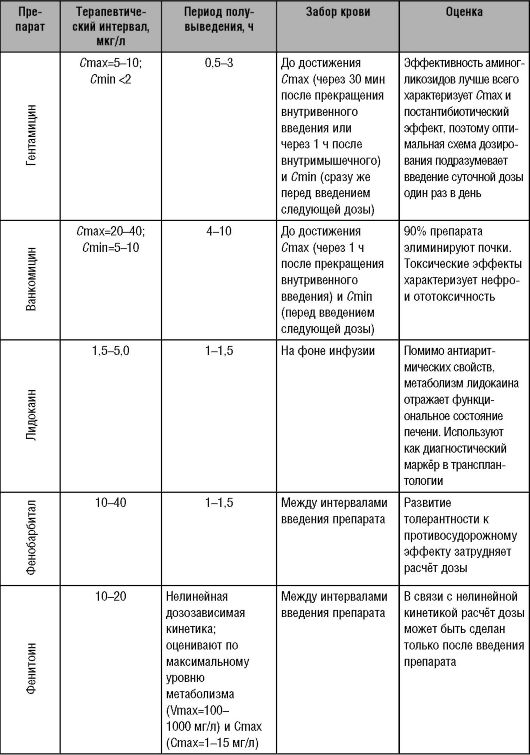 Таким
образом, изменение дозы ЛС не ведёт к значимому изменению
фармакокинетики и выраженности фармакологических эффектов. С другой
стороны, «слепой» подбор повышает вероятность нежелательных
лекарственных реакций (особенно у больных с нарушением функций печени и
почек при узкой терапевтической широте препарата), что делает ТЛМ
незаменимым методом подбора адекватного режима дозирования.
Таким
образом, изменение дозы ЛС не ведёт к значимому изменению
фармакокинетики и выраженности фармакологических эффектов. С другой
стороны, «слепой» подбор повышает вероятность нежелательных
лекарственных реакций (особенно у больных с нарушением функций печени и
почек при узкой терапевтической широте препарата), что делает ТЛМ
незаменимым методом подбора адекватного режима дозирования.
Правильное применение ТЛМ требует не просто механического измерения концентрации ЛС, а подразумевает динамическое наблюдение (начиная с введения первой дозы препарата) и оценку результатов исследований с учётом патологии, индивидуальных особенностей пациента и сопутствующего лечения. При интерпретации данных необходимо принимать во внимание время забора образцов, дозу препарата, время достижения равновесной концентрации ЛС и клинические эффекты лечения. По результатам ТЛМ подбирают дозу, позволяющую добиться оптимального соотношения между эффективностью и безопасностью.
Литература
Burger D et al. TDM of NFV and INV in treatment native patients: results from ATHENA. 1st IAS Conference on HIV Pathogenesis and Treatment Argentina. - 2001.
Fletcher C.V., Kawle S.P., Kakuda T.N. et al. Zidovudine triphosphate and lamivudine triphosphate concentration-response relationships in HIVinfected persons // AIDS. - 2000. - Vol. 29. - ? 14(14). - P. 2137-2144.
Sadler B.M., Gillotin C., Lou Y. et al. Pharmacokinetic study of human immunodeficiency virus protease inhibitors used in combination with amprenavir // Antimicrob. Agents Chemother. - 2001. - Vol. 45. - ? 12. - P. 3663-3668.
Anderson P.L., Brundage R.C., Kakuda T.N., Fletcher C.V. CD4 response is correlated with peak plasma concentrations of indinavir in adults with undetectable human immunodeficiency virus ribonucleic acid // Clin.
Pharmacol. Ther. - 2002. - Vol. 71. - ? 4. - P. 280-285.
Peloquin C.A. Therapeutic drug monitoring in the treatment oftuberculosis //
Drugs. - 2002. - Vol. 62. - ? 15. - P. 2169-2183.