Клиническая фармакокинетика: теоретические, прикладные и аналитические аспекты: руководство / Под ред. В.Г. Кукеса. - 2009. - 432 с
|
|
|
|
ГЛАВА 9 ОСОБЕННОСТИ ФАРМАКОКИНЕТИКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРИ ЗАБОЛЕВАНИЯХ ПОЧЕК И У БОЛЬНЫХ НА ГЕМОДИАЛИЗЕ
Н.Г. Бердникова
9.1. ФАРМАКОКИНЕТИЧЕСКИЕ ОСОБЕННОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРИ ПОЧЕЧНОЙ
НЕДОСТАТОЧНОСТИ
Почечная недостаточность влияет на лекарственное распределение, уменьшая системный клиренс, почечное выведение, связь с белками и распределение в тканях. Кроме того, воздействует на выведение ЛС и внепочечное распределение ЛС, метаболизирующихся печенью. Хотя снижение почечных метаболических ферментов при ПН ответственно за уменьшение лекарственного клиренса, но всё же больший вклад вносят изменения в транспортных системах. Если почки выводят активный препарат в неизменённом виде, то необходимо провести коррекцию дозы препарата в зависимости от уровня функционирования почек, особенно для ЛС с низким терапевтическим индексом.
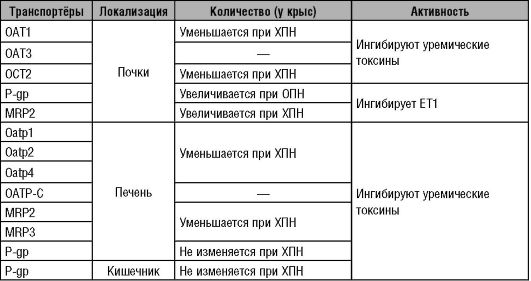
При ПН происходит накопление продуктов - уремических токсинов, обычно устраняемых почками. Уремические токсины у больных с ХПН вызывают тромбоцитарную дисфункцию, гипертонию, сердечную недостаточность, дефектную связь белка с ЛС, нарушения в щитовидной железе, ингибирование метаболизма в печени, неврологическую симптоматику. Органические анионы - индоксил сульфат (IS), 3-карбокси-4-метил-5-пропил-2-фуранпропаноиновая кислота (CMPF), индолацетат (IA) и гипуровая кислота (НА) накапливаются в плазме при ХПН. Гипуровая кислота ингибирует переработку глюкозы в мышцах. Повышение уровня гипуровой кислоты коррелирует с неврологической симптоматикой у больных с ХПН, и она, также как и CMPF вызывает повышение уровня, который ассоциируют не только с неврологической дисфункцией, но и с нарушениями функции щитовидной железы. Показано, что CMPF, фуран вместе с другими уремическими токсинами, блокирует связь ЛС с белками и их канальцевую экскрецию. Накопление уремических токсинов усугубляет течение ПН. Это подтверждают работы на лабораторных животных (табл. 9-1).
Таблица 9-1. Изменение транспортёров при ПН
 С
развитием ПН количество транспортных систем уменьшается, а уремические
токсины ингибируют почечную экскрецию различных ЛС и эндогенных
органических кислот путём блокирования ОАТ. ПН влияет на все фазы
метаболизма как печёночного, так и почечного.
С
развитием ПН количество транспортных систем уменьшается, а уремические
токсины ингибируют почечную экскрецию различных ЛС и эндогенных
органических кислот путём блокирования ОАТ. ПН влияет на все фазы
метаболизма как печёночного, так и почечного.
• Фаза I метаболизма в печени. ПН ассоциирует со снижением активности и экспрессии Р-450 вторично за счёт снижения mRNA.
• В почках изоферменты Р-450 (1А1, 1А2, 2Е1) находятся в проксимальных почечных канальцах, поскольку количество их невелико, то они не вносят клинически значимого вклада в метаболизм ЛС. Фаза II метаболизма-глюкуронирование и ацетилирование. Уремические токсины угнетают глюкуронирование и ацетилирование даже при сохранённой функции Р-450. Для ЛС с низким метаболизмом (например, эпросартан, розувастатин) это имеет огромное значение. Следует отметить, что в почках происходит глюкуронирование таких ЛС как парацетамол, зидовудин (азидотимидин♠), морфин, сульфаниламиды, фуросемид, хлорамфеникол.
Показано, что уремические токсины угнетают следующие транспортные системы: ОАТ1, ОАТ3, ОАТр2, ОАТР-С. В экспериментальных работах на крысах было показано, что уремические токсины CMPF и IS ингибируют ОАТР2 и hOАТР-С гепатоцитов. Содержание этих белков значительно меньше при ХПН. Кроме того, уремические токсины при ХПН уменьшают активность эффлюксного кишечного транспортёра P-gp. Показано, что у крыс при ХПН происходит угнетение P-gp и MRP2 в кишечнике, в то время как ОАТр2 и ОАТр3 остаются неизмёнными, т.е. инфлюксный механизм преобладает над эффлюксным. Кроме того, у крыс при ХПН происходит увеличение уровня MRP2 в почках и MRP3 в печени, что может служить серьёзным защитным механизмом. Ингибирование транспортёров ведёт к неблагоприятным взаимодействиям. Уремические токсины ингибируют почечное выведение большинства ЛС. ОАТ1 и ОАТ3 выводят эти уремические токсины, но сами токсины ингибируют транспортёры (см. табл. 9-1). Было предложено использовать эндотелеин 1 (ЕТ1) как маркёр уремического токсина. ЕТ1 значительно снижает транспорт циклоспорина и метотрексата, так как подавляет их транспортёры - P-gp и MRP2. При ПН количество ЕТ1 увеличивается. ЕТ1 индуцирует ингибирование эффлюксных транспортёров, ответственных за выведение циклоспорина, цисплатина, радиоконтрастных веществ, считающихся нефротоксичными.
9.1.1. Печёночный клиренс у пациентов с почечной недостаточностью
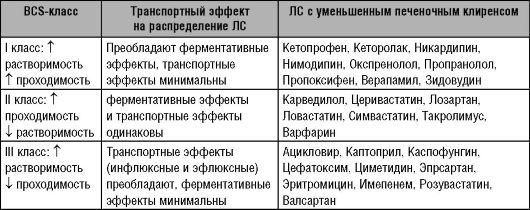
Многие ЛС, элиминирующиеся печенью, демонстрируют уменьшение выведения у пациентов с ПН, что невозможно объяснить уменьшением ренального клиренса. Ву и Бенет (2005) предложили классификацию ЛС, в зависимости от их растворимости и проходимости
[Biopharmaceutics Classification System (BCS)]. Данная классификация может помочь определить путь элиминации ЛС, эффект эффлюксных и инфлюксных транспортёров при всасывании и распределении ЛС, в зависимости от пути введения.
Использование этой системы классификации может быть полезным в понимании и предсказании механизмов уменьшенного печё- ночного клиренса при ПН.
Таблица 9.2. BCS-классификация ЛС со сниженным печеночным клиренсом у пациентов с ПН
 Использование
этой системы может быть полезным в понимании и предсказании механизмов
уменьшенного печеночного клиренса при почечной недостаточности.
Использование
этой системы может быть полезным в понимании и предсказании механизмов
уменьшенного печеночного клиренса при почечной недостаточности.
Согласно BCS-системе, класс I ЛС экстенсивно метаболизируется в печени, а роль транспортёров вообще незначительна. Следовательно, при почечной недостаточности уменьшение печеночного клиренса этих ЛС, типа пропранолола, верапамила, имодипина (см. таб. 9.2) наиболее вероятно произошло бы из-за уменьшенной деятельности фермента. Изменения в деятельности транспортёра не затронули бы печёночого клиренса этого класса ЛС. ЛС класса II также экстенсивно метаболизируются, но роль эфлюксных и инфлюксных транспортёров также важна для печёночной элиминации. Следовательно, уменьшение печёночной элиминации ЛС, типа церивастатина, ловастатина может произойти из-за изменений в транспортёрах и в деятельности фермента, и в результате взаимодействия фермента и транспортёра, печёночная элиминация может быть изменена, даже когда нет почечной недостаточности. Для ЛС класса III, типа эпростан, розувастатин, где важны эффлюксные и инфлюксные транспортёры для элиминации ЛС, уменьшение печёночного
(жёлчного) клиренса произошло бы из-за уменьшенной функции транс- портёров, без заинтересованности метаболических ферментов.
Так как ФК многих ЛС изменяется при почечной недостаточности, то необходимо использовать три правила: 1) использовать препараты с внепочечным выведением; 2) использовать номограммы, руководства, рекомендации по выбору доз; 3) использовать лекарственный мониторинг. Номограммы составлены с учетом уровня креатинина в сыворотке крови, массы тела и роста больного. Определив клиренс, врач пользуется соответствующими рекомендациями по дозированию и/или кратности назначения соответствующего препарата.
При ПН корректировку режима дозирования осуществляют с помощью расчёта клиренса эндогенного креатинина (С/кр). В норме клиренс эндогенного креатинина составляет 80-120 мл/мин. При ПН снижение доз используемых препаратов более эффективно, чем удлинение интервалов введения, так как в крови длительно поддерживается низкая концентрация препарата. Функциональное состояние почек необходимо учитывать при применении ЛС, имеющих узкий терапевтический коридор - аминогликозиды, СГ, аминофиллин (эуфиллин*), антикоагулянты, новокаин. Необходимо подбирать дозы пожилым пациентам со сниженной массой тела. У таких пациентов ориентируются на скорость клубочковой фильтрации, так как содержание креатинина в сыворотке может быть нормальным. При нарушении функции почек выведение метаболитов ЛС может быть ускорено, так как при ПН количество несвязанного препарата с белками плазмы возрастает. Возможно, быстрое выведение ЛС при ХПН связано с ускорением метаболизма в печени. На связь ЛС с белками плазмы также влияет гипоальбуминемия, непосредственно изменение структуры альбуминов, а также соединения, мешающие связыванию препарата с белками плазмы. Факторы, определяющие реакцию на ЛС при ПН:
• степень нарушения функции почек;
• токсичность препарата;
• пути метаболизма ЛС;
• фармакокинетика;
• зависимость эффекта от дозы.
9.1.2. Коррекция дозы лекарственных средств при почечной недостаточности
Индекс fu - фракция ЛС, выводимая почками в неизменённом виде; fu=1, если почки выводят препарат полностью; fu=0, если почки
не выводят препарат. Для коррекции дозы ЛС при ПН необходимо:
• проверить значение fu препарата или его активного метаболита, выводимого через почки в неизменённом виде;
• рассчитать Cl креатинина (Cr) по формуле Коккрофта-Голта с учётом массы тела, возраста и пола больного:
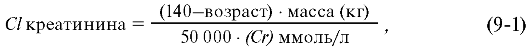 У женщин показатель Cl креатинина
умножают на 0,85, так как мышечная масса меньше. Необходимо вычислить
массу тела в норме, если у пациента ожирение. При расчёте в единицах
мл/мин нужно 50 000 заменить на 815. Формула неприменима к детям до 12
лет. В норме Cl креатинина Cr >1,5 мл/с; если Cr <0,06
ммоль/л, то необходимо подставить Cr=0,06. У пожилых пациентов почечный
клиренс более медленный. Следовательно, клиренс препаратов с высоким
индексом fu уменьшается с возрастом. В формуле учитывают, что
пожилые пациенты могут иметь маленький показатель клиренса креатинина
при нормальном уровне креатинина в сыворотке.
У женщин показатель Cl креатинина
умножают на 0,85, так как мышечная масса меньше. Необходимо вычислить
массу тела в норме, если у пациента ожирение. При расчёте в единицах
мл/мин нужно 50 000 заменить на 815. Формула неприменима к детям до 12
лет. В норме Cl креатинина Cr >1,5 мл/с; если Cr <0,06
ммоль/л, то необходимо подставить Cr=0,06. У пожилых пациентов почечный
клиренс более медленный. Следовательно, клиренс препаратов с высоким
индексом fu уменьшается с возрастом. В формуле учитывают, что
пожилые пациенты могут иметь маленький показатель клиренса креатинина
при нормальном уровне креатинина в сыворотке.
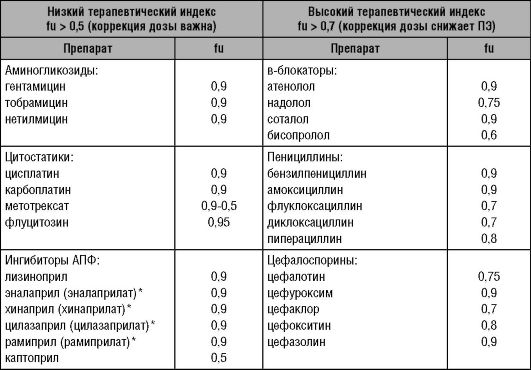
Таблица 9-3. Препараты, требующие коррекции дозы при ПН
 Окончание таблицы 9-3
Окончание таблицы 9-3
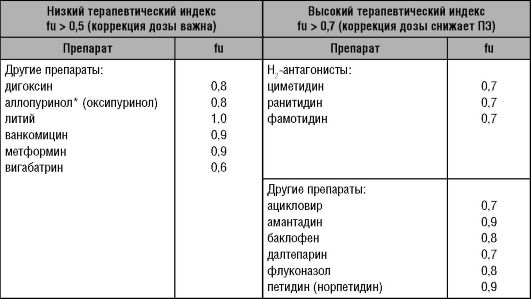 * - метаболит с высоким fu.
* - метаболит с высоким fu.
Для препаратов, выводящихся через почки в неизмененном виде, следует использовать формулу, где fu близко к 1:
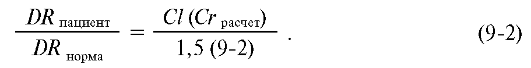 При этом уменьшение дозы, принимаемой в единицу времени, обозначают DR (dose-rate).
При этом уменьшение дозы, принимаемой в единицу времени, обозначают DR (dose-rate).
При условии, что препарат выводится не только через почки в неизмененном виде, необходимо корректировать дозу только той части препарата, которая выводится в неизмененном виде ( fu). Общая формула, в которой учитывается fu, метаболизируемая фракция (1 - fu) и уровень функционирования почек, т.е. для 0,5 < fu <1:
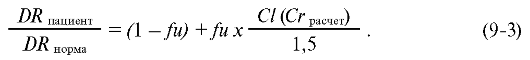 Это
особенно важно для препаратов с низким терапевтическим индексом. При
тяжёлой ПН не рекомендуют антимикробные препараты, которые
преимущественно выводят почки. Если всё же их исполь-
Это
особенно важно для препаратов с низким терапевтическим индексом. При
тяжёлой ПН не рекомендуют антимикробные препараты, которые
преимущественно выводят почки. Если всё же их исполь-
зуют, то перед введением каждой дозы нужно определить уровень препарата в крови. Антимикробную терапию при быстром нарастании ПН, тяжёлой уремии, диализе нельзя корректировать по уровню креатинина, а также необходимо следить за концентрацией антибиотика в крови. Антимикробные препараты, выводимые почками и печенью при лёгкой и умеренной ПН (уровень креатинина сыворотки ниже 3 мг%), назначают в обычных дозах. При умеренной и тяжёлой ПН увеличивают интервалы между введениями. При тяжёлой ПН противопоказан нитрофурантоин и все тетрациклины (кроме, доксициклина); не рекомендуют сульфаниламиды и аминосалициловую кислоту. В качестве профилактики острой почечной недостаточности (ОПН) неэффективны и даже вредны петлевые диуретики, агонисты дофаминовых рецепторов, натрийуретические пептиды, антагонисты аденозина (теофиллин), а также антагонисты кальция.
9.2. НЕФРОТОКСИЧНОСТЬ
В последние годы привлекают внимание неиммунные механизмы повреждения почек, среди которых не последнее место занимают воздействия лекарственных веществ. ЛС наиболее часто вызывают изменения интерстициальной ткани почек, которые почти в трети случаев сопровождаются образованием гранулём. Реже встречают минимальные изменения, мембранозный нефрит и другие варианты поражения почек. Основные факторы, вызывающие острый лекарственный нефрит - аминогликозиды и нестероидные противовоспалительные средства НПВС, реже - другие ЛС (бета-лактамные антибиотики, сульфаниламиды, тиазидные диуретики, тетрациклины, циметидин и т.д.). Нефротоксичность аминоликозидов возникает при поражении эпителия проксимальных по - чечных канальцев и выражается замедлением клубочковой фильтрации с формированием неолигурической ПН. С применением аминогликозидов связано около 50% всех случаев лекарственно-индуцированной ПН.
НПВС вызывают не только изменения интерстиция почек (аллергический интерстициальный нефрит и анальгетическую нефропатию с дальнейшим развитием интерстициального нефрита и папиллярного некроза), но и функциональные нарушения, а также ОПН. НПВС угнетают циклооксигеназу, которая участвует в синтезе простагландинов в почках. Простагландины Е обладают сосудорасширяющими и сосудосуживающими свойствами, и участвуют в регуляции клубочковой фильтрации и абсорбции электролитов в восходящей части
петли Генле. НПВС могут вызвать гипонатриемию, отёки и снизить эффект антигипертензивных средств. Роль простагландинов Е повышается при почечной и сердечной недостаточности, циррозе печени, повышении активности ренина плазмы, что наблюдают в пожилом возрасте. Устранение сосудорасширяющего эффекта простагландинов под влиянием НПВС приводит к снижению почечного кровотока, к скорости клубочковой фильтрации и к развитию «гемодинамической» ОПН. После отмены НПВС функция почек обычно быстро восстанавливается, но в некоторых случаях развивается ХПН, требующая лечения гемодиализом. НПВС также подавляют секрецию ренина и альдостерона через простагландин I2. НПВС могут также способствовать развитию ПН при наличии изменений почек, вызванных другими нефротоксичными препаратами, например, аминогликозидами или рентгенконтрастными веществами, а также комбинированными нефротоксичными препаратами (аминогликозиды+цефалоспорины).
ОПН наблюдают у 10-20% больных, получивших курс лечения аминогликозидами. Тяжесть ОПН, связанной с действием этих ЛС, усиливают такие факторы, как уменьшение объёма внутрисосудистой жидкости, старческий возраст, наличие скрытого заболевания почек, истощение запасов калия в организме и применение других нефротоксичных веществ или сильнодействующих диуретиков.
Рентгеноконтрастные вещества оказывают слабое нефротоксическое действие на здоровых людей. Однако у лиц, страдающих скрытым заболеванием почек, особенно у больных с диабетической нефропатией, введение рентгеноконтрастных веществ в 10-40% случаев вызывает ОПН. Показано, что применение диуретиков ухудшает клинический исход при остром некрозе почечных канальцев, обусловленном введением рентгеноконтрастных препаратов и хирургическим вмешательстве на сердце.
Некоторые обезболивающие ЛС (метоксифлуран и энфлуран) также могут вызывать ОПН. При высоком уровне ванкомицина в сыворотке возникает нефротоксичность, усиливающаяся при одновременном назначении аминогликозидов. Описаны случаи гиперкалиемии у пациентов с ПН при использовании высоких доз ко-тримоксазола.
Показано, что цефалоспорины - мощные ингибиторы ОАТ1, ОАТ3 и ОАТ4 в почках. Цефтриаксон, цефазолин, цефоперазон и цефалоридин в большей степени воздействуют на ОАТ3 и ОАТ4. В свою очередь, цефалотин и цефотаксим изменяют активность ОАТ1 и ОАТ4. Полученные результаты указывают, что, возможно, именно ОАТ4
лимитирует выведение цефалоридина, приводя таким образом к его накоплению и вызывая нефротоксичность.
Такие препараты, как циметидин и триметоприн - ингибиторы СОТ в канальцах при совместном использовании с прокаинамидом, повышают его концентрацию в крови и, как следствие, увеличивают риск. Пробенецид ингибирует ренальную секрецию анионов, например, почечная экскреция пенициллина, цидофовира, ципрофлоксацина, цисплатина снижается при комбинации с пробенецидом. Комбинированное использование метотрексата и НПВС увеличивает риск развития нежелательных эффектов, например, угнетение красного костного мозга, гепатотоксичность, нефротоксичность при ингибирующем влиянии НПВС на экскрецию метотрексата в результате действия на ОАТ-К1 и/или ОАТ-К2. Совместное использование ингибиторов Р-pg - кларитромицина, гуанидина, ритонавира, верапамила вместе с дигоксином приводит к повышению концентрации последнего в крови.
Роль в развитии ПН тяжёлых металлов (свинца, ртути, мышьяка, золота, хрома, висмута и урана), органических растворителей (четырёххлористого углерода, хлороформа), фенола, пестицидов на сегодняшний день не занимает лидирующего положения, что не исключает воздействия этих веществ.
Причинами ОПН могут быть нефротоксичные вещества, хотя отравления тяжёлыми металлами, органическими растворителями и гликолями встречают реже. Необходимо выяснить у больного с ОПН о возможном токсическом воздействии этих веществ в условиях профессиональной деятельности или быту.
9.3. ГЕМОДИАЛИЗ
При гемодиализе изменяется фармакокинетика некоторых ЛС. У больных с трансплантированной почкой фармакокинетика близка к показателям, обнаруживаемым при ХПН. Гемодиализ показан при выраженной гиперкалиемии, некупируемом метаболическом ацидозе, отёке лёгких, уремической энцефалопатии, перикардите, а также при невозможности ограничить поступление белка. Обычно в инструкциях к препаратам указывают фармакокинетику и параметры ЛС при проведении гемодиализа. Фармакокинетика практически не изменяется у большинства барбитуратов, антиаритмиков (амиодарон, лидокаин), антибиотиков [цефаперазон, цефтриаксон, доксициллин, салициловая к-та + хлорамфеникол + (левомицетин♠), клинда-
мицин)], противогрибковых препаратов (кетоконазол, миканазол), антикоагулянтов (гепарин и производные кумарина), трициклических антидепрессантов, антиэпилептических средств (фенитоин), гипотензивных (клонидин, миноксидил), почти у всех антагонистов кальция, диуретиков (фуросемид, индапамид), препаратов для нейролептанальгезии, ирбесартрана, лоратадина. У больных с нарушениями функции почек, получавших цефоперазон + сульбактам (сульперазон*), обнаружена высокая корреляция между общим клиренсом сульбактама из организма и расчётным клиренсом креатинина. Гемодиализ вызывает значительные изменения T1/2, общего клиренса из организма и Vd сульбактама. При ПН связывание с белками плазмы дексаметазона и преднизолона снижено, а клиренс увеличен, фармакокинетика метилпреднизолона не изменена. Гемодиализ уменьшает концентрацию ганцикловира в плазме примерно на 50%.
С большой осторожностью назначают любые лекарственные средства гемодиализным больным. К осложнениям при гемодиализе могут привести следующие лекарственные препараты:
• витамин А: его избыток приводит к ретинопатии;
• витамин D: способен быстро вызвать гиперфосфатемию и гиперкальциемию, что приводит к кальцификации мягких тканей;
• витамин С: в дозе, превышающей 150 мг/сут способен превращаться в оксалат. Оксалат кальция является причиной уролитиаза и кальцификации тканей;
• сердечные гликозиды: у диализных больных быстро вызывают гликозидную интоксикацию, а гемодиализ с калием на фоне дигитализации способствует развитию жизнеугрожающих аритмий;
• аллюминий содержащие препараты: должны быть полностью исключены у диализных больных, несмотря на то, что фосфалюгель и альмагель обладают хорошей способностью связывать фосфор, что важно для коррекции фосфор-кальциевого обмена у этих пациентов. Однако сам алюминий приводит к энцефалопатии и остеодистрофии, что является крайне тяжелым осложнением.
'лазикс: диуретики не используют у больных, находящихся на гемодиализе;
• солевые слабительные: способствуют быстрому развитию гипермагниемии.
У диализных больных не применяют аминогликозиды, глюкокортикостероиды (возможно использование в минимальных дозах и желательно короткое время), инфузионные растворы.
Причиной судорожных припадков у диализных больных могут быть следующие препараты: пенициллин, циклоспорин, литий, эуфиллин, метоклопрамид.
Литература
Белоусов Ю.Б., Моисеев В.С., Лепахин В.К. Клиническая фармакология и фармакотерапия. - М.: Универсум Паблишинг, 1997. - С. 33.
Бегг Э.. Клиническая фармакология. - М.: Бином, 2004. - С. 36-41.
Беркоу Р. Руководство по медицине // Диагностика и терапия. - 1997. - Т. 2. - С. 101-104.
Доказательная медицина. Ежегодный справочник. 2000.
Кукес В.Г. Метаболизм лекарственных средств: клинико-фармакологические аспекты. - М.: Рефафарм, 2004.
Кукес В.Г., Арзамасцев А.П., Колесников С.И. и др. Фармакокинетическое взаимодействие лекарственных средств на уровне системы биотрансформации и транспортёров: Руководство для практикующих врачей. - М., 2007.
Лепахин В.К.., Астахова А.В., Овчинникова Е.А. и др. Врачебные ошибки как причина осложнений лекарственной терапии // Качественная клиническая практика. - 2002. - ? 1.
Пальцев М.А., Кукес В.Г., Фисенко В.П. Молекулярные механизмы взаимодействия лекарственных средств. - М., 2004 (зел. кн.).
Стецюк Е.А. Основы гемодиализа // Под ред. Е.Б. Мазо. - М.:
ГЭОТАР-МЕД, 2001.
Hong Sun L. Frassetto L.Z., Benet. Effects of renal failure on drug transport and metabolism // Pharmacol. Ther. - 2006. - Vol. 109. - P. 1-11.
Judith Naud, Jose Michaud, Caroline Boisvert et al. Down-regulation of intestinal drug transporters in chronic renal failure in rats // J. Pharmacol. Exp. Ther. - 2007. - Vol. 320. - P. 978-985.
Nolin T.D., Frye R.F., Matzke G.R. Hepatic drug metabolism and transport in patient with kidney disease // Am. J. Kidney Dis. - 2003. - Vol. - 42, ? 5. -
P. 1-24.
Rang H.P., Dale M.M., Ritter J.M., Moore P.K. Pharmacology. - Churchill Livingstone, 2003.
Takeda M., Babu E., Narikawa S., Endou H. Interaction of human organic anion transporterswithvarious cephalosporin antibiotics //Eur.J.Pharmacol. -
2002. - Vol. 438. - ? 3. - P. 137-142.
Wooin Lee, Richard. B. Transporters and renal drug elimination. // Annu. Rev. Pharmacol. Toxicol. - 2004. - Vol. 44. - P. 137-166.