Клиническая фармакокинетика: теоретические, прикладные и аналитические аспекты: руководство / Под ред. В.Г. Кукеса. - 2009. - 432 с
|
|
|
|
ЧАСТЬ 2. ЧАСТНЫЕ ВОПРОСЫ КЛИНИЧЕСКОЙ ФАРМАКОКИНЕТИКИ ГЛАВА 14 ПРИКЛАДНЫЕ АСПЕКТЫ ФАРМАКОКИНЕТИКИ АНТИБАКТЕРИАЛЬНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
А.Н. Цой, А.К. Стародубцев, Г.А. Белякова, В.В. Архипов
Основная область практического применения данных о фармакокинетике антибактериальных ЛС - прогноз клинической эффективности препарата. Успехи клинической фармакологии и клинической медицины последних лет позволили вплотную подойти к количественному анализу закономерностей, связывающих терапевтичес-
кие или токсические эффекты антибиотиков с концентрацией этих средств в крови и тканях организма.
У антибактериальных препаратов выраженность клинического и микробиологического эффекта может изменяться в существенных пределах при одинаковой концентрации препарата в крови. Причин подобных вариаций эффекта несколько:
• различная чувствительность возбудителя инфекции к действию антибактериальных препаратов;
• различная способность популяции микроорганизмов к мутациям, вызывающим антибиотикорезистентность;
• различная степень проникновения антибиотика в зону инфекционного процесса;
• фармакокинетического взаимодействия антибактериальных препаратов с другими ЛС.
Важно отметить, что чувствительность возбудителя инфекции к действию антибактериальных препаратов - не постоянная величина: резистентность микроорганизмов значительно меняется с течением времени, кроме того, уровень резистентности может существенно различаться в разных регионах и даже в разных стационарах.
Таким образом, проблема соотношения эффективности антибактериальных препаратов и его концентрации в крови не имеет простого (линейного) решения. С другой стороны, наиболее важный показатель, от которого зависит эффективность антибактериальных препаратов, - степень резистентности микроорганизма к его действию. Количественно определить резистентность возбудителя можно, используя величину минимальной ингибирующей концентрации (МИК). Таким образом, обладая информацией о МИК можно, в первом приближении, предсказать эффективность антибактериальных препаратов. При этом приходится моделировать отношения между концентрацией антибактериальных препаратов и МИК возбудителя:
 где Е - эффект; С - концентрация.
где Е - эффект; С - концентрация.
Создание простейшей фармакокинетической, фармакодинамической модели эффективности антибактериальных препаратов можно показать на следующем примере. На рис. 14-1 представлены концентрации пенициллина после однократного внутривенного введения в разных дозах (5 млн, 2,5 млн, 1 млн, 0,5 млн ЕД) с постоянной скоро-
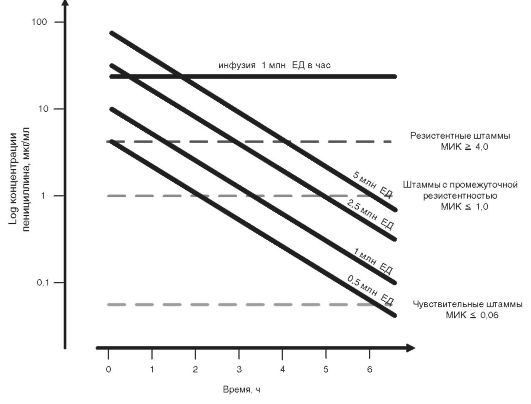 Рис. 14-1. Фармакокинетика
пенициллина: концентрация препарата в крови в зависимости от времени.
Для сравнения приведена средняя величина МИК для разных по
чувствительности к пенициллину штаммов S. pneumoniae
Рис. 14-1. Фармакокинетика
пенициллина: концентрация препарата в крови в зависимости от времени.
Для сравнения приведена средняя величина МИК для разных по
чувствительности к пенициллину штаммов S. pneumoniae
стью 1 млн ЕД/ч. Для сопоставления приводятся пограничные значения МИК для различных по чувствительности штаммов S. pneumoniae. Как видно из рис. 14-1, при назначении пенициллина в дозе 2,5 млн ЕД концентрация препарата непродолжительное время превышает МИК даже для резистентных штаммов пневмококка. Однако особенности фармакокинетической, фармакодинамической модели пенициллина таковы, что для достижения бактерицидного действия концентрация препарата должна превышать МИК не менее чем 50% времени. Таким образом, если назначать пенициллин каждые 6 ч, в отношении чувствительных пневмококков будут эффективны любые режимы дозирования, из числа представленных на рис. 14-1; по отношению к штаммам с промежуточной резистентностью - только дозы >2,5 млн ЕД и т.д.
Какое практическое значение могут иметь представленные данные о фармакокинетике и фармакодинамике пенициллина?
На рис. 14-2 представлены данные первого отечественного исследования резистентности S. pneumoniae к различным антибактериальным препаратам - ПЕГАС-I. На графике показана частота выявления у больных ряда штаммов пневмококка с различной устойчивостью по отношению к пенициллину. Используя информацию о фармакокинетике пенициллина и сведения о частоте выделения пневмококков с различным значением МИК, можно сделать заключение, что пенициллин в дозе 0,5 млн ЕД, назначаемый каждые 6 ч, будет эффективен менее чем у 90% больных. При назначении препарата по 1 млн ЕД, каждые 6 ч можно рассчитывать на то, что лечение будет эффективно у 96-97% больных, а использование препарата в дозе 2,5 млн ЕД, каждые 6 ч, теоретически будет эффективным у всех отечественных пациентов с пневмококковой инфекцией. В странах, где резистентность S. pneumoniae к пенициллину достигает 80-90%, результаты моделирования эффективности пенициллина будут существенно отличаться.
Другой пример использования фармакокинетических и фармакодинамических данных - оптимизация лечения у конкретного больного: располагая сведениями о величине МИК для возбудителя и концентрации антибактериальных препаратов в крови больного, можно:
• предсказать эффективность лечения;
• провести коррекцию дозы для достижения оптимального (соответствующего МИК) уровня концентрации антибактериальных препаратов в крови;
• при избыточно высоком уровне концентрации антибактериальных препаратов снизить дозу. Это позволит, не изменяя эффективности лечения, уменьшить риск токсических эффектов (актуально, например, для аминогликозидов, рифампицина и др.).
На рис. 14-3 представлены результаты итальянского исследования, которые демонстрируют положительное влияние изучения фармакокинетики и фармакодинамики антибактериальных препаратов при лечении больных с тяжёлыми инфекциями в условиях отделений интенсивной терапии. Определение концентрации антибактериальных препаратов и МИК позволяет снизить продолжительность пребывания больного в отделении интенсивной терапии, существенно уменьшить смертность больных и число случаев неэффективного применения антибактериальных препаратов.
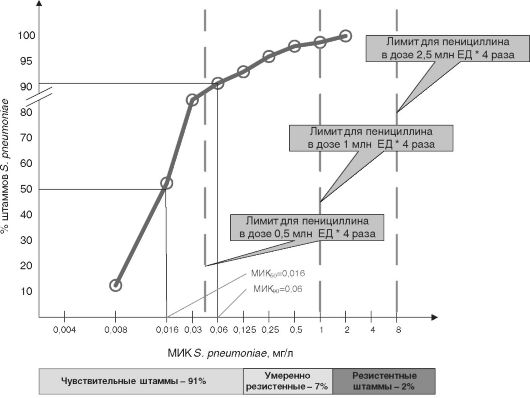 Рис. 14-2. Распространённость устойчивых к пенициллину штаммов S. pneumoniae в
РФ по данным исследования ПЕГАС-I и лимиты использования различных
режимов дозирования пенициллина (принятый критерий эффективности
пенициллина Τ > МИК = 50-60% от интервала дозирования)
Рис. 14-2. Распространённость устойчивых к пенициллину штаммов S. pneumoniae в
РФ по данным исследования ПЕГАС-I и лимиты использования различных
режимов дозирования пенициллина (принятый критерий эффективности
пенициллина Τ > МИК = 50-60% от интервала дозирования)
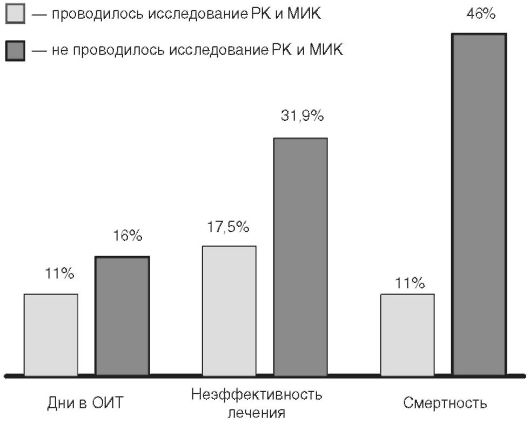 Рис. 14-3. Эффективность
оценки фармакокинетических/фармакодинами- ческих параметров у больных с
тяжёлой инфекцией в условиях отделений интенсивной терапии (Италия)
Рис. 14-3. Эффективность
оценки фармакокинетических/фармакодинами- ческих параметров у больных с
тяжёлой инфекцией в условиях отделений интенсивной терапии (Италия)
Однако вопрос о практическом применении фармакокинетических и фармакодинамических методов оценки эффективности антибактериальных препаратов остаётся открытым. Одновременное исследование фармакокинетики антибактериальных препаратов и МИК возбудителя достаточно трудоёмко и дорого даже для стран с развитой экономикой. Вместе с тем не вызывает сомнений необходимость подобных исследований у ряда категорий больных:
• у пациентов с тяжёлыми, угрожающими жизни инфекциями;
• у больных с нозокомиальной инфекцией;
• при использовании потенциально токсичных антибактериальных препаратов.
Построение фармакокинетических и фармакодинамических моделей эффективности антибактериальных препаратов опирается на изучение небольшого числа параметров. Параметров, с помощью которых принято описывать свойства микроорганизма, всего 2:
• МИК;
• концентрация, предотвращающая мутации.
Концентрация, предотвращающая мутации - самая низкая концентрация антибактериальных препаратов, которая способна предо-
твратить отбор любых мутирующих микроорганизмов в очень большом иноклиуме. Обычно концентрация, предотвращающая мутации, в 4-10 раз превышает уровень МИК для этого же микроорганизма.
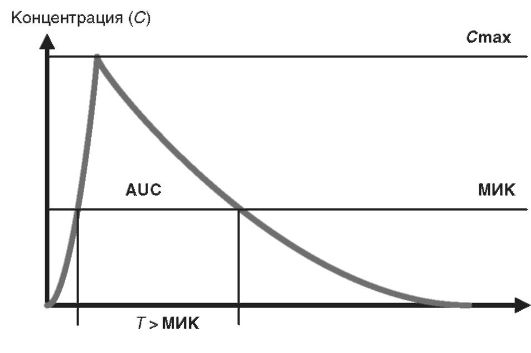
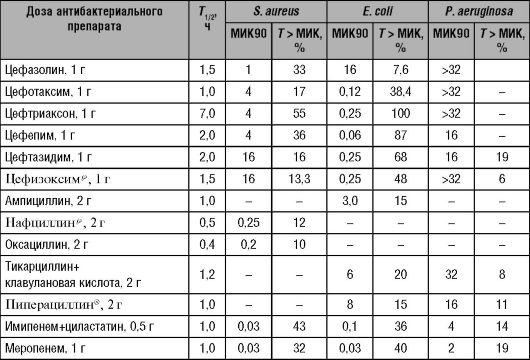
Для характеристики фармакокинетики антибактериальных препаратов также используют ограниченное число параметров (см. рис. 14-4):
• максимальная концентрация препарата в крови (Cmax);
• площадь под фармакокинетической кривой «концентрация- время» (AUC - area under curve);
• время, в течение которого концентрация антибактериальных препаратов превышает величину МИК для определённого возбудителя (T > МИК).
Наиболее важные параметры фармакокинетики антибактериальных препаратов:
• выраженность бактерицидного/бактериостатического эффекта антибактериальных препаратов in vitro или in vivo;
• частота эрадикации возбудителя;
• степень клинической эффективности (частота выздоровления пациента);
• положительная динамика симптомов и т.д.
На фармакокинетику антибактериальных препаратов влияют их физико-химические свойства, пути введения, степень связи с белка-
 Время, t
Время, t
Рис. 14-4. Основные фармакокинетические параметры для антибактериальных препаратов
ми, метаболизм и экскреция. Физико-химические свойства антибактериальных препаратов часто бывают определяющими для фармакокинетики. Например, для всасывания и распределения препаратов в тканях организма решающее значение имеет лиофильность ЛС. С другой стороны, высокое сродство липофильных препаратов к белкам плазмы препятствует образованию высоких концентраций препарата во внесосудистом русле.
Распределяясь в организме, большинство антибактериальных препаратов связываются с альбуминами (макролиды - с βl-кислым гликопротеидом). Связывание антибактериальных препаратов с белками не ограничивается сывороткой крови, оно происходит также в интерстициальной жидкости, в воспалительном экссудате и в цитоплазме клеток (связывание с белками субклеточных структур, хроматином лейкоцитов и другими клеточными компонентами).
Степень ионизации антибиотика так же имеет большое значение для фармакокинетики. Неионизированные соединения (например, макролиды) лучше проникают через липидные мембраны, в то время как для хорошего поступления в ткани и накопления соединений с высокой степенью ионизации (аминогликозиды и β-лактамные антибиотики) требуется кислая среда.
Фармакодинамический профиль антибактериальных препаратов
По особенностям бактерицидного действия все антибактериальные препараты можно разделить на две большие группы. Степень бактерицидного действия препаратов первой группы (фторхинолоны, аминогликозиды) зависит от их концентрации в крови. Действие препаратов второй группы (β-лактамные средства) зависит не столько от максимальной концентрации, сколько от времени, в течение которого концентрация препарата в крови превышает уровень МИК возбудителя.
Другая фармакодинамическая особенность ряда антибактериальных препаратов - постантибиотический эффект, или постантибиотическое действие. Под этим эффектом понимают прекращение роста возбудителя после завершения непродолжительного контакта с антибактериальными препаратами.
Существует несколько механизмов, которые обусловливают наличие у препарата постантибиотического действия:
• нелетальное повреждение микроорганизмов;
• антибактериальный стресс;
• накопление антибактериальных препаратов в бактериях и связывание с мишенями в бактериальной клетке (ферменты, органеллы и т.д.);
• накопление антибактериальных препаратов в лейкоцитах и макрофагах.
Выраженность и продолжительность постантибиотического действия зависит от целого ряда факторов, таких, как:
• механизм действия и физико-химические свойства антибактериальных препаратов;
• продолжительности действия антибактериальных препаратов;
• области инфекции (специфическое накопление ряда антибактериальных препаратов в тканях и в органах);
• концентрации антибактериальных препаратов.
Также постантибиотический эффект зависит от свойств возбудителя (грамположительные, грамотрицательные микроорганизмы, внутриклеточные микроорганизмы). Например, для большинства антибактериальных препаратов такой эффект в отношении грамотрицательных бактерий продолжается примерно 1-2 ч. Продолжительность постантибиотического действия в исследованиях in vitro часто отличается от продолжительности in vivo. Например, пенициллины обладают выраженным эффектом по отношению к стрептококкам in vitro, однако in vivo этот эффект отсутствует.
Взаимосвязь между фармакокинетическими параметрами и клинической эффективностью. В общем виде взаимосвязь между фармакодиинамическими параметрами и клинической эффективностью рада антибактериальных препаратов представлена в табл. 14-1.
Таблица 14-1. Параметры, определяющие эффективность антибактериальных препаратов
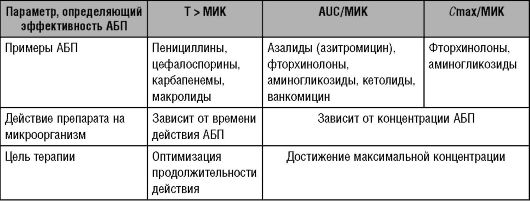 Антибактериальные препараты с выраженным постантибиотическим эффектом, действие которых зависит от концентрации
Антибактериальные препараты с выраженным постантибиотическим эффектом, действие которых зависит от концентрации
Для антибактериальных препаратов с выраженным постантибиотическим эффектом, бактерицидное действие которых зависит от концентрации, лучшими предикторами эффективности будут:
• отношение AUC/МИК;
• отношение Cmax/МИК.
Например, в исследованиях аминогликозидов величина Cmax/ МИК у больных, не отвечавших на лечение, по сравнению пациентами, у которых лечение оказалось эффективным, отличалась с очень высокой степенью статистической достоверности (р=0,00001) - см. рис. 14-5.
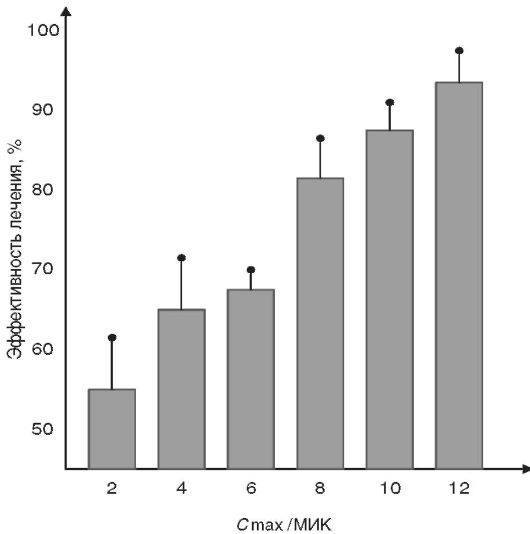 Рис. 14-5. Взаимосвязь
между эффективностью терапии и отношением Cmax/ МИК у 236 больных,
принимавших различные аминогликозиды (гентамицин, тобрамицин, амикацин)
Рис. 14-5. Взаимосвязь
между эффективностью терапии и отношением Cmax/ МИК у 236 больных,
принимавших различные аминогликозиды (гентамицин, тобрамицин, амикацин)
Параметры фармакокинетики и фармакодинамики, которые у этих антибактериальных препаратов коррелируют с высокой эффективностью терапии:
• для иммуноскомпрометированных больных величина AUC24/ МИК >125;
• для больных с сохранённым иммунитетом величина AUC24/ МИК >25;
• отношение Cmax/МИК >10.
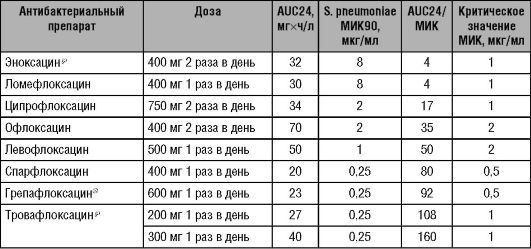
Эти параметры имеют большое практическоезначение. Основываясь на них, можно вычислить критическое значение МИК возбудителя, при котором антибактериальный препарат сохраняет свою эффективность. В данном случае критическое значение МИК определяют по формулам: AUC/25 или AUC/125 (для иммуноскомпрометированных больных). Например, у ципрофлоксацина AUC24=34 мгхч/л, а МИК S. pneumoniae по отношению к ципрофлоксацину составляет 2 мкг/мл (см. табл. 2). Таким образом, AUC24/МИК=34/2=17. Отношение AUC24/МИК существенно меньше 25, следовательно, препарат, вероятно, окажется неэффективным. Критическая точка МИК, при которой ципрофлоксацин сохраняет свою эффективность, в нашем примере составляет 34/25=1,4 мкг/мл.
Другой пример - левофлоксацин, антибактериальный препарат из группы респираторных фторхинолонов. У него AUC24=50 мгхч/л, МИК S. pneumoniae равна 1 мкг/мл (см. табл. 14-2). Соотношение AUC24/МИК=50/1=50, что существенно превышает критерий эффективности. Нетрудно подсчитать, что препарат будет сохранять эффективность по отношению к штаммам S. pneumoniae с МИК <50/25= 2 мкг/мл (в РФ были выявлены пневмококки с МИК к левофлоксацину от 0,25 до 2 мкг/мл).
Опираясь на показатели фармакокинетики и фармакодинамики, можно предсказать, что приём левофлоксацина по 500 мг 2 раза в сутки (AUC24=94 мгхч/л) позволит существенно повысить эффективность лечения. При таком режиме дозирования критическое значение МИК будет составлять не 2 мкг/мл (как в прошлом примере), а 3,76 мкг/мл. Кроме того, переход на более высокую дозу левофлоксацина позволяет снизить общую продолжительность лечения.
У азитромицина, эффективность которого, в отличие от других антибактериальных препаратов группы макролидов, определяет величина AUC24/МИК, значение AUC при однократном приёме в дозе 500 мг составляет 3 мгхч/л, критическое значение МИК S. pneumoniae
составляет 3/25=0,12 мкг/мл. Это обеспечивает эффективность лечения инфекций, вызванных чувствительными штаммами пневмококка (МИК90=0,12 мкг/мл; AUC24/МИК=25), однако недостаточную для лечения инфекций, вызванных резистентными к макролидам штаммами S. pneumoniae МИК90 >8 мкг/мл; AUC24/МИК=0,4) или H. influenzae (МИК90=1-2 мкг/мл; AUC24/МИК <3).
Таблица 14-2. Отношение AUC/МИК для некоторых фторхинолонов при лечении пневмококковой инфекции
 Антибактериальные препараты с минимально выраженным постантибиотическим эффектом, действие которых зависит от времени
Антибактериальные препараты с минимально выраженным постантибиотическим эффектом, действие которых зависит от времени
К антибактериальным препаратам, у которых постантибиотический эффект выражен минимально, относят β-лактамные антибактериальные препараты, макролиды (кроме азитромицина), клиндамицин и ко-тримоксазол [сульфаметоксазол+триметоприм]. Эффективность этих антибактериальных препаратов определяет время, в течение которого концентрация препарата в крови превышает значение МИК для возбудителя инфекции. Эту особенность определяет механизм действия антибактериальных препаратов, которые преимущественно нарушают синтез клеточной стенки и не проникают в цитоплазму микроорганизма. Синтез клеточной стенки происходит после деления бактериальной клетки и занимает относительно небольшой про-
межуток времени, таким образом, большую часть своего жизненного цикла возбудитель остаётся неуязвимым для антибактериальных препаратов. Поэтому для эффективной терапии принципиальное значение имеет длительное поддержание концентрации препарата в крови на уровне, превышающем величину МИК.
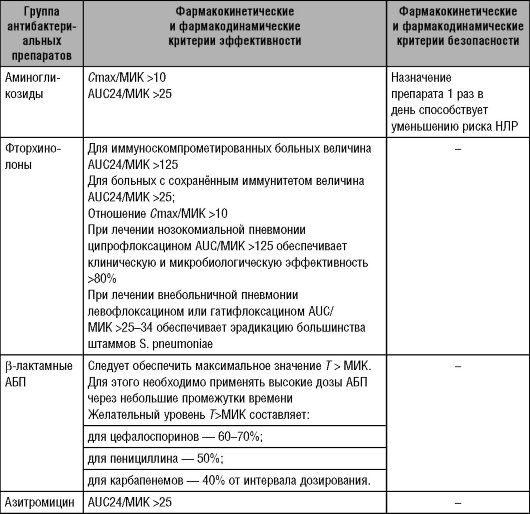
Обычно предиктором эффективности лечения служит величина Т > МИК, составляющая не менее 40-50% интервала между очередными назначениями антибактериальных препаратов. У больных средним отитом и синуситом, вызванными S. pneumoniae и H. influenzae необходимое значение Т > МИК существенно больше - до 80% (см. табл. 14-3).
Таблица 14-3. Фармакокинетические и фармакодинамические критерии эффективности и безопасности антибактериальных препаратов различных групп
 Эффективность критерия T > МИК для оценки эффективности лечения была доказана в ряде исследований (см. рис. 14-6).
Эффективность критерия T > МИК для оценки эффективности лечения была доказана в ряде исследований (см. рис. 14-6).
Ситуацию существенно упрощает то, что для определения времени, в течение которого концентрация препарата превышает МИК, нет
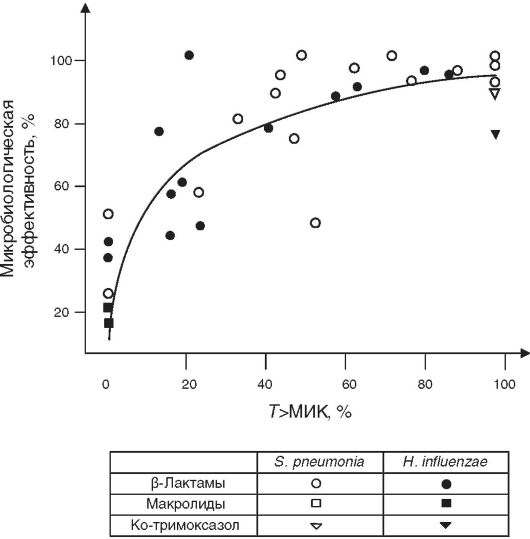 Рис. 14-6. Взаимосвязь между микробиологической эффективностью антибактериальной терапии и величиной T > МИК для β-лактамных антибактериальных препаратов, макролидов и ко-тримоксазола [сульфаметоксазол+ триметоприм]
Рис. 14-6. Взаимосвязь между микробиологической эффективностью антибактериальной терапии и величиной T > МИК для β-лактамных антибактериальных препаратов, макролидов и ко-тримоксазола [сульфаметоксазол+ триметоприм]
необходимости в проведении серии фармакокинетических измерений. Показатели фармакокинетики обычно не измеряют, а вычисляют, исходя из среднестатистических, по следующей формуле:
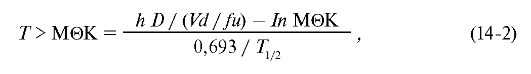 где D - доза; Vd - объём распределения препарата; fu - доля несвязанного с белками плазмы антибактериального препарата; МИК - минимальная ингибирующая концентрация; T1/2 - период полувыведения антибактериальных препаратов.
где D - доза; Vd - объём распределения препарата; fu - доля несвязанного с белками плазмы антибактериального препарата; МИК - минимальная ингибирующая концентрация; T1/2 - период полувыведения антибактериальных препаратов.
Основываясь на данных фармакокинетики и фармакодинамики, как и в предыдущем примере, можно рассчитать критическую величину МИК, при которой антибиотик сохраняет свою эффективность (Т > МИК/40-Т > МИК/60). Данные подобных расчётов для наиболее часто применяемых в практике β-лактамных антибактериальных препаратов приведены в таблицах 14-4 и 14-5.
В таблицах 14-6 и 14-7 приведены значения Т> МИК для ряда часто применяемых β-лактамных препаратов.
Таблица 14-4. Критические значения МИК S. pneumoniae при использовании пероральных β-лактамных антибактериальных препаратов (критерий эффективности терапии T > МИК более 40% от интервала дозирования)
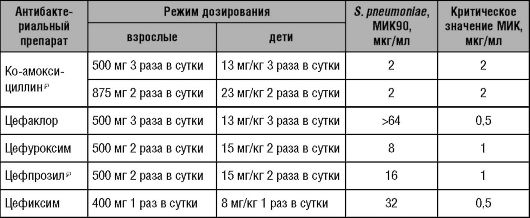 Таблица 14-5. Критические
значения МИК S. pneumoniae при использовании парентеральных β-лактамных
антибактериальных препаратов (критерий эффективности терапии T > МИК более 40% от интервала дозирования)
Таблица 14-5. Критические
значения МИК S. pneumoniae при использовании парентеральных β-лактамных
антибактериальных препаратов (критерий эффективности терапии T > МИК более 40% от интервала дозирования)
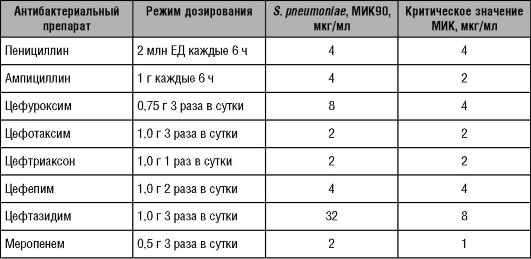 Таблица 14-6. Время,
превышающее МИК90 для наиболее распространён- ных возбудителей при
использовании различных β-лактамных антибактериальных препаратов
Таблица 14-6. Время,
превышающее МИК90 для наиболее распространён- ных возбудителей при
использовании различных β-лактамных антибактериальных препаратов
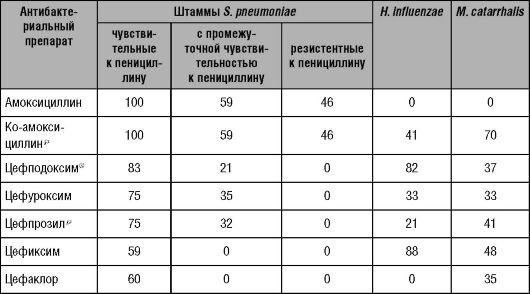 Таблица 14-7. Время,
превышающее МИК90 для наиболее распространён- ных возбудителей при
использовании различных β-лактамных антибактериальных препаратов
Таблица 14-7. Время,
превышающее МИК90 для наиболее распространён- ных возбудителей при
использовании различных β-лактамных антибактериальных препаратов
 Появление
фармакокинетических и фармакодинамических критериев эффективности
антибактериальных препаратов позволило достоверно моделировать
эффективность различных препаратов, не прибегая к дорогостоящим
клиническим исследованиям. Ниже представлены результаты подобных
исследований. Например, на рис. 14-7 представлена величина Т> МИК при
лечении пневмококковой инфекции с использованием различных режимов
дозирования амоксициллина. Представленная информация позволяет сделать
вывод о том, что для эффективного лечения этот антибактериальный
препарат нужно применять в дозах не менее 2 г (при приёме 2 раза в день)
или в меньших дозах, но значительно чаще: 500 мг на 4 приёма или 1000
мг на 3 приёма. Данные моделирования фармакокинетики и фармакодинамики в
целом совпадают с данными рандомизированных клинических исследований
амоксициллина и ко-амоксициллинаp, проведённых в последние годы (см. рис. 14-8).
Появление
фармакокинетических и фармакодинамических критериев эффективности
антибактериальных препаратов позволило достоверно моделировать
эффективность различных препаратов, не прибегая к дорогостоящим
клиническим исследованиям. Ниже представлены результаты подобных
исследований. Например, на рис. 14-7 представлена величина Т> МИК при
лечении пневмококковой инфекции с использованием различных режимов
дозирования амоксициллина. Представленная информация позволяет сделать
вывод о том, что для эффективного лечения этот антибактериальный
препарат нужно применять в дозах не менее 2 г (при приёме 2 раза в день)
или в меньших дозах, но значительно чаще: 500 мг на 4 приёма или 1000
мг на 3 приёма. Данные моделирования фармакокинетики и фармакодинамики в
целом совпадают с данными рандомизированных клинических исследований
амоксициллина и ко-амоксициллинаp, проведённых в последние годы (см. рис. 14-8).
Другой пример моделирования - анализ вероятности достижения фармакокинетических и фармакодинамических критериев эффек-
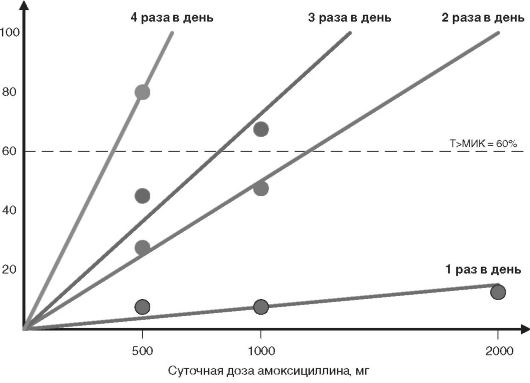 Рис. 14-7. Значение Т> МИК (МИК для S. pneumoniae равна 1 мг/л) при различных режимах дозирования амоксициллина (приём внутрь)
Рис. 14-7. Значение Т> МИК (МИК для S. pneumoniae равна 1 мг/л) при различных режимах дозирования амоксициллина (приём внутрь)
тивности лечения путём моделирования по методике Монте-Карло. Этот метод позволяет построить модель, одновременно обобщающую три основных переменных: данные фармакодинамики (данные полученные in vitro, в опытах у животных и в исследованиях у больных), показатели фармакокинетики (результаты исследований I-II фазы, популяционная фармакокинетика антибактериальных препаратов) и локальные (лечебное учреждение, город) или национальные данные о МИК возбудителей. Пример полученных в ходе моделирования по методике Монте-Карло результатов представлен в табл. 14-7. Данные анализа Монте-Карло широко используют для выбора оптимальных режимов дозирования антибактериальных препаратов и создания рекомендаций по антибактериальной терапии распространённых инфекций. Использования фармакокинетических и фармакодинамических моделей действия антибактериальных препаратов позволяет объяснить результаты клинических наблюдений, предсказать эффективность лечения ими у конкретных больных, выбрать наиболее оптимальные режимы дозирования. Роль фармакокинетических
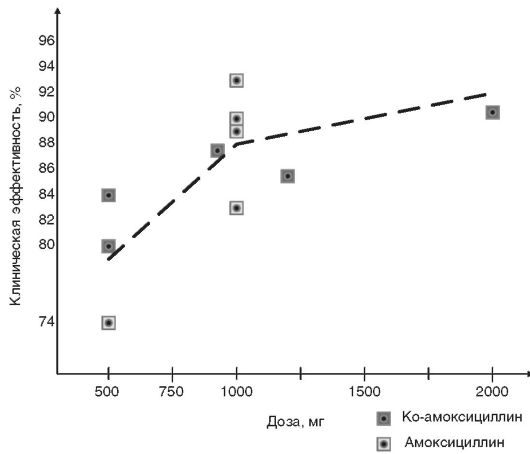 Рис. 14-8. Клиническая эффективность амоксициллина и ко-амоксициллинаp в зависимости от режима дозирования в 12 крупных клинических исследованиях 1995-2003 гг. у больных с внебольничной пневмонией
Рис. 14-8. Клиническая эффективность амоксициллина и ко-амоксициллинаp в зависимости от режима дозирования в 12 крупных клинических исследованиях 1995-2003 гг. у больных с внебольничной пневмонией
и фармакодинамических моделей неоценима при выборе режимов дозирования для исследований II-III фаз новых антибактериальных препаратов.
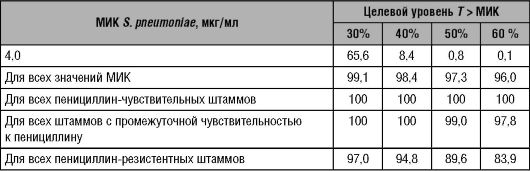
Таблица 14-8. Вероятность (%) достижения различных уровней T > МИК при лечении цефтриаксоном (1 г в сутки), в зависимости от различного уровня МИК S. pneumoniae
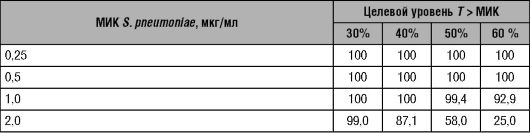 Окончание таблицы 14-8
Окончание таблицы 14-8
 Ограничения в использовании фармакокинетических и фармакодинамических моделей эффективности антибактериальных препаратов
Ограничения в использовании фармакокинетических и фармакодинамических моделей эффективности антибактериальных препаратов
Существуют определённые ограничения использования фармакокинетических и фармакодинамических моделей. Во-первых, эти модели опираются на определение МИК в ходе стандартных микробиологических исследований in vitro. Во-вторых, эти исследования построены таким образом, чтобы обеспечить постоянство концентраций возбудителя и исследуемого антибактериального препарата, что почти никогда не наблюдают in vivo. Кроме того, в этих исследованиях искусственно поддерживают постоянство среды, содержащей микроорганизмы, её химический состав и температуру. Время инкубации антибактериальных препаратов также определяют лабораторные стандарты (NCCLS) и поэтому оно всегда постоянно. Обычно данные о МИК получают при каком-либо одном уровне концентрации микроорганизмов (т.е. используют стандартное число колониеобразующих единиц). Кроме того, большинство существующих фармакокинетических и фармакодинамических моделей и рекомендаций по антибактериальной терапии не учитывают существенных изменений в уровне абсорбции, в величине Vd и в объёме циркулирующей жидкости, которые обычно наблюдают у больных с сепсисом, беременных, лиц с задержкой жидкости, с гипогидратацией и т.д.
Наиболее часто данные по фармакокинетике у антибактериальных препаратов получают в исследованиях I фазы, т.е. у здоровых добровольцев. Большинство существующих моделей опираются на фиксированные дозы антибактериальных препаратов, безотносительно
к весу, возрасту и другим индивидуальным показателям больных. Фармакокинетические и фармакодинамические модели не учитывают разницу в биодоступности генерических антибактериальных препаратов. Разумеется, большинство этих недостатков преодолимы, но эта работа требует проведения большого числа дополнительных фармакокинетических исследований.
В целом можно сделать заключение о том, что фармакокинетические и фармакодинамические модели всегда опираются на среднепопуляционные показатели МИК и усреднённые данные о фармакокинетике антибактериальных препаратов. Фармакокинетические и фармакодинамические модели редко учитывают данные о токсичности антибактериальных препаратов и их фармакокинетического взаимодействия. За рамкой подобных исследований остаются инфекции, вызванные несколькими микроорганизмами, заболевания, вызванные «редкими» возбудителями, а также микроорганизмами, которые не дают роста на стандартных средах, фармакоэкономические аспекты применения антибактериальных препаратов и т.д.
Наиболее существенный недостаток рекомендаций, опирающихся на фармакокинетические и фармакодинамические модели, - их узкая специфичность для данной страны или региона. Поэтому развитые страны обладают большой и регулярно обновляемой информацией по фармакокинетике и фармакодинамике антибактериальных препаратов, опирающейся на крупные исследования МИК у разных категорий больных. В развивающихся странах, в том числе и в РФ, информация об уровне антибиотикорезистентности очень ограничена, что затрудняет создание репрезентативных и объективных рекомендаций по использованию антибактериальных препаратов.
Литература
Козлов Р.С., Киречикова О.И., Сивая О.В. и др. Антимикробная резистентность S. pneumoniae в России: результаты проспективного многоцентрового исследования (фаза А проекта ПЕГАС-I) // Клин. микробол. и антимикроб. тер. - 2002. - Т.4. - ? 3. -С. 267-277.
Ambrose et al. Antimicrob // Agents Chemother. - 2001. - Vol. 45 - P. 2793-2797.
Ambrose P.G., Quintiliani R. Limitations of Single-Point Pharmacodynamic Analysis // Pediatr. Infect. Dis. J. - 2000. - Vol. 19. - P. 769.
Andes D., Craig W.A. In vitro activities of amoxicillin and amoxicillinclavulanate against Streptococcus pneumoniae. Application to breakpoint
determination // Antimicrob. Agents Chemother - 1998. - Vol. 42. -
P. 2375-2379.
Aubier M., Verster R., Regamey C. et al. Once-daily sparfloxacin versus high-dosage amoxicillin in the treatment of community-acquired, suspected pneumococcal pneumonia in adults. Sparfloxacin European Study Group //
Clin. Infect. Dis. - 1998, Jun. - Vol. 26. - ? 6. - P. 1312-1320.
Bergogne-Berezin E. Pharmacokinetics of Antibiotics in the Respiratory Tract: Clinical Significance // Clinical Pulmonary Medicine. - 1998. -
Vol. 5. - ? 4. - P. 211-220.
Bryan C.S., Talwani R., Stinson M.S. Penicillin dosing for pneumococcal pneumonia // Chest. - 1997. - Vol. 112. - P. 1657-1664.
Burgess D.S. Pharmacodynamic principles of antimicrobial therapy in the prevention of resistance // Chest. - 1999. - Vol. 115. - P. 19-23.
Craig, Andes // Pediatr. Infect. Dis. J. - 1996. - Vol. 15. - P. 255-259.
Craig W.A. Interrelationship between pharmacokinetics and pharmacodynamics in determining dosage regimens for broad-spectrum cephalosporins //
Diagn. Microbiol. Infect. Dis. - 1995. - Vol. 22. - P. 89-96.
Craig W.A. Postantibiotic effects and dosing of macrolides, azalides, and streptogramins // Expanding Indications for the New Macrolides, Azalides and Treptogramins / S.H. Inner, L.S. Young, J.F. Acar, H.C. Neu. - N.Y.: Marcel Dekker, 1997. - P. 27-38.
Craig W.A., Andes D. Pharmacokinetics and pharmacodynamics of antibiotics in otitis media // Pediatr. Infect. Dis. J. - 1996. - Vol. 15. - P. 255-259.
Craig W.A.., Andes D.R. Correlation of the Magnitude of the AUC24/MIC for 6 Fluoroquinolones against Streptococcus pneumoniaewith Survival and Bactericidal Activity in an Animal Model // Abstracts of the 40th ICAAC. -
Toronto, 2000. Abs-289.
Craig W.A. Pharmacokinetic/pharmacodynamic parameters: rationale for antibacterial dosing of mice and men // Clin. Infect. Dis. - 1998. -
Vol. 26. - P. 1-10.
Craig W.A. Post-antibiotic effects in experimental infection models: relationship to in vitro phenomena and to treatment of infections in man // J. Antimicrob. Chemother. - 1993. - Vol. 31, suppl. D. - P. 149-158.
Craig W.A. // CID. - 2001. - Vol. 33, suppl. 3. - P. 233.
Drusano G.L., Craig W.A. Relevance of pharmacokinetics and pharmacodynamics in the selection of antibiotics for respiratory tract infections // J. Chemother. - 1997, May. - Vol. 9, suppl. 3. - P. 38-44.
Drusano G.L. // Clin. Infect. Dis. - 2003. - Vol. 36, suppl. 1. - P. 42-50.
Dudley M.N., Ambrose P.G. Monte Carlo Simulation of new cefotaxime, ceftriaxone and cefepime susceptibility breakpoints for S. pneumoniae, includ-
ing strains with reduced susceptibility to penicillin // Abstracts of the 42nd
ICAAC. - San Diego, 2002. - Abs-635.
Dunbar L.M., Wunderink R.G., Habib M.P. et al. High-dose, short-course levofloxacin for community-acquired pneumonia: a new treatment paradigm // Clin. Infect. Dis. - 2003, Sep 15. - Vol. 37. - ? 6. - P. 752-760.
Fantin B., Ebert S., Leggett J. et al. Factors affecting duration of in vivo postantibiotic effect for aminoglycosides against Gram-negative bacilli // J. Antimicrob. Chemother. - 1990. - Vol. 27. - P. 829-836.
Finch R., Schurmann D., Collins O. et al. Randomized controlled trial of sequential intravenous (i.v.) and oral moxifloxacin compared with sequential i.v. and oral co-amoxiclav with or without clarithromycin in patients with community-acquired pneumonia requiring initial parenteral treatment // Antimicrob.
Agents Chemother. - 2002, Jun. - Vol. 46. - ? 6. - P. 1746-1754.
Fogarty C.M., Cyganowski M., Palo W.A. et al. A comparison of cefditoren pivoxil and amoxicillin/clavulanate in the treatment of community-acquired pneumonia: a multicenter, prospective, randomized, investigatorblinded, parallelgroup study // Clin. Ther. - 2002, Nov. - Vol. 24. - ? 11. - P. 1854-1870.
Forrest et al. // Antimicrob. Agents Chemother. - 1993. - Vol. 37. -
P. 1073-1081.
Genne D., Siegrist H.H., Humair L., Janin-Jaquat B. et al. Clarithromycin versus amoxicillin-clavulanic acid in the treatment of community-acquired pneumonia // Eur. J. Clin. Microbiol. Infect. Dis. - 1997, Nov. - Vol. 16. - ? 11. - P. 783-788.
Grant et al. // Pharmacotherapy. - 2002. - Vol. 22. - P. 471-483.
Hagberg L., Torres A., van Rensburg D. et al. Efficacy and tolerability of once-daily telithromycin compared with high-dose amoxicillin for treatment of community-acquired pneumonia // Infection. - 2002, Dec. - Vol. 30. - ? 6. - P. 378-386.
Jardim J.R., Rico G., de la Roza C. et al. A comparison of moxifloxacin and amoxicillin in the treatment of community-acquired pneumonia in Latin America: results of a multicenter clinical trial // Arch. Bronconeumol. -
2003, Sep. - Vol. 39. - ? 9. - P. 387-393.
Kashuba et al. // Antimicrob. Agents Chemother. - 1999. - Vol. 43. -
P. 623-629.
Lister P.K. Pharmacodynamics of Gatifloxacin Against Streptococcus pneumoniaein an in vitro Pharmacokinetic Model: Impact of AUC: MIC Ratios on Eradication // Antimicob. Agents Chemother. - 2002. - Vol. 46. -
P. 69-74.
Lode H., Garau J., Grassi C. et al. Treatment of community-acquired pneumonia: a randomized comparison of sparfloxacin, amoxycillin-
clavulanic acid and erythromycin // Eur. Respir. J. - 1995, Dec. - Vol. 8. - ? 12. - P. 1999-2007.
Mandell G.L. Principles and Practice of infection Diseases. - 4th ed. -
N.Y., 1995. - P. 233-264.
Moore R.D. et al. // J. Infect. Dis. - 1987. - Vol. 155. - P. 93-99.
Moore R.D., Lietman P.S., Smith C.R. Clinical response to aminoglycoside therapy: importance of the ratio of peak concentration to minimal inhibitory concentration // J. Infect. Dis. - 1987. - Vol. 155. - P. 93-99.
Nicolau et al. // Antimicrob. Agents Chemother. - 1995. - Vol. 39. -
P. 650-655.
Nicolau et al. // Antimicrob. Agents Chemother. - 2000. - Vol. 44. -
P. 1291-1295.
ODoherty B., Dutchman D.A., Pettit R., Maroli A. Randomized, doubleblind, comparative study of grepafloxacin and amoxycillin in the treatment of patients with community-acquired pneumonia // J. Antimicrob. Chemother. -
1997, Dec. - Vol. 40, suppl. A. - P. 73-81.
Petermans W. MIC-based therapies. - BVIKM/SBIMC, Antewerpen,
8 nov 2002.
Poirier R., Chardon H., Beraud A. et al. Efficacy and tolerability of pristinamycin vs amoxicillin-clavulanic acid combination in the treatment of acute community-acquired pneumonia in hospitalized adults // Rev. Pneumol. Clin. - 1997. - Vol. 53. - ? 6. - P. 325-331.
Roson B., Carratala J., Tubau F. et al. Usefulness of betalactam therapy for community-acquired pneumonia in the era of drug-resistant Streptococcus pneumoniae: a randomized study of amoxicillin-clavulanate and ceftriaxone // Microb. Drug Resist. - 2001, Spring. - Vol. 7. - ? 1. - P. 85-96.
Scaglione F. Can PK/PD be used in everyday clinical practice // Int. J. Antimicrob. Agents. - 2002, April. - Vol. 19. - ? 4. - P. 349-353.
Schentag et al. // Am. J. Med. - 1984. - Vol. 77. - P. 43-50.
Shentag. // CID. - 1998. - Vol. 27. - P. 40.
Torres A., Muir J.F., Corris P. et al. Effectiveness of oral moxifloxacin in standard first-line therapy in community-acquired pneumonia // Eur. Respir. J. - 2003, Jan. - Vol. 21. - ? 1. - P. 135-143.
Tremolieres F., de Kock F., Pluck N., Daniel R. Trovafloxacin versus highdose amoxicillin (1 g three times daily) in the treatment of communityacquired bacterial pneumonia // Eur. J. Clin. Microbiol. Infect. Dis. -
1998, Jun. - Vol. 17. - ? 6. - P. 447-453.
Vogelman B., Gudmundsson S., Turnidge J. et al. In vivo postantibiotic effect in a thigh infection in neutropenic mice // J. Infect. Dis. - 1988. -
Vol. 157. - P. 287-298.