Клиническая фармакокинетика: теоретические, прикладные и аналитические аспекты: руководство / Под ред. В.Г. Кукеса. - 2009. - 432 с
|
|
|
|
ГЛАВА 3 ВСАСЫВАНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
М.И. Савельева
3.1. ОБЩИЕ ПРЕДСТАВЛЕНИЯ О ВСАСЫВАНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Абсорбция, распределение, метаболизм и выделение - биологические процессы, важные в оценке фармакокинетики ЛС. На эти процессы влияют физико-химическая природа ЛС и пути их введения в организм, что определяет начало действия, его продолжительность и интенсивность фармакологического ответа ЛС. Например, парентеральный (внутрисосудистый) путь введения ЛС лишён стадии абсорбции, что обеспечивает непосредственное начало его действия при введении в организм человека. Для внесосудистых (энтеральных, аппликационных и специализированных) путей введения ЛС, когда ЛС перед достижением системного кровотока диффундируют через барьер, характерна задержка начала действия, величина которой зависит от сложности барьера, физико-химических особенностей препарата и его лекарственной формы. Многочисленность путей введения обусловлена стремлением врача либо быстрее воздействовать на патологический процесс, либо осуществлять постоянное на него воздействие при длительной терапии, минуя пути разрушения ЛС в организме. Немаловажный фактор при выборе пути введения препарата - его доступность, возможность обойтись без посто-
янного наблюдения медперсонала, избежать развития нежелательных лекарственных реакций. Следующие разделы в этой главе систематизируют абсорбционный процесс и его особенности, в зависимости от путей введения ЛС в организм человека.
3.2. ПУТИ ВВЕДЕНИЯ ПРЕПАРАТОВ
Первая категория
Эти ЛС необходимо вводить непосредственно в системный кровоток, поэтому эти пути введения называют «парентеральные» или «внутрисосудистые».
• Инъекционный путь введения непосредственно в сосудистую систему:
- внутривенный;
- внутриартериальный.
Основное достоинство внутривенного способа введения - непосредственное поступление препарата в кровь - обеспечивает быстроту наступления эффекта, а также точность дозировки. Внутривенный путь введения незаменим в экстренных ситуациях. ЛС можно вводить быстро (болюсно), относительно медленно (в течение нескольких минут), медленно и длительно (капельно). Последний способ нередко применяют в комбинации с болюсным внутривенным введением с целью быстрого достижения в крови терапевтической концентрации ЛС и последующего длительного его поддержания (например, введение лидокаина у больных с острым инфарктом миокарда, осложненным желудочковой экстрасистолией). Как внутривенный, так и внутриартериальный путь введения позволяет избежать быстрой биотрансформации препарата в печени, характерной для многих ЛС, применяемых перорально (пропранолол, верапамил, лидокаин и т.д.). Поэтому при внутриартериальном и внутривенном введении доза их в несколько раз меньше пероральной. Внутриартериальный путь введения используют значительно реже, чем внутривенный, и только по особым показаниям.
Вторая категория
К этой категории относят ЛС, которые перед достижением системного кровотока должны пройти через тканевой барьер. Цель использования этих внесосудистых путей введения - достижение системного, а не местного эффекта.
• Пероральные пути введения:
- пероральный;
- сублингвальный;
- буккальный.
• Ингаляционный путь.
• Инъекция в тело, но не в сосудистую систему:
- подкожная;
- внутримышечная;
- внутрикожная.
• Пути введения через естественные отверстия:
- назальный;
- ректальный;
- влагалищный.
Третья категория
К этой категории относят местные, или аппликационные внесосудистые пути введения ЛС, цель которых - достижение системного эффекта посредством нанесения ЛС на кожу. Абсорбция через кожу, которая представлена наиболее удалённым от сосудов роговым слоем (stratum corneum), - это более сложный путь, чем пути введения первой категории. В дополнение к физико-химическим особенностям препарата и его лекарственной форме, такие экологические факторы, как влажность, температура и физиологические условия кожи играют важную роль в абсорбционном процессе. Абсорбция ЛС, даже очень липофильных, происходит не сразу, так как концентрация препарата в плазме постепенно повышается после преодоления порога наименьшей концентрации.
• Местные пути введения:
- трансдермальный;
- кожный.
Четвёртая категория
К этой категории относят ЛС, имеющие специализированные пути введения, которые предназначены для местной и целевой терапии. В частности, эти внесосудистые пути введения используют врачи хирургических специальностей (нейрохирурги, торакальные и абдоминальные хирурги, офтальмологи, нефрологи, гинекологи и урологи). Несмотря на то, что цель их использования - достижение местного и целевого эффекта, часть препарата может достигать системного кровотока и соответственно вызывать системный эффект.
• Вид инъекции:
- непосредственно в поражённый орган или в ткань;
- эпидуральный (также используют термины «перидуральный» и «экстрадуральный»);
- интрацекальный;
- интрацистернальный;
- интракардиальный;
- интравентрикулярный;
- интраокулярный;
- интраартикулярный;
- интраперитонеальный.
• Пути введения через естественные отверстия:
- интрааурикулярный;
- внутриматочный;
- интрауретральный;
- конъюнктивальный.
Конъюнктивальное введение ЛС применяют для местной терапии заболеваний глаз. Конъюнктива хорошо абсорбирует препараты. Примером этого может служить местное использование различных ЛС для лечения глаукомы или офтальмологических инфекций.
В следующих разделах рассмотрим только те пути введения, где препараты должны пересечь барьер перед тем, как попасть в системный кровоток для общего распределения. Пути введения, которые обходят абсорбционный процесс и вызывают только местный эффект, в этой главе не рассмотрены.
3.2.1. Абсорбция ЛС в желудочно-кишечном тракте
Попадание ЛС в системный кровоток после всасывания из пищеварительного тракта определяется как последовательность проникновения препарата из просвета тонкой кишки через её стенку и последующей диффузией через капилляры в кровь.
3.2.1.1. Факторы, влияющие на абсорбцию в желудочно-кишечном тракте
Среди факторов, которые влияют на абсорбцию ЛС, введённых пероральным путём, важными считаются следующие.
• Влияние различной региональной рН пищеварительного тракта на фармакокинетику (рКа) препарата.
• Процесс эвакуации содержимого из желудка в кишечник, или желудочное опорожнение.
• Кишечная подвижность, определяемая как наименьшее время транзита через тонкий кишечник (SITT).
• Первичное прохождение:
- печёночное;
- желудочно-кишечная микрофлора;
- кишечные метаболические ферменты, типа цитохрома Р450 3А4 (СУР3А4);
- Гликопротеин-Р.
• Пища.
• Заболевания.
• Другие факторы.
3.2.1.2. Влияние различного рН в пищеварительном тракте на абсорбцию препаратов
ЛС, введённые перорально, проходят через две различные среды: желудочную и тонкого кишечника. Кроме анатомических различий, существуют различия в рН, что влияет на абсорбцию слабокислых и основных веществ. Желудочный рН натощак очень низкий и сопоставим c pH 0,15 М HCl. Однако во время еды, из-за буферной роли пищи, желудочная рН повышается и таким образом она изменяется в течение всего дня. Щелочная среда тонкого кишечника остаётся более стабильной и мало меняется в течение жизни; рН тонкого кишечника возрастает от 5,5-6,0 - в двенадцатиперстной кишке до 9-11 - в подвздошной кишке (приблизительно).
Поскольку способность к всасыванию многих ксенобиотиков, которые являются либо слабыми кислотами или слабыми основаниями, зависит от константы диссоциации, то только неионизированные формы молекул способны к проникновению через мембрану барьера. Поэтому низкий рН желудка увеличивает концентрацию неионизированных слабокислых препаратов, а высокий рН кишечника формирует неионизированные слабоосновные препараты. Таким образом, слабоосновные препараты в желудке и слабокислые препараты в кишечнике находятся в ионизированной форме. Уравнение Гендерсона-Хассельбаха может быть использовано к взаимоотношениям между фармакокинетикой (рКа) препарата и рН пищеварительного тракта как отношение между ионизированными и неионизированными разновидностями молекул.
 Поэтому
при рН=2 для каждых 10 неионизированных молекул препарата А с рКа=3
только одна молекула будет ионизирована. Отношение меняется значительно
для препарата В с рКа=8, где для каждой неионизированной молекулы 106 молекул будут ионизированы. При рН=7 отношения для препаратов А и В будут выглядеть как 10-4 и 10-1
соответственно. Таким образом, чем выше рН для слабоосновных
препаратов, тем больше неионизированных молекул, а для кислых препаратов
- больше ионизированных молекул и наоборот - при низком рН.
Поэтому
при рН=2 для каждых 10 неионизированных молекул препарата А с рКа=3
только одна молекула будет ионизирована. Отношение меняется значительно
для препарата В с рКа=8, где для каждой неионизированной молекулы 106 молекул будут ионизированы. При рН=7 отношения для препаратов А и В будут выглядеть как 10-4 и 10-1
соответственно. Таким образом, чем выше рН для слабоосновных
препаратов, тем больше неионизированных молекул, а для кислых препаратов
- больше ионизированных молекул и наоборот - при низком рН.
Было замечено, что, хотя слабокислые препараты находятся в основном в неионизированной форме в желудке, они абсорбируются главным образом в кишечнике. Причины этого: ограниченная поверхность желудка, непроницаемость желудочной стенки для малых гидрофильных молекул и короткий по времени промежуток нахождения ЛС в желудке. Таким образом, разумно предположить, что большинство слабокислых ЛС также абсорбируется в тонком кишечнике. Однако начало действия для кислых препаратов более раннее (непосредственно при попадании в тонкий кишечник), чем для основных препаратов.
3.2.1.3. Опорожнение желудка, или желудочная эвакуация
Опорожнение желудка и прохождение пищи в кишечник регулируется гуморальной и нервной системами. Сокращения желудка и тонкой кишки скоординированы между собой. Этот процесс можно представить в виде следующей схемы. Проглоченная пища, предварительно измельчённая в ротовой полости и смешанная со слюной, поступает в кардиальный отдел желудка. За счёт постоянных перистальтических движений пищевой комок перемещается в дистальный отдел. Дистальная часть желудка растирает пищу до мелких частиц и выполняет функцию ворот, пропуская в двенадцатиперстную кишку только жидкость и малые частицы, и не допуская обратного заброса пищи. Перистальтические сокращения проксимального и дистального отде-
лов желудка находятся под контролем блуждающего нерва, основным нейромедиатором которого выступает ацетилхолин. Ацетилхолин взаимодействует с рецепторами гладкомышечных клеток желудка, тем самым стимулируя их сокращение и расслабление во время акта глотания. Помимо этого, ряд гормонов также оказывает влияние на сокращения желудка, усиливая или ослабляя их. Например, холецистокинин снижает перистальтику проксимального отдела желудка, в то же время стимулируя сокращения дистального отдела, а секретин и соматостатин ослабляют сокращения обоих отделов.
Желудочная эвакуация занимает то время, за которое желудок освобождается от своего содержимого, которое дальше попадает в двенадцатиперстную кишку. Отклонение от нормального времени желудочной эвакуации в сторону увеличения способствует развитию задержки начала действия определённых ксенобиотиков и/или различных лекарственных форм препаратов. Согласно теории зависимости способности всасывания от константы диссоциации, слабоосновные препараты, ожидающие перехода в ионизированную форму в желудке, при медленной скорости желудочной эвакуации могли бы отсрочить начало действия основных ЛС. На скорость желудочной эвакуации влияют следующие факторы.
• Препараты, которые блокируют ацетилхолиновые рецепторы гладкомышечных клеток желудка, задерживая эвакуацию желудочного содержимого (например, пропантелин¤).
• Высокая кислотность желудочного химуса также задерживает эвакуацию содержимого желудка.
• Химический состав химуса в пределах желудка определяет время желудочной эвакуации. У людей жидкости выводятся приблизительно за 12 мин, а твёрдые частицы - приблизительно за 2 ч, в зависимости от химического состава химуса. Углеводы эвакуируются быстрее, чем белки, а белки быстрее, чем жиры.
• Желудочная эвакуация соответствует калорийности содержимого желудка так, что число калорий, переданных тонкому кишечнику, остается постоянным для различных питательных веществ в течение долгого времени, но эвакуация содержимого из желудка идёт тем медленнее, чем более богата пища калориями.
• Скорость желудочной эвакуации зависит от количества потребленной пищи. Например, изменение количества твёрдой пищи с 300 до 1692 г увеличивает время эвакуации из желудка с 77 до 277 мин. Размер частиц пищи также имеет значение, так как
крупные частицы пищи оказывают давление на стенки желудка, тем самым стимулируя эвакуацию содержимого желудка.
• Моделирование рецепторов тонкого кишечника (например, дуоденальных рецепторов, чувствительных к осмотическому давлению) гипертоническим или гипотоническим раствором замедляет желудочную эвакуацию.
• Температура твёрдой или жидкой пищи может влиять на скорость желудочной эвакуации. Температура выше или ниже физиологической нормы (37 °С) может пропорционально уменьшить эвакуацию содержимого желудка.
• Другие факторы, такие, как гнев или ажитация могут увеличить скорость эвакуации из желудка, тогда как депрессии или травмы, предположительно, уменьшают её. Положение тела также имеет значение. Например, стоя или лёжа на правом боку, можно облегчить прохождение содержимого в тонкую кишку за счёт увеличения давления в проксимальной части желудка.
3.2.1.4. Кишечная подвижность, определяемая как наименьшее время транзита через тонкий кишечник
Тонкая кишка имеет длину приблизительно 300-400 см со щелочной средой. Тонкая кишка начинается с пилорического сфинктера, продолжается двенадцатиперстной кишкой, затем переходит в тощую кишку, далее - в проксимальный и дистальный отделы подвздошной кишки и заканчивается илеоцекальным клапаном, открывающимся в толстую кишку. В двенадцатиперстной кишке рН приблизительно 6,0 и постепенно увеличивается всюду по ходу тонкого кишечника. Тонкая кишка очень богата пищеварительными ферментами (липазы, протеазы, амилазы, эстеразы и нуклеазы). Кроме того, в ее просвет выделяется жёлчь, богатая мицеллами жёлчных солей и которая, в свою очередь, добавляется к содержимому тонкой кишки. Подвижность тонкого кишечника представляет собой сегментарное сокращение, состоящее из смешивающей и пропульсивной фаз. Но главный участок абсорбции в пищеварительном тракте находится в тощей кишке, так как желудок и ободочная кишка имеют небольшую всасывающую (абсорбционную) поверхность, а в просвете ободочной кишки имеется много бактерий, препятствующих абсорбционному процессу.
Кишечная подвижность имеет четко определенную цикличность и состоит из чередования пищеварительных и межпищеварительных
циклов. Один полный цикл может длиться от 90 до 120 мин у здоровых субъектов. Пищеварительный цикл, во время которого происходят основные процессы переваривания пищи, осуществляется тогда, когда перистальтическая деятельность желудка и тонкого кишечника замедляется. На 30-40 мин минимальной сократительной деятельности гладкой мускулатуры этих органов запускается межпищеварительный цикл, который представляет собой нарастающие круговые и мигрирующие по тонкой кишке сокращения, получившие название «перистальтические». За время перистальтического цикла из тонкого кишечника удаляется всё, что поступило и переварилось в тонкой кишке. Наконец, сокращения уменьшают частоту и интенсивность, и цикл повторяется снова. Прием пищи приостанавливает межпищеварительный цикл и устанавливает кишечный тип подвижности для пищеварительного цикла. Пищеварительный цикл включает в себя, главным образом, смешивающие сокращения с немногочисленными продвигающими (пропульсивными) сокращениями. Время транзита через тонкий кишечник (SITT) в течение пищеварительного цикла довольно трудно определить, и рассмотрение изменчивости среди людей и типов пищи остается вопросом открытым. Одно сообщение, однако, указывало, что SITT для 95% (SITT 95) здоровых людей составляет приблизительно 80 мин, со стандартным отклонением в 70 мин. Время транзита через пищевод, двенадцатиперстную кишку и тощую кишку для здоровых субъектов, которых кормили картофельным пюре, помеченным серой, как сообщалось, составило 378+90 мин.
Большинство факторов, которые играют важную роль в скорости желудочной эвакуации, такие, как присутствие жиров и/или увеличенный объём пищи, также влияют и на кишечную подвижность. Например, обильная пища, богатая жирами, требует более долгих и сильных кишечных сокращений.
3.2.1.5. Первичное прохождение через печень
После того, как препараты и питательные вещества были абсорбированы эпителием, они попадают в капилляры подслизистой оболочки, которые, в свою очередь, подходят к венам тонкой кишки. Вены тонкой кишки, после соединения с венами селезёнки и поджелудочной железы, транспортируют препарат и питательные вещества через систему воротной вены в печень. В печени ретикулоэндотелиальные клетки абсорбируют питательные вещества, мелкие части-
цы и капли, а гепатоциты метаболизируют свободные ЛС и питательные вещества. Ферментативная деятельность - самая важная составляющая всего цикла первичного прохождения через печень. Количество препарата, который элиминируется путём печёночного метаболизма, может быть оценен как процент удаления или как экстракционное отношение (ER), которое является отношением нормы метаболизма препарата через печень к норме поступления препарата в печень (рис. 3-1):
 где Q - кровоток; С - концентрация препарата; ER - отношение извлечения.
где Q - кровоток; С - концентрация препарата; ER - отношение извлечения.
Количество препарата, которое будет доступно для проявления системного эффекта, можно оценить в терминах фракции доступности (Fоступности), которая избегает метаболизма первичного прохождения через печень:
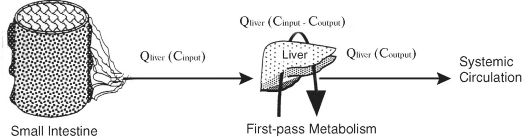 Рис. 3-1. Схематичное
представление абсорбции препарата из капилляров тонкой кишки через
гепатопортальную вену в печень, где осуществляется метаболизм первичного
прохождения, и то количество препарата, которое, избежав метаболизма
первичного прохождения через печень, поступает в системный кровоток
Рис. 3-1. Схематичное
представление абсорбции препарата из капилляров тонкой кишки через
гепатопортальную вену в печень, где осуществляется метаболизм первичного
прохождения, и то количество препарата, которое, избежав метаболизма
первичного прохождения через печень, поступает в системный кровоток
 Вышеприведённое
уравнение основывается на метаболизме первого порядка и предполагается,
что экстракционное отношение является постоянным для данного состава. В
случае нелинейного метаболизма, из-за ограниченной вместимости
ферментов для метаболизма, отношение извлечения будет являться
дозозависимой переменной, которая уменьшается с увеличением дозы.
Поэтому фракция доступности для системного эффекта (т.е. биодоступность)
значительно увеличивается с увеличением дозы препарата.
Вышеприведённое
уравнение основывается на метаболизме первого порядка и предполагается,
что экстракционное отношение является постоянным для данного состава. В
случае нелинейного метаболизма, из-за ограниченной вместимости
ферментов для метаболизма, отношение извлечения будет являться
дозозависимой переменной, которая уменьшается с увеличением дозы.
Поэтому фракция доступности для системного эффекта (т.е. биодоступность)
значительно увеличивается с увеличением дозы препарата.
3.2.1.6. Желудочно-кишечный метаболизм посредством микрофлоры
Желудочно-кишечная микрофлора представлена различными прокариотами и эукариотами, которые поселяются в пищеварительном тракте вскоре после рождения человека. Они колонизируют не только толстую кишку, но также и дистальный отдел подвздошной кишки. Все млекопитающие, включая человека, находятся в симбиозе с микробами. Примерами местной микрофлоры пищеварительного тракта у людей являются Bifidobacterium, Bacteroides fragilis и Bacteroides thetaiotaomicron. Во многих случаях они имеют важное значение для жизни хозяина. Поскольку желудочно-кишечная среда фактически существует без кислорода, то там отсутствует окисление, а для выживания в желудочно-кишечной среде бактерии выполняют биохимические реакции, и главным образом, - гидролиз. Микроорганизмы также способны разрушать коньюгированные метаболиты типа глюкуронидов, сульфатов, глутатионов и других форм коньюгатов. Другие эффекты микрофлоры пищеварительного тракта - сокращение кишечного времени транзита, гидролиз макромолекул, а также диетических полимеров в толстой кишке.
Тонкая кишка свободна от бактерий до дистального отдела подвздошной кишки, где микрофлора начинает увеличиваться в числе и разнообразии форм. В том случае, если бы активный компонент формы дозировки препарата не полностью абсорбировался перед достижением дистального отдела подвздошной кишки, то микрофлора метаболизировала бы его и переработанные продукты были бы полностью абсорбированы. Рассматривая разнообразие микрофлоры и их метаболических побочных продуктов, которые могут изменяться
от человека к человеку, следует иметь в виду, что тем самым они могут снижать биодоступность, эффективность и безопасность ЛС.
3.2.1.7. Желудочно-кишечный метаболизм посредством изоферментов цитохрома Р-450 (СУР3А4)
Среди важнейших ферментов, ответственных за метаболизм ксенобиотиков в организме человека, изозимы цитохрома Р-450 (СУР) - самая важная и исследованная группа ферментов. Их роль, классификация и функции будут обсуждены в отдельной главе. Подсемейство СУР, известное как СУР3А, наиболее изучено, поскольку СУР3А вовлечён в метаболизм более чем 50% всех ксенобиотиков. Член подсемейства СУР3А, изофермент СУР3А4 - основной цитохром Р-450 в человеческой печени. Его количество составляет в среднем около 30% от всех печёночных цитохромов Р-450 и это соотношение, возможно, возрастёт до 60% в индуцированной печени. В эпителиальном барьере тонкой кишки количество CУP3A4 составляет приблизительно 70% от общего числа цитохромов Р-450, представленных в тонкой кишке. Поэтому они играют важнейшую роль в кишечном метаболизме первичного прохождения препаратов, и эти препараты следует считать субстратами для СУР3А4. На системную доступность этих препаратов значимо влияет присутствие этого фермента не только в кишечнике, но также и в печени. Очевидно, присутствие ингибиторов или индукторов ферментативной системы увеличили бы или, наоборот, уменьшили бы соответственно доступность ЛС.
3.2.1.8. Эффект гликопротеина-Р
Гликопротеин-Р принадлежит к большой белковой группе мембранных активных транспортёров, которые существуют в различных областях организма человека, и известный как АТФ-транспортёр. В пищеварительном тракте этот белок присутствует на мембране эпителиальных клеток, обращённых в просвет тонкого кишечника, где выполняет функции транспортёра выведения или эффлюкса. Он является универсальным мембранным транспортёром, который действует в широком диапазоне эндогенных и экзогенных компонентов. Гликопротеин-Р структурирован таким образом, что играет определяющую роль в прохождении препарата сквозь мембрану клетки. Гликопротеин-Р - часть защитного механизма, который способствует вытеснению множества структурно разнообразных
ксенобиотиков из эпителиальных клеток. Таким образом, путём переноса ксенобиотиков из клеток этот белок уменьшает системную доступность ЛС, введённых в организм пероральным путём. В химиотерапии рака гликопротеин-Р является фокусом для стимулирования области множественного лекарственного сопротивления. В большом количестве исследований in vitro и in vivo было показано, что этот трансмембранный белок влияет на утечку числа структурно несвязанных ЛС, включая широко используемые противоопухолевые препараты (антрациклинр), блокаторы медленных кальциевых каналов (верапамил) и химиотерапевтических агентов (тамоксифен). Самая главная функция этого гликопротеина заключается в том, что он вызывает увеличение вытеснения химиотерапевтических агентов из опухолевых клеток. Такая точка зрения была предложена из-за близости гликопротеина-Р к СУР3А4, подобию их взаимодействию с различными веществами в тонком кишечнике и то, что их функции в кишечном барьере не только равны по значимости, но также дополняют друг друга.
3.2.1.9. Влияние пищи на абсорбцию в пищеварительном тракте
В общем виде, эффект пищевых продуктов на абсорбцию препаратов основан на их влиянии на уровень и степень всасывания. В определённых ситуациях уровень всасывания может меняться (задерживаться или ускоряться) в присутствии пищи, но степень абсорбции остаётся неизменной. Однако в некоторых случаях степень абсорбции уменьшается, а уровень всасывания остаётся неизменным. Очевидно, любое изменение в уровне всасывания затрагивает начало фармакологического ответа, тогда как изменение степени абсорбции может влиять на продолжительность действия препарата.
Взаимодействие пищи с ЛС в кишечнике - многостороннее и неоднозначное. Во-первых, пища может быть механическим барьером, препятствующим контакту ЛС с эпителием кишечника. Во-вторых, пища, стимулируя кровоток в пищеварительном тракте, способствует ускорению всасывания. В-третьих, пища может вступать с ЛС во взаимодействие, образуя хелатные комплексы (молоко, молочные продукты и другие пищевые смеси, содержащие ионы кальция, магния, железа, могут связываться с тетрациклинами, образуя нерастворимые
комплексы). Пища с высоким содержанием углеводов, жиров или белков значительно снижает всасывание ампициллина, оксациллина, изониазида. В то же время указанный состав пищи способствует лучшему всасыванию гризеофульвина. Необходимо также учитывать, что в пищевой массе лучше растворяются ЛС с большой молекулярной массой (спиронолактон, нитрофураны, гризеофульвин). Пища усиливает секрецию жёлчных кислот, в результате повышается растворимость, а следовательно, и абсорбция жирорастворимых ЛС (карбамазепина, спиронолактона, дикумарина, гризеофульвина и циклоспорина). Другой пример: увеличение степени абсорбции мидазолама, триазолама¤, нифедипина и циклоспорина, когда эти препараты запивают соком грейпфрута.
Не всегда замедление всасывания сопровождается уменьшением общего количества ЛС, попадающего в системное кровообращение, а приводит лишь к снижению максимальной концентрации его в крови и увеличению времени её достижения. Тем не менее, поскольку терапевтический эффект зависит от концентрации ЛС в крови, а не от поступившей в организм дозы, то замедление всасывания может привести к утрате эффекта, особенно в случае назначения препаратов с небольшим периодом полувыведения (например, фуросемид). Следовательно, если нужно быстро создать высокую концентрацию, то лучше принимать препарат до еды (если нет индивидуальных противопоказаний). При отсутствии экстренных ситуаций, когда необходимо проводить поддерживающую терапию, то целесообразнее назначать препараты после еды. Пищеварительные ферменты и витамины целесообразнее назначать во время еды, солевые препараты и большинство растительных настоек - после еды (если нет специальных показаний). В то же время следует учесть, что снижение всасывания (и биодоступности) при приёме с пищей некоторых препаратов еще не является показанием к их назначению перед едой, так как при этом ЛС может оказывать раздражающее действие, вызывать обострение гастрита, язвенной болезни или способствовать развитию диспепсических явлений.
Таким образом, влияние пищи на абсорбцию большинства ЛС неоднозначно, так как, наряду с действием пиши на кровоток, секрецию ферментов, количество сока, перистальтику, включаются и другие механизмы (исходное состояние функциональных систем, печени, характер пищи и многие другие факторы).
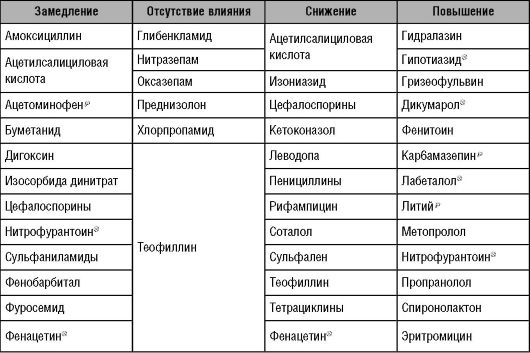
Таблица 3-1. Влияние пищи на всасывание препарата
 Говоря
о взаимодействии ЛС и пищи, следует отметить, что многие ЛС, особенно
при длительном применении, могут нарушать всасывание некоторых
ингредиентов пищи и в итоге вызывать различные патологические состояния.
Например, гормональные пероральные контрацептивы нарушают всасывание
фолиевой, аскорбиновой кислот, рибофлавина; антикоагулянты непрямого
действия подавляют всасывание витамина К♠, слабительные средства - всасывание всех жирорастворимых витаминов и т.д.
Говоря
о взаимодействии ЛС и пищи, следует отметить, что многие ЛС, особенно
при длительном применении, могут нарушать всасывание некоторых
ингредиентов пищи и в итоге вызывать различные патологические состояния.
Например, гормональные пероральные контрацептивы нарушают всасывание
фолиевой, аскорбиновой кислот, рибофлавина; антикоагулянты непрямого
действия подавляют всасывание витамина К♠, слабительные средства - всасывание всех жирорастворимых витаминов и т.д.
3.2.1.10. Влияние заболеваний
Такие серьезные заболевания, как язвенный колит и болезнь Крона (воспалительные заболевания кишечника) могут значительно уменьшать степень всасывания препаратов. Кроме того, сообщалось, что освобождение желудка может быть отсрочено у пациентов с сахарным диабетом. Болевой синдром, снижение АД, кровотечение также вызывают достоверное снижение абсорбции ЛС из пищеварительного тракта.
В зависимости от типа болезни, можно ожидать различные изменения в процессе абсорбции препаратов.
3.2.1.11. Другие факторы, влияющие на абсорбцию при пероральном приеме лекарственных средств
Так называемые нефизиологические факторы, которые также могут влиять на всасывание препаратов.
• ЛС могут существовать в виде рацемической смеси R и S энантиомеров. Различные энантиомеры имеют различный уровень и степень абсорбции и поэтому могут давать различные фармакологические ответы.
• Составные части различных лекарственных форм препарата могут приводить к различному уровню и степени всасывания. Например, так называемая пероральная форма управляемого медленного высвобождения имеет другой профиль абсорбции, отличающийся от обычных твёрдых лекарственных форм, которые готовятся путём прямого сжатия.
• Физико-химические свойства препаратов (гидрофобность и гидрофильность) влияют на абсорбцию. Препараты с более высоким коэффициентом разделения обычно всасываются быстрее и более полно. Например, гидрофобные β-адреноблокаторы пропранолол и метопролол имеют более быстрый уровень всасывания и высокую степень абсорбции, чем гидрофильньные атенолол и надолол®. Тип соли или кристалла, входящего в препарат, может иметь различную плотность и, следовательно, может изменять абсорбционное поведение препарата.
• Выбор времени приёма препаратов относительно режима питания - также важный фактор, который может повлиять на их абсорбцию. Например, прием пенициллина G или эритромицина за 1 ч до еды или спустя 2 ч после того, улучшает уровень и степень всасывания этих препаратов. Приём препаратов непосредственно во время еды вызовет снижение скорости желудочной эвакуации и увеличит время нахождения в кислой среде желудка. Уровень и степень всасывания некоторых препаратов, типа галофантринаp, улучшается при совместном приёме с жирными пищевыми продуктами.
• Разрушение и растворение твёрдой формы может также ограничить степень абсорбции препаратов. Различия в характере наполнителей лекарственных форм могут быть причиной значительных отличий в концентрациях ЛС в крови у одного и того же больного. В таких случаях говорят об отсутствии биоэквивалентности разных лекарственных форм.
3.2.2. Основные механизмы абсорбции в пищеварительном тракте
Основные механизмы, вовлечённые в транспорт препаратов через всасывающий эпителий пищеварительного тракта в системное кровообращение, заключаются в следующих этапах.
• Пассивная диффузия:
- транцеллюлярная (чрезклеточная) диффузия;
- парацеллюлярная (околоклеточная) диффузия.
• Трансцеллюлярная диффузия, опосредованная носителем или курьером (облегчённая диффузия).
• Транцеллюлярная диффузия посредством гликопротеиного-Р эффлюкса.
• Активный транспорт.
• Пиноцитоз.
Два других механизма могут, по возможности, быть вовлечены в абсорбцию препаратов из пищеварительного тракта:
• сопротивление растворителю;
• ион-парная абсорбция.
3.2.2.1. Пассивная диффузия: трансклеточная и параклеточная
Пассивная диффузия играет важную роль в большом количестве физиологических процессов. Большинство ЛС транспортируется через мембрану пищеварительного тракта путём пассивной диффузии. Движущая сила в этом типе проникновения через барьер - разность концентрации между средой в полости пищеварительного тракта и системным кровообращением. Это означает, что концентрация препарата больше на участке поглощения. Рассматривая большой объём системного кровотока и меньший объём жидкости в пищеварительном тракте, можно констатировать, что концентрация препарата на участке всасывания больше, чем концентрация свободного препарата в системном кровотоке.
3.2.2.2. Трансцеллюлярная диффузия посредством переносчика (облегченная диффузия)
Когда абсорбция напоминает пассивную диффузию, но при этом опосредованно использует носитель или курьера, то этот процесс называют трансцеллюлярной диффузией, опосредованной носите-
лем, или облегчённой диффузией. Крупные гидрофильные молекулы, которые не распадаются в липидной части барьера, и если их размеры больше, чем поры барьера, то они могут использовать другой тип транспорта. Мембрана содержит макромолекулы, которые действуют как переносчик и тем самым облегчают прохождение препарата через мембрану, не затрачивая при этом энергию. Скорость прохождения зависит от следующих факторов:
• градиента концентрации препарата;
• количества макромолекул, т.е. переносчиков, предоставленных для абсорбции;
• уровня взаимодействия препарата с переносчиком (т.е., и вместе - на входе в мембрану, и порознь - на выходе из мембраны);
• коэффициента прохождения комплекса переносчик-препарат через мембрану.
Очевидно, что воздействие любого из предложенных механизмов может ограничивать абсорбцию.
Хотя облёгченный транспорт - это процесс, не требующий энергетических затрат и который не противостоит градиенту концентрации, тем не менее он имеет существенные отличия от пассивной диффузии: этот процесс зависит от количества курьеров, находящихся в барьере, что, в свою очередь, может проявиться так называемым феноменом насыщения. Поэтому при высоких концентрациях препаратов абсорбционная кинетика может стать нелинейной. Важно отметить, что только несколько экзогенных составляющих используют облегчённый транспорт. Среди них - эндокринные стероиды (рецептор - опосредованная клеточная абсорбция) и витамин В12 (гликопротеин-опосредо- ванный кишечный транспорт).
3.2.2.3. Транцеллюлярная диффузия посредством P-гликопротеинного эффлюкса
Гликопротеин-Р с молекулярной массой 170 кД - АТФ-зависимый транспортёр эффлюкса, взаимодействует с большим количеством ксенобиотиков. Этот белок распространён в большом количестве тканей, особенно в эпителиальных клетках пищеварительного тракта, печени, почках, поджелудочной железе и в капиллярах эндотелия мозга и яичек. Его главная физиологическая роль - предотвратить смерть клетки путём перекачки препарата из клетки против градиента концентрации. Этот белок известен как ответственный за так называемое множественное лекарственное сопротивление. Снижая внутрикле-
точные концентрации препаратов, он препятствует им в достижении их терапевтических целей. Роль гликопротеина-Р состоит в ограничении абсорбции в пищеварительном тракте и в биодоступности ЛС, имеет важное защитное значение для организма человека.
3.2.2.4. Активный транспорт
В активном транспорте, подобном облегчённому транспорту, переносчики используются, чтобы передать через барьер определённые молекулы. Переносчики - это белки, и как противоположность облегчённого транспорта, они требуют затрат энергии для абсорбции. Активный транспорт происходит, главным образом, против градиента концентрации и только в некоторых органах - в кишечнике, печени и почках. Поскольку процесс требует затрат энергии, а концентрация переносчиков белка ограничена, то активный транспорт способен к проявлению эффекта насыщения. Кроме того, курьеры белка подвержены конкурентному ингибированию составами подобной структуры. Пути активного транспорта в тонком кишечнике необходимы для транспорта определённых питательных веществ, типа урацила, холина, производных фолата и солей жёлчи. Молекулы препарата, структурно похожие на эти питательные вещества, используют те же самые пути абсорбции. Например, противоопухолевый препарат фторурацил использует путь урацила, а другой протиопухолевый препарат - метотрексат - использует путь производных фолата.
Точный механизм активного транспорта неизвестен. Очевидно, переносчики должны быть весьма специфичными для определён- ных составов ЛС. Например, белковый переносчик может захватить молекулу препарата, пройти через не требующее энергии конформационное изменение и, перевернувшись на 180°, выпустить его в противоположной стороне (рис. 3-2, а). Другой сценарий: белковый курьер мог бы быть очень большой молекулой со связанными между собой участками и функциональными группами через всю её поверхность, позволив тем самым перевозить молекулы препарата между связанными участками к противоположной стороне (рис. 3-2, б).
3.2.2.5. Пиноцитоз
В этом типе абсорбции ЛС с большими молекулами, типа белковых или липофильных переносчиков, таких как липосомы или капельки микроэмульсии, могут пересекать мембрану путём впитывания этой
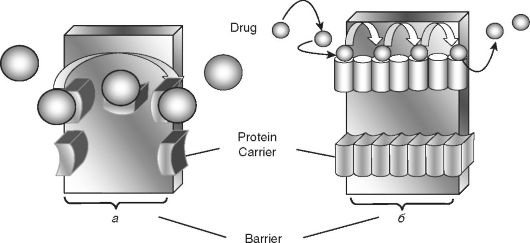 Рис. 3-2. Гипотетические механизмы активного транспорта: а - прямая гипотеза; б - курсирующая гипотеза
Рис. 3-2. Гипотетические механизмы активного транспорта: а - прямая гипотеза; б - курсирующая гипотеза
мембраной молекулы препарата или комплекса (препарата вместе с переносчиком). Процесс начинается, когда мембрана охватывает молекулу или частицу, прерывается и формирует покрытую мембраной частицу. Затем покрытая молекула или частица транспортируется сквозь барьер, где препарат или частица высвобождается из мембраны.
Мы знаем очень немного о физиологическом значении пиноцитоза. Он не относится к главным механизмам абсорбции препаратов, хотя этот процесс мог бы быть ответственным за транспортировку малых количеств макромолекул.
3.2.2.6. Абсорбция, зависимая от растворителя
Предполагается, что в этом типе механизма абсорбция препарата зависит от физико-химических особенностей растворителя. Поэтому проникновение растворителя будет способствовать транспорту рас- творённых в нём молекул препарата сквозь мембрану.
3.2.2.7. Ион-парная абсорбция
Согласно теории зависимости степени абсорбции от константы диссоциации, ионизированные формы препаратов не могут непосредственно диффундировать через биологический барьер, однако много
ионизированных препаратов, типа четвертичных аммониевых соединений и серных кислот, абсорбируются после перорального приёма. Механизм абсорбции ионизированных молекул не совсем ясен. Одно из объяснений - гипотеза абсорбции ионной пары. Согласно этой гипотезе, противоположно заряженные молекулы могут взаимодействовать и формировать нейтральный комплекс. Затем нейтральный комплекс пересекает биологический барьер путём пассивной диффузии. Поскольку формирование нейтрального комплекса представляет собой простое химическое равновесие, то избыток одного иона может увеличить формирование комплекса. Таким образом, формирование и поглощение комплекса зависит от концентрации одного или обоих ионов, и эта зависимость вносит свой вклад в беспорядочное поглощение препарата. Это означает, что формирование комплекса может ограничивать абсорбционный процесс. Разрушение комплекса также базируется на химическом равновесии. При попадании нейтрального комплекса внутрь мембраны установится новое равновесие, и все три химические разновидности молекулярных частиц - положительные, отрицательные и нейтральные - будут присутствовать в мембране одновременно. Как только заряженные молекулы покидают барьер, так больше нейтральных комплексов распадается на заряженные молекулы. Эта гипотеза полностью подтверждена экспериментальными данными in vivo.
3.2.3. Абсорбция при других существующих путях введения препаратов
3.2.3.1. Сублингвальная и буккальная абсорбция
Абсорбция происходит в присутствии слюны с рН, приблизительно равной 6,0 или 7,0. Всасывание препаратов осуществляется через обильно васкуляризированную слизистую оболочку в системный кровоток только посредством пассивной диффузии или пиноцитоза и ограничено молекулярной массой препарата. Этот путь введения наиболее подходит для препаратов, которые нестабильны при низкой рН желудка, разрушаются пищеварительными ферментами или подвергаются метаболизму в печени. Однако поток собственной слюны со скоростью 0,5 мл/мин может смывать препарат с участка абсорбции в желудок. Поэтому лекарственная форма может также играть важную роль в сублингвальном/буккальном всасывании и его биодоступнос-
ти. Кроме того, известно, что с возрастом абсорбция в пищеварительном тракте постепенно уменьшается, а сублингвальное/буккальное всасывание сохраняет свое постоянство.
Известную способность нитроглицерина и изосорбида динитрата всасываться через слизистую оболочку полости рта используют в новых буккальных лекарственных формах этих препаратов, способных достаточно длительно поддерживать терапевтическую концентрацию препаратов в крови.
3.2.3.2. Ингаляционный путь
Абсорбция ингалируемых субстанций, выпускаемых в виде аэрозолей или газов, осуществляется от мембраны или слизистой оболочки носа, глотки, трахеи, бронхов, бронхиол, альвеолярных мешочков и альвеол. Этот путь введения используют для достижения местного, а также системного эффекта. Всасывание жирорастворимых и летучих газов, типа эфира и хлороформа, осуществляется очень быстро, а системный анестезирующий эффект проявляется практически мгновенно. Водорастворимые газы не проникают дальше носоглоточной области. Абсорбция препаратов в форме аэрозолей, представляющих рассеянные твёрдые частицы или капельки, зависит от депозиции этих частиц или капелек. Размер частиц и скорость воздушного потока ограничивает их перемещение через лёгочную систему. Крупные частицы (5-30 мкм) остаются в носоглоточной области. Мелкие частицы (1-5 мкм) оседают в трахее, бронхах и бронхиолах в виде осадка. Самые мелкие частицы (1 мкм) проникают глубоко в лёгочное дерево, достигают альвеолярных мешочков и растворяются в имеющейся там жидкости. Поэтому всасывание мелких частиц, которые как бы пойманы в жидкостную ловушку, происходит главным образом через пассивную диффузию. Частицы также могут проникать непосредственно через эпителиальную мембрану и абсорбироваться посредством пиноцитоза. Ингаляционный путь введения широко используют в анестезиологии для проведения ингаляционного наркоза (введение анестетиков) и в пульмонологии, где в последние годы с успехом применяют β2-адреномиметики, ингаляционные глюкокортикоиды и М-холиноблокаторы.
Препараты, введённые ингаляционным путём, оказывают системный эффект, избегая этапов прохождения низкого рН желудка и первичного прохождения через печень. Однако абсорбция и биодоступность препаратов, введённых путём ингаляции, может быть непосто-
янной из-за случайного удаления частиц при выдохе или кашле. Стоит отметить, что максимальная воздушная вместимость лёгких равна приблизительно 5700 смЗ, а общий воздушный поток, проходящий через лёгкие при вдохе и выдохе, при активном нормальном дыхании равен приблизительно 4500 смЗ; поэтому в лёгких сохраняется только 1200 смЗ воздуха. Число дыханий в минуту - около 12-20. В покое этот объём воздуха снижается до 500 смЗ. Скорость потока воздуха очень высока в носоглоточной области и уменьшается по мере достижения альвеол. Следовательно, если частицы не успели абсорбироваться, то при выдохе они удаляются с участка абсорбции. Для мелких частиц всегда существует большая вероятность быть удалёнными при выдохе. Само собой разумеется, что при кашле или чихании может быть удалено с участка абсорбции существенное число частиц, особенно если это происходит сразу же после ингаляции препарата.
3.2.3.3. Подкожное всасывание
Подкожное введение обычно используют для инъекции маленьких объёмов вакцин или препаратов, типа инсулина и местных анестетиков. Этот способ также используют для имплантирования препаратов с лекарственной формой по типу медленного высвобождения, в виде полимерных палочек и шариков. После введения препараты распространяются путём пассивной диффузии, чтобы достигнуть первичной мембраны капиллярной стенки. Если состав ЛС является липофильным, то он может распространиться непосредственно через капиллярную мембрану путём трансцеллюлярной пассивной диффузии. Водорастворимые препараты диффундируют через проложенные поры и везикулярные каналы мембраны путём параклеточной пассивной диффузии. Таким образом, подкожное введение способствует быстрому всасыванию водорастворимых веществ, масляные же растворы всасываются медленно, и их всасывание обычно сопровождается выраженными болевыми ощущениями. Достижение системного эффекта при подкожном введении зависит от лекарственной формы препарата и скорости кровотока в данной области. Поэтому факторы, вызывающие сужение капилляров (охлаждение, приём вазоконстрикторов), значительно уменьшают абсорбцию препаратов с этого участка.
3.2.3.4. Внутримышечное всасывание
Абсорбция при внутримышечном введении препаратов похожа на абсорбцию при подкожном введении. Липофильные составы всасы-
ваются очень быстро путём трансцеллюлярной пассивной диффузии, тогда как жиронерастворимые молекулы абсорбируются путём параклеточной пассивной диффузии через проложенные поры и везикулярные каналы. Уровень абсорбции зависит от следующих факторов:
• Препараты всасываются быстрее из дельтовидной мышцы, чем из ягодичной.
• Абсорбция препаратов из ягодичной мышцы у людей с более низким соотношением жировой ткани к мышечной быстрее, чем у людей с более высоким соотношением.
• Местное проникновение жирорастворимых веществ выше у людей с более высоким соотношением жировой ткани к мышечной, чем у людей с более низким соотношением.
• Абсорбция препаратов при внутримышечном введении зависит от кровотока. Кровоток в мышцах в покое равен приблизительно 3-4 мл/мин в 100 г мышечной массы. Он увеличивается до максимума, который составляет 80-90 мл/мин в 100 г мышечной массы. Поэтому абсорбция препаратов из мышц у активных людей происходит быстрее, чем у людей, ведущих малоподвижный образ жизни.
• Препараты, введённые в мышцу или подкожную область, в отличие от попавших в пищеварительный тракт, не ограничены в сроках нахождения в данных областях, поэтому возможно использование форм медленного высвобождения.
• Если препараты введены в форме раствора, эмульсии или суспензии, то максимальный объём не должен превышать 10 мл.
Внутримышечное введение может использоваться для препаратов, которые разрушаются в пищеварительном тракте или же плохо всасываются, однако неполное всасывание может также проявиться и в мышцах из-за выпадения в осадок или разложения препаратов. Кроме того, некоторые состояния (гипотония и болезни органов кровообращения) могут также уменьшать уровень и степень абсорбции.
3.2.3.5 Внутрибрюшинная абсорбция
Брюшина с её большой площадью поверхности и богатым кровоснабжением представляет собой участок абсорбции или ресорбции препаратов для внутрибрюшинного введения. Препарат, поступивший в кровь брюшинной капиллярной сети, достигает портального кровообращения и доставляется в печень, а затем и в ткани организма. Поэтому препарат может подвергаться элиминации при первичном прохождении через печень. В практической медицине внутрибрю-
шинный обмен препаратами используют при проведении перитонеального диализа. Препараты, добавленные к диализату (растворы для диализа), попадают в системное обращение посредством пассивной диффузии или могут быть удалены из системного обращения вместе с диализатом, который не содержит никакого препарата.
3.2.3.6. Внутрикожная абсорбция
Участок инъекции при внутрикожном введении ЛС расположен ниже рогового слоя (stratum corneum). Этот путь введения не используют для достижения системного эффекта. Внутрикожную инъекцию часто применяют для аллергического тестирования ЛС или для введения нескольких вакцин, которые предназначены для определения местной реакции, например, с диагностической целью.
3.2.3.7. Интраназальная абсорбция
Назальный путь введения ЛС можно рассматривать как удобный способ введения для достижения системного эффекта. Носовой проход покрыт высокоспециализированным и уникальным эпителием, в состав которого входят: обонятельный эпителий, щёточные клетки, бокаловидные клетки, ресничатые и базальные клетки. Важная особенность этого участка абсорбции - способность эпителия метаболизировать ксенобиотики. Число изоформ цитохрома Р-450, типа СУР1А1, СУР2В1 и СYР4В1 выявлено в полости носа в нескольких различных разновидностях. Поэтому носовой метаболизм может уменьшать биодоступность препаратов. Область всасывания начинается в носовых ходах и заканчивается в глотке. Абсорбция препаратов из этого участка осуществляется также посредством пассивной диффузии. Жирорастворимые газы абсорбируются или метаболизируются эпителием. Нерастворимые частицы обычно удаляются или проглатываются после их депозиции. Водорастворимые газы или частицы, растворённые в слизи, проходят через эпителий и проникают в капилляры. Другие факторы, которые могут влиять на абсорбцию препаратов с этого участка, - это кровоснабжение данной области, вязкость слизи и скорость её выработки, рН, доза ЛС, экологические факторы (влажность и температура).
3.2.3.8. Ректальная абсорбция
Прямая кишка длиной 15-20 см и площадью поверхности 200- 400 см2 расположена в терминальной части толстой кишки. Этот
участок абсорбции имеет рН между 7,4 и 8,0 с ограниченной буферной ёмкостью и температурой 37 °С. Это - высоковаскуляризированная область. Верхняя ректальная артерия - главная артерия, а венозная сеть ректальной области включает верхнюю ректальную вену, среднюю ректальную вену и нижнюю венозную ректальную систему. Верхняя ректальная вена связана с гепатопортальной венозной системой; средняя и нижняя вены впадают в нижнюю кавальную вену. Поэтому препараты, абсорбируемые в верхней части прямой кишки, попадают в верхнюю ректальную вену и подвергаются метаболизму при первичном прохождении через печень перед распределением в тканях. Препараты, которые всасываются в среднюю и нижнюю ректальные вены, избегают печени и распределяются по телу, путем абсорбции попадая в системное кровообращение. Механизмы абсорбции на этом участке соответствуют трансцеллюлярной и параклеточной пассивной диффузии. Доказано, что в прямой кишке отсутствуют активные виды абсорбции и курьер-опосредованный транспорт. Немногие преимущества использования этого пути введения препаратов заключаются в следующем.
• Это устойчивая среда для всасывания препаратов; рН, вязкость и температура постоянны, ректальная подвижность очень низкая, и время нахождения препаратов в прямой кишке зависит от акта дефекации. Данные условия подходят для препаратов с лекарственной формой по типу медленного высвобождения.
• Лимфатическая циркуляция в ректальной области существенна, и поэтому препараты, действие которых направлено на лимфу, можно вводить ректально.
• В прямой кишке нет ферментов, и поэтому нет метаболизма на этом участке, однако метаболическая деятельность кишечной флоры продолжает оставаться существенной проблемой.
• Альтернативный путь введения препаратов, для которых характерна низкая биодоступность после перорального приёма.
• Это удобный путь введения препаратов для пациентов, которые не могут принять твёрдые формы дозировки через рот, например, младенцы, пациенты в бессознательном состоянии, пожилые люди.
Ректальный путь введения препаратов имеет несколько недостатков:
• Элиминация при первичном прохождении через печень препарата, абсорбированного в верхней части прямой кишки.
• Непригодность введения раздражающих препаратов.
• Непостоянная биодоступность.
3.2.3.9. Внутривлагалищная абсорбция
Абсорбция происходит в высоковаскуляризированной области влагалища; рН этой среды во взрослой популяции обычно кислая - между 4,0 и 5,0. Низкая рН обусловлена ферментативным процессом брожения нормально секретируемого гликогена в молочную кислоту посредством бактерий, которые обычно колонизируют этот участок. Большинство вагинальных форм дозировок предназначено для проявления местного эффекта (клотримазол, флуконазол, препараты, нормализующие микрофлору влагалища и др.); однако этот участок может быть эффективно использован для достижения системного эффекта, например, для препаратов, содержащих прогестерон. Абсорбция из этого участка происходит посредством трансцеллюлярной и парацеллюлярной пассивной диффузии.
3.2.3.10. Трансдермальная абсорбция
Механизм чрезкожной абсорбции ксенобиотиков, хотя и базируется на диффузии, но отличается от вышеупомянутых путей введения препаратов из-за сложности этого барьера. Кожа состоит из следующих слоёв.
• Эпидермис, состоящий из рогового, зернистого, шиповатого и зародышевого (базального) слоя.
• Дерма представлена соединительной тканью, жировой тканью, капиллярами и железистой тканью.
• Придатки кожи включают: потовые железы, сальные железы и волосяные фолликулы.
Внешний роговой слой (stratum corneum) ограничивает абсорбцию. Роговой слой представлен плотно упакованным кератином, поэтому он предотвращает всасывание. Возможность прохождения через кожу ксенобиотиков обеспечивают придатки кожи, которые составляют приблизительно 1% от общей площади поверхности тела. Передача препаратов через эти открытые доступы быстра, но не представляет существенной важности, по сравнению с абсорбцией через 99% оставшейся площади поверхности. Поэтому два главных механизма, чрезкожная абсорбция и абсорбция через придатки кожи, участвуют во всасывании препаратов через кожу. Дерма или собственно кожа - слой выше подкожной области. Когда препараты достигают дермы,
то они могут свободно диффундировать в капилляры подкожной области и попасть в системное обращение. Уровень и степень трансдермальной абсорбции зависят от следующих факторов:
• Факторы, связанные с кожей:
- целостность кожи и её состояние;
- частота применения (нанесения) препаратов;
- место нанесения препарата;
- площадь нанесения препарата;
- кожная биотрансформация из-за присутствия на ней ферментов.
? Изоферменты цитохрома Р-450:
- СУР1А1;
- СУР2А1;
- СУР1В1;
- СУР2В1.
? Ферменты II фазы метаболизма.
? UDP-глюкуронозил трансфераза:
- рибизозимы трансферазы глутатиона;
- катаболические ферменты:
- протеазы;
- липазы;
- гликозидазы;
- фосфатазы.
• Факторы, связанные с препаратом:
- коэффициент разделения (разведения) препарата;
- частица и молекулярный размер;
- вязкость;
- коэффициент диффузии препарата в лекарственной форме;
- коэффициент диффузии препарата в коже.
• Экологические факторы:
- температура;
- влажность;
- скорость воздушного потока.
• Дополнения, усиливающие проникновение агентов в лекарственной форме:
- алкоголь или другие органические растворители;
- сурфактанты (сульфат лаурила натрия);
- запрещенные составы, такие, как диметилсульфоксид (dmso), диметилформамид (dmf), диметилацетамид (dma).
Традиционно накожные аппликации применяли для местных воздействий, в последние годы трансдермальный путь введения при- обрёл большое значение и для системного введения ЛС. Например, в кардиологии для профилактики приступов стенокардии широко используют нитроглицериновую мазь, пластыри. Дерма проницаема как для жирорастворимых, так и для полярных водорастворимых соединений. Через эпидермис хорошо проникают только жирорастворимые соединения, а ионы, не растворимые в липидах, проникают медленно, минуя липидный барьер эпидермиса через волосяные луковицы и сальные железы.
Таким образом, знание особенностей всасывания ЛС при различных способах введения помогает врачу правильно назначать препарат, определять дозу ксенобиотика и схему его приёма.
Литература
Amlacher R., Hartl А., Neubert R. et al. Influence of ion-pair formation оп the pharmacokinetic properties of drugs: pharmacokinetic interactions of bretylium and hexasalicylic acid in rabbit // J Pharm. Pharmacol. - 1991. - Vol. 43. - P. 794.
Burks T.F., Galligan J.J., Porreca F., Barker W.D. Regulation of gastric emptying // Fed. Proc. - 1985. - Vol. 44. - P. 2897.
Christian Р.Е., More J.G., Sorenson J.A. et al. Effect of meal size and correction technique оп gastric emptying time: studies with two tracers and opposed detectors // J. Nucl. Med. - 1980. - Vol. 21. - P. 883.
Ehle F. R., Robertson J. В., Van Soest. Inf1uence of dietary fibers оп fermentation in human large intestine // J. Nutr. - 1982. - Vol. 112. - P. 156.
Finegold S.M., Sutter V.L., Mathisen G.E. Normal indigenous intestinal flora // Human Intestinal Microflora in Health and Disease / Ed. D.J. Hentges. - N.Y.: Academic Press, 1983.
Gibaldi М. Limitation of classical theories of drug absorption // Drug Absorption / Eds L.E. Prescott, W.S. Nimmo. - Lancaster: МТР Press Limited Falcon House, 1981.
Guyton А.С., Hall J.E. Textbook of Medical Physiology. - Philadelphia: W.B. Saunders, 1996. - 793 p.
Hall S.D., Thummel К. Е, Watkins Р.В. et al. Molecular and physical mechanism of first-pass extraction // Drug Metab. Dispos. - 1999. -
Vol. 27. - P. 161.
Hartl А., Amlacher R., Neubert R., Hause. С. Influence of ion-pair formation of beryllium and hexylsalicylic acid оп their blood levels in dogs //
Pharmazie. - 1990. - Vol. 45. - P. 295.
Hayton W.L. Rate-limiting barriers to intestinal drug absorption: а review // J. Pharmacokinet. Biopharm. - 1980. - Vol. 8. - P. 321.
Kim R.B., Fromm M.F., Wandel С. et al. The drug transporter P-glycoprotein limits oral absorption and brain entry of protease inhibitors // J. Clin.
Invest. - 1998. - Vol. 101. - P. 289.
Lown K. S., Baily D. G., Fontana .R. J. et al. Grapefruit juice increases felodipine oral availability in humans by decreasing intestinal СУР3А4 protein expression // J. Clin. Invest. - 1997. - Vol. 99. - P. 25-45.
Lown K. S., Мауо R. R., Leichtman А. B. et al. Role of intestinal P-glycoprotein (mdr 1) in interpatient variation in the oral bioavailability of cyclosporin А // Clin. Pharmacol. Ther. - 1997. - Vol. 62. - P. 248.
Nimmo W.S. Gastric emptying and drug absorption // Drug Absorption / Eds L.E. Prescott, W.S. Nimmo. - Lancaster: МТР Press Limited Falcon
House, 1981.
Oberle R.L., Amidon G.L. The influence of variable gastric emptying and intestinal transit rates оп the plasma level curve of cimetidine: ап explanation for double peak phenomenon // J. Pharтасоkiπеt. Biopharm. - 1987. - Vol. 15. - P. 529.
O'Reilly S, Wison C.G., Hardy J.G. The influence of food оп the gastric emptying of multiparticulate dosage forms // Int. J. Pharm. - 1987. -
Vol. 34. - P. 213.
Pond S.M., Tozer T.N. First-pass elimination: basic concepts and clinical consequences // Clin. Pharтасоkin. - 1984. - Vol. 9.
Rabinson P.H., Moran Т., McHugh P.R. Inhibition of gastric emptying and feeding by fenfluramine // J. Physiol. - 1986. - Vol. 250.
Savage D.C. Gastrointestinal microflora in mammalian nutrition // Аnnu.
Rev Nutr. - 1986. - Vol. 6. - P. 155.
Ueda K., Yoshida А., Amachi Т. Recent progress in P-glycoprotein research //
Anticancer Drug Des. - 1999. - Vol. 14. - P. 115.
van der Ohe М., Camillari М. Measurements of small bowel and colonic transit: indications and methods // Мауо Clin. Proc. - 1992. - Vol. 67. -
P. 1169.
Welling P.G. Effect offood оп drug absorption //Аnnu. Rev. Nutr. - 1996. -
Vol. 16. - P. 383.
Yu D.K. The contribution of P-glycoprotein to pharmacokinetic drug-drug interaction // J. Clin. Pharmacol. - 1999. - Vol. 39. - P. 1203-1211.