Клиническая фармакокинетика: теоретические, прикладные и аналитические аспекты: руководство / Под ред. В.Г. Кукеса. - 2009. - 432 с
|
|
|
|
ГЛАВА 10 ОСОБЕННОСТИ ФАРМАКОКИНЕТИКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРИ ЗАБОЛЕВАНИЯХ ПЕЧЕНИ
С.Ю. Сереброва, А.К. Стародубцев, С.Н. Кондратенко
Печень выполняет в организме ряд функций, влияющих, в том числе, на фармакокинетику ЛС.
• Синтетическая функция. Печень - единственный орган, синтезирующий альбумины, фибриноген, протромбин, проконвертин, проакцелерин. Здесь образуется основная масса α- и значительная часть иных глобулинов, гепарина, ферментов. У лиц с заболеваниями гепатобилиарной системы концентрация общего белка сохраняется в пределах нормы, однако при тяжёлом повреждении паренхимы (острая и хроническая печёночная недостаточность) наблюдают её снижение, причём на фоне повышенного содержания γ-глобулинов.
• Детоксикация и клиренс. Печень участвует в обезвреживании ряда эндогенных продуктов метаболизма и в химическом превращении некоторых ксенобиотиков (чужеродных организму химических веществ). Иногда очищение крови проходит путём избирательного поглощения из неё вещества и выделения
его с жёлчью без химических превращений. Нарушение захвата (экстрагирования) ЛС печенью изменяет их фармакокинетику, поскольку при первом прохождении в ней обычно задерживается более 60% от их количества.
• Депонирующая функция. В печени происходит накопление гликогена, витамина A и др.
• Внешнесекреторная функция. Выделение жёлчи в кишечник - необходимое условие для всасывания жиров и жирорастворимых соединений, в том числе витаминов А, D, E, K.
Анатомо-физиологический обзор гепатобилиарной системы. Основные нарушения, влияющие на фармакокинетику препаратов
Гепатоцит - основная структурная и функциональная единица печени; клетка функционально и пространственно биполярна: один полюс обращён к синусоидальному капилляру (здесь мембрана образует многочисленные микроворсины, через них в клетку поступают различные химические соединения), другой - к жёлчному канальцу. В ядрах гепатоцитов находятся многочисленные ферменты, участвующие в синтезе РНК, ДНК и белков.
Микросомы - фрагменты ЭПР, их ферменты играют важную роль в конъюгации билирубина, метаболизме стероидов, биосинтезе белков, выделяемых клеткой в тканевую жидкость, углеводном обмене, обезвреживании лекарственных и токсических веществ. Микросомальные и немикросомальные ферменты катализируют несинтетические реакции метаболизма ЛС (окисление, восстановление и гидролиз). В основе синтетических реакций лежит конъюгация ЛС с эндогенными субстратами (глюкуроновая кислота, сульфаты, глицин, глутатион, метильные группы и вода). Соединение указанных веществ с ЛС происходит через ряд функциональных групп: гидроксильную, карбоксильную, аминную. После завершения реакции молекула препарата становится более полярной и, следовательно, легче выводится из организма. Немикросомальные ферменты участвуют в биотрансформации малого числа лекарственных веществ, но среди них есть распространённые препараты: ацетилсалициловая кислота и сульфаниламиды. При острой и хронической печёночной недостаточности нарушается обмен ксенобиотиков, зависящий от микросомальных и немикросомальных ферментов. При циррозе печени (ЦП) активность сульфатаз находится на обычном уровне (сульфотрансфераз - иногда снижена), реакции конъюгации угнетены в меньшей степени, чем
обусловленные цитохромом P. Например, клиренс бензодиазепинов, подвергающихся только конъюгации (оксазепама и темазепама), у таких пациентов не страдает, а скорость выделения диазепама и мидазолама, метаболизирующихся с участием реакций первой и второй фаз, снижается. Ухудшение работы ферментных систем, связанных с цитохромом Р, возникает по разным причинам:
• нарушение транскрипции (CYP1A, CYP3A и CYP2C;
• изменение посттрансляционной модификации (CYP2E1);
• повышение чувствительности к холестазу (CYP2E1 и CYP2С9).
В исследовании, проводимом in vitro на культуре клеток гепатоцитов, показано повышение активности CYP3А4. Однако некоторые авторы отмечают, что при ЦП, всё-таки, происходит нарушение некоторых реакций конъюгации (например, зидовудина и морфина с глюкуроновой кислотой).
Пластинчатый комплекс (аппарат Гольджи) участвует в секреции жёлчи, в образовании лизосом и гликогена. В гранулярных частицах митохондрий происходит окислительное фосфорилирование. В митохондриях локализованы ферментные системы (в частности, цикла Кребса, дез- и трансаминирования). Лизосомы осуществляют «внутриклеточное пищеварение», участвуют в защитных реакциях, в образовании жёлчи, обеспечивают динамическое постоянство внутриклеточной среды.
Жёлчь (жёлчные кислоты) играет важную роль в усвоении жиров в кишечнике. При нарушении её образования или оттока жиры в повышенном количестве выводятся с калом. Жёлчь, вырабатываемая гепатоцитами, поступает в межклеточные жёлчные канальцы (они образованы полюсами двух и более смежных гепатоцитов, т.е. лишены собственной стенки). Канальцы, сливаясь друг с другом, образуют холангиолы, впадающие в дольковые жёлчные протоки. Здесь, с помощью специальных активных транспортных механизмов, происходит выведение амфифильных и жирорастворимых препаратов (переносятся гликопротеидом P); конъюгированных с глутатионом и глюкуроновой кислотой продуктов обмена, некоторых сульфатов (транспортируются MRP2); органических катионов.
Холестаз - нарушение синтеза, секреции и оттока жёлчи. Очевидно, что метаболизм препаратов с преимущественно печёночным путём выведения при холестазе замедлен. К сожалению, фармакокинетических исследований, посвящённых указанному вопросу, крайне мало. Неизвестно, какие маркёры использовать для выбора дозы подобных
ЛС. К тому же следует помнить о существовании диссоциированного холестаза, когда затруднено выделение отдельных компонентов жёлчи (например, при синдроме Дубина-Джонсона в организме задерживается только прямой билирубин).
Артериальное кровоснабжение осуществляется по общей печёноч- ной артерии.
Венозный отток. Особенность портальной венозной системы заключается в том, что кровь из брыжеечных артерий проходит две капиллярные сети. Первая из них - система капилляров желудка, кишечника, поджелудочной железы - мощный физиологический «кран», регулирующий перепад давления в приносящих артериях (120 мм рт.ст.) и воротной вене (5-10 мм рт.ст.). Богатая всосавшимися в кишечнике химическими соединениями кровь с большой скоростью (1,5 л/мин, т.е. почти 1/3 минутного объёма кровотока) по воротной вене поступает во вторую, внутрипечёночную сеть капилляров. Мельчайшие элементы микроциркуляторного русла печени, принимающие кровь из мелких веток печёночной артерии и воротной вены, - внутридольковые синусоидальные сосуды. Они контактируют с каждым гепатоцитом, их стенки лишены свойственной капиллярам других органов базальной мембраны и состоят из одного ряда эндотелиальных клеток. Гепатоциты обращены к синусоидальным сосудам полюсами с микроворсинками, причём между печёночными и эндотелиальными клетками есть свободное пространство, где и происходит промежуточный обмен. Стоит отметить, что распределение крови в печёночном ацинусе осуществлено так, что в направлении от центра к периферии происходит снижение PO2 и изменение метаболической организации гепатоцитов:
• во внутренних отделах активнее протекают пиноцитоз и поглощение питательных веществ из венозной крови, интенсивнее обмен белков (в том числе плазменных), происходит экскреция холевых кислот и билирубина;
• в наружных отделах интенсивнее идёт усвоение глюкозы, гликолиз, детоксикация аммиака.
Далее кровь попадает в систему печёночных, а затем - в нижнюю полую вену. Давление в печёночных венах составляет 0-5 мм рт.ст.
Портальная гипертензия - повышение давления в бассейне воротной вены, вызванное нарушением оттока крови различного происхождения и локализации (бассейн воротной, печёночной или нижней полой вены). Поскольку указанная венозная система лишена клапа-
нов, то повышение давления в ней может возникать при сердечной недостаточности, воспалении внутренней оболочки печёночных вен (эндофлебит), констриктивном перикардите. Заболевания, сопровождающиеся гибелью гепатоцитов, вызывают склероз и закупорку терминальных печёночных венул. Единая для всего органа синусоидальная сеть при циррозе расчленяется соединительнотканными перегородками на множество изолированных фрагментов, возникают портопечёночные шунты. Образованные при регенерации ложные дольки обладают собственной синусоидальной сетью, отличной от нормальной (резко увеличена, нет сфинктеров). В результате сдавления синусоидов при ожирении печени также иногда наблюдают портальную гипертензию. Давление в воротной вене возрастает при некоторых, не связанных с первичным поражением печени, заболеваниях: миелопролиферативных (полицитемия, миелофиброз, лейкоз, лимфома, миелоидная метаплазия), болезни Гоше.
Некоторые феномены, возникающие при портальной гипертензии, приводят к значительным изменениям фармакокинетики и фармакодинамики препаратов.
• Асцит - типичное проявление портальной гипертензии. Асцитическая жидкость - ультрафильтрат плазмы крови, её объём иногда превышает 10 л. У 10% больных с асцитом наблюдают плевральный выпот за счёт движения перитонеальной жидкости вверх через диафрагмальные лимфатические сосуды. У пациентов с отёками или асцитом на фоне ЦП возрастает объём распределения гидрофильных препаратов. При необходимости получения быстрого эффекта (например, дигоксина или β-лактамных антибиотиков) их НД увеличивают соразмерно возросшей массе тела. Накопление жидкости в брюшной и плевральных полостях приводит к снижению эффективного (участвующего в микроциркуляции) объёма плазмы, что стимулирует секрецию ренина. Он вызывает снижение почечного кровотока и клубочковой фильтрации, рост секреции антидиуретического гормона гипофиза и альдостерона надпочечников. Следовательно, происходит задержка воды и натрия. Больным ЦП, в связи со снижением у них скорости клубочковой фильтрации, с осторожностью назначают выводящиеся преимущественно почками препараты с малым терапевтическим индексом. При ЦП отмечено замедление выделения почками флуконазола, офлоксацина, цилазаприла, препаратов лития.
• Гепаторенальный синдром - «функциональная почечная недостаточность», ассоциированная с тяжёлым заболеванием печени, при отсутствии явных патологических изменений со стороны почек.
• Образование анастомозов. При нарушении кровотока в системе воротной вены отток крови происходит через внутри- и внепе- чёночные анастомозы. Воротная и полая вены связаны друг с другом многочисленными коллатералями в области пищевода и желудка, прямой кишки, передней брюшной стенки, забрюшинного пространства. Венозные анастомозы - путь для проникновения препаратов в системный кровоток минуя печень.
Поражение других органов и систем при хронических заболеваниях печени: гастропатия, гастрит и/или язвы слизистой оболочки верхних отделов желудочно-кишечного тракта. В подобной ситуации поступление препаратов в системный кровоток может как снижаться, так и увеличиваться (за счёт венозных анастомозов при портальной гипертензии). У пациентов с ЦП возрастает время эвакуации содержимого из желудка, что, возможно, возникает в результате сниженной активности гастроинтестинальных гормонов (секретина, глюкагона, холецистокинина, мотилина). В таких случаях следует с осторожностью использовать лекарственные формы с замедленным высвобождением активного вещества, так как их действие может быть отсрочено на неопределённое время и труднопрогнозируемо.
Следует упомянуть, что интенсивные и многочисленные реакции метаболизма протекают уже в стенке кишки (почти все известные синтетические и несинтетические реакции). Например, происходит конъюгирование изопреналина с сульфатами, ацетилирование гидралазина. Некоторые ЛС подвергаются биотрансформации неспецифическими ферментами (пенициллины, аминазы) или бактериями кишечника (метотрексат, леводопа), что иногда очень важно (так, из-за значительного метаболизма хлорпромазина в кишечнике, в системный кровоток поступает минимальное количество вещества).
Различные заболевания печени по-разному влияют на фармакокинетику препаратов. При неосложнённых острых гепатитах, токсических повреждениях без некроза и воспаления паренхимы скорость биотрансформации ЛС практически не меняется, а при диффузных поражениях органа с некрозом клеток (например, острый гепатит) она снижена почти в 2 раза. Компенсированный неактивный цирроз влияет на фармакокинетику ЛС в меньшей степени, чем декомпенсированный. Печёночно-клеточная недостаточность приводит к
снижению скорости метаболизма ЛС, а нарушение жёлчеотделения замедляет как всасывание, так и выделение жирорастворимых препаратов.
Изменение фармакокинетики ЛС лучше всего изучено при ЦП.
• Феназон. Его выведение не нарушено при компенсированном циррозе, остром гепатите и холестазе, но страдает при декомпенсированном ЦП.
• Гексобарбитал. При внутри- и внепечёночном холестазе, первичном билиарном ЦП снижения его клиренса нет, а при остром гепатите, компенсированном и декомпенсированном ЦП - есть.
• Циметидин. Фармакокинетика препарата нарушена лишь при цирротическом асците.
Печёночный клиренс, эффект первого прохождения через печень, выведение препаратов с жёлчью
Выведение ЛС осуществляется печенью (биотрансформация и выделение с жёлчью), почками и другими органами. Все препараты, поступившие в организм per os, проходят через печень, где часть из них подвергается пресистемному метаболизму (эффект первого прохождения через печень). Биодоступность вещества, кроме того, зависит от степени диссоциации и абсорбции в кишке, метаболизма кишечными ферментными системами (например, CYP3A4) и экскреции из энтероцита с помощью гликопротеина-P.
Препараты, выводящиеся через печень, разделяют на группы с высоким и с низким печёночным клиренсом (1 и 2 группа соответственно).
Печёночный клиренс (Clhep) - произведение органного кровотока (Q) и экскреции препарата (E) за первое прохождение через печень:
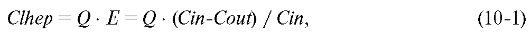 где Cin - концентрация препарата в портальной вене, Cout - концентрация препарата в печёночной вене.
где Cin - концентрация препарата в портальной вене, Cout - концентрация препарата в печёночной вене.
Если допустить, что концентрация препарата в печени однородная и равна таковой в печёночной вене (венозная равновесная модель), то E можно выразить иначе:
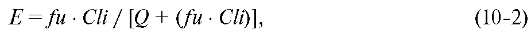 где Cli -
присущий препарату печёночный клиренс (показатель характеризует ёмкость
ферментных систем органа, перерабатывающих препарат независимо от
кровотока); fu - его свободная фракция (часть, не связанная с белками плазмы).
где Cli -
присущий препарату печёночный клиренс (показатель характеризует ёмкость
ферментных систем органа, перерабатывающих препарат независимо от
кровотока); fu - его свободная фракция (часть, не связанная с белками плазмы).
Используя указанное выше уравнение, печёночный клиренс можно рассчитать так:
• 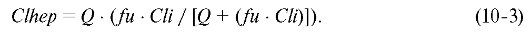 Лекарственные
вещества с высокой степенью печёночного клиренса хорошо извлекаются
гепатоцитами из крови. Способность печени их метаболизировать в
значительной степени зависит от скорости кровотока. Таким образом, для
препаратов первой группы произведение (fu Cli) значительно больше Q, и печёночный клиренс (Clhep) практически равен Q (т.е.
определяется печёночным кровотоком). Подобные лекарственные вещества
называют «потокзависимые». У препаратов с высокой степенью печёночной
экскреции выражен эффект первого прохождения (метаболизируется >60%
вещества) и низкая биодоступность (<40%). У пациентов с циррозом
печёночный кровоток значительно снижен, развиты внутри- и внепечёночные
анастомозы, поэтому эффект первого прохождения и выведение
потокзависимых препаратов значительно снижены, что ведёт к резкому
повышению их биодоступности. Известно, что, по сравнению со здоровыми
лицами, при ЦП возрастает биодоступность клометиазолар в 11,6, энкаинидар в 2,92, лабеталола в 1,91, морфина в 2,15, нифедипина в 1,78, нисолдипина в 3,75, пропранолола в 1,67, верапамила в 1,6 раз.
Лекарственные
вещества с высокой степенью печёночного клиренса хорошо извлекаются
гепатоцитами из крови. Способность печени их метаболизировать в
значительной степени зависит от скорости кровотока. Таким образом, для
препаратов первой группы произведение (fu Cli) значительно больше Q, и печёночный клиренс (Clhep) практически равен Q (т.е.
определяется печёночным кровотоком). Подобные лекарственные вещества
называют «потокзависимые». У препаратов с высокой степенью печёночной
экскреции выражен эффект первого прохождения (метаболизируется >60%
вещества) и низкая биодоступность (<40%). У пациентов с циррозом
печёночный кровоток значительно снижен, развиты внутри- и внепечёночные
анастомозы, поэтому эффект первого прохождения и выведение
потокзависимых препаратов значительно снижены, что ведёт к резкому
повышению их биодоступности. Известно, что, по сравнению со здоровыми
лицами, при ЦП возрастает биодоступность клометиазолар в 11,6, энкаинидар в 2,92, лабеталола в 1,91, морфина в 2,15, нифедипина в 1,78, нисолдипина в 3,75, пропранолола в 1,67, верапамила в 1,6 раз.
• Печёночный клиренс лекарственных веществ второй группы зависит не от скорости кровотока, а от ёмкости метаболизирующих их ферментативных систем. Для части препаратов указанной группы характерна высокая (фенитоин, хинидин, толбутамид), для другой - низкая степень связывания с белками крови (теофиллин, парацетамол). У веществ с низкой степенью печёночной экскреции величина ( fu Cli) значительно меньше Q и печёночный клиренс (Clhep) практически равен значению ( fu • Cli), т.е. зависит от свободной фракции препарата и ёмкости ферментативных систем печени, участвующих в их метаболизме. Подобные лекарственные вещества называют «ферментзависимые», эффект первого прохождения у них не выражен (метаболизируется не более 30% препарата), а биодоступность высока (>70%). Стоит отметить, что ЦП существенно не влияет на послед-
ний показатель, а снижение их печёночного клиренса возможно при уменьшении ёмкости ферментативных систем и свободной фракции. Метаболизм активно связывающихся с белками (прежде всего, альбуминами) препаратов, главным образом, зависит от скорости соединения молекул, а не от величины кровотока в печени.
Большинство ЛС занимает промежуточное положение между описанными выше крайними вариантами и обладает свойствами обеих групп. В целом, при заболеваниях печени клиренс ЛС обычно снижен, а период их полувыведения увеличен (из-за снижения кровотока в органе, ухудшения их захвата гепатоцитами, увеличения объёма распределения препарата).
Поступление ЛС в жёлчь - один из путей их выведения. Однако секретированные в жёлчь вещества могут повторно всасываться в кишечнике (происходит печёночно-кишечная циркуляция).
Связывание лекарственных средств с белками плазмы крови
Только свободные молекулы препарата способны проникать через мембрану клетки, поэтому связывание лекарственных веществ с белками плазмы приводит к снижению их концентрации в тканях. Между свободной и связанной частями ЛС существует динамическое равновесие. Иногда, в зависимости от градиента pH, степени связывания ЛС с внутриклеточными элементами и распределения веществ в жировой ткани, происходит избирательное накопление препаратов, что объясняют правилами диффузионного равновесия. Нарушение связывания лекарственных веществ наблюдают при снижении концентрации альбуминов в сыворотке (гипоальбуминемия) и/или ухудшении связывающей способности у белков при некоторых заболеваниях почек. Например, значительный рост свободной фракции препарата происходит при снижении концентрации альбуминов до (нормальное значение 33-55 г/л):
• 30 г/л - фенитоин;
• 20 г/л - фуросемид.
Заболевания печени и побочные эффекты лекарственных препаратов
У пациентов с заболеваниями печени коррекция количества вводимого вещества позволяет снизить угрозу развития дозозависимых побочных эффектов (тип A), но не влияет на риск возникновения не зависящих от дозы реакций (тип B).
Гепатотоксичность лекарственных средств у лиц с заболеваниями печени
Большинство побочных эффектов, затрагивающих саму печень, относят к типу B, однако некоторые ЛС обладают зависящей от их концентрации гепатотоксичностью (например, метотрексат, парацетамол - ацетаминофен♠, изониазид). Риск развития фиброза или ЦП при приёме метотрексата возрастает у лиц с алкоголизмом. Такие больные высокочувствительны и к гепатотоксическим эффектам парацетамола. Указанная особенность связана со способностью этилового спирта индуцировать ферментную систему CYP2E1, что ведёт к повышению образования N-ацетил-р-бензохинонимина - ядовитого метаболита парацетамола. Употребление алкоголя на фоне ЦП способствует проявлению токсического действия изониазида (он, как и парацетамол - субстрат для CYP2E1, потенцирование его неблагоприятного действия этанолом также связывают с повышением активности цитохрома). Типичный пример реакции типа B - формирование на фоне приёма ЛС мелкокапельной жировой дистрофии печени, что бывает при использовании вальпроевой и высоких (обезболивающих) доз ацетилсалициловой кислоты, некоторых опиатов и урикозурических средств (бензбромаронар). Возникновение мелкокапельной жировой дистрофии чаще наблюдают у пациентов с генетически детерминированными дефектами митохондриальных биохимических процессов (в частности, β-окисления и цикла мочевины) или при митохондриальной цитопатии. Риск развития не зависящих от дозы препарата побочных реакций возрастает при заболеваниях печени.
Итак, факторы риска лекарственного повреждения печени - её болезни, ферментный полиморфизм и специфический фенотип лимоцитарных антигенов (HLA). Однако следует отметить, что ряд нежелательных эффектов, возникающих у пациентов с ЦП, связан с нарушением функции почек и с энцефалопатией.
Токсическое действие лекарственных средств на другие органы и системы у лиц с заболеваниями печени
НПВС усугубляют нарушение почечного кровотока у больных ЦП. Для пациентов с портальной гипертензией характерен гиперкинетический тип кровообращения и низкое периферическое сосудистое сопротивление вследствие повышенной продукции вазодилатирующих субстанций (например, оксида азота). С целью компенсации указанных изменений возрастает активность ренин-ангиотензинальдостероновой и симпатоадреналовой систем, что, в свою очередь, ведёт к спазму почечных сосудов. В противовес указанным сдвигам
местный синтез простагландинов способствует расширению почечных артерий и поддержанию необходимого фильтрационного давления. При приёме НПВС синтез простагландинов в почках нарушается, что при ЦП может привести к почечной недостаточности. Полученные к сегодняшнему дню данные относительно эффектов избирательных ингибиторов циклооксигеназы-2 довольно противоречивы: в экспериментах над крысами с ЦП подобные препараты не снижали почечный кровоток, а у здоровых людей под их влиянием он ослабевал.
Прогнозирование нежелательных реакций, связанных с изменениями фармакокинетики экскретируемых печенью препаратов
К сожалению, не существует точного критерия оценки экскреторной функции печени и метода прогнозирования изменений фармакокинетики и фармакодинамики препарата у конкретного больного при её поражении. Об интенсивности метаболизма и состоянии органа судят косвенно - по изменению активности в сыворотке крови мар- кёрных ферментов, её повышение свидетельствует:
• о некрозе гепатоцитов (аланин и аспартат аминотрансферазы);
• о повышенной метаболической активности печени или повреждении клеточных мембран (γ-глутамил трансфераза);
• о тяжёлых функциональных поражениях печени (лактат дегидрогеназа);
• о холестазе (щелочная фосфатаза).
При тяжёлых поражениях паренхимы и механической желтухе возрастает концентрация конъюгированного билирубина в сыворотке крови, одновременно с этим происходит окрашивание мочи в интенсивный жёлтый цвет. О тяжёлых поражениях ткани печени также свидетельствуют: снижение показателя Квика; уменьшение концентрации фибриногена и повышение частичного тромбопластинового времени. Для оценки функции гепатоцитов при ЦП применяют прогностическую шкалу Чайлда-Пью (табл. 10-1).
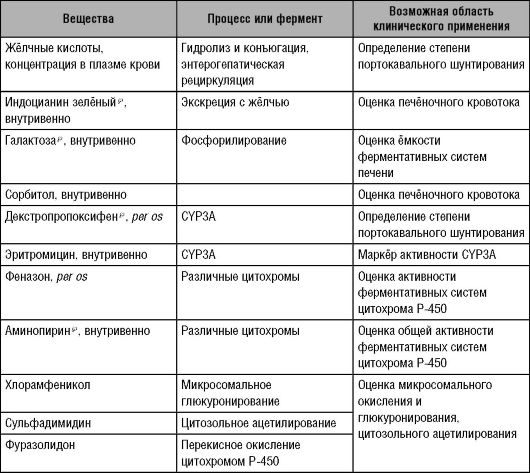
Поскольку эндогенных маркёров для оценки печёночного клиренса нет, то с указанной целью используют различные препараты (табл. 10-2). Однако оценка метаболизма лекарственных веществ с помощью подобных методик достаточно приблизительна, так как многие ферментативные системы печени дублируют друг друга.
Таблица 10-1. Шкала оценки функции гепатоцитов при циррозе печени (шкала Чайлда-Пью)
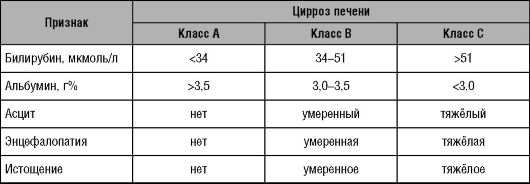 Таблица 10-2. Маркёры функций печени
Таблица 10-2. Маркёры функций печени
 Для
оценки нарушения функций печени некоторые исследователи предлагают
определять концентрацию альбумина в сыворотке крови, проводить
протромбиновый тест (например, расчёт международного нормализованного
отношения), поскольку указанные тесты отражают способность печени
синтезировать белки, а следовательно, и ферменты, метаболизирующие ЛС.
Для
оценки нарушения функций печени некоторые исследователи предлагают
определять концентрацию альбумина в сыворотке крови, проводить
протромбиновый тест (например, расчёт международного нормализованного
отношения), поскольку указанные тесты отражают способность печени
синтезировать белки, а следовательно, и ферменты, метаболизирующие ЛС.
В настоящее время систему биотрансформации ЛС изучают методами фенотипирования (по фармакокинетике «маркёрного» субстрата и продуктов его обмена) и генотипирования того или иного фермента.
Другой возможный способ прогнозировать фармакокинетику препарата у больного ЦП - учёт степени печёночного клиренса.
Коррекция нежелательных лекарственных реакций, связанных с изменениями фармакокинетики экскретируемых печенью препаратов
Изменение дозы или отказ от препаратов, экскретируемых печенью
Для ЛС, подвергающихся биотрансформации в печени, разработаны общие рекомендации по снижению доз. Например, при функциональном классе B ЦП её уменьшают на 25%, а при C - на 50-75%. Если концентрация альбумина в сыворотке крови <30 г/л, то возможен иной способ подбора верной дозы: её уменьшают на 50 или 25% (для препаратов с высоким и низким клиренсом соответственно).
При приёме ЛС внутрь с высокой степенью печёночной экскреции у больных ЦП начальную и поддерживающую дозы рассчитывают по формуле:
 где S - сниженная доза; N - доза для лиц без заболеваний печени; B - биодоступность препарата у здорового человека (доля вещества, достигшая системного кровотока после приёма per os, %).
где S - сниженная доза; N - доза для лиц без заболеваний печени; B - биодоступность препарата у здорового человека (доля вещества, достигшая системного кровотока после приёма per os, %).
Коррекцию поддерживающей дозы проводят с учётом желательных фармакологических эффектов и токсичности используемого препарата, причём возможное снижение печёночного клиренса в расчёт не принимают, поскольку оно мало, по сравнению с существенным увеличением биодоступности.
При внутривенном введении лекарственных веществ с высокой степенью печёночной экскреции начальная доза препарата может быть обычной, а поддерживающую дозу необходимо снижать в соответствии с печёночным клиренсом, зависящем от кровотока в органе.
У пациентов с ЦП существует линейная зависимость между концентрацией в плазме жёлчных кислот и степенью портокавального шунтирования. Таким образом, один из подходов к выбору дозы препарата с высокой степенью печёночной экскреции - определение концентрации жёлчных кислот в плазме.
Использование препаратов с низкой степенью печёночной экскреции можно начинать с обычных доз, а поддерживающие - уменьшать.
Ниже приведены примеры способов коррекции доз препаратов у лиц с заболеваниями печени (табл. 10-3).
Таблица 10-3. Коррекция доз препаратов у лиц с печёночной недостаточностью
 Разные
группы блокаторов медленных кальциевых каналов обладают невысокой
абсолютной биодоступностью из-за выраженного эффекта первого прохождения
через печень. Все они метаболизируются с помощью CYP3A4. Определённый
вклад в биотрансформацию верапамила вносит и CYP1A2. Эффект первого
прохождения через печень наиболее выражен у верапамила, галлопамилаp, никардипи-
Разные
группы блокаторов медленных кальциевых каналов обладают невысокой
абсолютной биодоступностью из-за выраженного эффекта первого прохождения
через печень. Все они метаболизируются с помощью CYP3A4. Определённый
вклад в биотрансформацию верапамила вносит и CYP1A2. Эффект первого
прохождения через печень наиболее выражен у верапамила, галлопамилаp, никардипи-
на, исрадипина, фелодипина, нисолдипина; наименее - у нифедипина, амлодипина, нитрендипина (поэтому они обладают большей биодоступностью). Самая высокая биодоступность - у амлодипина (60-80%), самая низкая - у нисолдипина (4-8%). Все препараты из группы блокаторов медленных кальциевых каналов в значительной степени связываются с белками плазмы крови (от 70-80% дилтиазем до 99% фелодипин), что необходимо учитывать при назначении их пациентам с гипопротеинемией (поскольку возможно значительное увеличение свободной фракции препаратов в крови, т.е. повышение риска возникновения побочных эффектов). У лиц с печёночной недостаточностью разовую дозу или кратность их приёма рекомендуют уменьшать.
Пациенты с ЦП более чувствительны к центральным нежелательным эффектам морфина (повышена биодоступность и снижена элиминация) - описаны случаи развития печёночной энцефалопатии после 4 введений препарата в дозе 8 мг. Антипсихотические средства (кроме тианептина) не менее активно метаболизируются в печени и также могут вызывать нежелательные реакции (причём их нельзя блокировать препаратами-антагонистами).
Больным с ЦП и асцитом не следует назначать НПВС. Данные о возможности применения селективных ингибиторов циклооксигена- зы-2 противоречивы (см. выше).
Препараты сульфонилмочевины, меглитиниды, тиазолидиндионного ряда и инсулины в основном подвергаются биотрансформации в печени, что требует коррекции их доз при циррозе.
Замена препарата
Под заменой препарата подразумевают использование другого вещества из той же или иной фармакологической группы, главное условие - в его экскреции не должна принимать участия печень.
Пациенты с ЦП более подвержены возникновению центральных нежелательных эффектов бензодиазепинов, но безопасной альтернативы им не существует. Из всех препаратов указанной группы отдают предпочтение оксазепаму и лоразепаму, поскольку они в печени подвергаются только конъюгации.
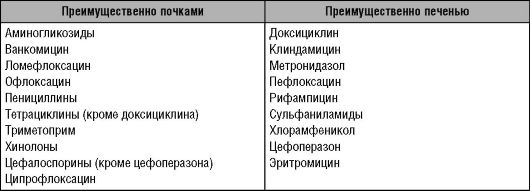
Пути элиминации у фторхинолонов различны: преимущественно внепочечный - у пефлоксацина (при ЦП общий клиренс снижается более чем на 70%) и спарфлоксацина; почти исключительно почечный - у ломефлоксацина. Другие препараты занимают промежуточное положение.
Преимущественные пути выведения некоторых антимикробных средств указаны в табл. 10-4.
Таблица 10-4. Пути выведения некоторых антимикробных средств (Яковлев С.В., 1997)
 Использование препаратов-метаболитов
Использование препаратов-метаболитов
Известна низкая биодоступность нитратов, вследствие чего созданы разнообразные лекарственные формы, исключающие эффект первого прохождения через печень. Однако у изосорбида динитрата (его биодоступность мала - 10-20%) есть активные метаболиты, обладающие собственной антиангинальной активностью (изосорби- да-5-мононитрат и изосорбида-2-мононитрат). Первый из них выпускают в качестве самостоятельного препарата. У него высокий почечный клиренс (1,8 л/мин), а биодоступность не зависит от функции печени и составляет около 100%. Печёночная и почечная недостаточность существенно не меняют его кинетику.
Использование препаратов-пролекарств
Если активация ЛС проходит в печени, то использовать подобный препарат следует с осторожностью.
Метаболизм эналаприла в печени происходит с образованием активной формы (эналаприлата), поэтому есть теоретическая вероятность снижения его эффективности при заболеваниях гепатобилиарной системы, хотя достоверных данных, подтверждающих указанное предположение, нет. Однако установлено, что при ЦП в крови возрастает концентрация как эналаприла (вероятно, за счёт увеличения его абсорбции), так и эналаприлата (возможно, есть корреляция между количеством субстрата и метаболита).
К пролекарствам относят ловастатин и симвастатин, поскольку они превращаются в активные формы в результате гидролиза в печени.
Отказ от выводящихся с жёлчью препаратов
Если основная часть препарата выводится из организма с жёлчью, то при холестазе его используют с осторожностью. Например, основная часть валсартана (70%) удаляется из организма подобным способом, поэтому в указанных условиях необходимо снижение его дозы.
Среди антибиотиков есть вещества как преимущественно с почечным, так и с печёночным путём элиминации (метаболизм в гепатоцитах до неактивных продуктов или выведение с жёлчью в неизменён- ном виде). При инфекционном процессе в жёлчевыводящих путях выделение антибактериального препарата с жёлчью обосновано и полезно, однако при холестазе такая особенность - основание для замены ЛС (табл. 10-5).
Таблица 10-5. Проникновение антибактериальных препаратов в жёлчь при нормальной проходимости жёлчевыводящих путей (Яковлев С.В., 1997)
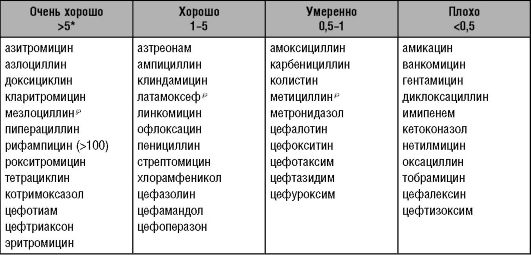 * Отношение между концентрациями препарата в жёлчи и в сыворотке крови.
* Отношение между концентрациями препарата в жёлчи и в сыворотке крови.
Использование препаратов с высокой степенью связывания с белками плазмы крови
Подобные препараты при гипоальбуминемии не применяют. Степень связывания различных антибиотиков с белками плазмы крови различна:
• 2% - меропенем;
• 10% - цефтазидим, цефодизимp, цефпиромp, большинство аминогликозидов (канамицин, гентамицин, тобрамицин, амикацин, сизомицина), фосфомицин;
• >90% - цефалотин, цефазолин, цефамандол, цефокситин, доксициклин, моноциклинp, рифампицин, кетоконазол, оксациллин, клоксациллин, диклоксациллин, флуклоксациллин, цефоперазон, цефтриаксон, рокситромицин, клиндамицин, амфотерицин B, миконазол.
Особые случаи
Больные ЦП менее чувствительны к натрийуретическому действию петлевых диуретиков, т.е. для выведения того же количества натрия им необходима большая доза препарата, чем здоровым. Указанное положение справедливо для фуросемида и буметанида, а торасемид при ЦП можно применять в обычных дозах, поскольку создание требуемой высокой концентрации препарата в канальцах происходит из-за снижения его печёночной элиминации.
При печёночной недостаточности бигуаниды применять нежелательно, поскольку возрастает риск развития лактатацидоза.
Среди макролидов лучше всего изучена биотрансформация кларитромицина: обнаружено 8 метаболитов. Они образуются за счёт S- и R-гидроксилирования, N-деметилирования и гидролиза. Основными среди них считают 14-ОН-кларитромицин и 14-ОН-N-демитилированное производное кларитромицина. Стоит отметить, что только реакция R-гидроксилирования (с образованием 14-ОН-кларитромицина) протекает с участием цитохрома P-450, поэтому при нарушении функции печени время полувыведения препарата практически не меняется, но не происходит и образования активного конечного продукта, т.е. снижается эффективность антибактериальной терапии.
Динамическое наблюдение за состоянием больного
К сожалению, влияние заболеваний печени на фармакокинетику и метаболизм ЛС изучено недостаточно, поскольку для решения указанной задачи необходимо подвергнуть всестороннему изучению огромный объём материала. Однако нежелательные эффекты большинства препаратов хорошо известны, поэтому при их использовании (особенно у пациентов с печёночно-клеточной недостаточностью, асцитом, холестазом и/или гипоальбуминемией) надо своевременно прово-
дить необходимые клинико-лабораторные исследования для оценки эффективности и безопасности терапии.
Литература
Белоусов Ю.Б., Ханина Н.Ю. Подходы к выбору дозы лекарственных препаратов у пациентов с циррозом печени // Фарматека. - ? 1. -
С. 116.
Белялов Ф.И. Лечение сочетанных расстройств. - 3-е изд. - М: Медицинская книга; Н. Новгород: Изд-во НГМА; Иркутск, 2007.
Клиническая фармакокинетика. Практикадозирования лекарств // Под ред. Ю.Б. Белоусова, К.Г. Гуревича. - М.: Литтерра, 2005 (Рациональная фармакотерапия).
Клиническая фармакология: Пер. с англ. // Под ред. Э. Бэгг. - М.: БИНОМ, 2004 (Лаборатория знаний).
Клиническая фармакология блокаторов медленных кальциевых каналов / 2-е изд., перераб. и доп. Под ред. В.Г. Кукеса, В.П. Фисенко, А.К. Стародубцева и др. - М.: ММА им. И.М. Сеченова, ЗАО «ИАА «Ремедиум»», 2003.
Клиническая фармакология по Гудману и Гилману: Пер. с англ. // Под общ. ред. А.Г. Гилмана; ред. Дж. Хардман, Л. Лимберд. - М.: Практика, 2006.
Кукес В.Г. Метаболизм лекарственных средств: клинико-фармакологические аспекты. - М.: Реафарм, 2004.
Макролиды // Под ред. А.М. Попковой, А.Л. Верткина, С.В. Колобова. - М.: Диалог-МГУ, 2000.
Шляхто Е.В., Семернин Е.Н., Фёдоров П.А., Карпов О.И. Клинико-экономическая экспертиза моно- и динитратов при стенокардии // Качествен. клин. практика. - 2003. - ? 2. - C. 1-9.
AstraZeneca. Summary of Product Characteristics. Nexium tablets,
2000.
Berson A., Gervais A., Cazals D. et al. Hepatitis after intravenous buprenorphine misuse in heroin addicts // J. Hepatol. - 2001. - Vol. 3. - P. 346-
350.
Furuta T. et al. Influence of CYP2C19 pharmacogenetic polymorphism on proton pump inhibitors // Drug Metab. Pharmacokinet. - 2005. - Vol. 20. - ? 3. - P. 153-167.
Parkinson A. et al. The effects of gender, age, ethnicity, and liver cirrhosis on cytochrome P450 enzyme activity in human liver microsomes and induc-
ibility in cultured human hepatocytes // Toxicol. Appl. Pharmacol. - 2004. -
Vol. 199. - P. 193-209.
Parlesak A., Schafer C., Schutz T. et al. Increased intestinal permeability to macromolecules and endotoxemia in patients with chronic alcohol abuse in different stages of alcohol-induced liver disease // J. Hepatol. - 2000. -
Vol. 32. - P. 742-747.
Thummel K.E., Slattery J.T., Ro H. et al. Ethanol and production of the hepatotoxic metabolite of acetaminophen in healthy adults // Clin. Pharmacol.
Ther. - 2000. - Vol. 67. - P. 591-599.