Клиническая фармакокинетика: теоретические, прикладные и аналитические аспекты: руководство / Под ред. В.Г. Кукеса. - 2009. - 432 с
|
|
|
|
ГЛАВА 6 ВЫВЕДЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ИЗ ОРГАНИЗМА
Н.Б. Лазарева
Процесс экскреции, наряду с метаболизмом и распределением в тканях, определяет продолжительность действия и скорость элиминации ЛС. Почки, гепатобилиарная система, лёгкие и кишечник - основные органы, участвующие в процессе выведения ЛС.
6.1. ПОЧЕЧНАЯ ЭКСКРЕЦИЯ
Почечная экскреция ЛС определяется тремя основными процессами, происходящими на уровне нефрона: клубочковой фильтрацией, канальцевой секрецией и реабсорбцией (в основном, путём пассивной диффузии).
Клубочковая фильтрация
Процесс клубочковой фильтрации носит избирательный характер; это предотвращает фильтрацию белков плазмы (в том числе альбумина) и способствует поддержанию осмотического градиента плазмы. Форму и размер молекулы, а также её электрический заряд относят к факторам, ограничивающим клубочковую фильтрацию. Приблизительно 130 мл плазмы ежеминутно подвергается клубочковой фильтрации (190 л в день); это и определяет основополагающую роль почек в процессе выведения ЛС. Любые лекарственные вещества, не свя-
занные с белками плазмы или форменными элементами, подвергаются клубочковой фильтрации. Молекулы с радиусом более 20 ангстрем (Α) могут иметь ограничения в процессе ультрафильтрации, крупные молекулы с радиусом более 42 Α не будут фильтроваться клубочками (Bennett P.N., 1988). Скорость клубочковой фильтрации заряженных молекул обычно ниже, чем нейтральных, даже при сопоставимой молекулярной массе. Наибольшие ограничения в процессе фильтрации имеют отрицательно заряженные молекулы (анионы); это, возможно, обусловлено электростатическим взаимодействием между молекулами фильтрата и отрицательно заряженными стенками клубочковых капилляров (Grantham J.J. and Chonko A.M., 1991).
Преимущественно за счёт клубочковой фильтрации происходит удаление из организма таких лекарственных веществ, как дигоксин, гентамицин, прокаинамид (новокаинамид*) и метотрексат. Скорость клубочковой фильтрации оценивают по величине клиренса креатинина.
Таблица 6-1. Основные пути выведения лекарственных средств из организма
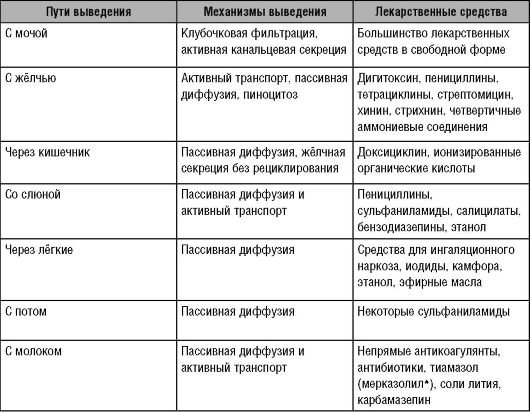
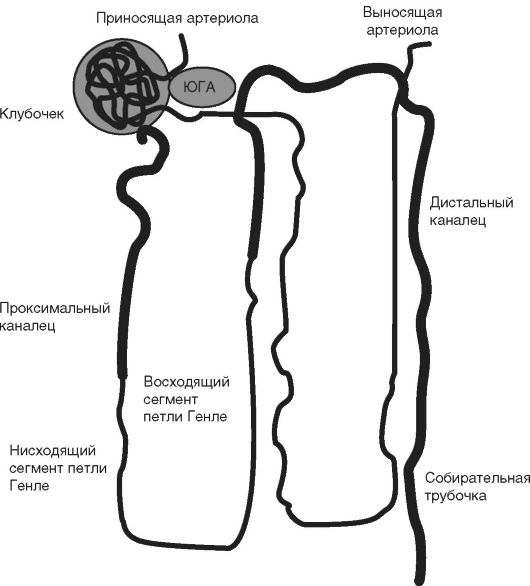 Рис. 6-1. Строение нефрона. ЮГА - юкстагломерулярный аппарат
Рис. 6-1. Строение нефрона. ЮГА - юкстагломерулярный аппарат
Формула расчёта клиренса лекарственных веществ
Клиренс препаратов (Cl), которые элиминируются из организма только благодаря клубочковой фильтрации, рассчитывают как произведение скорости клубочковой фильтрации и количества ЛС, содержащегося в плазме крови в несвязанном виде ( f):
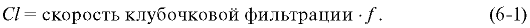 Факторы,
определяющие скорость клубочковой фильтрации, могут изменять клиренс
ЛС. Например, воспаление клубочковых капилляров приводит к ускорению
процессов ультрафильтрации и, таким образом, к увеличению клиренса ЛС.
Поскольку большинство ЛС хотя бы частично связаны с белками плазмы, то
скорость их ультрафильтрации будет ниже теоретической скорости
клубочковой фильтрации. Чем прочнее связь ЛС с белками плазмы, тем
значительнее удлинение периода полувыведения (Levy R.H., et al., 2000).
Факторы,
определяющие скорость клубочковой фильтрации, могут изменять клиренс
ЛС. Например, воспаление клубочковых капилляров приводит к ускорению
процессов ультрафильтрации и, таким образом, к увеличению клиренса ЛС.
Поскольку большинство ЛС хотя бы частично связаны с белками плазмы, то
скорость их ультрафильтрации будет ниже теоретической скорости
клубочковой фильтрации. Чем прочнее связь ЛС с белками плазмы, тем
значительнее удлинение периода полувыведения (Levy R.H., et al., 2000).
Пассивная диффузия
Важное звено почечной экскреции ЛС (особенно слабых электролитов) - процесс обратной диффузии через канальцевые мембраны в микроциркуляторное русло. В целом, движение ЛС обратно в кровь определяется градиентом их концентрации.
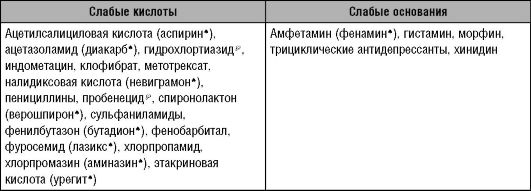
На скорость пассивной обратной диффузии может значительно влиять рН мочи. Процесс обратной диффузии осуществляется в основном в дистальных канальцах и собирательных трубочках, где происходит подкисление мочи. Так как неионизированные молекулы лекарственных веществ диффундируют из просвета канальцев обратно в кровь, то процесс подкисления будет повышать реабсорбцию (снижать элиминацию) слабых кислот, таких, как салицилаты, и снижать реабсорбцию (повышать элиминацию) слабых оснований, таких, как амфетамины. Однако изменение рН мочи практически не оказывает влияния на элиминацию неионизированных форм ЛС, не растворимых в жирах.
Возможность изменения рН мочи и влияния на скорость элиминации лекарственных веществ используют в медицинской практике при лечении отравлений. Например, для ускорения выведения барбитуратов (слабых кислот) необходимо назначить пациенту гидрокарбонат натрия. Экскрецию оснований можно повысить путём подкисления мочи, используя кислые соли.
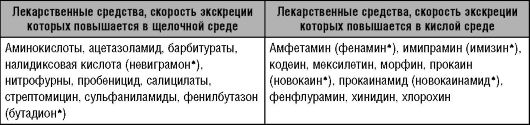
Таблица 6-2. Зависимость экскреции лекарственных средств от рН мочи
 Активная канальцевая секреция
Активная канальцевая секреция
Большинство ЛС служат субстратами для двух активных систем секреции в клетках проксимальных канальцев. Эти системы обеспечивают транспорт лекарственных веществ из крови в просвет канальцев и друг от друга не зависят. Первая система секретирует органические анионы - транспортёры органических анионов: ОАТР и ОАТ. Вторая система секретирует органические катионы - транспортёры органических катионов: ОСТ. Некоторые ЛС конкурируют с другими одноимённо заряженными ЛС, что, в свою очередь, снижает общую скорость элиминации каждого субстрата. Увеличение секреторной способности обеих систем наблюдают при высоких концентрациях ЛС в плазме крови. Каждое лекарственное вещество имеет свой «собственный» максимальный уровень секреции, называемый «транспортный максимум» и обозначаемый как Tm (Tamai and Tsuji, 2000; Kusuhara and Sugiyama, 2005).
Такие транспортёры, как гликопротеин-P и ассоциированный с развитием лекарственной резистентности протеин 2 типа (MRP2), расположенные на апикальной поверхности канальцевого эпителия, отвечают за секрецию части конъюгированных метаболитов молекул ЛС (глюкурониды, сульфаты, коньюгаты глутатиона). Поскольку конъюгаты, как правило, не обладают фармакологической активностью, увеличение скорости их элиминации путём активной секреции не будет оказывать выраженного эффекта на общую продолжительность действия ЛС (Goodman and Gilman, 2006).
Таблица 6-3. Лекарственные средства, выделяемые путём активного транспорта в канальцах
 Указанные системы активной секреции играют особенно важную роль в выведении анионов и катионов, имеющих сильную связь с бел-
Указанные системы активной секреции играют особенно важную роль в выведении анионов и катионов, имеющих сильную связь с бел-
ками плазмы, так как данные комплексы не подвергаются процессу клубочковой ультрафильтрации. Однако, вследствие обратимости связи с белком плазмы крови, системы активной секреции могут быстро и эффективно удалять ЛС, не связанные с белками из плазмы и транспортировать их в канальцевый секрет. Снижение секреторной активности приводит процесс экскреции к уровню, определяемому скоростью клубочковой фильтрации (Leblond, 2000).
Активная канальцевая реабсорция
Часть молекул ЛС, прошедших процесс клубочковой фильтрации, подвергаются реабсорбции в проксимальных канальцах. Процесс активной реабсорбции имеет особенное значение для эндогенных веществ (например, глюкозы* и аминокислот). Лишь небольшое количество ЛС подлежит активной реабсорбции.
Большинство ЛС замедляют процессы активного транспорта. Так, ЛС, способствующие снижению концентрации мочевой кислоты (пробеницидp и некоторые другие препараты), ингибируют активную реабсорбцию уратов, в то время как пиразинамид, снижающий экскрецию уратов, может блокировать активную секрецию мочевой кислоты. Некоторые ЛС обладают способностью ингибировать процессы активной реабсорбции (при введении одних доз) и активную секрецию (при введении других, часто меньших, доз препарата). Например, при введении небольшого количества салицилатов отмечают уменьшение выведения уратов, а при использовании больших доз данных препаратов, напротив, регистрируют урикозурический эффект. Данный пример объясняет парадоксальное влияние различных доз лекарственных веществ на общую скорость элиминации компонентов, выделяющихся путём активного транспорта.
Клиническое значение почечного пути выведения
Скорость почечной экскреции ЛС зависит от объёма распределения и степени связывания с белками плазмы крови.
Факторы, определяющие скорость почечной экскреции
• Скорость клубочковой фильтрации.
• рН канальцевой жидкости.
• Величина обратной диффузии неионизированных форм.
• Величина активной канальцевой секреции компонентов.
• Величина активной канальцевой реабсорбции.
Нарушение одного из этих процессов может привести к существенным изменениям клинических эффектов того или иного лекарственного
вещества. В итоге, количество ЛС, содержащегося в моче, представляет баланс между ультрафильтрацией, реабсорбцией (пассивной или активной) и секрецией. Продолжительность действия и выраженность фармакологического эффекта большинства препаратов определяет функциональный статус почек, так как именно они играют ключевую роль в процессе выведения лекарственных веществ. Нарушение функционирования почек влечёт за собой необходимость корректирования режима дозирования ЛС, с учётом степени почечной дисфункции.
Большое влияние на скорость почечной экскреции оказывает возраст больного. Так, у пожилых людей обнаруживают заметное снижение количества ЛС, активно выделяемых в канальцевом аппарате почек, по сравнению с молодыми. Отмечают также снижение скорости клубочковой фильтрации некоторых ЛС (прокаинамид, клофибрат, пенициллины, метилдопа, СГ). У детей, особенно на первом году жизни, выведение ЛС почками также снижено (по сравнению со взрослыми людьми). Эти особенности необходимо учитывать при выборе препаратов и подборе режима дозирования.
Большое значение придают применению ЛС при нарушении функции почек (табл. 6-4, 6-5). При лечении больных, страдающих почечной недостаточностью, дозы многих лекарственных веществ необходимо снижать.
Причины коррекции доз препаратов, используемьх при лечении больных с почечной недостаточностью
• Снижение клубочковой фильтрации, нарушение процессов секреции и реабсорбции приводят к задержке выведения ЛС и их метаболитов, а также к повышению концентрации препаратов в плазме крови.
• Токсичность ЛС или их метаболитов возрастает у больных почечной недостаточностью вследствие нарушения функционального состояния основных систем.
• При почечной недостаточности нередко происходит нарушение метаболизма ЛС, в результате снижается также скорость элиминации.
• У этой группы больных количество лекарственного вещества, связанного с белком плазмы крови, уменьшается. Это приводит к увеличению свободной фракции ЛС.
Указанные причины (в том числе при их комбинации) приводят к увеличению числа побочных эффектов ЛС у больных с почечной недостаточностью.
Таблица 6-4. Константы выведения лекарственных средств из организма при нормальной функции почек и при анурии
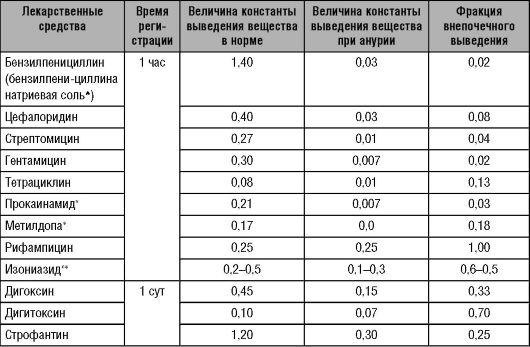 * - ЛС, имеющие активные метаболиты.
* - ЛС, имеющие активные метаболиты.
** - наличие метаболита зависит от скорости ацетилирования.
Таблица 6-5. Некоторые фармакологически активные метаболиты лекарственных средств, накапливающиеся в организме при почечной недостаточности, и их побочные эффекты
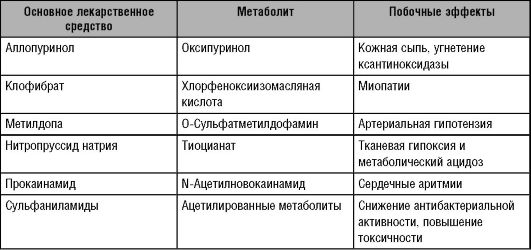 На
практике для коррекции режима дозирования ЛС при почечной
недостаточности используют специальные номограммы. По этим номограммам,
учитывая уровень креатинина в сыворотке крови пациентов, их массу тела и
рост, определяют клиренс креатинина - показатель скорости клубочковой
фильтрации. Зная клиренс креатинина, можно прогнозировать почечный
клиренс ЛС и корректировать его дозу для каждого конкретного больного.
На
практике для коррекции режима дозирования ЛС при почечной
недостаточности используют специальные номограммы. По этим номограммам,
учитывая уровень креатинина в сыворотке крови пациентов, их массу тела и
рост, определяют клиренс креатинина - показатель скорости клубочковой
фильтрации. Зная клиренс креатинина, можно прогнозировать почечный
клиренс ЛС и корректировать его дозу для каждого конкретного больного.
Именно поэтому при снижении креатининового клиренса необходимо уменьшить дозу ЛС таким образом, чтобы равновесная концентрация используемого препарата в плазме крови больного с почечной недостаточностью стала такой же, как у пациента с нормальной функцией почек.
Другой сложной проблемой считают подбор оптимального режима дозирования ЛС при лечении различных заболеваний у пациентов, страдающих почечной недостаточностью, во время проведения им гемодиализа или перитонеального диализа. При диализе происходит выведение определённого количества ЛС; это обусловливает изменение фармакокинетических параметров используемого препарата. Например, период полувыведения салициловой кислоты, равный при тяжёлой почечной недостаточности 23 ч, укорачивается при диализе до 4 ч. При применении фенобарбитала в тех же условиях регистрируют уменьшение длительности периода полувыведения от 115 до 8 ч.
Зная основные физико-химические и фармакокинетические свойства лекарственного вещества, можно определить интенсивность его выведения при диализе. ЛС с малой молекулярной массой (до 500 кД) хорошо проходят через диализную мембрану; крупные молекулы, например, гепарин (около 6000-20 000 кД) или ванкомицин (3300 кД) выводятся незначительно.
В настоящее время известны ЛС, которые интенсивно выводятся из организма при диализе: аминогликозиды, пенициллины, некоторые сульфаниламиды, триметоприм, цефалоспорины, салицилаты, теофиллин, изониазид, циметидин и некоторые другие вещества.
6.2. ВЫВЕДЕНИЕ С ЖЁЛЧЬЮ
Прохождение большинства чужеродных молекул из крови в печень не имеет серьёзных ограничений, так как эндотелий печёночного синуса по строению напоминает пористую мембрану. Следовательно, ЛС с молекулярной массой меньшей, чем у белков плазмы, быстро
выделяются в печёночные протоки. Все молекулы, выделяющиеся в жёлчь, можно разделить на три группы.
• К группе А относят вещества, концентрация которых в жёлчи и в крови идентична. Отношение концентрации этих веществ в жёлчи и плазме крови равно единице (глюкоза*, ионы натрия, калия, хлора).
• В группу В входят такие вещества, как соли жёлчи, билирубин, ксенобиотики. Отношение концентрации указанных веществ в жёлчи и плазме крови обычно варьирует от 10 до 1000 (но всегда больше единицы).
• Группу С составляют такие вещества, как фосфолипиды, инсулин, интерферон-α и интерферон-β. Отношение концентрации указанных веществ в жёлчи и плазме крови всегда меньше единицы.
Экскреция с жёлчью играет важную роль (составляет от 5 до 95% от полученной дозы препарата) в выведении ряда анионов, катионов и неионизированных молекул, таких, как СГ (Hoffmaster et al., 2005).
Печёночный путь выведения играет ключевую роль в экскреции солей тяжёлых металлов.
СГ, анионы и катионы транспортируются из печени в жёлчь тремя независимыми системами активного транспорта, сходными с системами канальцевой секреции в почках. ЛС, связанные с белками плазмы крови, полностью доступны для активного транспорта в печени.
Большинство ЛС секретируются печенью в жёлчь и затем попадают в тонкую кишку, где происходит обратное всасывание большей части веществ через кишечную стенку в кровь (энтерогепатическая рециркуляция). Этот процесс может продолжаться до тех пор, пока ЛС, претерпев метаболические изменения в печени, не будет выведено из организма с мочой или с жёлчью.
Лекарственные средства, подвергающиеся энтерогепатической рециркуляции
• Адриамицин*.
• Амфетамин.
• 1,25-дигидроксивитамин D3.
• Индометацин.
• Метронидазол.
• Морфин.
• Полярные конъюгаты глюкуроновой кислоты.
• Сулиндакp.
• Фенитоин (дифенинp).
• Эстрадиол.
Назначение энтеросорбентов может прервать цикл энтерогепатической циркуляции и удержать лекарственное вещество в просвете кишечника.
Большая часть чужеродных веществ (в том числе и ЛС) полностью или частично метаболизируется печенью. Конъюгация способствует увеличению билиарной секреции молекул путём образования полярного (анионного) центра, а также за счёт увеличения молекулярного веса. Реабсорбция конъюгированных ЛС из гастроинтестинального тракта происходит только после их гидролизации кишечными энзимами (3-глюкоронидаза). Хлорамфеникол, например, секретируется в жёлчь, затем гидролизуется кишечной флорой и снова практически полностью реабсорбируется. Данный путь рециркуляции ЛС - основная причина его токсичности.
Нарушение функций печени нередко приводит к изменению секреции жёлчи и, как следствие, к аккумулированию ряда лекарственных веществ в плазме крови (пробеницид, дигоксин, диэтилститбэстрол). Иногда регистрируют также усиление печёночной экскреции, например, при длительном использовании фенобарбитала или спиронолактона. В этом случае наблюдают снижение концентрации ЛС в плазме крови за счёт ускорения процессов печёночной элиминации.
6.3. РОЛЬ ТРАНСПОРТЁРОВ В ПРОЦЕССЕ ВЫВЕДЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
В целом почки и печень способны активно транспортировать одни и те же органические анионы. Однако данные органы имеют некоторые количественные различия, касающиеся аффинитета определён- ных лекарственных веществ к системам транспортёров. В настоящее время известно несколько систем транспортёров, обеспечивающих перенос (транспорт) молекул ЛС (Shitara et al., 2006).
Скорость работы транспортёров определяет общую скорость почечной или печёночной элиминации и общий клиренс лекарственного вещества. Транспортёры также регулируют фармакологические и токсические эффекты ЛС в силу своей способности лимитировать распределение веществ в тканях и, как следствие, развитие фармакологических и побочных эффектов того или иного препарата (Giacomini and Sugiyama, 2005).
Транспортёры в основном вовлечены в процессы канальцевой секреции и реабсорбции (Inui et al., 2000; Dresser et al., 2001). Несколько активных транспортных систем, вовлечённых в процесс секреции, локализуются в проксимальных канальцах. Реабсорбция в ряде случаев осуществляется при помощи белков-транспортёров, однако большинство ЛС реабсорбируется путём пассивной диффузии - результат наличия градиента концентрации между плазмой крови и содержимым нефрона (Koepsell and Endou, 2004; Sekine et al., 2000; Wright and Dantzler, 2004).
Субстраты для почечных транспортёров перечислены в табл. 6-6.
Таблица 6-6. Лекарственные средства, подвергающиеся транспортёр-опос- редованной почечной экскреции в неизменённом виде, и их транспортёры
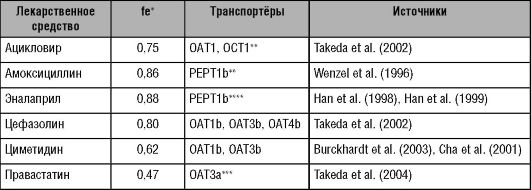 *fe
- фракция препарата, выделяющаяся с мочой в неизменённом виде. **ОАТ -
транспортёр органических анионов (organic anion transporter); ОСТ -
транспортёр органических катионов (organic cation transporter); PEPT. ***а
- лекарственный препарат - субстрат данного белка-транспортёра. b -
лекарственный препарат - ингибитор данного белка-транспортёра.
*fe
- фракция препарата, выделяющаяся с мочой в неизменённом виде. **ОАТ -
транспортёр органических анионов (organic anion transporter); ОСТ -
транспортёр органических катионов (organic cation transporter); PEPT. ***а
- лекарственный препарат - субстрат данного белка-транспортёра. b -
лекарственный препарат - ингибитор данного белка-транспортёра.
Детальные механизмы транспорта большинства лекарственных веществ не изучены.
Формула расчёта суммарного клиренса
Суммарный клиренс (Cltot) представляет сумму печёночного (Clh) клиренса и почечного (Clr) клиренса (Matsushita et al., 1992):
 Данное
уравнение демонстрирует баланс между почечным и печё- ночным путями
выведения. Кроме того, почечный и печёночный клиренс регулируются
степенью аффинитета лекарственного вещества к
Данное
уравнение демонстрирует баланс между почечным и печё- ночным путями
выведения. Кроме того, почечный и печёночный клиренс регулируются
степенью аффинитета лекарственного вещества к
тому или иному белку-транспортёру, локализованному в печени или в почках (Tahara et al., 2005). Например, 41-47% от общей дозы правастатина выводится с мочой в неизменённом виде, следовательно, можно утверждать, что правастатин - субстрат почечных транспортё-ров, в частности ОАТ3, расположенного на базолатеральной мембране проксимальных канальцев (Hasegawa et al., 2002).
6.4. ВЫВЕДЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ЧЕРЕЗ ЛЁГКИЕ
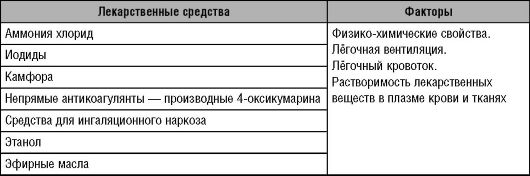
Выведение ЛС через лёгкие (с выдыхаемым воздухом) определяется физико-химическими свойствами вещества, его растворимостью в крови и тканях, а также лёгочной вентиляцией и лёгочным кровотоком (Schermuly R.T. et al., 2002). Этот путь выведения - основной только для некоторых ЛС (табл. 6-7). Около 90% этанола окисляется в печени, но часть его выводится лёгкими. Содержание этанола в выдыхаемом воздухе хорошо коррелирует с его концентрацией в плазме крови; это имеет важное практическое значение. Данный показатель нетрудно определить.
Таблица 6-7. Лекарственные средства, выделяющиеся через лёгкие и факторы, влияющие на их выделение
 6.5. ВЫВЕДЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ С МОЛОКОМ МАТЕРИ
6.5. ВЫВЕДЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ С МОЛОКОМ МАТЕРИ
Этот путь экскреции не имеет существенного значения, с точки зрения фармакокинетики ЛС, однако, его необходимо всегда иметь в виду при назначении лечения кормящим матерям (Bennett P.N., 1988).
Как правило, концентрация ЛС в молоке равна или даже выше концентрации препарата, обнаруживаемого в плазме крови матери (табл. 6-8).
Таблица 6-8. Параметры выведения некоторых лекарственных средств с грудным молоком
 Концентрация
ЛС в грудном молоке, а следовательно, и общее количество данного
препарата и его метаболитов, попадающих в организм новорождённого,
зависят от физико-химических свойств вещества, степени связывания его с
белками плазмы крови, режима применения (доза, частота и путь введения),
режима кормления и некоторых других факторов. ЛС, хорошо связывающиеся с
белком, остаются в плазме крови матери. Препараты, хорошо связывающиеся
с жиром, концентрируются в молоке (например, барбитураты). Концентрация
теофиллина в молоке составляет 70% от концентрации данного препарата в
плазме крови, левомицетина - 50%, пенициллина и цефалоспоринов - до 20%.
Хорошо проникают в молоко эритромицин, тетрациклин, изониазид,
сульфаниламиды, литий, мепробамат (мепротан*),
ацетилсалициловая кислота, тербуталин. Следует также учитывать, что даже
малые концентрации лекарственного вещества в молоке могут вызывать
разнообразные аллергические реакции у грудных детей.
Концентрация
ЛС в грудном молоке, а следовательно, и общее количество данного
препарата и его метаболитов, попадающих в организм новорождённого,
зависят от физико-химических свойств вещества, степени связывания его с
белками плазмы крови, режима применения (доза, частота и путь введения),
режима кормления и некоторых других факторов. ЛС, хорошо связывающиеся с
белком, остаются в плазме крови матери. Препараты, хорошо связывающиеся
с жиром, концентрируются в молоке (например, барбитураты). Концентрация
теофиллина в молоке составляет 70% от концентрации данного препарата в
плазме крови, левомицетина - 50%, пенициллина и цефалоспоринов - до 20%.
Хорошо проникают в молоко эритромицин, тетрациклин, изониазид,
сульфаниламиды, литий, мепробамат (мепротан*),
ацетилсалициловая кислота, тербуталин. Следует также учитывать, что даже
малые концентрации лекарственного вещества в молоке могут вызывать
разнообразные аллергические реакции у грудных детей.
Большинство ЛС при поступлении в организм новорождённого с молоком матери относительно безопасны (исключая аллергизирующее действие). Однако при необходимости приёма некоторых лекарственных веществ грудное вскармливание следует прекратить. К таким ЛС относят соли лития, изониазид, левомицетин, противоопухолевые и цитостатические вещества, радиоактивные диагностические препа-
раты. Следует также избегать контакта с инсектицидами (дихлордифенилтрихлорметилметан; гексахлоран), обладающими высокой растворимостью в жирах и поступающими в значительных количествах в организм новорождённого с молоком матери.
6.6. ЭКСКРЕЦИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ СО СЛЮНОЙ
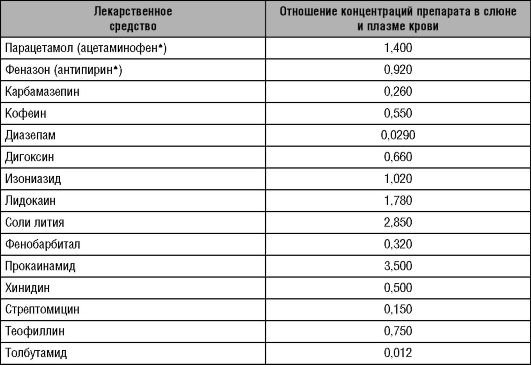
Выведение ЛС со слюной (табл. 6-9) имеет значение в связи с возможностью определения фармакокинетических параметров, если концентрация препарата в слюне коррелирует с его концентрацией в плазме крови (Gandia et al., 2003).
Таблица 6-9. Выведение лекарственных средств со слюной
 Основной
транспортный механизм экскреции ЛС со слюной - пассивная диффузия.
Скорость выведения зависит от липофильности и величины константы
кислотности (рКа) лекарственного вещества, степени его связывания
с белками плазмы крови, а также рН слюны. Значительная вариабельность
данного показателя резко ограничивает возможности использования слюны
для оценки инди-
Основной
транспортный механизм экскреции ЛС со слюной - пассивная диффузия.
Скорость выведения зависит от липофильности и величины константы
кислотности (рКа) лекарственного вещества, степени его связывания
с белками плазмы крови, а также рН слюны. Значительная вариабельность
данного показателя резко ограничивает возможности использования слюны
для оценки инди-
видуальных фармакокинетических параметров. Практически это можно осуществить лишь для ЛС с рКа, приблизительно равной 7 (т.е. для неионизированных при физиологическом рН веществ), так как для них зависимость скорости экскреции от рН слюны минимальна (Gubala et al., 2003). К числу таких веществ относят феназон (антипирин*). Фармакокинетические параметры феназона используют для оценки общей активности смешанных оксидаз печени.
6.7. ДРУГИЕ ПУТИ ЭКСКРЕЦИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Экскреция ЛС с потом, слёзной жидкостью, вагинальным секретом не имеет существенного клинического значения. Усиление выведения лекарственных веществ с потом отмечают при выраженном потоотделении вследствие артериальной гипертензии, повышения тонуса симпатической нервной системы, внезапном падении АД. Однако даже в этих случаях количество выводимых ЛС незначительно и для оценки фармакокинетических параметров практического значения не имеет
(Sato et al., 2001). Литература
Bennett P.N. Drugs and Human Lactation. - Amsterdam: Elsevier, 1988.
Burckhardt B.C., Brai S, Wallis S. Transport of cimetidine by ounder and human renal organic anion transporter 1 // Am. J. Physiol. Renal Physiol. - 2003. - Vol. 284. - P. 503-509.
Cha S.H., Sekine T., Fukushima J.I. Identication and characterization of human organic anion transporter 3 expressing predominantly in the kidney //
Mol. Pharmacol. - 2001. - Vol. 59. - P. 1277-1286.
Cihlar T., Lin D.C., Pritchard J.B. The antiviral nucleotide analogs cidofovir and adefovir are novel substrates for human and rat renal organic anion
transporter 1 // Mol. Pharmacol. - 1999. - Vol. 56. - P. 570-580.
Dresser M.J., Leabman M.K., Giacomini K.M. Transporters involved in the elimination of drugs in the kidney: organic anion transporters and organic cation transporters // J. Pharm. - 2001. - Vol. 90. - P. 397-421.
Giacomini K.M., Sugiyama Y. Membrane transporters and drug response // Goodman and Gilman's. The Pharmacological Basis of Therapeutics. - 11th ed. / Eds L.L. Brunton, J.S. Lazo, K.L. Parker. - N.Y.: McGraw-Hill
Professional, 2005. - P. 41-70.
Giacomini K.M., Sugiyama Y. Membrane transporters and drug response // Goodman and Gilman's. The Pharmacological Basis of Therapeutics. - 11th ed. / Eds L.L. Brunton, J.S. Lazo, K.L. Parker. - N.Y.: McGraw-Hill Professional, 2006.
Grantham J.J., Chonko A.M. Renal handling of organic anions and cations: excretion of uric acid // The Kidney. - 4th ed. / Eds B.M. Brenner, F.C. Rector. - Philadelphia: Saunders, 1991.
Gubala W., Zuba D. Gender differences in the pharmacokinetics of ethanol in saliva and blood after oral ingestion // Pol. J. Pharmacol. -2003, Jul. - Vol. 5. - ? 4. - P. 639-644.
Gandia P., Bareille M, Saivin S. et al. Influence of Simulated Weightlessness on the Oral Pharmacokinetics of Acetaminophen as a Gastric Emptying Probe in Man: a Plasma and a Saliva Study // J. Clin. Pharmacol. - 2003,
Nov. - Vol. 43. - P. 1235-1243.
Han H, De Vrueh R.L., Rhie J.K. 5'-Amino acid esters of antiviral nucleosides, acyclovir, and AZT are absorbed by the intestinal PEPT1 peptide transporter. // Pharm. Res. - 1998. - Vol. 15. - P. 1154-1159.
Hasegawa M., Kusuhara H, Sugiyama D. et al. Functional involvement of rat organic anion transporter 3 (rOat3; Slc22a8) in the renal uptake of organic
anions. // J. Pharmacol. Exp. Ther. - 2002. - Vol. 300. - P. 746-753.
Ho E.S., Lin D.C, Mendel D.B, Cihlar T. Cytotoxicity of antiviral nucleotides adefovir and cidofovir is induced by the expression of human renal organic anion transporter 1 // J. Am. Soc. Nephrol. - 2000. - Vol. 11. -
P. 383-393.
Hoffmaster K.A., Zamek-Gliszczynski M.J., Pollack G.M. et al. Multiple transport systems mediate the hepatic uptake and biliary excretion of the metabolically stable opioid peptide enkephalin // Drug Metab. Dispos. -
2005, Feb. - Vol. 33. - P. 287-293.
Inui K., Masuda S., Saito H. Cellular and molecular aspects of drug
transport in the kidney // Kidney Int. - 2000. - Vol. 58. - P. 944-958.
Koepsell H, Endou H.The SLC22 drugtransporterfamily//Pflugers Arch. -
Vol. 447. - P. 666-676.
Kusuhara H., Sugiyama Y. Active ef ux across the blood-brain barrier: role of the solute carrier family. - Neuro Rx., 2004. - Vol. 2. - P. 73-85.
Kusuhara H., Sugiyama Y. Active ef ux across the blood-brain barrier: role of the solute carrier family. - Neuro Rx., 2005.
Leblond F., Giroux L., Villeneuve J. Decreased in vivo metabolism of drugs in chronic renal failure // Drug Metab. Dispos. - 2000, Nov. - Vol. 28. - P. 1317.
Levy R.H. et al. Metabolic Drug Interactions. - Philadelphia: Lippincott;
Williams and Wilkins, 2000.
Matsushita H., Suzuki H., Sugiyama Y. et al. Effect of benzylpenicillin on the disposition of cefodizime in rats: no net effect on total clearance due to decreased hepatobiliary clearance and increased renal clearance // J. Pharma
col. Exp. Ther. - 1992. - Vol. 260. - P. 499-504.
Sato S., Kitagawa S., Nakajima M. et al. Assessment of tear concentrations on therapeutic drug monitoring. II. Pharmacokinetic analysis of valproic acid in guinea pig serum, cerebrospinal fluid, and tears // Pharm. Res. - 2001,
Apr. - Vol. 18. - P. 500-509.
Schermuly R.T., SchulzA., Ghofrani H.A. et al. Pharmacokinetics and metabolism of infused versus inhaled Iloprost in isolated rabbit lungs //
Pharmacol. Exp. Ther. - Nov., 2002. - Vol. 303. - P. 741.
Sekine T., Cha S.H., Endou H. The multispecic organic anion transporter
(OAT) family // Pflugers. Arch. - 200. - Vol. 440. - P. 337-350.
Shitara Y., Horie T., Sugiyama Y. Transporters as a determinant of drug clearance and tissue distribution // Eur. J. Pharmaceutic. Sci. - 2006. -
P. 425-446.
Tahara H., Kusuhara H., Endou H. et al. A species difference in the transport activities of H2 receptor antagonists by rat and human renal organic anion and cation transporters // J. Pharmacol. Exp. Ther. - 2005. - Vol. 315. - P. 337-345.
Takeda M., Khamdang S., Narikawa S. et al. Human organic anion transporters and human organic cation transporters mediate renal antiviral
transport // J. Pharmacol. Exp. Ther. - 2002. - Vol. 300. - P. 918-924.
Takeda M., Noshiro R., Onozato D. Evidence for a role of human organic anion transporters in the muscular side effects of HMG-CoA reductase
inhibitors // Eur. J. Pharmacol. - 2004. - Vol. 483. - P. 133-138.
Tamai I., Tsuji A. Transporter-mediated permeation of drugs across the blood-brain barrier // J. Pharm. - 2000. - Vol. 89. - P. 1371-1388.
Wenzel U., Gebert I., Weintraut H. Transport characteristics of differently charged cephalosporin antibiotics in oocytes expressing the cloned intestinal peptide transporter PepT1 and in human intestinal Caco-2 cells // J. Pharma
col. Exp. Ther. - 1996. - Vol. 277. - P. 831-839.
Wright S.H., Dantzler W.H. Molecular and cellular physiology of renal organic cation and anion transport // Physiol. Rev. - 2004. - Vol. 84. -
P. 987-1049.