Клиническая фармакокинетика: теоретические, прикладные и аналитические аспекты: руководство / Под ред. В.Г. Кукеса. - 2009. - 432 с
|
|
|
|
ГЛАВА 2 РОЛЬ ТРАНСПОРТЁРОВ ЛЕКАРСТВЕННЫХ СРЕДСТВ В ФАРМАКОКИНЕТИЧЕСКИХ ПРОЦЕССАХ
В.Г. Кукес, Д.А. Сычёв
Благодаря достижениям молекулярной медицины последних лет, представления о системе биотрансформации и транспортёрах ЛС претерпели значительные изменения. На сегодняшний день общепринято считать, что цели функционирования системы биотрансформации и транспортёров ЛС это (Кукес В.Г., 2004):
• предотвращение проникновения ЛС в организм человека (в системный кровоток, органы и ткани);
• снижение биологической (фармакологической) активности ЛС;
• снижение липофильности и повышение гидрофильности ЛС для облегчения их выведения;
• выведение ЛС из организма.
Все эти процессы осуществляют специализированные белки - участники системы биотрансформации и транс- портёров ЛС (рис. 2-1) (Кукес В.Г., 2004; Середенин С.Б.,
2004).
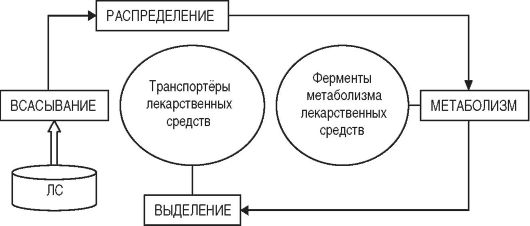 Рис. 2-1. Роль участников системы биотрансформации и транспортёров лекарственных средств в фармакокинетических процессах
Рис. 2-1. Роль участников системы биотрансформации и транспортёров лекарственных средств в фармакокинетических процессах
К таким белкам относят:
• ферменты биотрансформации, осуществляющие реакции I и II фаз метаболизма ксенобиотиков, в том числе и ЛС;
• гликопротеин-Р (Р-gp) - транспортный белок, основные функции которого: препятствие всасыванию ксенобиотиков и ЛС в кишечнике; при их попадании в организм - предотвращение проникновения через гистогематические барьеры, а также скорейшее выведение печенью в жёлчь и почками в мочу;
• транспортёры органических анионов и катионов, отвечающие за выведение ксенобиотиков и ЛС печенью в жёлчь и почками в мочу.
Ферменты биотрансформации ЛС подробно рассмотрены в главе 5 «Биотрансформация лекарственных средств», но так как транспортё- ры ЛС участвуют в процессах всасывания, распределения и выведения, то мы остановимся на них подробно до описания соответствующих фармакокинетических процессов.
«Судьбы» липофильных и гидрофильных ЛС в организме существенно различаются. Ниже представлены общие схемы детоксикации, или элиминации липофильных и гидрофильных ЛС.
Липофильные ЛС обычно хорошо всасываются, однако, проникнув в энтероциты, они могут вновь «выбрасываться» в просвет
кишечника гликопротеином-Р1. Тем не менее, попав в энтероциты, а затем и в гепатоциты, липофильные ЛС подвергаются биотрансформации до гидрофильных метаболитов, которые либо попадают в системный кровоток, либо активно секретируются в жёлчь транс- портёрами органических анионов и катионов. Находясь в гепатоцитах, не успевшие метаболизироваться липофильные ЛС также способны активно секретироваться в жёлчь с помощью гликопротеина-Р. Минуя описанные процессы, липофильные ЛС могут достигнуть системного кровотока, однако их проникновение в ткани затруднено функционированием гликопротеина-Р эндотелиоцитов кровеносных сосудов: ЛС, попав в эндотелиоцит, вновь «выбрасывается» гликопротеином Р в просвет сосуда. Не метаболизировавшиеся липофильные ЛС способны активно секретироваться в проксимальных почечных канальцах в мочу гликопротеином-Р. Гидрофильные метаболиты ЛС легко фильтруются в почечных клубочках и, кроме того, могут активно секретироваться в проксимальных почечных канальцах в мочу транспортёрами органических анионов и катионов (Kim R.B., 2002).
Гидрофильные ЛС плохо всасываются в кишечнике, а всосавшись, плохо проникают через мембраны гепатоцитов путём простой диффузии, поэтому они активно транспортируются в гепатоциты транспор- тёрами органических анионов и катионов. В гепатоцитах гидрофильные ЛС слабо метаболизируются, и, как правило, в неизменённом виде могут активно секретироваться в желчь также транспортёрами органических анионов и катионов. Достигнув системного кровотока, гидрофильные ЛС плохо проникают в ткани, фильтруются в почечных клубочках, и, кроме того, могут активно секретироваться в проксимальных почечных канальцах в мочу транспортёрами органических анионов и катионов (Kim R.B., 2002).
Таким образом, система биотрансформации и транспортёров ЛС представляет собой дублирующие друг друга взаимосвязанные механизмы, направленные на борьбу организма с ЛС.
В настоящее время выделяют следующие фазы детоксикации, или элиминации ксенобиотиков, и в том числе ЛС (Кукес В.Г., 2004):
• 0 фаза - препятствие всасыванию ксенобиотиков в кишечнике, осуществляемое гликопротеином-Р;
1 Гликопротеин-Р - важный компонент гистогематических барьеров: гематоэнцефалического, гематоплацентарного, гематотестикулярного, гематотимического и т.д.
• I фаза представляет собой реакции I фазы биотранфсормации, в процессе которых ксенобиотики, под действием, главным образом, изоферментов цитохрома Р-450 переходят в более гидрофильные соединения благодаря присоединению или освобождению активных функциональных групп (например, -ОН, -NH2, -SH);
• II фаза - это реакции II фазы биотрансформации или синтетические реакции - соединение (коньюгация) ксенобиотиков и/или их метаболитов с эндогенными веществами; в результате образуются гидрофильные коньюгаты;
• III фаза - активная секреция ксенобиотиков и/или их метаболитов в мочу или в желчь, осуществляемая гликопротеином-Р, транспортёрами органических анионов и катионов.
Очевидно, что именно функционирование системы биотрансформации и транспортёров и определяет фармакокинетику ЛС. В свою очередь, изменение фармакокинетики ЛС, а значит эффективности и безопасности ЛС, зависит от факторов, воздействующих на активность участников этой системы (ферментов биотрансформации и транспортёров ЛС). К таким факторам относят:
• генетический фактор;
• влияние индукторов/ингибиторов, в том числе и ЛС;
• пол;
• возраст;
• заболевания и т.д.
Понимание механизмов влияния этих факторов на ферменты биотрансформации и транспортёры ЛС позволит «управлять судьбой ЛС» путём применения индивидуального режима дозирования ЛС, обеспечивая максимальную эффективность и безопасность фармакотерапии (Sweet D.H., 2001).
Как было указано выше, транспортёры играют существенную роль в фармакокинетических процессах, таких, как всасывание, распределение и выведение. Перечислим основные функции транспортёров в фармакокинетике ЛС.
• При их локализации в энтероцитах, осуществляют:
- выброс или выкачивание ЛС в просвет кишечника [при участии гликопротеина-Р (P-gp, кодируется геном mdrl), белка резистентности рака молочной железы (ВСRP), белка 2, ассоциированного с множественной лекарственной устойчивостью (MRP2)];
- всасывание или вкачивание ЛС - транспортёр 1 олигопептидов (РЕРТ1), полипептид В, транспортирующий органические анионы (ОАТР-В или ОАТР2-В1).
• При локализации в гепатоцитах:
- захват ЛС из крови [полипептиды А, В и С, транспортирующие органические анионы (ОАТР-А или ОАТР1-В3, ОАТР-В или ОАТР2-В1, ОАТР-С или ОАТР1-В1); белки 1, 3 и 4, ассоциированные с множественной лекарственной устойчивостью (MRP1, MRP3, MRP4)];
- активная секреция ЛС в жёлчь (гликопротеин-Р; белок 2, ассоциированный с множественной лекарственной устойчивостью; белок резистентности рака молочной железы).
• При локализации в эпителиоцитах проксимальных почечных канальцев:
- захват ЛС из крови [транспортёры органических анионов 1, 2 и 3 (ОАТ1, ОАТ2 и ОАТ3)];
- активная секреция в мочу (гликопротеин Р; ОАТ4; белки 2 и 4, ассоциированные с множественной лекарственной устойчивостью - MRP2, MRP4);
- реабсорбция ЛС (транспортёры 1 и 2 олигопептидов - РЕРТ1, РЕРТ2; белок 1, ассоциированный с множественной лекарственной устойчивостью - MRP1).
• При локализации в эндотелиоцитах гематоэнцефалического барьера: выброс ЛС в просвет сосуда, не допуская их проникновение в ЦНС - гликопротеин-Р.
В фармакокинетике ЛС участвуют и другие транспортёры. Характеристика основных транспортёров ЛС представлена в приложениях 3 и 4.
Исходя из вышерассмотренного, очевидно, что полиморфизм генов, кодирующих транспортёры, может существенно влиять на фармакокинетику ЛС, изменяя фармакодинамик, а в итоге - эффективность и безопасность ЛС.
Гликопротеин-Р - продукт гена mdrl - представляет собой аденозинтрифосфат (АТФ)-зависимый насос, локализованный на цитоплазматических мембранах различных клеток и осуществляющий выброс во внеклеточное пространство различных ксенобиотиков, в том числе и ЛС (Kim, 2002, рис. 2-2). Гликопротеин-Р изначально изучали в опухолевых клетках как белок, участвующий в формировании механизма резистентности опухолей к цитоста-
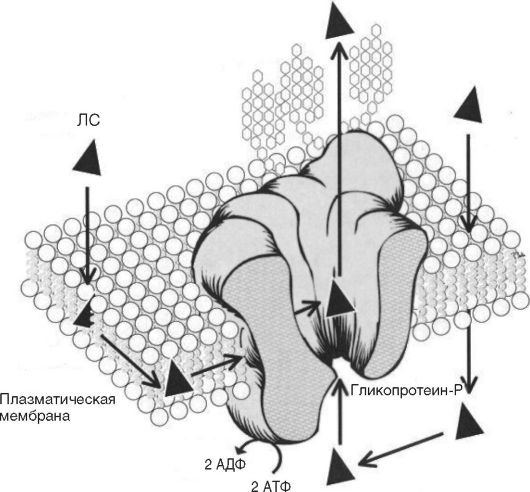 Рис. 2-2. Механизм функционирования гликопротеина-Р
Рис. 2-2. Механизм функционирования гликопротеина-Р
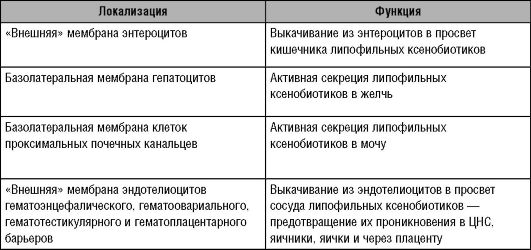
тикам. Однако экспрессия гена гликопротеина-Р обнаружена и в нормальных клетках, и в тканях организма человека: в энтероцитах, гепатоцитах, в клетках проксимальных почечных канальцев и в эндотелиоцитах гистогематических барьеров (гематоэнцефалического, гематоовариального, гематотестикулярного и гематоплацентарного). В кишечнике гликопротеин-Р выполняет роль своеобразного насоса, выкачивающего ЛС из клетки в просвет кишечника. Располагаясь в гепатоцитах, гликопротеин-Р способствует выведению ксенобиотиков в жёлчь. Гликопротеин-Р эпителия почечных канальцев участвует в активной секреции ксенобиотиков в мочу, а в эндотелиоцитах гистогематических барьеров он препятствует проникновению ксенобиотиков в ЦНС, яичники, яички, через плаценту. Таким образом, гликопротеин-Р - это адаптационный механизм,
возникший в процессе эволюции для защиты организма человека от ксенобиотиков; основная его функция - препятствие всасыванию ксенобиотиков, а при их попадании в организм - скорейшее выведение (Kim R.B., 2002, табл. 2-1).
Следует отметить, что уровень содержания гликопротеина-Р значительно варьирует у мужчин и женщин. Так, Shnetz и соавт. (1995) показали, что уровень экспрессии гена, кодирующего гликопротеин-Р (mdrl), у мужчин в 2,4 раза превышает таковой у женщин. По мнению Cummins (2002), именно этот феномен лежит в основе половых различий в фармакокинетике ряда ЛС.
Таблица 2-1. Локализация и функция гликопротеина Р в организме человека
 Субстраты
гликопротеина-Р - ряд широко применяемых ЛС: сердечные гликозиды
(дигоксин, дигитоксин), блокаторы медленных кальциевых каналов,
ингибиторы ГМГ-КоА-редуктазы (статины), блокаторы Н1-рецепторов
гистамина, макролиды, некоторые цитостатики, противоретровирусные
препараты и др. Полный список субстратов гликопротеина-Р представлен в приложении 3. Следует отметить, что многие ЛС-субстраты гликопротеина-Р одновременно являются субстратами CYP3A4.
Субстраты
гликопротеина-Р - ряд широко применяемых ЛС: сердечные гликозиды
(дигоксин, дигитоксин), блокаторы медленных кальциевых каналов,
ингибиторы ГМГ-КоА-редуктазы (статины), блокаторы Н1-рецепторов
гистамина, макролиды, некоторые цитостатики, противоретровирусные
препараты и др. Полный список субстратов гликопротеина-Р представлен в приложении 3. Следует отметить, что многие ЛС-субстраты гликопротеина-Р одновременно являются субстратами CYP3A4.
Роль гликопротеина-Р в фармакокинетике ЛС хорошо изучена на моделях животных, в качестве которых использовали мышей линии CF-1, нокаутных по гену гликопротеина-Р (mdrl). Фармакокинетика ЛС-субстратов гликопротеина-Р (дигоксина, циклоспорина, вин-бластина) значительно изменена у нокаутных мышей и опре-
деляется в виде более полного всасывания, угнетения выведения в жёлчь и мочу, повышения проникновения ЛС через гистогематические барьеры.
В клинических исследованиях активность гликопротеина-Р оценивают по фармакокинетике его специфического (маркёрного) субстрата фексофенадина. Активность гликопротеина-Р зависит от множества факторов, основной из которых - полиморфизм гена mdrl, кодирующего гликопротеин-Р. В настоящее время активно изучают клиническое значение четырёх полиморфных маркёров, представляющих собой замену в нуклеотидной последовательности ДНК одного нуклеотида на другой (так называемые однонуклеотидные полиморфизмы). Как показали исследования последних лет, наибольшее клиническое значение имеет полиморфный маркёр C3435T, представляющий собой замену в нуклеотидной последовательности цитозинового нуклеотида на тимидиновый в положении 3435. Частота аллелей и генотипов по полиморфному маркёру C3435T значительно варьирует в различных этнических группах. В исследованиях in vitro было показано, что у индивидуумов с генотипом ТТ отмечают снижение экспрессии гена mdrl в двенадцатиперстной кишке, в CD56+-лейкоцитах, в почках. Очевидно, что снижение экспрессии гена mdrl в кишечнике и почках должно приводить к снижению количества гликопротеина-Р в этих органах, а следовательно, к более полному всасыванию и замедленному выведению ЛС, а субстратов гликопротеина-Р. В результате у индивидуумов с ТТ-генотипом обнаруживают высокие концентрации ЛС-субстратов гликопротеина-Р в плазме крови, в частности, СГ, иммуносупрессантов (циклоспорина, такролимуса). Кроме того, у лиц с ТТ-генотипом наблюдают усиление проникновения ЛС через гематоэнцефалический барьер, что может приводить не только к повышению риска развития нежелательных лекарственных реакций со стороны ЦНС, но и в случае, если мишени ЛС находятся в головном мозге, - к повышению эффективности терапии. Так, например, было продемонстрировано, что эффективность терапии шизофрении при применении нейролептика бромперидолар выше у пациентов, имеющих генотип ТТ по полиморфному маркёру С3435Т гена mdrl, что, по-видимому, связано с более хорошим проникновением препарата через гематоэнцефалический барьер. Этим же феноменом, а не только изменениями фармакокинетики, объясняют большую эффективность противосудорожных и противорвотных ЛС у носителей ТТ-генотипа.
В последние годы большое внимание уделяют влиянию полиморфизма гена mdrl, кодирующего гликопротеин-Р, на эффективность противовирусных ЛС, применяемых при инфекции вирусом иммунодефицита человека (ВИЧ), из группы ингибиторов ВИЧ-протеиназы. Однако результаты этих исследований противоречивы. Так, Haas D.W. и соавт. (2005) обнаружили, что носительство генотипа ТТ по полиморфному маркёру С3435Т гена mdrl ассоциируется с более выраженным снижением количества вируса при применении нелфинавира, по сравнению с носителями генотипов СТ и СС. В то же время, Verstuyft C. и соавт. (2005) не выявили различий в фармакокинетике и клинической эффективности при применении другого ингибитора ВИЧ-протеиназы - индинавира - между группами пациентов в зависимости от носительства генотипов по полиморфным маркёрам гена mdrl.
Результаты, полученные при исследованиях по изучению влияния полиморфизма гена гликопротеина-Р (mdrl) на фармакокинетику и фармакодинамику ЛС, противоречивы. Выяснение значения полиморфизма гена mdrl для индивидуализации фармакотерапии возможно, только если будут продолжены клинические исследования по изучению влияния полиморфизма mdrl на фармакокинетику, фармакодинамику, а также на эффективность и безопасность ЛС-субстратов гликопротеина-Р. Кроме того, необходимы клинические исследования по изучению оптимальных режимов дозирования ЛС-субстратов гликопротеина-Р для пациентов, в зависимости от генотипа гликопротеина-Р. На основании результатов уже проведён- ных исследований можно предположить, что при выявлении аллельных вариантов гена mdrl необходимо:
• снижать дозу ЛС-субстратов гликопротеина-Р с узкой терапевтической широтой (дигоксин, циклоспорин);
• не применять ЛС-субстраты гликопротеина-Р, нежелательные лекарственные реакции которых связаны с их проникновением через гистогематические барьеры (фексофенадин, лоперамид);
• назначать препараты с низкой биодоступностью, так как у этой категории пациентов они могут оказаться наиболее эффективными (ингибиторы ВИЧ-протеиназы, статины);
• назначать препараты, проникновение которых через гематоэнцефалический барьер затруднено, а их мишени расположены в ЦНС, так как у этой категории пациентов они могут оказаться наиболее эффективными (противосудорожные ЛС, бромперидолр, респеридонр).
Таким образом, изучение генетического полиморфизма гликопротеина Р может оказаться перспективным методом индивидуализации фармакотерапии, что повысит её эффективность и безопасность.
Транспортёры органических анионов и катионов представляют собой трансмембранные белки, ответственные за перенос через мембрану эндогенных веществ и ксенобиотиков различной химической структуры, в том числе ЛС и их метаболитов, общее свойство которых - гидрофильность. Транспортёры органических анионов формируют суперсемейство Nа+-независимых транспортных систем, осуществляющих транспорт через мембрану ряда ЛС и их метаболитов. Они подразделяются на два семейства: органических переносчиков анионов - OAT) и органических анион-транспортирующих полипептидов - OATP. Суперсемейство транспортёров органических катионов представлено одним семейством - ОСТ. ОАТ, ОАТР, ОСТ обнаруживают в печени, почках, головном мозге и кишечнике, что позволяет им играть важную роль во всасывании, распределении и, самое главное - в выведении ЛС. ОАТ и ОСТ играют наибольшую роль в активной секреции гидрофильных ЛС в проксимальных почечных канальцах в мочу, а ОАТР - в гепатоцитах в жёлчь. К субстратам транспортёров органических анионов и катионов относят ряд широко применяемых ЛС, включая β-лактамные антибиотики, диуретики, нестероидные противовоспалительные средства (НПВС), противовирусные и противоопухолевые средства, ингибиторы ГМГ-КоА-редуктазы (статины - приложение 3).
В настоящее время наиболее хорошо изучено влияние генетического полиморфизма oatp-c на фармакокинетику и фармакодинамику статинов. Доказано, что носительство определённых аллельных вариантов гена OATP-C, кодирующего полипептид С, транспортирующий органические анионы (ОАТР-С или SLCO1B1), приводит к его сниженной активности. Это проявляется увеличением периода полувыведения, площади под фармакокинетической кривой и снижением клиренса ряда статинов (питавастатинар, правастатина, розувастатина), перорального гипогликемического ЛС репаглинида, а также нового гиполипидемического ЛС эзетимиба и его активного метаболита. Помимо транспортёров органических анионов и катионов, во всасывании, в распределении и выведении ЛС могут принимать участие и другие транспортёры, которые в настоящее время активно изучают (транспортёры системы олигопептидов, нуклеозидов, транспортёры множественной лекарственной устойчивости -
приложение 3), но фармакогенетические исследования их свойств только начались.
Литература
Кукес В.Г. Метаболизм лекарственных средств: клинико-фармакологические аспекты. - М.: Реафарм, 2004. - С. 113-120.
Середенин С.Б. Лекции по фармакогенетике. - М.: МИА, 2004. -
С. 303.
Cummins L. Sex-related differences in the clearance of cytochrome P450 3A4 substrates may be caused by P-glycoprotein // Clin. Pharmacol. Ther. - 2002. - Vol. 75. - P. 56-67.
Kim R.B. Drugs as P-glycoprotein substrates, inhibitors, and inducers // Drug Metab. Rev. - 2002. - Vol. 34. - P. 47-54.
Schuetz E.G., Furuya K.N., Schuetz J.D. Interindividual variation in expression of P-glycoprotein in normal human liver and secondary hepatic neoplasms // J. Pharmacol. Exp. Ther. - 1995. - Vol. 275. - P. 1011-1018.
Sweet D.H., Bush K.T., Nigam S.K. The organic anion transporter family: from physiology to ontogeny and the clinic // Am. J. Physiol. Renal. Physiol. - 2001, Aug. - Vol. 281. - ? 2. - P. 197-205.
Verstuyft C., Marcellin F., Morand-JoubertL. etal.; ANRS081 Study Group. Absence of association between MDR1 genetic polymorphisms, indinavir pharmacokinetics and response to highly active antiretroviral therapy // AIDS - 2005, Dec. - Vol. 2. - ? 19(18). - P. 2127-2131.