Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев. 2010. - 920 с.
|
|
|
|
ГЛАВА 7 ОБЩИЕ ПРИНЦИПЫ И МЕТОДЫ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Современные достижения клинической онкологии позволяют излечить не менее 1/3 больных, страдающих злокачественными новообразованиями. Большинство пациентов (60-70 %) подвергаются хирургическому лечению или операции в сочетании с лучевой или химиотерапией. Около 30 % больных получают только облучение и до 10 % - только цитостатическое лечение. Шансы на благоприятный исход у потенциально излечимых больных значительно возрастают при использовании всех возможностей для установления правильного диагноза и проведения адекватного лечения. Самым важным условием излечения преобладающего большинства злокачественных опухолей является ранняя стадия процесса.
Оптимальными являются лечение и наблюдение онкологических пациентов в специализированных клиниках, оснащенных современным медицинским оборудованием, с высококвалифицированным медицинским персоналом.
Планирование лечения конкретного больного должно осуществляться группой специалистов-онкологов (патоморфолог, хирург, лучевой терапевт и химиотерапевт). При обсуждении лечебной тактики необходимо учитывать все индивидуальные биологические критерии заболевания, к которым относятся как особенности опухолевого процесса (гистологический тип, стадия), так и общее состояние больного, наличие сопутствующей патологии, состояние иммунитета и т.п. Коллективный подход к лечению больного представляется наиболее оптимальным, поскольку обеспечивает преемственность и максимально полный объем лечебной помощи. Возможные варианты лечения включают применение одного из методов воздействия на опухоль (хирургического, лучевого или лекарственного) или, значительно чаще, различных их комбинаций. Последовательность применения лучевого, лекарственного и хирургического методов лечения
варьирует в зависимости от морфологической характеристики опухоли, распространенности злокачественного процесса, чувствительности опухоли к цитостатикам, задач лечения, наличия у больного сопутствующей патологии и др.
В клинической онкологии используют следующие варианты лечения:
• комбинированное лечение - применение у одного больного двух однонаправленных методов лечения (например, локальное воздействие на опухоль путем выполнения радикальной операции с последующим курсом лучевой терапии);
• комплексное лечение - применение локального и системного методов воздействия на опухоль (например, хирургического и лекарственного лечения).
Отдельно выделяют сочетанный вариант лечения, подразумевающий одновременное применение принципиально однородных методов с различным механизмом действия (например, сочетание дистанционного и внутритканевого облучения).
Лечение онкологических больных может быть радикальным, паллиативным и симптоматическим. Радикальным называется такой вид лечения, после проведения которого в организме больного не выявляются клинические, рентгенологические, эндоскопические и морфологические признаки опухолевого процесса. После выполнения паллиативного лечения в организме больного сохраняются проявления опухолевого заболевания. При проведении симптоматического лечения все мероприятия направлены только на устранение тягостных или угрожающих жизни симптомов и осложнений заболевания.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Как правило, хирург является первым специалистом, к которому обращается больной, страдающий злокачественным новообразованием. Кроме того, в процессе лечения онкологического пациента возникает необходимость в хирургическом вмешательстве для морфологической верификации диагноза, определения степени распространения опухолевого процесса, для реализации паллиативных задач и т.п. Профессионализм хирурга-онколога заключается также в знании как стандартных, так и нестандартных вариантов лечения злокачественных опухолей, способности объяснить их больному, в адекватном и полном выполнении начальных этапов в диагностике и лечении.
Проведение морфологического исследования позволяет выбрать адекватный объем хирургического вмешательства, а также предоставляет юридические основания для выполнения в случае необходимости калечащей операции.
Хирургические вмешательства подразделяются на диагностические и лечебные.
Диагностические операции (тонкоигольная и трепанобиопсия, ножевая биопсия, видеоассистированные операции) выполняются для верификации диагноза и определения степени распространения опухолевого процесса. Выделяют биопсии лимфатических узлов, опухоли (молочной железы, конечностей, ЖКТ, дыхательных путей).
Лечебные операции подразделяются на радикальные, условнорадикальные или циторедуктивные и паллиативные.
В онкологической практике приняты понятия, характеризующие общие показатели хирургической активности.
1. Операбельность. Понятие операбельности включает так называемые общие критерии, определяющие состояние больного, его возраст, сопутствующие заболевания, функциональные резервы жизненно важных органов, принципиально позволяющие выполнить операцию, а также критерии, характеризующие опухоль и опухолевый процесс в целом. К ним относятся локализация опухоли, анатомо-функциональные нарушения в пораженном органе, степень распространения опухоли, наличие отдаленных метастазов, тип роста опухоли и ее гистологическое строение. Состояние, исключающее возможность проведения хирургического лечения, принято называть иноперабельностью. Решение вопроса о возможности выполнения радикального оперативного вмешательства должно приниматься только после тщательного обследования больного, желательно в условиях стационара. По обобщенным данным, неоперабельными ошибочно признаются до 15-20 % онкологических больных. Необоснованный же отказ от операции значительно уменьшает шансы пациента на излечение.
2. Резектабельность. В отличие от операбельности под резектабельностью понимается техническая возможность удаления опухоли с учетом степени ее распространения, т.е. глубины поражения органа, наличия регионарных и отдаленных метастазов. Резектабельность опухоли определяется клинически, с помощью дополнительных методов обследования и интраоперационно.
Радикальные операции предусматривают радикализм по отношению к первичной опухоли и ее регионарным метастазам. После выполнения радикальной операции в организме не остается опухолевых очагов, определяемых клиническими, рентгенологическими, эндоскопическими или морфологическими методами.
Выделяют:
1) стандартные радикальные операции, при которых удаляют основную опухоль и близлежащие зоны ее метастазирования в лимфатическую систему;
2) расширенные операции, при которых увеличивается объем удаления зон регионарного метастазирования за счет смежных анатомических областей;
3) комбинированные или мультиорганные операции; в результате таких вмешательств удаляют часть органа или полностью другой орган, в которые произошла инвазия первичной опухоли.
В последние годы увеличивается доля комбинированных и расширенных операций в лечении местно-распространенных и метастатических опухолей органов грудной клетки, пищеварительного тракта, мочеполовой системы и опорно-двигательного аппарата. Это обусловлено разработкой и внедрением принципиально новых хирургических приемов. Во многом их применение стало возможным благодаря интегральному развитию анестезиологии и реанимации, а также разработке нового медицинского оборудования (CellSaver, УЗ-скальпель, LigaSure, протезы, гемостатические губки и пр.). Надо отметить, что большинство операций данной категории является практически неклассифицируемыми, требуют высочайшего класса хирургической техники и реанимационноанестезиологического обеспечения, что доступно лишь в крупных специализированных центрах. С учетом высокой заболеваемости раком желудка и частого выявления его местно-распространенных форм особенно актуальным с точки зрения современной онкохирургии является выполнение комбинированных операций - гастрэктомии с резекцией поджелудочной железы, надпочечника, поперечной ободочной кишки, диафрагмы и т.д.
Постепенно увеличивается доля расширенных и комбинированных операций в хирургии опухолей опорно-двигательного аппарата. Нами разработаны и внедрены такие методы оперативного вмешательства, как спондиллэктомия на двух уровнях и более, комбинированная резекция позвоночника и грудной стенки при
опухолях реберно-позвоночного угла, удаление злокачественных новообразований таза и крестца больших размеров с реконструкцией тазового кольца.
Объем оперативного вмешательства определяется локализацией опухоли, стадией заболевания и анатомическим типом роста. При экзофитно растущих, четко отграниченных опухолях допустимо расширение показаний к операции вплоть до комбинированных резекций. При инфильтративном характере роста опухоли расширение показаний к органосохранному оперативному лечению обычно неоправданно.
Радикальное удаление первичной опухоли должно удовлетворять принципам абластики, антибластики, зональности, футлярности.
Абластика является основным принципом радикального хирургического лечения злокачественных новообразований, заключающимся в резекции пораженного органа в пределах здоровых тканей. К основным приемам абластики относятся в первую очередь исключение грубых манипуляций с пораженными органами и тканями, острая препаровка скальпелем или электроножом, предварительное лигирование венозных сосудов, смена инструментов и перчаток после удаления опухоли перед реконструктивным этапом, тщательный гемостаз, хорошее дренирование раны в послеоперационном периоде и т.п. При адекватном выполнении этих мероприятий значительно уменьшается риск попадания опухолевых клеток в рану, их имплантация в здоровые ткани и распространение по кровеносному руслу. Однако рассеивание некоторого количества злокачественных клеток в ране может происходить, несмотря на соблюдение правил абластики, поэтому обеспечение радикализма оперативного вмешательства должно включать комплекс антибластических мер.
Антибластика представляет собой ряд мероприятий, направленных на уничтожение и удаление оставшихся в операционном поле опухолевых клеток. К ним относятся: обильное орошение и промывание раны раствором фурацилина, 3 % раствором перекиси водорода, пред-, интра- и послеоперационное облучение операционного поля.
Принцип зональности базируется на знании особенностей местного распространения опухоли и ее метастазирования в регионарные лимфатические узлы.
Операции при злокачественных опухолях различных локализаций предусматривают удаление пораженного органа и клетчатки с лимфатическими узлами в зонах регионарного метастазирования.
Лимфаденэктомией (лимфодиссекцией) называется иссечение регионарных к удаляемому органу лимфатических узлов и сосудов; данные термины на равных правах применяются в мировой литературе. Следует отметить, что термин «лимфодиссекция», являясь более емким, чем термин «лимфаденэктомия», включает моноблочное удаление не только лимфатических узлов, но и всего лимфатического аппарата (лимфатических сосудов с окружающей жировой клетчаткой) в пределах фасциальных футляров. Впервые такой подход был предложен более 100 лет назад W.S. Halsted при хирургическом лечении рака молочной железы.
Тот факт, что лимфатические узлы и сосуды служат проводником и временным барьером опухолевой генерализации, и предположение, что их раннее хирургическое иссечение может обеспечить излечение, послужили главными предпосылками к выполнению регионарных лимфаденэктомий при злокачественных опухолях разных органов.
Уже в XIX веке существовало понятие о лимфогенном метастазировании злокачественных опухолей. Это привело к осознанию необходимости удаления не только пораженного органа, но и соседних структур, несущих метастазы. Возможности радикального лечения рака определялись развитием хирургической техники и ее обеспечения.
В конце XIX века появились работы по применению лимфаденэктомии при раке шейки матки. Тогда же была разработана классическая техника расширенной экстирпации матки с придатками и принципиальной подвздошно-тазовой лимфаденэктомией.
В 1894 г. W. Halsted описал радикальную мастэктомию с иссечением регионарных подмышечных и в некоторых случаях надключичных лимфатических узлов. В 1948 г. D. Patey, W. Dyson предложили свой вариант радикальной операции, который предусматривал сохранение большой грудной мышцы. В комбинации с лучевой терапией результаты этой операции были не хуже, чем у операции W. Halsted. Вследствие значительно меньшей травматичности и лучших функциональных результатов она стала широко применяться при лечении рака молочной железы. Следующим этапом в развитии щадящих операций было предложение J. Madden в 1965 г. удалять лимфатические узлы подмышечной и межпекторальной областей с сохранением обеих грудных мышц. Если лучевую терапию дополняют сохранением мышц, это не влияет на отдаленные результаты лечения, но обеспечивает лучшие функциональные показатели и резко снижает количество отеков верхней конечности. В 70-е годы прошлого века
работы U. Veronesi позволили уменьшить объем операции без снижения ее радикальности.
В 1908 г. W. Miles впервые предложил осуществлять лимфаденэктомию в хирургии ЖКТ: он выполнял брюшно-промежностную экстирпацию прямой кишки по поводу рака en bloc с прилежащими лимфатическими узлами и клетчаткой. К.П. Сапожков в 1945 г. пропагандировал принципиальную гастрэктомию с расширенной лимфаденэктомией при раке желудка, называя ее «предельно-радикальной» операцией. Широкое выполнение расширенных лимфаденэктомий при раке желудка, имеющее характер хирургической доктрины, началось в 60-е годы XX века в Японии и затем распространилось в других странах.
В то же время широкое иссечение клетчатки с лимфатическими коллекторами достоверно увеличивает частоту осложнений. При раке молочной железы лимфодиссекция часто сопровождается длительной лимфореей, инфицированием раны, а также отеком конечности, болевыми ощущениями, утратой работоспособности, общим дискомфортом. При раке желудка расширенная лимфодиссекция увеличивает количество абсцессов в ложе удаленной селезенки, случаев панкреатита, панкреатических свищей. Все это нередко приводит к инвалидизации больных, не говоря уже об увеличении продолжительности пребывания их в стационаре и увеличении стоимости лечения. В то же время при тщательном гистологическом исследовании удаленных во время лимфодиссекции тканей часто не находят злокачественных клеток, т.е. объем операции превышает необходимый. Поэтому возникло стремление выполнять лимфодиссекцию не профилактически, а при наличии метастазов.
Концепция развития сторожевых лимфатических узлов связана с учением о лимфогенном метастазировании различных опухолей органов и тканей. Она возникла на основе новейших достижений в области анатомии и функции лимфатической системы, в частности методов исследования внеорганных путей транспорта лимфы.
Концепция сторожевых лимфатических узлов может быть объяснена упорядоченным строением путей оттока лимфы от определенных зон разных органов и перекрестным метастазированием при блокаде опухолевыми тромбами части из них - в отдаленные группы узлов. В последнем случае до известной степени нарушается принцип автономности лимфатических сегментов пораженного опухолью органа, и дренаж патологических тканей осуществляется
в разных направлениях. В нормальных условиях лимфатические сегменты до известной степени анатомически и физиологически клинически обособлены. Физиологически лимфатические сегменты - это единые образования в системе функционирования лимфатической системы (как транспортной, так и иммунологической). Клинически опухолевый процесс в одном из лимфатических сегментов органов и тканей приводит к локальным морфофункциональным изменениям лимфатических узлов или только одного узла. Одиночные метастазы в группах узлов всегда свидетельствуют об органической избирательности лимфоидных элементов в ответ на существующую злокачественную опухоль.
Одна из первых практических работ в определении направления путей лимфооттока выполнена в 1960 г. E. Gould. Он показал, что при опухолях околоушной железы метастазами в первую очередь поражается лимфатический узел в месте слияния передней и задней лицевых вен. В 1974 г. В.Ю. Янушкевич на практике при обнаружении одиночного метастаза у больных раком молочной железы отказался от расширенного варианта операции. Автор описал двух больных, которым планировалась подмышечно-грудинная мастэктомия, но применение метода хромолимфографии позволило отказаться от предполагаемого расширения границ операций.
Наряду с выявлением метастазов прижизненная окраска лимфатического аппарата помогла четко определить зоны регионарного лимфооттока, что, в свою очередь, позволило соблюдать принципы анатомической зональности и футлярности оперирования. Работу по индивидуализации объема лимфодиссекции и попытки уменьшить объем удаляемых тканей продолжил R. Cabanac, который в 1977 г. провел исследования у 100 пациентов раком полового члена. Автор, изучив данные лимфангиографии и анатомические срезы удаленной клетчатки, показал, что для рака данной локализации также существует лимфатический центр, в который в первую очередь осуществляется отток лимфы из определенного участка ткани. Этот узел получил название «sentinel lymph node» (в переводе с английского - часовой, страж). Отсюда возник перевод: «сторожевой лимфатический узел», который мы предпочитаем другому термину, иногда появляющемуся в отечественных переводах, - сигнальный узел. Именно этот узел в первую очередь поражается метастазами при раке полового члена и является как бы первым фильтром для опухолевых клеток. Этот лимфатический узел является также фильтром и для контрастных
препаратов - он в первую очередь окрашивается при введении контрастного препарата непосредственно в лимфатические пути или в ткани. В результате данный лимфатический узел хорошо визуализируется на рентгенограммах. R. Cabanac определил наиболее частую локализацию этого лимфатического узла при раке полового члена и рекомендовал его удаление и срочное гистологическое исследование для определения целесообразности дальнейшей лимфаденэктомии. Если в сторожевом лимфатическом узле метастазы не обнаруживались, дальнейшую лимфаденэктомию автор не рекомендовал. Сторожевой узел не обязательно поражается метастазами, но если у больного есть лимфогенные метастазы, то именно сторожевой узел поражается метастазами в первую очередь.
Предложенный R. Cabanac метод ангиолимфографии не получил широкого применения в практике определения сторожевых лимфатических узлов, поскольку был дорогим, технически сложным, не всегда информативным, а кроме того, не позволял во время операции определить, какой именно из нескольких лимфатических узлов является сторожевым.
Поэтому была продолжена работа по использованию красителя для контрастирования сторожевых лимфатических узлов. В 1991 г. D. Morton и соавт. опубликовали результаты экспериментальных исследований по определению эффективности различных красителей для окрашивания с целью визуализации сторожевых лимфатических узлов. Наиболее эффективным оказался краситель Isosulfan blue clue, который с того времени успешно применяется для этих целей. Сторожевые лимфатические узлы прокрашиваются через 30-60 мин после введения препарата по периферии опухоли.
Следующим шагом в развитии концепции сторожевых лимфатических узлов явились исследования J. Alex и D. Krag (1993), которые предложили методику интраоперационного определения лимфатических узлов с использованием гамма-сканера и коллоида, меченного радиоактивным технецием - 99тТе (период полураспада - 6,01 ч). Радиоактивный коллоид вводили в несколько точек вокруг опухоли за несколько часов до операции. Поиск сторожевых лимфатических узлов осуществляли с использованием гамма-камеры и портативного гамма-сканера. Авторы показали преимущества метода. Во-первых, можно определять расположение сторожевых лимфатических узлов непосредственно через кожу, в том числе и парастернальных. Во-вторых, при разрезе тканей можно в любой момент
контролировать локализацию узла и направление разреза. В-третьих, всегда можно удостовериться, что был удален действительно сторожевой лимфатический узел. В-четвертых, метод позволяет выявить остаточные лимфатическе узлы, накапливающие радиоактивный коллоид. Важным преимуществом метода является и то, что сторожевой лимфатический узел может быть удален через небольшой разрез, в отличие от использования красителя, когда нужно рассечь кожу и ткани, чтобы увидеть узел. И наконец, метод прост, легко и быстро выполним, а его чувствительность выше, чем методика с использованием красителя. Проведенные в последующем исследования показали, что наибольшая достоверность интраоперационной индикации сторожевых лимфатических узлов наблюдается при одновременном применении этих методов.
С 1993 г. стали появляться работы по применению красителя и радиоактивного коллоида при раке молочной железы, меланоме кожи, раке вульвы, полового члена, опухолях гортани, а также при раке желудка и толстой кишки.
Сторожевой лимфатический узел не обязательно является ближайшим к опухоли лимфатическим узлом. Проведенные исследования показывают, что нередко сторожевыми являются лимфатические узлы, расположенные на значительном расстоянии от опухоли. Так, D. Krag и соавт. установили, что в 11% случаев сторожевыми при раке молочной железы являются лимфатические узлы 2-3-го уровня без вовлечения узлов 1 уровня. При раке желудка метастатическое поражение лимфатических узлов 2-го уровня без вовлечения 1-го встречается в 1-13 % случаев.
К возможным неудачам при идентификации сторожевых лимфатических узлов относятся отсутствие возможности найти сторожевой узел и ложноотрицательный результат, при котором в сторожевом узле опухолевые клетки не выявляются, но при этом элементы опухоли находят в несторожевых лимфатических узлах. Поэтому с 1999 г. основное внимание исследователей посвящено двум вопросам: как успешнее найти сторожевой лимфатический узел и как избежать ложноотрицательных результатов. Существует 3 возможных объяснения получения ложноотрицательных результатов. Во-первых, это может быть следствием неточной идентификации сторожевых лимфатических узлов, удаления смежного, прилежащего несторожевого лимфатического узла и удаления 1 сторожевого лимфатического узла и более, но оставления других, содержащих метастазы. Во-вторых,
сторожевой лимфатический узел может быть обнаружен, но возможны ошибки при выявлении микрометастазов в ходе срочного гистологического исследования. Удаление такого лимфатического узла, но оставление других, с потенциально возможными микрометастазами, увеличивает риск регионарных рецидивов. В-третьих, правильно идентифицированные и по-настоящему негативные сторожевые лимфатические узлы могут быть удалены в такой стадии развития заболевания, когда опухолевые эмболы находятся между первичной опухолью и сторожевым лимфатическим узлом. При этом также увеличивается риск рецидива.
Следующий вопрос, возникающий при иссечении сторожевого лимфатического узла: «Насколько адекватно производится его срочное гистологическое исследование?» Именно неадекватностью срочного исследования главным образом обусловлены ложноотрицательные результаты (5-15 %) биопсий сторожевых лимфатических узлов. Метастаз может располагаться в любом месте лимфатического узла, и для его выявления явно недостаточно исследования 1-2 срезов со стандартным окрашиванием эозином и гематоксилином. Показано (J. Meyer), что для выявления метастаза размером 0,25 мм необходимо гистологическое исследование 8-10 срезов лимфатического узла.
Хотя при детальном исследовании лимфатических узлов, вначале считавшихся негативными, выявляют скрытые микрометастазы у 10-15 % пациентов, значение этих данных остается спорным. Самый большой отчет по исследованию частоты скрытых метастазов представлен Ludwig Breast Cancer Study Group (1990): приготовление большего количества срезов лимфатических узлов позволило выявить микрометастазы у 83 (9 %) из 921 пациентов.
На сегодняшний день применяются следующие основные виды морфологических исследований:
1) срочное морфологическое исследование сторожевых узлов (гистологическое, цитологическое, иммуногистохимическое);
2) плановое гистологическое исследование фиксированных в 10 % растворе формалина тканей с помощью окрашивания гематоксилином и эозином;
3) плановое иммуногистохимическое исследование срезов лимфатического узла с применением специфических антител;
4) плановое исследование с применением моноклональных антител.
Идеальной, с точки зрения практического онколога, является возможность использовать срочное морфологическое исследование удаленных лимфатических узлов с целью оптимизации объема выполняемого оперативного вмешательства. Однако абсолютное большинство исследователей, начиная с D. Morton, на значительном клиническом материале показывают, что частота ложноотрицательных заключений при выполнении срочного исследования замороженных срезов может достигать 60 %. Средняя чувствительность метода составляет, по разным источникам, от 33 до 38 %. Это отнюдь не является противопоказанием к выполнению данного исследования непосредственно во время операции, однако требует критической оценки.
Выполнение планового гистологического исследования фиксированных срезов с использованием окрашивания гематоксилином и эозином тканей лимфатического узла также должно выполняться по определенным правилам, чтобы получить максимально достоверную информацию о состоянии исследуемого материала. Выше мы приводили данные, полученные при дополнительном гистологическом исследовании лимфатических узлов у пациентов с полной лимфодиссекцией. Процент пропущенных лимфатических узлов, пораженных микрометастазами, достигал, по данным некоторых авторов, 22 %. В этой связи авторы методики поиска сторожевых лимфатических узлов рекомендуют серийное гистологическое исследование сторожевых лимфатических узлов. При этом производят срезы толщиной 4 мкм на расстоянии 500 мкм друг от друга (в среднем с 1 лимфатического узла получается 9-10 срезов). Препараты фиксируют 10 % раствором формалина и окрашивают гематоксилином и эозином. Эти же срезы подвергают иммуногистохимическому исследованию. Описывая найденные указанным способом метастазы в лимфатических узлах, G. Carlson выделяет следующие их типы по объему поражения: макрометастаз (>2 мм), микрометастаз (<2 мм), метастазы в виде групп клеток, расположенных в расширенных синусах (до 10-20 групп), метастазы в виде отдельных изолированных клеток, расположенных в синусах лимфатического узла (от 1 до 20 клеток). Изучив гистологическое строение 134 сторожевых и несторожевых лимфатических узлов, полученных у 104 больных с меланомой при полной лимфодиссекции, он пришел к выводу, что макрометастазы чаще выявляются в несторожевых лимфатических узлах, тогда как все прочие метастатические типы (микрометастазы) - в сторожевых
и составляют около 77 %. Для их адекватной диагностики автор рекомендует параллельное серийное гистологическое и иммуногистохимическое исследование. Сравнивая значимость обычного и серийного гистологических исследований сторожевых лимфатических узлов, автор приводит сведения о расхождениях в диагнозе при применении данных методик в клинических условиях, достигающих 14 и даже 20 % частоты.
В настоящее время методика гистологического изучения сторожевых лимфатических узлов является стандартной. Во время операции производят срочное гистологическое исследование половины удаленного лимфатического узла (либо пополам рассекаются все найденные лимфатические узлы), оставшуюся половину отсылают на плановое серийное исследование. Иммуногистохимическое исследование проводится, если при серийном гистологическом исследовании метастазов в лимфатических узлах не выявлено. В среднем выявляемость микрометастазов в сторожевых лимфатических узлах, по данным комплексных исследований, составляет от 10 до 17 %.
Принцип футлярности предполагает удаление опухоли в едином блоке со всеми анатомическими структурами фасциального футляра, в котором она находится. Соблюдение этого принципа особенно важно при удалении сарком мягких тканей, распространяющихся преимущественно вдоль фасций, которые выполняют функцию естественных барьеров для опухоли.
Паллиативные операции не удовлетворяют всем требованиям радикального удаления опухоли, после их выполнения в организме больного остаются неликвидированные очаги опухоли. Основной целью паллиативных операций являются предотвращение тяжелых осложнений опухолевого процесса (перфорации полого органа, стеноза его просвета, кровотечения из опухоли или магистральных сосудов) и улучшение качества жизни больного. В ряде случаев данный метод хирургического лечения сопровождается увеличением продолжительности жизни. Паллиативные операции могут быть циторедуктивными и симптоматическими.
Циторедуктивные операции обеспечивают относительно полную или частичную циторедукцию, что позволяет в дальнейшем проводить адъювантное лучевое или лекарственное лечение.
Симптоматические операции представляют собой хирургические вмешательства, при которых не предпринимаются попытки воздействовать на опухолевый процесс. Эти операции выполняют с целью
устранения того или иного ведущего патологического симптома, зачастую представляющего непосредственную угрозу жизни больного (непроходимость ЖКТ, кровотечение из опухоли и др.).
Развитие онкохирургии привело к переосмыслению проблемы паллиативных операций. Операция считается паллиативной, если резекция пораженных органов выполнена с оставлением части опухоли на соседних анатомических структурах, включая опухолевые клетки по линии резекции. Аналогичной оценке подлежит операция, при которой резекция первичного очага производится без удаления регионарных лимфогенных метастазов или при удалении первичной опухоли с отдаленными метастазами (вариант циторедуктивной операции).
С современных позиций основной смысл выполнения паллиативных вмешательств заключается в профилактике фатальных осложнений и улучшении качества жизни.
Кроме того, паллиативные операции с циторедуктивной целью на сегодняшний день являются неотъемлемой частью стратегии лечения распространенного колоректального рака и других опухолей, открывая перспективу для проведения дополнительного специализированного лечения, направленного на улучшение отдаленных результатов.
В последние годы при нерезектабельных опухолях пищевода и кардиоэзофагеальной зоны оправданным считается отказ от выполнения таких функционально и морально устаревших вмешательств, как гастростомия и еюностомия.
В зависимости от распространения опухоли по пищеводу и желудку для устранения основного симптома заболевания - дисфагии и восстановления естественного пассажа пищи по пищеварительному тракту целесообразно выполнение разработанных и широко применяющихся в клинике шунтирующих операций, значительно улучшающих качество жизни больных. Следует отметить, что, несмотря на деонтологическую привлекательность, обходные анастомозы можно применять только при условии надежности основного и самого сложного этапа вмешательства - формирования пищеводного соустья, поскольку главным условием выполнения шунтирующих операций является низкая послеоперационная летальность.
К одним из наиболее тяжелых осложнений метастатического поражения позвоночника относятся развитие компрессии спинного мозга и появление соответствующей неврологической симптоматики.
В ГУ РОНЦ им. Н.Н. Блохина РАМН разработана и внедрена серия паллиативных хирургических методик, позволяющих достоверно улучшить качество жизни данной категории больных, включая декомпрессивные вмешательства на разных уровнях позвоночника.
Также активно применяется малоинвазивный метод чрескожной вертебропластики.
Органосохраняющие операции
Радикальное хирургическое лечение злокачественных новообразований на ранних стадиях позволяет в большинстве случаев добиться прекрасных результатов. Кроме того, небольшой объем опухоли дает возможность применять менее агрессивный, чем стандартный хирургический подход, без ущерба для выживаемости. В связи с этим на фоне повышения интереса к вопросам сохранения и поддержания удовлетворительного качества жизни онкологических больных постепенно увеличивается доля органосохраняющих операций в хирургии опухолей молочной железы, мягких тканей и опорно-двигательного аппарата, опухолей почки и др.
В хирургии опухолей бронхов в настоящее время активно развиваются ангиобронхопластические операции с выполнением адекватного объема внутрилегочной и медиастинальной лимфодиссекции.
При этом не отмечено снижения выживаемости пациентов, по сравнению с показателем у больных, перенесших стандартные хирургические вмешательства.
В настоящее время разрабатываются методика и техника так называемых спленосохранных операций - гастрэктомии с выполнением полной диссекции ворот селезенки, которую мы считаем равноценной объему D2.
Предварительные результаты показывают, что спленосохранные операции улучшают непосредственные результаты лечения и качество жизни больных без ущерба онкологическому радикализму.
Прослеживается тенденция к снижению доли калечащих операций, выполняемых при опухолях костей и мягких тканей.
Одно из наиболее перспективных направлений данного раздела онкохирургии - разработка технологии широкой резекции и удаления en bloc местно-распространенных опухолей костей и мягких тканей с последующей пластикой магистральных сосудов, нервных стволов и замещением дефекта протезами костей и (или) мягкоткаными лоскутами на микрососудистых анастомозах.
Для выполнения подобных операций необходимы индивидуально подобранные расходные материалы (протезы), специальное оборудование (операционный микроскоп, микрохирургические инструменты) и владение микрохирургической техникой. Выживаемость пациентов после хирургического лечения данного объема не уступает таковой в группе больных, перенесших калечащее лечение, при несоизмеримо лучшем качестве жизни.
Интересным направлением органосохраняющего лечения в онкологии является экстракорпоральная резекция органов. Лечение больных двусторонним раком почки, а также пациентов с единственной функционирующей почкой или заболеванием контралатеральной почки остается серьезной проблемой. Как правило, на стороне большего поражения выполняется нефрэктомия. Однако при наличии нескольких опухолевых узлов или центральной локализации опухоли возможности органосохраняющего хирургического лечения на контралатеральной стороне могут быть резко ограничены. У данной категории пациентов единственным вариантом лечения, позволяющим избежать выполнения двусторонней нефрэктомии с последующим проведением программного гемодиализа, является методика экстракорпоральной резекции почки.
Данный метод подразумевает выполнение нефрэктомии с последующей резекцией почки в условиях холодовой ишемии и ее гетеротопическую аутотрансплантацию в контралатеральную подвздошную область. Непосредственные, отдаленные и функциональные результаты при сроках наблюдения от 10 до 27 мес удовлетворительные.
Экстракорпоральную резекцию печени - процедуру технически и методологически более сложную, выполняют при множественных билобарных метастазах карциноидных и некоторых других опухолей. Разработана также методика так называемых ex-situ резекций печени, когда печень мобилизуется в кавальных воротах без пересечения элементов гепатодуоденальной связки.
Важным направлением онкохирургии является удаление опухолей брюшной полости и забрюшинного пространства с резекцией и протезированием магистральных сосудов. Нами накоплен опыт оперативных вмешательств в объеме удаления опухоли с резекцией и протезированием нижней полой вены (НПВ), удаления опухоли с протезированием инфраренального отдела аорты, комбинированных операций с протезированием подвздошных сосудов. С хорошими отдаленными результатами проводятся операции по поводу
местно-распространенного рака поджелудочной железы в объеме гастропанкреатодуоденальной резекции с пластикой верхней брыжеечной вены.
Довольно распространенным показанием к аналогичным операциям является рак почки, осложнившийся развитием опухолевого тромба, распространяющегося по просвету почечной вены и НПВ вплоть до правых отделов сердца (4-10 % случаев).
Хирургическое удаление опухолевого тромба с пораженной почкой является единственным методом лечения, дающим шанс на выздоровление и продление жизни большинству больных. Наибольшую техническую сложность представляет удаление наддиафрагмальных тромбов.
При больших размерах внутрипредсердного компонента опухоли и ее фиксации к интиме резекция НПВ и тромбэктомия выполняются с использованием кардиопульмонального шунтирования, которое, снижая риск эмболических осложнений, значительно увеличивает объем и травматичность операции, повышает риск коагулопатических кровотечений из-за системной гепаринизации.
С целью снижения частоты осложнений, ассоциированных с применением искусственного кровообращения (ИК), нами разработан трансдиафрагмальный доступ к внутриперикардиальному отделу НПВ, позволяющий быстро и безопасно удалять флоттирующие опухолевые тромбы из правого предсердия; 5-летняя выживаемость пациентов без отдаленных метастазов после радикальной нефрэктомии с тромбэктомией составляет 47-64 %.
Ранее врастание опухолевых масс в стенку НПВ на значительном протяжении, не позволяющее выполнить ее резекцию с сохранением просвета сосуда, являлось абсолютным противопоказанием к операции. В РОНЦ им. Н.Н. Блохина РАМН разработана и внедрена в клиническую практику методика нефрэктомии, тромбэктомии, кавэктомии, предлагающая удаление почки единым блоком с опухолевым тромбом и отделом НПВ, проращенным опухолью, и позволяющая излечивать данную категорию пациентов.
При опухолях правой почки возможно удаление всей НПВ, включая зону устья левой почечной вены, так как отток от левой почки может осуществляться по яичковой (яичниковой) и надпочечниковой венам. При опухолях левой почки резекция области устья правой почечной вены невозможна в связи с отсутствием у последней венозных коллатералей.
Непосредственные и ближайшие результаты кавэктомии удовлетворительные. В случае исходно сохраненного кровотока по НПВ, а также при недостаточно развитых венозных коллатералях оправдано выполнение кавэктомии с последующим протезированием НПВ. Хирургическое вмешательство данного объема выполнено в Центре трем пациентам; непосредственные и ближайшие результаты удовлетворительные.
В ряде случаев циркулярная резекция НПВ и (или) аорты с протезированием требуется при выполнении забрюшинной лимфаденэктомии после индукционной химиотерапии при раке яичка с ретроперитонеальными метастазами, а также первичных и рецидивных неорганных забрюшинных опухолях.
Расширенные хирургические пособия позволили улучшить онкологические результаты лечения этой категории больных, которые еще недавно считались неоперабельными. Таким образом, хирургическое вмешательство - один из наиболее эффективных методов лечения злокачественных новообразований.
Залогом достижения удовлетворительных результатов является рациональное определение показаний, сроков и объема операции, основанное на правильной верификации диагноза и адекватном стадировании опухолевого процесса, а также соблюдении основных принципов онкохирургии, к которым относятся:
1) онкологическая адекватность: мобилизация «острым путем» по принципу «от сосуда к пораженному органу», правильная последовательность мобилизации с целью профилактики интраоперационной диссеминации опухолевых клеток, профилактический принцип моноблочной лимфодиссекции;
2) максимальная безопасность: правильный выбор оперативного доступа и объема хирургического вмешательства, рациональные приемы мобилизации и обработки смежных органов, формирование надежных анастомозов;
3) высокая функциональность: выбор рационального метода пластики, формирование технически простых антирефлюксных анастомозов.
Внедрение новых хирургических технологий (рис. 7.1-7.7), с одной стороны, позволило расширить спектр показаний к выполнению органосохраняющих вмешательств в онкологии, с другой - увеличить долю радикальных операций при местно-распространенных и метастатических злокачественных новообразованиях,

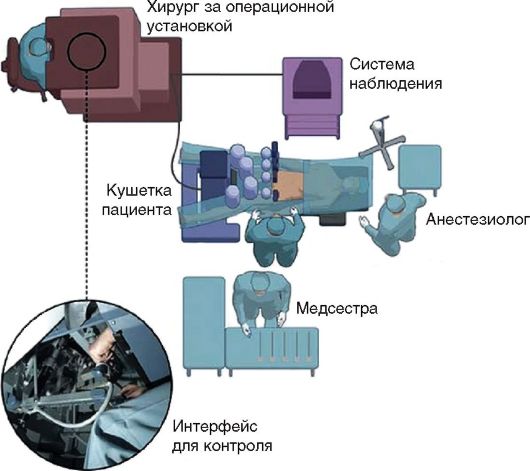 Рис. 7.2. Принцип работы роботизированной хирургической установки
Рис. 7.2. Принцип работы роботизированной хирургической установки
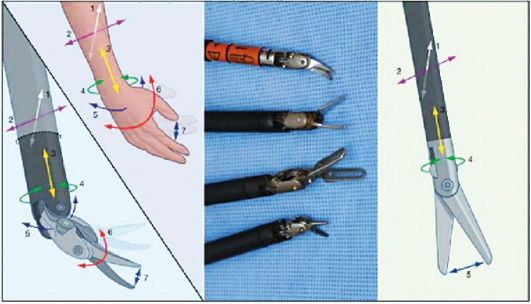 Рис. 7.3. Инструменты роботизированной хирургической установки
Рис. 7.3. Инструменты роботизированной хирургической установки
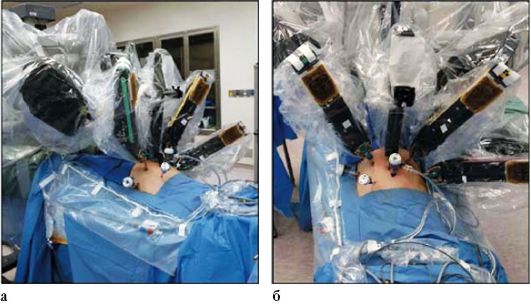 Рис. 7.4. Роботизированная хирургическая установка выполняет оперативное вмешательство (а, б)
Рис. 7.4. Роботизированная хирургическая установка выполняет оперативное вмешательство (а, б)
ранее считавшихся неоперабельными. Разработка новых реконструктивных методов, а также оперативных подходов к паллиативной помощи больным с распространенными опухолями дала возможность существенно улучшить качество жизни данной категории пациентов.
Важный этап в обеспечении хороших послеоперационных результатов - скоординированная работа мультидисциплинарной бригады высококлассных специалистов (рис. 7.8), включающей
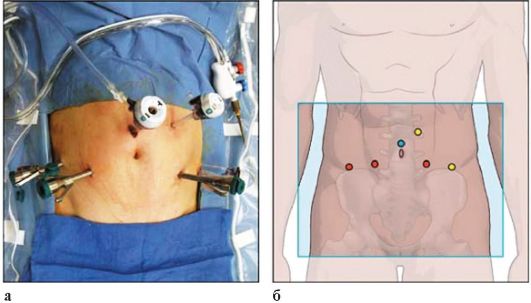 Рис. 7.5. Доступы при выполнения оперативных вмешательств с помощью роботизированной хирургической установки (а, б)
Рис. 7.5. Доступы при выполнения оперативных вмешательств с помощью роботизированной хирургической установки (а, б)
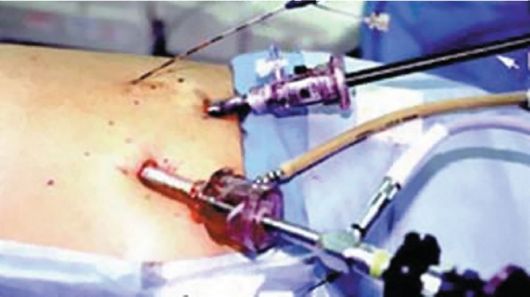 Рис. 7.6. Лапароскопическая операция
Рис. 7.6. Лапароскопическая операция
анестезиолога, хирурга и реаниматолога. Кроме того, лечение половины больных со злокачественными новообразованиями требует комплексного подхода с привлечением специалистов в области системной цитотоксической и лучевой терапии. Таким образом, адекватное современное лечение онкологических больных возможно только в крупных специализированных центрах и не должно осуществляться в клиниках общего профиля.
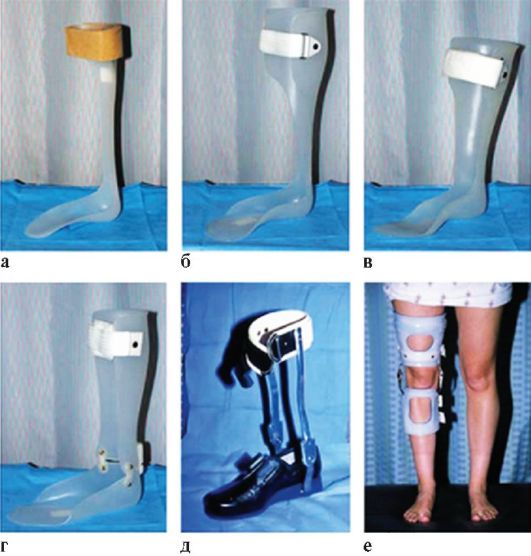 Рис. 7.7. Современные протезы (а-е)
Рис. 7.7. Современные протезы (а-е)
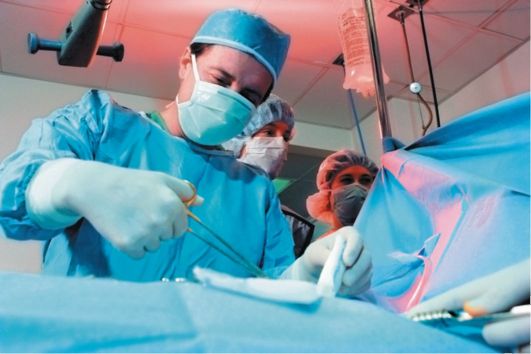 Рис. 7.8. Хирургическая бригада выполняет операцию по поводу колоректального рака
Рис. 7.8. Хирургическая бригада выполняет операцию по поводу колоректального рака
ЛУЧЕВАЯ ТЕРАПИЯ
Лучевая терапия представляет собой прикладную медицинскую дисциплину, в основе которой лежит использование различных видов ионизирующего излучения. Лучевую терапию применяют как самостоятельный метод или в составе комбинированного и комплексного лечения (в сочетании с хирургическим или лекарственным). За последние десятилетия она претерпела существенные изменения, позволившие значительно расширить показания и улучшить результаты ее применения. В настоящее время лучевой терапии подвергается 60-70 % всех онкологических больных. При правильном назначении и проведении облучение приводит к стойкому излечению почти половины пациентов.
Строение атома и радиоактивность
Ядро атома состоит из протонов и нейтронов, которые удерживаются силами ядерного взаимодействия. Атомный номер отражает число протонов в ядре и постоянен для каждого элемента и всех его изотопов. Массовое число равно сумме протонов и нейтронов. Большинство элементов характеризуется устойчивым состоянием ядра. При неустойчивом соотношении протонов и нейтронов образуются радиоактивные элементы.
Каждому радиоактивному изотопу присущи такие особые характеристики, как период полураспада (Т1/2) и радиоактивное излучение. Т1/2 - это время, в течение которого происходит распад половины радиоактивных атомов. Большинство изотопов распадаются быстро, поэтому в природе практически не встречаются (исключение составляют такие элементы, как радий, торий, свинец и уран). Большая часть радиоактивных изотопов, используемых в медицине, создается искусственно на реакторах или циклотроне.
Виды ионизирующих излучений
Ионизирующим называется излучение, приводящее при взаимодействии с веществом к появлению зарядов разных знаков. В современной лучевой терапии применяют разнообразные виды излучений, различающихся по биологическому воздействию, проникающей способности и распределению энергии в пучке излучения. В клинической практике применяют фотонное и корпускулярное ионизирующее излучение.
Фотонное излучение представляет собой электромагнитные колебания, характеризующиеся различной частотой и длиной волны. К нему относятся:
1) γ-излучение (электромагнитное излучение естественных или искусственно получаемых радионуклидов, способное проникать на глубину 1 м и более);
2) рентгеновское излучение (электромагнитное излучение, образующееся при переходе электронов между орбитами внутри ядра, которое получают с помощью рентгеновских аппаратов);
3) тормозное излучение (электромагнитное излучение, получаемое с помощью ускорителей электронов при энергиях, достигающих десятков мегаэлектронвольт - МэВ);
Корпускулярное излучение представляет собой поток ядерных частиц. К этому виду ионизирующего излучения относятся:
1) β-излучение (корпускулярное излучение потока отрицательно заряженных электронов, способного проникать в ткани на глубину от нескольких миллиметров до 1 см);
2) позитронное излучение (корпускулярное излучение потока положительно заряженных частиц, равных по массе электронам). Позитроны также могут проникать в ткани на глубину до нескольких миллиметров;
3) α-частицы (корпускулярное излучение ядер атомов гелия, состоящих из двух нейтронов и двух протонов и способных распространяться в тканях на глубину 10-20 клеток).
Радиотерапевтическая аппаратура
К основным источникам ионизирующего излучения относятся:
• радиоактивные вещества (естественные или искусственно получаемые радионуклиды);
• специальные электрофизические аппараты (рентгеновские аппараты, ускорители электронов и протонов, генераторы нейтронов).
Для дистанционного облучения применяют рентгеновские аппараты (с энергией 60-100 кэВ), гамма-аппараты «Агат» и «Рокус» (в том числе автоматизированные; рис. 7.9). Аппараты имеют радиационную головку, которая может вращаться вокруг больного, что облегчает его укладку и центрацию пучка излучения. Радиационная головка снабжена коллиматором для регулирования поля облучения. Дальнодистанционное тормозное и электронное облучение осуществляется с помощью линейных ускорителей электронов
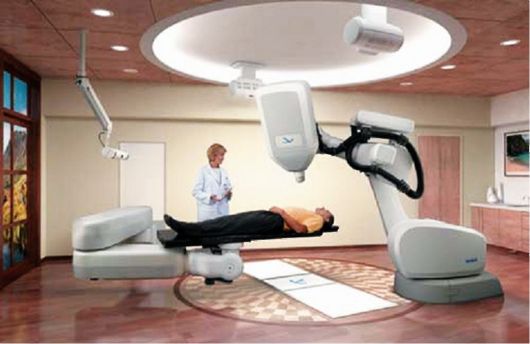 Рис. 7.9. Гамма-терапевтический аппарат «Рокус-1»
Рис. 7.9. Гамма-терапевтический аппарат «Рокус-1»
и циклотронов (бетатроны, микротроны). Электронное излучение с энергией 20-30 МэВ имеет преимущество по сравнению с рентгеновским при облучении поверхностных очагов.
Наиболее распространенным источником как дистанционного, так и контактного облучения является радиоактивный изотоп кобальта (60Co), период полураспада которого составляет 5,24 года. Помимо него, для контактных методов лучевой терапии используются радиоактивные изотопы цезия (137Cs), иридия (192Ir), золота (198Au), свинца (32P), иода (132I) и др. Выделяют закрытые и открытые источники контактного облучения. Закрытые радиоактивные источники (60Со, 137Cs, 192Ir, 198Au), имеющие вид проволоки, игл, шариков, вводят в полости или ткани непосредственно или через проводники. Открытые источники (32P, 132I, 198Au) вводят в организм больного в виде водных или коллоидных растворов per os, внутривенно или интратуморально.
Способы облучения
В настоящее время облучение проводится двумя основными способами.
1. Дистанционное облучение, при котором источники излучения находятся на расстоянии 80-100 см от больного. К дистанционному облучению относятся рентгенотерапия, гамма-терапия, протонная и нейтронная терапия, а также облучение быстрыми электронами.
2. Контактное облучение (брахитерапия), при котором источники излучения находятся в непосредственной близости от больного (на расстоянии, не превышающем 30 см) или контактируют
с опухолью. При контактном облучении относительно высокая доза может быть доставлена к ограниченному объему пораженной ткани. Поскольку энергия излучения обратно пропорциональна расстоянию от источника до мишени, то неизмененные (нормальные) ткани, окружающие опухоль, облучаются в меньшей степени. Процедуры брахитерапии, как правило, выполняют с использованием местной или общей анестезии. С помощью автоматизированных аппаратов источники излучения дистанционным методом доставляются в эндостаты, предварительно расположенные внутри организма больного. Ручное введение источников, сопровождающееся высокой лучевой нагрузкой на медицинский персонал, в настоящее время практически не применяется. Оптимальные дозы облучения составляют в среднем 50-60 сГр/ч, длительность лечения - 1-3 дня. К основным видам контактного облучения относятся:
а) внутриполостное, при котором источники излучения вводят в естественные (полость рта, мочевого пузыря, матки или влагалища, прямой кишки, пищевода) или искусственные (послеоперационная рана) полости;
б) внутритканевое (или интерстициальное), при котором закрытые или открытые источники излучения помещаются через специальный катетер в опухоль. Наиболее часто интерстициальная брахитерапия с радиоактивным 137Cs применяется в лечении злокачественных новообразований головы и шеи, а также сарком мягких тканей;
в) аппликационное, при котором источники излучения (β-аппликаторы, содержащие 90Sr и 90Y, γ-аппликаторы, содержащие 60Co) помещают на поверхность тела больного;
г) внутреннее (или системное), при котором открытые радионуклиды (например, 131I, 198Au) вводят внутривенно или перорально.
Совместное применение дистанционного и контактного методов облучения называется сочетанной лучевой терапией.
Взаимодействие ионизирующего излучения с веществом
При воздействии радиоактивного излучения на ткани часть энергии поглощается. Биофизическое воздействие на клетки и ткани поглощенного излучения заключается в ионизации и возбуждении атомов и молекул. Этот процесс, занимающий доли секунды, одинаков для всех видов ионизирующего излучения. Образующиеся при облучении короткоживущие (доли секунды) свободные радикалы
имеют очень короткий пробег в тканях (10 нм). Это означает, что любое повреждение клеток происходит очень быстро и в ограниченном пространстве. Несмотря на почти мгновенное действие облучения, биологические эффекты могут быть отсрочены на дни, месяцы и даже десятилетия (мутагенный и канцерогенный эффекты).
Для определения количества радионуклида и силы его воздействия на ткани используют следующие понятия:
• экспозиционная доза (Х), характеризующая энергию фотонного излучения, затраченную на ионизацию массы сухого воздуха (измеряется в рентгенах);
• поглощенная доза (D), характеризующая количество энергии, переданной облучаемому объекту, приходящейся на единицу его массы. В современной медицинской радиологии единицей поглощенной дозы является 1 Грей (Гр). При поглощении дозы 1 Гр облучаемому веществу массой 1 кг передается энергия, равная 1 Дж. Мощность поглощенной дозы соотнесена с единицей времени (1 Гр/с). Для измерения поглощенной дозы используется и внесистемная единица - рад (1 Гр = 100 рад).
Дозиметрическая аппаратура
Для измерения дозиметрических показателей ионизирующего излучения применяется специальная аппаратура. В течение последних десятилетий контроль доз осуществлялся с помощью дозиметров, регистрирующих электрические заряды, возникающие в облучаемой среде (ионизационный метод). Разработаны детекторы, основанные на полупроводниковом, термолюминесцентном, фотографическом методах.
Планирование облучения
Планирование облучения больного заключается в выборе источника излучения, метода и параметров облучения, т.е. его дозы, мощности и длительности. Для этого, помимо данных об источниках излучения и радиотерапевтической аппаратуре, необходимо получить топометрическую информацию о подлежащей облучению области тела больного. Она представляется в виде топометрических карт в плоскостях сечения тела больного, на которых изображают контуры тела, всех органов и структур.
После выбора способа облучения и вида излучения определяют метод (статический, подвижный, однопольный, многопольный и т.д.). Для правильного подбора доз используют атласы, в которых
собраны карты изодоз в зависимости от программ облучения. В последние годы для более точного расчета распределения поглощенных доз в теле больного при различных видах лучевого воздействия, а также для планирования заданного распределения дозы используется компьютерная техника.
Непременным условием грамотного и безопасного облучения является подведение точной дозы ионизирующего излучения к опухолевому очагу в сочетании с минимальным повреждением и сохранением жизнеспособности окружающих структур. От регенераторной способности нормальных тканей и органов, входящих в поле облучения, зависят исход лучевого лечения и возникновение осложнений. Выделяют понятие толерантной дозы, при которой частота поздних осложнений не превышает 5 % в течение 5 лет наблюдения. Различные органы и ткани характеризуются разной величиной предельной толерантной дозы (например, 60 Гр - для соединительной ткани). Чем меньше суммарная поглощенная доза излучения превышает толерантную, тем реже наблюдаются лучевые повреждения. Для уменьшения риска развития осложнений суммарная доза подводится небольшими фракциями в течение определенного периода времени.
Стандартные величины фракций (или разовых доз) составляют от 1,8 до 2 Гр 5 раз в неделю до достижения суммарной очаговой дозы (от 25 до 70-100 Гр). Помимо обычного режима применяют мультифракционирование (дневное дробление дозы на несколько фракций, подводимых с интервалом 4-8-12 ч).
Биологические предпосылки использования ионизирующего излучения для лечения опухолей
В основе гибели клеток в результате облучения лежит повреждение ДНК с последующим прерыванием репликации (репродуктивная или митотическая гибель). Выраженность клинических проявлений этого процесса зависит от скорости регенерации и дифференцировки клеток. Репарация сублетальных и нелетальных повреждений клеток начинается уже через несколько часов после облучения, однако полного восстановления клеточных структур, по-видимому, не происходит. Гибель клеток при облучении носит произвольный характер. При непрерывном подведении постоянной дозы излучения происходит летальное повреждение постоянной доли облучаемых клеток. Степень уменьшения объема опухоли определяется не только гибелью клеток, но и скоростью их пролиферации.
Второй путь реализации действия ионизирующего излучения - непрямое действие на клетки через ионизацию, главным образом в результате радиолиза воды. Свободные радикалы оказывают повреждающее воздействие на клетку, вызывая нарушение метаболизма и развитие некробиотических процессов.
Радиобиологический эффект напрямую зависит от концентрации кислорода в тканях («кислородный эффект»). Неполноценное кровоснабжение опухолевой ткани, приводящее к ее гипоксии, является одной из причин резистентности к ионизирующему излучению. При облучении опухоли в большей мере погибают хорошо оксигенированные клетки, расположенные вблизи от капилляров. По мере удаления погибших клеток приток кислорода увеличивается, т.е. происходит реоксигенация опухоли. Наиболее эффективная реоксигенация достигается при длительном (в течение 6-7 нед) облучении в режиме 30-35 фракций по 2 Гр.
Помимо этого облучение вызывает апоптоз, т.е. запрограммированный процесс смерти клеток в результате генетических повреждений, и гибель клеток в интерфазе (в периоды G0- и 01-клеточного цикла). Радиочувствительность - это мера восприимчивости клеток к повреждающему действию ионизирующего излучения. Она зависит от периода клеточного цикла и достигает максимума в G2- и M-фазы. По этой причине быстро пролиферирующие опухолевые клетки, а также кроветворная ткань, эпителий тонкой кишки, кожи и гонад обладают наибольшей чувствительностью к облучению. Этот биологический феномен лежит в основе режима фракционирования, который позволяет при подведении последующей дозы облучения застать выжившие клетки опухоли, перешедшие в постсинтетический и митотический периоды клеточного цикла. На степень радиочувствительности влияют степень дифференцировки клеточных элементов, соотношение стромы и паренхимы, кровоснабжение и размер опухоли, ее локализация, наличие сопутствующего воспалительного процесса.
Злокачественные опухоли характеризуются различной радиочувствительностью. Так, высокой степенью радиочувствительности обладают лимфомы, эмбриональные опухоли (семиномы), мелкоклеточный и низкодифференцированный рак. Относительно высокая радиочувствительность свойственна плоскоклеточному раку гортани, глотки, мочевого пузыря, кожи, шейки матки, железистому раку пищеварительного тракта, средняя - железистому раку тела
матки, молочной железы и бронхов. И наконец, низкая степень радиочувствительности отличает железистый рак слюнной железы, почки, печени, желудка, поджелудочной железы, саркомы костей и мягких тканей и меланому кожи.
Радиоустойчивость, или радиорезистентность, - это характеристика, противоположная радиочувствительности. Наибольшей радиорезистентностью обладают клетки, находящиеся в синтетической (или S-) фазе клеточного цикла (например, клетки эндотелия, поперечно-полосатой и гладкой мускулатуры, соединительной и нервной ткани).
Радиомодификация
Для повышения эффективности лучевой терапии применяют различные способы модификации радиочувствительности тканей с помощью радиомодифицирующих агентов. Последние представляют собой физические и химические факторы, способные изменять (ослаблять или усиливать) радиочувствительность клеток и тканей. Радиомодификация, т.е. управление лучевыми реакциями, применяется также с целью противолучевой защиты нормальных тканей.
К основным способам радиомодификации относятся оксигенотерапия, оксигенобаротерапия (облучение в условиях гипербарической оксигенации), гипоксирадиотерапия (перевод больного на время проведения сеанса лучевой терапии на дыхание гипоксической газовой смесью), гипертермия опухоли, применение цитостатиков (5-ФУ, цисплатин). Цитостатики (так называемые радиосенсибилизаторы) реализуют синхронизирующий эффект, задерживая деление опухолевых клеток в определенных фазах цикла. В результате большее число клеток опухоли находится в наиболее радиочувствительных фазах митоза и премитоза, что значительно повышает эффективность лучевой терапии.
Клиническое применение лучевой терапии
В современной онкологической практике лучевую терапию применяют в качестве самостоятельного метода при радиочувствительных опухолях и значительно чаще как компонент комбинированного и комплексного лечения (в сочетании с хирургическим и лекарственным). При этом облучение, являясь регионарным методом лечения, способствует прежде всего улучшению результатов локального противоопухолевого воздействия.
КОМБИНАЦИЯ ЛУЧЕВОЙ ТЕРАПИИ И ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
Как компонент комбинированного метода лучевая терапия позволяет расширить показания к радикальному лечению местно-распространенных опухолей, повысить резектабельность, уменьшить частоту развития местных рецидивов. Выделяют пред-, интра- и послеоперационное облучение.
Предоперационная лучевая терапия применяется с целью разрушения наиболее радиочувствительных клеток или понижения их жизнеспособности, уменьшения опасности интраоперационного метастазирования и увеличения операбельности. Оптимальная очаговая доза должна быть достаточной для того, чтобы вызвать гибель большей части опухолевых клеток, и в то же время она не должна нарушать процессы заживления послеоперационной раны.
В настоящее время используются 2 основные методики предоперационного облучения:
1) ежедневное облучение первичной опухоли и регионарных зон по 2 Гр до суммарной очаговой дозы 40-45 Гр в течение 4-5 нед лечения. Операцию выполняют через 2-3 нед;
2) ежедневное облучение в режиме крупного фракционирования по 4-5 Гр в течение 1 нед до суммарной дозы 20-25 Гр. Оперативное вмешательство производят не позднее 72 ч после ее окончания.
Интраоперационная лучевая терапия представляет собой дистанционное или внутритканевое облучение опухоли или ее ложа с целью снижения частоты местных рецидивов. Проводится с использованием быстрых электронов до суммарной дозы 15-30 Гр.
Послеоперационная лучевая терапия применяется для уменьшения риска возникновения локального рецидива, особенно после выполнения нерадикального оперативного вмешательства. Потенциальная эффективность послеоперационного облучения ниже, поскольку оно проводится в условиях нарушенного кровоснабжения и местного воспаления. Осуществляется в режиме классического фракционирования не ранее чем через 2-3 нед после хирургического этапа лечения. На область удаленной опухоли подводят высокие (до 50-60 Гр) дозы, на зоны регионарного метастазирования - до 45-50 Гр.
КОМБИНАЦИЯ ЛУЧЕВОЙ И ЛЕКАРСТВЕННОЙ ТЕРАПИИ
Дозы и методика облучения зависят от чувствительности опухоли к ионизирующему излучению, цитостатикам и гормональным препаратам.
Так, при комплексном лечении больных раком молочной железы, бронхов, органов головы и шеи облучение первичной опухоли и зон регионарного метастазирования проводится в высоких (канцерицидных) дозах (55-60 Гр).
При лечении злокачественных опухолей, высокочувствительных к лекарственной терапии (например, герминогенные опухоли яичка, лимфопролиферативные заболевания), облучение играет роль вспомогательного метода. Дозы ионизирующего излучения, как правило, уменьшают на 1/3 (до 30-45 Гр).
Сочетанное применение лекарственной и лучевой терапии зачастую сопровождается увеличением частоты и тяжести побочных реакций. С целью снижения риска осложнений облучение проводят в классическом режиме фракционирования (по 1,8-2 Гр 5 раз в неделю), избегая крупных (4-5 Гр) фракций.
Типы лучевой терапии
1. Радикальная лучевая терапия имеет целью излечение больного и направлена на полное разрушение опухоли и ее регионарных метастазов. Она включает облучение первичного опухолевого очага (в максимальных дозах, достигающих 60-80 Гр) и зон регионарного метастазирования (до 40-50 Гр). С радикальными целями используют наружное или сочетанное облучение, т.е. дополненное внутриполостным или внутритканевым.
Радикальная лучевая терапия часто является основным методом лечения злокачественных опухолей сетчатки и сосудистой оболочки глаза, краниофарингиомы, медуллобластомы, эпендимомы, рака кожи, полости рта, языка, глотки, гортани, пищевода, шейки матки, влагалища, предстательной железы, а также ранних стадий лимфомы Ходжкина и семином. При лечении больных со злокачественными новообразованиями органов головы и шеи, раком молочной железы, легких, пищевода, мочевого пузыря, прямой кишки, костей радикальную лучевую терапию назначают в сочетании с хирургическим лечением или химиотерапией.
2. Паллиативная лучевая терапия подавляет рост опухоли и уменьшает ее объем, что позволяет облегчить состояние больных, улучшить качество их жизни, а в ряде случаев и увеличить ее продолжительность. Используемый для паллиативной лучевой терапии диапазон доз, как правило, не превышает 40-50 Гр. Частичное разрушение опухолевой массы сопровождается уменьшением интенсивности болевого синдрома и риска патологических переломов при метастатическом поражении костей, устранением неврологической симптоматики при метастазах в головном мозгу, восстановлением проходимости пищевода или бронхов при их обструкции, сохранением зрения при первичных или метастатических опухолях глаза и глазницы и т.п.
3. Симптоматическая лучевая терапия, в отличие от паллиативной, проводится не с целью уменьшения объема опухоли, а только для устранения тяжелых симптомов распространенного злокачественного процесса, таких, как интенсивные боли при метастазах в костях, компрессионно-ишемическая радикуло- и миелопатия, центральная неврологическая симптоматика при метастатическом поражении головного мозга. Как правило, симптоматическую лучевую терапию назначают короткими курсами в дозах, не превышающих 20-30 Гр, что позволяет быстро купировать тягостную симптоматику заболевания.
Лучевые реакции и осложнения
Частота и тяжесть лучевых повреждений в первую очередь зависят от суммарной поглощенной дозы излучения. В результате повреждающего действия ионизирующего излучения в облученных тканях развиваются дегенеративные и деструктивные (вплоть до острого некроза) процессы, нарушается микроциркуляция. Замедление процессов репарации и гипоксия приводят к воспалению, замещению клеток органов и тканей соединительной тканью (склерозирование). Особенностями лучевого повреждения являются прогрессирование морфологических изменений, переход в хроническую форму, в тяжелых случаях - малигнизация. Профилактикой служат правильное планирование лучевой терапии, применение современных методик, выбор адекватных режимов фракционирования и суммарных очаговых доз.
Лучевые повреждения условно разделяют по времени возникновения на:
а) ранние, обусловленные гибелью быстро делящихся клеток организма больного; развиваются в процессе облучения или
в течение 3 мес после него. Основными механизмами их развития являются сублетальное повреждение генетического аппарата клеток и функциональные нарушения; б) поздние, вызванные лучевым поражением медленно пролиферирующих клеток: развиваются спустя месяцы и годы после завершения лучевой терапии и имеют необратимый характер, поскольку в основе их развития лежат морфологические повреждения кровеносных и лимфатических сосудов.
Выделяются 4 степени выраженности лучевых повреждений - от легкой до очень тяжелой.
Лучевые повреждения со стороны разных органов и систем:
• кожи и слизистых оболочек - гиперемия, эритема, шелушение, эпидермит, изъязвление, алопеция, атрофический дерматит;
• органов дыхания - охриплость голоса, кашель, боли в горле, одышка, пневмонит, пневмофиброз, дыхательная недостаточность;
• пищеварительной системы - анорексия, тошнота, рвота, боли в животе, печеночная недостаточность, атония кишечника, кишечная непроходимость, язвенный ректит, стеноз, свищи;
• мочеполовой системы - дизурия, гематурия, эрозивно-язвенный цистит, кольпит, сморщенный мочевой пузырь, свищи, почечная недостаточность;
• сердечно-сосудистой системы - изменения на ЭКГ, аритмии, стенокардия, перикардит, сердечная недостаточность;
• нервной системы - головная боль, парестезии, парез, паралич, кома;
• системы кроветворения - тромбоцитопения, нейтропения, анемия.
ХИМИОТЕРАПИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Модели и методы для изучения
противоопухолевой активности различных соединений
Изучение новых лекарственных препаратов невозможно без постановки экспериментов, однако их проведение на человеке недопустимо. В экспериментальной онкологии используются многочисленные модели опухолей животных, которые в той или иной степени подобны опухолям человека. Полученные данные с учетом особенностей
моделей переносят в клиническую практику, где они подвергаются корректировке или отвергаются вовсе.
Спонтанные опухоли обнаруживают у животных, не подвергшихся каким-либо воздействиям со стороны экспериментатора. Классическими объектами являются мыши, крысы, кролики, домашние куры, обезьяны. Эти модели привлекают исследователей легкостью наблюдения, возможностью измерения и получения штаммов перевиваемых опухолей.
Перевиваемые опухоли позволяют получить более воспроизводимые и статистически достоверные результаты на меньшем числе животных. Трансплантация любой спонтанной или индуцированной опухоли в пределах одной линии лабораторных животных (например, мышей) всегда успешна. Перевиваемый штамм, т.е. опухоль, сохраняющую свои свойства при последующих перевивках, можно подвергнуть замораживанию и длительному хранению в жидком азоте. В онкологических центрах и лабораториях существуют банки, где хранятся сотни перевиваемых штаммов опухолей, в том числе метастазирующих и обладающих лекарственной устойчивостью. Все цитостатики, применяющиеся в настоящее время в онкологической практике, были испытаны и проявили противоопухолевую активность в отношении тех или иных перевиваемых опухолей животных.
Принципы лекарственного лечения
Эффективное применение противоопухолевых цитостатиков основывается на понимании принципов кинетики опухолевого роста, основных фармакологических механизмов действия лекарственных средств, фармакокинетики и фармакодинамики, механизмов лекарственной резистентности. Последние научные достижения в области молекулярной онкологии позволяют идентифицировать большое количество потенциальных мишеней для новых противоопухолевых агентов.
Биологическое поведение опухолей и их ответ на лекарственную терапию определяются индивидуальным потенциалом клеток к пролиферации. Опухолевые клетки можно разделить на 3 основные популяции:
1) клетки, завершившие деление и дифференцировку;
2) клетки, продолжающие деление;
3) неделящиеся клетки, находящиеся в состоянии покоя, но способные вступить в клеточный цикл. Клеточный цикл состоит
из четырех последовательных фаз, в течение которых клетка готовится к митозу и проходит его. Прохождение клетки через фазы клеточного цикла регулируется специфическими сигнальными белками. Ряд противоопухолевых агентов обеспечивают реализацию цитотоксического эффекта в строго специфических фазах клеточного цикла. Лекарственное противоопухолевое лечение включает химиотерапию (использование цитостатиков), гормонотерапию и биотерапию. Классификация противоопухолевых цитостатиков в зависимости от механизма действия:
1) алкилирующие агенты;
2) антиметаболиты;
3) противоопухолевые антибиотики;
4) антимитогенные препараты;
5) ингибиторы ДНК-топоизомераз I и II.
Алкилирующие агенты реализуют противоопухолевый эффект в отношении пролиферирующих опухолевых клеток независимо от периода клеточного цикла (т.е. не являются фазоспецифичными). Препараты этой группы повреждают макромолекулы (ДНК, РНК) путем реакции алкилирования, т.е. замещения атома водорода на алкильную группу. В результате образуются поперечные сшивки и разрывы ДНК, нарушающие процесс репликации, появляются дефектные нуклеотиды, возникают мутации и гибель клеток. При неизменной дозе цитостатика доля поврежденных клеток является постоянной. Помимо цитотоксического эффекта, алкилирующие средства оказывают мутагенное, канцерогенное и тератогенное действие. К препаратам этой группы относятся производные хлорэтиламинов (мелфалан, циклофосфамид, ифосфамид) и этилениминов (тиотепа, альтретамин, имифос), эфиры дисульфоновых кислот (бусульфан), производные нитрозометилмочевины (кармустин, ломустин, стрептозоцин), комплексные соединения платины (цисплатин, карбоплатин, оксалиплатин), триазины (дакарбазин, прокарбазин, темозоломид). Алкилирующие агенты обладают широким спектром противоопухолевой активности, что позволяет использовать их в лечении практически всех чувствительных к лекарственной терапии злокачественных опухолей (лимфомы, рак молочной железы, яичников, бронхов, головы и шеи, пищеварительного тракта, головного мозга, герминогенные опухоли и т.п.).
Дозолимитирующей токсичностью для большинства из них является угнетение кроветворения, часто носящее стойкий и глубокий характер. Для цисплатина наиболее серьезным осложнением является развитие кумулятивной нефротоксичности, проявляющейся синдромом почечной недостаточности. Профилактика этой побочной реакции осуществляется назначением достаточной внутривенной водной нагрузки (до 5000 мл/сут) и мочегонных средств, а также постоянным контролем клиренса креатинина при использовании цисплатина. Следует также отметить дозолимитирующую токсичность оксалиплатина, выражающуюся в развитии острой (в течение 2 сут) и хронической сенсорной нейропатии (парестезии, дизестезии, гипестезии). Характерным осложнением терапии ифосфамидом и циклофосфамидом (в высоких дозах) является развитие геморрагического цистита вследствие повреждающего воздействия на слизистую оболочку мочевыводящих путей метаболита этих цитостатиков - акролеина. К профилактическим мероприятиям относятся водная нагрузка, стимуляция диуреза и назначение специфического антидота уромитексана (месны).
Антиметаболиты выступают структурными аналогами веществ, участвующих в синтезе нуклеиновых кислот. Включение антиметаболитов в макромолекулу опухолевой ДНК приводит к нарушению синтеза нуклеотидов и как следствие к гибели клетки. Наибольшую цитостатическую активность они проявляют в отношении интенсивно пролиферирующих опухолевых клеток, находящихся в S-фазе клеточного цикла. Зависимость доза-эффект у антиметаболитов нелинейная; после достижения определенного уровня дальнейшее повышение дозы не сопровождается увеличением доли гибнущих клеток. Однако эта доля возрастает с увеличением времени воздействия, поскольку новые клетки успевают вступить в период S.
К препаратам этой группы относятся антагонисты фолиевой кислоты (метотрексат, эдатрексат, триметрексат), аналоги пиримидина (5-фторурацил, тегафур, капецитабин, цитарабин, гемцитабин), аналоги пурина (флударабин, меркаптопурин, тиогуанин), аналоги аденозина (кладрибин, пентостатин). Антиметаболиты широко применяются в лекарственной терапии больных раком пищевода, желудка и толстой кишки, головы и шеи, молочной железы, остеогенными саркомами.
Дозолимитирующая токсичность представлена угнетением кроветворения, мукозитом, диареей.
Противоопухолевые антибиотики являются продуктами жизнедеятельности грибов и микроорганизмов. Препараты этой группы действуют независимо от периода клеточного цикла и наиболее успешно применяются при медленно растущих опухолях с низкой ростовой фракцией. Механизмы действия противоопухолевых антибиотиков различны и включают подавление синтеза нуклеиновых кислот в результате образования свободных радикалов кислорода, ковалентного связывания ДНК, торможения активности топоизомеразы I и II.
Наиболее широко в клинической практике применяются доксорубицин, блеомицин, дактиномицин, митомицин, идарубицин. Наибольший спектр противоопухолевой активности демонстрирует доксорубицин, высокоэффективный в отношении рака молочной железы, сарком костей и мягких тканей, саркомы Юинга, лимфом. Дозолимитирующей токсичностью препарата являются угнетение кроветворения и развитие рефрактерной дилатационной кардиотоксичности.
Антимитогенные препараты: винкаалкалоиды (винкристин, винбластин, виндезин, винорельбин) и таксаны (доцетаксел, паклитаксел), точкой приложения которых являются микротрубочки митотического аппарата. При этом механизм действия винкаалкалоидов заключается в денатурации тубулина, входящего в состав микротрубочек митотического веретена, что приводит к деполимеризации тубулина и остановке митоза. Механизм действия таксанов противоположен: они ускоряют сборку микротрубочек, но нарушают их деполимеризацию, приводя к образованию избытка дефектных микротрубочек. В результате клетки задерживаются в фазе митоза, их цитоскелет повреждается, и наступает гибель.
Дозолимитирующей токсичностью большинства антимитогенных цитостатиков являются угнетение кроветворения, периферическая нейропатия и аллергические реакции (для таксанов), паралитическая кишечная непроходимость (для винкристина). Препараты этой группы широко применяются для лечения больных раком молочной железы, яичников, бронхов, с герминогенными опухолями яичка.
Ингибиторы ДНК-топоизомераз I и II. Топоизомеразы представляют собой ферменты, устраняющие гиперспирализацию ДНК путем последовательного «разрезания» и «сшивания» ее цепей. При этом топоизомераза I взаимодействует с одной цепью ДНК, а топоизомераза II - сразу с обеими. Нормальное функционирование этих
ферментов необходимо для осуществления процессов транскрипции, репликации и митоза. ДНК-топоизомеразы являются мишенями для целого ряда цитостатиков. Производные камптотецина (иринотекан, топотекан) ингибируют активность топоизомеразы I, эпиподофиллотоксины (этопозид, тенипозид) - топоизомеразы II. Это вызывает повреждение ДНК, приводящее к гибели опухолевой клетки. Ингибиторы топоизомераз I и II наиболее активны в G2- и М-фазах клеточного цикла.
Дозолимитирующей токсичностью иринотекана является развитие профузной диареи, для остальных ингибиторов топоизомераз - угнетение гранулоцитарного ростка кроветворения.
Показания к применению иринотекана - рак толстой кишки, топотекана - рак яичника, мелкоклеточный рак легкого. Этопозид с успехом применяется в лечении больных герминогенными опухолями яичка, лимфопролиферативными заболеваниями, раком легкого.
Основы гормонотерапии злокачественных опухолей
Эндокринотерапия, или гормонотерапия, - это метод лечения злокачественных опухолей посредством удаления источника гормонов, подавления их синтеза или блокирования действия гормонов на органы-мишени. Выделяют следующие виды гормонального воздействия:
• хирургическое, направленное на удаление источника гормонов путем оперативного вмешательства (овариэктомия, орхиэктомия, адреналэктомия, гипофизэктомия);
• лучевое, т.е. удаление источника гормонов путем лучевого воздействия (например, лучевая овариэктомия у больных раком молочной железы);
• лекарственное, связанное с использованием гормональных препаратов и антигормонов.
Группы гормональных препаратов и антигормоны
В клинической практике применяют стероидные гормоны - эстрогены, антиэстрогены, прогестины, андрогены, антиандрогены, ингибиторы ароматазы, кортикостероиды, агонисты LH-RH, а также тиреоидные гормоны и аналоги соматостатина. Механизм действия этих препаратов сложен и связан с их способностью изменять гормональные соотношения в организме и оказывать непосредственное влияние на опухолевые клетки. В основе чувствительности опухоле-
вых клеток к препаратам этой группы лежит наличие у них специфических рецепторов к гормонам. Действие антагонистов гормонов определяется их конкуренцией с соответствующими гормонами на уровне клеточных рецепторов. К наиболее гормоночувствительным опухолям относятся рак молочной железы, предстательной железы, эндометрия. Гормонотерапия характеризуется удовлетворительной переносимостью; к наиболее частым осложнениям относятся остеопороз, гиперплазия эндометрия, надпочечниковая недостаточность, гиперкальциемия.
Основная задача гормональной терапии - это подавление продукции гипофизарных и тканевых гормонов, стимулирующих пролиферацию опухолевых клеток, и блокада передачи патологических сигналов. Реализуя свой противоопухолевый потенциал, гормональные препараты связываются с белками-рецепторами, проникают в ядра клеток-мишеней и нарушают синтез нуклеиновых кислот. Эффект гормонотерапии определяется также возможностью стимуляции или торможения аутокринных и паракринных факторов роста, воздействия на гипоталамус и гипофиз, продуцируемые ими гормоны.
Антиэстрогены блокируют рецепторы эстрогенов, которые контролируют участок гена, ответственного за пролиферацию. Выделяют селективные модуляторы (тамоксифен, торемифен) и селективные супрессоры (фульвестрант) рецепторов эстрогенов. Эти препараты широко используют в адъювантном и паллиативном лечении больных раком молочной железы с положительным рецепторным статусом.
Ингибиторы ароматазы инактивируют фермент (ароматазу), ответственный за превращение андрогенов, образующихся в надпочечниках и периферических тканях, в эстрогены. В результате содержание эстрогенов у больных раком молочной железы, находящихся в менопаузе, значительно снижается. Различают нестероидные препараты (анастрозол, летрозол), обратимо ингибирующие ароматазу, и стероидные (экземестан), вызывающие необратимое подавление активности фермента. Ингибиторы ароматазы широко применяются у больных рецепторположительным раком молочной железы в качестве адъювантной терапии или при метастатической форме заболевания.
Кортикостероиды (преднизолон, метилпреднизолон, дексаметазон) оказывают прямое литическое воздействие на патологические лимфоидные клетки (при остром и хроническом лейкозе, лимфомах, миеломной болезни). Помимо этого кортикостероиды включают
в режимы полихимиотерапии, назначают в качестве симптоматических средств при метастатическом поражении печени, компрессии спинного мозга, отеке головного мозга, для профилактики тошноты и рвоты, обусловленной цитостатиками.
Андрогены (метилтестостерон, флуоксиместерон) оказывают противоопухолевое действие, влияя на функцию гипофиза или непосредственно подавляя пролиферацию опухолевых клеток. Применяются в терапии метастатического рака молочной железы, как правило, когда исчерпаны возможности других видов гормонотерапии.
Антиандрогены (бикалутамид, флутамид, нилутамид) конкурируют с андрогенами за связывание с рецепторами в тканях-мишенях. С успехом применяются в лечении больных раком предстательной железы.
Агонисты LH-RH подавляют продукцию лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов гипофиза, опосредованно ингибируя синтез тестостерона у мужчин и эстрогенов у женщин. Используются в лечении рака предстательной и молочной желез.
Прогестины оказывают противоопухолевое действие на уровне рецепторов опухолевой клетки, содействуя ее дифференцировке. Применяются при раке эндометрия и молочной железы.
Основы биотерапии злокачественных опухолей
Модификаторы биологических реакций - это лекарственные препараты, обладающие способностью изменять биологическую реакцию организма на опухоль. Примерами являются повышение иммунной защиты, усиление противоопухолевого иммунитета, стимуляция дифференцировки опухолевых клеток, уменьшение повреждающего действия цитостатиков на нормальные клетки, торможение процессов метастазирования и ангиогенеза. Остановимся на основных группах модификаторов биологических реакций.
Иммуномодуляторы - в первую очередь цитокины (интерфероны, интерлейкины), ряд синтетических препаратов (левамизол, полиоксидоний и др.), препараты тимуса (тимоген, тактивин и др.), иммуноглобулины, экстракты растений, препараты микробного происхождения (рибомунил, имудон). Действие иммуномодуляторов заключается в коррекции того или иного звена иммунной системы. Перед назначением препаратов этой группы необходимо оценить состояние иммунитета конкретного больного, определить дефектные звенья (это,
в частности, пониженная цитотоксическая активность натуральных киллеров или фагоцитирующая способность нейтрофилов).
Цитокины представляют собой биологически активные вещества белковой природы, регулирующие широкий спектр процессов, протекающих в организме. Основными функциями цитокинов являются регуляция гемопоэза, иммунного ответа, участие в ангиогенезе, апоптозе, хемотаксисе и т.п.
Семейство интерферонов (ИФН) представляет группу секреторных гликопротеидов, обладающих рядом биологических свойств. В клинической онкологии наибольшее значение имеют следующие эффекты интерферонов: подавление пролиферации опухолевых клеток, регуляция процессов клеточной дифференцировки, стимуляция апоптоза, повышение активности эффекторов естественного и специфического иммунитета, потенцирование противоопухолевого действия цитостатиков. ИФН-α обладает отчетливой противоопухолевой активностью в отношении рака почки, меланомы кожи (в комбинации с цитостатиками), волосатоклеточном лейкозе.
Наиболее востребованным препаратом из семейства интерлейкинов (ИЛ) является ИЛ-2, продуцируемый активированными Т-лимфоцитами. ИЛ-2 стимулирует иммунный ответ за счет дальнейшей активации Т-клеточных популяций, способствует синтезу ряда цитокинов и антител В-лимфоцитами. Препарат применяется в лечении больных диссеминированным раком почки и меланомой кожи.
Достижением последних лет является применение в иммунотерапии злокачественных новообразований препаратов на основе моноклональных антител. Мишенями для них являются некоторые из поверхностных антигенов опухолевых клеток. Современные препараты этой группы представляют собой гуманизированные и химерные антитела, содержащие мышиный и человеческий иммуноглобулины. Как правило, моноклональные антитела применяются в комбинации с цитостатиками. К моноклональным антителам, обладающим доказанной клинической эффективностью, относятся:
- ритуксимаб (мабтера - химерные антитела к антигену CD20, представленному на поверхности В-лимфоцитов). Антитела связываются с этими поверхностными антигенами, индуцируя антителозависимую цитотоксичность и апоптоз. Ритуксимаб успешно применяется в лекарственном лечении больных В-клеточной лимфомой;
- трастузумаб (герцептин - гуманизированные антитела к белку HER-2/neu, являющемуся эпидермальным фактором роста человека). Гиперэкспрессия этого онкогена характерна для рака молочной железы, желудка, некоторых других опухолей и коррелирует с плохим прогнозом заболевания;
- бевацизумаб (авастин - гуманизированные антитела к сосудисто-эндотелиальному фактору роста) применяется в терапии больных раком толстой кишки, легкого, почки, молочной железы;
- цетуксимаб (эрбитукс - химерные антитела к рецептору эпидермального фактора роста) эффективен в терапии рака толстой кишки, головы и шеи.
Колониестимулирующие факторы в онкологии
Угнетение костно-мозгового кроветворения, обусловленное проведением цитостатического лечения, проявляется нейтропенией, анемией и реже тромбоцитопенией различной степени тяжести.
Нейтропения, т.е. снижение абсолютного числа нейтрофилов <2000 в 1 мкл, относится к наиболее клинически значимым осложнениям цитостатической терапии. Она увеличивает риск возникновения инфекции у ослабленных онкологических больных, ведет к необходимости удлинения интервалов между циклами химиотерапии, а также редуцирования доз, что сопровождается уменьшением эффективности лечения. Наиболее серьезным, представляющим угрозу для жизни больного проявлением нейтропении служит фебрильная нейтропения, определяемая как снижение абсолютного числа нейтрофилов с 1000 в 1 мкл в сочетании с повышением температуры тела выше 38-38,2 °С.
К факторам риска ее возникновения относятся предшествующая химиотерапия, лучевая терапия на область таза, позвоночник, тяжелое общее состояние больного, снижение иммунитета, наличие хронических инфекций и т.п. Развитие фебрильной нейтропении у ослабленных и пожилых больных, с малыми резервами костно-мозгового кроветворения, сопровождается присоединением бактериальной и грибковой инфекции, часто приобретающей генерализованный характер. С целью профилактики и лечения этого осложнения в клинической практике используются гранулоцитарные колониестимулирующие факторы (КСФ) - цитокины, регулирующие пролиферацию соответствующего ростка костного
мозга. К основным механизмам действия относятся укорочение времени созревания нейтрофилов, ускорение их выхода в периферическую кровь, проникновения в ткани и фагоцитоза. Показания для назначения КСФ:
1) высокая вероятность развития фебрильной нейтропении (например, при проведении высокодозной химиотерапии сублетальными дозами цитостатиков, при назначении стандартной химиотерапии больным со сниженными резервами костного мозга и т.п.);
2) наличие фебрильной нейтропении в анамнезе;
3) мобилизация периферических стволовых клеток для последующей трансплантации.
Препараты этой группы получают, как правило, методом генной инженерии, назначают подкожно или внутривенно. Наиболее широко используются филграстим, его пролонгированная форма пегфилграстим, ленограстим.
Анемия часто осложняет течение таких злокачественных опухолей, как рак толстой кишки, почки, легкого, гемобластозы. Развитию анемии также способствует проведение химиотерапии производными платины, алкилирующими агентами, антрациклиновыми антибиотиками. Коррекция анемии проводится при снижении уровня гемоглобина <110 г/л, при развитии клинических симптомов. Для стимуляции эритропоэза применяют рекомбинантные человеческие эритропоэтины (эпоэтин, дарбэпоэтин и др.). К механизмам их действия относятся стимуляция деления и созревания клеток эритроидного ряда, синтеза гемоглобина. Лечение проводят в течение 4-8 нед до достижения уровня гемоглобина 120-130 г/л.
Показания к назначению противоопухолевой лекарственной терапии
1. Для излечения от таких злокачественных опухолей, как:
- лимфомы, нефробластома, саркома Юинга, ретинобластома, рабдомиосаркома у детей, лимфогранулематоз и некоторые лимфомы высокой степени злокачественности у взрослых (вероятность излечения достигает 50 % и более);
- герминогенные опухоли яичка - семиномы, несеминомы (вероятность излечения - 75 % и более);
- хориокарцинома у женщин (вероятность излечения -90 % и более);
- острые лейкозы у взрослых, рак яичников (вероятность излечения - 15-20 %).
2. Существенное продление жизни (при небольшой вероятности излечения) - у больных раком молочной железы, мелкоклеточным раком легкого, некоторыми лимфомами низкой степени злокачественности, остеогенной саркомой.
3. Уменьшение выраженности симптомов при диссеминированных формах злокачественных опухолей.
4. Лечение бессимптомных опухолей:
- при выявлении агрессивных опухолей, чувствительных к лекарственному лечению;
- при доказанном снижении риска рецидива и увеличении безрецидивной и общей выживаемости (адъювантная химиотерапия при III стадии рака толстой кишки, I и II стадиях рака молочной железы, остеогенной саркоме).
5. Уменьшение объема планируемого хирургического вмешательства (неоадъювантная химиотерапия или химиолучевая терапия при раке анального канала, молочной железы, пищевода, органов головы и шеи).
ВИДЫ ЛЕКАРСТВЕННОЙ ТЕРАПИИ
1. Первичная химиотерапия назначается по поводу местно-распространенного неоперабельного и метастатического процесса. Выделяют излечивающую (см. выше) и паллиативную химиотерапию. Паллиативную химиотерапию назначают больным со злокачественными новообразованиями при выявлении отдаленных метастазов с целью не излечения, а продления жизни и улучшения ее качества. Важными характеристиками паллиативного лекарственного лечения являются умеренная токсичность и удобство его проведения.
2. Адъювантная химиотерапия представляет собой дополнительный метод лечения, назначаемый после выполнения радикальной или циторедуктивной операции или лучевой терапии, т.е. при отсутствии остаточной опухоли и отдаленных метастазов. Основанием для нее являются высокий риск рецидива после выполнения радикальной операции; невозможность прогнозировать, в каких случаях для излечения больного будет достаточно только оперативного лечения; а также неспособность химио-
терапии излечить заболевание при возникновении метастазов. Целью адъювантной химиотерапии являются уменьшение риска появления отдаленных метастазов, увеличение безрецидивной и общей выживаемости больных. Назначение адъювантной химиотерапии показано пациентам, страдающим раком молочной железы, яичника, толстой кишки, остеогенной саркомой, саркомой Юинга. Как правило, применяются комбинации цитостатиков, обладающих высокой эффективностью при лечении диссеминированных форм этих новообразований. 3. Неоадъювантная химиотерапия проводится перед выполнением планового оперативного вмешательства или лучевой терапии с целью уменьшения объемов первичной опухоли и ее регионарных метастазов. Регресс опухолевых очагов позволяет увеличить резектабельность, сократить объем радикальной операции до органосохраняющей и т.п. Последующее патолого-анатомическое исследование предоставляет информацию о степени цитостатического повреждения клеток опухоли (лекарственный патоморфоз). Регистрация выраженного патоморфоза служит основанием для использования эффективных цитостатиков и в адъювантном режиме.
Противопоказания к назначению химиотерапии
1. Невозможность оценить эффект лечения, выявить и устранить его осложнения.
2. Тяжелое состояние больного, при котором даже при уменьшении размеров опухоли и метастазов не ожидается увеличения продолжительности жизни пациента.
3. Малая ожидаемая продолжительность жизни больного, недостаточная для реализации лечебного эффекта химиотерапии.
4. Медленно растущие бессимптомные опухоли, не поддающиеся излечению.
Монохимиотерапия и полихимиотерапия (ПХТ)
Целесообразность назначения комбинированной химиотерапии базируется на кинетических и фармакологических принципах. Выделяют 3 основные теоретические предпосылки преимущества комбинаций цитостатиков по сравнению с монотерапией.
1. Максимальный рост гибели опухолевых клеток наряду с минимизацией токсических эффектов из-за неперекрывающейся дозолимитирующей токсичности.
2. Большие возможности для преодоления эндогенной (первичной) лекарственной резистентности опухолевых клеток.
3. Предупреждение или снижение риска развития вторичной лекарственной устойчивости опухолевых клеток.
Принципы выбора цитостатиков для комбинированных режимов
1. Выбор цитостатиков, обладающих эффективностью в режиме монотерапии. Предпочтение следует отдавать препаратам, вызывающим полный регресс опухоли.
2. Выбор препаратов, обладающих различными механизмами действия и аддитивной или синергичной цитотоксичностью.
3. Использование цитостатиков в оптимальных дозах и режимах, через стандартные временные интервалы (как правило, 14-28 дней), достаточные для восстановления костного мозга.
4. Назначение препаратов с различными механизмами развития лекарственной резистентности (с целью минимизации риска развития перекрестной резистентности).
Резистентность опухоли к противоопухолевой терапии
1. Первичная резистентность объясняется возникновением спонтанных мутаций в клетках опухоли в процессе ее роста. Мутации приводят к появлению клонов, изначально устойчивых к действию цитостатиков.
2. Вторичная резистентность. К механизмам вторичной, т.е. развивающейся в процессе химиотерапии, резистентности опухоли относятся:
- стимуляция цитостатиками (например, цитарабином) синтеза ряда ферментов, вызывающих их инактивацию в клетке;
- повышенное содержание глутатиона, обладающего способностью связывать алкилирующие агенты, ускорять их катаболизм, а также стимулировать репарацию ДНК;
- повышенная активность Р-гликопротеида, мембранного белка, который осуществляет активный транспорт цитостатиков из клетки;
- стимуляция синтеза белков-переносчиков на мембране опухолевых клеток некоторыми цитостатиками (например, метотрексатом). В результате основная часть препарата выводится из клетки, не реализовав свой противоопухолевый эффект.
КРИТЕРИИ ОЦЕНКИ ПРОТИВООПУХОЛЕВОГО
ЭФФЕКТА
Принципы объективной оценки эффективности противоопухолевой терапии были разработаны в конце 1970-х годов и изданы в качестве рекомендаций ВОЗ. Представим их основные положения:
- общий объем опухоли характеризуется посредством оценки измеримых и неизмеримых опухолевых очагов. К измеримым относят очаги, площадь которых можно измерить переумножением двух перпендикулярных диаметров, один из которых - наибольший; к неизмеримым - очаги, которые не могут быть измерены при помощи линейки или циркуля, их динамика оценивается при осмотре, УЗили рентгенологическом исследовании (в частности, лимфангит в легочной ткани, метастазы в коже, костях);
- опухолевые очаги должны оцениваться до начала лечения и в процессе лечения с регулярными интервалами, с использованием одного и того же метода измерения и оценки;
- лечебный эффект оценивается в соответствии со следующими критериями: полный регресс, частичный регресс, стабилизация, прогрессирование.
Полный регресс регистрируется при исчезновении всех клинических проявлений опухолевого процесса; частичный регресс - уменьшение опухолевых очагов более чем на 50 % от их первоначальной площади; стабилизация - регресс очагов менее чем на 50 % или увеличение менее чем на 25 %; прогрессирование - увеличение размеров опухолевых очагов более чем на 25 % или появление новых очагов.
Объективный ответ регистрируется при достижении полного или частичного регресса. Дополнительно выделяют лечебный эффект, включающий, помимо частичного и полного регресса, стабилизацию опухолевого процесса.
Наряду с выраженностью лечебного эффекта оценивается его продолжительность. Выделяют время до прогрессирования или продолжительность объективного ответа (период с момента начала лекарственной терапии до появления признаков прогрессирования заболевания), а также продолжительность полного регресса (период с момента установления полного регресса до появления признаков прогрессирования заболевания).
С 2000 г. для оценки эффекта лечения больных солидными опухолями введены критерии RECIST (Response Evaluation Criteria in Solid Tumors), характеризующиеся следующим:
- все измерения целевых опухолевых очагов осуществляются посредством определения одного, наибольшего диаметра;
- сумма наибольших диаметров всех целевых очагов регистрируется на исходном уровне; их изменения в процессе лечения будут оцениваться как полный и частичный регресс и стабилизация.
Не менее важным, чем объективный ответ, критерием оценки эффективности лекарственной терапии является качество жизни больного. Это понятие включает функциональное состояние больного, симптомы, связанные с заболеванием или его лечением, половую функцию, удовлетворенность медицинской помощью и т.п. Для оценки качества жизни используют специальные анкеты, на вопросы которой пациент отвечает самостоятельно.
Токсические реакции противоопухолевой терапии
К токсическим реакциям относятся любые изменения в самочувствии или состоянии больного, а также клинически значимые отклонения лабораторных показателей. Выделяют 4 степени тяжести побочных эффектов химиотерапии:
• 1 (слабая) степень - легкое осложнение, причиняющее минимальные неудобства и не препятствующее повседневной деятельности больного;
• 2 (умеренная) степень - осложнение, вызывающее умеренный дискомфорт и нарушающее повседневную деятельность пациента;
• 3 (выраженная) степень - тяжелый побочный эффект, препятствующий обычной повседневной деятельности больного;
• 4 (представляющая угрозу для жизни больного) степень - осложнение, подвергающее пациента непосредственному риску смерти.
Побочные реакции со стороны различных органов и систем:
• системы кроветворения - угнетение костномозгового кроветворения (анемия, нейтропения, тромбоцитопения);
• пищеварительной системы - анорексия, изменение вкуса, тошнота, рвота, диарея, стоматит, эзофагит, кишечная непроходимость, повышение активности трансаминаз печени, желтуха;
• дыхательной системы - кашель, одышка, отек легких, пульмонит, пневмофиброз, плеврит, кровохарканье, изменение голоса;
• сердечно-сосудистой системы - аритмия, гипоили гипертензия, ишемия миокарда, снижение сократительной способности миокарда, перикардит;
• мочеполовой системы - дизурия, цистит, гематурия, повышение уровня креатинина, протеинурия, нарушение менструального цикла;
• нервной системы - головная боль, головокружение, нарушения слуха и зрения, бессонница, депрессия, парестезии, потеря глубоких рефлексов;
• кожи и ее придатков - алопеция, пигментация и сухость кожи, сыпь, кожный зуд, экстравазация препарата, изменение ногтевых пластинок;
• метаболические нарушения - гипергликемия, гипогликемия, гиперкальциемия, гиперкалиемия и др.
ФОТОДИНАМИЧЕСКАЯ ТЕРАПИЯ
Фотодинамическая терапия (ФДТ) представляет собой цитотоксический вид лечения, в основе которого лежит применение низкоинтенсивного лазерного излучения. Основоположником метода является датский физик Н.Р. Финсен (1903). В основе противоопухолевого действия ФДТ лежит механизм фотооксигенации, заключающийся в образовании промежуточных радикалов и двухатомного кислорода, которые оказывают повреждающее воздействие на опухолевые клетки.
Принцип метода ФДТ можно представить следующим образом: молекулы фотосенсибилизатора избирательно фиксируются на мембранах активно пролиферирующих клеток (опухолевых, эндотелиальных), а также в клеточных органеллах (в частности, в митохондриях). После облучения фотосенсибилизированной ткани опухоли лазерным излучением происходит переход нетоксичного триплетного кислорода в активное, возбужденное состояние. Активный двухатомный (или синглетный) кислород обладает выраженной способностью взаимодействовать с биомолекулами цитоплазматических, митохондриальных и лизосомальных мембран, вызывая их повреждение и гибель, а также инактивацию ферментов митохондрий, высвобождение гидролитических ферментов, повреждение ДНК ядра клетки.
Облучение фотосенсибилизированных клеток эндотелия приводит к выработке медиаторов воспаления и цитокинов (простагландинов, лимфокинов, тромбоксанов), играющих важнейшую роль в сосудистых повреждениях стромы опухоли. Снижение эффективности ФДТ возможно при недостаточной тропности фотосенсибилизатора, нарушении васкуляризации стромы опухоли, снижении содержания кислорода в опухоли.
Требования, предъявляемые к фотосенсибилизаторам:
- отсутствие (или минимальная) фототоксичности;
- неизменный (стойкий) химический состав;
- избирательность (селективность) накопления в опухолевой ткани;
- обеспечение достаточного переноса энергии для образования двухатомного кислорода;
- выраженное поглощение в красной части видимого спектра, поскольку именно такой свет лучше всего проникает в ткани.
Синтез первого фотосенсибилизатора (производного гематопорфирина) был осуществлен в 1950 г. В последующие годы синтезировано несколько классов фотосенсибилизаторов; к ним, помимо порфиринов, относятся хлорины, бактериохолины, фталоцианины.
Показания к ФДТ
Первые результаты лечения методом ФДТ были опубликованы в 1978 г. До настоящего времени метод находится на стадии клинического изучения. Как правило, применяется при лечении больных эндобронхиальным раком, поверхностным раком мочевого пузыря, раком пищевода и желудка.
ФДТ может проводиться как по радикальной (у больных с ранними формами рака бронха, пищевода и желудка, в том числе с целью подготовки к операции), так и по паллиативной (при распространенных стенозирующих опухолях для устранения явлений дыхательной недостаточности, дисфагии, кишечной непроходимости) программам. Применяется интраоперационная ФДТ при видеоторакоскопическом плевродезе, при лечении рака пищевода и желудка. Возможно комбинирование ФДТ с лучевой и (или) химиотерапии.
Противопоказания к ФДТ
• Наследственная или приобретенная порфирия.
• Повышенная кожная фоточувствительность.
• Тяжелые поражения печени и почек.
• Распад опухолей с образованием фистул, вовлечением в процесс крупных сосудов.
Лечение хронической боли онкологического генеза
Боль - эволюционно выработанный типовой процесс, возникающий в результате действия на организм ноцицептивных (повреждающих) факторов ослабления антиноцицептивной системы. Это - физиологический феномен, необходимый для нормальной жизнедеятельности и информирующий нас о вредных воздействиях, представляющих потенциальную опасность для организма. В настоящее время наиболее распространено определение боли, предложенное Международной ассоциацией по изучению боли (IASP, 1994): «Боль - это неприятное ощущение и эмоциональное переживание, связанное с реальным или потенциальным повреждением тканей или описываемое терминами такого повреждения». Боль всегда субъективна, ее конечная оценка определяется локализацией и характером повреждения, природой повреждающего фактора, психологическим состоянием человека и его индивидуальным жизненным опытом. В связи с этим классификация боли достаточно условна и включает несколько признаков:
1) предполагаемые патофизиологические механизмы: ноцицептивные или неноцицептивные;
2) факторы времени: острая или хроническая боль;
3) локализация: зона болезненности;
4) этиология: например, онкологическое заболевание.
Ноцицептивная боль возникает в результате повреждения структур, чувствительных к боли, и в зависимости от того, где активируются ноцицепторы, подразделяется на соматическую и висцеральную. Неноцицептивная боль представлена нейропатической и психогенной болью, при этом нейропатическая боль подразделяется на периферическую и центральную в зависимости от того, какие отделы нервной системы ответственны за поддержание боли. Для практики данная классификация весьма условна из-за тесного сочетания патогенетических механизмов при хронической боли онкологического генеза (например, опухолевая инфильтрация тканей и компрессия нервов). Кроме того, почти у 25 % онкологических пациентов выявляются 2 источника боли или более, имеющих разные патогенетические механизмы. В то же время данная классификация помогает составить
адекватный план фармакологического лечения болевого синдрома, так как принципы лечения ноцицептивной и неноцицептивной боли существенно различаются.
Под хронической болью (ХБ) понимают боль, сохраняющуюся более 3 мес. Нередко ХБ становится самостоятельной болезнью и может оставаться даже после устранения первоначально вызвавшей боль причины. Распространенность ХБ у онкологических пациентов крайне велика - более 70 % больных в конечном периоде жизни считают боль основным симптомом заболевания.
Боль онкологического генеза можно разделить на острую, вызванную непосредственно опухолью или противоопухолевым лечением, и хроническую, обусловленную прогрессированием онкологического заболевания или противоопухолевым лечением.
Важную роль в правильном выборе тактики лечения ХБ онкологического генеза играют диагностика причин, патогенетического типа и интенсивности боли, а также контроль эффективности проводимых лечебных мероприятий на этапах курации пациента. Диагностику следует проводить простыми неинвазивными методами, оценивая интенсивность боли, показатели качества жизни пациента и переносимость применяемых лекарственных средств. При сборе жалоб, анамнеза и проведении физикального исследования определяют следующие характеристики боли:
• первичные факторы:
- количество и локализация очагов боли;
- тяжесть и интенсивность болевых ощущений;
- характер болевых ощущений;
- иррадиация;
- временная модальность различных очагов боли.
• вторичные факторы:
- причины усиления и ослабления боли;
- обстоятельства возникновения боли;
- уточнение этиологии боли (прогрессирование опухолевого процесса, метастазирование, последствия лечения, обострение сопутствующих заболеваний);
- методы и эффективность лечения боли в анамнезе;
- наличие признаков тревоги и (или) депрессии.
Оценить интенсивность боли наиболее удобно для исследователя и пациента при применении шкалы вербальных (словесных) оценок: 0 - боли нет; 1 - слабая; 2 - умеренная; 3 - сильная; 4 - самая
сильная боль. Нередко применяют визуальную-аналоговую шкалу, на которой пациент отмечает выраженность своих болевых ощущений - от 0 до 100 %. Эти шкалы позволяют количественно оценить динамику болевого синдрома в процессе лечения.
Основой лечения ХБ онкологического генеза у пациентов всех возрастных групп является системная фармакотерапия, которая оказывается эффективной более чем в 80 % случаев. Лекарственные препараты, используемые для этих целей, делятся на 3 категории: неопиоидные анальгетики, опиоидные анальгетики и адъювантные препараты.
Согласно «анальгетической лестнице» ВОЗ, при слабой боли применяют неопиоидные анальгетики. При усилении боли до уровня умеренной дополнительно назначают опиоиды слабой потенции. Для лечения сильной боли применяют сильнодействующие опиоиды.
На всех ступенях обезболивания анальгетики могут сочетаться с адъювантными средствами: противосудорожными, кортикостероидами, трициклическими антидепрессантами, транквилизаторами и др. Для получения положительного результата с первых дней фармакотерапии необходимо строго соблюдать следующие принципы: дозу анальгетика подбирают индивидуально в зависимости от интенсивности и характера боли, добиваясь устранения или значительного облегчения боли; назначают анальгетики строго «по часам», вводя очередную дозу препарата до прекращения действия предыдущей; анальгетики применяют «по восходящей», т.е. от максимальной дозы слабодействующего препарата к минимальной дозе сильнодействующего; приоритет отдавать следует неинвазивным формам лекарственных средств. Одним из важнейших условий успешного лечения является индивидуальный подбор способа введения, дозы и схемы приема анальгетика.
По современным представлениям при терапии интенсивной ХБ онкологического генеза оптимальным следует считать назначение продленных лекарственных форм опиоидов сильной потенции - морфина, бупренорфина и фентанила, отвечающих современным принципам противоболевой фармакотерапии. В Российской Федерации зарегистрированы и разрешены к применению морфина сульфат (MST-continus) в таблетках и трансдермальные терапевтические системы фентанила (дюрогезик) и бупренорфина (транстек), наклеиваемые на кожу пациента в виде пластыря.
Для профилактики запора одновременно с назначением опиоидов следует проводить адекватную гидратацию и назначать слабительные средства. Для профилактики тошноты и рвоты у чувствительных лиц
в первые дни целесообразно применять антагонисты допамина или малые дозы галоперидола. Седация, наблюдающаяся у определенной части пациентов, представляет собой побочный эффект, а не следствие передозировки. Для ее устранения необходимо отменить все другие препараты с седативным эффектом или сменить опиоид.
Нейропатическая боль, наблюдающаяся в 15-40 % случаев, обычно плохо поддается терапии анальгетиками. Для ее контроля применяют антидепрессанты (преимущественно трициклические), антиконвульсанты (карбамазепин, габапентин), антагонисты NMDA-рецепторов (ламотриджин, флупиртин), ГАМКергические препараты (баклофен). Существенную роль играют нефармакологические методы лечения.
СИМПТОМАТИЧЕСКОЕ ЛЕЧЕНИЕ
Симптомный контроль респираторных нарушений
Одышка
Согласно определению экспертов, термин «одышка» используется для описания субъективного чувства дискомфорта, связанного с внешним дыханием и представленного различными ощущениями, варьирующими по интенсивности. Ощущение одышки является следствием взаимодействия множества физиологических, психологических, социальных факторов и факторов окружающей среды и может сопровождаться формированием ответных физиологических и поведенческих реакций. Одышка встречается у 10-70 % онкологических пациентов и по своему воздействию на качество жизни не уступает боли. Причины одышки у онкологических больных представлены в табл. 7.1.
Особенности одышки у данной категории пациентов заключаются в том, что она не связана с сатурацией кислородом и частотой дыхательных движений. Таким образом, оценка одышки основывается на субъективных ощущениях пациента. Объем исследований у больных с терминальными состояниями, страдающих одышкой, определяется характером и стадией заболевания, а также желанием пациента.
Одышка, как и боль, представляет собой субъективное качественное ощущение, которое в то же время можно оценить с применением некоторых количественных параметров. Методы оценки одышки принципиально разделяются на дискриминативные (т.е. позволяющие оценить различия в выраженности одышки
Таблица 7.1. Причины одышки у онкологических больных
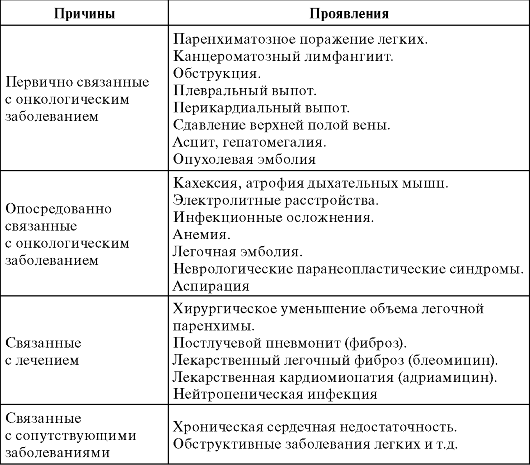 между
индивидуумами) и эволюционные (позволяющие оценить изменения
выраженности одышки у одного и того же индивидуума). Дискриминативные
шкалы одышки широко применяются в популяционных и скрининговых
исследованиях и позволяют оценить выраженность одышки в условиях обычной
повседневной активности. Одной из наиболее популярных является
5-балльная шкала, разработанная экспертами Британского совета по
проведению научных исследований в области медицины (табл. 7.2).
между
индивидуумами) и эволюционные (позволяющие оценить изменения
выраженности одышки у одного и того же индивидуума). Дискриминативные
шкалы одышки широко применяются в популяционных и скрининговых
исследованиях и позволяют оценить выраженность одышки в условиях обычной
повседневной активности. Одной из наиболее популярных является
5-балльная шкала, разработанная экспертами Британского совета по
проведению научных исследований в области медицины (табл. 7.2).
Для оценки одышки во время физической нагрузки обычно используются 2 эволютивные шкалы - визуальная аналоговая шкала (ВАШ) и шкала Борга. Шкала ВАШ представляет собой вертикальную линию длиной 100 мм, крайние точки которой обозначают ощущения «нет одышки» (0 мм) и «самая тяжелая одышка, какая только может
Таблица 7.2. Шкала оценки одышки
 существовать»
(100 мм). Уровень одышки оценивает сам больной до нагрузки и в конце
нагрузки; она измеряется в миллиметрах. Шкала Борга включает в себя
словесные описания ощущений одышки на равно отстоящих расстояниях друг
от друга точках и соответствующие определенному числу баллов. Больной
отмечает свой уровень одышки в соответствии с описаниями шкалы до и
после физической нагрузки. Шкала Борга - одна из наиболее надежных и
хорошо воспроизводимых эволютивных шкал, широко использующихся во время
нагрузочных тестов и при оценке эффективности терапии диспноэ.
существовать»
(100 мм). Уровень одышки оценивает сам больной до нагрузки и в конце
нагрузки; она измеряется в миллиметрах. Шкала Борга включает в себя
словесные описания ощущений одышки на равно отстоящих расстояниях друг
от друга точках и соответствующие определенному числу баллов. Больной
отмечает свой уровень одышки в соответствии с описаниями шкалы до и
после физической нагрузки. Шкала Борга - одна из наиболее надежных и
хорошо воспроизводимых эволютивных шкал, широко использующихся во время
нагрузочных тестов и при оценке эффективности терапии диспноэ.
Лечение одышки может быть специфическим, направленным на устранение причины (заболевания), лежащей в ее основе, либо (чаще) неспецифическим, направленным на устранение одышки как симптома. К потенциально устранимым причинам одышки относятся обтурация просвета бронха опухолью, инфекция, плевральный выпот, обструкция верхней полой вены (ВПВ), канцероматозный лимфангиит, анемия и т.д.
Немедикаментозные методы коррекции одышки включают в себя:
• удобное положение тела (головной конец кровати приподнят на 30°);
• сохранение энергии;
• поддержание комфортной температуры воздуха и влажности в помещении, проветривание;
• коррекцию других симптомов;
• релаксацию;
• технику дыхания (диафрагмальное, через вытянутые губы);
• направленную вентиляцию (на область иннервации тройничного нерва) с помощью веера, вентилятора и т.д.
Вопреки широко распространенному мнению кислородотерапия у данной категории больных имеет ограниченное значение.
Фармакологическое лечение тяжелой одышки заключается в назначении опиоидов. С учетом того, что одышка часто сопровождается тревогой, назначение анксиолитиков пациентам оправдано.
Кашель
Кашель наблюдается почти у 50 % больных с прогрессирующими формами злокачественных новообразований и почти у 80 % пациентов с терминальной стадией рака легкого (табл. 7.3). Изнурительный кашель и сопровождающая его бессонница значительно астенизируют пациентов. Кроме того, постоянный кашель, особенно в сочетании с одышкой и кровохарканьем, приводит к развитию множества различных осложнений.
Таблица 7.3. Причины кашля у онкологических больных
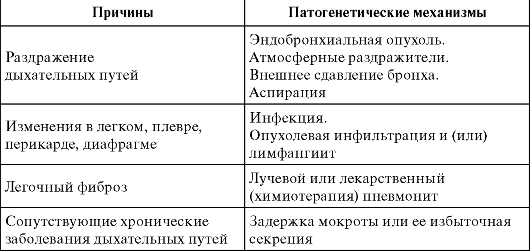 При
принятии решения о назначении лечения не следует игнорировать
возможность нескольких причин кашля и особенно наиболее частые его
причины (заболевания верхних дыхательных путей, гастроэзофагеальный
рефлюкс, астма), даже если диагноз кажется очевидным на основе
клинических и рентгенологических данных.
При
принятии решения о назначении лечения не следует игнорировать
возможность нескольких причин кашля и особенно наиболее частые его
причины (заболевания верхних дыхательных путей, гастроэзофагеальный
рефлюкс, астма), даже если диагноз кажется очевидным на основе
клинических и рентгенологических данных.
Симптоматический контроль продуктивного кашля У пациентов, которые в состоянии самостоятельно или с посторонней помощью откашливать мокроту, цель лечения заключается в облегчении ее отхождения. В этом плане эффективны физиотерапевтические меры, постуральный дренаж, ингаляции физиологического раствора через небулайзер. Противокашлевые средства назначают только на ночь для обеспечения спокойного сна.
У сильно ослабленных или умирающих пациентов лечение заключается в подавлении кашля и бронхиальной секреции. В этих случаях назначают противокашлевые средства (преимущественно опиоиды), холинолитики (ипратропия бромид через небулайзер, свечи с гиосцином), фуросемид через небулайзер.
Симптоматический контроль сухого кашля
Если невозможно устранить причину кашля, назначают периферические (лидокаин или бупивакаин через небулайзер) или центральные (фолкодин, декстрометорфан, декстропропоксифен, кодеин, дигидрокодеин, морфин) противокашлевые средства.
Симптомный контроль гастроинтестинальных нарушений
Тошнота и рвота
Тошнота наблюдается у 20-30 % пациентов с распространенными формами рака, при этом в последнюю неделю жизни от тошноты страдают до 70 % больных. Рвота наблюдается у20 % пациентов с распространенными формами рака. Наиболее высока частота возникновения тошноты и рвоты в онкогинекологии (42 %) и у больных раком желудка (36 %). Тошнота развивается почти у 1/3 пациентов в 1-ю неделю приема морфина. В таблице 7.4 представлена широко распространенная классификация тошноты и рвоты по степени выраженности Национального института рака США.
Таблица 7.4. Классификация тошноты и рвоты
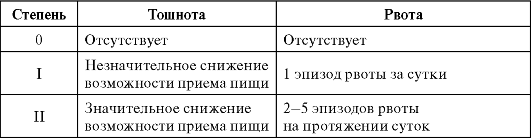 Окончание табл. 7.4
Окончание табл. 7.4
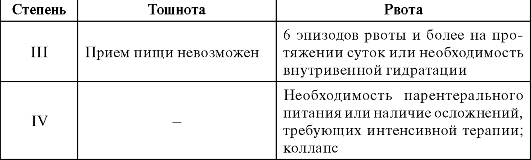 Обследование. В
первую очередь следует определить причину тошноты и рвоты, что позволит
выбрать оптимальную тактику ведения больных. При оценке состояния
пациента тошноту и рвоту необходимо рассматривать как 2 различных
симптома. Оценивают провоцирующие и облегчающие факторы, частоту,
распределение эпизодов во времени, объем и характер рвотных масс.
Проводится полноценное непосредственное исследование больного, включая
оценку неврологического статуса и фундоскопию. Принципы дифференциальной
диагностики различных причин тошноты и рвоты у онкологических больных
представлены в табл. 7.5.
Обследование. В
первую очередь следует определить причину тошноты и рвоты, что позволит
выбрать оптимальную тактику ведения больных. При оценке состояния
пациента тошноту и рвоту необходимо рассматривать как 2 различных
симптома. Оценивают провоцирующие и облегчающие факторы, частоту,
распределение эпизодов во времени, объем и характер рвотных масс.
Проводится полноценное непосредственное исследование больного, включая
оценку неврологического статуса и фундоскопию. Принципы дифференциальной
диагностики различных причин тошноты и рвоты у онкологических больных
представлены в табл. 7.5.
Таблица 7.5. Дифференциальная диагностика тошноты и рвоты у онкологических больных
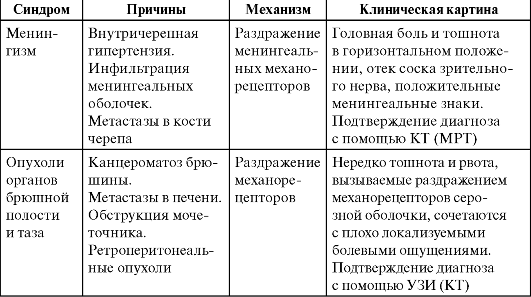 Продолжение табл. 7.5
Продолжение табл. 7.5
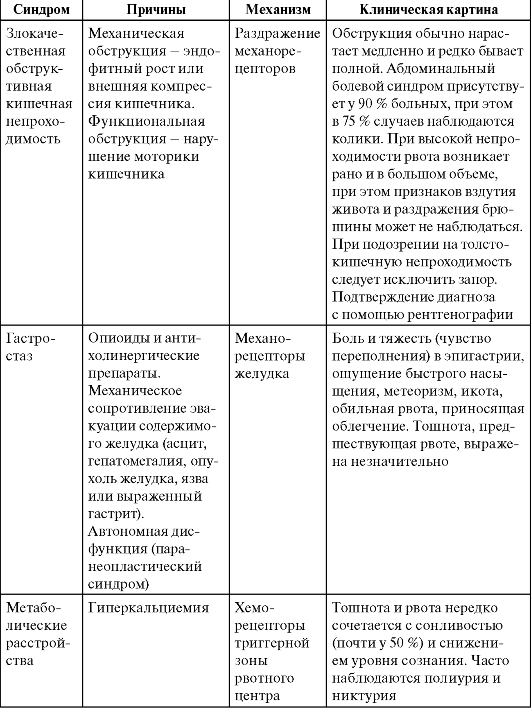 Окончание табл. 7.5
Окончание табл. 7.5
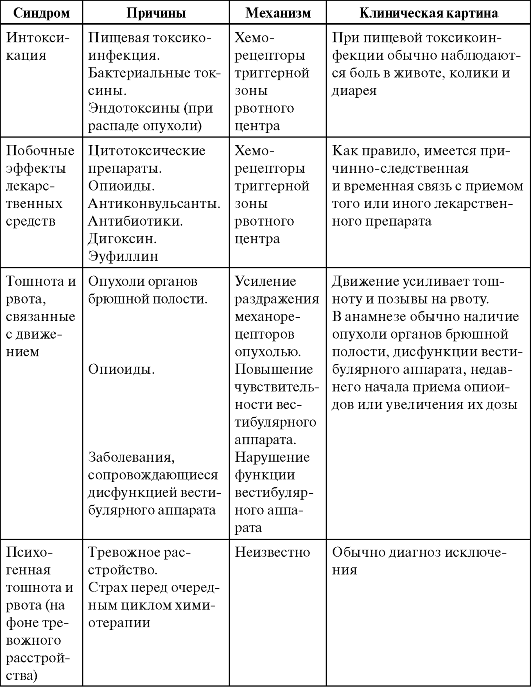 Дополнительные методы обследования больных
Дополнительные методы обследования больных
• Тяжесть основного заболевания определяется на основании сбора жалоб, анамнеза, данных медицинской документации. При подозрении на прогрессирование заболевания может возникнуть необходимость в проведении контрольных визуализирующих исследований.
• Следует выполнить общий и биохимический анализ крови для исключения гиперкальциемии, нарушения электролитного баланса и дегидратации, а также почечной недостаточности.
• Необходимо оценить степень дегидратации и наличие возможных сопутствующих симптомов - дисфагии, регургитации (внезапно, происходящий без всякого усилия заброс небольших объемов содержимого пищевода или желудка в глотку) и запора.
Общие принципы лечения
• Установите причину тошноты и рвоты.
• Проведите коррекцию потенциально устранимых причин.
• Начните медикаментозную терапию препаратами 1-го ряда в зависимости от клинической картины и механизма действия препаратов.
• Проведите коррекцию осложнений, связанных с длительной тошнотой и рвотой.
• При непредвиденно плохом ответе на лечение пересмотрите возможную причину тошноты и рвоты.
• При улучшении состояния, но сохранении тошноты и рвоты в течение 24-48 ч добавьте другой препарат или назначьте препараты 2-го ряда.
• Препараты следует применять постоянно, а не по потребности.
• При сохранении симптоматики еще раз оцените клиническую картину.
Общие меры
Прием пищи:
• дегидратация усиливает тошноту и рвоту;
• приготовление пищи должно осуществляться в отдельном помещении, чтобы пациента не раздражали запахи;
• не следует оказывать избыточное давление на пациента в плане приема пищи;
• при приготовлении пищи ориентируйтесь на пожелания пациента;
• более целесообразен регулярный прием небольших порций пищи;
• при приготовлении пищи отдавайте предпочтение продуктам с высоким содержанием углеводов и цитрусовым.
Коррекция потенциально устранимых причин тошноты и рвоты
• Тошнота и рвота, вызванные непосредственно опухолью:
- метастатическое поражение головного мозга:
• кортикостероиды (дексаметазон);
• лучевая терапия.
- злокачественная обструктивная кишечная непроходимость:
• хирургическое лечение (резекция, формирование обходных анастомозов или стомы, стентирование).
• Гиперкальциемия:
- регидратация;
- бифосфонаты.
• Воспаление слизистой оболочки желудка или язва желудка:
- прекращение приема ульцерогенных препаратов (нестероидные противовоспалительные препараты - НПВП);
- гастропротекция (ингибиторы протонного насоса, Н2-блокаторы, мизопростол).
• Запор:
- слабительные (после исключения механической непроходимости).
• Тревога:
- психотерапия;
- анксиолитики.
Лекарственная терапия
Основные группы лекарственных препаратов для лечения тошноты и рвоты приведены в табл. 7.6.
Таблица 7.6. Основные группы противорвотных средств
Антагонизм в отношении рецепторов
Препарат | фаминовые | ^-гис- таминовые | М-ацетилхоли- новые | 5-HT2 - серотониновые | 5-HT3 - серотониновые | NK1 |
Метоклопрамид* ++ + | - | |||||
Домперидон ++ | - | |||||
Окончание табл. 7.6
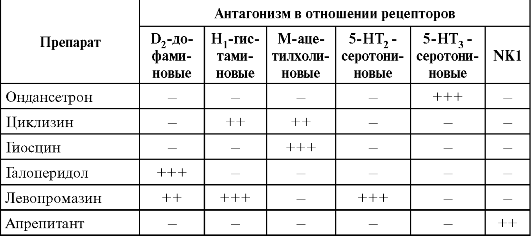 Примечание. Эффект: «-» отсутствует или незначительный; «+» слабый;
Примечание. Эффект: «-» отсутствует или незначительный; «+» слабый;
«++» умеренный; «+++» выраженный.
* Агонист 5-НТ4-серотониновых рецепторов.
Повышенное внутричерепное давление
При метастатическом поражении головного мозга следует рассмотреть возможность направления пациента в специализированное учреждение для проведения лучевой терапии.
Кортикостероиды. Начальная доза дексаметазона составляет 16 мг/сут в течение 4-5 дней, затем дозу постепенно снижают до поддерживающей (4-6 мг/сут). Если эффекта от назначения кортикостероидов нет, их следует отменить.
При неэффективности: добавить димедрол либо левомепромазин (2,5-5 мг подкожно или 12,5 мг перорально 1 раз в день).
Злокачественная обструктивная кишечная непроходимость
• Функциональная или частичная непроходимость:
- прекращение приема осмотических и стимулирующих слабительных, препарата выбора для получения адекватного стула - докузат;
- избегать приема пищи, богатой растительными волокнами и клетчаткой, частый прием небольших количеств жидкости;
- при отсутствии колик и нормальном отхождении газов лечение следует начинать с противорвотных препаратов, обладающих прокинетическими свойствами (метоклопрамид, домперидон). При развитии полной непроходимости прием этих препаратов следует прекратить.
• Полная непроходимость:
- если позволяет состояние пациента, рассмотреть вопрос о хирургическом лечении;
- циклизин для устранения тошноты;
- устранение рвоты с помощью галоперидола и антисекреторной терапии;
- при обструкции выходного отдела желудка с развитием быстрой дегидратации - назогастральный зонд, внутривенная гидратация, ранитидин (парентерально);
- при полной дистальной обструкции - гиосцина бутилбромид (устраняет колики, однако антисекреторный эффект в полной мере достигается только через 3 сут) или октреотид (при необходимости достижения более быстрого и мощного антисекреторного эффекта).
Гастростаз:
- прокинетики (метоклопрамид, домперидон). Не следует назначать прокинетики одновременно с препаратами, обладающими антихолинергической активностью (димедрол, гиосцина бутилбромид);
- при неэффективности добавить антисекреторную терапию - ранитидин, в более тяжелых случаях - октреотид.
Побочные эффекты лекарственных средств
• Тошнота и рвота на фоне приема опиоидов:
- в самом начале приема опиоидов профилактический эффект оказывает прием прокинетиков (метоклопрамид, домперидон);
- на фоне приема: галоперидол (1,5-2,5 мг/сут), дроперидол;
- при неэффективности заменить галоперидол на левомепромазин.
• Химиотерапия.
Препараты, применяемые для профилактики и лечения тошноты и рвоты на фоне химиотерапии, приведены в табл. 7.7.
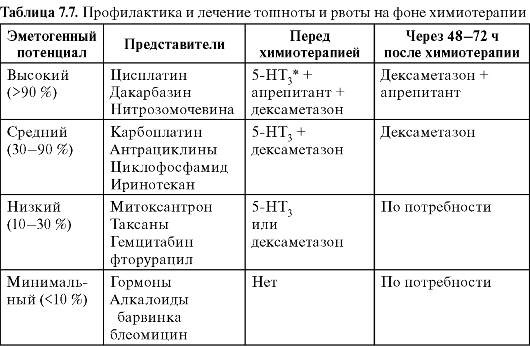 Примечание.
Примечание.
* Антагонист 5-НТ3-рецепторов: ондансетрон, гранисетрон, трописетрон, доласетрон, палоносетрон.
Тошнота и рвота, связанные с движением
• Вестибулярные расстройства:
- димедрол;
- гиосцина гидробромид;
- при неэффективности циннаризин.
• Опухоли органов брюшной полости и таза (см. выше).
• Прием опиоидов (см. выше).
Тошнота и рвота психогенной этиологии (тревога)
• Психотерапия и анксиолитики (избегайте назначения диазепама).
Тошнота и рвота, связанные с несколькими причинами или неясной этиологии
• Левопромазин.
• При неэффективности добавить дексаметазон.
Запор
Запор является одним из наиболее распространенных симптомов среди здоровых людей, он возникает у 1-6 %, среди пациентов, направляемых в хосписы и отделения паллиативной помощи, - у45 %. У больных, получающих опиоиды, без профилактического лечения запор развивается почти в 95 % случаев.
Классификация. Запор может быть временным (эпизодическим) и длительным (хроническим). Выделяют (J. Lannard-Jones) следующие разновидности хронического запора, связанные:
• с образом жизни;
• с воздействием внешних факторов;
• с эндокринными и метаболическими нарушениями;
• с неврологическими факторами:
- связанные с гастроэнтерологическими заболеваниями;
- связанные с патологией аноректальной зоны.
Причины запора у пациентов, нуждающихся в паллиативной помощи:
• снижение физической активности: иммобилизация, слабость, невозможность самостоятельного посещения туалета;
• нарушение питания: уменьшение приема пищи, щадящая диета (с низким содержанием растительных волокон и клетчатки), анорексия/кахексия;
• дегидратация: недостаточное потребление жидкости, увеличение потери жидкости (рвота, полиурия, избыточное потоотделение);
• нарушение моторики кишечника: невозможность обеспечения нормального внутрибрюшного давления, тазовые расстройства, кишечная непроходимость;
• метаболические расстройства: гиперкальциемия, гипокалиемия;
• прием лекарственных препаратов: опиоиды, диуретики, антихолинергические препараты, ингибиторы 5НТ3-рецепторов, аналоги соматостатина, антагонисты кальция, антациды, препараты железа;
• депрессия.
Обследование. Необходимо провести тщательный сбор жалоб и анамнеза. Поставить диагноз запора позволяет наличие двух из перечисленных клинических проявлений и более:
• частота стула реже 3 раз в нед;
• длительный и многоэтапный акт дефекации, требующий дополнительных потужных усилий;
• плотная консистенция кала;
• отхождение кала небольшими порциями («овечий» кал);
• ощущение неполного опорожнения;
• ощущение препятствия опорожнению;
• необходимость ручного пособия для эвакуации кала.
В первую очередь следует исключить острую кишечную непроходимость: почти у всех больных с полной кишечной непроходимостью наблюдаются тошнота и рвота, кроме того, выявляются абдоминальная висцеральная боль (спастического характера), вздутие живота, отсутствие кишечных шумов, тимпанический звук при перкуссии живота, шум плеска, отсутствие отхождения газов. Следует исключить такие причины запора, как сахарный диабет, гипотиреоз, системная склеродермия, болезнь Паркинсона, заболевания аноректальной области, а также возможные осложнения запора: боль в животе или усиление хронической боли у пациентов с опухолями брюшной полости и забрюшинного пространства, вздутие живота, абдоминальный дискомфорт, тошнота и рвота, диарея «переполнения» (парадоксальная диарея), геморрой и анальные трещины, задержка мочи.
Каловый завал. Клинические проявления калового завала: длительный запор, боли в животе, дискомфорт в области прямой кишки, парадоксальная диарея, недержание кала, тошнота, рвота, поллакиурия, недержание мочи.
Непосредственное обследование больного. Оценивают нутритивный статус пациента, состояние кожных покровов (бледность, сухость, расправление кожной складки), при исследовании живота обращают внимание на наличие пальпируемой опухоли или каловых масс, вздутия, напряжения, проводят аускультацию живота. Всем больным обязательно выполняют пальцевое исследование прямой кишки. Также необходимо оценить неврологический статус.
Лабораторно-инструментальные исследования. Проводятся в зависимости от наличия клинических показаний и обычно включают общий анализ крови, определение кальция, калия, глюкозы, креатинина и ТТГ. В некоторых случаях для оценки степени тяжести запора необходимо провести рентгенографию органов брюшной полости с определением «индекса запора». Для этого оценивают количество каловых масс в каждом квадранте в соответствии со следующей шкалой и складывают полученные баллы:
0 - нет каловых масс;
1 - каловые массы занимают менее 50 % просвета кишки;
2 - каловые массы занимают более 50 % просвета кишки;
3 - каловые массы полностью занимают просвет кишки.
При сумме баллов >7 речь идет о тяжелом запоре, требующем неотложного лечения.
Лечение
Методы лечения запора:
• слабительные, увеличивающие объем содержимого кишечника (клетчатка);
• размягчающие, осмотические (лактулоза, сульфат магния), раздражающие (сенна, бисакодил) слабительные и детергенты (докузат натрия);
• прокинетики (метоклопрамид, цизаприд);
• клизмы;
• агонисты 5-НТ4-рецепторов.
Классификация слабительных средств представлена в табл. 7.8.
Профилактика. Общие меры заключаются в обеспечении достаточного поступления жидкости (1,6-2,0 л), поощрении физической активности (в зависимости от переносимости). Увеличение содержания в пищевом рационе клетчатки и растительных волокон, как правило, плохо переносится пациентами, поэтому необходим индивидуальный подход.
Больные, получающие опиоиды. При начале терапии опиоидами необходимо одновременно обеспечить достаточную пероральную гидратацию и начать комбинированную терапию: препараты сенны (1-2 таблетки) + докузат натрия (100 мг) 2 раза в день, если в течение суток стула не будет, добавить на ночь бисакодил 10 мг (при отсутствии стула принять бисакодил утром). В дальнейшем дозы препаратов титруют до обеспечения нормальной работы кишечника (обычно достаточно назначить препараты сенны - по 2-4 таблетки 2 раза в сутки).
Установившийся запор. При отсутствии стула в течение 3 сут и более возникает необходимость в клизме и назначении ректальных свечей.
Полная ампула прямой кишки:
• мягкие каловые массы - 2 свечи с бисакодилом;
• плотные каловые массы - 1 глицериновая свеча + 2 свечи с бисакодилом;
• при отсутствии эффекта - ретенционная клизма с растительным маслом.
Пустая ампула прямой кишки: на ночь - ретенционная клизма с растительным маслом, утром - высокая клизма с колоксилом.
Пациенты, получающие опиоиды: сульфат магния или лактулоза (30-60 мл 2-4 раза в сутки); фосфорно-содовая клизма.
Следует избегать длительного приема осмотических слабительных (возможны нежелательные водно-электролитные расстройства) и лактулозы (приводит к вздутию живота).
Таблица 7.8. Классификация слабительных средств
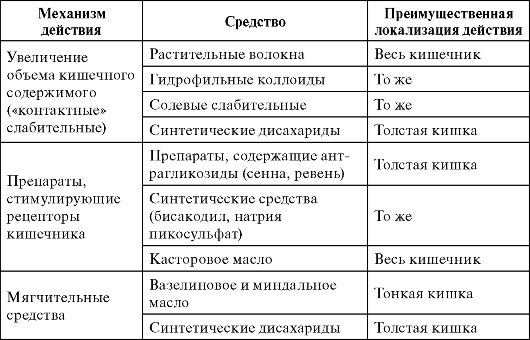 Диарея
Диарея
Диарея (частота стула >3 раза в сутки при объеме кала не менее 200 г в сутки) встречается у 4-5 % взрослого населения западных стран; у пациентов, нуждающихся в паллиативной помощи, ее частота возрастает до 10 %.
Классификация. Выделяют острую инфекционную диарею (до 2 нед) и хроническую диарею (>4 нед).
Острая инфекционная диарея
• Распространенная диарея (или диарея путешественников).
• Нозокомиальная диарея (начало не ранее чем через 3 дня после госпитализации).
• Персистирующая диарея (более 7 дней).
• Диарея при иммунодефиците. Хроническая диарея
• Заболевания толстой кишки (онкологические и воспалительные).
• Воспалительные заболевания тонкой кишки.
• Мальабсорбция.
• Мальдигестия (вследствие внешнесекреторной недостаточности поджелудочной железы).
• Расстройства моторики кишечника.
• Дисбактериоз.
• Артифициальная диарея (на фоне приема слабительных).
• Парадоксальная диарея (диарея переполнения при запоре). Обследование. Необходимо собрать анамнез и жалобы для установления:
а) органического или функционального характера диареи;
б) механизма диареи (воспалительный, секреторный, моторный, мальабсорбция);
в) специфических форм диареи.
При обследовании больного следует обратить внимание на семейный анамнез, наличие перенесенных операций на органах брюшной полости, панкреатита, сахарного диабета, употребление лекарственных препаратов (слабительных, противоопухолевых). Лабораторные исследования определяются клиническими показаниями и обычно включают общий анализ крови, определение СОЭ, С-реактивного белка, биохимический анализ крови (креатинин, глюкоза, кальций, калий, железо), показатели функции печени и ТТГ.
Лечение
Меры общего порядка. Регидратация, диета (бананы, рис, яблочный сок и сухари), белое куриное мясо, вареные яйца. Овощи, особенно кабачки и капусту, следует исключить из рациона.
Лекарственная терапия. Лекарственная терапия диареи в зависимости от причин представлена в табл. 7.9.
Таблица 7.9. Лечение диареи
Причина диареи I Лечение
Антибиотики широкого спектра действия (клиндамицин, цефалоспорины, пенициллин)
Метронидазол, ванкомицин
Окончание табл. 7.9
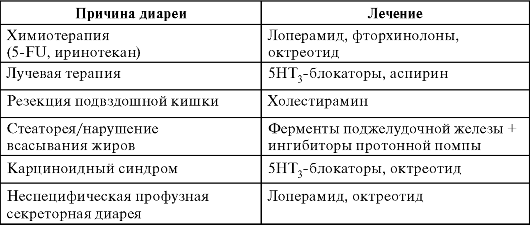 Коррекция конституциональных симптомов
Коррекция конституциональных симптомов
Слабость
Слабость - один из самых распространенных симптомов у пациентов, нуждающихся в паллиативной помощи; она наблюдается, по разным оценкам, в 69-96 % случаев.
Диагностические критерии. Перечисленные ниже симптомы наблюдались в прошлом месяце ежедневно или почти ежедневно в течение не менее 2 нед:
• значительная слабость, уменьшение энергичности, повышенная необходимость в отдыхе, не пропорциональная изменению уровня активности;
• 5 из перечисленных признаков или более:
- жалобы на генерализованную мышечную слабость или тяжесть в конечностях;
- снижение концентрации внимания;
- снижение мотивации или интереса к происходящему в повседневной жизни;
- нарушение сна;
- сон не приносит отдыха и восстановления сил;
- выраженное эмоциональное восприятие собственной слабости;
- трудности в выполнении повседневной активности;
- нарушение кратковременной памяти;
- постнагрузочное недомогание продолжительностью несколько часов.
Основные причины слабости у онкологических больных:
• первичные факторы: злокачественное новообразование, хроническая боль, интоксикация, анемия;
• побочные эффекты лечения;
• психологические факторы: депрессия, тревога, нарушение сна;
• метаболические факторы: похудение, изменение нутритивного статуса, нарушение водного и электролитного баланса;
• снижение общего уровня физической активности, детренированность;
• сопутствующие заболевания.
Обследование. Включает в себя сбор жалоб и анамнеза с акцентом на оценке выраженности слабости, временных параметров (начало, длительность, особенности течения, распределение в течение суток), выявление провоцирующих и усугубляющих, а также улучшающих состояние факторов. Необходимо выявить потенциально устранимые причины слабости, оценить неврологический (нейропатия) и психический (депрессия) статус. Объем лабораторных и инструментальных исследований определяется в зависимости от клинических показаний. Выраженность слабости и ее общее влияние на состояние пациента можно оценить с помощью распространенного краткого опросника для оценки слабости.
Краткий опросник для оценки слабости (Brief Fatigue Inventory)
1. Пожалуйста, оцените выраженность слабости, обведя кружком цифру, в наибольшей степени отражающую Ваше самочувствие в настоящий момент:
0 123456789 10
Нет Максимально
слабости вообразимая
2. Пожалуйста, оцените выраженность слабости, обведя кружком цифру, в наибольшей степени отражающую Ваше обычное самочувствие в течение последних суток:
слабость
0 1
Нет
слабости
2
3
4
5
6
7
8
9
10
Максимально
вообразимая
слабость
3. Пожалуйста, оцените выраженность слабости, обведя кружком цифру, в наибольшей степени отражающую Ваше наихудшее самочувствие в течение последних суток:
0 123456789 10
Нет Максимально
слабости вообразимая
слабость
4. Пожалуйста, обведите кружком цифру, которая в наибольшей степени отражает, насколько слабость мешала Вам на протяжении последних суток:
A. Общая активность
0 123456789 10
Не Полностью
мешает мешает
Б. Настроение
0 123456789 10
Не Полностью
мешает мешает
B. Передвижение
0 123456789 10
Не Полностью
мешает мешает
Г. Нормальная работа (как за пределами дома, так и по дому)
0 123456789 10
Не Полностью
мешает мешает
Д. Общение/отношения с другими людьми
0 123456789 10
Не Полностью
мешает мешает
Е. Удовольствие от жизни
0 123456789 10
Не Полностью
мешает мешает
Лечение
Общие принципы лечения
• Устранение или коррекция модифицируемых причин слабости:
- боль: адекватная аналгезия;
- депрессия: антидепрессанты (ингибиторы обратного захвата серотонина, вторичные трициклические амины, бупропион);
- анемия: препараты железа, гемотрансфузии, эритропоэтин;
- расстройства сна: снотворные;
- электролитные расстройства: коррекция нарушений.
• Немедикаментозное лечение:
- обучение пациента;
- индивидуальный режим физической нагрузки;
- изменение режима активности и отдыха;
- поведенческая терапия;
- адекватное питание и гидратация.
• Симптоматическая лекарственная терапия:
- психостимуляторы;
- кортикостероиды (малые дозы).
• Слабость, рефрактерная к лечению:
- эмпирическая терапия (ингибиторы обратного захвата серотонина, амантадин).
Лимфедема
Вторичная лимфедема (в отличие от первичной, которая является наследственным заболеванием) развивается вследствие нарушения целостности лимфатических путей или их обструкции (в результате хирургического вмешательства, травмы, воспаления или злокачественного роста). Наиболее частой причиной вторичной лимфедемы у жителей Северного полушария являются злокачественные новообразования и последствия их лечения. Частота развития вторичной лимфедемы составляет 6-30 % у пациенток с леченым раком молочной железы, 1-47 % у пациентов с опухолями тазовых органов, 22-56 % у пациентов с опухолями головы и шеи.
Классификация. Клиническая классификация лимфедемы представлена в табл. 7.10.
Обследование. На ранних стадиях отличить вторичную лимфедему от других состояний, сопровождающихся отечным синдромом, достаточно трудно. По мере прогрессирования появляются клинические признаки нарушения лимфатического дренажа:
Таблица 7.10. Клиническая классификация лимфедемы (по Миллеру)
• 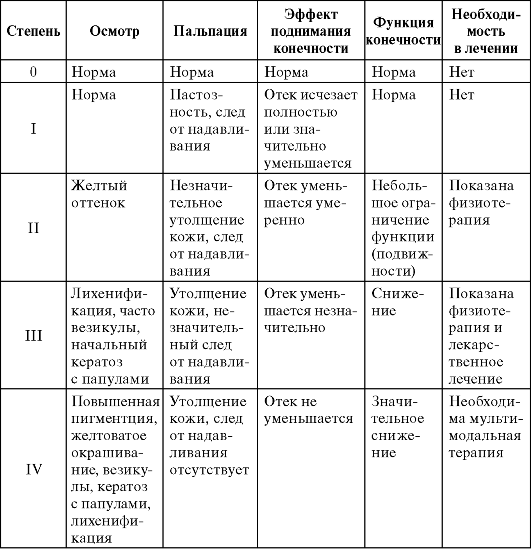 изменения кожи в виде «кожуры апельсина» (peau d'orange);
изменения кожи в виде «кожуры апельсина» (peau d'orange);
• положительный симптом Стеммера - невозможность собрать кожную складку над вторым пальцем стопы.
В рамках дифференциального диагноза необходимо исключить венозную обструкцию, тромбоз, проявления сердечной недостаточности. Дополнительно для подтверждения нарушения лимфатического дренажа применяют прямую и непрямую лимфографию, лимфокапилляроскопию, а также УЗИ, КТ и МРТ.
Нередко довольно плавное течение заболевания прерывается острыми воспалительными эпизодами, связанными со стрептококковой инфекцией и сопровождающимися покраснением, повышением локальной температуры и болью. Классическая флегмона кожи, вызванная стафилококковой инфекцией, практически не встречается. Крайне редко течение заболевания осложняется развитием лимфоангиосаркомы.
Оценка симптоматики. Для оценки динамики клинических проявлений используют несколько параметров:
• степень лимфедемы (см. табл. 7.10);
• окружность конечности;
• индекс кожной складки (ИКС), который рассчитывают по формуле:
(ИКС - ИКС ) / ИКС χ 100,
ν пор неги ' неп '
где ИКСпор - индекс кожной складки пораженной конечности; ИКСнеп - непораженной конечности.
Лечение
Нелекарственные методы лечения
Общие меры: ношение бандажа (обычно многослойного), компрессионные повязки (перчатки, носки, гольфы, чулки), физические упражнения, тщательный уход за кожей.
Физиотерапия: простой лимфодренаж, мануальный лимфодренаж, а также интермиттирующая пневматическая компрессия, тепловые процедуры и УЗ-терапия. Положительный эффект в некоторых случаях достигается с помощью чрескожной электростимуляции нервных волокон.
Хирургическое лечение обычно проводится в случае неэффективности других методов терапии. Принципиально различают 2 вида операций:
• микрохирургические операции (создание лимфатико-лимфатических, лимфатико-венолимфатических, лимфатико-венозных и нодально-венозных анастомозов);
• расширенные вмешательства (частичное или полное удаление лимфедематозной эпифасциальной ткани).
Лекарственная терапия. Применяются следующие группы препаратов (табл. 7.11):
Таблица 7.11. Лекарственная терапия лимфедемы
 Кахексия
Кахексия
Синдром кахексии/анорексии - один из наиболее распространенных у онкологических пациентов (у 70 % - в терминальной фазе) и прямо или косвенно является причиной смерти 5-23 % больных.
К наиболее простым критериям кахексии/анорексии относятся критерии North Central Cancer Treatment Group (NCCTG):
• уменьшение массы тела более чем на 2 кг в течение предшествующих 2 мес и (или) расчетное суточное потребление <20 кал/кг;
• желание пациента улучшить аппетит и увеличить массу тела;
• прибавка массы тела произведет, по мнению врача, положительный эффект.
Кахексию следует заподозрить при непроизвольном уменьшении массы тела более чем на 5 % от исходной (до заболевания) в течение 6 мес и на 10 % у пациентов с ожирением.
Обследование. Оценка состояния пациента основывается на анализе следующих данных.
Анамнез: определение факторов, приводящих к недостаточности питания, в том числе связанных с противоопухолевым лечением (табл. 7.12, 7.13), анализ динамики потери массы тела, аппетита, желудочно-кишечных симптомов, диеты и медикаментозной терапии.
Таблица 7.12. Нутриционные последствия радикальной резекции органов пищеварительного тракта
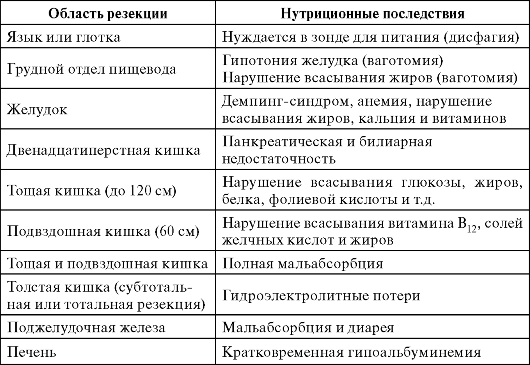 Таблица 7.13. Нутриционные последствия, связанные с лучевой терапией
Таблица 7.13. Нутриционные последствия, связанные с лучевой терапией
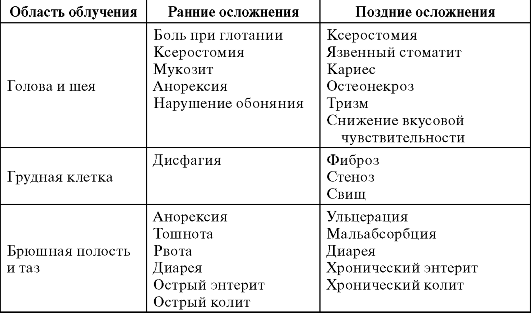 Осмотр: признаки
нарушения физических и психических функций, антропометрия с
определением массы тела, индекса массы тела (ИМТ; норма - 21-25 кг/м2; возможное истощение - 18-20 кг/м2; отчетливое истощение -<18 кг/м2; предельное -<16 кг/м2),
определение окружности плеча, толщины кожно-жировой складки над
трицепсом, потеря подкожного жира, мышечной массы, отек крестца, асцит.
Осмотр: признаки
нарушения физических и психических функций, антропометрия с
определением массы тела, индекса массы тела (ИМТ; норма - 21-25 кг/м2; возможное истощение - 18-20 кг/м2; отчетливое истощение -<18 кг/м2; предельное -<16 кг/м2),
определение окружности плеча, толщины кожно-жировой складки над
трицепсом, потеря подкожного жира, мышечной массы, отек крестца, асцит.
Лабораторные исследования: общий анализ крови (анемия), абсолютное число лимфоцитов, сывороточный альбумин, трансферрин, креатинин, азот мочевины, С-реактивный белок.
Следует исключить потенциально устранимые или корригируемые причины снижения массы тела: боль, слабость, психологические факторы (депрессия, психогенная анорексия), особенности диеты (невкусная пища, неадекватная калорийность), заболевания ротовой полости, дисфагия, тошнота (рвота), мальабсорбция, сопутствующие тяжелые соматические заболевания.
Лечение
Немедикаментозная терапия
Гиперкалорийное питание; при выборе пищи предпочтение отдается пожеланиям пациента. Влияние искусственного питания на многие нутриционные параметры достаточно ограничено. Общепринятый режим включает: около 30-35 ккал/кг в сутки и 1-2 г аминокислот кг/сут; 30-35 % от энергетической ценности пищи покрывается за счет жиров. Домашнее полное парентеральное питание является рациональным выбором для пациентов с далеко зашедшим опухолевым процессом при следующих специфических критериях:
• наличие дисфагии и хронической обструкции ЖКТ;
• средняя ожидаемая продолжительность жизни превышает 2 мес;
• адекватный контроль главных, не относящихся к питанию симптомов;
• отсутствие поражения жизненно важных органов (мозг, легкие, печень и т.д.).
Лекарственная терапия
В настоящее время для лечения кахексии (анорексии) применяют несколько групп препаратов.
А. Ингибиторы образования (высвобождения) цитокинов и других
биологически активных факторов. Б. Прокинетики.
В. Блокаторы цикла Кори.
Г. Блокаторы истощения жировой ткани.
Д. Блокаторы истощения мышечной ткани.
Е. Стимуляторы аппетита.
Ж. Антидепрессанты.
Препараты 1-го ряда: глюкокортикоиды (дексаметазон) (Е, А), прогестероны (мегестрола ацетат) (Е, А).
Препараты 2-го ряда: метоклопрамид (Б, Е), эйкозапентаеновая кислота (Г, Д, А), мелатонин (А), талидомид (А), Р2-агонисты (Д), НПВП (А, Е), анаболические стероиды (Д), пентоксифиллин (А), гидразина сульфат (В).
Вопросы для самоконтроля
1. Приведите классификацию методов лечения в онкологии.
2. Назовите виды хирургических операций.
3. Охарактеризуйте термины «операбельность» и «резектабельность».
4. Раскройте значение радикализма хирургического лечения в онкологии, укажите принципы абластики, антибластики, футлярности, зональности.
5. Дайте определение циторедуктивных и симптоматических операций.
6. В чем заключается главная задача лучевой терапии?
7. Дайте определение разовой и суммарной очаговой дозы.
8. Перечислите методы лучевой терапии по способу распределения дозы во времени.
9. Назовите основные принципы лучевой терапии злокачественных образований.
10. Определите показания и противопоказания к проведению лучевой терапии.
11. Каковы функции радикальной, паллиативной и симптоматической лучевой терапии?
12. Назовите методы лучевой терапии по способу подведения доз к опухоли.
13. Перечислите задачи пред- и послеоперационной лучевой терапии.
14. Укажите факторы, влияющие на радиочувствительность тканей и злокачественных опухолей.
15. При каких методах радиомодификации реализуется кислородный эффект?
16. Дайте определение понятия «химиотерапия злокачественных опухолей».
17. Назовите злокачественные новообразования, которые могут быть принципиально излечены более чем в 50 % случаев с помощью химиотерапии.
18. Назовите опухоли, малочувствительные к химиотерапии.
19. Охарактеризуйте критерии оценки результатов лекарственного лечения.
20. Назовите основные виды химиотерапии.
21. Расскажите об основных принципах и задачах химиотерапии.
22. Как подразделяются осложнения химиотерапии по срокам возникновения?
23. Перечислите противопоказания к проведению химиотерапии.
24. Как подразделяются цитостатики по механизму действия и происхождению?
25. Как определяется понятие «боль» Международной ассоциацией по изучению боли?
26. В чем причины острого и хронического болевых синдромов?
27. Чем отличается хронический болевой синдром от острого?
28. Какие типы боли при раке различают и каковы причины их возникновения?
29. Какие существуют методы оценки интенсивности боли и эффективности болеутоления? Расскажите о них.
30. Охарактеризуйте механизм действия опиатов и других центральных анальгетиков.
31. Охарактеризуйте механизм анальгетического действия НПВП.
32. Укажите общие принципы фармакотерапии острых и хронических болевых синдромов.
33. Каковы принципы фармакотерапии острого болевого синдрома?
34. Каковы принципы фармакотерапии хронических болевых синдромов?
35. Охарактеризуйте тактику фармакотерапии согласно 3-ступенча- той схеме болеутоления (ВОЗ, 1989).
36. Какие лекарственные средства относят к коанальгетикам? Каковы принципы действия лекарств данной группы?
37. Расскажите о возможных осложнениях при фармакотерапии боли, об их профилактике и купировании.
38. Перечислите симптомы заболевания и способы их коррекции у онкологических больных.