Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев. 2010. - 920 с.
|
|
|
|
ГЛАВА 4 ПАТОГЕНЕЗ КЛИНИЧЕСКИХ СИМПТОМОВ
ПРЕДРАКОВЫЕ ЗАБОЛЕВАНИЯ
Проблема предболезни и раннего рака чрезвычайно актуальна в онкологии, так как позволяет предсказывать возможность развития онкологического заболевания, проводить его профилактику, а на ранних стадиях развития рака полностью излечивать его. Идея концепции о предраке состоит в том, что новообразование почти никогда не возникает в здоровом организме, каждому раку присущ «свой» предрак, а процесс перехода от нормальных клеток к сформированной опухоли имеет промежуточные этапы, которые можно диагностировать с помощью морфологических методов. Практическое значение учения о предраке состоит в том, что оно позволяет выделить группы повышенного риска возникновения рака того или иного органа и проводить углубленные систематические наблюдения за лицами этой группы. На сегодняшний день стратегия всей системы борьбы с раком основана на предупреждении, выявлении и лечении предраковых состояний и ранних форм злокачественных новообразований.
Факультативный и облигатный предрак
Предрак, или предраковое заболевание - состояние, которое переходит в рак с большей степенью вероятности, чем в основной популяции. Однако наличие предракового фона еще не говорит о том, что он с фатальной неизбежностью перейдет в рак. Малигнизация при состоянии, именуемом предраком, наблюдается в 0,1-5 %.
Спектр предраковых состояний необычайно широк. К ним относятся практически все хронические воспалительные специфические и неспецифические процессы. Например, в желудке это - хронический гастрит различной этиологии, в том числе в желудке, резецированном по поводу язвенной болезни; в легких - хронический
бронхит; в печени - хронический гепатит и цирроз; в желчевыводящих путях - холелитиаз; дисгормональные процессы в молочной железе - мастопатия; гиперпластический процесс в эндометрии - железистая гиперплазия; в шейке матки - эрозия и лейкоплакия; диффузный и узловой зоб в щитовидной железе; дистрофические процессы, вызванные нарушением обмена веществ, и дискератозы (крауроз вульвы); лучевые дерматиты и повреждения тканей после УФ-облучения и ионизирующей радиации; механические повреждения, сопровождающиеся хроническими раздражениями слизистых оболочек (зубные протезы, пессарии, травмы; химические агенты, вызывающие профессиональный дерматит, ожоги слизистой оболочки); вирусные заболевания (папилломавирусная инфекция в шейке матки); дизонтогенетические - аномалии первичной закладки органов (тератомы, гамартомы, боковые кисты шеи - дериваты жаберных дуг); доброкачественные опухоли (аденоматозные полипы желудка и толстой кишки, нейрофибромы); паразитарные заболевания (описторхоз и др.).
Больные с предраковыми состояниями находятся под наблюдением врачей общей лечебной сети (в соответствии с локализацией заболевания - у терапевтов, гастроэнтерологов, гинекологов, ЛОРспециалистов и др.), а лечение предраковых заболеваний является профилактикой рака. При этом назначают антибактериальные и противовоспалительные препараты, витамины, микроэлементы, производят коррекцию гормонального и иммунологического статуса.
К предраку относят предраковые состояния - факультативный предрак и предраковые условия - облигатный предрак. К раннему раку относят прединвазивный рак, или carcinoma in situ, и ранний инвазивный рак - микрокарциному. Таким образом, при ранней онкологической патологии можно выделить 4 последовательные фазы морфогенеза рака: I - предраковые состояния - факультативный предрак; II - предраковые условия - облигатный предрак; III - прединвазивный рак - carcinoma in situ и IV - ранний инвазивный рак (Петерсон Б.Е., Чиссов В.И., 1985).
К I фазе предрака - предраковым состояниям, или факультативному предраку - следует отнести различные хронические заболевания, сопровождающиеся дистрофическими и атрофическими изменениями тканей с включением регенераторных механизмов, дисрегенераторные процессы и метаплазию, приводящие к возникновению очагов пролиферации клеток, среди которых может возникнуть очаг опухолевого роста.
II фаза предрака - предраковые условия, или облигатный предрак. К ней относят дисплазию (dys - нарушение, plasis - образование), которая всегда возникает в недрах дисрегенераторного процесса и сопровождается недостаточной и неполной дифференцировкой стволовых элементов ткани, нарушениями координации между процессами пролиферации и созревания клеток.
Дисплазия
Дисплазию эпителия эксперты ВОЗ (1972) определили следующей триадой:
1) клеточная атипия;
2) нарушенная дифференцировка клеток;
3) нарушение архитектоники ткани.
Дисплазия не ограничивается лишь появлением клеток с признаками клеточной атипии, а характеризуется отклонениями от нормальной структуры всего тканевого комплекса.
В большинстве органов диспластический процесс развивается на фоне предшествующей гиперплазии (увеличение количества клеток), связанной с хроническим воспалением и дисрегенерацией. Но зачастую гиперплазия и дисплазия эпителия сочетаются с атрофией ткани. Это сочетание отнюдь не случайно, так как гиперплазия и атрофия имеют общие генетические механизмы, в которых участвуют гены, стимулирующие митотическую активность и запускающие пролиферацию клеток - c-myc и bcl-2, а также ген-супрессор p53, который блокирует пролиферацию клеток и инициирует апоптоз. Поэтому в одних случаях последовательная активация этих генов приводит к пролиферации клеток и дисплазии, в других - к апоптозу и атрофии клеток. При дисплазии обнаруживаются отчетливые изменения деятельности всех регуляторов межклеточных взаимоотношений: адгезивных молекул и их рецепторов, факторов роста, протоонкогенов и продуцируемых ими онкобелков.
Относительно некоторых органов для характеристики переходных предраковых изменений термин «дисплазия» не применяется. Так, для описания переходных этапов от нормальных к раковым пролифератам в предстательной железе используется понятие «интраэпителиальная неоплазия простаты» - PIN (prostatic intraepithelial neoplasia), для выстилки влагалищной порции шейки матки - CIN (cervical intraepithelial neoplasia), во влагалище - VaIN и вульвы - VIN. Для
эндометрия вместо терминов «cancer in situ» и «дисплазия» применяют термины «атипическая железистая гиперплазия» или «аденоматоз» и «железистая гиперплазия».
Чаще всего используется трехстепенная градация дисплазии: слабо выраженная (Д I), умеренно выраженная (Д II) и выраженная (Д III). При этом определяющим критерием степени дисплазии служит выраженность клеточной атипии. По мере нарастания степени дисплазии увеличиваются размеры ядер, отличаются их полиморфизм, гиперхромность, огрубление и комковатость хроматина, увеличение количества и относительных размеров ядрышек, усиление митотической активности. Со временем дисплазия может регрессировать, носить стабильный характер или прогрессировать. Динамика морфологических проявлений дисплазии эпителия в значительной мере зависит от степени ее выраженности и длительности существования. Слабая степень дисплазии практически не имеет отношения к раку; обратное развитие слабой и умеренной дисплазии наблюдается повсеместно. Чем выраженнее дисплазия, тем меньше вероятность ее обратного развития. Возможность перехода дисплазии в cancer in situ (которую можно рассматривать как крайнюю степень дисплазии) и, следовательно, в рак возрастает по мере усиления ее выраженности.
Дисплазия, или интраэпителиальная неоплазия, тяжелой степени расценивается как облигатный (угрожающий) предрак - стадия ранней онкологической патологии, которая рано или поздно трансформируется в рак. Морфологические проявления выраженной дисплазии очень напоминают рак, который не обладает инвазивными свойствами, что в основном соответствует молекулярно-генетическим изменениям в клетках. Поэтому при облигатном предраке необходимы комплекс профилактических мер и даже радикальное лечение, а больные облигатным предраком должны состоять на учете у онколога. Основные этапы динамики дисплазии многослойного плоского эпителия и переход ее в рак представлены на рис. 4.1:
а) нормальный эпителий. Четкая стратификация слоев. Герминативная зона эпителия - базальный слой темных клеток незначительной ширины. Ее клетки всегда обладают довольно высокой митотической активностью; БМ - мембрана;
б) слабо выраженная дисплазия эпителия шейки матки. Герминативная зона расширена примерно до 1/3 эпителиального пласта и замещена пролиферирующими клетками базального эпителия;
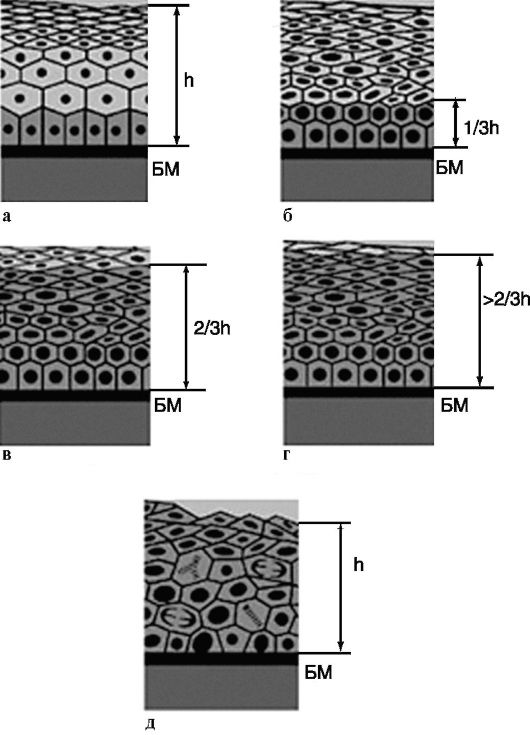 Рис. 4.1. Основные этапы динамики дисплазии многослойного плоского эпителия и переход ее в рак:
Рис. 4.1. Основные этапы динамики дисплазии многослойного плоского эпителия и переход ее в рак:
а - нормальный эпителий; б - слабовыраженная дисплазия эпителия; в - умеренно выраженная дисплазия; г - выраженная дисплазия; г - cancer in situ
в) умеренно выраженная дисплазия многослойного плоского эпителия шейки матки. От У2 до 2/3 высоты эпителиального пласта замещено клетками герминогенной зоны. Наряду с высокой митотической активностью встречаются патологические митозы. Клеточная атипия выражена;
г) выраженная дисплазия. Более 2/3 высоты эпителиального пласта замещено клетками базального слоя. Наблюдаются клеточная атипия, патологические митозы. В верхнем ряду сохраняется пласт зрелых клеток. БМ сохранена;
д) cancer in situ. Вся толща эпителиального пласта замещена незрелыми пролиферирующими клетками типа базальных с клеточной атипией, патологическими митозами. БМ сохранена.
Если в отношении эпителия понятие «предрак» - это отчетливая дефиниция, то в других тканях выделить облигатные предзлокачественные состояния невозможно. Так, в настоящее время широко обсуждается понятие «предлейкоз». Под этим и близкими к нему терминами (миелодиспластический синдром, гемопоэтическая дисплазия, дисгемопоэз) объединяются различные типы нарушения кроветворения, нередко предшествующие развитию лейкоза. К ним относят цитопению, рефрактерную анемию, в том числе без бластоза или с небольшим бластозом костного мозга, признаки неэффективного эритропоэза, длительный неясный моноцитоз, транзиторный лейкоцитоз и др. Как предлейкоз сегодня рассматривается миелодисплазия костного мозга, которая может развиваться после массивной химиотерапии некостномозговых, злокачественных опухолей с последующей аплазией костного мозга. Любая опухоль образуется из так называемого опухолевого зачатка. Подобные опухолевые зачатки наблюдаются только в условиях эксперимента, обнаружить их в клинической практике не удается.
ПОНЯТИЕ О РАННЕМ РАКЕ.
ФОРМЫ РОСТА ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Следующей, III, стадией морфогенеза опухоли является стадия неинвазивного внутриэпителиального или неинвазивного рака. При этом опухолевый процесс ограничен лишь эпителиальным пластом при сохраненной целостности базальной мембраны, в пределах которого клетки имеют все признаки катаплазии, свойственные раку. А опухоль распространяется лишь поверхностно вдоль эпителиального пласта. Такие изменения еще называют внутриэпителиальным раком, или carcinoma in situ. Внутриэпителиальный рак выделяется в самостоятельную морфогенетическую форму опухоли, которую еще называют компенсированным раком.
Термин «carcinoma in situ» отражает динамическое равновесие между онкогенными тенденциями и защитными реакциями организма. Как правило, 5-летняя выживаемость пациентов с carcinoma in situ составляет 100 %. Окончательное подтверждение диагноза carcinoma in situ основано на тщательном гистологическом исследовании пораженной ткани и нередко - при использовании серийных срезов для полного исключения возможности инвазивного роста.
Carcinoma in situ представляет собой бессосудистую фазу развития злокачественной опухоли. Обмен веществ в агрегатах таких злокачественных клеток поддерживается диффузией, а жизнедеятельность опухоли на этом этапе направлена только на выживание клеток. В этот период устанавливается равновесие между пролиферацией клеток в опухолевом зачатке и их гибелью. Данная стадия может существовать достаточно долго - 10 лет и более. Критическим моментом при формировании злокачественной опухоли и переходе из внутриэпителиального рака является начало инвазивного роста.
Следует заметить, что термин «carcinoma in situ» применим лишь для ограниченного количества эпителиальных опухолей, в основном для многослойного плоского эпителия, переходного эпителия уротелия, эпителия долек молочной железы. Этот термин совершенно неприменим для тканевых комплексов, таких, как слизистая оболочка желудка и кишечника, эндометрия. Для слизистой оболочки эндометрия адекватным термином является «атипическая гиперплазия эндометрия», или «аденоматоз» желудка - неинвазивный рак, когда опухолевые клетки расположены в пределах стромы слизистой оболочки.
Четвертая стадия морфогенеза опухоли - ранний рак (early carcinoma), или микрокарцинома. При этом опухоль локализована, метастазы отсутствуют. «Микрокарцинома» - понятие клиникоморфологическое, основанное на тщательном изучении удаленного во время операции препарата. Микроскопический инвазивный (минимальный) рак - злокачественная эпителиальная опухоль, проросшая за пределы базальной мембраны на глубину до 0,3 см, что в среднем составляет одно поле зрения малого увеличения микроскопа. Это, как правило, бессосудистая опухоль (рис. 4.2). Однако, учитывая, что количество клеток в такой опухоли может превышать критические размеры 1-2 мм, когда опухоль может пронизываться сосудами, в ряде случаев отнести данный тип новообразования к «раннему раку» нельзя. Однако высокий уровень 5-летней выжи-
 Рис. 4.2. Схема морфологических проявлений рака in situ шейки матки с минимальной инвазией. Инвазивный плоскоклеточный рак. Переход cancer in situ в
микрокарциному. Инвазия опухолевых клеток через базальную мембрану.
Прорастание раковых клеток через базальную мембрану и инвазия в
подлежащую ткань. Разрушение и замещение опухолью предсущестующего
эпителия. Врастание в кровеносные и лимфатические сосуды. Характерна
клеточная атипия: клеточный и ядерный полиморфизм, высокая митотическая
активность, большое количество патологических митозов
Рис. 4.2. Схема морфологических проявлений рака in situ шейки матки с минимальной инвазией. Инвазивный плоскоклеточный рак. Переход cancer in situ в
микрокарциному. Инвазия опухолевых клеток через базальную мембрану.
Прорастание раковых клеток через базальную мембрану и инвазия в
подлежащую ткань. Разрушение и замещение опухолью предсущестующего
эпителия. Врастание в кровеносные и лимфатические сосуды. Характерна
клеточная атипия: клеточный и ядерный полиморфизм, высокая митотическая
активность, большое количество патологических митозов
ваемости позволяет расценивать эту форму как прогностически благоприятную стадию инвазивного рака.
При доказанном раннем инвазивном раке применяется стандартный объем хирургического лечения без дополнительной лучевой или химиотерапии. Вопрос об экономных, органосохраняющих операциях решается у каждого пациента индивидуально. Однако суживать объем хирургических операций допустимо лишь в онкологических учреждениях, имеющих специализированные отделения.
Опыт раннего выявления рака большинства локализаций (шейки матки, губы, кожи), соответствуя экспериментальным данным, подтверждает, что злокачественная опухоль возникает преимущественно на фоне предраковых состояний. Возникновение эпителиальных опухолей de novo, описанное в литературе, едва ли возможно, так как многие переходные этапы становления опухоли могут протекать латентно и быстротечно, сопровождаясь слабыми морфологическими и клиническими проявлениями. По мере углубления инвазии опухоли вероятность метастазирования увеличивается.
Сопоставляя структурные проявления различных стадий канцерогенеза, можно выделить следующие этапы формирования опухоли (Шабад Л.М., 1969):
1) предопухолевые пролифераты (гиперплазия);
2) доброкачественные опухоли;
3) дисплазия;
4) carcinoma in situ;
5) инвазивный рак.
Инвазивный плоскоклеточный рак. Прорастание раковых клеток через базальную мембрану и инвазия в подлежащую ткань. Разрушение и замещение опухолью предсуществующего эпителия. Врастание в кровеносные и лимфатические сосуды. Характерна клеточная атипия: клеточный и ядерный полиморфизм, высокая митотическая активность, большое количество патологических митозов.
Зачастую в этой цепочке может отсутствовать одно из звеньев, чаще - второе.
При росте опухоли и формировании метастазов исключительно важную роль играет образование сосудов - ангиогенез. Образование сосудов является одним из важных факторов, регулирующих процессы пролиферации опухолевых клеток, влияющих на прогрессию и спонтанную регрессию злокачественных новообразований. В 1971 г. J. Folkman выделил белковый фактор, который стимулирует деление клеток эндотелия, вызывает пролиферацию капилляров и способствует их врастанию из прилежащей неопухолевой ткани в опухоль. В настоящее время выделены и другие ангиогенные факторы белковой природы, которые могут продуцироваться опухолями, - как ускоряющие, так и ингибирующие образование сосудов.
К позитивным факторам, способствующим ангиогенезу, относят: ангиогенин, трансформирующий ростовой фактор, фактор роста эндотелия сосудов, фактор роста фибробластов, эпидермальный фактор роста, гранулоцитарно-макрофагальный колониестимулирующий фактор, фактор некроза опухоли, ИЛ-8. Эти факторы вызывают образование сосудов в опухолевом очаге за счет миграции в него эндотелиальных клеток из прилегающей соединительной ткани и последующего их деления. К негативным регуляторам, подавляющим образование сосудов, относятся: ангиостатин - компонент плазминогена, ингибитор хрящевой ткани, гепариназа, тканевой ингибитор протеиназ и др.
С началом ангиогенеза появляется возможность метастазирования опухоли, что в принципе возможно после того, как количество клеток достигнет 106, а размеры опухоли превысят 1-2 мм. В новообразованиях меньших размеров питательные вещества и кислород поступают в опухоль из окружающей ткани в ограниченном количестве посредством диффузии. Дальнейший рост опухоли зависит от образования сосудов, через которые клетки могли бы получать кислород и питательные вещества. Сразу после васкуляризации опухоли начинается быстрое, экспоненциальное размножение клеток. Питание васкуляризированной опухоли осуществляется за счет механизмов перфузии, что способствует ее росту и повышает возможность инвазии и метастазирования. Считается, что метастазирование возможно только начиная с этой фазы развития опухоли и уже с момента сосудообразования раковые клетки могут попадать в кровеносное русло. Прекращение по тем или иным причинам образования сосудов в опухоли способно на время остановить ее рост и перевести в «дремлющее» состояние, что может быть использовано для лечения опухолей.
Опухолевый рост остается одним из самых загадочных явлений природы. Несмотря на множество предложенных определений, ни одно из них не дает исчерпывающего представления об опухоли. Можно выделить лишь 3 основные группы признаков, свойственных новообразованиям:
1) приобретение клетками свойства «бессмертия» (иммортальности), способности делиться в бесконечном количестве генераций;
2) автономность клеточного роста;
3) атипия - своеобразие морфологических и функциональных свойств.
В какой-то мере опухолевый рост можно определить как нарушенную регенерацию, при которой клетки могут делиться неограниченное количество раз, приобретая свойство «бессмертия». Все опухоли происходят из камбиальных или герминативных клеток, служащих источником регенерации тканей, которые некоторые авторы называют еще стволовыми. В процессе дифференцировки опухолевые клетки приобретают сходство с тканями, из которых они развились. Практически все ткани организма могут быть источниками опухолевого роста.
Особенностью опухолевого роста является атипия - комплекс отличительных от нормальных тканей признаков. Выделяют структурную
и функциональную атипию. Функциональная атипия опухолевых клеток выражается в усилении анаэробного гликолиза - расщеплении глюкозы до лактата в присутствии кислорода. В опухолевых клетках активируется расщепление глюкозы по пентозофосфатному шунту и (или) анаэробному пути. Гликолиз протекает не только при отсутствии снабжения кислородом клетки, но и в его присутствии, что создает известную устойчивость опухолевых клеток к гипоксии. В опухолевой ткани гликолитические процессы преобладают над окислительными. Клетки новообразований содержат мало аэробных ферментных систем: цитохрома, каталазы. Все перестройки метаболизма в опухоли направлены на приспособление клеток к дефициту кислорода, который всегда сопровождает ее рост.
Гликолиз сопровождается накоплением молочной кислоты в тканях, что делает их сходными с эмбриональной тканью. По составу опухолевая клетка отличается от неопухолевой большим содержанием воды, ионов натрия и кальция, в меньшей степени - калия; значительно снижается концентрация магния. По сравнению с неопухолевой клеткой цитоплазма опухолевой клетки более богата белками, нейтральными жирами и фосфолипидами, холестерином, гликогеном, нуклеиновыми кислотами, недоокисленными продуктами обмена.
Структурная, или морфологическая, атипия опухоли выражается в нарушении гистотипической, цитотипической и ультраструктурной дифференцировки. Выраженность структурной атипии бывает различной не только в гистогенетически разных новообразованиях, но и в пределах одной и той же опухоли.
Тканевая атипия характеризуется нарушением порядка расположения клеток, свойственного для данной ткани и органа. Опухолевые клетки и их комплексы располагаются в виде беспорядочных, хаотично ориентированных комплексов и скоплений. Бесспорными признаками злокачественной опухоли являются инвазия опухолевых клеток (от лат. in vaza - в сосуд) за пределы органа, проникновение клеток в лимфатические и кровеносные сосуды и рост по периневральным щелям.
Клеточный, или цитологический, атипизм - это морфологические проявления опухолевого роста на уровне клетки. Он выражается в полиморфизме - изменении размеров и формы клеток. В ряде случаев злокачественной опухоли, наоборот, свойственна мономорфность клеток. Одним из проявлений клеточного атипизма является ядерный атипизм, который характерен преимуществен-
но для злокачественных опухолей. Ядерная атипия выражается в увеличении относительных размеров ядер, что проявляется увеличением ядерно-цитоплазматического соотношения, многочисленными фигурами деления и наличием патологических митозов. Полиморфизм ядер характеризуется разнообразием формы и размеров, изменением плотности окраски по сравнению с нормальным клеточным прототипом. Клеточный атипизм может быть различной степени выраженности, иногда он так значителен, что опухолевые клетки становятся непохожими на клетки исходной ткани и органа. При крайней степени морфологической катаплазии строение опухоли упрощается, и она становится монотонной по клеточному составу.
В клетках новообразований увеличивается количество свободных рибосом, не связанных с эндоплазматической сетью. Цитоскелет опухолевых клеток характеризуется дезорганизацией всех компонентов. В клетках неоплазмы, как правило, уменьшено количество митохондрий. Преобладают полиморфные, уродливые, крупные и гигантские формы этих органелл с нарушенной ориентацией и хаотичным расположением крист. Электронно-микроскопически ядра опухолевых клеток, как правило, имеют крайне сложную и причудливую конфигурацию, выглядят сегментированными и окружены большим количеством инвагинатов, которые имеют вид трубок и карманов, содержащих элементы цитоплазмы. В некоторых случаях они пористого вида и напоминают по строению губку. В ядрах обнаруживаются своеобразная дольчатость и изрезанность мембраны.
Название опухоли образуется из корня слова, обозначающего греческое или латинское наименование ткани, из которой она развилась, с добавлением окончания «ома» или слова «бластома» (в случае доброкачественности опухоли) и слов «карцинома», «рак», «саркома» (в случае злокачественного новообразования). Так, доброкачественные опухоли, производные гладкомышечной ткани, называются лейомиомами, сосудов - гемангиомами. Правда, бывают и исключения. Например, высокозлокачественная опухоль нейроэктодермального происхождения называется «нейробластомой». В ряде случаев для обозначения злокачественности опухоли перед названием ее гистогенетической принадлежности ставят прилагательное «злокачественная». Например, злокачественная опухоль производных потовых желез называется злокачественной акроспиромой, а опухоль зубных зачатков - злокачественной амелобластомой.
Несмотря на сходство всех признаков опухолевого роста, он настолько разнообразен, что дать общую схему строения опухолей, в которую укладывалось бы все разнообразие форм существующих новообразований, практически невозможно. Поэтому в клиникоанатомическом и клинико-физиологическом плане нельзя говорить об опухоли вообще. Своеобразие конкретной формы новообразования зависит от особенностей этиологии, гисто- и морфогенеза, локализации опухоли, ее распространенности.
По течению процесса и прогнозу опухоли в основном подразделяются на доброкачественные и злокачественные. К категории доброкачественных относят новообразования, имеющие благоприятный прогноз. Для них характерны медленный рост, отсутствие способности к метастазированию, инфильтрирующему росту, рецидивированию. Нередко они вообще могут прекращать рост, претерпевая инволюционные изменения.
Однако понятие доброкачественности является относительным. Например, доброкачественные опухоли тонкой кишки - лейомиомы больших размеров, сдавливающие петли, могут вызывать инвагинацию и некроз кишечника. Угрожать жизни больного также могут и доброкачественные опухоли, вызывающие эндокринные нарушения. Примером тому служат гормонально-активные аденомы надпочечников, паращитовидных желез.
Для злокачественных новообразований характерны относительно быстрый рост, способность к метастазированию и диссеминации, инвазия опухолевых клеток в прилежащие органы. В финале своего развития опухоль может разрушать жизненно важные органы и целые системы организма. Но понятие злокачественности, как и доброкачественности, также относительное. Некоторые злокачественные новообразования при том, что они способны к метастазированию, имеют более доброкачественное течение, обладая более низким метастатическим потенциалом и инвазивными свойствами. Так, аденокарциномы эндометрия имеют лучший прогноз, чем плоскоклеточный рак шейки матки. Плоскоклеточный рак легкого - более медленно развивающаяся форма, чем мелкоклеточный рак, который отличается очень агрессивным течением и рано метастазирует. Фолликулярный и папиллярный рак щитовидной железы даже при наличии отдаленных метастазов успешно лечится радиоактивным йодом и обладает лучшим прогнозом, чем другие типы рака этого органа - медуллярный и недифференцированный.
Подразделение опухолей на доброкачественные и злокачественные не всегда возможно. Поэтому отдельно выделяются новообразования с местно-деструирующим ростом и потенциально злокачественные. Для местно-деструирующих опухолей, как и для злокачественных, характерен инфильтрирующий рост, и даже после их радикального удаления зачастую развиваются рецидивы. Однако эти опухоли не обладают способностью к метастазированию. К этому типу относят базалиому (базально-клеточный рак) кожи, плеоморфную аденому слюнной железы (смешанную опухоль), десмоидные фибромы. В группу потенциально злокачественных включены опухоли, которые при морфологических признаках доброкачественности иногда могут метастазировать. Это - карциноиды тонкой кишки, гигантоклеточная опухоль кости (остеобластокластома), мукоэпидермоидная опухоль слюнной железы, гранулезоклеточная опухоль яичников.
Метастазирование - это многоступенчатый процесс массового отделения клеток опухоли, приобретения отторгнутыми клетками способности существовать вне поддержки первичного очага, уклоняться от «надзора» иммунной системы, проникать и закрепляться в новом месте, индуцируя опухолевый ангиогенез (рис. 4.3).
Трудной задачей является дифференциация истинных опухолей и реактивных состояний - компенсаторных гиперплазий. В первую очередь это относится к отграниченным гиперплазиям желез внутренней секреции, например, в корковом слое надпочечников, в щитовидной железе. Наиболее часто встречающиеся полипы желудка (гиперпластические) также не имеют отношения к опухолевому росту и представляют собой регенераторные пролифераты эпителия.
Инвазивные свойства опухоли и способность к метастазированию зависят от продукции опухолевыми клетками своеобразных протеолитических ферментов, разрушающих внеклеточный матрикс стромы органов, - нейтральных металлопротеаз (или протеингликаназ), действие которых сходно с эффектом гиалуронидазы, а также их активаторов и ингибиторов. Проявление инвазивных свойств опухоли в основном определяется динамическим равновесием между продукцией металлопротеаз и их ингибиторов. Литические ферменты дают возможность опухолевым клеткам прорастать нормальные ткани. Инвазивный рост происходит в первую очередь вдоль слабых мест, по щелям вдоль лимфатических и кровеносных сосудов, нервных стволов.
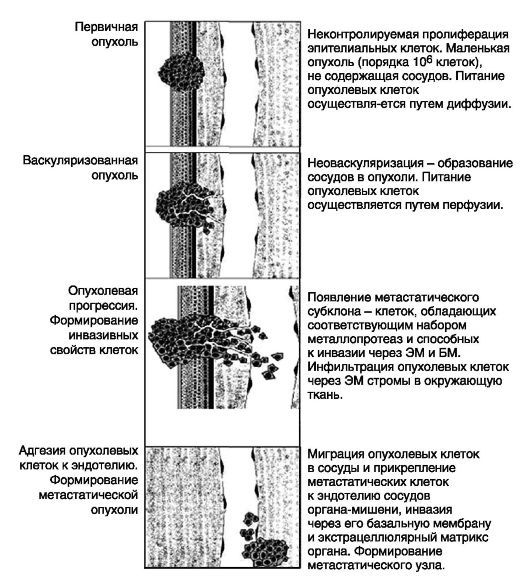 Рис. 4.3. Основные этапы метастазирования опухоли
Рис. 4.3. Основные этапы метастазирования опухоли
Оценка распространенности процесса по стадиям и системе TNM
Ведущим фактором, определяющим прогноз опухоли, является распространенность последней к моменту ее диагностики. По мере увеличения размеров злокачественной опухоли повышается вероятность метастазирования, и при определении прогноза течения
опухолевого процесса, выборе рациональной терапии, а также для единообразного учета и оценки отдаленных результатов лечения, кроме идентификации гистологического типа, степени дифференцировки или злокачественности опухоли, необходимо учитывать стадию новообразования. Такая система распространенности процесса - TNM - разработана Международным противораковым союзом. Основные характеристики опухоли, согласно классификации TNM, определяются глубиной инвазии первичного опухолевого узла в орган или окружающие ткани и выраженностью метастатического процесса.
В классификации TNM рассматриваются категории: Т (tumor - опухоль) - определяет местное распространение или степень инвазии первичного узла в органе и окружающих тканях; N (nodes - лимфатический узел) - означает выраженность регионарного метастазирования; М (metastases) - характеризует наличие отдаленных метастазов.
Категория Т:
Тх - скрытый рак (pccult carcinoma), первичная опухоль не может быть оценена, но имеет косвенные проявления, например к моменту диагностики имеются отдаленные метастазы. Категории ТО и Tis применяют для обозначения cancer in situ, т.е. неинвазивных опухолей.
В трубчатых и полых органах категория T1 означает инвазию в толщу слизистой оболочки и подслизистый слой, Т2 и Т3 - инвазию через мышечные слои, Т4 - прорастание через стенку органа.
Категория N:
Nx - неизвестно о наличии метастазов в регионарных лимфатических узлах;
N0 - метастазы в регионарные лимфатические узлы отсутствуют; N1, N2 или N3 - различная степень выраженности метастатического поражения регионарных лимфатических узлов.
Категория М:
Мх - неизвестно, существуют ли отдаленные метастазы; МО - отдаленные метастазы отсутствуют; M1 - имеются отдаленные метастазы.
Кроме стадии распространенности процесса учитывается и категория G - гистологическая дифференцировка опухолей: Ох - степень дифференцировки не может быть оценена;
Gl - высокая степень дифференцировки; G2 - средняя степень дифференцировки; G3 - низкая степень дифференцировки; G4 - недифференцированные опухоли.
Также разработана унифицированная система оценки стадии опухолевого процесса на материале, удаленном во время радикальной операции, - постхирургическая патогистологическая классификация pTNM. Однако критерии pТNМ могут применяться только лишь в том случае, если при хирургическом вмешательстве удалено определенное количество регионарных лимфатических узлов. В каждом конкретном случае заболевания злокачественным новообразованием могут быть различные сочетания pN.
Категория М может быть дополнена конкретными проявлениями метастазов: pul - легкое, per - брюшная полость, mar - костный мозг, bra - головной мозг, oss - кости, ski - кожа, ple - плевра, lym - лимфатические узлы, пер - печень, oth - другие. Например, М1(пер) или М2фш) - 1 метастаз в печени или 2 - в легких, а М1(пер1) (pul2) - одновременно 1 метастаз в печени и 2 - в легких.
Здесь нет необходимости приводить полную классификацию опухолей по TNM, так как с ней можно ознакомиться в специальных руководствах. В качестве примера приведем лишь принципы стадирования для рака желудка.
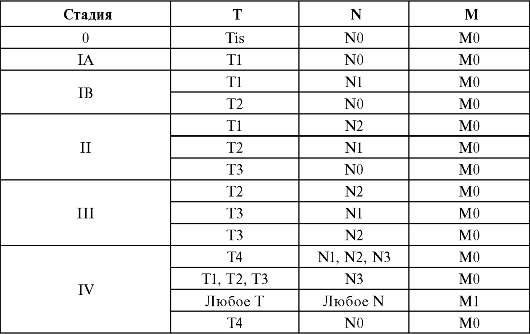
Стадийность рака желудка, согласно Международной классификации по системе ТNМ (1997), выглядит следующим образом. Согласно МКБ-10, рак желудка находится в рубрике С16:
Тх - недостаточно данных для оценки первичной опухоли;
ТО - первичная опухоль не определяется;
Tis - преинвазивная карцинома: интраэпителиальная опухоль без инвазии собственной пластинки слизистой оболочки (carcinoma in situ);
Tl - опухоль инфильтрирует слизистую оболочку и подслизистый слой;
Т2 - опухоль инфильтрирует мышечную оболочку до субсерозного слоя;
Т3 - опухоль прорастает серозную оболочку без инвазии в соседние органы;
Т4 - опухоль распространяется на соседние структуры; ? - недостаточно данных для оценки регионарных лимфатических узлов;
N0 - нет признаков метастатического поражения регионарных лимфатических узлов;
N1 - имеются метастазы в 1-6 регионарных лимфатических узлах;
N2 - имеются метастазы в 7-15 регионарных лимфатических узлах;
N3 - имеются метастазы более чем в 15 регионарных лимфатических узлах;
Мх - недостаточно данных для определения отдаленных метастазов;
М0 - отсутствие признаков отдаленных метастазов; M1 - имеются отдаленные метастазы.
Группировка рака желудка по стадиям
 ДОКЛИНИЧЕСКИЙ И КЛИНИЧЕСКИЙ
ДОКЛИНИЧЕСКИЙ И КЛИНИЧЕСКИЙ
ПЕРИОДЫ РАЗВИТИЯ РАКА
Опухоль без каких-либо клинических проявлений, как правило, развивается достаточно длительное время. Период доклинических проявлений злокачественного новообразования может продолжаться несколько лет, а предшествующие диспластические изменения - несколько десятилетий. Так, изучение предраковых состояний при
раке желудка показало, что длительность течения дисплазии до момента появления признаков начального рака составляет 10-15 лет. С момента появления первых раковых клеток в желудке до клинических проявлений опухоли с выраженной симптоматикой проходит в среднем 7-10 лет.
Опухолевая ткань, как и нормальная, состоит из пролиферирующей (фракция роста, или пролиферативный пул) и покоящейся субпопуляций клеток. Последнюю образуют непролиферирующие клетки, временно выходящие из клеточного цикла, сохраняющие способность делиться (фаза G0). Так, при раке молочной железы в фазах G0 и G2 может задерживаться примерно 5-40 % всей клеточной популяции. Доля опухолевых клеток, находящихся в периоде покоя, может быть незначительной, однако именно эти клетки резистентны к химиопрепаратам и действию лучевой терапии. Наличием таких «покоящихся» клеток и последующей их пролиферацией можно объяснить развитие рецидивов через значительный промежуток времени после удаления опухоли и существование «дремлющих» метастазов. Ионизирующее излучение и лекарственные химиотерапевтические средства действуют в основном на фракцию роста, т.е. все быстро растущие опухоли, в которых большая часть клеток находится в состоянии пролиферации (лейкозы, злокачественные лимфомы, хорионэпителиома матки, саркома Юинга), являются высокочувствительными к химиотерапевтическим воздействиям и облучению.
Скорость роста каждой конкретной опухоли индивидуальна и определяется тремя параметрами: продолжительностью клеточного цикла, величиной пролиферативного пула и количеством утраченных клеток. Решающую роль играют 2 последних фактора. Среднее время удвоения размеров солидных новообразований широко варьирует, но обычно составляет около 90 дней. При лейкозах этот показатель может достигать четырех дней.
Длительность биологического развития большинства новообразований максимальна в первых двух стадиях рака. Однако по мере увеличения размеров инвазивного рака скорость его роста замедляется, так как усиливается гибель клеток вследствие апоптоза и некроза, из-за недостаточного кровоснабжения и воздействия иммунологических факторов.
Для различия между возможной (когда отсутствуют клеточные потери) и действительной скоростью роста опухоли предложены
понятия потенциального и фактического времени удвоения опухоли. Данные В.М. Моисеенко и соавт. (1991) показывают, что фактическая скорость роста рака молочной железы в среднем почти в 23 раза меньше, чем могла бы быть при учете средней пролиферативной активности опухолевых клеток. Клеточные потери при этом составляют до 95,5 %.
Таким образом, морфогенез опухоли - это достаточно длительный процесс, который в некоторых тканях, преимущественно в эпителиальных, проявляется четкими морфологическими изменениями переходного типа от нормальных клеток к опухолевым. Это дает время для проведения диагностических мероприятий.
Точно предсказать переход предракового состояния в рак у конкретного пациента при использовании обычных методов исследования невозможно, так что дальнейший прогноз носит лишь вероятностный характер. Ответ на вопрос, разовьется ли опухоль у данного пациента, напрямую связан с особенностями генетических перестроек в клетках. Прогноз возникновения новообразования у конкретного индивидуума определяется не столько выраженностью структурных предопухолевых изменений, сколько наличием генетических изменений в клетках - определенных комбинаций экспрессированных онкогенов, генов-модификаторов и инактивированных генов-супрессоров, которые можно рассматривать как ранний маркер злокачественной опухоли - «молекулярный предрак».
Диагностика ранних форм злокачественных новообразований чрезвычайно важна. Однако выявление злокачественных новообразований на ранних этапах затрудняется тем, что основное время их развития протекает бессимптомно, а отчетливая симптоматика проявляется при распространенных и подчас запущенных формах рака. При клинической манифестации почти у 2/3 онкологических больных опухоль генерализована уже к началу лечения, хотя клинически метастазы не проявляются. Успешная диагностика злокачественных новообразований зависит от онкологической настороженности, тщательности обследования каждого пациента, обратившегося к врачу любой специальности. Для выявления новообразований необходимо знание симптомов ранних стадий злокачественных опухолей и предраковых заболеваний. В трудных и неясных случаях следует думать о возможности атипичного или осложненного течения злокачественных новообразований.
Патогенез клинических симптомов злокачественных новообразований. Основные клинические феномены рака
Клиническая симптоматика злокачественных новообразований характеризуется большим разнообразием и зависит от многих факторов: локализации опухоли, ее гистологической формы, характера роста, распространенности процесса, возраста пациента, наличия сопутствующих заболеваний.
Так, клиника заболевания может определяться анатомической локализацией растущей опухоли. Например, при поражении органов желудочно-кишечного тракта (ЖКТ) могут наблюдаться кахексия, анемия; при поражении печени страдает обмен веществ. Особенности локализации опухоли в самом органе также определяют клиническую картину. Опухоль, расположенная в пилорическом отделе желудка, имеет симптомы стеноза; опухоль же, локализующаяся в кардии и поражающая пищевод, приводит к дисфагии - препятствию для прохождения пищи.
В ряде случаев при IV стадии заболевания основная симптоматика может быть связана не с первичной опухолью, а с ее метастазами. Так, первые симптомы заболевания при метастазах небольшого рака легкого в мозг могут возникать со стороны головного мозга. Нередко рак предстательной железы диагностируется после выявления метастазов в костях и сопровождается сильным болевым синдромом.
Злокачественные опухоли, кроме местной симптоматики, связанной с поражением того или иного органа, проявляются общими симптомами. По мере развития новообразование может разрушать жизненно важные органы и целые системы организма. Однако рост опухолей, преимущественно злокачественных, может сопровождаться различными нарушениями, которые влияют на обмен веществ, на нервную, эндокринную и иммунную системы. Таким образом, новообразование может оказывать как местное, так и системное действие на организм опухоленосителя. Местные изменения возникают в результате прямого действия опухолевых клеток на неопухолевую ткань, непосредственно граничащую с новообразованием.
Местное действие опухоли проявляется рядом клинических феноменов, которые позволяют диагностировать ее клинически; можно выделить следующие группы симптомов новообразования: опухолевидного образования, обтурации, компрессии и деструкции. Наличие опухолевидного образования можно диагностировать
визуально и путем пальпации. Прощупыванием можно установить, из какого органа исходит новообразование. Пальпируя опухоль или область ее расположения, можно получить сведения о ее протяженности и границах, консистенции, взаимоотношениях с окружающими тканями и органами. Одновременно при обследовании следует пальпировать все регионарные лимфатические узлы. Метастатические лимфатические узлы обычно увеличены, плотные, иногда бугристые, спаяны с окружающими тканями и другими лимфатическими узлами.
Обязательной при обследовании любого онкологического больного является пальпация органов брюшной полости, особенно печени. В печени могут локализоваться метастазы любых злокачественных опухолей. Пальцевое исследование прямой кишки, вагинальное исследование дают дополнительную информацию и о состоянии органов малого таза.
Вызывая сдавление и нарушая проходимость полых органов, даже доброкачественные опухоли некоторых локализаций могут представлять смертельную опасность. Рост опухоли в просвет полого органа может обусловить закрытие просвета и нарушение пассажа его содержимого, определяя синдром сдавления и обтурации. Так, опухоль пищевода ведет к дисфагии или полной непроходимости пищевода, что обрекает организм на голодание. Опухоль любой части пищеварительного тракта нарушает пассаж пищи и ведет к нарушению питания. Новообразование привратника желудка вызывает рвоту и резкое истощение организма, кишечника - непроходимость, мочеточника - анурию, гортани - стеноз, удушье, бронха - ателектаз легочной ткани, при опухоли желчевыводящих протоков развиваются холестаз и желтуха. Опухоль мозга может сдавливать жизненно важные центры.
По мере увеличения размеров опухоли могут наблюдаться ее разрушение или распад. При прорастании опухоли в сосуды на фоне ее распада и изъязвления может наступить аррозия сосудов, приводящая к кровотечениям, иногда даже смертельным. Некрозы опухолей могут вызвать перфорацию стенок органа (пищевода, мочевого пузыря), полностью либо частично разрушать органы, что при поражении жизненно важных систем организма может повлечь за собой смерть. При разрушении кости метастазами или первичными опухолями (иногда незлокачественными) могут развиться патологические переломы.
Дополнительные феномены злокачественных новообразований. Влияние предшествующих заболеваний и присоединившейся инфекции на клиническую картину рака
Системное действие опухоли на организм проявляется в виде неспецифических симптомов: общей иммунодепрессии, лихорадки, анемии, астении, кахексии и специфических паранеопластических синдромов. В организме опухоленосителя отмечается тенденция к развитию алкалоза.
Метаболизм жиров в опухоли всегда ускорен, что связано с высокой интенсивностью деления клеток, необходимым условием для которой является синтез липидных компонентов цитоплазматической мембраны. Накопление холестерина в опухолевых клетках также связано с потребностью в строительстве мембран. В клетках новообразований всегда усилен синтез белков при относительном снижении выработки гистонов. Опухоль потребляет незаменимые аминокислоты из крови, что сопровождается дефицитом белка и белковым голоданием организма опухоленосителя при больших размерах новообразования. В результате в крови уменьшается содержание сывороточного альбумина и несколько повышается количество α1-, α2- и β-глобулинов.
Для опухолевого роста характерен феномен «субстратных ловушек». Непрерывно разрастаясь, опухоль может потреблять продукты, необходимые для жизнедеятельности организма: глюкозу - для энергообразования, аминокислоты - для построения компонентов цитоплазмы, липиды и холестерин - для синтеза клеточных мембран. Появление кахексии у больных с распространенными формами рака объясняется метаболическими особенностями опухолевого роста.
Учитывая особенности обмена опухолевых клеток, следует подчеркнуть, что каких-либо специфических токсических соединений они не выделяют. Однако, несмотря на приспособленность опухолевых клеток к гипоксии, при больших размерах новообразования наступает массовый некроз клеток - опухолевый распад, проявляющийся синдромом неспецифической эндогенной интоксикации, вызванной наличием большой массы некротической ткани. При этом всасывается большое количество продуктов тканевого распада. Влияние значительных нарушений всех видов обмена веществ при распаде рака в сочетании с непрерывным и все нарастающим всасыванием продуктов распада опухолевой ткани позволяет объяснить
интоксикацию организма, которая может наблюдаться при злокачественных опухолях.
Продукты метаболизма распространенных опухолей отрицательно влияют на различные физиологические системы организма. Метаболиты распадающейся опухоли оказывают повреждающее действие на мембраны нормальных клеток различных органов. Активация перекисного окисления липидов и образование повышенного количества свободных радикалов у онкологических больных вызывают склонность к гемолизу эритроцитов и развитие анемии.
Системное, специфическое действие опухоли на организм также проявляется паранеопластическими синдромами. Паранеопластические синдромы - это совокупность метаболических нарушений, сопровождающих развитие опухоли. В основе паранеопластических синдромов лежат нарушения, обусловленные непрямым воздействием новообразования: дисбалансом обменных процессов, иммунным конфликтом «опухоль - организм», эктопическим образованием гормоноподобных полипептидов, в норме не продуцирующихся. Эти симптомы связаны с появлением опухоли и исчезают после ее удаления. Перед клиницистом стоит задача выявления таких признаков, чтобы в совокупности с инструментальными и морфологическими методами распознать новообразование на самых ранних стадиях.
К специфическим проявлениям паранеоплазии относят эндокринные нарушения, вызванные действием продуктов метаболизма опухоли, секрецией гормонов и медиаторов. Гормонообразование объясняется тем, что конструкция генов клеток организма принципиально дает возможность полипотентному синтезу, при котором гормонообразование в эндокринных клетках блокируется, а в опухолевых клетках, наоборот, высвобождается. Примерами этого является образование паратгормона в опухолях легких с формированием гиперкальциемии, инсулина - при опухолях почек, яичников и надпочечников; образование тромбокиназоподобных веществ при опухолях поджелудочной и слюнных желез (опасность тромбозов), АКТГ - при опухолях легких и средостения с развитием синдрома Кушинга, тиреотропного гормона - при опухолях легких, гастрина - при опухолях поджелудочной железы.
Основные нейроэндокринные синдромы связаны с секрецией серотонина, гастрина, АКТГ, при опухолях коры надпочечников, опухолях нейроэндокринной системы - апудомах. Чаще всего наблюдается
карциноидный синдром, развивающийся на фоне ЕС-клеточных нейроэндокринных опухолей - карциноидов, секретирующих серотонин. Карциноидный синдром сопровождается сосудистыми расстройствами, лихорадкой, бронхоспазмом, диареей, абактериальным эндокардитом, олигурией.
В контексте паранеопластического синдрома могут также рассматриваться гемостазиологические и неврологические нарушения, дерматопатии, поражение скелетных мышц в виде миопатий и мышечных дистрофий, нарушение деятельности ЖКТ, кардиодепрессия, снижение толерантности к глюкозе и др.
Гемостазиологический паранеопластический синдром у больных со злокачественными опухолями проявляется тромбозом, мигрирующим тромбофлебитом, эмболией ветвей легочной артерии, абактериальным тромбоэндокардитом, парадоксальными кровотечениями, тромботической микроангиопатией. Патогенез тромботических осложнений у онкологических больных сложен, поскольку наряду с общими факторами действуют еще и специфические механизмы.
Опухолевая клетка играет ключевую роль в запуске коагуляционного каскада через сосудисто-тромбоцитарное звено гемостаза. Выброс опухолевыми клетками различных факторов свертывания крови приводит к повышенному фибриногенообразованию, нарушению реологических свойств крови, что определяет большое количество тромбозов и тромбоэмболических осложнений, сопутствующих опухолевому росту. В основе патогенеза гемостазиологической паранеоплазии лежит активация как коагуляционного, так и сосудисто-тромбоцитарного звеньев свертывания крови, которая обеспечивается:
1) синтезом прокоагулянтов и ингибиторов фибринолиза опухолевыми клетками;
2) прокоагулянтной активностью опухольассоциированных макрофагов;
3) нарушением целостности и стабильности сосудистого эндотелия при воздействии опухолевых цитокинов;
4) многофакторным усилением агрегационных свойств тромбоцитов.
Важная роль в регуляции сосудисто-тромбоцитарного звена свертывающей системы крови при злокачественных новообразованиях принадлежит опухолевым цитокинам, в частности фактору некроза опухоли. In vitro фактор некроза опухолей вызывает значительные
морфологические изменения в цитоскелете эндотелиальных клеток, подавляя их пролиферативную активность, что in vivo проявляется повреждением эндотелия.
Определенное значение в развитии тромбоза имеет эмболизация сосудов опухолевыми клетками. Раковый эмбол служит ядром тромба, который при соответствующих условиях, если процесс организации запаздывает, может способствовать метастазированию. Отложение фибрина в опухоли и вокруг нее оказывает стимулирующее влияние как на опухолевый рост, так и на процесс метастазирования. Участие фибрина в защите опухолевых клеток от воздействия охранных механизмов организма также вполне доказано.
Повреждение мембран тромбоцитов продуктами перекисного окисления, образующимися при опухолевом распаде, также может способствовать повышенному тромбообразованию. Поэтому распространенные формы рака, как правило, протекают на фоне скрытого или явного синдрома диссеминированного внутрисосудистого свертывания (ДВС). К факторам риска тромбообразования у онкологических больных можно отнести и диспротеинемию, проявляющуюся снижением содержания альбуминов и увеличением активности α- и γ-глобулиновых фракций. Механизм раковой диспротеинемии сложен и связан не только с расстройствами обмена, но и с иммунологическими реакциями, с циркуляцией противоопухолевых иммунных комплексов.
Воздействие опухолевых перекисных метаболитов может приводить к повреждениям сосудистой стенки, что проявляется пролиферацией и деструктивно-некробиотическими процессами в эндотелии, гомогенизацией и разволокнением мышечного слоя.
Злокачественные опухоли редко возникают в совершенно здоровом органе. Фоновые заболевания, на почве которых возникает рак, могут влиять на его клинические проявления, маскируя картину опухолевого заболевания. При излечимых новообразованиях, но протекающих с осложнениями, может создаться ложное впечатление запущенного заболевания. При раке пищевода, например, тяжелое состояние больного может быть обусловлено непроходимостью пищевода и голоданием. Так, при раке желудка кровотечение из опухоли может обусловить тяжелую анемию, однако новообразование - быть вполне операбельным. При небольшом раке, обтурирующем просвет бронха, может развиться тяжелая перифокальная пневмония, что создает обманчивое впечатление о тяжести состояния и «безнадежности»
больного. В таких случаях необходимо тщательно обследовать пациента и остерегаться необоснованного отказа от попытки радикального лечения.
Распад и изъязвление злокачественной опухоли представляют собой благоприятную почву для развития вторичной инфекции. Многие опухоли, особенно граничащие с внешней средой, могут инфицироваться, воспаляться, иногда нагнаиваться. При этом возможно развитие инфекционно-гнойных септических осложнений. У онкологических больных, особенно при лейкемиях (лейкозах) и злокачественных лимфомах, развиваются иммунодепрессия и вторичное инфицирование различными микроорганизмами, что, в свою очередь, может стать причиной различных септических осложнений.
Все перечисленные нарушения наблюдаются при распространенных формах новообразований. При ранних формах злокачественных опухолей какие-либо специфические их проявления отсутствуют. При пальпации или рентгенологическом исследовании самая малая величина опухоли, которую можно обнаружить, составляет примерно 1 см3, а ее масса - менее 1 г (это примерно 30 удвоений, или 109 клеток). Однако опухоль такого объема, как известно, уже может метастазировать. Даже при том условии, что злокачественное новообразование небольших размеров можно диагностировать клинически, его следует рассматривать как распространенную стадию процесса и даже как системное заболевание.
Поэтому ранняя диагностика злокачественных опухолей, которая на сегодняшний день является главным условием их успешного лечения, должна осуществляться не по мере обращения пациента за помощью к врачу, а посредством соответствующих скрининговых программ, диспансерного наблюдения и углубленных систематических обследований лиц, включенных в группу повышенного риска развития злокачественного новообразования.
Следует заметить, что в настоящее время в качестве диагностических тестов в группах повышенного риска развития рака могут быть использованы молекулярно-биологические исследования. По мнению А.Г. Татосяна (2001), на основе молекулярно-биологических методов можно достаточно легко разработать относительно недорогие скрининговые, неинвазивные программы исследований, основывающихся на выявлении измененных фрагментов и комбинаций онкогенов, например, в мокроте. Лица, у которых будет установлен молекулярный предрак, должны избегать любых контактов с кан-
церогенами и систематически проходить углубленные медицинские обследования. Использование молекулярных маркеров ранних стадий канцерогенеза может лечь в основу новых методов скрининга, а именно выявления признаков злокачественного роста до формирования его морфологических проявлений.
Вопросы для самоконтроля
1. Какие фазы морфогенеза рака следует отнести к ранней онкологической патологии?
2. Что такое предраковые состояния и чем они отличаются от предраковых условий?
3. Что такое earcinoma in situ и чем она характеризуется?
4. Что такое микрокарцинома и чем она отличается от earcinoma in situ?
5. Как называются ферменты, которые определяют способность опухолевых клеток к инвазивному росту?
6. Какие основные признаки злокачественных новообразований вы можете выделить?
7. Какие нормальные клетки, малигнизируясь, могут стать источником опухолевого роста?
8. Какие выделяются основные типы опухолей?
9. Чем отличаются злокачественные опухоли от потенциально злокачествен ных?
10. Какие проявления опухолевого роста являются ведущими при прогнозе клинического течения злокачественной опухоли?
11. Какие клетки опухолевой популяции устойчивы к действию химиопрепаратов и лучевой терапии?
12. Перечислите основные клинические феномены, обусловленные местным распространением опухоли.
13. Что такое паранеопластические синдромы?
14. Назовите основные специфические клинические проявления ранних форм злокачественных опухолей.