Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев. 2010. - 920 с.
|
|
|
|
ГЛАВА 29 РАК МОЧЕВОГО ПУЗЫРЯ
ЭПИДЕМИОЛОГИЯ
В структуре онкологических заболеваний населения России рак мочевого пузыря занимает 8-е место у мужчин и 18-е - у женщин; сохраняется тенденция к постоянному увеличению числа заболевших. В 2007 г. показатель заболеваемости мужчин был 15,7 на 100 тыс., женщин - 3,5. За последние 9 лет абсолютный прирост заболеваемости раком мочевого пузыря составил 34,8 % в мужской и 14,4 % - в женской популяции. В России ежегодно данная опухоль развивается у 12 тыс. человек. У впервые заболевших I и II стадии заболевания диагностируются в 45,8 %, III стадия - в 35,2 %, IV стадия - в 13,6 % наблюдений. Летальность в течение 1-го года с момента установления диагноза составляет 29,3 %.
ЭТИОЛОГИЯ
Этиология рака мочевого пузыря неизвестна, однако выявлен ряд факторов, способствующих развитию данного заболевания. Достоверно чаще рак мочевого пузыря поражает мужчин. Наиболее характерно развитие опухоли в возрасте старше 60 лет. Частота появления рака мочевого пузыря ниже у представителей негроидной расы.
Доказано значительное увеличение риска появления рака мочевого пузыря у лиц, длительное время контактирующих со вторичными ароматическими аминами, полициклическими ароматическими углеводородами. Установлено, что курильщики болеют раком мочевого пузыря в 2-3 раза чаще, чем некурящие.
Шистосоматоз приводит к значительному увеличению заболеваемости раком мочевого пузыря. Кроме того, ряд авторов отмечают корреляцию между вероятностью заболеть раком мочевого пузыря и наличием инфекционных заболеваний мочевыводящих путей,
а также уростаза. Установлено, что применение фенацетинсодержащих анальгетиков и циклофосфамида приводит к возрастанию риска возникновения опухоли.
Отмечено увеличение заболеваемости раком мочевого пузыря в популяции, подвергнутой воздействию ионизирующего облучения.
Риск развития данного новообразования снижен у лиц, использующих при приготовлении пищи растительные масла и маргарин, содержащие полиненасыщенные жирные кислоты, а также потребляющих большое количество β-каротина, калия, витамина С. Отмечена тенденция к повышению заболеваемости раком мочевого пузыря при увеличении содержания в рационе белка и поваренной соли.
Рак мочевого пузыря является генетически детерминированным процессом, связанным с цепью хромосомных изменений. Однако в настоящее время не выявлено высокоспецифичных мутаций, вызывающих развитие именно данного вида опухоли. В канцерогенезе рака мочевого пузыря важную роль играет делеция участка короткого плеча 17-й хромосомы (р11-13), включающего ген опухолевой супрессии р53. Описана также амплификация е-егЪВ-2-онкогена. Значительную роль на начальных стадиях онкогенеза при раке мочевого пузыря играет делеция длинного плеча 9-й хромосомы (или потеря всей хромосомы). Также при опухолях данной локализации часто встречаются структурные изменения 1-й хромосомы. Трисомия 7-й хромосомы - частое явление при раке мочевого пузыря, особенно в комбинации с другими изменениями генома. В клетках опухоли у мужчин может отсутствовать Y-хромосома.
МОРФОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ ОПУХОЛЕЙ МОЧЕВОГО ПУЗЫРЯ
1. Эпителиальные опухоли мочевого пузыря. 1.1. Доброкачественные.
1.1.1. Уротелиальная (переходно-клеточная) папиллома.
1.1.2. Уротелиальная (переходно-клеточная) папиллома, инвертированный тип.
1.1.3. Плоскоклеточная папиллома.
1.1.4. Виллезная аденома.
1.2. Папиллярные уротелиальные (переходно-клеточные) опухоли с низким злокачественным потенциалом.
1.3. Злокачественные.
1.3.1. Уротелиальная (переходно-клеточная) карцинома.
1.3.1.1. Папиллярная уротелиальная (переходно-клеточная) карцинома.
1.3.1.2. Инфильтративная уротелиальная (переходно-клеточная) карцинома.
1.3.1.3. Уротелиальная (переходно-клеточная) карцинома in
situ.
1.3.1.4. Атипия/дисплазия.
1.3.1.5. Варианты уротелиальной (переходно-клеточной) карциномы.
1.3.2. Плоскоклеточный рак. 1.3.2.1. Веррукозная карцинома.
1.3.3. Аденокарцинома.
1.3.4. Рак урахуса.
1.3.5. Светлоклеточная аденокарцинома.
1.3.6. Мелкоклеточный рак.
1.3.7. Недифференцированный рак.
2. Неэпителиальные опухоли.
3. Смешанная группа опухолей.
3.1. Параганглиома.
3.2. Гематопоэтические и лимфоидные новообразования.
3.3. Карциносаркома.
3.4. Злокачественная меланома.
4. Метастатические опухоли и распространение на мочевой пузырь других опухолей.
5. Неклассифицируемые опухоли.
6. Эпителиальные нарушения.
6.1. Гиперплазия.
6.1.1. Плоская уротелиальная (переходно-клеточная) гиперплазия.
6.1.2. Папиллярная уротелиальная (переходно-клеточная) гиперплазия.
6.2. Реактивная атипия.
6.3. Атипия неопределенного значения.
6.4. Гнезда фон Брунна.
6.5. Кистозный цистит.
6.6. Железистая метаплазия.
6.7. Нефрогенная аденома.
6.8. Плоскоклеточная метаплазия.
6.9. Эффекты лечения.
7. Опухолеподобные поражения.
7.1. Папиллярный и полипоидный цистит.
7.2. Фолликулярный цистит.
7.3. Малакоплакия.
7.4. Амилоидоз.
7.5. Миофибробластические пролиферации.
7.5.1. Миофибробластическая опухоль.
7.5.2. Послеоперационный веретеноклеточный узел.
7.6. Фиброзный (фиброэпителиальный) полип.
7.7. Эндометриоз.
7.8. Гамартома.
7.9. Кисты.
7.10. Шистосомоз.
7.11. Лучевой цистит.
До 95 % опухолей мочевого пузыря эпителиального происхождения. Наиболее распространенной (>90 %) гистологической формой злокачественных эпителиальных новообразований мочевого пузыря является переходно-клеточный рак. Обычно выделяют 2 его формы: папиллярную, которая составляет 70-75 % впервые выявленных опухолей, и непапиллярную. Среди непапиллярных опухолей выделяют карциному in situ (CIS) и инвазивный рак.
Плоскоклеточный рак составляет около 5 % случаев в зонах, не эндемичных по шистосомозу, а в областях, где шистосомоз распространен, на его долю приходится около 75 % новообразований мочевого пузыря. Около 0,5-2 % злокачественных эпителиальных опухолей мочевого пузыря представлены аденокарциномой. Реже имеет место недифференцированный рак.
В зависимости от степени дифференцировки опухоли выделяют высокодифференцированные (G1), умеренно дифференцированные (G2) и низкодифференцированные (G3) опухоли.
Рост и метастазирование
Для рака мочевого пузыря характерно лимфогенное метастазирование. Поражение регионарных лимфатических узлов отмечается у 66-75 % больных инвазивным (T2-4) и у 5 % - с поверхностным (Tis-T1) раком мочевого пузыря. При carcinoma in situ частота лимфогенного метастазирования достигает 20 %. В 78 % случаев поражаются тазовые лимфатические узлы. Наиболее часто выявляются метастазы в обтураторных (74 %), наружных подвздошных (65 %) и паравезикальных (16 %) лимфатических узлах.
Отдаленные метастазы развиваются у 50 % больных инвазивным раком мочевого пузыря и практически не встречаются при поверхностных опухолях. Наиболее часто поражаются печень (38 %), легкие (36 %), кости (27 %), надпочечник (21 %).
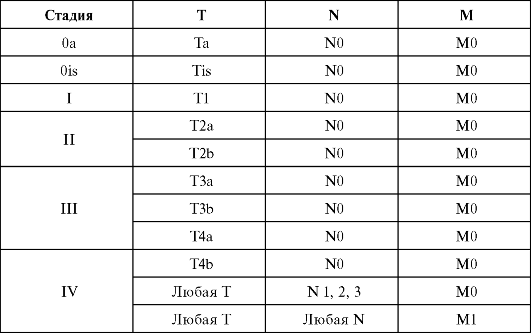
КЛИНИЧЕСКАЯ КЛАССИФИКАЦИЯ TNM (2002)
Правила классификации
Представленная ниже классификация применима только для рака. Случаи папилломы исключены. В каждом случае необходимо гистологическое подтверждение диагноза.
Анатомические области
1. Треугольник мочевого пузыря.
2. Купол мочевого пузыря.
3. Боковая стенка мочевого пузыря.
4. Передняя стенка мочевого пузыря.
5. Задняя стенка мочевого пузыря.
6. Шейка мочевого пузыря.
7. Мочеточниковое отверстие.
8. Первичный мочевой проток (урахус).
Регионарные лимфатические узлы
К регионарным относят лимфатические узлы таза, расположенные ниже бифуркации общей подвздошной артерии. Наличие ипсилатеральных либо контралатеральных регионарных метастазов не влияет на показатель классификации N.
Клиническая классификация 1ЫМ
Т - первичная опухоль
Суффикс (m) добавляют к категории Т для отражения множественного характера опухоли. Суффикс (is) отражает наличие рака in situ. Тх - оценка первичной опухоли невозможна. Т0 - первичная опухоль не обнаружена. Та - папиллярный неинвазивный рак. Tis - рак in sitii.
Т1 - опухоль с поражением подслизистого слоя. Т2 - опухоль с поражением мышечного слоя:
Т2а - опухоль с поражением внутренней части мышечного слоя;
Т2Ъ - опухоль с поражением внешней части мышечного слоя. Т3 - опухоль с поражением околопузырной жировой клетчатки: Т3а - опухоль с поражением околопузырной жировой клетчатки по данным микроскопического исследования; Т3Ъ - опухоль с поражением околопузырной жировой клетчатки по данным макроскопического исследования. Т4 - опухоль с поражением одного из следующих органов: предстательная железа, матка, влагалище, стенка таза, стенка брюшной полости:
Т4а - опухоль с поражением предстательной железы, матки и влагалища;
Т4Ъ - опухоль с поражением стенки таза или брюшной полости.
N - регионарные лимфатические узлы
? - состояние регионарных лимфатических узлов оценить невозможно.
N0 - метастазов в регионарных лимфатических узлах нет.
N1 - метастаз в один регионарный лимфатический узел, размером до 2 см в наибольшем измерении.
N2 - метастазы в один или несколько регионарных лимфатических узлов, размером 2,1-5 см в наибольшем измерении.
N3 - метастазы в один или несколько регионарных лимфатических узлов, размером более 5 см в наибольшем измерении.
М - отдаленные метастазы
Мх - наличие отдаленных метастазов оценить невозможно.
М0 - отдаленных метастазов нет.
М1 - наличие отдаленных метастазов.
Патоморфологическая классификация pTNM
Критерии выделения категорий pT, рN и рМ соответствуют таковым для категорий T, N и М.
Группировка по стадиям
 КЛИНИЧЕСКАЯ КАРТИНА
КЛИНИЧЕСКАЯ КАРТИНА
Одним из первых признаков рака мочевого пузыря является макрогематурия, чаще тотальная. Однако при локализации опухоли в области шейки возможно наличие примеси крови только в терминальной порции мочи. Свертывание крови в полости мочевого пузыря может привести к развитию тампонады и к острой задержке мочи. Другим распространенным симптомом заболевания является дизурия, которая обусловлена инфицированием, инвазией стенки мочевого пузыря и нарушением оттока мочи. Дизурические явления очень характерны для carcinoma in situ. Боль над лоном может быть обусловлена инфекционными осложнениями, хронической задержкой мочи, а на поздних стадиях заболевания - инфильтрацией стенки мочевого пузыря опухолью. При дальнейшем росте новообразования появляются боли в области промежности, крестца. Сдавление устьев мочеточников опухолью приводит к нарушению оттока мочи
из верхних мочевыводящих путей, следствием чего являются их дилатация, уростаз, развитие пиелонефрита, ХПН. Полная обструкция устьев мочеточников приводит к анурии.
Метастатическое поражение лимфатических узлов таза, как правило, вызывает появление клинических симптомов при больших размерах опухолевого конгломерата. При этом отмечается появление отеков нижних конечностей. Отдаленные метастазы рака мочевого пузыря вызывают развитие симптомов, соответствующих локализации поражения.
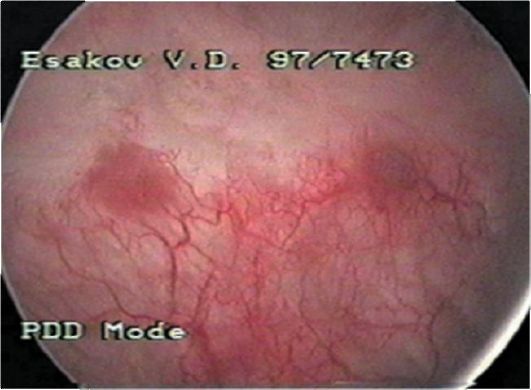 Рис. 29.1. Рак мочевого пузыря. Цистограмма
Рис. 29.1. Рак мочевого пузыря. Цистограмма
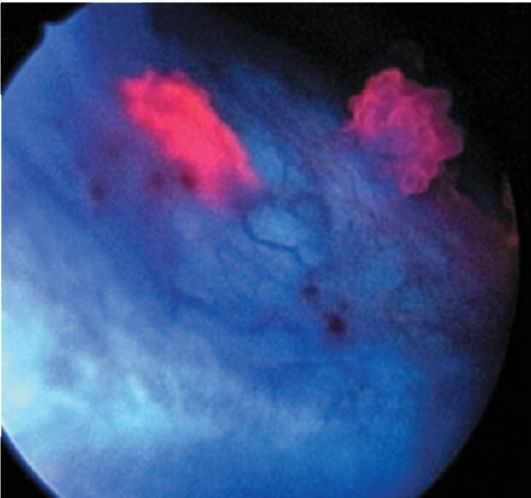 Рис. 29.2. Рак мочевого пузыря (флюоресценция протопорфирина IX в опухолевой ткани). Цистограмма с флюоресцентным контролем
Рис. 29.2. Рак мочевого пузыря (флюоресценция протопорфирина IX в опухолевой ткани). Цистограмма с флюоресцентным контролем
ДИАГНОСТИКА
Для выявления и адекватного стадирования рака мочевого пузыря необходимо комплексное обследование, включающее физикальные, инструментальные и лабораторные методы.
Ведущую роль в диагностике опухолей мочевого пузыря занимает цистоскопия, позволяющая оценить количество, локализацию, размеры, характер роста новообразований (рис. 29.1). Расширить возможности цистоскопии позволяет применение флюоресцентной диагностики рака мочевого пузыря (рис. 29.2). Для выполнения цистоскопии с флюоресцентным контролем в мочевой пузырь вводят раствор 5-аминолевули- новой кислоты, продукт метаболизма которой (протопорфирин IX) накапливается в опухолевых клетках. При освещении мочевого пузыря сине-фиолетовым светом возникает флюоресценция протопорфирина IX, концентрация которого в опухоли значительно
выше, чем в нормальной слизистой оболочке. Таким образом, врач имеет возможность увидеть новообразования, которые не видны при обычном освещении (в том числе и рак in situ), взять биопсию из флюоресцирующих участков или удалить их. Чувствительность флюоресцентной цистоскопии на 20 % выше, чем цистоскопии при обычном освещении, и составляет более 90 %.
Для подтверждения диагноза используется цитологическое исследование мочи, которое позволяет выявить клетки рака у больных с низкодифференцированными опухолями или carcinoma in situ мочевого пузыря. Однако при высокодифференцированном раке результаты цитологического исследования бывают негативными в 25-70 % случаев. Чувствительность метода составляет в среднем 40 %.
Помимо цитологического исследования мочи, в настоящее применяется ряд лабораторных тестов, позволяющих заподозрить рак мочевого пузыря на основании выявления в моче ряда веществ: тест на наличие специфического антигена ВТА (blader tumor antigen; чувствительность метода - 67 %), BTA TRAK-тест (чувствительность метода - 72 %), тест на ядерный матриксный протеин (NMP-22; чувствительность метода - 53 %), определение теломеразы, хемилюминиесценции гемоглобина (чувствительность метода - 67 %).
Трансабдоминальное УЗИ позволяет выявить новообразование, оценить его локализацию, размеры и глубину прорастания стенки мочевого пузыря. Кроме того, данный метод дает информацию о наличии или отсутствии дилатации верхних мочевыводящих путей. Трансуретральное УЗИ обладает большей точностью при оценке глубины инвазии опухоли, чем трансабдоминальное исследование. Чувствительность метода составляет 90 %, специфичность - 76 %. Трансуретральная УЗКТ позволяет получить более точные результаты, касающиеся глубины прорастания стенки мочевого пузыря, при поверхностных новообразованиях.
КТ должна входить в алгоритм обследования больных инфильтративным раком с целью оценки глубины инвазии опухоли и выявления метастазов в тазовые и забрюшинные лимфатические узлы. Чувствительность метода составляет 83 %, специфичность - 82 %. МРТ позволяет получать изображения мочевого пузыря, а также простаты, семенных пузырьков, тазовых лимфатических узлов в нескольких проекциях, что облегчает интерпретацию результатов исследования (рис. 29.3). Чувствительность метода составляет 73 %, специфичность - 84 %. В отличие от УЗИ, КТ и МРТ обладают наибольшей точностью
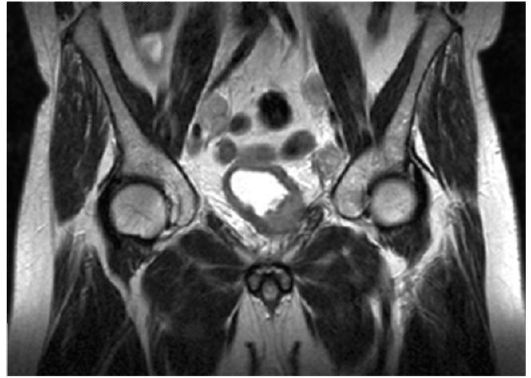 Рис. 29.3. Рак мочевого пузыря с метастазами в тазовые лимфатические узлы. Магнитно-резонансная томограмма
Рис. 29.3. Рак мочевого пузыря с метастазами в тазовые лимфатические узлы. Магнитно-резонансная томограмма
при оценке степени распространенности инвазивных опухолей.
Помимо этого всем больным раком мочевого пузыря необходимо выполнять УЗИ органов брюшной полости и забрюшинного пространства, а также рентгенографию органов грудной клетки для определения степени распространенности опухолевого процесса. Среди методов диагностики не утратила своего значения экскреторная урография.
ЛЕЧЕНИЕ
Большое значение для выбора метода лечения и составления прогноза имеет подразделение опухолей мочевого пузыря на поверхностные (Tis-TaT1) и инвазивные (T2-T4). Поверхностные опухоли характеризуются высокой склонностью к местному рецидивированию после хирургического лечения и способны прогрессировать в инвазивный рак. Инвазивным новообразованиям свойственны агрессивный рост и метастазирование. Кроме того, существенное влияние на лечебную тактику оказывает выделение в группе поверхностных опухолей Тis. Carcinoma in situ (CIS) является интраэпителиальной опухолью, для клеток которой характерно отсутствие способности к адгезии. Потеря межклеточных связей становится причиной агрессивного клинического течения данной опухоли, характеризующегося крайне высоким риском прогрессии с развитием инвазии стенки мочевого пузыря и диссеминацией опухолевого процесса. Степень гистопатологической дифференцировки также является значимым прогностическим фактором и влияет на выбор тактики лечения.
Лечение рака мочевого пузыря стадий Ta и T1
Оптимальным методом лечения поверхностного рака стадий Ta и Т1 является трансуретральная резекция (ТУР) мочевого пузыря. При этом производится последовательная резекция экзофитного компонента, а затем - ножек и основания опухоли с помощью петли резектоскопа. ТУР необходимо выполнять таким образом, чтобы
максимально сохранить архитектонику стенки органа и соотношение опухоли со всеми ее слоями. Для повышения радикальности выполняемого вмешательства можно применять флюоресцентный контроль, основанный на появлении в синем свете красного свечения опухоли, индуцированного 5-аминолевулиновой кислотой.
Биопсию неизмененной слизистой оболочки выполняют во всех случаях при положительном результате цитологического исследования мочи, даже при отсутствии опухоли или наличии непапиллярного новообразования мочевого пузыря. Дополнительная биопсия больным с солитарными папиллярными опухолями не показана, так как сама по себе не несет дополнительной информации, а повреждение слизистой оболочки теоретически может спровоцировать имплантацию клеток рака.
Все удаленные ткани подвергаются гистологическому исследованию. Кусочки опухоли и подозрительные в отношении опухолевого роста участки стенки мочевого пузыря маркируют для адекватной оценки степени распространенности опухолевого процесса. С целью правильного установления стадии Т необходимо раздельное изучение экзофитного компонента и основания опухоли.
Основными осложнениями ТУР мочевого пузыря являются кровотечение и перфорация мочевого пузыря.
При малом числе мелких поверхностных опухолей (1-3) и верифицированном диагнозе возможно выполнение трансуретральной электровапоризации измененных участков слизистой.
Открытая резекция мочевого пузыря при поверхностном раке в настоящее время применяется редко - при наличии опухоли, удаление которой с помощью ТУР сопряжено с высоким риском кровотечения или перфорации. К данной группе новообразований относятся, в частности, большие опухоли верхушки мочевого пузыря.
При выборе метода дальнейшего лечения больных раком мочевого пузыря Ta и Т1 стадий необходимо принимать во внимание риск развития рецидива и прогрессирования опухолевого процесса, возможность развития побочных эффектов и соотношение цена- эффективность. Частота рецидивов поверхностного рака мочевого пузыря даже после адекватного лечения очень высока (30-80 %). Риск прогрессирования с развитием инвазии невелик, однако вероятность появления инфильтративного роста при опухолях T1G3, составляющих 10 % поверхностных опухолей, увеличивается до 50 %. Риск
рецидива и прогрессирования может быть предсказан на основании клинических и морфологических данных. Факторы прогноза развития рецидива в порядке убывания значимости следующие:
1) количество опухолей на момент установления диагноза;
2) частота рецидивов в предшествующий период; рецидив через 3 мес после лечения;
3) размер опухоли: чем она больше, тем выше риск рецидива;
4) степень гистопатологической дифференцировки опухоли. Наиболее важное прогностическое значение для появления
инфильтративного роста имеют степень анаплазии и стадия Т опухоли. Основываясь на данных прогностических факторах, все поверхностные опухоли мочевого пузыря можно разделить на следующие группы риска:
• низкого риска: единичные опухоли TaG1 диаметром <3 см;
• высокого риска: T1G3, множественные или часто рецидивирующие опухоли, Tis;
• умеренного риска: остальные поверхностные опухоли Ta-1, G1-2, множественные опухоли диаметром >3 см.
Во всех случаях непосредственно после ТУР мочевого пузыря показано внутрипузырное введение химиопрепарата. Это позволяет снизить риск развития рецидива в несколько раз.
Пациентам группы низкого риска дополнительное лечение может не проводиться. Больным, относящимся к группам умеренного и высокого риска развития рецидива, необходим 6-недельный курс внутрипузырной иммунотерапии вакциной БЦЖ или химиотерапии.
Адъювантную терапию вакциной БЦЖ начинают не ранее чем через 4 нед после ТУР мочевого пузыря. При наличии гематурии необходимо отложить начало лечения, чтобы избежать развития тяжелых системных осложнений. Абсолютным противопоказанием к внутрипузырному введению вакцины БЦЖ является активный туберкулез. Оптимальные дозы вакцины БЦЖ в настоящее время не установлены. Наиболее часто применяется разовая доза 100 мг. Однако показано, что при папиллярном раке мочевого пузыря T1-аG1-2 редукция дозы до 25 % позволяет добиться того же эффекта, что и применение стандартных дозировок, при меньшей выраженности побочных реакций. Продолжает обсуждаться вопрос об оптимальной схеме лечения. Наиболее распространенными являются режим внутрипузырной БЦЖ-терапии с использованием
6 еженедельных инстилляций и поддерживающая схема, включающая 6 еженедельных и 10 ежемесячных инстилляций препарата.
Адъювантная БЦЖ-терапия позволяет снизить частоту рецидивов поверхностного рака после ТУР мочевого пузыря, уменьшить риск опухолевой прогрессии (при использовании поддерживающей схемы), не влияя на выживаемость.
Наиболее распространенным осложнением БЦЖ-терапии является цистит, который развивается у 90 % больных. В 40 % наблюдений отмечают появление макрогематурии. Более серьезные побочные эффекты - фебрильная температура (3 %), гранулематозный простатит (0,9 %), пульмонит и гепатит (0,7 %). БЦЖ-сепсис возникает у 0,4 % пациентов; в литературе описано несколько летальных исходов при развитии данного осложнения внутрипузырной БЦЖ-терапии.
Выраженный цистит, вызванный микобактериями, и гематурия, не проходящие к моменту следующей инстилляции, служат противопоказанием к продолжению лечения. Тяжелые местные, а также системные осложнения БЦЖ-терапии требуют применения противотуберкулезных препаратов (изониазид в дозе 300 мг/сут, рифампицин - 600 мг/сут, этамбутол - 1200 мг/сут). Специфическое лечение БЦЖ-цистита проводят до исчезновения клинических симптомов и затем еще в течение 2 нед. При генерализации инфекционного процесса противотуберкулезная терапия применяется до 6 мес.
В качестве эффективных агентов для внутрипузырной химиотерапии используются митомицин С, доксорубицин, тиоТЭФ. Ранняя профилактическая интравезикальная химиотерапия позволяет снизить риск рецидивирования поверхностного рака мочевого пузыря на 15 %, не влияя на риск опухолевой прогрессии и на выживаемость.
Лечение carcinoma in situ мочевого пузыря
Стандартным лечением рака мочевого пузыря in situ является проведение 6 еженедельных внутрипузырных инстилляций вакцины БЦЖ. Полная ремиссия отмечается в 70 % случаев. При сохранении положительных результатов цитологического исследования мочи и гистологического исследования биоптата слизистой оболочки показан дополнительный курс внутрипузырной БЦЖ-терапии. Применение 2-го курса иммунотерапии позволяет добиться полного эффекта еще у 15 % больных. С целью предотвращения рецидива назначают поддерживающую терапию в виде ежемесячных инстилляций в течение 36 мес. При неэффективности 2-го курса
лечения, а также при раннем развитии рецидива показано выполнение радикальной цистэктомии ввиду бесперспективности дальнейшего консервативного лечения.
Лечение рака мочевого пузыря T1G3
Рак мочевого пузыря T1G3 имеет высокую склонность к прогрессированию. В связи с этим методом выбора в лечении пациентов данной группы является радикальная цистэктомия.
Лечение инвазивного рака мочевого пузыря
Радикальная цистэктомия остается стандартом лечения инвазивных опухолей. Показанием к цистэктомии является рак мочевого пузыря T2-4аN0x-M0. Другими показаниями служат часто рецидивирующие поверхностные опухоли, не излеченный БЦЖ-терапией рак in situ, опухоли T1G3, распространенные поверхностные новообразования, при которых невозможно добиться излечения с помощью консервативных методов.
Радикальная цистэктомия предполагает удаление мочевого пузыря единым блоком с простатой и семенными пузырьками у мужчин (маткой с придатками - у женщин). Удаляют также проксимальный отдел уретры. При наличии carcinoma in situ необходимо срочное гистологическое исследование края резекции уретры. Удаление мочеиспускательного канала в настоящее время считается необходимым при поражении шейки мочевого пузыря у женщин и простатического отдела уретры - у мужчин. Радикальная цистэктомия также включает тазовую лимфаденэктомию с обеих сторон. Границами лимфодиссекции являются: сверху - бифуркация общих подвздошных артерий, латерально - бедренно-половой нерв, снизу - дно таза, медиально - стенка мочевого пузыря. Морфологическое исследование удаленных лимфатических узлов позволяет получить дополнительную информацию, касающуюся прогноза. Лечебная роль лимфодиссекции при раке мочевого пузыря не подтверждена.
В настоящее время существует 3 альтернативных метода отведения мочи после цистэктомии:
1) илеальный кондуит с формированием «влажной стомы»;
2) удерживающий мочу резервуар;
3) отведение мочи в ортотопический артифициальный мочевой пузырь или в непрерывный кишечник, обеспечивающее возможность контролируемого мочеиспускания.
Операция по созданию илеального кондуита (операция Брикера, уретероилеокутанеостомия) была предложена в 1950 г. и до сих пор широко применяется в клинической практике, являясь стандартом, с которым сравнивают результаты других операций деривации мочи. При формировании илеального кондуита резецируют терминальный сегмент подвздошной кишки длиной около 15 см. Непрерывность кишечника восстанавливают анастомозом конец в конец или бок в бок. Приводящий конец резецированного сегмента подвздошной кишки ушивают. Отступя от него 3-4 см, накладывают анастомозы между дистальными концами мочеточников и резецированным участком подвздошной кишки. Отводящий конец сегмента выводят на кожу с формированием влажной уростомы, требующей постоянного ношения мочеприемников (рис. 29.4).
Операция Брикера обеспечивает удовлетворительные функциональные результаты. Однако в отдаленном послеоперационном периоде у 20 % больных развиваются стриктуры стомы. В 30 % случаев
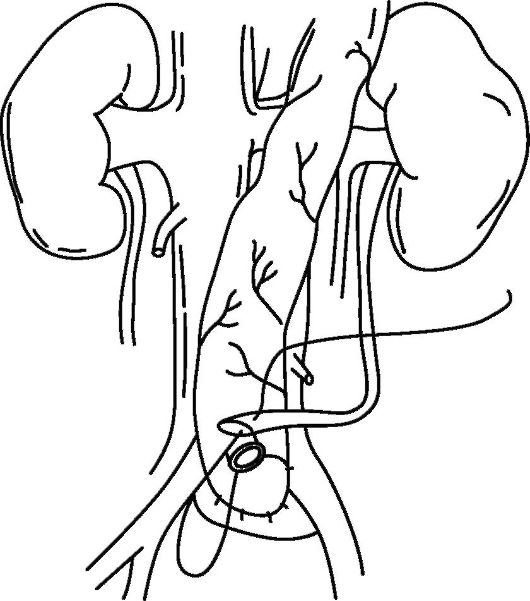 Рис. 29.4. Схема формирования отводящего конца сегмента с выведением на кожу и формированием влажной уростомы
Рис. 29.4. Схема формирования отводящего конца сегмента с выведением на кожу и формированием влажной уростомы
отмечаются дилатация чашечно-лоханочной системы, хронический пиелонефрит.
Основным фактором, определяющим качество жизни после цистэктомии, является возможность контролировать выделение мочи. В связи с этим предложено множество вариантов удерживающих мочу резервуаров (рис. 29.5), которые пациент по мере необходимости опорожняет путем аутокатетеризации.
Для создания удерживающих резервуаров используются детубуляризированные отделы ЖКТ: желудок, сегмент подвздошной кишки, илеоцекальный отдел, сигмовидная и прямая кишки. Сформированный резервуар открывается на кожу «сухой» стомой. Предложены многочисленные варианты создания удерживающих мочу механизмов: инвагинационный клапан на отводящем из резервуара сегменте кишки, суживание отводящего сегмента подвздошной кишки и баугиниевой заслонки специальными швами (Indiana pouch), инвагинирование отводящего сегмента кишки и проведение инвагината через баугиниеву заслонку (Mainz pouch), использование аппендикса, проведенного через подслизистый тоннель. С целью профилактики развития пиелонефрита дистальные отделы мочеточников имплантируются в резервуар с использованием антирефлюксных методик.
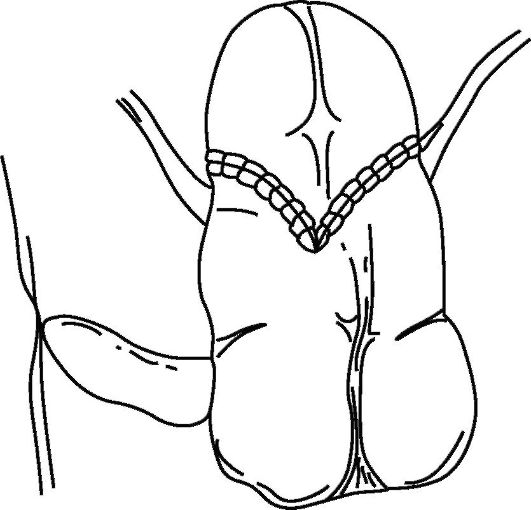 Рис. 29.5. Схема сформированного резервуара
Рис. 29.5. Схема сформированного резервуара
При формировании удерживающих резервуаров у 12 % пациентов развиваются ранние и у 37 % - поздние осложнения. Основными осложнениями в отдаленном послеоперационном периоде являются стриктура и (или) обструкция мочеточников, неудержание мочи, сложности аутокатетеризации, формирование конкрементов в полости резервуара. Довольно часто у данной категории больных отмечаются метаболические расстройства. При использовании илеальных или илеоцекальных кишечных сегментов длиннее 50 см нарушается абсорбционная способность кишечника с развитием дефицита некоторых микроэлементов и витаминов, в частности В12. Кроме того, резорбция мочи кишечным сегментом может способствовать появлению метаболического ацидоза и электролитных нарушений. Однако в большинстве случаев при адекватном отборе и правильном обучении больных аутокатетеризации данные метаболические расстройства легко поддаются коррекции.
Ортотопический артифициальный мочевой пузырь является оптимальным для больного методом деривации мочи, так как при этом отсутствует стома и сохраняется возможность самостоятельного мочеиспускания.
Удержание мочи при создании ортотопического мочевого пузыря осуществляется за счет наружного сфинктера мочевого пузыря. Поэтому обязательными условиями являются пересечение уретры сразу ниже верхушки предстательной железы и минимальная травматизация поперечно-полосатого сфинктера. Противопоказаниями к формированию ортотопического мочевого пузыря являются переходно-клеточный рак простатической части уретры, carcinoma in situ, сложные стриктуры мочеиспускательного канала, применение высоких доз лучевой терапии до операции.
Для формирования искусственного мочевого пузыря используются тонкая кишка - операции Studer; Camey II; Hemi-Kock (рис. 29.6), илеоцекальный угол (операция Mainz pouch I), толстая кишка.
После операций по созданию артифициального мочевого пузыря в ряде случаев отмечается ночное недержание мочи. В 1/3 случаев требуется периодическая катетеризация. Послеоперационные осложнения, требующие повторного хирургического вмешательства, отмечаются у 22 % больных.
Уретеросигмостомия исторически является первой операцией, направленной на сохранение контролируемого мочеиспускания. Данный вид деривации мочи ассоциирован с высокой частотой
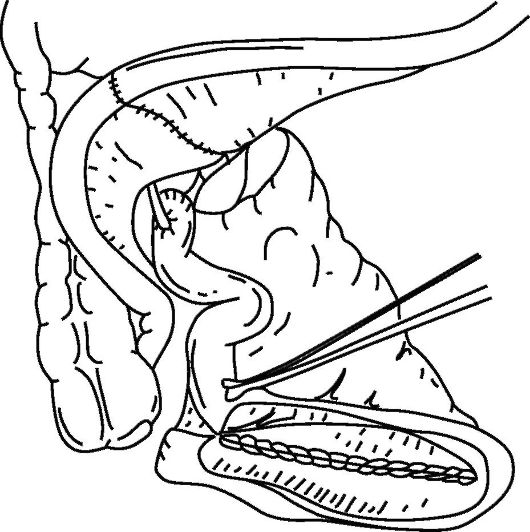 Рис. 29.6. Схема формирования искусственного мочевого пузыря с использованием тонкой кишки (операции Studer, Camey II, Hemi-Kock)
Рис. 29.6. Схема формирования искусственного мочевого пузыря с использованием тонкой кишки (операции Studer, Camey II, Hemi-Kock)
осложнений, включающих развитие гиперхлоремического и гипокалиемического ацидоза (31-50 %), восходящей мочевой инфекции (26-50 %), стриктуры мочеточников (33-50 %). Отмечено увеличение риска появления рака толстой кишки у данной категории пациентов.
В связи с этим был разработан ряд операций отведения мочи в непрерывный кишечник с созданием резервуаров низкого давления, открывающихся в сигмовидную или прямую кишку. Наиболее часто применяют методику конструирования резервуара из детубуляризированной петли сигмовидной кишки (Mainz pouch II). Данный вид деривации мочи позволяет добиться хороших функциональных и отдаленных результатов. Около 98 % больных, подвергнутых цистэктомии, операции Mainz pouch II, удерживают мочу. Применение антирефлюксной методики пересадки мочеточников обеспечивает отсутствие резервуарно-мочеточникового рефлюкса. Однако в ряде случаев отмечается развитие метаболического ацидоза, требующего медикаментозной коррекции.
Осложнения радикальной цистэктомии развиваются у 11 % больных и включают длительный парез кишечника, недостаточность уретрорезервуарного анастомоза, недостаточность межкишечного анастомоза. Послеоперационная летальность колеблется от 1 до 4 %. Смертность в отдаленном послеоперационном периоде определяется видом отведения мочи.
Рецидивы развиваются у 50 % больных, в большинстве случаев - в течение 24 мес после операции. Возможно появление рецидивных опухолей в полости малого таза (15-20 %), а также метастазов в регионарные лимфатические узлы (10-15 %) и отдаленных метастазов. Кроме того, надо принимать во внимание риск прогрессирования опухоли в уретре (5-13 %) и реже - верхних мочевых путях (1-3 %). Риск прогрессирования опухолевого процесса после радикальной цистэктомии строго коррелирует со стадией заболевания. Частота местных рецидивов после цистэктомии составляет 6 % при стадии
рТ2а, 18 % - при Т2в и 51 % - при Т3.
5-летняя выживаемость после цистэктомии составляет 40-60 %. Независимыми факторами, влияющими на прогноз, являются только стадия Т и наличие регионарных метастазов. Так, 5-летняя выживаемость больных при стадии рTis составляет 78-100 %, при рТ1 - 69-95 %, рТ2 - 63-70 %, рТ3а - 47-53 %, рТ3в - 31-33 %, рТ4 - 19-28 %. Наличие метастазов в регионарные лимфатические узлы резко ухудшает прогноз: 5 лет переживает только 7 % пациентов со стадией N+.
Кроме того, отмечено влияние на выживаемость степени дифференцировки и плоидности опухоли, состояния верхних мочевых путей, соматического статуса и других факторов.
Частота объективных ответов на проведение цисплатинсодержащей терапии при раке мочевого пузыря составляет 40-70 %. В связи с этим в настоящее время активно исследуется роль неоадъювантной, адъювантной, сочетанной с облучением и проводимой в монорежиме химиотерапии. Неоадъювантная химиотерапия, основанная на цисплатине, увеличивает выживаемость на 5 %, однако столь незначительное улучшение результатов не позволяет рекомендовать токсичное дооперационное лечение всем больным. Преимущество выживаемости при применении адъювантной химиотерапии после радикальной цистэктомии не доказано.
Изменение отношения к вопросам качества жизни в последнее время определяет повышение интереса к органосохраняющему лечению при инфильтративных опухолях.
ТУР мочевого пузыря, являющаяся основным методом в лечении поверхностных опухолей, в ряде случаев используется при инвазивном раке. Сомнительная радикальность эндоскопических вмешательств при инфильтративных новообразованиях обусловлена высокой вероятностью оставления опухолевых клеток в макроскопически неизмененных участках стенки органа. Помимо этого во время ТУР не производится удаление регионарных лимфатических узлов, которые поражаются у 66-75 % пациентов с инвазивными опухолями. Это ограничивает применение данного метода у больных раком мочевого пузыря стадий Т2-4. ТУР может быть использована у отобранных пациентов с солитарными опухолями T1G1-2 небольших размеров. Операцию можно считать радикальной при условии отсутствия опухолевых клеток в ткани ложа опухоли. ТУР мочевого пузыря при инвазивном раке обеспечивает высокое качество жизни больных. Однако частота рецидивов после применения данного вида лечения достигает 54 %. Около половины рецидивных опухолей также являются инвазивными. 5-летняя выживаемость пациентов с инфильтративными опухолями, подвергнутых только ТУР мочевого пузыря, составляет 36 %. Адъювантная химиотерапия после ТУР мочевого пузыря при инвазивном раке обеспечивает 3-летнюю безрецидивную выживаемость, достигающую 56 %.
Резекция мочевого пузыря может быть выполнена незначительному числу тщательно отобранных пациентов при наличии солитарной первичной инвазивной опухоли диаметром не более 5-6 см, локализующейся на подвижных стенках на расстоянии не менее 3 см от шейки и отсутствии carcinoma in situ в окружающей слизистой оболочке. Во время хирургического вмешательства необходимо удаление регионарных лимфатических узлов, так как при инвазивном раке риск их поражения увеличивается. Качество жизни остается удовлетворительным при условии сохранения более 50 % объема органа. После операций большего объема накопительная и сократительная функции мочевого пузыря, как правило, нарушаются. Рецидивы рака после резекции мочевого пузыря отмечаются в 56-65,5 % случаев. 5-летняя выживаемость при инвазивном раке мочевого пузыря после резекций различного объема составляет 32,5-79,4 %. Вероятность рецидивирования и продолжительность жизни пациентов зависят от стадии Т и степени анаплазии опухоли. Отмечены увеличение частоты рецидивов и уменьшение выживаемости после резекций мочевого пузыря при локализации новообразования в области шейки и треугольника Льето.
Отдаленные результаты органосохраняющего лечения инвазивного рака мочевого пузыря улучшаются при использовании комбинированного подхода с проведением неоадъювантной лучевой, химиоили химиолучевой терапии.
Лучевая терапия. Альтернативным методом лечения инвазивного рака мочевого пузыря является радикальная лучевая терапия. Облучение проводится пациентам, участвующим в клинических исследованиях при органосохраняющем лечении, а также с противопоказаниями к цистэктомии или отказавшимся от операции.
Радикальная лучевая терапия применяется при раке мочевого пузыря T1-4N0M0. Облучение проводят при достаточной емкости и сохранной функции мочевого пузыря, отсутствии тяжелой мочевой инфекции, предшествующих воспалительных заболеваний органов таза или хирургических вмешательств на них, повлекших за собой развитие выраженного спаечного процесса.
Наиболее часто применяют наружную ДЛТ. Принятый объем облучения включает мочевой пузырь, паравезикальную клетчатку и лимфатические узлы ниже бифуркации общих подвздошных артерий. Однако до настоящего времени не получено убедительных доказательств того, что облучение тазовых лимфатических узлов увеличивает выживаемость. Облучение проводят до СОД 60-65 Гр в РОД 1,8-2 Гр. Продолжительность лечения составляет 6-7 нед.
Альтернативой дистанционной лучевой терапии при солитарных опухолях диаметром <5 см является брахитерапия. Данный метод позволяет подвести источники облучения непосредственно к новообразованию, что создает условия для максимального повреждения опухоли при минимальном воздействии на окружающие ткани. Внутритканевая терапия позволяет достичь оптимального соотношения между общей и очаговой дозами. Применяются методики введения постоянного радиоактивного источника (98Au) и удаляемых гибких источников (137Cs, 192Ir, 182Ta).
В настоящее время широко исследуется роль симультанной химиотерапии в качестве индуктора эффекта облучения.
У большинства больных, получающих лучевую терапию на область таза, развиваются энтерит, проктит, цистит. Обычно данные осложнения выражены умеренно и купируются самостоятельно. Эректильная дисфункция появляется у 2/3 мужчин, получающих лучевую терапию.
Полная регрессия отмечается у 50 % больных инвазивным раком мочевого пузыря, подвергнутых облучению. Выполнение ТУР
мочевого пузыря перед началом лучевой терапии улучшает местный эффект лечения. Факторами, коррелирующими с высокой эффективностью консервативного лечения инвазивного рака мочевого пузыря, являются небольшие размеры опухоли, отсутствие гидронефроза, радикальное выполнение ТУР мочевого пузыря и полный эффект индукционного лечения.
Частота рецидивирования после облучения по радикальной программе составляет около 50 %.
Лучевая терапия обеспечивает удовлетворительную 5-летнюю выживаемость, достигающую 24-46 %. Прогноз заболевания зависит от стадии Т: в отдаленные сроки выживаемость при стадии Т2 составляет 26-59%, при Т3а - 35-52 %, при Т3в - 23-29 %. Кроме того, на продолжительность жизни пациентов, получавших лучевую терапию, влияют степень анаплазии, размер и локализация опухоли, состояние верхних мочевыводящих путей.
Неполная регрессия опухоли, а также появление рецидива служат показанием к осуществлению цистэктомии. Выполнить радикальную спасительную цистэктомию после попытки радикальной лучевой терапии удается в 80 % случаев. При этом 5-летняя выживаемость оперированных составляет 35-50 %.
Лечение диссеминированного рака мочевого пузыря
При раке мочевого пузыря с отдаленными метастазами долгое время наиболее эффективным методом лечения было проведение ПХТ по схеме М-VAC (метотрексат, винбластин, доксорубицин, цисплатин). При этом отдаленная выживаемость достигает 15-20 %; в группе пациентов с висцеральными метастазами - 15 %, у больных с поражением лимфатических узлов - 30 %. Средняя продолжительность жизни составляет 13 мес. Данный режим характеризуется выраженной токсичностью.
В настоящее время стандартом лечения распространенного рака мочевого пузыря является схема, включающая гемцитабин и таксаны; она позволяет добиться аналогичных результатов, однако токсичность ее намного ниже, чем M-VAC. Показано также, что применение сочетания гемцитабина и таксанов позволяет добиться хорошего эффекта у пациентов, которым безрезультатно проводилось лечение
M-VAC.
Описан хороший эффект у больных раком мочевого пузыря с метастазами при применении цисплатина, гемцитабина и таксанов.
К неблагоприятным факторам, влияющим на эффективность химиотерапии, относятся повышение уровня щелочной фосфатазы сыворотки крови, возраст старше 60 лет и плохой соматический статус пациента.
Наблюдение за больными раком мочевого пузыря
Наблюдение за больными после ТУР мочевого пузыря при поверхностном раке
Нерадикальное удаление опухоли, имплантация клеток рака в травмированную слизистую оболочку мочевого пузыря, а также быстрый рост эпителиальной опухоли приводят к высокой частоте рецидивирования переходно-клеточного рака в течение первых 3 мес после ТУР. Поэтому всем больным необходимо выполнять контрольную цистоскопию через 3 мес после операции. При низкодифференцированных поверхностных опухолях рекомендуется повторная контрольная ТУР зоны резекции менее чем через 3 мес после хирургического вмешательства.
Частота контрольных цистоскопий должна зависеть от наличия неблагоприятных факторов прогноза. У больных, относящихся к группе низкого риска развития рецидива, при условии отсутствия признаков рецидивирования в течение 3 мес следующее обследование может быть выполнено через 9 мес, а далее - ежегодно в течение 5 лет. При появлении рецидивной опухоли в 95 % случаев ее гистологические признаки аналогичны таковым у первичного новообразования.
Больным, относящимся к группе высокого риска, контрольную цистоскопию проводят каждые 3 мес в течение 2 лет, каждые 4 мес - в течение 3-го года и каждые 6 мес - в течение 4-го и 5-го года после ТУР мочевого пузыря. Частота контрольных обследований в группе умеренного риска занимает промежуточное положение. При появлении рецидива режим цистоскопий такой же, как и после 1-й операции.
Наблюдение за больными раком мочевого пузыря TaG1 продолжается в течение 5 лет. Во всех остальных случаях необходим контроль в течение 10 лет, а в группе высокого риска - пожизненно.
Рутинное выполнение экскреторной урографии при динамическом наблюдении не требуется в связи с низкой частотой появления опухолей верхних мочевых путей у больных раком мочевого пузыря. Данный метод обследования показан пациентам с carcinoma in situ при сохранении положительных результатов цитологического исследования мочи.
Наблюдение за больными после радикальной цистэктомии
В течение 1-го полугодия после радикальной цистэктомии обследование должно проводиться каждые 3 мес, в следующие 1,5 года - каждые 6 мес, далее - ежегодно. Контрольное обследование включает УЗКТ полости малого таза, печени и почек, а также уретроскопию и рентгенографию органов грудной клетки.
Вопросы для самоконтроля
1. Что относится к предполагаемым факторам риска развития рака мочевого пузыря?
2. Какие группы лимфатических узлов поражаются при диссеминации рака мочевого пузыря?
3. В каких органах чаще всего диагностируются отдаленные метастазы при инвазивном раке мочевого пузыря?
4. Какой морфологический тип опухоли чаще всего встречается при опухолевом поражении мочевого пузыря?
5. Что является наиболее частым клиническим симптомом при раке мочевого пузыря? Какое осложнение может развиться при этом?
6. Что может быть причиной развития хронической почечной недостаточности и анурии при раке мочевого пузыря?
7. Какой инструментальный метод диагностики является ведущим при раке мочевого пузыря?
8. Какие особенности клинического течения имеет поверхностный рак мочевого пузыря?
9. Какие особенности клинического течения имеет инвазивный рак мочевого пузыря?
10. Перечислите факторы прогноза развития рецидива после ТУР мочевого пузыря по поводу рака?
11. Назовите группы риска развития рецидива рака мочевого пузыря. Каким группам риска при поверхностном раке мочевого пузыря показана дальнейшая терапия после ТУР мочевого пузыря?
12. Что является показанием к проведению цистэктомии у больных раком мочевого пузыря?
13. Какие сроки наблюдения показаны при динамическом контроле за пациентами, получившими лечение по поводу поверхностного рака мочевого пузыря?