Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев. 2010. - 920 с.
|
|
|
|
ГЛАВА 30 РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
ЭПИДЕМИОЛОГИЯ
В структуре онкологической заболеваемости мужчин в России рак предстательной железы (РПЖ) находится на 4-м ранговом месте, составляя 15,5 %. В 2007 г. заболеваемость им достигла 30,7 на 100 тыс. мужского населения. Прирост показателей заболеваемости за последние 7 лет составил 42,2 %. По величине прироста РПЖ вышел на 1-е ранговое место, что объясняется выявлением большого количества бессимптомных форм заболевания в связи с внедрением в повседневную практику диагностики опухолевого маркера - простатоспецифического антигена (ПСА).
В возрасте 60-70 лет у 40 % мужчин имеется микроскопический РПЖ. В связи с особенностями клинического течения опухоль может долгие годы не сказываться на самочувствии больного. Только в 10% случаев латентная форма РПЖ переходит в клинически значимую и приводит к смерти лишь 3-5 % больных. Отмечаются существенные различия в частоте заболеваемости в разных географических регионах и этнических группах. Наиболее высока заболеваемость в США, самая низкая - в странах Азии и Африки. За последние годы уменьшилась частота местно-распространенных и диссеминированных опухолей и повысилась доля клинически локализованного РПЖ.
ЭТИОЛОГИЯ
Этиология РПЖ неизвестна, однако выявлено влияние ряда факторов на риск развития опухоли данной локализации. Отмечено увеличение частоты заболеваемости РПЖ у мужчин пожилого и старческого возраста. Многие исследователи поддерживают гормональную гипотезу развития РПЖ. В ряде работ отмечается роль генетической предрасположенности к данному заболеванию. Многочисленные
исследования, посвященные изучению влияния на риск развития РПЖ различных факторов, таких, как повышенное потребление животных жиров, воздействие кадмия, инфекционных факторов, не выявили их достоверной связи с заболеваемостью.
МОРФОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ
Наиболее распространенной гистологической формой опухолей РПЖ является аденокарцинома. В 70 % случаев рак развивается в периферической, в 20 % - переходной и в 10 % - в центральной зоне железы.
С целью стандартизации интерпретации морфологической картины данной опухоли, а также определения тактики лечения и прогноза заболевания широко применяется гистологическая шкала Глисона, основанная на определении степени дифференцировки железистых структур опухоли и сопоставимая со значением степени клеточной анаплазии. В соответствии с классификацией Глисона выделяют 5 градаций. Для расчета показателя Глисона суммируют 2 градации, наиболее часто встречающиеся в опухоли. Показатель Глисона <4 баллов соответствует I степени анаплазии, от 4 до 7 баллов - II, более 7 баллов - III степени.
КЛАССИФИКАЦИЯ TNM (2002)
Правила классификации
Представленная ниже классификация применима только для аденокарциномы. Переходно-клеточный РПЖ относят к опухолям мочеиспускательного канала. В каждом случае необходимо гистологическое подтверждение диагноза.
Регионарные лимфатические узлы
К регионарным относят лимфатические узлы малого таза, которые в большинстве случаев расположены ниже бифуркации общей подвздошной артерии.
Наличие ипсилатеральных либо контралатеральных регионарных метастазов не влияет на показатель классификации N.
Клиническая классификация TNM
T - первичная опухоль
Тх - оценка первичной опухоли невозможна.
Т0 - первичная опухоль не обнаружена.
Т1 - непальпируемая опухоль, не выявляемая с помощью методов исследования и не имеющая клинических проявлений: Т1а - объем случайно обнаруженной опухоли при резекции
железы - до 5 % от общего размера образца; Т1Ь - объем случайно обнаруженной опухоли при резекции железы - более 5 % от общего размера образца; Т1с - опухоль идентифицируют по результатам пункционной
биопсии (у больных с повышенным уровнем ПСА). Т2 - опухоль ограничена в пределах простаты*:
Т2а - пальпируемая опухоль не выходит за пределы половины доли;
Т2Ь - пальпируемая опухоль выходит за пределы половины доли, но не занимает обе доли;
Т2с - опухоль поражает обе доли. Т3 - опухоль прорастает через капсулу железы**:
Т3а - одностороннее или двустороннее распространение опухоли за пределы капсулы;
Т3Ь - опухоль поражает семенной пузырек. Т4 - опухоль поражает соседние структуры, за исключением
семенных пузырьков: шейку мочевого пузыря, сфинктер
мочеиспускательного канала, прямую кишку, стенку таза и
(или) мышцы, поднимающие задний проход.
Обратите внимание!
* Опухоль, обнаруженную в одной или обеих долях железы с помощью трансректальной биопсии, но не выявляемую при пальцевом ректальном исследовании или применений лучевых методов, относят к группе Т1с
** Поражение верхушки железы или самой капсулы (без проникновения за ее пределы) позволяет отнести опухоль к группе Т2, а не Т3.
N - регионарные лимфатические узлы
? - состояние регионарных лимфатических узлов оценить невозможно.
N0 - метастазов в регионарных лимфатических узлах нет. N1 - метастазы в регионарные лимфатические узлы имеются.
М - отдаленные метастазы
Мх - наличие отдаленных метастазов оценить невозможно.
М0 - отдаленных метастазов нет.
М1 - наличие отдаленных метастазов.
М1а - метастазы в нерегионарные лимфатические узлы.
М1Ь - метастазы в кости.
М1с - висцеральные метастазы. При наличии метастазов более одной локализации указывается наиболее высокая категория М.
Патоморфологическая классификация pTNM
Критерии выделения категорий рТ, pN и рМ соответствуют таковым для категорий Т, N и М.
Категория рТ1 отсутствует по причине недостаточного количества ткани для оценки максимальной категории рТ.
Обратите внимание!
Метастазы диаметром не более 0,2 см относят к группе pN1 (mi).
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина РПЖ складывается из симптомов, обусловленных первичным опухолевым очагом, и проявлений метастазов, определяющихся их локализацией. В связи с тем, что аденокарцинома, как правило, развивается в периферических отделах железы, РПЖ длительное время течет бессимптомно, и жалобы появляются при распространенных формах заболевания. Нарушение пассажа мочи по простатическому отделу уретры вызывает затруднение мочеиспускания вплоть до задержки мочи, дизурию. Прорастание слизистой оболочки уретры или шейки мочевого пузыря опухолью может привести к появлению гематурии. Сдавление или прорастание прямой кишки опухолью служит причиной стойкого запора и примеси крови в кале. Опухоль предстательной железы может привести к сдавлению устьев мочеточников, обусловливающему уретерогидронефроз и почечную недостаточность. Метастатическое поражение тазовых лимфатических узлов может стать причиной лимфостаза и появления отеков нижних конечностей. Наиболее типичная локализация метастазов РПЖ - кости (позвоночник, кости таза, ребра). В связи с этим нередко первыми проявлениями заболевания служат боль в костях, патологические переломы позвоночника и развитие симптомов сдавления спинного мозга (параличи, парезы, нарушение функции тазовых органов).
ДИАГНОСТИКА
Основными методами диагностики РПЖ являются определение уровня ПСА в сыворотке крови, пальцевое ректальное исследование и трансректальное УЗИ. Для морфологической верификации диагноза используется пункционная биопсия простаты.
ПСА - опухолевый маркер, позволяющий диагностировать, оценивать эффективность лечения РПЖ и определять прогноз. Повышение уровня ПСА, помимо РПЖ, может быть обусловлено простатитом, доброкачественной гиперплазией, трансуретральными и трансректальными манипуляциями. Несмотря на большую роль ПСА в ранней диагностике РПЖ, метод характеризуется специфичностью (позволяет отличать больных РПЖ от здоровых) только при высоких значениях маркера (>10 нг/мл). При низких значениях (<2,5 нг/мл) специфичность маркера низкая. Иными словами, у мужчин с сывороточным уровнем ПСА <2,5 нг/мл нельзя исключить наличие РПЖ. С целью повышения специфичности (дифференциации злокачественного и доброкачественного процессов) предложено использовать определение плотности, скорости прироста и соотношения свободного и связанного ПСА, так как содержание свободной фракции маркера у больных РПЖ значительно ниже, чем при незлокачественных заболеваниях.
Для определения показаний к выполнению биопсии предстательной железы предложены условные возрастные нормы: 40-49 лет - 0-2,5 нг/мл, 50-59 лет - 0-3,5 нг/мл, 60-69 лет - 0-4,5 нг/мл, 70-79 лет - 0-6,5 нг/мл. В скрининговых программах традиционно используют пороговый уровень ПСА в 3-4 нг/мл для всех возрастных групп.
Отмечена корреляция уровня данного маркера и стадии заболевания. При ПСА <10 нг/мл риск диссеминации опухоли равен 0. При ПСА более 50 нг/мл в 80 % случаев имеется экстракапсулярная инвазия опухоли, в 66 % - поражение регионарных лимфатических узлов. Повышение ПСА >100 нг/мл ассоциировано с наличием метастазов у 100 % пациентов.
Несмотря на широкое применение современных диагностических методов (рис. 30.1), вероятность ошибки при стадировании заболевания остается высокой, особенно при локализованном РПЖ. С целью предсказания вероятности экстракапсулярного распространения опухоли, вовлечения семенных пузырьков и поражения лимфатических узлов разработаны номограммы, основанные на сумме баллов по
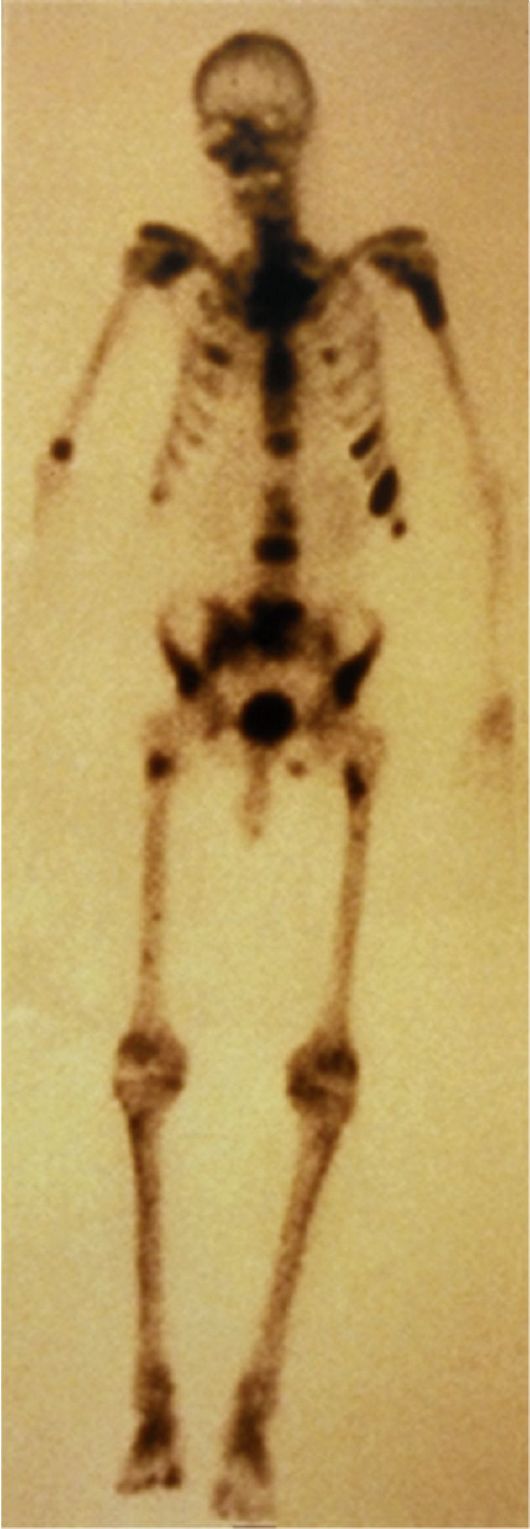 Рис. 30.2. Метастазы РПЖ в кости. Сканограмма
Рис. 30.2. Метастазы РПЖ в кости. Сканограмма
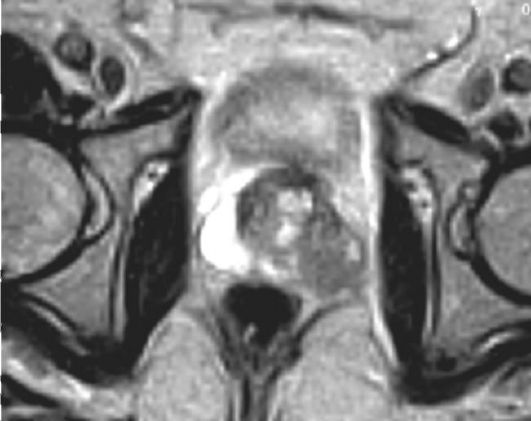 Рис. 30.1. Рак предстательной железы. Магнитно-резонансная томограмма
Рис. 30.1. Рак предстательной железы. Магнитно-резонансная томограмма
шкале Глисона, значении категории Т и уровне ПСА перед началом лечения.
КТ и МРТ - наиболее информативные методы оценки состояния лимфатических узлов таза. С целью выявления метастазов выполняют сканирование (рис. 30.2) и по показаниям рентгенографию костей скелета, органов грудной клетки, УЗИ органов брюшной полости и забрюшинного пространства.
ЛЕЧЕНИЕ
Выбор метода лечения РПЖ определяется стадией опухолевого процесса. При локализованных формах заболевания (T1-2N0M0) используются 2 основных подхода, обеспечивающих сходные отдаленные результаты: радикальная простатэктомия и лучевая терапия. Оба метода также
применяются в лечении местно-распространенного рака простаты (T3N0/+M0). С учетом гормональной зависимости аденокарциномы предстательной железы единственным эффективным видом лечебного воздействия при распространенных формах заболевания (T1-4N0/+M1) является гормонотерапия с блокадой андрогенной стимуляции опухоли. Переход РПЖ в гормонально-резистентную фазу служит показанием к химиотерапии.
Лечение локализованного РПЖ
В настоящее время дискутируется вопрос о необходимости незамедлительного (после установления диагноза) лечения локализованных форм РПЖ. В рандомизированных исследованиях продемонстрирована удовлетворительная (87 %) отдаленная выживаемость больных, получавших отсроченное лечение. При этом летальность, обусловленная опухолью, достоверно снижается по мере увеличения среднего возраста больных. Сокращение продолжительности жизни, ассоциированное с основным заболеванием, у молодых мужчин в 10 раз выше, чем у пациентов старше 75 лет. По мере снижения степени дифференцировки опухоли летальность значительно увеличивается. Из сказанного выше следует, что у молодых больных РПЖ при средней и низкой степени дифференцировки опухоли вместо ожидаемой продолжительностьюи жизни более 10 лет весьма высок риск преждевременного исхода, поэтому они должны рассматриваться как кандидаты для агрессивных видов лечения. Динамическое наблюдение может быть рекомендовано больным с малой ожидаемой продолжительностью жизни, имеющим высокодифференцированные опухоли.
Методом выбора при локализованном РПЖ является радикальная простатэктомия, предусматривающая удаление железы единым блоком с семенными пузырьками и парапростатической клетчаткой. Обязательным условием хирургического вмешательства данного объема является удаление регионарных лимфатических узлов, позволяющее адекватно установить категорию N. Тазовая лимфаденэктомия - стадирующая процедура. Лечебное воздействие лимфодиссекции при РПЖ не доказано. Ранее рекомендовалось удаление наружных подвздошных и обтураторных лимфатических узлов. Границы лимфодиссекции расширялись в группе высокого риска поражения лимфатических узлов согласно номограммам. Однако в современных сериях, основанных на данных расширенных лимфаденэктомий,
выявлена более высокая частота поражения регионарных лимфатических узлов с преобладанием доли метастазов в обтураторной зоне и вдоль внутренних подвздошных сосудов, чем в ранних исследованиях. Отмечено значительное расхождение реального риска наличия N+ с таблицами Partin при всех концентрациях ПСА и сумме баллов по Глисону >4. В последних работах отмечено увеличение периода без биохимического рецидива у больных с поражением небольшого количества лимфатических узлов в зависимости от числа удаленных метастазов. В связи с этим у пациентов с визуально неизмененными узлами, любым ПСА и суммой баллов по Глисону >4 рекомендуется выполнять расширенную лимфаденэктомию, включающую лимфодиссекцию вдоль общих, наружных, внутренних подвздошных, запирательных сосудов и удаление пресакральных лимфатических узлов.
Радикальная простатэктомия ассоциирована с небольшой частотой неспецифических хирургических осложнений и низкой летальностью. Специфическим осложнением данной операции является импотенция. Основным методом предотвращения развития эректильной дисфункции у данной категории больных является сохранение как минимум одного сосудисто-нервного пучка во время вмешательства. Непременными условиями выполнения нервосберегающей радикальной простатэктомии являются нормальная потенция до операции, заинтересованность больного в ее сохранении, отсутствие пальпируемого узла со стороны сохраняемого сосудисто-нервного пучка, низкодифференцированной опухоли в большинстве биопсийных препаратов, отсутствие опухоли в области верхушки простаты по данным пальцевого исследования и биопсии. Тщательное анатомичное выполнение нервосберегающей операции позволяет во многих случаях сохранить потенцию.
У пациентов, страдающих РПЖ T1-2b, имеющих противопоказания к выполнению радикальной простатэктомии и ожидаемую продолжительность жизни >5-10 лет, методом выбора является лучевая терапия. В настоящее время наиболее распространенный вид лучевого воздействия - ДЛТ с использованием мегавольтных источников. Зона облучения включает область простаты. В многочисленных исследованиях не выявлено преимуществ в выживаемости больных, подвергнутых облучению клинически негативных лимфатических узлов и семенных пузырьков. Увеличение дозы облучения >70 Гр приводит к повышению эффективности лечения,
но сопряжено с нарастанием частоты осложнений. Рациональной СОД при ДЛТ с конвенционным облучением является 68-70 Гр. При конформной лучевой терапии, позволяющей выбрать наиболее рациональные условия лучевого воздействия, возможно применение более высоких доз.
Альтернативой ДЛТ у больных локализованным РПЖ с объемом железы не более 50 см3 является внутритканевая лучевая терапия - брахитерапия постоянными или временными источниками. Брахитерапия проводится за один сеанс и включает 2 этапа. На 1-м этапе выполняют трансректальное УЗ-сканирование предстательной железы, определение ее объема, рассчитывают количество и определяют положение радиоактивных зерен, способных обеспечить равномерное распределение дозы в железе. На 2-м этапе источники радиоактивного излучения в виде зерен, содержащих радиоактивный изотоп и фиксированных на нити, вводятся закрытым способом в предстательную железу с помощью специальных игл. После удаления игл зерна остаются в железе и обеспечивают нужный уровень радиоактивного излучения в течение нескольких недель. Обычно рекомендуемая минимальная периферическая доза составляет 140-160 Гр. Поскольку зерна доставляются непосредственно в предстательную железу, концентрация излучения внутри опухоли в 2-3 раза выше, чем при ДЛТ, когда используются более низкие дозы из-за опасения повредить здоровые ткани. Результаты брахитерапии сравнимы с радикальной простатэктомией и ДЛТ.
Лечение местно-распространенного РПЖ
Методом выбора в лечении местно-распространенного РПЖ (Т3?М0) является ДЛТ. Проведение неоадъювантной гормонотерапии перед облучением при местно-распространенном РПЖ приводит к достоверному уменьшению объема железы, а также увеличивает безрецидивную выживаемость. Адъювантное гормональное лечение в течение 2-3 лет после лучевой терапии улучшает у данной категории больных как общую, так и безрецидивную выживаемость.
Долгие годы методом выбора при местно-распространенном РПЖ ^3N0M0) была лучевая и (или) гормонотерапия. Однако ни в одном исследовании не продемонстрировано преимуществ гормональнолучевой терапии над хирургическим методом. Радикальная простатэктомия при стадии Т3 показана тщательно отобранным пациентам с поражением 1 доли предстательной железы, ПСА <20 нг/мл и сумме
баллов по шкале Глисона не более 8. Хирургическое вмешательство должно быть агрессивным и включать расширенную тазовую лимфодиссекцию, удаление сосудисто-нервного пучка (по крайней мере, со стороны поражения), семенных пузырьков и шейки мочевого пузыря. В 20 % наблюдений регистрируется клиническое завышение стадии, и данная группа больных с патологической категорией рТ2 не нуждается в дополнительном лечении. У 100 % пациентов со стадией рТ3 в течение 24-36 мес после операции возникают рецидивы, поэтому желательно ее дополнить адъювантным лучевым или гормональным лечением, достоверно увеличивающими время до прогрессирования и специфическую выживаемость. В некоторых исследованиях получены данные, свидетельствующие о возможной роли неоадъювантной гормонотерапии в комбинированном лечении больных местнораспространенным РПЖ.
Отсроченное лечение при бессимптомном РПЖ в стадии T3-4NxM0 приводит к снижению продолжительности жизни, поэтому наблюдение может быть рекомендовано только пациентам с низкой ожидаемой продолжительностью жизни и высокой степенью дифференцировки опухоли G1-2.
Лечение распространенного РПЖ
Рост и размножение клеток аденокарциномы предстательной железы происходит под воздействием андрогенов. Единственным методом лечения распространенного РПЖ является гормонотерапия, приводящая к прекращению выработки андрогенов путем кастрации (медикаментозной или хирургической) и (или) нарушающая их связывание с рецепторами в опухоли за счет применения антиандрогенов.
До недавнего времени «золотым стандартом» 1-й линии терапии диссеминированного РПЖ признавали удаление обоих яичек, снижающее уровень сывороточного тестостерона на 95 % в течение 3 мес. Хирургическая кастрация - наиболее дешевый метод лечения, но она сопряжена с серьезной психологической травмой.
С целью медикаментозной кастрации применяются агонисты гонадотропин-рилизинггормона ГтРГ (гозерелин, леупролид, бусерелин), вызывающие гиперстимуляцию рецепторов ГтРГ, приводя к супрессии продукции лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов. При этом кастрационный уровень тестостерона достигается в течение 2-3 нед после начала лечения.
У больных, начавших лечение агонистами ГтРГ, отмечается первичная гиперсекреция тестостерона (синдром «вспышки»). Для подавления клинических проявлений повышения уровня тестостерона возможно применение антиандрогенов перед введением агонистов ГтРГ. Значимых различий результатов при применении разных препаратов данной группы не обнаружено. Доказана равная эффективность медикаментозной и хирургической кастрации. Не выявлено различий между результатами лечения агонистами ГтРГ и диэтилстильбэстролом при большей частоте сердечно-сосудистых осложнений в случае применения эстрогенов.
Как медикаментозная, так и хирургическая кастрация позволяют добиться объективного ответа более чем у 80 % больных. К сожалению, этот вид лечения имеет ограниченную эффективность, так как у 20 % пациентов не удается достичь объективного ответа. Среднее время до прогрессирования составляет 12-33 мес. Через 18-24 мес у большинства больных развивается рефрактерность к дальнейшей гормональной терапии. После перехода заболевания в гормонорезистентную фазу медиана выживаемости составляет 23-37 мес.
Максимальная андрогенная блокада (МАБ) достигается применением кастрации (медикаментозной или хирургической) в сочетании с антиандрогенами, что приводит к блокаде продукции тестостерона и нарушению его взаимодействия с рецепторами. В настоящее время доказано, что МАБ приводит к достоверному, но очень небольшому увеличению выживаемости (5 %) по сравнению с кастрацией. Наибольшее преимущество в выживаемости обеспечивает МАБ, в состав которой в качестве антиандрогена включают нестероидный препарат.
Монотерапия антиандрогенами является привлекательной альтернативой кастрации и МАБ, предложенной как метод андрогенной блокады, который может предотвратить побочные эндокринные эффекты, в том числе подавление сексуальной функции. В настоящее время применяется 5 основных препаратов данного класса: стероидные антиандрогены - ципротерона ацетат и мегестрола ацетат, и нестероидные антиандрогены - флутамид, бикалутамид и нилутамид. Монотерапия нестероидными антиандрогенами у пациентов с распространенным РПЖ без отдаленных метастазов обеспечивает результаты, сравнимые с таковыми при кастрации. У больных с отдаленными метастазами монотерапия антиандрогенами уступает кастрационной терапии в отношении выживаемости.
Интермиттирующая (перемежающаяся) гормональная терапия предполагает проведение гормонотерапии до снижения ПСА до неопределяемого уровня с последующим возобновлением лечения при повышении уровня ПСА. Интермиттирующее лечение позволяет улучшить сексуальную функцию и снизить частоту побочных эффектов при отсутствии различий в выживаемости и во времени до прогрессирования (по сравнению с показателями при постоянном лечении) у больных со стадией М0, суммой баллов по шкале Глисона <7, достигших нормального уровня ПСА после 1-го цикла лечения. Предполагают, что данный подход способен задержать развитие гормональной резистентности опухоли. Ожидаются результаты крупных рандомизированных исследований по изучению отдаленных результатов интермиттирующего режима лечения.
Лечение гормонорезистентного РПЖ
В большинстве случаев РПЖ изначально является андрогензависимой опухолью, представленной тремя популяциями клеток: гормонально чувствительными, гормонально зависимыми и гормонально нечувствительными. Под воздействием андрогенной депривации происходят селекция андрогеннезависимых клеток и переход заболевания в гормонально-рефрактерную фазу. Период сохранения андрогенной зависимости опухоли колеблется от 18 до 40 мес. Гормонорезистентный РПЖ диагностируется на основании повышения уровня ПСА в 2-3 измерениях через 2 нед и более на фоне характерного после кастрации уровня тестостерона.
При переходе заболевания в гормонорезистентную форму возможна попытка гормональных манипуляций 2-й линии. У пациентов, получавших максимальную андрогенную блокаду, отмена антиандрогенов в 13-30 % случаев приводит к снижению уровня ПСА в среднем на 3,5 мес. Больным, подвергнутым только кастрации, показано назначение антиандрогенов; лечебный эффект достигается в 15-54 % случаев при средней продолжительности 4-11 мес. Гормонотерапией 3-й линии являются эстрогены, кетоконазол и кортикостероиды.
В последние годы изучаются новые направления гормонотерапии РПЖ. Получены данные о противоопухолевой эффективности супрессоров пролактина и аналогов соматостатина.
До недавнего времени стандартом лечения гормонорезистентного РПЖ была комбинация митоксантрона с преднизолоном,
позволяющая снизить интенсивность боли в 30 % наблюдений, но не влияющая на выживаемость. Завершенные в 2004 г. исследования SWOG и TAX убедительно продемонстрировали преимущество режимов, основанных на доцетакселе. Схемы химиотерапии с включением доцетаксела позволяют снизить риск смерти от РПЖ, увеличить медиану выживаемости, время до прогрессирования и повышения уровня ПСА, а также улучшить качество жизни по сравнению с таковым при применении митоксантрона. Изучаются комбинации доцетаксела с таргетными агентами, теоретически способными увеличить эффективность таксанов.
ПРОГНОЗ
Радикальная простатэктомия позволяет добиться соответственно 10- и 15-летней выживаемости больных РПЖ T1-2 в95 и85 % случаев. Важнейшими прогностическими факторами, влияющими на продолжительность жизни оперированных, являются стадия Т, степень дифференцировки опухоли (сумма баллов по шкале Глисона) и предоперационный уровень ПСА.
ДЛТ при РПЖ T1-2 позволяет добиться удовлетворительных отдаленных результатов, которые несколько уступают радикальному хирургическому лечению; 10-летняя выживаемость без местного рецидива достигает 71-96 %.
Полный эффект лечения при местно-распространенном РПЖ ^3NxM0) достигается в 20-30 % случаев. Общая 10- и 15-летняя выживаемость при стадии Т3 составляет соответственно 35-42 и
18-31 %, при Т4 - 15 и 15 %.
Вопросы для самоконтроля
1. Какой гистологический тип опухоли чаще всего встречается при РПЖ?
2. Какие симптомы чаще всего обусловлены местным распространением РПЖ?
3. Где чаще всего диагностируются метастазы РПЖ?
4. Перечислите основные методы диагностики РПЖ.
5. Чем может быть вызвано повышение титра ПСА при отсутствии
РПЖ?
6. Какие основные подходы существуют для лечения локализованного РПЖ?
7. Какой объем оперативного вмешательства включает в себя термин «радикальная простатэктомия» при РПЖ?
8. Для чего выполняется нервосберегающая простатэктомия? Перечислите условия, необходимые для выполнения нервосберегающей радикальной простатэктомии.
9. Что включает в себя термин «максимальная андрогенная блокада»
при РПЖ?
10. Что означает термин «интермиттирующая гормональная терапия»? С какой целью используется данная методика?
11. Что может указывать на развитие гормонорезистентности РПЖ?