Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев. 2010. - 920 с.
|
|
|
|
ГЛАВА 27 РАК ПОЧКИ
ЭПИДЕМИОЛОГИЯ
Заболеваемость раком почки в России в 2007 г. составляла 11,8 на 100 тыс. населения. Среди всех злокачественных новообразований у мужчин опухоль занимает 9-е, среди женщин - 10-е место. Абсолютный прирост заболеваемости в России за последние 10 лет составил 13,3 на 100 тыс. населения (3-е место). Ежегодно от рака почки умирают около 8 тыс. россиян. Показатель смертности при данном злокачественном новообразовании среди мужчин составляет 7,1 на 100 тыс., среди женщин - 0,8. Заболеваемость почечно-клеточным раком достигает максимума к 70 годам. У мужчин рак почки развивается чаще, чем у женщин.
ЭТИОЛОГИЯ
Несмотря на значительное количество исследований, посвященных раку почки, этиология этой формы опухоли до сих пор не ясна. Однако выделено несколько групп факторов риска, способствующих развитию данного новообразования.
Продемонстрировано неблагоприятное влияние курения табака и количества выкуриваемых сигарет на вероятность развития рака почки. Риск появления опухоли почки у курящих (как мужчин, так и женщин) возрастает с 30 до 60 % по сравнению с некурящим населением. При отказе от курения вероятность развития заболевания уменьшается. В течение 25 лет после отказа от курения риск появления рака почки снижается на 15 %.
Вероятность развития рака почки повышается при чрезмерной массе тела. Ожирение ассоциируется с ростом частоты заболеваемости почечно-клеточным раком на 20 %. Колебания массы тела и значительное ее увеличение у взрослых - независимые факторы риска развития данной патологии.
Риск заболеть раком почки у больных артериальной гипертензией возрастает на 20 %. Остается открытым вопрос, является причиной развития почечно-клеточного рака собственно гипертензия или развитие опухоли потенцируется применением разнообразных гипотензивных препаратов? Так, при повторном обследовании групп больных, страдающих гипертензией и получавших соответствующее лечение, было выявлено, что, несмотря на нормализацию давления, риск развития рака почки остается на прежнем уровне.
Известно, что в ряде случаев опухоль почки способствует развитию артериальной гипертензии. Проведено исследование с целью оценки влияния истинной гипертензии, развившейся до выявления опухоли почки, на вероятность появления почечно-клеточного рака. Согласно полученным результатам, риск развития рака почки повышен у больных с гипертензионным анамнезом длительностью 5 лет и более.
В ряде работ отмечено увеличение заболеваемости почечно-клеточным раком больных, страдающих сахарным диабетом. Однако показатели смертности от рака почки в данной группе аналогичны таковым в популяции. Тесная взаимосвязь между сахарным диабетом, ожирением и гипертензией затрудняет оценку истинного влияния каждого из этих заболеваний на частоту развития опухоли почки.
Многие авторы связывают появление почечно-клеточного рака с использованием диуретических препаратов. Риск развития этой патологии у больных, получавших мочегонные средства, по различным показаниям, составляет более 30 %. Установлено, что препараты, содержащие амфетамин, в значительной степени увеличивают риск развития рака почки. Прием фенацетинсодержащих анальгетических препаратов увеличивает вероятность заболевания опухолью почки.
Не доказано увеличение частоты заболеваемости раком почки при мочекаменной болезни и у пациентов с кистами почек. Отмечен повышенный риск развития почечно-клеточного рака при терминальной стадии хронической почечной недостаточности (ХПН).
Установлена корреляция между частотой возникновения рака почки и употреблением мяса, растительных продуктов, а также маргарина и масла, однако достоверного влияния конкретных продуктов питания на заболеваемость почечно-клеточным раком не выявлено. Возможно, патогенетическое значение имеют не сами исходные продукты, а вещества, выделяющиеся при приготовлении пищи.
Доказанным канцерогенным эффектом обладают пиролизисные составляющие, в частности гетероциклические амины, вырабатывающиеся при высокотемпературной обработке мяса. Употребление овощей и фруктов, по данным большинства авторов, способствует снижению риска развития рака почки.
Почечно-клеточный рак не является профессиональным заболеванием. Однако есть данные о повышенном риске развития данной патологии у лиц, занятых в ткацком, резиново-каучуковом, бумажном производстве, имеющих контакт с промышленными красителями, нефтью и ее производными, промышленными ядохимикатами и солями тяжелых металлов.
МОРФОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ
Выделяют 4 вида рака почки: светлоклеточный (60-85 %), хромофильный (папиллярный; 7-14 %), хромофобный (4-10 %) и рак собирательных протоков (2-5 %). Гистологические типы рака почки имеют характерные генетические особенности, обусловливающие различие морфологических признаков, разное клиническое течение и ответ на системную терапию.
Светлоклеточный рак характеризуется наличием делеции хромосомы 3р. Только в опухолях данного типа имеет место мутация гена VHL (Вона-Гиппеля-Линдау). Другими специфическими генетическими изменениями светлоклеточного почечно-клеточного рака являются дупликация хромосомы 5q22 и делеции плеча хромосом 6q,8p,9p и 14q. Данный тип рака почки чаще характеризуется инфильтративным ростом с сосудистой инвазией, имеет более высокий метастатический потенциал и отличается худшей выживаемостью, чем при папиллярной и хромофобной формах. Прогрессирование опухолевого процесса при традиционном почечно-клеточном раке ассоциировано с дополнительными генетическими альтерациями, такими, как дупликация хромосомы 5q22 и делеция участков хромосом 6q23,8p,9p и 14q.
При папиллярной форме рака почки обычно выявляется комбинация трисомий по 7,17,3q,8,12,16 и 20 хромосомам, а также утрата Y-хромосомы. Папиллярная карцинома часто бывает двусторонней и мультифокальной. Эта форма рака ассоциирована с лучшей выживаемостью, чем светлоклеточный, но худшей, чем хромофобный тип опухоли.
Для хромофобного рака характерно уменьшение количества хромосом в сочетании с гетерозиготностью по хромосомам 1,2,6,10,13, 17,21,X и гипоплоидным содержанием ДНК. Данная форма почечно-клеточного рака имеет низкий метастатический потенциал. Выживаемость больных с хромофобными опухолями выше, чем с папиллярной и светлоклеточной формами рака почки.
Рак собирательных протоков является редкой опухолью. Специфические для данного типа опухоли генетические альтерации не выявлены. Эта опухоль очень агрессивная, с высоким метастатическим потенциалом.
Рост и метастазирование
Почечно-клеточный рак составляет 95 % опухолей почечной паренхимы. Рак почки склонен к местно-деструирующему росту с инвазией венозных сосудов и формированием опухолевого тромба почечной вены, НПВ и правых камер сердца (10 % случаев). Диссеминация опухолевого процесса происходит лимфогенным и гематогенным путями. Чаще всего поражаются легкие (32 %), кости (25 %), регионарные (забрюшинные) лимфатические узлы (20 %) и печень (8 %). Возможно также метастазирование в нерегионарные группы лимфатических узлов, надпочечники, контралатеральную почку, головной мозг, мягкие ткани.
КЛАССИФИКАЦИЯ TNM (2002)
Правила классификации
Представленная ниже классификация применима только для рака почки. В каждом случае необходимо гистологическое подтверждение диагноза.
Регионарные лимфатические узлы
К регионарным относят лимфатические узлы ворот почки, а также парааортальные, преаортaльныe, интераортокавальные, прекавальные, паракавальные, ретрокавальные и ретроаортальные лимфатические узлы.
Наличие ипсилатеральных либо контралатеральных регионарных метастазов не влияет на показатель классификации N.
Клиническая классификация 1ЫМ
Т - первичная опухоль
Тх - оценка первичной опухоли невозможна. Т0 - первичная опухоль не обнаружена.
Т1 - опухоль размером до 7 см в наибольшем измерении, ограничена в пределах почки:
Т1а - опухоль размером до 4 см в наибольшем измерении,
ограничена в пределах почки; Т1Ь - опухоль размером 4,1-7 см в наибольшем измерении, ограничена в пределах почки. Т2 - опухоль размером более 7 см в наибольшем измерении, ограничена в пределах почки. Т3 - опухоль поражает крупные вены, надпочечники или околопочечную клетчатку, но не распространяется на почечную фасцию:
Т3а - опухоль поражает надпочечники, околопочечную клетчатку* и клетчатку почечной пазухи путем непосредственного распространения, но не проникает за пределы почечной фасции;
Т3Ь - опухоль проникает в почечную вену** либо ее сегментарные ветви, а также в полую вену, расположенную ниже диафрагмы;
Т3с - опухоль проникает в полую вену, расположенную выше диафрагмы, либо поражает ее стенку. Т4 - опухоль распространяется за пределы почечной фасции.
Обратите внимание!
* Околопочечная клетчатка включает также жировую ткань ворот почки.
** К почечной вене относят и сегментарные ветви. N - регионарные лимфатические узлы
? - состояние регионарных лимфатических узлов оценить невозможно.
N0 - метастазов в регионарных лимфатических узлах нет.
N1 - метастаз в один регионарный лимфатический узел.
N2 - метастазы в несколько регионарных лимфатических узлов.
М - отдаленные метастазы
Мх - наличие отдаленных метастазов оценить невозможно.
М0 - отдаленных метастазов нет.
М1 - наличие отдаленных метастазов.
Патоморфологическая классификация pTNM
Критерии выделения категорий pT, рN и рМ соответствуют таковым для категорий T, N и М.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
Классическая триада симптомов, описывавшаяся ранее при раке почки у 15 % больных (боль, макрогематурия и пальпируемая опухоль), в настоящее время встречается редко. Появление варикоцеле отмечают около 3,5 % больных, артериальной гипертензии - 15 %, синдром сдавления НПВ (отеки ног, варикоцеле, расширение подкожных вен живота, тромбоз глубоких вен нижних конечностей, протеинурия) - 50 % пациентов. Это происходит при опухолевом тромбозе НПВ или при компрессии НПВ опухолью и увеличенными лимфатическими узлами. Рак почки характеризуется большим разнообразием паранеопластических синдромов, к которым относятся артериальная гипертензия, эритроцитоз, гиперкальциемия, гипертермия, амилоидоз, развитие печеночной недостаточности при отсутствии ее метастатического поражения (синдром Штаффера). Появление висцеральных метастазов вызывает развитие соответствующих симптомов: поражение легких - кашель, кровохарканье; метастазы в кости - боль, патологические переломы, признаки компрессии спинного мозга; вовлечение головного мозга - общемозговую и очаговую симптоматику. Признаками поздних стадий являются анемия, высокая СОЭ, потеря аппетита, похудение, слабость.
ДИАГНОСТИКА
В анализах крови больных часто выявляется эритроцитоз вследствие избыточной продукции эритропоэтинов опухолью, гиперкальциемия, которые служат проявлениями паранеопластического синдрома. При продуцировании опухолью паратгормоноподобного белка у больных происходят остеолиз и почечная реабсорбция кальция. При содержании кальция в крови >3,0 ммоль/л проявляются клинические симптомы гиперкальциемии, такие, как обезвоживание, слабость, снижение массы тела, головная боль, спутанность сознания, аритмия, брадикардия, асистолия.
Наиболее часто опухоль почки обнаруживают при УЗИ, однако основным методом диагностики объемных образований почки является КТ. МРТ выполняется больным с аллергией на йодсодержащие контрастные вещества, с ХПН, опухолевым тромбозом НПВ, а также для подтверждения костных метастазов. Обязательной диагностической процедурой при обследовании больных с опухолями почечной паренхимы является КТ органов брюшной полости, забрюшинного пространства и легких, направленная на выявление регионарных и отдаленных метастазов. Сканирование костей рекомендуется больным с наличием соответствующих жалоб и (или) повышением уровня щелочной фосфатазы сыворотки крови. КТ головного мозга показана пациентам с неврологическими симптомами.
ЛЕЧЕНИЕ
Лечение локализованного и местно-распространенного рака почки
Радикальная нефрэктомия остается «золотым стандартом» лечения локализованного и местно-распространенного рака почки (T1a-T4N0/+M0). Данное вмешательство заключается в удалении почки единым блоком с надпочечником и паранефрием в пределах фасции Героты в сочетании с регионарной лимфаденэктомией (рис. 27.1). Наличие опухолевого венозного тромбоза служит показанием к тромбэктомии (удалению опухолевого тромба из НПВ и в ряде случаев - правых отделов сердца).
Лапароскопическая радикальная нефрэктомия может использоваться для лечения больных с категориями Т1а-Т2, при которых возможно соблюдение всех онкологических принципов, но они ассоциированы с меньшей травматичностью, чем открытые хирургические вмешательства.
При малых опухолях используют органосохраняющие операции. Абсолютным показанием для резекции почки являются: значительное снижение (отсутствие) выделительной функции, гипоплазия (аплазия) контралатеральной почки или двустороннее опухолевое поражение; относительными показаниями считаются снижение функции контралатеральной почки, высокий риск послеоперационной острой почечной недостаточности, врожденные формы двустороннего рака почки с высокой вероятностью возникновения метахронных опухолей в контралатеральной почке. Относительным показанием
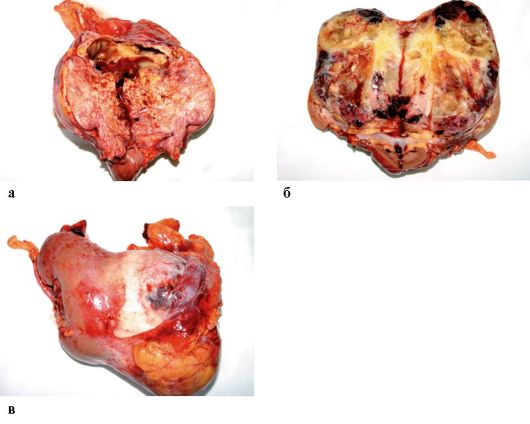 Рис. 27.1. Рак почки. Макропрепарат
Рис. 27.1. Рак почки. Макропрепарат
(а-в)
к органосохраняющему вмешательству служит рак почки сТ1а при неизмененной контралатеральной почке. Резекция почки у пациентов с опухолью менее 4 см способна обеспечить безрецидивную и отдаленную выживаемость, сравнимую с результатами радикальной нефрэктомии. Если опухоль полностью удалена, то величина хирургического края (при отступе от опухоли >1 мм) не ассоциирована с большей вероятностью возникновения местного рецидива.
Лапароскопическая резекция почки - альтернатива открытой резекции у ограниченного числа больных. Оптимальными показаниями для вмешательств такого типа являются маленькие опухоли, располагающиеся преимущественно экстрапаренхиматозно. Использование лапароскопического доступа ассоциировано с меньшей травматичностью и хорошим косметическим эффектом, однако приводит к увеличению времени ишемии и повышению частоты операционных осложнений. Онкологическая радикальность данных вмешательств соответствует открытым резекциям.
Минимально инвазивные методы лечения (радиочастотная аблация, криоаблация, микроволновая аблация, аблация высокоинтенсивной сфокусированной УЗ-волной) могут служить альтернативой хирургическому методу при условии тщательного отбора больных. Аблация может быть рекомендована пациентам с маленькими опухолями, располагающимися в корковом слое паренхимы почки, в случае противопоказаний к хирургическому вмешательству, а также больным с множественными и (или) двусторонними опухолями. Результаты аблативных методик изучаются.
В настоящее время показаний к адъювантной терапии (т.е. проводимой с профилактической целью после полного удаления опухоли) после хирургического лечения нет. Изучается эффективность опухолевой вакцинации и таргетной терапии в адъювантных режимах. Адъювантная терапия цитокинами (ИФН-α и ИЛ-2) не влияет на выживаемость после радикальной нефрэктомии.
Лечение диссеминированного рака почки (М+)
В настоящее время определены показания к хирургическому лечению больных диссеминированным раком почки, получающих иммунотерапию. Всем пациентам с категорией М+, имеющим удовлетворительный соматический статус, показано выполнение нефрэктомии. У пациентов с множественными метастазами нефрэктомия носит паллиативный характер. При сравнении нефрэктомии в сочетании с иммунотерапией и только иммунотерапии отмечено преимущество выживаемости оперированных пациентов. Целесообразность выполнения паллиативной нефрэктомии у больных, получающих таргетную терапию (направленную на определенные молекулярные мишени), не доказана.
Хирургическое удаление солитарных или единичных метастазов позволяет излечить больного. Полное удаление всех метастатических очагов улучшает клинический прогноз при диссеминированном раке почки. Удаление метастазов рекомендовано пациентам с ограниченным количеством опухолевых очагов, возможностью их радикального хирургического удаления и хорошим соматическим статусом.
Несмотря на радиорезистентность рака почки, лучевая терапия может быть использована при неудалимых метастазах в головной мозг и костных поражениях, так как способна существенно уменьшить симптоматические проявления при указанных выше локализациях.
Почечно-клеточная аденокарцинома характеризуется гиперэкспрессией гена множественной лекарственной устойчивости (MDR), продукт которого отвечает за выведение из клетки токсичных веществ, в том числе цитостатиков. В связи с этим рак почки резистентен к химиотерапии.
Случаи спонтанной регрессии и обнаружения у больных раком почки в периферической крови цитолитических Т-лимфоцитов, популяции мононуклеаров, инфильтрирующих опухоль, послужили теоретической основой, позволившей расценить почечно-клеточный рак как иммуногенную опухоль, лечение которой может быть основано на модуляции иммунитета. До недавнего времени иммунотерапия играла ведущую роль в лечении распространенных форм рака почки. Стандартом лечения являлась терапия с использованием ИФН-α и ИЛ-2.
Суммарный ответ на иммунотерапию ИФН-α колеблется от 10 до 20 %, составляя в среднем 15 %, полный - 2 %. Продолжительность ремиссий у преобладающего большинства пациентов невелика и составляет 6-10 мес, но у 5-7 % больных с полным ответом на лечение возможно достижение длительной ремиссии. Несмотря на достаточный опыт применения ИФН-α при диссеминированном раке почки, оптимальные дозы и режимы его введения не определены. Применение разовых доз ИФН-α менее 3 млн МЕ снижает эффективность терапии, а увеличение разовой дозы данного цитокина более 10 млн МЕ не дает преимуществ. Наиболее распространенный режим терапии ИФН-α - 6 млн ЕД подкожно, 3 раза в неделю, длительно.
Общая эффективность ИЛ-2 составляет 15 % при частоте полной и частичной ремиссии соответственно 7 и 8 %. Оптимальные дозы ИЛ-2 неизвестны; наиболее распространенный режим: 125-250 МЕ/кг подкожно, 3 раза в неделю, длительно. Наибольшая эффективность препарата отмечается при его внутривенном введении, однако это сопряжено с высокой частотой тяжелых осложнений и летальностью от проявлений токсичности.
Выделяют факторы неблагоприятного прогноза при диссеминированном раке почки, к которым отнесены соматический статус (индекс Карновского <80 %), высокий уровень ЛДГ (>1,5 норм), гиперкальциемия (скорректированный уровень кальция >10 мг/дл), анемия (НЬ <13 г/дл) и время от первичного диагноза до начала системного лечения <1 года. На основании полученных результатов разработана прогностическая модель MSKCC, выделяющая плохой
(>3 факторов риска, медиана выживаемости - 6 мес), умеренный (1-2 фактора риска, медиана выживаемости - 14 мес) и благоприятный (0 факторов риска, медиана выживаемости - 30 мес) прогноз. Стандартная терапия цитокинами высокоэффективна при хорошем прогнозе, малоэффективна среди пациентов с умеренным прогнозом и неэффективна при плохом прогнозе.
Применение комбинации цитокинов (ИНФ-α и ИЛ-2), цитокинов и цитостатических препаратов (5-фторурацила, винбластина, циклофосфамида, доксорубицина) и ретиноидов не повышает эффективность лечения.
С лучшим пониманием иммунологии опухолей стало возможным создание принципиально нового поколения вакцин с использованием дендритных клеток. Последние являются наиболее мощными антигенпрезентирующими клетками, представляющими опухолевый антиген в комплексе с молекулой главного комплекса гистосовместимости (МНС) I класса цитотоксическим лимфоцитам и активирующими последние. Открытие опухольассоциированного антигена G250, специфического для рака почки, присутствующего в85 % случаев в опухоли, и выделение ассоциированного с ним пептида, узнаваемого цитотоксическими Т-лимфоцитами, дало новый толчок к созданию G250-пептидных вакцин, которые активно изучаются. Принципиально новым подходом является применение моноклональных антител G250, меченных 131I, которые активно накапливаются в опухолях почки и могут быть использованы как с диагностической, так и с лечебной целью. Генетическая модификация противоопухолевых вакцин дает возможность повысить их эффективность. Введение ex vivo в геном опухолевых клеток определенных полинуклеотидных последовательностей позволяет им приобрести способность вырабатывать различные цитокины, что повышает их иммуногенность. Отмечено, что вакцины, продуцирующие гранулоцитарно-макрофагальный колониестимулирующий фактор, индуцируют формирование иммунного ответа против слабоиммуногенных опухолей. Одно из направлений иммунотерапии солидных опухолей, резистентных к другим видам лечения, - аллогенная трансплантация стволовых клеток, вызывающая развитие реакции трансплантат против хозяина. При этом используются немиелоаблативные методики, позволяющие оказать достаточное для проведения аллогенной трансплантации иммуносупрессивное действие без угнетения собственного кроветворения реципиента. Частота объективных ответов
у больных диссеминированным раком почки достигает 53 %. Основным лимитирующим фактором является высокая токсичность, приводящая к летальному исходу в 12-30 % случаев.
Появление эффективных таргетных агентов заставляет постепенно пересматривать подходы к лечению диссеминированного рака почки. Для почечно-клеточного рака свойственны мутации VHL (Вона-Гиппеля-Линдау)-гена, способствует активации опухолевого патогенеза по пути VEGF (внутрисосудистый эпителиальный фактор роста). В связи с этим препараты, блокирующие ангиогенез, приводят к задержке опухолевого роста при почечной аденокарциноме, являющейся хорошей моделью для изучения таргетной терапии.
При почечно-клеточном раке в настоящее время эффективность продемонстрировали 5 препаратов. Сорафениб (?хауаг) - мультитаргетный ингибитор тирозинкиназ, которые взаимодействуют с многими рецепторами, задействованными в пути патогенеза VEGF. Сорафениб приводит к уменьшению размеров опухоли у большинства больных и достоверно увеличивает выживаемость без прогрессирования с 12 до 24 нед по сравнению с плацебо. Сунитиниб (Sutent) - другой мультитаргетный блокатор тирозинкиназ. Отмечены высокая частота объективного ответа, достигающая 40 %, и длительная продолжительность жизни без признаков прогрессирования в группе пациентов, рефрактерных к терапии цитокинами (8 мес). Сунитиниб продемонстрировал достоверное преимущество перед интерфероном в отношении выживаемости без прогрессирования (соответственно 5 и 11 мес). Аналогично ингибитор тирозинкиназы AG013736 позволил добиться высокой частоты объективных ответов (46 %) при диссеминированном раке почки. Бевацизумаб (авастин) - антитела VEGF - приводит к достоверному увеличению выживаемости без признаков прогрессирования при использовании в монорежиме, а также в комбинации с ИФН-α. Темсиролимус (Torisel) - ингибитор mTOR, действующий непосредственно на выработку HIF (фактор, индуцированный гипоксией). Данный препарат продемонстрировал преимущество выживаемости по сравнению с ИФН в группе плохого прогноза. В настоящее время в группе хорошего и умеренного прогноза (модель MSKCC) в качестве 1-й линии терапии может быть рекомендован сунитиниб, плохого прогноза - темсиролимус; в качестве 2-й линии лечения при интерферонрефрактерных опухолях эффективность продемонстрировали сунитиниб и сорафениб.
ПРОГНОЗ
5- и 10-летняя общая выживаемость больных раком почки составляет соответственно 61,5 и 46,6 % (при I стадии заболевания - 83,4 и 65,7 %, при II стадии - 62,1 и 40,9 %, при III стадии - 31,7 и 16,7%, при IV стадии - 15,4 и 1 % соответственно). Помимо стадии на прогноз заболевания оказывают влияние категории T, N, M, гистологический вариант и степень анаплазии опухоли, плоидность дезоксирибонуклеиновой кислоты (ДНК) и митотический индекс, а также ряд молекулярных факторов.
Вопросы для самоконтроля
1. Что относится к факторам риска развития рака почки?
2. Какие морфологические виды рака почки встречаются?
3. Какими особенностями обладает рак почки при местной распространенности процесса?
4. Что относится к классической «триаде симптомов» при раке почке?
5. Что является основным методом диагностики при раке почки?
6. Какой объем оперативного вмешательства включает в себя термин «радикальная нефрэктомия» при раке почки?
7. Что является абсолютным показанием для органосохраняющего лечения (резекции) при раке почки? Какие показания являются относительными?
8. Что относится к факторам неблагоприятного прогноза при раке почки?