Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев. 2010. - 920 с.
|
|
|
|
ГЛАВА 5 МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ОПУХОЛЕВОГО РОСТА
ОПУХОЛЕВЫЙ ПРОЦЕСС КАК БИОЛОГИЧЕСКОЕ ЯВЛЕНИЕ
Опухолевый процесс - это процесс, сопровождающийся прибавлением клеточной массы. Для новообразований характерен автономный тип роста. В норме количество клеток регулируется посредством точной балансировки двух противоположных процессов - клеточного деления и клеточной элиминации. При онкологическом заболевании прибавление клеточной массы опережает клеточную гибель либо за счет активации процессов пролиферации, либо вследствие угнетения процессов апоптоза, а чаще всего - при сочетанном нарушении этих процессов. Существенно, что дисбаланс регуляции количества клеток вызван неспособностью трансформированного клона реагировать на внешние сигналы; таким образом, объем клеточной массы перестает зависеть от потребностей организма, что и подразумевается под понятием «автономность».
На протяжении всего XX века ученые пытались сформулировать, какие конкретные признаки отличают опухолевые клетки и ткани от их нормальных предшественников. Прогресс в данной области, представляющей основу для разработки направлений противоопухолевой терапии, затруднялся биологическим разнообразием проявления новообразований. Тем не менее к настоящему времени удалось выделить и классифицировать несколько четких, подкрепленных молекулярногенетическими данными тенденций. Наиболее ясное обобщение этих признаков представлено в работе основоположников молекулярной онкологии D. Hanahan и R. Weinberg, появившейся на страницах журнала Cell (? 1 за 2000 г.). По мнению авторов, все или почти все опухоли характеризуются несколькими неотъемлемыми чертами.
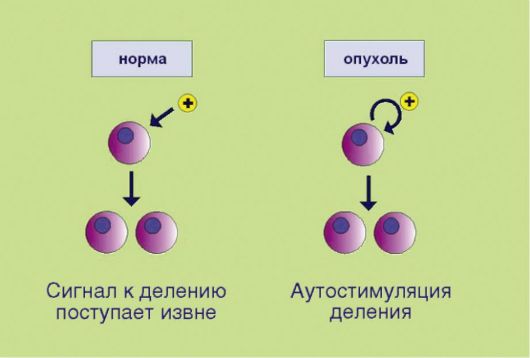 Рис. 5.1. Аутостимуляция пролиферативного сигнала
Рис. 5.1. Аутостимуляция пролиферативного сигнала
1. Самодостаточность в отношении сигналов пролиферации, связанная e аутопродукцией факторов роста, соответствующих рецепторов или других компонентов сигнального промитотического каскада (рис. 5.1). Существенно, что нормальная клетка никогда не делится сама по себе; для запуска пролиферативной программы необходим сигнал извне, доставляемый эндокринной системой (гормоны), паракринными механизмами (тканевые факторы роста), или через синаптические окончания нейронов (нейротрофика). Таким образом, увеличение количества клеток в норме происходит лишь в том случае, если многоклеточный организм-хозяин продуцирует сигналы к наращиванию клеточной массы. Трансформированная клетка продуцирует подобные сигналы сама для себя, вне зависимости от потребностей организма, что и приводит к безостановочному делению опухолевого клона.
2. Потеря чувствительности к сигналам, сдерживающим процесс пролиферации, обусловленная инактивацией супрессорных (антимитотических) белков (рис. 5.2). Клоны, обладающие аномальной способностью к аутостимуляции пролиферативного каскада, могут возникать в организме достаточно часто, что связано с постоянным мутационным процессом в клетках организма. Однако все многоклеточные представители живой природы выработали в процессе эволюции несколько уровней защитных систем, препятствующих несанкционированному накоплению клеток. В случае появления клеток со способностью к аутокринной стимуляции деления организмхозяин продуцирует сдерживающие сигналы, доставляемые к клеткам
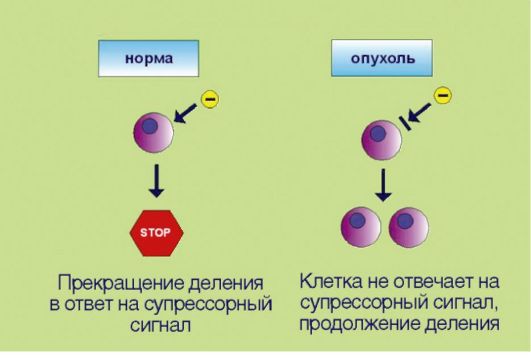 Рис. 5.2. Потеря чувствительности к сигналам, прекращающим клеточное деление
Рис. 5.2. Потеря чувствительности к сигналам, прекращающим клеточное деление
в виде гуморальных факторов и направленные на прекращение пролиферации. Трансформированные клетки в отличие от нормальных утратили способность к восприятию таких сигналов. Подобная нечувствительность к супрессорным воздействиям может происходить в результате утраты соответствующих мембранных рецепторов или других компонентов сигнальных каскадов, участвующих в проведении экстрацеллюлярного сигнала к клеточному ядру.
3. Замедление процессов программируемой клеточной гибели, опосредованное дисбалансом биохимической регуляции процессов апоптоза (рис. 5.3). В повседневной жизни слово «смерть» всегда подразумевает негативный эмоциональный оттенок. Напротив, в условиях функционирования многоклеточных живых систем физиологическое значение гибели клеток в значительной мере зависит от контекста этого события. Принято выделять 2 основные разновидности клеточной смерти: непрограммируемая и программируемая. Непрограммируемая гибель клеток (некроз) происходит в результате выраженных неблагоприятных воздействий (гипоксия, ожог и т.д.). Подобное событие может негативно отражаться на структуре и функции органа и сопровождаться формированием рубцовой ткани. Программируемая клеточная гибель в отличие от некроза является ювелирно управляемым, энергозатратным процессом, направленным на сохранение и поддержание морфофункциональных характеристик органов и тканей. Наиболее
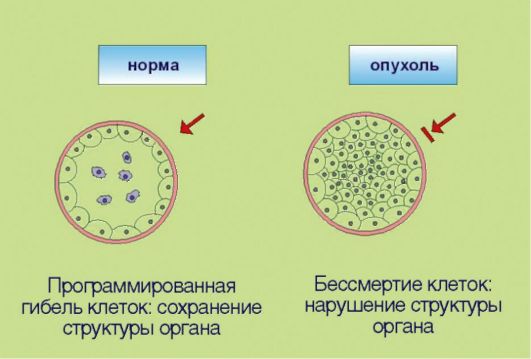 Рис. 5.3. Иммортализация (бессмертие)
Рис. 5.3. Иммортализация (бессмертие)
изученная разновидность программируемой клеточной гибели - апоптоз - обеспечивает «плановую» элиминацию клеток; этот процесс особенно выражен в тканях с высокой интенсивностью обновления клеток - в эпителии ЖКТ, коже, крови. Помимо этого клетка способна распознавать собственные повреждения ДНК и другие биохимические изменения, представляющие угрозу с точки зрения злокачественной трансформации. При появлении подобных нарушений запускается «суицидная» программа, приводящая к самоуничтожению потенциально опасных клеток. Раковые клетки в отличие от нормальных утратили способность к самоэлиминации, что позволяет им сохранять жизнеспособность, несмотря на наличие повреждений ДНК и ассоциированных с гиперпролиферацией стрессовых условий существования.
4. Неограниченный репликативный потенциал клеток (преодоление «лимита Хэйфлика»), сопряженный с реактивацией экспрессии фермента теломеразы и как следствие отсутствием физиологического укорачивания теломер (рис. 5.4). Представим, что в организме возник клон клеток, обладающий способностью к аутостимуляции деления, не чувствительный к супрессорам митоза и утративший способность к самоэлиминации посредством апоптоза. Даже эти клетки, обладающие целым набором характеристик злокачественной трансформации, не смогут сформировать клинически распознаваемую опухоль! В многоклеточных организмах существует еще один уровень защиты: ограничение
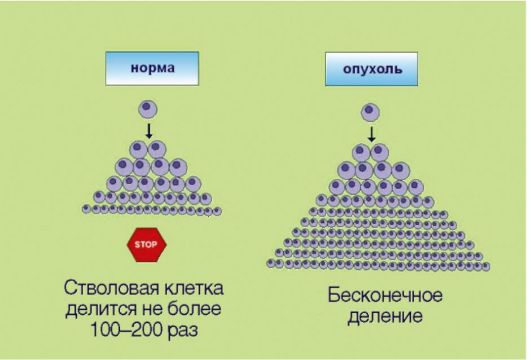 Рис. 5.4. Неограниченный репликативный потенциал (бесконечное деление)
Рис. 5.4. Неограниченный репликативный потенциал (бесконечное деление)
репликативного потенциала делящихся клеток. В 1961-1962 гг. американский ученый L. НауШек установил, что нормальные клетки могут делиться не более 100-150 раз, после чего весь клон (т.е. исходная клетка и ее потомки, обладающие соответственно меньшим резервом возможных делений) утрачивает возможность к самовоспроизведению. Этот феномен, зачастую называемый лимитом Хэйфлика, по крайней мере отчасти лежит в основе биологических механизмов старения: установлено, что репликативный потенциал клеток уменьшается с возрастом индивидуума. Более того, преодоление лимита Хэйфлика является необходимым условием злокачественной трансформации; демонстрацией этого свойства является тот факт, что в лабораторных условиях только опухолевые клетки могут подвергаться многолетнему культивированию, в то время как долгосрочные культуры нормальных клеток получить не удается. Неограниченный репликативный потенциал опухолевых клеток принято объяснять активацией фермента теломеразы, которая компенсирует наблюдаемое в ходе клеточного деления физиологическое укорочение концевых участков хромосом. Теломераза, по-видимому, является одной из самых перспективных молекулярных мишеней для противоопухолевой терапии.
5. Стимуляция процессов ангиогенеза в опухоли, вызванная экспрессией трансформированными клетками ангиогенных факторов и направленная на удовлетворение повышенных потребностей быстроделящихся неопластичес-
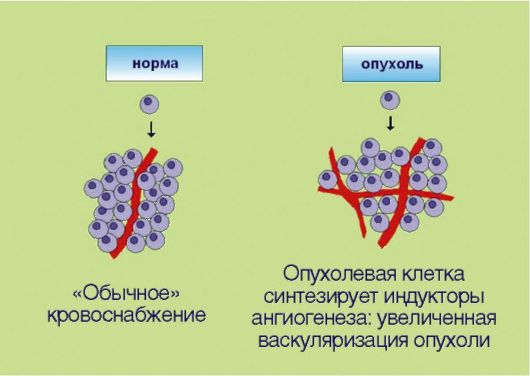 Рис. 5.5. Индукция ангиогенеза
Рис. 5.5. Индукция ангиогенеза
ких компонентов в оксигенации (рис. 5.5). Длительное время опухолевым клеткам приписывалась полная самодостаточность. Предполагалось, что трансформированный клон пролиферирует сам по себе, а все остальные элементы опухоли - строма, сосуды, фибробласты - являются лишь пассивными вспомогательными компонентами. Изменение этих представлений связано с именем выдающегося американского ученого J. Folkman, который совмещал повседневную работу врачахирурга с основополагающими, фундаментальными исследованиями в области экспериментальной онкологии. J. Folkman предположил и экспериментально доказал, что опухолевые клетки могут сформировать клинически распознаваемое новообразование лишь в том случае, если они продуцируют факторы неоангиогенеза. Таким образом, формирование сосудистой сети опухоли происходит не само по себе, а за счет активных, управляемых трансформированными клетками биологических процессов. К настоящему времени идентифицированы десятки факторов, провоцирующих или, наоборот, ингибирующих ангиогенез. Примечательно, что разработка антиангиогенных препаратов считается одним из самых перспективных направлений в онкологии. Дело в том, что во взрослом организме практически не происходит формирования новых сосудов (исключение составляют посттравматическая регенерация тканей и некоторые процессы, связанные с репродуктивным циклом у женщин). Предполагается, что антиангиогенные препараты должны обладать прекрасным
терапевтическим индексом, т.е. эффективно тормозить рост опухолевой массы без каких-либо побочных воздействий на организм.
6. Способность к инвазии и метастазированию, ассоциированная с продукцией опухолью гистолитических ферментов (протеаз), а также факторов, угнетающих локальный иммунитет (рис. 5.6). Эта особенность злокачественной трансформации почти всегда упоминается как ключевой компонент опухолевого роста. Внимание к инвазии и метастазированию связано с клинической значимостью данных процессов: именно они компрометируют результаты хирургического лечения рака и приводят к летальному исходу у онкологических больных. В контексте сказанного отметим, что ни один из перечисленных признаков опухолевого роста не является достаточным для клинической манифестации онкологического процесса. В частности, процесс метастазирования нетрансформированных клеток характерен для заболевания женской репродуктивной системы - эндометриоза, которое никоим образом не является онкологической патологией.
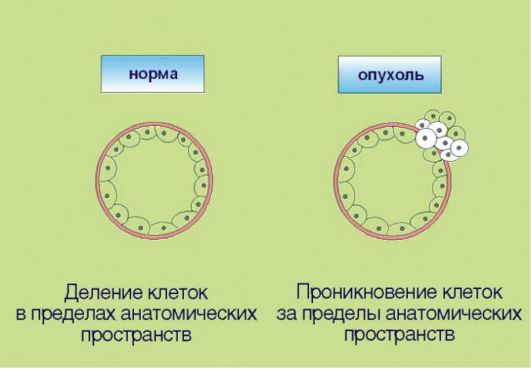 Рис. 5.6. Инвазия и метастазирование
Рис. 5.6. Инвазия и метастазирование
7. Геномная нестабильность, опосредованная инактивацией систем репарации ДНК и нарушениями в молекулярном контроле клеточного цикла (рис. 5.7). Для опухолевой клетки характерно ускоренное накопление мутаций, что по крайней мере отчасти связано со снижением эффективности процессов репарации ДНК. Подобная особенность приводит к чрезвычайной биологической пластичности новообразований, которые способны быстро приспосабливаться
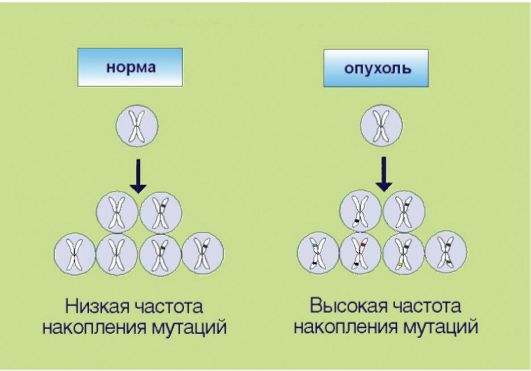 Рис. 5.7. Геномная нестабильность
Рис. 5.7. Геномная нестабильность
к изменяющимся условиям метаболизма и разнообразным лечебным воздействиям. Существенно, что геномная нестабильность, по-видимому, является основным свойством опухолевых клеток, обеспечивающим «терапевтическое окно» при назначении цитостатических препаратов. Ранее полагали, что механизм лечебного действия цитостатиков связан с избирательным подавлением делящихся клеток. Это утверждение остается в силе, однако нуждается в важном дополнении. Противоопухолевый эффект химиотерапии и радиации связан с индукцией повреждений ДНК, которые действительно проявляются лишь в процессе клеточного деления; однако опухолевые клетки, по крайней мере в теории, обладают большей чувствительностью к ДНК-повреждающим агентам, так как их способность к репарации химических изменений структуры нуклеиновых кислот ниже, чем у неизменных компонентов органов и тканей.
8. Перестройка стромальных компонентов, создающая более благоприятные условия для эволюции злокачественного клона (рис. 5.8). Длительное время предполагалось, что элементы стромы образуют лишь пассивный каркас для размножающихся опухолевых клеток. В последние годы установлено, что подобное утверждение далеко от истины. Многочисленные факты свидетельствуют о том, что стромальные компоненты опухолей заметно отличаются от таковых в нормальных тканях; некоторые исследователи даже настаивают
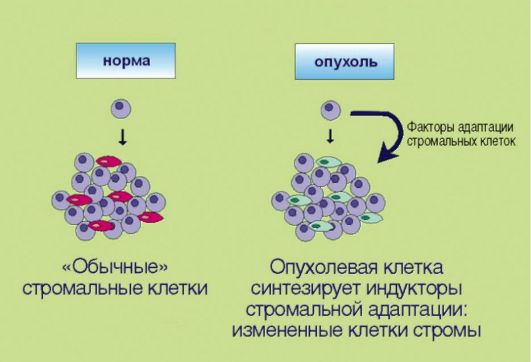 Рис. 5.8. Адаптация стромальных клеток к особенностям опухолевого роста
Рис. 5.8. Адаптация стромальных клеток к особенностям опухолевого роста
на том, что фибробласты, инфильтрирующие эпителиальные новообразования, содержат соматические мутации, отличные от таковых в опухолевых клетках и необходимые для жизнедеятельности злокачественного новообразования. Продемонстрированы многочисленные случаи симбиоза трансформированных клеток и окружающих их фибробластов. В частности, независимость малигнизированного эпителия от внешних пролиферативных сигналов может обеспечиваться не аутокринной стимуляцией как таковой, а секрецией факторов роста фибробластами, населяющими опухоль. В свою очередь, эпителиальные клетки секретируют целый спектр биологически активных веществ, регулирующих адаптацию стромальных элементов к потребностям опухолевого роста.
Подобная «диссекция» ключевых признаков опухолевого роста имеет существенное практическое значение. Эмпирический подход, сопряженный со случайным перебором тысяч биологически активных химикатов, постепенно замещается научно обоснованным, молекулярно-направленным поиском действительно специфических противораковых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации. Первые подобные средства уже внедрены в практическую медицину. По-видимому, их количество увеличится в ближайшие годы в десятки раз, что приведет к существенному улучшению результатов противоопухолевой терапии.
Онкогены и антионкогены
До самого последнего времени количество «теорий рака» измерялось сотнями. К наиболее значимым следует отнести вирусные, иммунологические, канцерогенные и гормонально-метаболические концепции, которые были предметом горячих споров в середине ХХ столетия. Понимание природы опухолевого роста стало принимать более очерченные формы лишь в течение двух последних десятилетий прошлого века благодаря бурному развитию молекулярной онкологии. Первый серьезный прорыв произошел в 1970-х годах, в процессе изучения молекулярных основ вирусного канцерогенеза. При проведении серии экспериментов, направленных на идентификацию «онкологически значимых» фрагментов генома вируса саркомы Рауса, выяснилось, что за всю картину злокачественной трансформации отвечает лишь один-единственный ген, который назвали онкогеном src. Позже было установлено, что подобный принцип характерен для большинства известных онкогенных вирусов. Однако значение опытов на вирусах лимитировалось тем фактом, что данная разновидность опухолевого патогенеза наблюдалась только у животных (мышей, крыс, птиц), при этом причастности вирусов к опухолям у человека доказать не удавалось. Разработка метода гибридизации нуклеиновых кислот привела к новому революционному открытию: оказалось, что все вирусные онкогены имеют гомологов в составе человеческого генома. Более того, данные гомологи являются необходимым компонентом клеточной жизнедеятельности; они отвечают за такие важнейшие процессы, как пролиферация, дифференцировка и т.д. Венцом примерно 10-летней серии экспериментов стало доказательство факта активации онкогенов в опухолях (вследствие увеличения количества копий и/или функциональной модификации). К середине 1980-х годов онкогенная теория рака приобрела стройность. Ее основные положения можно сформулировать следующим образом.
1. Онкогеном называется ген, который: а) в норме оказывает активирующее влияние на процессы пролиферации и/или препятствует клеточной гибели; б) активируется в опухолях; в) проявляет трансформирующие свойства в экспериментах по трансфекции.
2. Онкогены необходимы для нормального функционирования (обновления) тканей; их работа находится под строгим контролем сигнальных систем организма. Соматическая мутация
в онкогене приводит к независимости клетки от внешних регулирующих влияний, т.е. клеточный клон, находясь в условиях аутостимуляции, приобретает способность к неконтролируемому размножению. Генетические повреждения в онкогенах могут возникать вследствие случайного мутационного процесса, однако вероятность мутаций существенно повышается при увеличении канцерогенной нагрузки.
3. При вирусном канцерогенезе у животных вирус содержит уже активированную версию онкогена и, таким образом, является лишь транспортной формой последнего. У человека, напротив, большинство опухолей возникает за счет активации (мутации) эндогенных онкогенов.
4. Активация одного онкогена почти всегда компенсируется. Процесс злокачественной трансформации требует сочетанных нарушений в нескольких онкогенах.
К настоящему моменту идентифицированы сотни онкогенов. Они принадлежат к самым разнообразным классам белков и могут выполнять широкий спектр клеточных функций. Наиболее хорошо изучены протеинкиназы - ферменты, осуществляющие регуляцию активности белков-мишеней посредством фосфорилирования. Протеинкиназы делятся на 2 класса: тирозинкиназы и серин-треониновые киназы. Тирозинкиназы несколько легче поддаются изучению, поэтому сведения об их причастности к возникновению опухолей представлены в достаточно обширном объеме. К наиболее исследованным тирозинкиназам относятся мембранные белки EGFR, HER2, KIT, цитоплазматические ферменты SRC, ABL и т.д. В качестве примеров серин-треониновых киназ, вовлеченных в процесс онкогенеза, можно привести белки АКТ, PKC и т.п. Большую известность получили работы, посвященные изучению ГТФаз, особенно онкобелков семейства RAS. Значительное число известных онкогенов кодирует регуляторы транскрипции; к наиболее изученным ядерным онкобелкам относятся MYC, FOS и JUN.
Несмотря на кибернетическую очевидность причастности к данной проблеме противоположно направленных процессов, т.е. механизмов сдерживания клеточного роста, молекулярные основы негативной регуляции количества клеток почти не обсуждались вплоть до открытия антионкогенов. Антионкогеном (супрессорным геном) называется ген, который: а) в норме оказывает инактивирующее влияние на процессы пролиферации и (или) способствует кле-
точной гибели; б) инактивируется в опухолях; в) осуществляет реверсию злокачественного фенотипа в экспериментах по трансфекции. К концу 1980-х годов было установлено, что практически каждая опухоль содержит множественные мутации в антионкогенах, выражающиеся как в виде делеций, так и в форме микромутаций. Вероятно, инактивирующие повреждения супрессорных генов встречаются существенно чаще, чем активирующие мутации в онкогенах, что соответствует бытовой логике «ломать - не строить». В целом открытие антионкогенов стало заметным этапом в истории молекулярной онкологии, добавив целостности и логичности к имевшимся до этого воззрениям.
Наиболее известным супрессорным геном является ген р53. Он кодирует небольшой белок, осуществляющий огромное число разнообразных защитных функций. В частности, р53 дирижирует ответом клетки на повреждение ДНК посредством взаимодействия с другими регуляторными белками и, в зависимости от ситуационного контекста, инициирует процессы блокировки клеточного цикла, репарации ДНК, апоптоза. Помимо этого р53 является фактором транскрипции, т.е. регулирует уровень экспрессии целого ряда генов. Другой хорошо изученный супрессорный ген - RB1 - участвует в контроле деления клеток. К супрессорным генам с определенными оговорками можно отнести практически все гены, участвующие в поддержании геномной стабильности. Наследственные мутации во многих из них - BRCA1, BRCA2, MLH1, MSH2 - являются причиной так называемых семейных раковых синдромов.
Значимым событием первого десятилетия XXI века является открытие принципиально нового класса биологически активных молекул - микроРНК, которые представляют собой очень короткие некодирующие последовательности (около 20 нуклеотидов). МикроРНК способны связываться с комплементарными участками кодирующих РНК, что приводит к угнетению трансляции и (или) деградации последних. К настоящему моменту идентифицировано примерно 5 сотен микроРНК. Каждая из этих молекул отвечает за функционирование десятков генов-мишеней. Таким образом, микроРНК являются уникальным инструментом координации процессов функционирования генов. Многочисленные работы свидетельствуют о несомненной роли микроРНК в онкогенезе. Различные представители этого класса молекул могут выполнять как онкогенные, так и антионкогенные функции.
Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум 5-9 мутаций в разных онкогенах и антионкогенах; меньшее количество мутаций почти всегда компенсируется защитными системами организма. Подобная особенность объясняет возрастное распределение онкологических заболеваний: большинство опухолей проявляют себя лишь во второй половине жизни, так как для их манифестации необходима целая цепь мутационных событий.
Генетические нарушения в опухолях
Опухоли характеризуются широким спектром различных генетических нарушений. Многие онкогены и антионкогены поражаются посредством микромутаций - небольших изменений в последовательности ДНК, проявляющихся микроделециями, микроинсерциями или нуклеотидными заменами (рис. 5.9). Подобный тип нарушений лежит в основе активации онкогенов RAS, BRAF, EGFR, инактивации супрессорного гена р53 и т.д.
Большинство опухолей также характеризуется нестабильностью на уровне протяженных участков хромосом, поэтому для новооб-
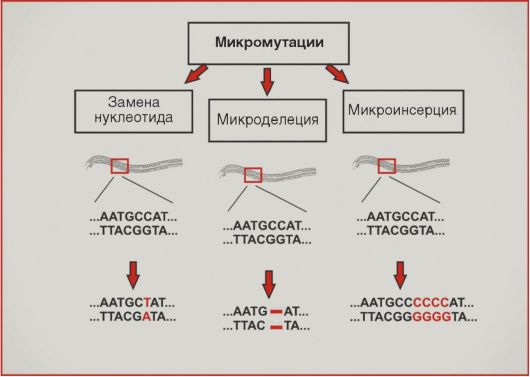 Рис. 5.9. Микромутации
Рис. 5.9. Микромутации
разований исключительно типичны нарушения копийности генетического материала (рис. 5.10). Увеличение копийности онкогенов обозначается термином «амплификация»; последняя приводит к возрастанию количества соответствующих белковых продуктов. Подобный механизм активации характерен для онкогенов HER2, NMYC, cyclin D1. Значительно чаще амплификаций встречаются делеции участков хромосом; подобный механизм повреждений типичен для супрессорных генов RB1, APC, p16. Транслокации - перестройки хромосом, приводящие к изменению уровня экспрессии генов или образованию химерных белков, - в большей степени характерны для онкогематологической патологии. Наиболее известна транслокация BCR-ABL, приводящая к образованию так называемой филадельфийской хромосомы и наблюдаемая при хроническом миелолейкозе.
В последние годы внимание исследователей все больше привлекают нарушения экспрессии генов в трансформированных клетках (рис. 5.11). По крайней мере отчасти изменения активности транскрипции онкогенов и генов-супрессоров обусловлены метилированием цитозинов в промоторных последовательностях. Статус
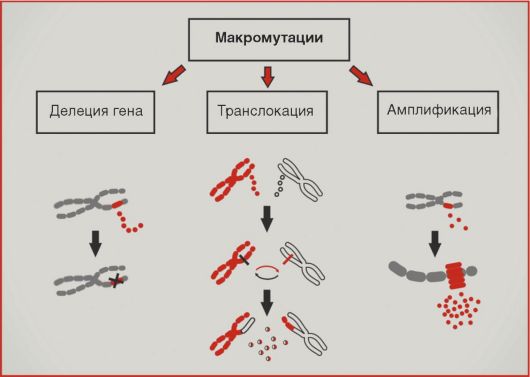 Рис. 5.10. Макромутации
Рис. 5.10. Макромутации
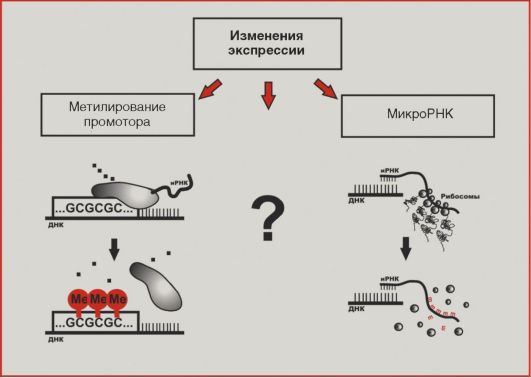 Рис. 5.11. Изменения экспрессии
Рис. 5.11. Изменения экспрессии
метилирования по цитозину наследуется при делении клетки, поэтому метилированный цитозин иногда называют 5-м основанием ДНК. Наконец, как упоминалось выше, недавние открытия молекулярных биологов демонстрируют существенную роль изменений экспрессии микроРНК в формировании молекулярного портрета опухолевой клетки. Следует заметить, что многие аспекты механизмов регуляции экспрессии в норме и при патологии остаются неизученными.
Методы анализа молекулярных нарушений в опухолях
Методическая база молекулярной биологии характеризуется исключительной сложностью и разнообразием. Мы кратко остановимся лишь на тех лабораторных подходах, которые имеют прямое или косвенное отношение к клиническим аспектам онкологической диагностики.
Основным методом молекулярной биологии по праву считается полимеразная цепная реакция (ПЦР; polymerase chain reaction - PCR), изобретенная K. Mullis в 1983 г. Принцип ПЦР основан на праймерзависимой энзиматической амплификации фрагментов ДНК,
позволяющей накапливать любую генетическую последовательность в неограниченных количествах. ПЦР не имеет предела чувствительности и специфичности, при этом данный метод является относительно доступным для рутинного применения. ПЦР используется для стандартного анализа генетических фрагментов с целью обнаружения изменений нуклеотидной последовательности. Одна из разновидностей ПЦР - RT-PCR (reverse-transcriptase PCR) - применяется для анализа экспрессии генов; в данном случае на матрице клеточной РНК с помощью фермента обратной транскриптазы синтезируется копия комплементарной ДНК (кДНК), которая, в свою очередь, служит непосредственным материалом для ПЦР-анализа.
Помимо молекулярно-биологических методик в лабораторной онкологии используются различные усовершенствования морфологических и цитогенетических методов. Наибольшую популярность получил метод иммуногистохимии (ИГХ), позволяющий визуализировать белки с помощью специфичных меченых антител. К его преимуществам следует отнести относительною простоту и возможность анализировать локализацию белков-мишеней, к недостаткам - полуколичественный характер получаемых результатов. Активно внедряется в практику метод флюоресцентной гибридизации in situ (fluorescent in situ hybridization - FISH), основанный на комплементарном взаимодействии меченых генов-зондов с соответствующими участками хромосом. Этот подход применяется для выявления транслокаций и амплификаций генетического материала.
Большой резонанс получили разработки, направленные на системный анализ геномных изменений. Наибольшего прогресса достигла так называемая транскриптомика, т.е. исследования изменений экспрессии в опухолях. Принцип соответствующих методик подразумевает гибридизацию тотальной клеточной РНК (кДНК) с полным набором генов человека, зафиксированным на крошечной пластинке - микрочипе. Интенсивность комплементарного связывания генов-зондов с генами-мишенями оценивается с помощью ультратонких сканеров; затем полученные результаты подвергаются сложнейшей компьютерной обработке, позволяющей выявить гипер- и гипоэкспрессируемые гены. Подобный подход позволяет провести идентификацию принципиально важных компонентов опухолевой прогрессии, однако его внедрение в клиническую практику на сегодняшний день остается затруднительным.
Достижения экспериментальной онкологии
Каждый год в онкологии происходят сенсационные события, в корне меняющие представления о некоторых фундаментальных аспектах злокачественного роста.
Огромный интерес научной общественности привлекли сообщения о существовании стволовых клеток опухолей. Ранее новообразования расценивались как относительно гомогенные структуры, состоящие из равноправных клеток. Даже если в некоторых неоплазмах и наблюдалась определенная гетерогенность, ее считали пассивным следствием нестабильности ракового генома. Недавно в серии экспериментов были представлены доказательства существования иерархии опухолевых клеток, что позволяет рассматривать новообразование как своеобразный «орган». Весьма вероятно, что многим типам малигнизаций присуще наличие так называемых стволовых клеток. Последние в отличие от «дифференцированных» клеток опухоли представляют собой лишь небольшую часть опухолевой массы (< 1 %), при этом они не только способны к неограниченному самовоспроизведению, но и отличаются по некоторым фенотипическим характеристикам от основной клеточной популяции новообразования. К сожалению, подобные наблюдения ставят под сомнение существующие стратегии поиска противоопухолевых препаратов, так как основным источником мишеней для последних являются преобладающие, «дифференцированные» клетки трансформированной ткани.
Многие поколения онкологов были воспитаны на принципах абластики и антибластики. Одной из производных этих принципов следует считать абсолютную, фатальную опасность для организма единичных опухолевых клеток, оставшихся после оперативного вмешательства и цитостатической терапии. Результаты некоторых исследований последних лет заставляют предположить, что единичные опухолевые клетки могут существовать в организме на протяжении многих лет после проведенного лечения. Факторы, ассоциированные с прогрессией этих «дремлющих» клонов в клинически распознаваемые рецидивы заболевания, остаются неизвестными. Представления о возможности длительного бессимптомного существования злокачественных клеточных пулов в организме объясняют многие временные закономерности, наблюдаемые в практической онкологии, и заставляют рассматривать опухоль не как изолированный, абсолютно автономный патологический процесс, а лишь как компонент
сложной и взаимосвязанной системы биологических взаимодействий с организмом хозяина.
Метастазирование объясняет 90 % случаев летальных исходов онкологических заболеваний. Процесс метастазирования всегда рассматривался как изолированное взаимодействие отщепившихся опухолевых клеток с органом-мишенью. К настоящему моменту стали накапливаться данные о том, что управление процессом метастазирования по крайней мере отчасти может модулироваться первичной опухолью. Доказано, что некоторые неоплазмы секретируют биологически активные вещества, которые доставляются с кровотоком к сайтам метастазирования и способствуют пролиферации трансформированных клеток. Подобные наблюдения имеют непосредственную клиническую перспективу: не исключено, что лекарственное противодействие взаимоотношениям между первичной опухолью и отдаленными метастазами может замедлить прогрессию онкологического заболевания.
КЛИНИЧЕСКИЕ АСПЕКТЫ МОЛЕКУЛЯРНОЙ ОНКОЛОГИИ
Главным практическим достижением молекулярной онкологии следует считать почти исчерпывающее раскрытие проблемы наследственного рака. Для преобладаюшего числа известных семейных опухолевых синдромов уже разработаны лабораторно-диагностические алгоритмы, предусматривающие ДНК-анализ соответствующих генов. С каждым годом увеличивается количество молекулярно-диагностических тестов, направленных на оптимизацию выбора терапии онкологических заболеваний. К наиболее информативным тестам следует отнести анализ мутации гена EGFR, обладающий уникально высокой предиктивной значимостью в отношении ответа опухолей легкого на терапию гефитинибом или эрлотинибом. Развиваются подходы, направленные на прогнозирование эффективности и безопасности применения фторпиримидинов, производных платины, иринотекана и т.д.
Популярной областью прикладных исследований является разработка методов молекулярной детекции единичных опухолевых клеток. Ожидается, что подобные подходы позволят улучшить прогнозирование региональных и отдаленных рецидивов злокачественного процесса, осуществлять мониторинг трансформированного клона, а в далекой перспективе - способствовать ранней диагностике
новообразований. Следует подчеркнуть, что сегодня работы, направленные на выявление диссеминированных опухолевых клеток, носят преимущественно экспериментальный характер и пока не внедрены в рутинную клиническую практику.
Помимо молекулярной диагностики, молекулярная онкология формирует направления поиска новых противоопухолевых препаратов. К настоящему времени в практической медицине уже используется более десятка так называемых таргетных лекарств, разработка которых основывалась не на эмпирическом подборе неспецифических цитостатических веществ, а на целенаправленном синтезе антагонистов онкоассоциированных молекул. Наибольшую популярность в клинике получили антитела и низкомолекулярные ингибиторы, направленные на подавление активности белков EGFR, HER2, модуляторов ангиогенеза и т.д.
Вопросы для самоконтроля
1. Охарактеризуйте понятие опухолевого роста.
2. Назовите основные биологические особенности опухолевой ткани.
3. Чем характеризуется автономность опухолевого роста?
4. Как меняются процессы апоптоза в опухолевых клетках?
5. Чем объясняется неограниченный репликативный потенциал опухолевых клеток?
6. Какова роль неоангиогенеза при опухолевом росте?
7. Охарактеризуйте процессы инвазии и метастазирования.
8. Какова роль геномной нестабильности при опухолевом росте?
9. Назовите отличия стромальных компонентов опухоли от нормальной ткани.
10. Дайте понятия онкогенов и антионкогенов. Каковы их функции в норме и при опухолевом росте?
11. Охарактеризуйте типы генетических нарушений в опухолях.
12. Какие методы используются для анализа молекулярных нарушений в опухолях?
13. В чем заключается прикладное значение достижений молекулярной онкологии?