Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев. 2010. - 920 с.
|
|
|
|
ГЛАВА 23 РАК ПЕЧЕНИ
ЭПИДЕМИОЛОГИЯ
Первичный рак печени в России является сравнительно редким заболеванием и составляет 3-5 % в общей структуре злокачественных новообразований. В 2007 г. в стране зарегистрировано 6298 новых случаев рака печени. Мужчины заболевают примерно в 1,5-2 раза чаще женщин. В 2007 г. в России показатель заболеваемости мужчин раком печени и внутрипеченочных желчных протоков составил 5,4, женщин - 3,6.
Заслуживает внимания тот факт, что в некоторых странах первичный рак печени занимает ведущую позицию в структуре онкологической заболеваемости: его доля в структуре злокачественных новообразований в странах Юго-Восточной Азии составляет около 40 %, а в странах юга Африки - более 50 %.
Ежегодно в мире от первичного рака печени погибают более 300 тыс. человек. В 2005 г. в России показатель смертности мужчин от рака печени был 5,8, женщин - 2,6 (на 100 тыс. населения).
ФАКТОРЫ РИСКА
1. Вирусоносительство антигена гепатита В (Ы^-антиген обнаруживают у 70-90 % больных первичным раком печени).
Вирус гепатита В относится к группе гепаднавирусов. Ы^-антиген вируса оказывает ингибирующее действие на функцию антионкогена р53, который участвует в супрессии клеточного деления.
Возбудитель гепатита С также является одним из факторов высокого риска, способствующих развитию гепатоцеллюлярного рака (ГЦР). По данным ВОЗ, в течение 8 лет после заражения эта форма рака развивается у каждого 6-го больного. При хроническом гепатите С происходит инактивация опухолевого супрессора р53; это
приводит к утрате негативного контроля пролиферации и нарастанию генетической нестабильности клеток, что резко увеличивает вероятность возникновения ГЦР.
Таким образом, профилактика ГЦР печени включает меры по снижению заболеваемости гепатитом В и С, а именно вакцинацию групп повышенного риска.
2. Длительное употребление алкоголя, приводящее к циррозу печени (ЦП), является одним из факторов риска возникновения рака. При ЦП в печени происходят процессы атрофической клеточной дегенерации, в гепатоцитах наблюдаются признаки клеточной атипии.
3. Описторхозная инвазия. Возбудителем описторхоза являются двуустка кошачья или двуустка сибирская (класс трематод типа плоских червей). Заболевание характеризуется очаговостью распространения в речных бассейнах Днепра, Камы, Волги, Дона, Северной Двины, Печоры, Невы, в Сибири - Оби, Иртыша. Заражение происходит при употреблении в пищу сырой талой или мороженой рыбы (строганина), недостаточно термически обработанной, в основном карповых пород. Двуустка кошачья в организме человека паразитирует в желчных протоках печени, желчном пузыре в течение длительного времени, нередко десятилетиями. Развиваются хроническое воспаление желчных протоков, нарушение оттока желчи, явления дисплазии эпителия; в дальнейшем на этом фоне повышается риск развития холангиокарциномы. Главным в профилактике холангиокарциномы является употребление в пищу рыбы после тщательной термической обработки.
4. Высокий уровень заболеваемости в странах Южной Африки и Юго-Восточной Азии связан с употреблением в пищу сельскохозяйственных культур, зараженных Aspergellus flavus, продуцирующим афлотоксин В. В связи с увеличением в последние годы поставок в нашу страну продуктов питания из различных регионов мира необходим строгий контроль качества этой продукции.
Гистологическая классификация опухолей печени (ВОЗ, 1983)
Согласно гистологической классификации опухолей печени, разработанной экспертами ВОЗ, выделяют следующие гистологические формы.
I. Эпителиальные опухоли.
А. Доброкачественные.
1. Печеночно-клеточная аденома (гепатоцеллюлярная аденома).
2. Аденома внутрипеченочных желчных протоков.
3. Цистаденома внутрипеченочных желчных протоков. Б. Злокачественные.
1. ГЦР (печеночно-клеточный рак).
2. Холангиокарцинома (рак внутрипеченочных желчных протоков).
3. Цистаденокарцинома желчных протоков.
4. Смешанный гепатохолангиоцеллюлярный рак.
5. Гепатобластома.
6. Недифференцированный рак.
II. Неэпителиальные опухоли.
A. Гемангиома.
Б. Инфантильная гемангиоэндотелиома.
B. Гемангиосаркома.
Г. Эмбриональная саркома.
Д. Другие.
III. Различные другие типы опухолей.
A. Тератома.
Б. Карциносаркома.
B. Другие.
IV. Неклассифицируемые опухоли.
V. Опухоли кроветворной и лимфоидной ткани. VI. Метастатические опухоли.
VII. Аномалии эпителия.
А. Дисплазия печеночных клеток. Б. Аномалии желчного протока.
VIII. Опухолеподобные процессы.
A. Гамартомы.
1. Мезенхимальная гамартома.
2. Билиарная гамартома (микрогамартома, комплекс ван Мейенбурга).
Б. Врожденные билиарные кисты.
B. Очаговая узловая гиперплазия.
Г. Компенсаторная долевая гиперплазия. Д. Пурпурная печень. Е. Гетеротопия. Ж. Другие.
Среди первичных злокачественных опухолей печени ГЦР встречается чаще, чем холангиокарцинома: в 70-80 % случаев по сравнению c 20-30 %. ГЦР почти всегда сочетается с ЦП, в отличие от рака внутрипеченочных желчных протоков, который сопровождается циррозом примерно в 25 % случаев.
МАКРОСКОПИЧЕСКИЕ ФОРМЫ
ПЕРВИЧНОГО РАКА ПЕЧЕНИ
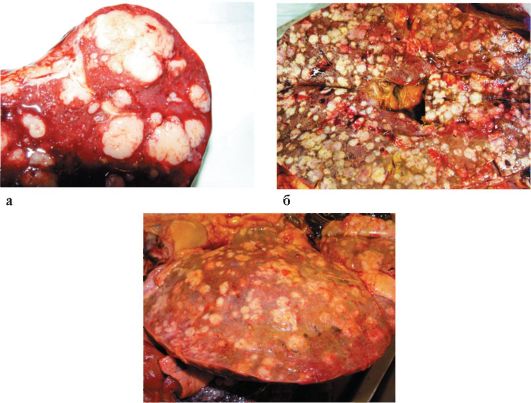
1. Узловая форма - встречается наиболее часто, составляя 60-85 % всех форм рака (рис. 23.1). Почти всегда сопровождается ЦП. В толще увеличенной в размерах печени содержатся многочисленные опухолевые очаги - как микроскопические, так и диаметром до нескольких сантиметров. Согласно уницентрической теории роста, вначале возникает одна злокачественная опухоль, из которой затем образуется множество метастатических опухолей в остальных отделах печени.
 в
в
Рис. 23.1. Рак печени. Макропрепарат (а-в)
Согласно мультицентрической теории роста, опухоли возникают одновременно из нескольких очагов.
2. Массивная форма - встречается почти в 25 % случаев первичного рака печени. Опухоль обычно располагается в правой доле печени и иногда достигает огромных размеров. При массивной форме рака ЦП встречается очень редко. Опухоли единичные либо окружены более мелкими метастатическими очагами.
3. Диффузная форма - встречается реже, чем предыдущие; составляет около 12 % всех случаев первичного рака печени. Печень не увеличена в объеме. На фоне атрофического цирроза развивается милиарный карциноматоз печени.
Метастазирование
К регионарным лимфатическим узлам печени относятся воротные, супрапанкреатические, передние и задние узлы средостения.
При первичном раке печени метастазы в регионарные лимфатические узлы (чаще - в области ворот и расположенные вдоль печеночной ножки) встречаются приблизительно в 5 % случаев. Реже наблюдается лимфатическая отдаленная диссеминация в передние и задние лимфатические узлы средостения, шейные лимфатические узлы.
Длительное время считали, что гематогенные метастазы при первичном раке печени встречаются редко. В настоящее время установлено, что одним из ранних проявлений первичного рака печени в 1,5-5 % случаев являются гематогенные метастазы в ребра и позвоночник.
Метастазы первичного рака печени в легкие обнаруживаются на более поздних стадиях заболевания примерно в 10 % случаев.
Значительно чаще происходит внепеченочное распространение опухоли в близлежащие органы - диафрагму, желудок, двенадцатиперстную кишку, надпочечники.
Метастазы гепатоцеллюлярного рака могут сохранять функциональные свойства клеток печени (например, способность секретировать желчь).
КЛИНИЧЕСКАЯ КЛАССИФИКАЦИЯ TNM (2002)
Правила классификации
Представленная ниже классификация применима в первую очередь для печеночно-клеточного рака. Кроме того, эту классификацию можно использовать для холангиокарциномы (рака внутрипеченочных желчных протоков). В каждом случае необходи-
мы гистологическое подтверждение диагноза и выделение гистологического типа опухоли.
Анатомические области
1. Печень.
2. Внутрипеченочные желчные протоки.
Регионарные лимфатические узлы
К регионарным относят воротные лимфатические узлы, а также узлы по ходу нижней полой вены, портальной вены, собственной печеночной артерии. Исключение составляют нижние диафрагмальные лимфатические узлы.
Клиническая классификация TNM
Т - первичная опухоль
Тх - оценка первичной опухоли невозможна.
Т0 - первичная опухоль не обнаружена.
Т1 - одиночная опухоль без поражения сосудов.
Т2 - одиночная опухоль с поражением сосудов либо множественные опухоли диаметром не более 5 см.
Т3 - множественные опухоли диаметром более 5 см либо опухоль с поражением крупных ветвей воротной или печеночной вены.
Т4 - опухоль с непосредственным распространением на прилегающие органы и ткани за исключением желчного пузыря либо опухоль с проникновением через висцеральную брюшину.
N - регионарные лимфатические узлы
? - состояние регионарных лимфатических узлов оценить невозможно.
N0 - метастазов в регионарных лимфатических узлах нет.
N1 - наличие метастазов в регионарных лимфатических узлах.
М - отдаленные метастазы
Мх - наличие отдаленных метастазов оценить невозможно.
М0 - отдаленных метастазов нет.
М1 - наличие отдаленных метастазов.
Патоморфологическая классификация pTNM
Критерии выделения категорий рТ, рN и рМ соответствуют таковым для категорий Т, N и М.
С целью патоморфологической оценки показателя N проводят удаление трех регионарных лимфатических узлов или более. В настоящее время принято, что отсутствие характерных изменений ткани при патоморфологическом исследовании биоптатов меньшего количества лимфатических узлов позволяет подтвердить стадию
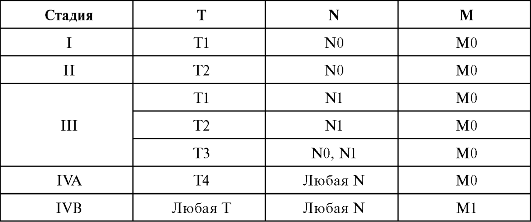
Группировка по стадиям
 КЛИНИЧЕСКАЯ КАРТИНА
КЛИНИЧЕСКАЯ КАРТИНА
Особенностями клинической картины первичного рака печени являются незаметное начало, неспецифичность субъективных симптомов, быстрое течение болезни, в результате чего диагноз почти всегда устанавливают в запущенной стадии заболевания.
Больные обращаются к врачу впервые в среднем через 3 мес с момента появления первых симптомов заболевания. Примерно 75 % больных жалуются на похудение, отсутствие аппетита, боли в животе. Более половины больных сами обнаруживают у себя опухоль в области печени. Преобладающими среди пациентов являются жалобы на выраженную общую слабость, вялость, быструю утомляемость, увеличение размеров живота, желтуху, повышение температуры тела, понос, тошноту, рвоту, появление отеков, носовые кровотечения.
Основным объективным симптомом заболевания служит гепатомегалия, которая наблюдается примерно у 90 % больных первичным раком печени. Нижняя граница печени по правой среднеключичной линии увеличивается в среднем на 5-10 см. Верхняя граница печени
достигает уровня IV ребра, увеличивается и переднезадний размер грудной клетки. При пальпации печень очень плотная (каменистой консистенции), иногда с гладкой поверхностью и твердым и острым передним краем. Увеличение печени сопровождается ощущением распирания в эпигастральной области. Более чем у половины больных поверхность печени и передний ее край - с множеством узелков различной величины, чаще плотной консистенции. В более редких случаях наблюдается очаговое увеличение печени, при этом пальпаторно удается определить нечетко отграниченную опухоль в правой или левой половине печени. Увеличивающаяся в размерах опухоль сдавливает ветви воротной вены. Следствием этого являются портальная гипертензия, увеличение размеров селезенки, иногда - расширение вен пищевода.
На боль в правом подреберье, эпигастрии или поясничной области жалуются около 70 % больных. Боль вызывается быстрым ростом опухоли и растяжением вследствие этого глиссоновой капсулы печени, иногда - сопутствующим перигепатитом. Болевой симптом вначале периодический, возникает при ходьбе и физическом напряжении. Позже боль может стать постоянной, умеренно интенсивного характера, обычно проявляется ощущением тяжести в эпигастрии и правом подреберье.
Из диспепсических расстройств у больных наблюдаются метеоризм, тошнота, рвота, понос, что приводит к выраженному похудению.
Желтуха - симптом непостоянный, как правило, она ярко не выражена и наблюдается примерно у половины больных. При первичном раке печени желтуха механическая - причиной ее возникновения является сдавление опухолью внутрипеченочных желчных протоков. Интоксикация также приводит к недостаточности печени вследствие дегенеративных изменений ее клеточных структур. Интенсивность желтухи не всегда является признаком, характеризующим степень распространенности опухолевого процесса.
Асцит наблюдается у половины госпитализированных больных и соответствует синдрому портальной гипертензии, возникающей иногда вследствие внутрипеченочной блокады из-за ЦП, а иногда в результате внепеченочной блокады, обусловленной тромбозом воротной вены. Часто асцит бывает геморрагического характера. Асцитическая жидкость обычно не содержит опухолевых клеток.
Температура тела повышена у большинства больных - субфебрильная, обусловлена раковой интоксикацией. Иногда температура
обусловлена инфицированием некротических очагов или развитием холангита.
Признаками, сопутствующими ЦП, на фоне которого возник первичный рак, являются развитие коллатерального кровообращения, увеличение селезенки, сосудистые звездочки, ладонная эритема, гинекомастия и др.
Паранеопластические синдромы, наблюдающиеся примерно у 10-15 % больных, сопровождаются гипогликемией, эритроцитозом, гиперкальциемией, гиперхолестеринемией. Наиболее часто встречается гипогликемический паранеопластический синдром, который проявляется нарастающей сонливостью, прогрессирующей слабостью и спутанностью сознания. Реже возникает внезапно, в виде гипогликемического криза, и заканчивается развитием гипогликемической комы.
По преобладанию одного симптома или группы симптомов описаны различные клинические формы первичного рака печени. Различают следующие клинические формы рака печени:
• гепатомегалическая;
• форма, симулирующая абсцесс печени;
• цирротическая;
• форма с механической желтухой;
• внутрибрюшная геморрагическая;
• гипогликемическая;
• литиазная (симулирующая желчнокаменную болезнь);
• форма хронического гепатита (симулирующая гепатит);
• интраабдоминальная кистозная;
• диффузная карциноматозная;
• лейкемоидная;
• параплегическая (при метастазах в позвоночник).
ДИАГНОСТИКА
Диагностика рака печени представляет определенные трудности.
В клиническом анализе крови больного первичным раком печени выявляются повышенная СОЭ, нейтрофильный лейкоцитоз, иногда - эритроцитоз.
Лабораторная диагностика рака печени основана на обнаружении в сыворотке крови зародышевого белка α-фетопротеина. В 1963 г. Г.И. Абелев и соавт. обнаружили α-фетопротеин в сыворотке крови
зародыша человека и мышей с первичным раком печени в эксперименте. Ю.С. Татариновым в 1964 г. этот метод был внедрен в клиническую практику. Положительная реакция на α-фетопротеин отмечается у 70-90 % больных ГПЦ. Нормальная концентрация указанного маркера в сыворотке крови взрослых (исключая беременных) достигает 15 мкг/л.
Радиоизотопное сканирование печени с 131I, 198Au позволяет обнаружить «холодные» очаги в печени, соответствующие локализации опухоли. Сосудистый характер опухоли печени выявляется с помощью эмиссионной КТ с использованием меченых эритроцитов.
УЗИ позволяет визуализировать опухолевый очаг, увеличенные регионарные лимфатические узлы, выявить асцит и метастатическое поражение печени.
Первичный рак печени на сонограмме представляет собой округлой формы образование с эхопозитивными и эхонегативными участками, иногда с полостью распада в центре.
Одним из методов топической диагностики новообразований печени является КТ (рис. 23.2).
МРТ также применяется с целью диагностики первичного рака печени; ее преимуществом является возможность получения изображения печени в различных срезах, вследствие чего повышается информативность метода в отношении уточнения локализации опухоли и внутри- и внепеченочного ее распространения.
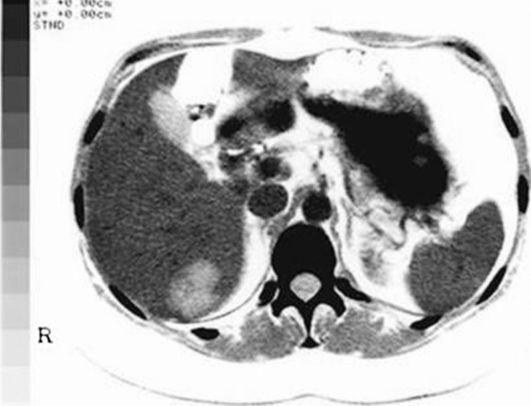 Рис. 23.2. Рак печени. Компьютерная томограмма
Рис. 23.2. Рак печени. Компьютерная томограмма
Селективная целиакография - специальный метод исследования, позволяющий установить точную локализацию опухоли печени. ГПЦ на снимке выглядит как очаг гиперваскуляризации, образованный расширенными сосудами с неравномерным просветом, формирующими густую сеть в толще опухоли.
Методом морфологической диагностики первичного рака печени является тонкоигольная пункционная биопсия, которую выполняют под контролем УЗИ и лапароскопии.
Наиболее достоверный диагноз первичного рака печени устанавливают при лапароскопии с биопсией опухоли.
При отсутствии желтухи у больного раковые узлы печени желтоватого или белого цвета, при ее наличии - с зеленоватым оттенком. Опухоль - плотной, хрящевой консистенции, с неровной, бугристой поверхностью, иногда с кратерообразным углублением в центре. При оптическом увеличении в зоне опухоли визуализируется сеть мелких кровеносных сосудов.
В сложных диагностических случаях выполняют диагностическую лапаротомию.
Метастатический рак печени
Более 90 % среди всех злокачественных новообразований печени составляют вторичные, или метастатические, злокачественные опухоли. По локализации метастатического рака печень занимает 1-е место (см. рис. 23.1, б, в). Обычно метастазирование происходит по печеночной артерии, воротной вене и по протяжению. Метастазы рака поджелудочной железы в печень встречаются в 50 % случаев, колоректального рака - в 20-50 %, рака желудка - в 35 %, рака молочной железы - в 30 %, рака пищевода - в 25 % случаев.
Симптоматология вторичных (метастатических) опухолей печени определяется первичным и вторичным опухолевыми процессами.
В диагностике метастатических опухолей печени используют УЗИ, КТ, лапароскопию с взятием биопсии.
ЛЕЧЕНИЕ
Несмотря на успехи медицины и научный прорыв в ряде ее областей, при злокачественных новообразованиях печени современная онкология пока не может предложить более радикального средства, чем хирургическое лечение, которое сегодня остается «золотым стандартом».
5-летняя выживаемость (при метастазировании колоректального рака в печень), по литературным данным, составляет от 25-28 до 35-40 %.
В комбинации с химиотерапией в адъювантном режиме, по данным Ю.И. Патютко и соавт. (2003), 5-летняя выживаемость при метастазах колоректального рака в печень повышается до 48 %. К сожалению, как известно, операбельность при злокачественных опухолях печени, по сводным данным, не превышает 15-20 % (рис. 23.3), т.е. более 80 % больных подлежат нехирургическим методам противоопухолевого воздействия.
Методы нехирургического лечения можно условно разделить на лекарственные (системная/регионарная химиотерапия, химиоэмболизация), местно-деструирующие способы воздействия (аблация, радиоэмболизация) и лучевую терапию. В ряде случаев эффективной оказывается комбинация нескольких методов.
Эффективность химиотерапии при лечении больных с нерезектабельными колоректальными метастазами в печень была столь незначительна, а ее токсичность так велика, что до 1990-х годов считалось более этичным не проводить ее вообще.
Длительное время стандартным режимом при метастатическом раке толстой кишки являлась комбинация 5-фторурацила и лейковорина, эффективность которой в качестве 1-й линии химиотерапии составляет 16-21 %.
Разработка и внедрение в клиническую практику новых препаратов (иринотекан, оксалиплатин и др.) и новых схем их применения (FOLFOX, IFL, XELOX, FOLFIRI) позволили пересмотреть место
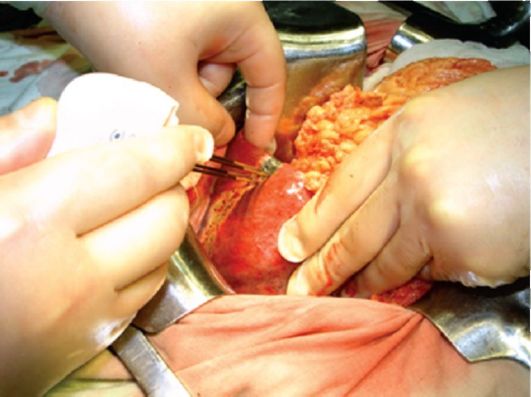 Рис. 23.3. Этап хирургической операции
Рис. 23.3. Этап хирургической операции
химиотерапии в лечении метастатического рака печени. Созданные на основе этих препаратов комбинации позволили увеличить общую эффективность лечения до 35-39 %.
Углубленные исследования в области канцерогенеза, изучения механизмов функционирования опухолевых клеток стали стимулом к синтезу препаратов для таргетной терапии, - таких, как бевацизумаб (авастин) - ингибитор рецепторов сосудистого фактора роста эндотелиальных клеток, цетуксимаб - ингибитор рецепторов эпидермального фактора роста, целекоксиб - ингибитор циклоок- сигеназы-2. Предварительные результаты многочисленных работ, посвященных изучению эффективности химиотерапии с включением в схему лечения этих препаратов, демонстрируют потенциальную возможность увеличения частоты объективного ответа, времени до прогрессирования и общей выживаемости.
Результаты химиотерапевтического лечения неоперабельного ГЦР остаются более чем скромными: одногодичная выживаемость не превышает 15 %, а медиана выживаемости - 18 мес.
Для снижения общей токсичности и повышения концентрации химиопрепарата в опухолевой ткани с 1970-х годов применяют методику регионарной внутриартериальной инфузии препаратов в общую печеночную артерию. По некоторым данным, непосредственный эффект при ГЦР наблюдался в 47-60 % случаев.
Имеются работы по комбинированному применению внутриартериальной химиотерапии и иммунотерапии при ГЦР. При этом клиническое улучшение зафиксировано почти у половины больных, однако увеличения продолжительности жизни не отмечено.
Химиоэмболизация применяется как самостоятельно, так и в сочетании с другими способами лечения.
В основе метода лежит особенность кровоснабжения печени и опухолевых узлов. 75 % притекающей к печени крови доставляется по портальной вене и лишь 25 % - по печеночной артерии, в то время как кровоснабжение опухолевой ткани на 95 % осуществляется за счет более оксигенированной артериальной крови из бассейна печеночной артерии. Таким образом, при эмболизации ветвей печеночной артерии создается зона ишемии, к которой высокочувствительны опухолевые клетки. В этой зоне развивается ишемический некроз.
Чувствительность опухоли к химиопрепарату напрямую зависит от его концентрации. При регионарном артериальном введении концентрация препарата в ткани печени выше в 10-100 раз, чем
при системном введении, а общетоксическое влияние, напротив, ниже. Введение эмболизата способствует задержке препарата в ткани (от нескольких часов до недель). Наибольшее распространение получила так называемая масляная эмболизация, когда используется смесь раствора химиопрепарата и масляного контрастного вещества.
Для проведения химиоэмболизации не требуется дорогостоящее оборудование (при условии, что в распоряжении интервенционного радиолога имеется рентгенотелевизионный комплекс). Показанием к химиоэмболизации служит наличие первичной или метастатической опухоли (опухолей) печени у пациентов, которым возможно выполнить селективную катетеризацию. К противопоказаниям относят недостаточный портальный кровоток, печеночную недостаточность, билиарную гипертензию, объем опухолевого узла более 50 % объема печени, а также сердечную и почечную недостаточность.
Чувствительность опухолей (как первичных, так и метастатических) к химиоэмболизации составляет 60-80 %. При развитии рецидивов возможны повторные манипуляции. Частота осложнений, включающих абсцесс либо некроз печени, равна 5 %. Смертность в интервале до 30 дней после процедуры составляет 1-3 %.
Лучевая терапия. Дистанционная лучевая терапия не получила широкого распространения из-за того, что малые (субтерапевтические) дозы не давали желаемого результата, а при подведении терапевтических доз крайне высока вероятность развития лучевого гепатита, хотя некоторые авторы сообщают о доведении СОД до 70 Гр и медианы выживаемости (при ГЦР) - до 17 мес.
Внутрипротоковая лучевая терапия, как показали М.И. Нечушкин и соавт. (1998), весьма эффективна при холангиоцеллюлярном раке печени и позволяет увеличить среднюю продолжительность жизни до 19-29 мес.
С целью снижения лучевой нагрузки на неизмененную паренхиму печени был разработан метод местного лучевого воздействия на опухоль посредством доставки радиоизотопа непосредственно к опухоли.
Радиоэмболизация применяется в клинической практике с 1980- х гг. Стимулом к развитию этой методики послужили неудовлетворительные результаты ДЛТ опухолей печени. Микросферы, содержащие изотоп иттрия-90, вводили суперселективно через общую печеночную артерию к сосудам, кровоснабжающим опухоль. Были отмечены удовлетворительная переносимость лечения, отсутствие
тяжелых осложнений, однако увеличения продолжительности жизни не произошло, и методика не получила широкого распространения.
Поиски новых, эффективных методов воздействия на новообразования печени сегодня входят в список приоритетных задач большинства противораковых центров. Особое внимание уделяется малоинвазивным методикам, позволяющим при меньшем количестве осложнений добиться результатов лечения, в ряде случаев сопоставимых с таковыми при хирургическом вмешательстве.
Развитие интервенционной радиологии и новейшие разработки в сфере высоких технологий позволили создать ряд систем, оказывающих локальное деструктивное воздействие на опухоль. В последнее 10-летие активно развивается и получает широкое применение сравнительно новый метод лечения опухолей печени - аблация опухолей, т.е. локальное деструктивное воздействие, приводящее к развитию некроза с последующей организацией. Важно отметить, что метод может применяться как во время полостных операций, так и чрескожно. Это существенно расширяет контингент больных, подлежащих лечению.
Аблация (от лат. ablation) - методика прямого направленного умертвления ткани. Выделяют термическую аблацию и химическую (введение этилового спирта либо уксусной кислоты в опухоль) деструкцию, электрохимический лизис.
Химическая аблация заключается во введении химически активного соединения (этиловый спирт, уксусная кислота, др.) в опухолевую ткань под лучевым (УЗКТ, РКТ) наведением и контролем. Это довольно распространенный метод лечения в мире, так как он малоинвазивен, прост, дешев и дает неплохие результаты при лечении первичного рака печени. Ряд авторов отмечают меньшую частоту рецидивов после введения уксусной кислоты (по сравнению с этиловым спиртом).
Под действием химического агента (раствор спирта, кислоты) происходит дегидратация опухолевых клеток с развитием коагуляционного некроза и фиброза. Кроме того, развивается некроз эндотелиоцитов и активируется агрегация тромбоцитов, что приводит к тромбозу и ишемии.
Метод применяется, как правило, у больных ГЦР на фоне ЦП. При этом опухоль не должна превышать 30 % объема печени. Противопоказаниями являются тяжелая форма печеночной
недостаточности, глубокая тромбоцитопения, тромбоз портальной вены.
Недостаток метода - необходимость многократных инъекций (12 и более при введении этанола) и длительный период развития некроза. Кроме того, метод неэффективен при лечении колоректальных метастазов в печень.
При первичных опухолях диаметром менее 5 см полная деструкция наблюдается в 70-75 % случаев, при размерах опухоли от 5 до 8 см - приблизительно в 60 %.
Частота осложнений, таких, как кровотечение в брюшную полость, гемобилия, абсцесс печени, после многократных инъекций составляет 1,3-13,4 %, смертность - 0,09 %.
Электрохимический лизис получает развитие с середины 1990-х годов. Метод заключается в деструкции (лизисе) опухолевой ткани между парой электродов за счет литического действия щелочи (гидроксид натрия) и кислоты (соляная кислота), образующихся соответственно в зоне катода и анода. Кроме того, деструкция усиливается прямым воздействием постоянного электрического тока. Зона воздействия может существенно возрастать (до 20 см за 1 сеанс) за счет увеличения количества вводимых в опухоль электродов.
Термоаблация - гипотермическое воздействие (криодеструкция) и группа методов гипертермического воздействия (микроволновая, лазерная, радиочастотная и УЗ-деструкция).
Криоаблация (криодеструкция) применяется для лечения опухолей печени с 1963 г. Это наиболее старый и, следовательно, наиболее изученный из всех методов аблации. Для его проведения требуется специальная установка. В нее помещают криогенный материал (жидкий азот либо аргон), который, циркулируя по системе через криозонд или через криоаппликатор, подведенные к опухоли, создает необходимую пониженную температуру в очаге (180-190 °С ниже нуля). По сравнению с другими методами аблации (химическая, гипертермическая) при криодеструкции отмечается значительно более высокая частота осложнений (9-21 %).
Для локального повышения температуры созданы и успешно применяются системы гипертермической аблации: радиочастотная, микроволновая и лазерная, причем электроды (световоды) могут вводиться как непосредственно в орган (после лапаротомии), так и чрескожно под лучевым контролем. Зона воздействия микроволнового и лазерного аппаратов имеет веретенообразную форму и не
превышает в диаметре 1,8-2 см, поэтому часто требуются дополнительные аппликации. Кроме того, высокоинтенсивная сфокусированная УЗ-установка также позволяет локально повышать температуру ткани до 70 °С.
Сфокусированный высокоинтенсивный УЗ - это методика гипертермической деструкции тканей, использующая УЗ-энергию, которая сфокусирована в точке приложения на определенной глубине в теле человека. При этом поверхностные и глубокие структуры и органы, находящиеся на пути луча, остаются интактными.
Эффект достигается посредством двух механизмов: сначала температура повышается из-за поглощения энергии звуковых волн, что приводит к выраженному в различной степени термическому повреждению ткани. Второй механизм - это явление переходной или инерционной кавитации.
Безусловным преимуществом метода (даже при сравнении с радиочастотной аблацией) является его практическая неинвазивность, поскольку технология не требует никакого прокола кожи, так как отсутствует собственно зонд (электрод).
Основным ограничением метода является невозможность использовать его в органах, которые смещаются при дыхании. Кроме того, имеются ограничения и в зонах применения. Так, метод неприменим в случае, если на пути УЗ-лучей между датчиком и опухолью имеется костная или воздушная ткань.
Из перечисленных устройств лишь радиочастотный аппарат позволяет сегодня получить заданную сферическую зону воздействия диаметром до 7 см в ходе однократной аппликации (система RITA). Это стало возможным благодаря внедрению ряда принципиально новых технических решений, таких, как использование многоэлектродных зондов, охлаждаемых электродов и др. В настоящее время разрабатываются мультиволоконные световоды, которые увеличивают зону некроза при лазерной аблации до 5 см.
Радиочастотная термоаблация, являясь одним из молодых методов воздействия на опухоль, находит все более широкое применение в лечении онкологических больных. Полученные результаты позволяют рассматривать данную технологию в ряде случаев как самостоятельный метод лечения в онкологии. Безусловными достоинствами рассматриваемого метода являются его малая инвазивность и реальный клинический эффект. Сегодня метод радиочастотной аблации
органично вплетается в схему комбинированного и комплексного лечения опухолей печени.
ПРОГНОЗ
Общая 5-летняя выживаемость после хирургического лечения первичного рака печени, по разным данным, составляет от 10 до 30 %. По данным American Cancer Society, 5-летняя выживаемость при раке печени в 1975-1977 гг. составляла 4%, в 1984-1986 гг. - 6 %,
в 1996-2002 гг. - 10 %.
Вопросы для самоконтроля
1. Дайте определение первичного и метастатического рака печени.
2. Каковы тенденции заболеваемости и смертности от первичного рака печени в России и в мире?
3. Охарактеризуйте макроскопические формы роста первичного рака печени.
4. Назовите гистологические варианты рака печени.
5. Какие факторы являются ведущими в этиологии и патогенезе ГЦР?
6. Какова роль описторхоза в возникновении холангиокарциномы?
7. Меры профилактики первичного рака печени.
8. Какие клинические симптомы характерны для первичного рака печени?
9. Охарактеризуйте периоды развития и клинические формы рака печени.
10. Какие существуют методы диагностики рака печени?
11. Назовите принципы и методы лечения первичного и метастатического рака печени.
12. Каков прогноз при раке печени?