Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев. 2010. - 920 с.
|
|
|
|
ГЛАВА 26 ЗЛОКАЧЕСТВЕННЫЕ ЛИМФОМЫ
ЛИМФОМА ХОДЖКИНА (ЛИМФОГРАНУЛЕМАТОЗ)
Лимфома Ходжкина (ходжкинская злокачественная лимфома), первичное опухолевое заболевание лимфатической системы.
Впервые лимфому Ходжкина описал в 1832 г. английский врач Т. Ходжкин, сообщивший о семи случаях заболевания, протекающего с увеличением лимфатических узлов и селезенки, лихорадкой, кахексией, неизменно заканчивающегося смертью больного.
В 1875 г. И.А. Кутаревым были проведены первые гистологические исследования удаленного при жизни больного лимфатического узла. В 1890 г. русский исследователь С.Я. Березовский описал гистологическую картину лимфомы Ходжкина. Он установил наличие патогномоничных для лимфомы Ходжкина гигантских клеток. В 1897-1898 гг. венские патологоанатомы I. Paltauf, С. Sternberg, D. Reed описали полиморфно-клеточную гранулему с наличием гигантских многоядерных клеток, названных впоследствии клетками Березовского-Рид-Штернберга.
ЭПИДЕМИОЛОГИЯ
Важность изучения лимфомы Ходжкина, как и всех злокачественных лимфом, диктуется тем, что заболевшие - в основном люди молодого возраста (большинство - от 12 до 40 лет). В структуре онкологической заболеваемости лимфома Ходжкина занимает 9-10-е место. Показатель заболеваемости злокачественными новообразованиями лимфатической и кроветворной тканей в РФ в 2007 г. составил 16,0 на 100 тыс. населения, в том числе лимфомой Ходжкина - 2,2. Городские жители болеют приблизительно в 1,5 раза чаще, чем сельское население. Лимфомой Ходжкина заболевают в любом возрасте, но 1-й пик заболеваемости приходится на 20-30 лет; 2-й пик отмечается после
60 лет. Мужчины болеют несколько чаще женщин. Уровень заболеваемости мужского населения выше в 1,5-2 раза в детском возрасте и в возрастной группе старше 40 лет.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Основной аргумент, выдвигаемый в пользу инфекционной природы лимфомы Ходжкина, базируется на эпидемиологическом анализе частоты заболеваемости в разных регионах. В группу повышенного риска включают однояйцевых близнецов в случае заболевания одного из них, ближайших родственников больных и лиц, перенесших инфекционный мононуклеоз. Инфекция в раннем детстве может привести к иммунизации без проявления признаков заболевания, в более поздние сроки - к развитию лимфомы Ходжкина. О значении генетических факторов в этиологии заболевания можно судить на основании частоты выявления определенных HLA-антигенов, в первую очередь у идентичных близнецов.
Другая теория базируется на вирусном поражении Т-лимфоцитов. Повышение спонтанной трансформации и появление гипербазофильных клеток в периферической крови могут служить признаком иммунной защиты сенсибилизированных лимфоцитов от генетически чужеродных, пораженных вирусом клеток. Аналогичным образом можно объяснить цитотоксическое действие лимфоцитов, полученных от пациентов с болезнью Ходжкина, на культивируемые клетки Березовского-Рид-Штернберга и сходную топографию этих клеток и лимфоцитов в организме. Циркулирующие иммунные комплексы с помощью антител адсорбируются преимущественно на этих клетках. Таким образом, феномен злокачественной трансформации фагоцитарной системы находится в центре внимания исследователей, однако вопрос о природе Т-клеточных нарушений остается открытым. Супрессорный эффект приписывают злокачественно трансформированным макрофагам.
Происхождение клетки Березовского-Рид-Штернберга окончательно не установлено. Вероятнее всего, эта клетка происходит из Т- и В-лимфоцитов. Некоторые авторы указывали, что злокачественные клетки при лимфогранулематозе могут происходить из моноцитарно-гистиоцитарно-макрофагального клона. При лимфоме Ходжкина нарушается структура лимфатических узлов; соедини-
тельнотканные тяжи, разрастаясь непосредственно от капсулы, пронизывают ткань лимфатического узла, превращая его в гранулему. Клеточный состав представлен В-лимфоцитами на разных стадиях созревания, Т-лимфоцитами с фенотипом Т-хелперов и Т-супрессоров. При лимфоме Ходжкина особое диагностическое значение приобретает обнаружение одноядерных клеток Ходжкина, являющихся промежуточным звеном при трансформации в многоядерные клетки Березовского-Рид-Штернберга.
S. Роррота (1992) указывает на изменение кариотипа у 30 % больных лимфогранулематозом. Отмечено также, что частота изменения кариотипа различна при разных гистологических вариантах лимфогранулематоза.
КЛАССИФИКАЦИЯ
Гистологическая классификация лимфомы Ходжкина
Диагноз лимфомы Ходжкина может быть установлен только на основании гистологического исследования, после биопсии лимфатического органа или узла. Доказательством наличия лимфомы Ходжкина является обнаружение клеток Березовского-Рид-Штернберга.
В соответствии с Международной морфологической классификацией (Raje Classification) различают 4 классических варианта лимфомы Ходжкина:
1) нодулярный склероз (типы 1 и 2);
2) классический вариант, богатый лимфоцитами;
3) смешанно-клеточный вариант;
4) вариант лимфоидного истощения.
Классификация по стадиям. Признаки интоксикации, их прогностическое значение
Распространенность опухолевого процесса определяется в соответствии с клинической классификацией, принятой в 1971 г. на конференции по злокачественным лимфомам (г. Анн-Арбор, США).
I стадия - поражение 1 лимфатической зоны (I) или локализованное поражение 1 экстралимфатического органа или ткани (IE).
II стадия - поражение 2 лимфатических областей или более по одну сторону диафрагмы (II) или локализованное поражение 1 экстралимфатического органа или ткани и их регионарных лимфатических
узлов с другими (или без них) лимфатическими областями по ту же сторону диафрагмы (IIE).
III стадия - поражение лимфатических узлов по обе стороны диафрагмы (III), которое может сочетаться с локализованным поражением 1 экстралимфатического органа или ткани (IIIE), с поражением селезенки (IIIS) или с сочетанным их поражением (IIIE + S).
IV стадия - диссеминированное поражение одного или нескольких экстралимфатических органов, с поражением (или без него) лимфатических узлов; или изолированное поражение экстралимфатического органа с поражением отдаленных лимфатических узлов.
Символом S обозначается поражение селезенки (стадии IS, IIS, IIIS); символом E - локализованное экстранодальное поражение (стадии IE, IIE, IE). Символом В обозначается наличие одного или более из следующих симптомов: ночной профузный пот, повышение температуры выше 38 °С не менее трех дней подряд без признаков воспалительного процесса, потеря 10 % массы тела за последние 6 мес; символом А - отсутствие указанных выше симптомов.
Симптомы интоксикации являются неблагоприятными прогностическими факторами у больных лимфомой Ходжкина.
КЛИНИЧЕСКАЯ КАРТИНА. ДИАГНОСТИКА
Клиническое течение заболевания зависит от локализации первичного очага, степени вовлечения в процесс близлежащих органов и морфологического варианта заболевания.
Заболевание чаще начинается с увеличения одного или нескольких лимфатических узлов шейнонадключичной, подмышечной или паховой области (рис. 26.1).
При длительном анамнезе лимфатические узлы могут достигать огромных размеров, сливаться в конгломераты.
При поражении лимфатических узлов средостения могут отмечаться одышка, кашель, одутловатость лица, синдром ВПВ. При локализации процесса в забрюшинных
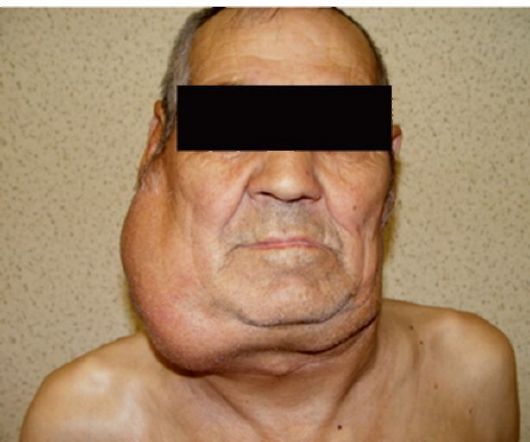 Рис. 26.1. Лимфома Ходжкина. Поражение шейных и надключичных лимфатических узлов
Рис. 26.1. Лимфома Ходжкина. Поражение шейных и надключичных лимфатических узлов
и мезентериальных лимфатических узлах могут появляться боли в животе, отек нижних конечностей.
Дифференциальную диагностику лимфомы Ходжкина проводят с лимфаденитом и лимфаденопатией различной этиологии. Бактериальный лимфаденит возникает в ответ на инфекцию и может наблюдаться при различных заболеваниях, таких, как СПИД, туберкулез и др. Протозойный (при токсоплазмозе) и грибковый (при актиномикозе) лимфаденит встречается относительно редко. Возможна вирусная природа лимфаденитов при инфекционном мононуклеозе, гриппе, краснухе. Лимфаденит может быть локальным, чаще в области ворот инфекции (при гриппе, ангине), или генерализованным (при сепсисе). Гистологическая структура лимфатического узла при реактивных лимфаденитах сохраняет нормальные его элементы.
Помимо изложенного выше различают клиническую (CS) и патологическую (PS) стадии. Клиническую стадию устанавливают в результате подробного клинического обследования и биопсии лимфатического узла (или ткани). Патологическая стадия подразумевает морфологическое подтверждение каждой локализации поражения, установленной в результате применения хирургических процедур: биопсии костного мозга, печени, а также лапаротомии со спленэктомией.
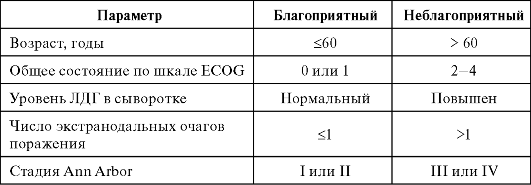
Для выбора тактики лечения больных лимфомой Ходжкина используется группа прогностических факторов, обозначаемых как благоприятные и неблагоприятные. К неблагоприятным прогностическим факторам относят: наличие массивных, диаметром более 5 см, лимфатических узлов, сливающихся в конгломераты; расширение тени средостения на рентгенограммах увеличенными лимфатическими узлами более чем на 1/3 диаметра грудной клетки в самом широком ее месте (МТИ >0,35); массивное поражение селезенки, поражение трех зон лимфатических узлов или более; ускорение СОЭ >30 мм/ч - при стадии B и СОЭ >50 мм/ч при стадии А. Ряд исследователей относят к неблагоприятным факторам возраст старше 40 лет, экстранодальное поражение в пределах, обозначаемых символом E, смешанно-клеточный вариант и лимфоидное истощение. Наличие одного или нескольких из перечисленных выше признаков служит основанием для отнесения больного в группу с неблагоприятным прогнозом. Остальные пациенты, как и все больные с I патологической стадией лимфогранулематоза, относятся к группе с благоприятным прогнозом.
Значение морфологического метода исследования. Техника
Следует отметить определяющую роль морфологического исследования при лимфоме Ходжкина. Обязательно проведение аспирационной и открытой биопсии.
Цитологическая картина при лимфоме Ходжкина характеризуется клеточным полиморфизмом. В препарате видны лимфоциты, пролимфоциты, эозинофилы, нейтрофилы, плазматические клетки, одноядерные гигантские клетки Ходжкина, а также многоядерные гигантские клетки Березовского-Рид-Штернберга. Окончательный диагноз ставят только после гистологического исследования биопсированного лимфатического узла.
При лимфогистиоцитарном варианте отмечается пролиферация лимфоцитов и гистиоцитов. Встречаются единичные клетки Березовского-Рид-Штернберга. При варианте нодулярного склероза видны коллагеновые тяжи, разделяющие лимфатические узлы на отдельные участки. При смешанно-клеточном варианте рисунок лимфатического узла полностью стерт, местами отмечается лимфоидная гиперплазия с лимфобластами, лимфоцитами. Синусы разрушены, есть очаги некроза, в полях зрения большое количество клеток Березовского-Рид-Штернберга. При варианте лимфоидного истощения в препарате видно небольшое количество лимфоцитов, но они могут и отсутствовать. Имеются диффузный склероз, соединительнотканные тяжи, большое количество клеток Березовского- Рид-Штернберга.
Метод цитологического исследования пунктатов основан на изучении клеток патологического очага, полученных пункцией. Этот метод заключается в получении клеточного материала из лимфатических узлов, расположенных в толще тканей. Для данной процедуры должны быть подготовлены стерильные сухой шприц и сухая инъекционная игла.
В процедурной (перевязочной) больного укладывают на стол. Должны соблюдаться все правила асептики и антисептики. Кожу над лимфатическими узлами обрабатывают спиртом, после чего отмечают место укола иглой. Левой рукой фиксируют лимфатические узлы, а правой вводят иглу с заранее надетым шприцем. Ощутив попадание иглы в лимфатический узел, правой рукой начинают оттягивать поршень, а левой продвигают иглу то вглубь, то к поверхности опухоли. Фиксируя иглу в опухоли, шприц снимают в положении максимально оттянутого поршня, после
чего извлекают иглу. Затем в оттянутом положении вновь надевают иглу, быстрым толчком поршня выдувают ее содержимое на предметное стекло и из полученной капли пунктата приготовляют мазок.
Под биопсией понимают прижизненное изъятие кусочка ткани из опухолевого очага с целью микроскопического исследования. Техника биопсии зависит от глубины расположения лимфатических узлов. Ножевую (эксцизионную) биопсию проводят под местной анестезией или под внутривенным обезболиванием - в зависимости от глубины расположения лимфатических узлов. После 3-кратной обработки операционного поля проводят разрез над лимфатическими узлами. Берут на гистологическое исследование наибольший лимфатический узел или несколько лимфатических узлов. Удаление лимфатического узла лучше проводить вместе с капсулой. Если невозможно удаление всего лимфатического узла, выполняют клиновидную резекцию. Завершают биопсию гемостазом и послойными швами на рану.
Объем исследования для оценки распространенности опухолевого процесса. Значение диагностической лапаротомии. Спленэктомия
Диагностика лимфомы Ходжкина не представляет особых трудностей. Правильно собранный анамнез заболевания, характер лимфатических узлов, дополнительные методы диагностики с обязательной верификацией диагноза позволяют выявить опухолевую патологию на ранних стадиях заболевания.
Обследование больных лимфомой Ходжкина включает:
1. Анамнез, клинические данные (наличие или отсутствие симптомов интоксикации), количество пораженных лимфатических узлов и зон.
2. Биопсию пораженного лимфатического узла (цитологическая и морфологическая верификация диагноза с обязательным установлением гистологического варианта лимфомы Ходжкина).
3. Иммунофенотипирование.
4. Общий анализ крови (СОЭ, лейкоциты, лейкоцитарная формула).
5. Биохимический анализ крови (печеночные пробы, уровень щелочной фосфатазы, лактатдегидрогенизы (ЛДГ), фибриногена, гаптоглобина, церулоплазмина, а2-глобулина).
6. Трепанобиопсию костного мозга.
7. Рентгенографию органов грудной клетки (выяснение состояния медиастинальных, прикорневых лимфатических узлов, легочной ткани, плевры).
8. КТ грудной клетки (при малой информативности рентгенологических данных), установление размеров опухолевой ткани.
9. УЗИ органов брюшной полости и забрюшинной области для исключения поражения мезентериальных, забрюшинных, внутритазовых лимфатических узлов, печени, селезенки.
10. КТ брюшной полости (более точное установление зон поражения, экстралимфатических органов).
11. Радиоизотопное исследование костной системы с 99тТс и лимфатической системы с 67Оа.
По показаниям применяются:
• эндоскопические методы диагностики (фиброгастроскопия, ларингоскопия, торакоскопия, лапароскопия);
• лимфография;
• диагностическая лапаротомия.
Диагностическую лапаротомию проводят больным, у которых по данным клинического обследования нельзя точно установить, имеется поражение селезенки или нет. Проводят лапаротомию со спленэктомией и гистологическим исследованием селезенки. При изолированном поражении лимфатических узлов средостения показана трансторакальная пункция или торакоскопия с биопсией лимфатических узлов.
Факторы прогноза
1. Массивное поражение средостения (МТИ >0,33).
2. Спленомегалия (5 очагов поражения и более или увеличение органа с диффузной инфильтрацией).
3. Наличие одиночного экстранодального поражения (Е).
4. СОЭ >30 мм/ч для варианта В и СОЭ >50 мм/ч для варианта А.
5. 3 зоны пораженных лимфатических узлов и более.
Группы прогноза
• Благоприятный прогноз
I и IIA стадии, без факторов риска.
• Промежуточный прогноз
IA и IB стадии:
1. Наличие экстранодального поражения (Е).
2. СОЭ >30 мм/ч для варианта B.
3. СОЭ >50 мм/ч для варианта А. IIA стадия:
1. Наличие экстранодального поражения (Е).
2. СОЭ >50 мм/ч для варианта А.
3. Поражение 3 зон лимфатических узлов и более. IIB стадия:
1. СОЭ >30 мм/ч для варианта B.
2. Поражение 3 зон лимфатические узлов и более - IIIA стадия, без факторов риска.
• Неблагоприятный прогноз
IA стадии, ? стадии, IIA стадия:
1. Массивное поражение средостения (МТИ >0,33).
2. Спленомегалия (5 очагов поражения и более или увеличение органа с диффузной инфильтрацией).
IIB стадия:
1. Массивное поражение средостения (МТИ > 0,33).
2. Спленомегалия (5 и более очагов поражения или увеличение органа с диффузной инфильтрацией).
3. Стадия Е. IIIA стадия:
1. Массивное поражение средостения (МТИ >0,33).
2. Спленомегалия (5 очагов поражения и более или увеличение органа с диффузной инфильтрацией).
3. Стадия Е.
4. СОЭ >50 мм/ч.
Выбор метода лечения в зависимости от клинических особенностей болезни
Основными методами лечения лимфомы Ходжкина являются лучевой, лекарственный и их комбинация.
В течение нескольких десятилетий единственным методом лечения этой болезни было оперативное удаление пораженных лимфатических узлов. Но во второй половине XIX века установилось мнение, что в результате оперативного вмешательства происходит генерализация опухолевого процесса, и лечение болезни было ограничено общеукрепляющими средствами. В 1901 г. W. Pusey (Чикаго, США) провел однократные облучения лимфатических узлов у 2 больных
лимфогранулематозом. В 1902 г. N. Senn использовал рентгеновские лучи в терапии лимфомы Ходжкина; через 4 года этот метод появился в России (Решетило Д.Ф., 1906). И только с начала 1940-х годов лучевая терапия была дополнена химиотерапией. В качестве первого химиотерапевтического средства L. Сооатап и соавт. (1946) предложили мустаргеналкилирующий препарат из группы хлорэтиламинов.
В СССР с 1947 г. Л.Ф. Ларионовым стал использоваться аналог этого препарата - эмбихин. До начала 1960-х годов применение химиопрепаратов при лимфогранулематозе было нерегулярным и носило преимущественно исследовательский или паллиативный характер. Основным методом лечения лимфогранулематоза оставалась лучевая терапия. В начале 1960-х годов V. De Vita предложил
новый курс ПХТ - МОРР.
При применении радикальной лучевой терапии в самостоятельном режиме СОД доводится до 40 Гр за 4-6 нед, а в зонах профилактического облучения она составляет 30-60 Гр за 3-4 нед. Эта программа лечения является методом выбора только для больных с локальными (IA-IIA) патологическими стадиями лимфогранулематоза и благоприятными прогностическими факторами.
В последнее десятилетие наибольшее распространение получили различные комбинированные химиолучевые программы лечения. Для больных с благоприятными прогностическими признаками лечение проводят по программе: 2 цикла ПХТ по любой из схем 1-й линии + облучение только зон поражения в дозе 36 Гр + 2 цикла ПХТ по той же схеме, что и перед облучением.
Комбинированная терапия является методом выбора для больных лимфомой Ходжкина с (и IE-ПЕ) стадиями и неблагоприятным прогнозом. Лечение целесообразно начинать с ПХТ. Объем лечения всегда больше, чем у больных с благоприятным прогнозом. Используется программа, включающая 3 цикла ПХТ по одной из схем 1-й линии + облучение пораженных зон в дозе 36 Гр (некоторые авторы рекомендуют и профилактическое облучение зон субклинического распространения) + 3 консолидирующих цикла ПХТ.
В лечении больных с IIIA стадией лимфомой Ходжкина в последнее время все чаще используется комбинированная химиолучевая терапия. Для больных с благоприятными прогностическими факторами программа лечения включает 4 цикла ПХТ 1-й линии + облучение зон поражения в дозе 30-40 Гр.
Для больных с неблагоприятными прогностическими факторами программа лечения включает 6-8 циклов ПХТ по схеме 1-й линии + облучение зон поражения в дозе 30 Гр (для больных с полной ремиссией) и 40 Гр (для больных с остаточными опухолевыми массами). Для лечения больных с генерализованными ШБ-IV стадиями лимфомы Ходжкина методом выбора является цикловая ПХТ.
Ниже приведены наиболее распространенные схемы 1-й линии при лечении лимфомы Ходжкина:
МОРР: мехлорэтамин (мустарген, эмбихин) - 6 мг/м2 внутривенно в 1-й и 8-й дни; винкристин (онковин) - 1,4 мг/м2 (максимум 2 мг) внутривенно в 1-й и 8-й дни; прокарбазин (натулан) - 100 мг/м2 ежедневно внутрь с 1-го по 14-й день; преднизолон - 40 мг/м2 ежедневно внутрь с 1-го по 14-й день. Перерыв между циклами 2 нед. MVPP: аналогична схеме МОРР, только в ней винкристин заменен на винбластин в дозе 6 мг/м2 в те же дни введения. Перерыв между циклами 3-4 нед. CVPP: циклофосфамид - 600 мг/м2 внутривенно в 1-й и 8-й дни; винбластин - 6 мг/м2 внутривенно в 1-й и 8-й дни; прокарбазин - 100 мг/м2 ежедневно внутрь с 1-го по 14-й день; преднизолон 40 мг/м2 ежедневно внутрь с 1-го по 14-й день в 1-м и 4-м циклах. Перерыв между циклами 2 нед. СОРР: аналогична схеме CVPP, только в ней винбластин заменен на винкристин в дозе 1,4 мг/м2 (максимум 2 мг) в те же дни введения. Перерыв между циклами 2 нед. LVPP: аналогична схеме CVPP, только в ней циклофосфамид заменен на хлорамбуцил (лейкеран) в дозе 6 мг/м2 (максимум 10 мг) с 1-го по 14-й день ежедневно внутрь. Перерыв между циклами 3-4 нед. ABVD: доксорубицин (адриамицин) - 25 мг/м2 внутривенно в 1-й и 14-й дни; блеомицин 10 мг/м2 внутривенно в 1-й и 14-й дни; винбластин - 6 мг/м2 внутривенно в 1-й и 14-й дни; дакарбазин (ДТИК) - 375 мг/м2 внутривенно в 1-й и 14-й дни. Перерыв между циклами 2 нед. При применении только цикловой ПХТ у больных с любой стадией лимфомы Ходжкина лечение следует проводить до достижения полной ремиссии, после чего необходимо провести еще как минимум 2 консолидирующих цикла. Полная ремиссия, особенно у больных с генерализованными стадиями заболевания, редко достигается
ранее 4-го цикла ПХТ, поэтому необходимый минимум всей программы лечения составляет 6 циклов.
При лечении поздних рецидивов лимфомы Ходжкина, возникших после двух лет полной ремиссии, используются те же принципы, что и у первичных больных, т.е. выбор программы лечения зависит от стадии рецидива, определяемой теми же методами диагностики, что и при первичном обследовании. Большую сложность представляет лечение больных с ранними (до двух лет) рецидивами лимфомы Ходжкина и больных, у которых не получено полной ремиссии при первичном лечении. Больным с I-II стадиями и благоприятным прогнозом маргинальные (краевые) рецидивы, возникшие в течение первых 5 мес после лучевой терапии, рекомендуется дополнительно облучить в обычной дозе (40 Гр). Остальным больным показана смена химиотерапии.
Для лечения ранних генерализованных рецидивов после комбинированной терапии, первично-резистентных больных и больных с непрерывно рецидивирующими формами лимфомы Ходжкина предложено большое число схем 2-й линии, а в последнее десятилетие - и высокодозная химиотерапия под защитой аутотрансплантации костного мозга или стволовых клеток (схемы 3-й линии). В схемах 2-й линии нашли широкое применение такие препараты, как ломустин (CCNU), этопозид, тенипозид, а в схемах высокодозной терапии - и мелфалан (алкеран), сарколизин, цитарабин (алексан) и препараты платины.
Схемы 2-й линии для терапии лимфомы Ходжкина: DexaBEAM: дексаметазон - по 8 мг 3 раза в день внутрь в 1-10-й день; кармустин - 60 мг/м2 в/в в 2-й день или ломустин - 80 мг/м2 в/в в 2-й день; мелфалан - 20 мг/м2 в/в в 3-й день; этопозид - 200мг/м2 в/в с 4 по 7-й дни; цитарабин - 100 мг/м2 каждые 12 часов в/в с 4 по 7-й дни; КСФ - с 8-й по 18-й дни. Цикл возобновляется на 28-й день. После двух циклов проводится высокодозный этап. B-CAVe: блеомицин - 5 мг/м2 внутривенно в 1, 28, 35-й дни; ломустин - 100 мг/м2 внутрь в 1-й день; доксорубицин - 60 мг/м2 внутривенно в 1-й день; винбластин - 6 мг/м2 внутривенно в 1-й день. Курс повторяется на 42-й день. СЕР: ломустин - 80 мг/м2 внутрь в 1-й день; этопозид - 100 мг/м2 внутривенно капельно с 1-го по 5-й дни; преднемустин - 60 мг/м2 внутрь с 1-го по 5-й день. Курс повторяется на 28-й день.
Модификация схемы СЕР для перорального применения: РЕСС: преднизолон - 40 мг/м2 ежедневно внутрь с 1-го по 7-й день; этопозид - 200 мг/м2 ежедневно внутрь с 1-го по 3-й день; хлорамбуцил (лейкеран) 20 мг/м2 ежедневно внутрь с 1-го по 5-й день; ломустин (CCNU) 100 мг/м2 внутрь в 1-й день. Перерыв между циклами 3 нед. ABVD-salvage для резистентных к МОРР и ее модификациям больных: доксорубицин - 25 мг/м2 внутривенно в 1-й и 14-й дни; блеомицин - 10 мг/м2 внутривенно в 1-й и 14-й дни; винбластин - 6 мг/м2 внутривенно в 1-й и 14-й дни; дакарбазин - 175 мг/м2 ежедневно внутривенно с 1-го по 5-й день. Перерыв между циклами 4-6 нед. MOPP/ABV (возможно в 1-ю нед цикла использование одной из модификаций схемы МОРР): мехлорэтамин (эмбихин) - 6 мг/м2 внутривенно в 1-й день; винкристин (онковин) - 1,4 мг/м2 внутривенно (максимум 2 мг) в 1-й день; прокарбазин (натулан) - 100 мг м2 ежедневно внутрь с 1-го по 7-й день; преднизолон - 40 мг/м2 ежедневно внутрь с 1-го по 8-й дни; доксорубицин (адриамицин) - 35 мг/м2 внутривенно в 8-й день; блеомицин - 10 мг/м2 внутривенно в 8-й день; винбластин - 6 мг/м2 внутривенно в 8-й день. Перерыв между циклами 3 нед. Во второй линии применяются также схемы IGEV, ICE,IVAM. Схемы 3-й линии (высокодозная терапия + аутомиелотрансплантация или возвращение стволовых клеток):
BEAM: кармустин (BCNU) - 300 мг/м2 внутривенно в 1-й день; этопозид - 100-200 мг/м2 внутривенно во 2-5-й дни; цитарабин - 200-400 мг/м2 внутривенно во 2-5-й дни; мелфалан - 140 мг/м2 внутривенно в 6-й день; аутомиелотрансплантация или возвращение стволовых клеток на 7-й день. В настоящее время отмечаются увеличение прогностически неблагоприятных факторов и повышение частоты первично-резистентных форм лимфомы Ходжкина к цитостатической терапии. Все это приводит к ухудшению эффекта лечения, невозможности его проведения в оптимальных дозах и режимах. В результате сокращаются сроки ремиссий, повышается количество рецидивов, уменьшается продолжительность жизни пациентов. В последнее время широко используется высокодозная химиотерапия с облучением (или без него) перед аутотрансплантацией костного мозга, высокодозная химиотерапия
в сочетании с введением рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора, высокодозная химиотерапия с применением аутологичных клеток - предшественников гемопоэза из периферической крови.
Оценку непосредственных результатов лечения у больных проводят на основании следующих клинических критериев.
Объективный лечебный эффект оценивают с помощью физикального обследования, ультрасонографического и рентгенологического исследования после 3-го и 6-го курсов изучаемых вариантов лекарственной терапии согласно критериям, рекомендованным ВОЗ (Женева, 1979):
• полная ремиссия - полное исчезновение всех клинических и лабораторных проявлений опухолевого заболевания на срок не менее 4 нед; для гемобластозов с вовлечением костного мозга необходима полная нормализация миелограммы и гемограммы;
• частичная ремиссия - уменьшение всех измеряемых опухолей не менее чем на 50 % на срок не менее 4 нед;
• стабилизация - уменьшение опухолевых очагов менее чем на 50 % при отсутствии новых поражений или увеличении опухолевых очагов не более чем на 25 %;
• прогрессирование - увеличение размеров опухолей на 25 % и более и/или появление новых очагов поражения.
Динамику В-симптомов опухолевой интоксикации оценивают по их наличию или отсутствию после 3-го и 6-го курсов изучаемых вариантов лекарственной терапии.
Наряду с критериями «безрецидивная выживаемость» и «общая выживаемость» во 2-й половине 1990-х годов для оценки эффективности лечения были введены новые критерии: «выживаемость, свободная от неудач лечения» и «бессобытийная выживаемость».
1. Безрецидивная выживаемость (DFS - disease free survival) рассчитывается от даты констатации полной ремиссии до даты рецидива или после дней явки больного. Безрецидивная выживаемость характеризует только группу больных, достигших полной ремиссии, и показывает, какая часть из этих больных имеет возможность прожить указанный срок без признаков возврата заболевания.
2. Выживаемость, свободная от неудач лечения (FFTF - freedom from treat ment failure), рассчитывается от начала лечения до любой «неудачи» лечения или до даты последней явки больного. Под «неудачей» лечения понимаются: прогрессирование в процессе лечения; отсутствие полной ремиссии после окончания всей программы лече-
ния; рецидив; осложнения лечения, вызвавшие его прекращение; смерть от любой причины. Этот критерий характеризует всю группу больных, начавших лечение, и показывает, какая часть из них имеет возможность прожить указанный срок без признаков заболевания.
3. Выживаемость, зависящая от заболевания (DSS - disease specific survival), рассчитывается от даты начала лечения до даты смерти от данной болезни или до даты последней явки больного. Этот критерий характеризует всю группу больных, начавших лечение, и показывает, какая часть из них могла бы прожить указанный срок, если бы не было смертей от осложнений лечения в период полной ремиссии заболевания.
4. Общая выживаемость (OS - overall survival) рассчитывается от даты начала лечения до смерти от любой причины или до даты последней явки больного. Общая выживаемость характеризует всю группу больных, начавших лечение, и показывает фактическую выживаемость на указанный срок наблюдения.
5. Бессобытийная выживаемость (EFS - event free survival) рассчитывается от даты начала лечения до любого «отрицательного» события или до даты последней явки больного. Под «отрицательным» событием понимают: прогрессирование, отсутствие полной ремиссии после окончания всей программы лечения; осложнения лечения, вызвавшие его прекращение; рецидив; смерть от любой причины; появление 2-й опухоли или любое другое позднее осложнение лечения, угрожающее жизни больного. Бессобытийная выживаемость характеризует всю группу больных, начавших лечение, и отражает длительность и качество жизни всех больных данной группы.
ПРОГНОЗ
5-летняя общая и безрецидивная выживаемость больных с локальными формами лимфомы Ходжкина с наддиафрагмальной локализацией процесса составляет при комплексной терапии около 90 %. При лимфоме Ходжкина IIIA стадии 5-летняя общая и безрецидивная выживаемость составляет более 80 %, при ШБ стадии - около 60 %. 5-летняя общая выживаемость при IV стадии после полихимиолучевого лечения составляет около 45 %. По данным American Cancer Society, общая 5-летняя выживаемость больных лимфомой Ходжкина в 1975-1977 гг. была 73 %, в 1984-1986 гг. -
79 %, в 1996-2002 гг. - 86 %.
Экспертиза нетрудоспособности. Социальная значимость реабилитации больных лимфогранулематозом
При благоприятном клиническом прогнозе критериями возвращения к трудовой деятельности являются:
• общее удовлетворительное состояние;
• психологическая «оправленность»;
• нормализация гематологических и биохимических показателей;
• законченное лечение осложнений.
При эффективном незаконченном лечении продолжительность временной утраты трудоспособности (ВУТ) может быть больше. При проведении химиотерапевтического лечения, хорошей переносимости и отсутствии осложнений, требующих лечения между курсами, больные на этот период временно нетрудоспособны. В остальных случаях и при проведении химиотерапии у больных с сомнительным прогнозом временная нетрудоспособность не должна превышать 4 мес с последующим направлением на медико-социальную экспертизу (МСЭ).
Противопоказанные виды и условия труда:
• тяжелый и средней тяжести труд;
• работа в горячих цехах;
• работа в условиях локальной или общей вибрации. Показания для направления на МСЭ. На МСЭ направляются:
• радикально леченные больные после завершения лечения и реабилитации при необходимости трудоустройства;
• больные, получающие адъювантную химио- и гормонотерапию;
• больные с рецидивом и появлением отдаленных метастазов;
• для повторного или досрочного освидетельствования. Стандарты обследования при направлении на МСЭ:
• клинический анализ крови;
• биохимические показатели крови;
• рентгенограмма грудной клетки, при необходимости - томограммы;
• ЭКГ;
• основные показатели гемодинамики;
• УЗИ печени.
В направлении на МСЭ необходимо дать полную характеристику опухоли и характера проведенного лечения, по показаниям - заключение психолога.
Экспертиза трудоспособности позволяет оценить степень нарушения жизнедеятельности, социальную недостаточность и при необходимости разработать программу реабилитации больных лимфогранулематозом.
НЕХОДЖКИНСКИЕ ЛИМФОМЫ
В последние годы регистрируется устойчивая тенденция к росту заболеваемости неходжкинскими лимфомами (НХЛ). Это неоднородная группа гистологически и биологически злокачественных новообразований лимфоидной системы с неясной этиологией.
ЭПИДЕМИОЛОГИЯ
Во всем мире в настоящее время НХЛ диагностирована примерно у 4,5 млн человек, а ежегодно умирают от этого заболевания 300 тыс. человек. В развитых странах заболеваемость увеличилась более чем на 50 % за последние 20 лет и по темпам прироста составляет 3-7 % ежегодно. Определенный вклад в рост заболеваемости НХЛ внесли увеличение продолжительности жизни, улучшение качества диагностики лимфом, эпидемия ВИЧ. Но этим можно объяснить лишь небольшую часть прироста. Частота НХЛ варьирует в разных регионах мира: они редки в Японии, Индии, Сингапуре, весьма распространены в США, Канаде, Африке. Отмечаются расовые различия в заболеваемости: европеоиды болеют значительно чаще афроамериканцев и особенно чаще японцев. Пик заболеваемости НХЛ в Европе отмечен в Нидерландах и Скандинавских странах. В течение последних 4 десятилетий рост заболеваемости носит эпидемический характер. Увеличение идет в основном за счет агрессивных форм. Увеличение частоты первичных лимфом центральной нервной системы (ЦНС) частично связывают с возникновением их у пациентов с синдромом приобретенного иммунодефицита (СПИД), хотя рост заболеваемости начался до эпидемии СПИДа и касается популяции ВИЧ-неинфицированных. Отмечено также географическое разнообразие гистологических подтипов НХЛ. Например, форма лимфомы Беркитта встречается у детей в экваториальной Африке; высокий уровень заболеваемости лимфомой желудка отмечается в Северной Италии. Назальная форма Т-клеточных лимфом широко распространена в Китае, мелкоклеточная лимфома кишечника - на Ближнем
Востоке, Т-клеточный лейкоз (лимфома) взрослых - в Южной Японии и Карибском бассейне. Сообщается о низкой частоте фолликулярной лимфомы в Азии и в развивающихся странах. У эмигрантов из Азии, проживающих в США, случаи фолликулярной лимфомы встречаются реже, чем в общей выборке популяции. Описаны географические различия в распределении лимфом зоны мантии, определенных Т-клеточных лимфом и первичных экстранодальных лимфом.
Тем не менее, несмотря на изложенные выше факторы, способствующие росту заболеваемости лимфом, большинство случаев возникновения НХЛ объяснить воздействием тех или иных этиологических факторов не удалось. В последние годы все больше исследователей уделяют внимание экологической обстановке в мире.
По данным РОНЦ им. Н.Н. Блохина РАМН, в России НХЛ составляют 2,6 % всех злокачественных опухолей; ежегодно выявляется 10-12 тыс. новых случаев. Максимальный уровень заболеваемости НХЛ приходится на 70-79 лет. Наблюдается линейная зависимость между возрастом и заболеваемостью всеми формами лимфом. У мужчин частота, приближенная к среднестатистической (8,3 на 100 тыс. населения), пришлась в 2004 г. на возрастную группу 45-49 лет; у женщин показатель наблюдался в возрастной группе 50-54 года. К возрасту 75 лет и старше стандартизованный показатель заболеваемости лимфомами для мужчин составил 27,0, для женщин - 15,5. Лимфомы относят к разряду онконозологических форм, за счет которых увеличилась частота выявления опухолевых заболеваний на поздних стадиях (Давыдов М.И., 2006). Существенный разброс статистических показателей в отдельных регионах связан с отсутствием единообразия в регистрации различных форм лимфопролиферативных заболеваний, зачастую НХЛ включают в статистическую категорию «гемобластозы».
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Причина большинства случаев возникновения НХЛ неизвестна, однако некоторые генетические и инфекционные заболевания, а также экологические факторы могут оказывать определенное влияние на развитие НХЛ. Наиболее часто среди злокачественных новообразований у лиц молодого возраста, страдающих атаксией-телеангиэктазией или синдромом Вискотта-Олдрича, а также у детей с Х-ассоциированным лимфопролиферативным синдромом наблюдается НХЛ.
В мировых научных литературных источниках отмечают определенный риск развития НХЛ у людей, чьи родственники I степени родства страдали гемобластозами. У лиц с отягощенным наследственным анамнезом риск развития НХЛ повышался в 2-3 раза. Возможно, это объясняется наследованием особенностей иммунной системы и (или) зависит от повышенной генетической восприимчивости к действию канцерогенных факторов окружающей среды.
Заболеваемость НХЛ связана с различными этиологическими факторами, при этом особую роль отводят ВИЧ-инфекции. Иммунодефицит, включающий врожденные и приобретенные состояния, может выступать безусловным фактором риска при НХЛ. У ВИЧинфицированных заболеваемость НХЛ в 100 раз выше, чем в общей популяции. Наиболее часто у этих пациентов встречаются НХЛ B-клеточной природы, преимущественно крупноклеточные лимфомы и лимфомы Беркитта с экстранодальным поражением, например, головного мозга.
Инфекционные агенты, такие, как лимфоцитарный вирус I типа (HTLV-I), EBV, H. pylori, и, возможно, вирус гепатита С (HCV), могут повышать риск развития НХЛ. В случае лимфомы Беркитта вирус Эпштейна-Барр (EBV) представляет собой один из основных факторов риска. HTLV-I относится к группе ретровирусов и имеет эпидемическое распространение в Южной Японии и странах Карибского бассейна. Инфицирование в детстве тесно коррелирует с развитием Т-клеточного лейкоза и лимфомы в более старшем возрасте. Хроническое инфицирование желудка H. pilory связано с 6-кратным увеличением риска возникновения MALT, лимфомы желудка (mucosa-associated lymphoid tissue). Также имеются данные об ассоциации гепатита С с некоторыми В-клеточными лимфомами. Результаты эпидемиологических исследований неоднозначны: работы, с выявленной положительной корреляцией между гепатитом С и типом НХЛ, чередуются с публикациями, в которых такой связи не обнаружено.
Пациенты, получающие иммуносупрессивную терапию по поводу солидных опухолей (химиотерапия и лучевое лечение) или трансплантации костного мозга, подвержены риску возникновения НХЛ в 30-50 раз больше. Это связано с разбалансировкой пролиферации лимфоцитов, а также с активацией латентной EBV-инфекции.
Важную роль в развитии лимфом играет образ жизни. Повышенный риск НХЛ связан с потреблением белков животного происхождения,
мяса, жира. Напротив, употребление в большом количестве фруктов и овощей с высоким содержанием каротина приводит к его понижению. Неоднозначно влияние алкоголя и курения на развитие НХЛ. По данным некоторых исследователей, солнечное излучение ассоциировано с развитием лимфом.
ЛИМФОМОГЕНЕЗ И МОЛЕКУЛЯРНАЯ ГЕНЕТИКА
Понимание нормальной дифференцировки лимфоцитов позволит лучше разобраться в морфологии, иммунофенотипе и клиническом течении лимфом. Известно, что лимфоциты дифференцируются из незрелых стволовых клеток в костном мозге. На стадии реарранжировки генов иммуноглобулинов и Т-клеточных рецепторов лимфобласты (В-клетки большого размера) активно пролиферируют до превращения их в В-лимфоциты (зрелые эффекторные клетки костного мозга). В дальнейшем созревание происходит в лимфатических узлах и экстралимфатических фолликулах. В герминальном центре лимфатических узлов под влиянием антигенов лимфоциты преобразуются в иммунобласты или центробласты (крупные пролиферирующие клетки). В это время в вариабельных регионах иммуноглобулиновых генов появляются множественные точечные мутации, что обеспечивает их антигенную специфичность. Формирование герминального центра и образование плазматических клеток, продуцирующих IgG, происходят за счет центроцитов (малых непролиферирующих лимфоцитов). Некоторые из них мигрируют и образуют маргинальные зоны, окружающие активированные фолликулы; там они остаются в качестве В-клеток памяти.
Клетки, дифференцирующиеся в Т-лимфоциты, подразделяются на 3 типа антигенспецифических эффекторных Т-клеток: СD4 (хелперы и цитотоксические Т-клетки), СD8 (супрессоры и цитотоксические Т-клетки) и Т-клетки памяти. От генетических изменений, происходящих в клетке, зависят дифференцировка и созревание. СD (Clusterof-differentiation antigens) представляют собой антигены поверхностных рецепторов, вовлеченных в дифференцировку; обнаруживаются они с помощью специфических антител. Для Т- и В-лимфоцитов антигены различны и изменяются в процессе дифференцировки. СD выполняют несколько функций в созревании лимфоцитов, в том числе узнавание и адгезию с другими генами и молекулами. Т-клеточные СD-антигены включают: CD3, взаимодействующие с Т-рецепторами и участвующие
в передаче сигналов, CD4, связывающиеся с молекулами МНС класса II, CD5, CD8, узнающие молекулы МНС класса I, и CD45. В-клеточные СD: включают CD19 и CD20, вовлеченные в сигнальную трансдукцию. Для лимфобластов характерна экспрессия концевой дезоксинуклеотидилтрансферазы и поверхностного антигена CD34, но они не обладают антигенами В- и Т-клеток. Зрелые плазматические клетки теряют В-клеточные антигены и приобретают антиген CD38.
Таким образом, в процессе созревания лимфоциты проходят сложный путь дифференцировки, который обеспечивает выполнение присущих им функций в иммунной системе организма. При нарушении такого хода событий возникают злокачественные новообразования лимфоидной природы.
В основе злокачественной трансформации клеток лежат такие явления, как нарушение механизмов регуляции функционирования генов и стабильности генома. Определенную роль в развитии НХЛ играют дефекты реакций иммунитета, такие, как дисбаланс выработки цитокинов, а также генетические нарушения реарранжировки иммуноглобулинов Т-клеточных рецепторов.
Генетические повреждения при лимфомах можно подразделить на 2 крупные категории: активация протоонкогенов и инактивация генов-супрессоров опухолевого роста. На прогрессию заболевания влияют чувствительность к аутокринным факторам роста наряду с резистентностью к антипролиферативным сигналам, иммортализация, избегание апоптоза, инвазия, метастазирование, ангиогенез, особое место занимают факторы микроокружения опухоли.
Основным из механизмов активации протоонкогенов при лимфатических опухолях являются хромосомные транслокации. Зачастую на одной из партнерских хромосом, близко к участку рекомбинации, располагается протоонкоген, который в типичном случае не изменен структурно, но нарушена регуляция его экспрессии. Приведенный вариант транслокации можно противопоставить транслокациям при острых лейкозах вследствие слияния двух генов и образованию химерного продукта с новыми онкогенными свойствами. Оба участвующих гена структурно изменены. При НХЛ протоонкоген чаще всего перемещается в область локусов генов иммуноглобулинов и попадает под влияние гетерологичных элементов, регулирующих экспрессию генов на партнерской хромосоме. Это приводит к постоянной экспрессии протоонкогена, не зависящей от обычных стимулов (тогда как в норме его экспрессия происходит
только в ответ на эти стимулы), или к неспецифическому усилению экспрессии протоонкогена (тогда как в норме его экспрессия очень слабая). Значительно реже активация протоонкогенов при лимфомах происходит по другим механизмам, не связанным с образованием транслокаций. Транслокации возникают случайно и в большинстве случаев ни к чему не приводят: клетки-носительницы транслокаций просто погибают. Опухоль возникает, если транслокация «уместна», т.е. оказывается случайным образом в определенной субпопуляции лимфоцитов на определенной стадии развития.
В настоящее время накоплено немало данных о молекулярно-генетической структуре определенных опухолей, установлены постоянно выявляемые и характерные для каждой нозологической формы молекулярные маркеры. Исходя из современных знаний о природе мультифакториальных заболеваний, к которым относятся и лимфомы, предполагается, что совокупность генов, отвечающих за предрасположенность к ним, образует сеть связанных между собой элементов, результат взаимодействия которых на уровне белковых продуктов определяет биохимическую индивидуальность человека. В зависимости от этого у индивидуума формируется присущая ему высокая или низкая степень предрасположенности к тому или иному заболеванию, которая в случае действия соответствующих факторов внешней и внутренней среды приводит к развитию патологии. Одной из причин вариабельности механизмов опухолевой прогрессии является наличие генетического полиморфизма. Разные варианты полиморфного локуса могут влиять на ослабление или усиление функции гена; что, в свою очередь, может способствовать развитию какого-либо заболевания в конкретных условиях или влиять на восприимчивость организма к определенным формам лекарственных препаратов.
Анализ работ, проводимых в связи с поиском генетических маркеров предрасположенности к лимфомам, позволил выделить несколько функциональных групп генов, исходя из их потенциальной биологической роли (рис. 26.2). Одна группа включает гены, которые вовлечены в процессы сохранения целостности генома и метилирования. Полиморфные варианты этих генов могут менять частоту хромосомных аберраций, эффективность репарации ДНК и статус метилирования ДНК. Другая большая группа представлена генами, которые влияют на жизнедеятельность и рост B-клеток, включая гены провоспалительных и регуляторных цитокинов и гены, во-
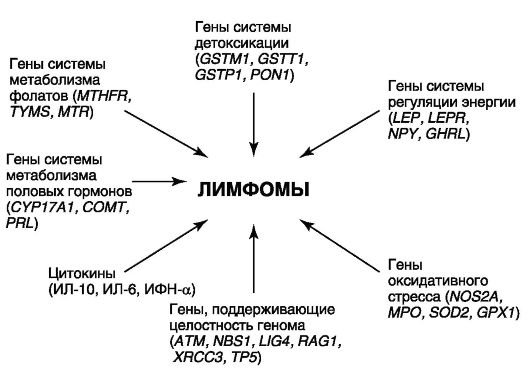 Рис. 26.2. Гены, вовлеченные в патогенез НХЛ
Рис. 26.2. Гены, вовлеченные в патогенез НХЛ
влеченные в естественный иммунитет, оксидативный стресс, поддержание энергетического гомеостаза и производство гормонов. В 3-ю группу можно отнести гены, продукты которых участвуют в метаболизме ксенобиотиков. И это лишь немногие гены, которые изучаются в мире.
КЛАССИФИКАЦИЯ ЛИМФОМ.
МОРФОЛОГИЯ И ИММУНОФЕНОТИП
В 2001 г. ВОЗ опубликована классификация лимфом, в основу которой легла европейско-американская классификация лимфоидных опухолей (REAL classification), опубликованная в 1994 г. международной группой по изучению лимфом. Предпосылкой для ее создания послужило разнообразие морфологических, иммунофенотипических и молекулярно-генетических признаков. Однако она не отражает генетическую связь или иерархическую зависимость, а является лишь перечнем клинико-морфологических рубрик.
Классификация ВОЗ (2001)
• В-клеточные опухоли
I. Опухоли из предшественников В-лимфоцитов.
В-лимфобластный лейкоз/лимфома из предшественников В-клеток (острый лимфобластный лейкоз из предшественников В-клеток).
II. Зрелые В-клеточные опухоли (В-клеточные опухоли с фенотипом зрелых лимфоцитов).
1. Хронический лимфоцитарный лейкоз/лимфома из малых лимфоцитов.
2. В-клеточный пролимфоцитарный лейкоз.
3. Лимфоплазмоцитарная лимфома.
4. Селезеночная лимфома маргинальной зоны.
5. Волосатоклеточный лейкоз.
6. Плазмоцитарная миелома.
7. Моноклональная гаммапатия с неопределенным потенциалом.
8. Солитарная плазмоцитома костей.
9. Внекостная плазмоцитома.
10. Первичный амилоидоз.
11. Болезнь тяжелых цепей.
12. Экстранодальная В-клеточная лимфома маргинальной зоны (лимфома лимфоидной ткани, ассоциированной со слизистыми оболочками; MALT-лимфома).
13.Нодальная В-клеточная лимфома маргинальной зоны.
14. Фолликулярная лимфома.
15. Лимфома из клеток зоны мантии.
16. Диффузная крупноклеточная В-клеточная лимфома.
17. Медиастинальная крупноклеточная В-клеточная лимфома.
18. Внутрисосудистая крупноклеточная В-клеточная лимфома.
19. Первичная лимфома серозных полостей.
20. Лимфома/лейкоз Беркитта.
III. В-клеточные лимфопролиферативные процессы с неопределенным опухолевым потенциалом.
1. Лимфоматоидный гранулематоз.
2. Посттрансплантационное лимфопролиферативное заболевание, полиморфно-клеточное.
• Т-клеточные опухоли
I. Опухоли из предшественников Т-лимфоцитов.
Т-лимфобластный лейкоз/лимфома из предшественников Т-клеток (острый лимфобластный лейкоз из предшественников Т-клеток).
II. Т- и NK-клеточные опухоли с фенотипом зрелых лимфоцитов.
Лейкозы и первично-диссеминированные лимфомы:
1. Т-клеточный пролимфоцитарный лейкоз.
2. Т-клеточный лейкоз из крупных гранулярных лимфоцитов.
3. Агрессивный NK-клеточный лейкоз.
4. Т-клеточный лейкоз/лимфома взрослых. Кожные лимфомы
1. Грибовидный микоз.
2. Синдром Сезари.
3. Первичная кожная крупноклеточная анапластическая лимфома.
4. Лимфоматоидный папуллез.
III. Другие экстранодальные лимфомы.
1. Экстранодальная NK/Т-клеточная лимфома, назальный тип.
2. Т-клеточная лимфома типа энтеропатии.
3. Гепатолиенальная Т-клеточная лимфома.
4. Панникулитоподобная Т-клеточная лимфома подкожной клетчатки.
IV. Лимфомы лимфатических узлов.
1. Ангиоиммунобластная Т-клеточная лимфома.
2. Лимфома из клеток с иммунофенотипом периферических Т-лимфоцитов, неуточненная.
3. Анапластическая крупноклеточная лимфома.
V. Опухоль неопределенной дифференцировки. Бластная NK-клеточная лимфома.
Морфологические признаки, объединяющие лимфомы в группы сходного гистологического строения:
1) пролиферация бластных клеток;
2) диффузная пролиферация мелких клеток;
3) диффузная пролиферация крупных клеток;
4) фолликулярный рост лимфоидной ткани;
5) нодулярный характер роста опухолевой ткани;
6) анапластическая морфология лимфоидных клеток;
7) диффузная полиморфно-клеточная лимфоидная пролиферация;
8) лимфогранулематозоподобное строение опухоли. Лимфобластные лимфомы из клеток-предшественников В-лимфоцитов,
лимфобластные лимфомы из клеток-предшественников Т-лимфоцитов и бластоидный вариант лимфомы из клеток зоны мантии. Диффузная пролиферация лимфоидных клеток с бластной морфологией характеризуется замещением ткани лимфатического узла довольно однообразным пролифератом из клеток средних размеров (в 1,5-2 раза больше ядра малого лимфоцита). Ядра этих клеток округлые, правильной формы или с неровными, иногда зазубренными контурами. Цитоплазма может быть различима в виде узкого сероватого ободка. Много фигур митозов. Ключевым признаком, определяющим бластную морфологию опухолевых клеток, является строение ядра. Гетерохроматин в ядрах имеет однородное пылевидное, зернистое или мелкоглыбчатое строение. В некоторых случаях отчетливо видно сетчатое и нежнопетлистое строение хроматина, имеющего вид тонких нитей. Гетерохроматин равномерно распределен по всему объему ядра. Ядра содержат 1-3 небольших полиморфных ядрышка. В отдельных случаях бласты могут содержать в ядрах довольно грубый хроматин в виде мелких глыбок, несколько различающихся размерами; хроматин может быть распределен с увеличением его количества возле ядерной мембраны. Гистологическое исследование не позволяет дифференцировать лимфобластные лимфомы, отличающиеся своей принадлежностью к В- или Т-клеточной линии.
Лимфоплазмоцитарная, лимфоцитарная, фолликулярные лимфомы и В-клеточные лимфомы маргинальной зоны. При диффузной пролиферации мелких лимфоидных клеток обычно обнаруживаются объемные опухолевые массы монотонного строения, замещающие организованную лимфоидную ткань. Характерен инфильтративный рост за пределы капсулы лимфатического узла в перинодальную жировую ткань, мономорфный клеточный состав и более или менее выраженные признаки клеточной атипии. Диагностические проблемы возникают при исследовании небольших или сильно деформированных биоптатов, когда трудно оценить структуру ткани и строение клеток.
Фолликулярные лимфомы. Фолликулярный рост лимфоидной ткани означает В-клеточную природу опухолевого или гиперпластического процесса, поэтому в иммуногистохимическом исследовании с антителами к В-линейным антигенам необходимости нет.
Опухолевые фолликулы при фолликулярных лимфомах обнаруживаются во всех анатомических зонах лимфатического узла. Фолликулы чаще однообразной формы и примерно одинаковых размеров, чем отличаются от реактивных фолликулов при гиперпластических процессах в лимфатических узлах. Опухолевые фолликулы могут располагаться так тесно, что деформируют друг друга и приобретают отчасти полигональную форму. Тем не менее между фолликулами в фолликулярной лимфоме практически всегда удается различить более или менее выраженную Т-зону, которая содержит малые лимфоциты, посткапиллярные венулы.
Тщательное исследование под большим увеличением межфолликулярных пространств в фолликулярных лимфомах позволяет всегда обнаружить центроциты - мелкие угловатые клетки, которые в норме не обнаруживаются вне лимфоидных фолликулов, и крупные лимфоидные клетки с признаками атипии в виде ядер с глубокими вдавлениями и неправильными контурами ядра.
Опухолевые фолликулы не окружает слой малых лимфоцитов, называемый зоной мантии. Четкие концентрические слои малых лимфоидных клеток - признак, характерный для гиперпластического процесса.
Центроциты и центробласты образуют довольно однородную смесь; для опухолевых фолликулов поляризация строения нехарактерна. Митотическая и пролиферативная (Ki-67) активность клеток фолликулярной лимфомы обычно невелика, почти всегда она меньше, чем в реактивных фолликулах. Макрофаги в ткани фолликулярной лимфомы почти не фагоцитируют, тогда как в реактивных светлых центрах размножения фолликулов легко обнаружить фагоцитоз обломков ядерного вещества. Внеклеточные белковые эозинофильные депозиты тоже редко обнаруживаются в опухолевых фолликулах, что отличает лимфому от реактивных изменений.
Ангиоиммунобластная Т-клеточная лимфома и лимфома из клеток с иммунофенотипом периферических Т-лимфоцитов, неуточненная, экстранодальная ЫК-/Т-клеточная лимфома назального типа, подкожная панникулитоподобная Т-клеточная лимфома и Т-клеточная лимфома типа энтеропатии. Для предварительного гистологического диагноза следует считать перечисленные ниже морфологические признаки подтверждением принадлежности НХЛ полиморфно-клеточного строения к Т-клеточному типу: 1) диффузный характер роста лимфомы с поражением в начальных стадиях развития опухоли паракортикальной зоны; 2) появление
большого количества посткапиллярных венул с набухшим эндотелием; 3) гнездный вид расположения (компартментализация) опухолевых клеток с образованием групп, разделенных тонкими пучками коллагеновых волокон; 4) широкие вариации размеров и формы ядер, отсутствие клеток с расщепленными ядрами; 5) со светлой цитоплазмой и четкой мембраной, иногда они образуют рисунок «булыжной мостовой»; 6) наличие полиморфных клеток, в том числе подобных клеткам Березовского-Рид-Штернберга; 7) примесь гистиоцитов, эпителиоидных клеток, эозинофильных лейкоцитов, плазматических клеток.
Строение ангиоиммунобластной Т-клеточной лимфомы отличается наличием резидуальных фолликулов в пораженном лимфатическом узле, довольно часто эти фолликулы имеют вид «выгоревших», т.е. таких, которые имеют малые размеры с малочисленными активированными клетками в своем составе на фоне фиброза и гиалиноза. Другой особенностью является очаговая пролиферация фолликулярных дендритических клеток, особенно интенсивно выраженная возле посткапиллярных венул с набухшим эндотелием. Т-клеточную природу опухоли подтверждает экспрессия Т-линейных антигенов лимфоидными клетками малого, среднего и крупного размера. Нередко встречаются крупные активированные В-клетки, относящиеся вместе с малыми В-лимфоцитами, плазматическими клетками, гистиоцитами и эозинофильными гранулоцитами к реактивному компоненту.
Лимфомы из клеток с иммунофенотипом периферических Т-лимфоцитов, неуточненные, могут существенно различаться у больных тканевой организацией и клеточным составом. Это позволяет выделить в опухоли с иммунофенотипом периферических Т-клеток гистологические (цитологические) варианты: плеоморфно-клеточные, лимфоэпителиоидно-клеточные, Т-зоны. Но дифференциальные признаки малоспецифичны и не имеют явной связи с клиническим течением опухоли, поэтому в практической работе выделение гистологических вариантов необязательно.
Гистологическое строение и цитологический состав экстранодальных T- и NK-клеточных лимфом без каких-либо существенных особенностей, которые могли бы иметь дифференциально-диагностическое значение. Для экстранодальной NK-/T-клеточной лимфомы назального типа характерен ангиоцентрический и ангиодеструктивный рост опухоли, который становится причиной обширных циркуляторных некрозов, но эти признаки могут обнаруживаться и в других опухолях. Цитотоксические свойства опухолевых клеток становятся еще одной
причиной некрозов в опухоли, а также программированной клеточной гибели клеток - апоптоза.
Иммунологическая диагностика лимфом заключается в подробном изучении антигенов мембраны и цитоплазмы опухолевых клеток с целью определения происхождения лимфомы (В- или Т-клеточное) и стадии, на которой остановлено их нормальное развитие. Проводится сопоставление иммунофенотипа (т.е. набора маркеров) клеток опухоли с иммунофенотипом нормального клеточного аналога. В процессе формирования лимфомы опухолевые лимфоидные клетки приобретают необычные (в норме практически отсутствующие) иммунологические признаки и частично утрачивают типичные антигены.
В- и Т-клеточные лимфомы подразделяются на 2 большие группы: лимфомы из клеток-предшественников и периферические лимфомы. При этом учитываются моноклональность или монотипность лимфоидного опухолевого пролиферата и его отличия от нормальных клеток лимфатического узла. Наиболее распространенным признаком В-клеточных лимфом является моноклональность злокачественных В-клеток по типу легких полипептидных цепей иммуноглобулинов (κ или λ).
Зачастую НХЛ имеют В-клеточное происхождение, экспрессируя пан-В-клеточные антигены (>90 %): CD19, CD20, CD22, обычно в сочетании с HLA/DR и молекулами поверхностных иммуноглобулинов. Наличие других В-клеточных антигенов (CD5, CD10, CD38, CD23 и др.) позволяет с наибольшей достоверностью установить В-клеточный подвариант НХЛ, что лежит в основе выбора адекватной лечебной тактики (>90 %).
Для Т-клеточных опухолей характерно наличие CD4, CD7, CD8. Дополнительные иммунофенотипические характеристики способствуют дифференциальной диагностике различных вариантов НХЛ.
ДИАГНОСТИКА И КЛИНИЧЕСКАЯ КАРТИНА
Диагноз опухоли лимфоидной ткани должен основываться на гистологическом и иммуногистохимическом исследовании биоптата, анамнезе, объективном статусе, лабораторных данных с целью определения стадии и дальнейшего планирования лечения.
Анамнез заболевания и объективный статус пациента являются основополагающими факторами для оценки его состояния и назначения необходимых исследований. При опросе следует акцентировать внимание на продолжительности и темпах заболевания
(внезапное уменьшение до этого увеличенных лимфатических узлов, что нередко наблюдается при фолликулярной лимфоме). Наличие тех или иных признаков будет характеризовать прогноз течения заболевания и ответ на лечение. Они включают лихорадку, вечерний пот и необъяснимую потерю массы тела. Первичный опухолевый очаг может локализоваться в лимфатических узлах (нодальное поражение) или в других органах и тканях (экстранодальное поражение).
Распространение происходит путем лимфогенного и гематогенного метастазирования. Клинические проявления определяются расположением опухолевых очагов. Наиболее часто первым проявлением болезни бывает поражение лимфатических узлов (45-50 % случаев); при этом периферические лимфатические узлы вовлекаются в процесс значительно чаще (35-38 %), чем медиастинальные, забрюшинные и внутрибрюшные. Лимфатические узлы могут достигать больших размеров (рис. 26.3), сливаться в конгломераты - так называемые «target lesion» или «bulky», когда размер одного из лимфатических узлов/конгломератов превышает 7 см и (или) опухоль в средостении видна на рентгеновском снимке в прямой проекции. Поражение лимфатических узлов средостения может проявляться одышкой, кашлем, одутловатостью лица, синдромом ВПВ. При локализации процессов в забрюшинных и мезентериальных лимфатических узлах могут отмечаться боли в животе, отеки нижних конечностей. Экстранодальные очаги часто возникают в ЖКТ, лимфоидном кольце Пирогова-Вальдейера, коже, ЦНС, реже - в плевре, легких, костях, мягких тканях и т.д. По жалобам, предъявляемым пациен-
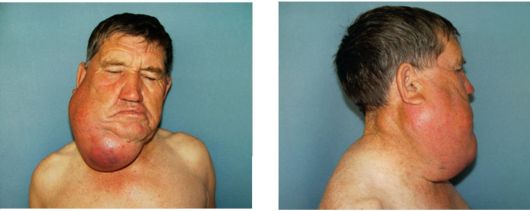 а б
а б
Рис. 26.3. НХЛ. Конгломерат лимфатических узлов на шее справа: а - вид спереди; б - вид сбоку
том, можно приблизительно определить уровень поражения (боли в груди, животе или костях). Например, признаки лимфомы ЦНС включают головную боль, летаргию, центральные неврологические признаки, парастезии или паралич.
Физикальные методы исследования (осмотр, пальпация, аускультация) с исследованием всех групп периферических лимфатических узлов позволяют оценить вовлеченность в процесс глоточного кольца, щитовидной железы, плевральной полости (плеврит), брюшной полости (гепатомегалия, спленомегалия, асцит), кожного покрова (рис. 26.4, 26.5).
Лабораторные методы исследования должны включать общий анализ крови и биохимический ее анализ, а чтобы оценить функцию почек и печени - определение глюкозы сыворотки крови, содержания кальция, альбумина, уровни ЛДГ и Р2-микроглобулина. Цель этих исследований состоит в том, чтобы помочь в определении прогноза (например, ЛДГ, Р2-микроглобулин, альбумин) и идентифицировать отклонения в функционировании других органов, которые могли бы усложнить терапию (например, почечная или печеночная недостаточность).
Диагноз следует выставлять на основании гистологического и иммуногистохимического исследования биоптата (рис. 26.6, 26.7). Материал для морфологического исследования лимфатического узла может быть получен с помощью биопсии - аспирационной (взвесь клеток), пункционной (столбик ткани), открытой инцизионной (фрагмент лимфатического узла) и открытой эксцизионной
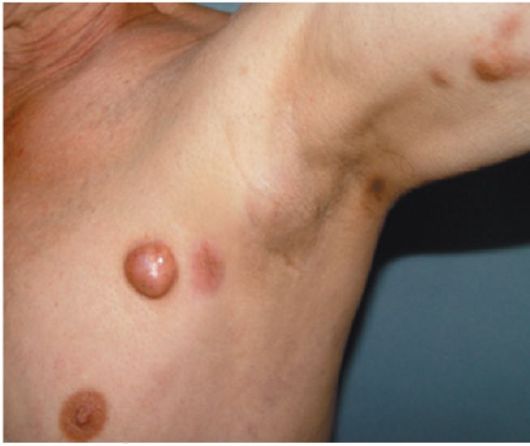 Рис. 26.4. НХЛ. Поражение подмышечных лимфатических узлов слева, специфическое поражение кожи
Рис. 26.4. НХЛ. Поражение подмышечных лимфатических узлов слева, специфическое поражение кожи
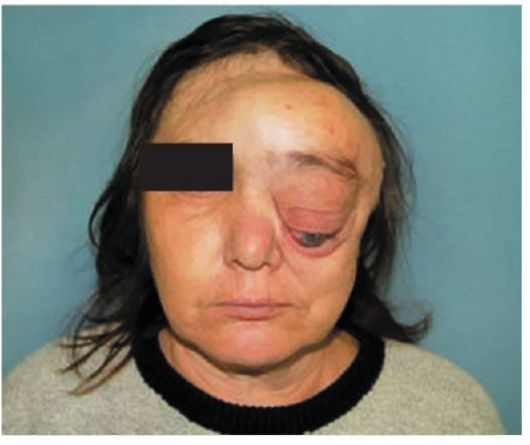 Рис. 26.5. НХЛ. Поражение орбиты, прорастание и деформация левого глазного яблока
Рис. 26.5. НХЛ. Поражение орбиты, прорастание и деформация левого глазного яблока
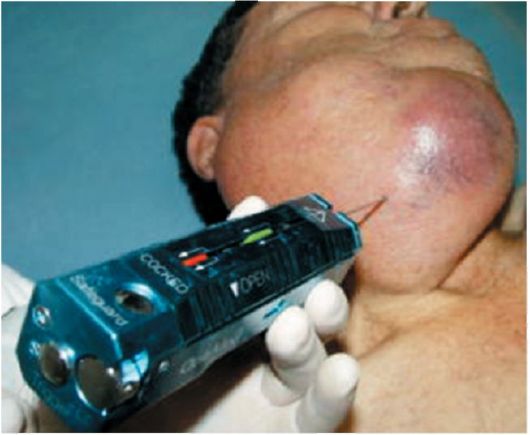 Рис. 26.6. Биопсия у больного НХЛ
Рис. 26.6. Биопсия у больного НХЛ
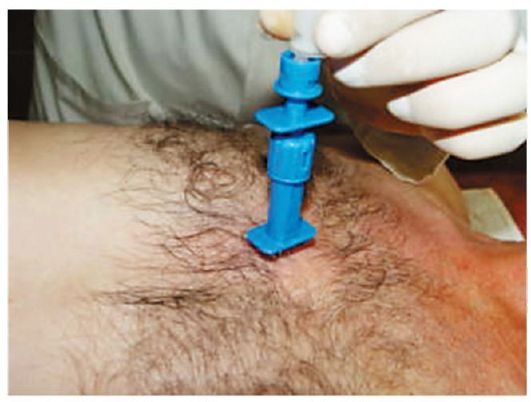 Рис. 26.7. Стернальная пункция у больного НХЛ
Рис. 26.7. Стернальная пункция у больного НХЛ
(весь лимфатический узел или конгломерат лимфатических узлов). В основе гистологического исследования биопсий лимфатических узлов, как и всех других органов и тканей, лежит детальное исследование тканевой структуры (архитектоники) и клеточного состава биоптата. Цитологическое исследование высокоинформативно и должно широко выполняться в амбулаторных условиях. Значение этого метода в последнее время возрастает, так как разработаны эффективные методы иммунофенотипирования на цитологических препаратах. Однако окончательным следует считать гистологическое исследование биоптата опухолевой ткани с иммунофенотипированием. Цитологическая верификация допускается только в тех случаях, когда взятие материала для гистологического исследования сопряжено с высоким риском для жизни.
Иммуногистохимическое исследование опухолей лимфоидной ткани является методом выбора, если необходима дифференциальная диагностика опухолей при выраженном сходстве гистологического строения. В дополнение к диагностической биопсии всем пациентам должна проводиться трепанобиопсия костного мозга. Вовлечение костного мозга в злокачественный процесс зависит от подтипа лимфомы. Так, у70 % пациентов с лимфоплазмоцитарной лимфомой и лимфомой мантийной зоны имеется поражение костного мозга, у 50 % - с фолликулярной лимфомой, приблизительно у 15 % пациентов с диффузной В-крупноклеточной лимфомой.
При определенных ситуациях показано цитологическое исследование спинномозговой жидкости. К ним относятся поражение придаточных пазух носа, яичка, перидуральная лимфома и, возможно,
вовлечение костного мозга при крупноклеточной лимфоме. При таких вариантах поражения вероятность распространения процесса на мозговые оболочки достаточно велика, в связи с чем оправдано выполнение диагностической люмбальной пункции. Кроме того, последняя часто рекомендуется для пациентов с высокоагрессивной гистологией и ВИЧ-инфицированных. При подозрении на поражение ЦНС или периферической нервной системы необходима консультация невропатолога.
Достоверным подтверждением опухолевого поражения лимфатического аппарата кольца Вальдейера являются данные фиброларингоскопии с биопсией пораженных участков. Рентгенологическое исследование (предпочтительнее КТ) органов грудной клетки позволяет уточнить состояние медиастинальных лимфатических узлов (медиастинальная лимфаденопатия наблюдается в среднем у 15-25 % больных, за исключением первичной НХЛ средостения или лимфобластной лимфомы из клеток-предшественников, при которых это бывает первым или основным проявлением болезни) и выявить паренхиматозное поражение легких, наблюдающееся в 3-6 % случаев. Развитие специфического плеврита отмечается нечасто (8-10 %), преимущественно при агрессивных и высокоагрессивных НХЛ, или является единственным клиническим симптомом при первичной В-клеточной НХЛ серозных оболочек (primary effusion lymphoma). Доказательством опухолевой природы плеврита служит цитологическое исследование экссудата.
Данные о высокой частоте вовлечения ЖКТ (15-25 %) делают настоятельной необходимостью выполнение рентгенологического исследования желудка или (предпочтительнее) гастроскопии с множественной биопсией суспициозных участков слизистой оболочки. При выявлении специфического поражения желудка обязательно рентгенологическое исследование всех отделов кишечника, так как у4% больных в этом случае возможно сочетанное вовлечение нескольких отделов ДКТ. Всем пациентам, независимо от определяемых в момент диагностики клинических проявлений заболевания, выполняют УЗИ брюшной полости и малого таза.
Необходимым этапом в обследовании является проведение КТ с контрастным усилением и (или) МРТ органов шеи, средостения, брюшной полости и малого таза. Эти методы позволяют не только более полно определить объем поражения, но и дать объективную оценку эффективности проведенной терапии. Также МРТ является
методом выбора в случае поражения ЦНС и (в меньшей степени) костного мозга, при этом проведение трепанобиопсии не исключается.
Сцинтиграфию назначают при подозрении на поражение костей, селезенки, а также для дифференцирования фиброза и остаточной активной (резидуальной) опухоли после лечения. Для диагностики лимфом используется 67Ga, который связывается с рецепторами трансферрина в опухолевых клетках. ПЭТ - это метод визуализации, основанный на гликолитической активности, которая увеличивается в опухолевых тканях, включая лимфомы. ПЭТ позволяет провести исследование всего организма с меньшей дозовой нагрузкой, чем КТ. Метод обладает высокой специфичностью, позволяет с большей степенью вероятности отдифференцировать неопухолевые процессы от специфического поражения.
Дифференциальную диагностику НХЛ проводят с лимфаденопатиями различной этиологии, лимфогранулематозом, метастазами рака, острым лейкозом, хроническим лимфолейкозом. Бактериальный лимфаденит может наблюдаться при различных заболеваниях - таких, как СПИД, туберкулез и др. Протозойный (при токсоплазмозе) и грибковый (при актиномикозе) лимфаденит встречается относительно редко. Возможна вирусная природа лимфаденитов при инфекционном мононуклеозе, гриппе, краснухе. Лимфаденит может быть локальным, в области ворот инфекции (грипп, ангина), или генерализованным (сепсис). В основе дифференциального диагноза лежит иммуноморфологическое исследование лимфатического узла.
Определение распространенности (стадирование). Международный прогностический индекс
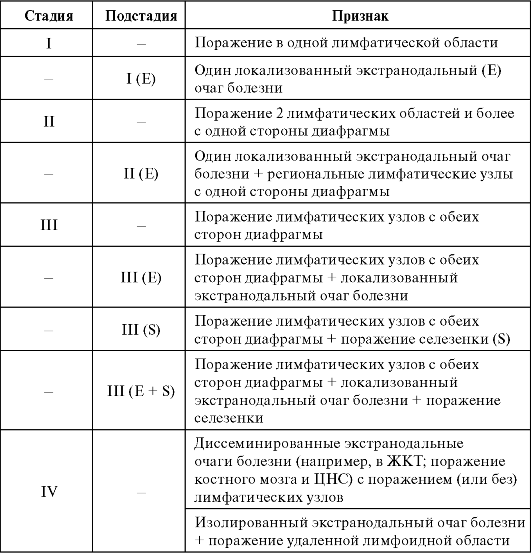
Для стадирования НХЛ применяется клиническая классификация Анн Арбор, изначально разработанная для лимфомы Ходжкина. Классификация TNM при лимфомах не используется, так как лимфома представляет собой системное заболевание, чаще имеющее исходно генерализованную манифестацию (стадия III и IV), чем локальную (стадия I и II) [Carbone P., 1971]. Определение распространенности процесса базируется на данных анамнеза, клинического обследования, методов визуализации и биопсии (табл. 26.1).
При изолированном поражении селезенка считается лимфоидной областью.
Таблица 26.1. Распределение НХЛ по стадиям (по Ann Arbor, 1971)
 Наличие
или отсутствие симптомов интоксикации, обусловленных лимфатической
опухолью, имеет прогностическое значение и указывается в стадии:
Наличие
или отсутствие симптомов интоксикации, обусловленных лимфатической
опухолью, имеет прогностическое значение и указывается в стадии:
• категория A - отсутствие В-симптомов;
• категория В - необъяснимая потеря более 10 % массы тела за 6 мес. Необъяснимая лихорадка с повышением температуры до 38 °С и выше. Ночной пот («с мокрой подушкой»). Зуд (обычно генерализованный), выраженность которого меняется в зависимости от активности болезни.
Кроме указанного клинического стадирования (cS) выделяют патолого-анатомическое стадирование (pS). Классификация применяется в случаях, когда для нее имеются данные гистологического исследования, т.е. морфологическое подтверждение каждой локализации поражения, установленной в результате применения хирургических процедур.
С учетом вариабельности клинического течения в пределах гистологического типа в ходе специального международного проекта был выработан международный прогностический индекс (МПИ), в основу которого легли 5 параметров с приблизительно равным и независимым влиянием на выживание (табл. 26.2). Данная система имеет важное значение в прогнозировании и планировании лечения каждого конкретного пациента.
Таблица 26.2. Международный прогностический индекс (МПИ)
 При
неблагоприятном значении каждому из этих параметров присваивается 1
балл. МПИ равен числу неблагоприятных факторов риска: 0-1 - низкая
группа риска; 2 - промежуточная/низкая; 3 - промежуточная/высокая; 4 или
5 - высокая.
При
неблагоприятном значении каждому из этих параметров присваивается 1
балл. МПИ равен числу неблагоприятных факторов риска: 0-1 - низкая
группа риска; 2 - промежуточная/низкая; 3 - промежуточная/высокая; 4 или
5 - высокая.
МПИ остается одним из основных показателей, используемых для назначения современных терапевтических режимов, включающих химиоиммунотерапию.
ЛЕЧЕНИЕ
Для общих алгоритмов лечения НХЛ в каждом конкретном случае определяющим для выбора принципов лечения является разделение НХЛ на иммунофенотипы (В-клеточные и Т-клеточные НХЛ) и внутри их - по характеру течения на индолентные, агрессивные и высокоагрессивные.
Зависимость между гистологическим вариантом лимфомы и выживаемостью представлена в табл. 26.3.
Таблица 26.3. Гистологические варианты НХЛ и выживаемость
 Для лечения НХЛ применяются все виды противоопухолевой терапии.
Для лечения НХЛ применяются все виды противоопухолевой терапии.
В настоящее время показанием к проведению хирургического вмешательства при I стадии НХЛ ЖКТ является только осложнение, угрожающее жизни (перфорация, кровотечение, кишечная непроходимость). В дальнейшем хирургическое лечение обязательно дополняют химиотерапией.
Лучевая терапия при лимфомах в качестве самостоятельного метода применяется в исключительных случаях. Показания к применению лучевой терапии:
- комбинация с химиотерапией;
- невозможность/бесперспективность проведения химиотерапии (паллиативное облучение).
При всех гистологических вариантах, локализациях и стадиях НХЛ основным методом лечения является химиотерапия.
Стандартом лечения большинства В-клеточных агрессивных лимфом можно считать комбинированную химиотерапию по известной программе СНОР (АСОР) в виде 6-8 циклов - с проведением двух циклов после достижения полной ремиссии при 3-недельных интервалах (СНОР-21). Сокращение интервала между циклами
отчетливо повышает эффективность: документированы преимущества схемы СНОР-14 по сравнению с СНОР-21.
В настоящее время пациентам в возрасте до 60 лет рекомендуется в 1-й линии химиотерапии назначать схему СНОЕР. Добавление этопозида положительно сказывается на общей выживаемости. В случае благоприятного прогноза применяют схему СНОЕР-21, неблагоприятного - СНОЕР-14 или СНОР-14. Пациентам старше 60 лет схему СНОЕР не назначают, поскольку этопозид высокотоксичен. Также в лечении пациентов пожилого и старшего возраста допустима замена доксорубицина (с выраженной кардиотоксичностью) на другие противоопухолевые антибиотики: идарубицин в дозе 10 мг/м2 (схема СОР), эпирубицин (фарморубицин) в дозе 70-80 мг/м2 (схема FCOP), митоксантрон (новантрон) в дозе 10-12 мг/м2 (схема CNOP).
За последние 5 лет существенно улучшились результаты лечения первичных больных агрессивными лимфомами. У пациентов с В-клеточными лимфомами с содержанием антигена CD20 (выявляется в опухоли иммуногистохимическим методом) целесообразно использовать моноклональные антитела (МКА) - ритуксимаб (мабтера) в сочетании со схемой CHOP - режим R-СНОР: в 1-й день ритуксимаб в дозе 375 мг/м2 в виде длительной внутривенной инфузии, 2-й день - стандартная схема CHOP.
Для ряда пациентов, у которых по каким-либо причинам недопустимо применение СНОР, используются другие сочетания химиопрепаратов. Пациентам с гипертонической болезнью или с сахарным диабетом необходимо подобрать схемы без кортикостероидных гормонов - CytaBEP, MEV, VAMA, «3+7», с сердечной недостаточностью - исключать антрациклины и назначать СОРР, МОРР, POMP, СОАР, СОР-интенсивный, COP-Bleo, MEV, VAMP, с функциональными нарушениями печени, почек, поджелудочной железы - заменять токсические для паренхиматозных органов препараты (чаще циклофосфамид) на сарколизин или мелфалан.
CHOP: 25 мг/м2 вместо 750 мг/м2 циклофосфамида.
СОР (5-дневный): 10 мг/м> вместо 400 мг/м2 циклофосфамида.
СОРР: 20 мг/м2 вместо 650 мг/м2 циклофосфамида.
Алгоритм лечения индолентных лимфом отличается от методики лечения агрессивных форм. Основная его особенность в том, что он предназначен для лечения В-клеточных вариантов, преимущественно фолликулярных лимфом I и II степени. Однако при
трансформации их в диффузные В-крупноклеточные (наблюдается в 20-30 % случаев) требуется лечение по принципиальной схеме для агрессивных форм, к которым также примыкают фолликулярные НХЛ III степени.
Лучевая терапия в I и II стадиях (30-50 Гр на очаг) дает от 54 до 88 % 10-летней безрецидивной выживаемости. Отношение к выжидательной тактике (т.е. до появления симптомов интоксикации или прогрессирования) неоднозначно. Согласно клиническим рекомендациям ESMO (2003), выжидательная тактика целесообразна только после первоначального лечения. В отечественной практике, особенно при достаточно больших опухолевых массах в III-IV стадиях, принято начинать лечение с химиотерапии - моно- (алкилирующими агентами, винкаалкалоидами) или комбинированной (LOPP, COP). Следует иметь в виду, что комбинированная химиотерапия увеличивает частоту ответа и безрецидивный период, но не влияет на общую выживаемость, медиана которой составляет 8-10 лет. Впрочем, и при высокодозной химиотерапии с пересадкой стволовых клеток в этом отношении отмечены противоречивые результаты даже при достижении молекулярных ремиссий.
Абсолютным достижением в лечении индолентных (фолликулярных I-II степени) лимфом является применение в III-IV стадии препарата ритуксимаб (мабтера), индуцирующего в моноиммунотерапии до 73 % ответа, с медианой времени до прогрессирования 552 дня, а при первично-рефрактерных формах и рецидивах - не менее 50 % длительных ремиссий. Значимую поддержку в продлении достигнутой ремиссии при фолликулярных НХЛ I и II степени оказывает применение рекомбинантного ИФН-α, достоверно увеличивающего продолжительность ремиссии и выживаемость при длительном (12-18 мес) применении этого цитокина.
Схемы 1-й линии для терапии НХЛ:
СНОР-21: циклофосфамид внутривенно 750 мг/м2 в 1-й день;
доксорубицин внутривенно 50 мг/м2 в 1-й день;
винкристин внутривенно 1,4 мг/м2 в 1-й день;
преднизолон внутрь 60 мг/м2 в 1-й и 5-й дни. СНОЕР-21: циклофосфамид внутривенно 750 мг/м2 в 1-й день;
доксорубицин внутривенно 50 мг/м2 в 1-й день;
винкристин внутривенно 1,4 мг/м2 в 1-й день;
этопозид 100 мг/м2 в 3-5-й день;
преднизолон внутрь 60 мг/м2 в 1-5-й день.
СОР: циклофосфамид внутривенно, внутримышечно
750 мг/м2 в 1-й день;
винкристин внутривенно 1,4 мг/м2 в 1-й день; преднизолон внутрь 60 мг/м2 в 1-5-й день. СОР-BLEO: циклофосфамид внутривенно, внутримышечно 125 мг/м2 в 1-14-й день;
винкристин внутривенно 1,4 мг/м2 в 1-й и 8-й дни; преднизолон внутрь 60 мг/м2 в 1-5-й день; блеомицин внутривенно 10 мг/м2 в 1-й и 8-й дни. СОРР: циклофосфамид внутривенно 650 мг/м2 в 1-й и 8-й дни;
винкристин внутривенно 1,4 мг/м2 в 1-й и 8-й дни;
прокарбазин внутрь 100 мг/м2 в 1-14-й день;
преднизолон внутрь 60 мг/м2 в 1-14-й день. СУТР: циклофосфамид внутривенно 650 мг/м2 в 1-й, 8-й дни;
винбластин внутривенно 6 мг/м2 в 1-й, 8-й дни;
прокарбазин внутрь 100 мг/м2 в 1-14-й день;
преднизолон внутрь 60 мг/м2 в 1-14-й день. Лечение рецидивов агрессивных лимфом зависит от продолжительности ремиссии. Если рецидивы наступили после полной ремиссии, длившейся не менее 6 мес, т.е. в поздние сроки, повторяют прежнее лечение. Если же рецидивы развились на фоне частичной ремиссии или в ранние сроки после окончания лечения, схемы лечения необходимо пересмотреть, заменив более интенсивными.
В схемы ПХТ 2-й линии входят в разных сочетаниях препараты, которые пока редко применяются на первых этапах лечения: ломустин (ВАЕМ, LABO), кармустин (BVCPP), цитарабин ^НАР), ципла-
тин (СЕМР, РЕВ), ифосфамид (MINE, ICE, IVE), метил-гаг (MIME),
этопозид и митоксантрон (СЕРР [В], OPEN, VEMP, BACOD-E). В других - эти же препараты используются в высоких и повышенных дозах ^АР, ESAP, DHAP).
В случае первичной резистентности могут быть использованы препараты и их сочетания, не применявшиеся в период первоначального лечения, в обычных и повышенных дозах. Для этого целесообразно использование так называемой Salvage therapy (MINE, E5HAP, DHAP, Dexa-BEAM).
При вовлечении в опухолевый процесс костного мозга с бластной лейкемизацией необходимо лечение в соответствии с типом развившегося лейкоза. При бластной трансформации костного мозга,
лимфобластных, крупноклеточных опухолях, лимфоме яичка и Беркитта, особенно с поражением средостения и кожи, профилактику поражения ЦНС проводят, как при остром лейкозе. В спинномозговой канал вводят метотрексат (12,5 мг/м2), цитарабин (20 мг/м2) и дексаметазон (4 мг/м2) или преднизолон (25-30 мг/м2). Препараты вводят в 1-й день каждого цикла лечения.
У многократно леченных больных можно получить полную ремиссию с помощью флударабина и кладрибина в монорежиме. Флударабин вводят из расчета 25 мг/м2 внутривенно в течение 5 дней подряд каждые 4 нед или 4 дня подряд каждые 3 нед. Кладрибин применяют в дозе 0,1 мг/кг ежедневно в течение 7 дней каждые 4-5 нед. Проводят 6-8 циклов. Однако преимущество получают при использовании комбинаций флударабина с митоксантроном или циклофосфамидом и кортикостероидами (FMP, FC) или без них: ремиссии наступают быстрее и намного чаще.
При трансформации зрелоклеточных лимфом в бластные (синдром Рихтера) рекомендуется проведение тех же схем, как при лимфомах высокой степени злокачественности.
Схемы 2-й линии терапии НХЛ:
ESHAP: этопозид внутривенно 1-часовая инфузия 60 мг/м2 в 1-4-й день;
метилпреднизолон внутрь 500 мг/м2 в 1-4-й день; цитарабин внутривенно 2-часовая инфузия 2000 мг/м2 в 1-4-й день;
цисплатин внутривенно 25 мг/м2 в 1-й день.
Периодичность - 28 дней. FC: флударабин внутривенно 25 мг/м2 в 1-3-й день;
циклофосфамид внутривенно 400 мг/м2 в 1-3-й день.
Периодичность - 21 день. LABO: ломустин внутрь 1000 мг/м2 в 1-й день;
доксорубицин внутривенно 35 мг/м2 в 1-й и 8-й дни;
блеомицин внутримышечно 15 мг/м2 в 1-й и 8-й дни;
винкристин внутривенно 1,4 мг/м2 в 1-й и 8-й дни.
Периодичность - 21-28 дней. OPEN: винкристин внутривенно 1,4 мг/м2 в 1-й день;
преднизолон внутрь 60 мг/м2 в 1-5-й день;
этопозид внутривенно 100 мг/м2 в 1-3-й день;
митоксантрон внутривенно 10 мг/м2 в 1-й день.
Периодичность - 28 дней.
Обязательной частью лечения НХЛ являются критерии объективной оценки его эффективности, без которой невозможны не только сравнение полученных результатов, но и сам подход к определению первичной или приобретенной резистентности, полноты и степени ответа, рецидивов и других клинических ситуаций, требующих стратегических и тактических решений в вопросе об отказе или продолжении терапии.
Выделены 6 категорий ответа эффективности на лечение при НХЛ, при этом измеряют размер лимфатических узлов только по наибольшему поперечному диаметру, учитывают размеры селезенки и печени, их динамику - во всех случаях с использованием КТ и ЯМР. В критерии оценки введены также результаты исследования (трепанобиопсия или аспират) костного мозга.
Полная ремиссия (CR - complete remission) - полное исчезновение всех опухолевых проявлений заболевания, подтвержденное теми же методами исследования, которыми эти изменения выявлялись, и при необходимости дополнительными методами исследования. Полная ремиссия констатируется после окончания лечения, причем только в том случае, если она сохраняется не менее 4 мес после окончания программы.
Неуверенная полная ремиссия, «не подтвержденная/сомнительная полная ремиссия» (CR[u] - unconfirmed/uncertain complete remission) констатируется у больных с остаточными узлами размером не более 1,5 см, которые невозможно верифицировать гистологически. Как и полная ремиссия, неуверенная полная ремиссия подтверждается в случае, если она сохраняется не менее 4 мес после окончания лечения.
При возобновлении опухолевого роста ранее чем через 4 мес ремиссия не констатируется, а результат лечения оценивается как прогрессирование.
Частичная ремиссия (PR - partial remission) - уменьшение размеров опухолевых проявлений более чем на 50 % от исходных размеров.
Стабилизация (SD) - уменьшение размеров опухолевых проявлений более чем на 25 %, но менее чем на 50 % от исходных размеров.
Без эффекта - уменьшение или увеличение размеров опухолевых проявлений менее чем на 25 % от исходных размеров.
Прогрессирование (Pr) - увеличение размеров опухолевых проявлений более чем на 25 % от их минимальных размеров, достигнутых в процессе лечения, или появление хотя бы одного нового очага
поражения, а также возврат болезни после констатации ремиссии в течение первых 4 мес после окончания программы лечения.
В дополнение к перечисленным категориям предлагается использовать еще несколько показателей, обязательных для окончательной оценки эффективности лечения в сравниваемых при клинических испытаниях в группах больных НХЛ. Из них 3 являются первостепенными: 1) общая выживаемость среди всех больных, которая исчисляется от момента включения в исследование до смертельного исхода от любой причины; 2) «бессобытийная» (eventfree) выживаемость (для больных с CR, CRu и PR - от того же момента до прогрессии, рецидива или смерти от любой причины (time to treatment failure - TTF) и 3) выживаемость без прогрессии (для всех больных - со времени включения в исследование или начала лечения до прогрессирования или до смерти от НХЛ). «Вторичными» (second end pоints) считаются еще 4 показателя, применимые и в каждом отдельном случае: 1) продолжительность безрецидивного периода (disease free survival) - время от 1-й оценки ответа до рецидива (только для больных с CR, CRu); 2) длительность ответа (response duration) для больных с CR, CRu и PR - с того же момента до рецидива или прогрессирования; 3) смертность, непосредственно связанная с НХЛ (cause-specific death) - среди всех больных и 4) время до следующего лечения (все больные - от момента начала лечения до начала другого).
По данным American Cancer Society, общая 5-летняя выживаемость больных НХЛ в 1975-1977 гг. была 48 %, в 1984-1986 гг. - 53 %, в 1996-2002 гг. - 63 %.
Вопросы для самоконтроля
1. Дайте определение злокачественным лимфомам, какие группы заболеваний объединяет эта нозологическая группа?
2. Что такое лимфогранулематоз, кто впервые описал это заболевание?
3. В каких возрастных группах может встречаться лимфогранулематоз?
4. Какие группы лимфатических узлов поражаются наиболее часто при лимфогранулематозе?
5. Что включает в себя определение «симптомы интоксикации»?
6. Чем отличается пункционная биопсия от открытой биопсии?
7. Какие гистологические варианты лимфогранулематоза вы знаете?
8. Как называется диагностическая для лимфогранулематоза клетка?
9. Что можно увидеть на рентгенограмме у больных лимфогранулематозом с поражением медиастинальных лимфатических узлов?
10. Какой радиоизотопный препарат используется для диагностики распространенности поражения у больных лимфогранулематозом?
11. Сколько стадий лимфогранулематоза вы знаете?
12. Какие методы лечения используются у больных лимфогранулематозом?
13. Какие схемы полихимиотерапии (I линии) наиболее часто используются у больных лимфогранулематозом?
14. Какие факторы являются прогностически неблагоприятными у больных лимфогранулематозом?
15. Как и в каких дозах проводится лучевая терапия у больных лимфогранулематозом?
16. Как оценивают результаты лечения больных лимфогранулематозом?
17. Каковы отдаленные результаты лечения больных лимфогранулематозом?
18. Охарактеризуйте заболеваемость неходжкинскими лимфомами.
19. Каковы этиопатогенетические особенности НХЛ?
20. Охарактеризуйте понятия лимфомогенеза и молекулярной генетики НХЛ.
21. Приведите классификацию неходжкинских лимфом по морфологии и иммунофенотипам.
22. Назовите морфологические признаки, объединяющие неходжкинские лимфомы в группы сходного гистологического строения.
23. В чем заключается иммунологическая диагностика неходжкинских лимфом?
24. В чем особенности диагностики и клинической картины неходжкинских лимфом?
25. Как проводится определение распространенности (стадирование)
НХЛ?
26. Назовите основные принципы лечения неходжкинских лимфом.
27. Какие критерии объективной оценки являются обязательной частью лечения НХЛ?
28. На каких параметрах основан Международный прогностический индекс?