Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев. 2010. - 920 с.
|
|
|
|
ГЛАВА 20 ГАСТРОИНТЕСТИНАЛЬНЫЕ СТРОМАЛЬНЫЕ ОПУХОЛИ ЖЕЛУДКА
В последние 20 лет выделен особый тип стромальных опухолей ЖКТ, имеющих веретеноклеточное строение и своеобразное клиническое течение. Эти опухоли получили название гастроинтестинальных стромальных опухолей (ГИСО - gastrointestinal stromal tumors - GIST). Хотя ГИСО составляют всего около 1 % новообразований ЖКТ, они являются самыми частыми мезенхимальными опухолями этой локализации. Несмотря на относительно низкую заболеваемость ГИСО, вопросы их диагностики и лечения остаются актуальными в современной онкологии.
Независимо от размеров и гистологических параметров все ГИСО являются потенциально злокачественными, так как их биологическое поведение зачастую непредсказуемо. В последние годы в диагностике, лечении ГИСО произошли существенные изменения. Применение в лечении пациентов с такими распространенными формами ГИСО, как метастатические или неоперабельные, таргетного препарата иматиниб (гливек) привело к значительному улучшению прогноза.
До 80-х годов ХХ века предполагалось, что большинство веретеноклеточных опухолей ЖКТ возникают из гладкой мускулатуры, и это определяло их первичный диагноз - лейомиобластома, лейомиома, лейомиосаркома. Впоследствии их гистогенез был уточнен при использовании электронной микроскопии и иммуногистохимических методов исследования, позволивших установить сочетание гладкомышечной и невральной направленности дифференцировки опухолевых клеток. Эти клетки являются аналогами возбудимых интерстициальных клеток Кахаля (ИКК) (interstitial cells of Cajal) ЖКТ. ИКК обладают электрической активностью (рacemaker) и объединяют гладкомышечные клетки с периферической нервной системой, участвуя в регуляции перистальтики стенки ЖКТ. В 1983 г. Mazur и Clark для обозначения опухолей,
клетки которых обладают свойствами интерстициальных клеток Кахаля, предложили термин «стромальная опухоль». Более полное понимание гистогенеза стромальных опухолей ЖКТ стало возможно в 1998 г. в связи с открытием сверхэкспрессии онкобелка KIT (CD117) в большинстве составляющих ГИСО клеток. Онкобелок KIT - трансмембранный рецептор тирозинкиназы, определяющий дифференцировку примитивных мезенхимальных клеток в ИКК. Его экспрессия оказалась очень специфичной для ИКК. Клеточная пролиферация, адгезия, дифференцировка и туморогенез в ГИСО в большинстве случаев связаны с активацией онкогена с-KIT. В экспериментах при внесении мутированного с-KIT в геном мыши у последней развивались ГИСО.
Молекулярными событиями, приводящими к развитию опухоли, являются активирующие опухолеродные мутации генов, экспрессирующих онкобелки KIT и PDGFRa (рецептор фактора роста тромбоцитов-α), относящиеся к группе тирозинкиназ. Большинство ГИСО несут в себе ЮТ-мутации, но около 30% имеют активационные мутации в гене, кодирующем выработку PDGFRa, что определяет двоякий механизм запуска туморогенеза в ГИСО: посредством гиперэкспрессии KIT и (или) PDGFRa. Однако в механизмах опухолевой прогрессии ГИСО участвуют и другие, пока не идентифицированные молекулярные и цитогенетические мутации.
ЭПИДЕМИОЛОГИЯ
Частота заболеваемости ГИСО составляет 15-20 случаев на 1 млн в год. ГИСО встречается у пациентов в достаточно широком возрастном диапазоне (возрастная медиана - 55-65 лет), однако пик заболеваемости приходится на 6-ю декаду жизни, а менее 10 % опухолей развиваются в возрасте до 40 лет. ГИСО несколько чаще преобладают у мужчин.
Наиболее частая локализация опухолей - желудок (60-70 %), далее следуют тонкая кишка (20-30 %), прямая или ободочная кишка (5 %) пищевод (<5 %). Сообщается о первичных ГИСО сальника и брыжейки кишечника. Очень редко эктопические ГИСО могут обнаруживаться и вне ЖКТ, например у мужчин в предстательной железе. Опухоль ЖКТ может доходить до малого таза и диагностироваться при гинекологическом или ректальном осмотре.
КЛИНИЧЕСКИЕ И МОРФОЛОГИЧЕСКИЕ
ХАРАКТЕРИСТИКИ
На момент диагностики размеры первичной опухоли могут быть диаметром от 1 до 35 см и более, что определяет достаточно широкий спектр клинических симптомов. При ГИСО могут наблюдаться местные симптомы, обусловленные особенностями локализации опухоли. К таким симптомам относятся: чувство быстрого насыщения, вздутие живота, желудочно-кишечные кровотечения или повышенная утомляемость вследствие анемии. У некоторых пациентов могут отмечаться тошнота, рвота, боли, потеря массы тела, а иногда при пальпации можно обнаружить опухоль. Могут быть и кожные проявления - сыпь, которая проходит, как только удаляют опухоль. Однако чаще течение асимптоматичное или неспецифическое.
Достаточно часто ГИСО желудка выявляется как случайная находка при эндоскопии, лапароскопии или КТ, диспансерном обследовании, хирургическом вмешательстве по поводу другого заболевания или на аутопсии. По разным данным, случайное выявление ГИСО желудка отмечается в 17,7 % случаев.
Согласно M. Miettinen и соавт. (2005), проанализировавших более 1700 случаев с ГИСО желудка, у 54,4 % больных были выявлены симптомы желудочно-кишечного кровотечения, постгеморрагическая анемия или мелена, что определялось глубоким изъязвлением опухоли. Реже (16,8 %) отмечались боли в верхнем этаже брюшной полости, тогда как симптомы острого живота выявлялись лишь в 1,7 % случаев. Средняя продолжительность симптоматики до установления диагноза составляла 4-6 мес.
Для ГИСО ЖКТ характерна триада Carney (1977) в виде сочетания экстраадренальной параганглиомы, хондром легких и самой ГИСО.
Опухоль в основном поражает подслизистую оболочку, распространяясь в стенку ЖКТ. Возможно изъязвление слизистой оболочки. Крупные опухоли обычно выбухают в просвет или в сторону серозной оболочки (рис. 20.1). Ткань опухоли в основном рыхлая, мягкая, редко - саркоматозного вида, на разрезе светло-коричневого, серого или розоватого цвета. Границы мелких опухолей отчетливые. Опухоли крупных размеров зачастую обладают инфильтрирующим ростом. В преобладающем большинстве крупных опухолей наблюдаются центральный некроз и кистозные полости с кровоизлияниями.
Такие опухоли ошибочно могут быть приняты за кисту поджелудочной железы и забрюшинную
кисту.
Большинство ГИСО имеют достаточно характерную гистологическую картину. Поражения состоят из веретенообразных и эпителиоидных клеток, в связи с чем выделяются веретеноклеточный и эпителиоидный типы (рис. 20.2 и 20.3). Веретенообразную форму клеток имеют
около 70 % ГИСО, эпителиоидную морфологию - 20 %. В остальных случаях опухоль представлена смесью из веретенообразных и эпителиоидных клеток.
В большинстве опухолей преобладают веретенообразные клетки, образующие завитки или короткие пучки. Ядра клеток овальные, мономорфные, часто имеют везикулярный хроматин. Цитоплазма относительно бледная, с неясными контурами. Напротив, эпителиоподобные опухолевые клетки - полигонально-округлые, диаметром 15-25 мкм, с более отчетливыми клеточными границами и светлой слабоэозинофильной или оптически пустой светлой цитоплазмой. Ядра без атипии, светлые, овально-округлой формы, иногда располагаются эксцентрично. Клетки опухоли разделены на дольки
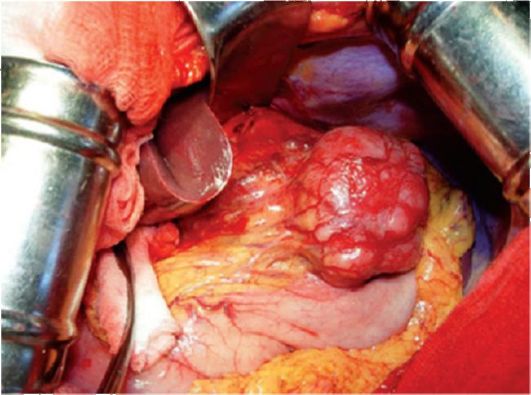 Рис. 20.1. Гастроинтестинальная стромальная опухоль желудка
Рис. 20.1. Гастроинтестинальная стромальная опухоль желудка
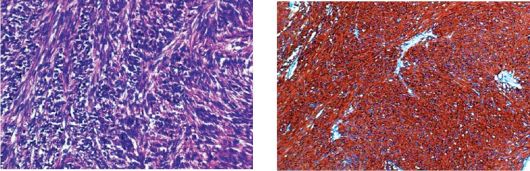 Рис. 20.2. Веретеноклеточно-пуч- Рис. 20.3. Интенсивная экспресковый тип. Микропрепарат сия антигена c-kit (CD 117). Имму-
Рис. 20.2. Веретеноклеточно-пуч- Рис. 20.3. Интенсивная экспресковый тип. Микропрепарат сия антигена c-kit (CD 117). Имму-
ногистохимический микропрепарат
тонкими прослойками соединительной ткани, придающими им гнездную архитектуру. Данный тип опухолей ранее называли лейомиобластомой.
В большинстве ГИСО наблюдается незначительный ядерный полиморфизм и очень редко определяются явно атипичные клетки. В последнем случае необходим дифференциальный диагноз с лейомиосаркомой.
В ГИСО могут встречаться ослизнение, параганглио- и карциноидоподобные структуры. В небольшом количестве опухолей могут выявляться отчетливые ядерные палисады, встречающиеся в опухолях оболочек периферических нервов. Однако указанные морфологические особенности не имеют какого-либо прогностического значения. К проявлениям патоморфоза опухоли после лечения иманитибом (гливеком) относятся: очаги некроза, кровоизлияния и миксоидная дегенерация. По материалу небольшого фрагмента ткани затруднительно установить правильный диагноз, поскольку опухоль может иметь различную гистологическую структуру, а картина - изменяться на фоне терапии.
Учитывая достаточно широкий спектр морфологических характеристик, ГИСО следует дифференцировать с мезенхимальными, нейроэндокринными, нейрогенными опухолями брюшной полости: истинными лейомиосаркомами и лейомиомами, гломусной опухолью, шванномами (опухоли оболочек периферических нервов), злокачественной меланомой, фиброматозом. От лейомиомы ГИСО отличаются большей клеточностью. Гломусная опухоль ЖКТ обладает позитивностью к виментину и негативна к гладкомышечным маркерам, для шванномы характерны ослизнение, тонкие, веретенообразные клетки (так называемое тонкое веретено).
Иммуногистохимическая диагностика
Более 95 % ГИСО экспрессируют KIT, что позволяет на сегодняшний день рассматривать его как универсальный маркер данного типа опухоли. Для точного диагноза и принятия терапевтического решения необходимо иммуногистохимическое исследование для выявления экспрессии онкобелка KIT (CD117). Окраска на CD117 при ГИСО может быть очаговой и (или) диффузной. В большинстве случаев определяется четкое окрашивание клеточной мембраны и (или) цитоплазмы. Окрашенные структуры в клетке могут иметь точечно-глыбчатую структуру (dot-like). Характер окраски на CD117
может варьировать в самой опухоли, а также изменяться после терапии.
Следует отметить, что кроме ИКК в норме в ЖКТ CD117/KIT всегда экспрессируют тучные клетки, что может служить положительным контролем при иммуногистохимическом исследовании. Кроме ГИСО, СD117 могут экспрессировать тучно-клеточные лейкозы, глиобластомы, мелкоклеточный рак легких. Примечательно, что меланомы глаза, также экспрессируя СD117, метастазируют в печень, минуя легкие, и также лечатся гливеком.
Для диагностики ГИСО применяются и другие иммуногистохимические маркеры, которые, однако, по специфичности уступают CD117. Дополнительные маркеры включают: CD34 - антиген гемопоэтических клеток-предшественников и эндотелия сосудов (чувствительность 60-80 %), гладкомышечный актин (чувствительность - 35 %), S-100 (чувствительность - 10 %) и десмин (чувствительность - 5 %). Для стандартной диагностики ГИСО общепринятым является применение KIT (CD117), CD34 и десмина; последний маркер используется для дифференциальной диагностики c лейомиосаркомами. Следует отметить, что ГИСО желудка всегда экспрессируют CD34, в тонкой кишке этот антиген, как правило, не экспрессируется. При эпителиоидно-клеточном варианте CD117 окрашивается слабо.
Некоторые опухоли, не относящиеся к ГИСО, при технологических дефектах в процессе иммуногистохимической обработки антигена, бывают ложноположительными к CD117. С другой стороны, позитивность к KIT может наблюдаться в метастатической меланоме и сосудистых опухолях. Поэтому всегда при интерпретации иммуногистохимических результатов следует учитывать клиническую картину и морфологические данные.
В 4-5 % случаях опухоли, имеющие клинические и морфологические признаки ГИСО, не дают положительной окраски при реакции с антителами к CD117. Эти опухоли, не экспрессирующие в достаточном для выявления количестве KIT, несут в себе активационные мутации PDGFRa. Поэтому, если все основные характеристики опухоли соответствуют ГИСО, в некоторых случаях диагноз может быть установлен и при негативной реакции на KIT. При наличии опухоли с типичными морфологическими признаками ГИСО, но KIT-отрицательной для подтверждения диагноза в ряде случаев может потребоваться молекулярно-биологическое исследование для определения KIT PDGFRa-мутаций.
Ошибки при диагностике GIST составляют около 6 %. ГИСО ошибочно может диагностироваться как меланома, светлоклеточная саркома, лейомиосаркома, рак, крупноклеточная лимфома, карциноидная и гломическая опухоли, интрадоминальный (тонкокишечный) десмоид, саркома без определенного гистогенеза.
ПРОГНОЗ
Термин «доброкачественная опухоль» при ГИСО неприменим, так как все опухоли независимо от размеров и локализации считаются потенциально злокачественными. Применить универсальные морфологические критерии злокачественности как признаки тканевой, клеточной и ядерной атипии, присущие для злокачественных опухолей другого гистогенеза, при ГИСО не представляется возможным. Безусловно, опухоли при наличии диагностированных метастазов, независимо от гистологическй картины, являются злокачественными и всегда имеют плохой прогноз.
Метастазируют ГИСО в основном гематогенно, и очень редко - лимфогенно. Метастазы наблюдаются главным образом в печени, редко - в лимфатических узлах и почти никогда не выявляются в легких. У некоторых пациентов с распространенной стадией обнаруживают обширные брюшинные отсевы в виде множественных мелких узелков диаметром до 0,5 см с характерной полостью в центре с геморрагическим содержимым.
Более чем у 30 % пациентов к моменту диагностики имеются признаки распространенности в виде интраабдоминальных метастазов и (или) метастазов в печень и опухолевой инфильтрации окружающих органов. В настоящее время критерии клинического стадирования ГИСО еще не разработаны. На практике целесообразно выделение локализованной формы - при отсутствии метастазов и распространенной - при наличии метастазов в печени и диссеминации брюшины.
После проведения проспективных молекулярных исследований с включением в исследуемые группы желудочных и нежелудочных ГИСО, а также анализа результатов лечения первичных и рецидивных опухолей были выделены статистически значимые критерии прогноза течения заболевания. Вероятность метастазирования повышается по мере увеличения размеров опухоли и митотической активности, определяемой при светооптической микроскопии
с окраской гематоксилином и эозином. Дополнительное прогностическое значение имеет определение индекса пролиферативной активности, выявляемого с помощью антител Ki-67. Решающим критерием злокачественности является более 5 митозов в 50 полях зрения в большом поле зрения микроскопа (х400), что коррелирует с внутрибрюшным распространением опухоли и (или) метастазами в печени. Эта корреляция усиливается при увеличении размеров опухоли. Критическими следует считать размеры опухоли >10 см. К сожалению, даже митотические неактивные и относительно мелкие опухоли могут рецидивировать и метастазировать.
К дополнительным гистологическим признакам, которые ассоциируются с агрессивным поведением, относятся инвазия слизистой оболочки, высокая клеточность в опухоли, выраженная атипия клеток и ядер, очаги некрозов и эпителиоидная морфология.
На основании ретроспективного анализа 1765 случаев (Miettinen M. et al., 2005) с учетом размеров опухоли и митотического индекса (табл. 20.1) для определения риска рецидива ГИСО были выделены 4 группы новообразований: очень низкого, низкого, среднего и высокого риска рецидива или степени агрессивности. Опухоли больших размеров с высоким митотическим индексом ассоциируются с максимальным риском, хотя опухоли диаметром >10 см с любым митотическим индексом или опухоли с 10 митозами и более в 50 полях зрения при большом увеличении вне зависимости от размера относят к группе высокого риска.
Таблица 20.1. Прогноз желудочных ГИСО
Риск прогрессирования | Размер опухоли, см | Число митозов на 50 полей зрения,х400 |
Очень низкий | <2 | <5 |
Низкий | 2-5 <5 | <5 6-10 |
Средний | 5-10 >5 | <5 >5 |
Высокий | >10 Любой | Любой >10 |
Первичная локализация опухоли, пол пациента, гистологический вариант, интенсивность экспрессии CD117 не влияют на уровень общей выживаемости. Значение анатомической локализации
продолжает обсуждаться, но считается, что тонкокишечные ГИСО характеризуются более агрессивным поведением, чем желудочные опухоли.
ДИАГНОСТИКА
Диагностика первичной ГИСО желудка зависит от ее размеров и клинической симптоматики. Стандартным методом для диагностики отдаленных метастазов и определения резектабельности опухолей больших размеров и мониторинга при лечении является КТ органов брюшной полости. КТ с контрастированием позволяет охарактеризовать распространенность и наличие метастазов. Для получения качественного контрастного изображения применяют пероральные или внутривенные контрастные препараты.
На КТ ГИСО выглядит как плотное образование, с повышенной контрастностью, хотя крупные опухоли при наличии некрозов, кровоизлияний или участков распада могут иметь менее гомогенную структуру. ГИСО - хорошо васкуляризированная опухоль с четкими границами, часто - с экзофитным ростом в пределах подслизистого слоя, что может приводить к смещению других органов. Однако ГИСО, несмотря на большие размеры, редко приводят к обструкции ЖКТ.
При диагностике ГИСО обязательно проводят эндоскопическое исследование верхних отделов ЖКТ, часто - в сочетании с эндоскопическим УЗИ. При больших опухолях с изъязвлением слизистой оболочки желудка выполняют гастробиопсию, позволяющую получить достаточное количество материала для морфологического исследования. При подслизистых образованиях оптимальным является эндоскопическое УЗИ (УЗ-эндоскопия), позволяющее определить точные размеры опухоли и идентифицировать слои ЖКТ, обнаружить кистозные полости, а также установить вовлеченность окружающих структур или лимфатических узлов.
Эхоэндоскопически ГИСО обычно определяется как гипоэхогенные массы, которые возникают в мышечном слое или мышечной пластинке слизистой оболочки. Критериями агрессивного течения ГИСО, по данным эндоскопического УЗИ, являются:
• размеры опухоли >4 см;
• нечеткие внешние контуры опухоли;
• эхогенные включения;
• кистозные полости в опухоли.
Под контролем эндоскопического УЗИ выполняется тонкоигольная биопсия, рассматриваемая как ведущий метод в уточнении диагноза перед хирургической резекцией; она позволяет получить диагностический материал более чем в 75 % случаев.
Ткань ГИСО очень нежная и легко кровоточит при травматизации. Поэтому при подозрении на «стромальную опухоль», если возможно полное ее удаление по данным первичного обследования, проводить биопсию до операции не рекомендуется вследствие высокого риска диссеминации клеток. Исключение - эндоскопическая биопсия, которая не сопряжена с риском интраабдоминального распространения опухоли. Отметим, что зачастую материала предоперационной биопсии бывает недостаточно для дооперационной диагностики. Поэтому хирургическое удаление первичной опухоли рекомендуется выполнять у всех пациентов, способных перенести операцию.
С целью дифференциальной диагностики под контролем эндоскопического УЗИ также может выполняться подслизистая резекция небольших узлов, подозрительных на ГИСО. Однако при полученном ранее морфологическом подтверждении ГИСО эндоскопическая резекция противопоказана, поскольку связана с возможным вовлечением мышечного слоя стенки органа и с высокой вероятностью наличия остаточной опухоли по линии резекции.
Окончательное заключение о злокачественности процесса возможно лишь на основании морфологического исследования полностью удаленного препарата. Производится светооптическая микроскопия с оценкой гистологической структуры опухоли. Но при этом следует заметить, что морфологическое строение опухоли может измениться после терапии. Для исключения других опухолей и подтверждения диагноза обязательно осуществляют иммуногистохимическое исследование. При этом выявление экспрессии онкобелка с-KIT в ГИСО имеет не только диагностическое, но и очень важное терапевтическое значение, так как позволяет обоснованно назначить таргетную терапию.
ЛЕЧЕНИЕ
В качестве терапии 1-й линии у пациентов с локализованной ГИСО применяется оперативное лечение. Однако даже при условии полной резекции опухоли медиана выживаемости после хирургического лечения составляет 5 лет.
Целью радикального оперативного вмешательства при первичных ГИСО является полное удаление опухоли в пределах здоровых тканей. ГИСО необходимо удалять аккуратно, без повреждения псевдокапсулы. При травматизации опухоли возможны кровотечение и (или) интраоперационная диссеминация опухолевых клеток. Такая диссеминация определяет крайне высокий риск интраперитонеального рецидива заболевания. Так, по данным исследователей M.D. Anderson Cancer Center (1992), после полного удаления ГИСО желудка, осложнившегося вскрытием псевдокапсулы, отмечается статистически значимое ухудшение выживаемости по сравнению с показателем у пациентов, у которых вмешательство прошло без осложнений.
Вовлечение окружающих структур при ГИСО желудка встречается крайне редко. В случае их вовлечения или если опухоль спаяна с окружающими органами, чтобы избежать вскрытия псевдокапсулы, выполняют моноблочную комбинированную резекцию всего конгломерата в пределах здоровых тканей. При этом непораженные ткани не удаляют.
В отличие от аденокарциномы желудка метастазы в регионарные лимфатические узлы при ГИСО встречаются редко. Поэтому лимфодиссекция рутинно не выполняется, за исключением случаев с явным вовлечением лимфатических узлов.
Некоторые исследователи предлагают выполнять парциальные резекции желудка, однако размер опухоли и ее локализация зачастую требуют более расширенного вмешательства, вплоть до гастрэктомии.
Большинство рецидивов ГИСО после операции происходит в течение первых двух лет. При этом сроки выживаемости не зависят от наличия или отсутствия опухолевых клеток по линии резекции. Даже при полной резекции в пределах здоровых тканей и отсутствии опухолевых клеток по линии резекции главной проблемой остается наличие резидуальной опухоли, поскольку при ГИСО, особенно крупных размеров, в брюшной полости сохраняется некоторое количество опухолевых клеток.
При ретроспективно диагностированных ГИСО, например после вылущивания «лейомиом», необходима радикальная повторная опепация; при этом удаляется большой сальник.
В последнее время в лечении ГИСО все шире применяются лапароскопические технологии. Однако эндохирургическое иссечение
из мини-доступа выполняют при размерах ГИСО <2 см, когда риск интраоперационного повреждения псевдокапсулы невелик.
Оперативное лечение ГИСО при наличии множественных метастазов в печени, обширных отсевах по брюшине или рецидивах опухоли не имеет значительного преимущества. При развитии рецидива или метастазов химиотерапия или облучение дают небольшой эффект: частота ответов при проведенной системной химиотерапии колеблется от 0 до 27 %, а медиана выживаемости у пациентов с ГИСО, получивших ПХТ, составляет 14-18 мес. Проведение лучевой терапии ГИСО ограничено вследствие риска облучения окружающих тканей.
В последнее время, с целью уменьшения комбинированных резекций, а также в группе больных с плохим прогнозом, все шире применяется неоадъювантная этиопатогенетическая молекулярнонаправленная, или таргетная (от англ. targent - мишень), терапия опухоли препаратом иматиниб (гливек) либо адъювантная терапия этим препаратом после хирургического лечения.
Механизм действия иматиниба (гливек) заключается в конкурентном взаимодействии с трансмембранными тирозинкиназными рецепторами онкобелков: KIT, PDGFRa, PDGFRp, внутриклеточными тирозинкиназами ARG, ABL и химерным белком BCR-ABL, образующимся при хроническом миелолейкозе (ХМЛ).
В настоящее время иматиниб применяется в качестве терапии 1-й линии при метастатических или неоперабельных ГИСО и всех стадиях ХМЛ с филадельфийской хромосомой.
Несмотря на то что полный ответ на иматиниб удается получить довольно редко, в большинстве случаев применение препарата ведет к остановке роста и сокращению размеров опухоли. Терапию иматинибом рекомендуется продолжать даже при отсутствии признаков прогрессии заболевания, поскольку при его отмене происходит значительная прогрессия опухоли.
Конференция National Comprehensive Cancer Network и European Society for Medical Oncology (ESMO) в 2004 г. достигла консенсуса, предложив терапевтический алгоритм, где оперативное лечение является терапией 1-й линии при первичных операбельных ГИСО, а иматиниб применяется в качестве терапии 1-й линии у пациентов с метастазами или рецидивами (схема 20.1).
Лечение больных ГИСО как после хирургической резекции первичной опухоли, так и при лечении иматинибом при поздних стадиях
ГИСО требует проведения тщательного мониторинга для выявления рецидива или прогрессии заболевания. Для этого более предпочтительным методом является КТ с контрастированием. Ответ на лечение иманитибом, оцениваемый по изменению размеров опухоли, наблюдается уже через 1 мес от начала терапии. Рецидив ГИСО после резекции возможен в месте первичной локализации опухоли или в виде метастазов. О прогрессии часто свидетельствует появление новых, небольших внутриопухолевых узелков.
Примерно у 14 % пациентов наблюдается ранняя резистентность к иматинибу. Основную роль в обеспечении эффективности без развития непереносимых побочных реакций играет подбор оптимальной дозы препарата. Терапию рекомендуют начинать со стартовой дозы 400 мг/сут с увеличением ее до 800 мг/сут при прогрессии после инициального ответа.
Для лечения ГИСО используются и другие таргетные препараты.
Сунитиниб (SU11248) - ингибитор различных типов киназ: рецепторов факторов роста тромбоцитов (PDGFRa, PDGFRp), онкобелка
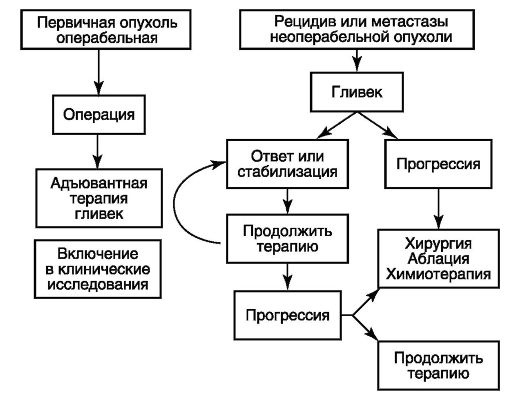 Схема 20.1. Алгоритм лечения местно-распространенных и локализованных форм ГИСО
Схема 20.1. Алгоритм лечения местно-распространенных и локализованных форм ГИСО
KIT и рецепторов фактора роста сосудов VEGFR (VEGFR1, VEGFR2, VEGFR3), что определяет выбор лечения ГИСО с двойным механизмом туморогенеза, включая направленное угнетение онкогенной тирозинкиназной активности KIT или PDGFRa и антиангиогенное действие, обусловленное подавлением факторов роста VEGFR и PDGFR. Данный препарат применяется при ГИСО, резистентных к иматинибу.
Дазатиниб (BMS-354825) - ингибитор онкогенных тирозинкиназ, KIT, PDGFR, BCR-ABL; предназначен для перорального применения.
Вопросы для самоконтроля
1. Каковы особенности эпидемиологии ГИСО?
2. Приведите клинические и морфологические характеристики ГИСО желудка.
3. Определите роль иммуногистохимической диагностики ГИСО.
4. Какие методы применяются в диагностике ГИСО?
5. Назовите основные принципы лечения ГИСО желудка.
6. В чем заключается алгоритм лечения местно-распространенных и локализованных форм ГИСО?
7. Определите роль таргетных препаратов в лечении ГИСО.
8. Каков прогноз ГИСО желудка?