Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев. 2010. - 920 с.
|
|
|
|
ГЛАВА 6 МЕТОДЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Одной из важных проблем в совершенствовании оказания специализированной медицинской помощи онкологическим больным является создание унифицированной системы стандартизации методов диагностики злокачественных новообразований. Стандарты - это нормативные документы, которые определяют требования к диагностике и лечению больного с определенным диагнозом, синдромом или при той или иной клинической ситуации. Стандартный подход к диагностике злокачественных новообразований предусматривает использование тех или иных методов с позиций их медицинской эффективности, экономической целесообразности в той или иной клинической ситуации. Однако следует отметить, что при определенных условиях возникают ситуации, когда появляется необходимость индивидуализировать подходы к диагностике, отходить от стандартов, использовать в конкретном случае методы, не предусмотренные стандартами. Принципы построения стандартов диагностики и лечения больных отражены в приказе МЗ РФ ? 3 от
03.08.99.
Диагностика онкологических заболеваний связана с применением комплекса различных методов исследований, выполняемых в ЛПУ разного уровня и профиля. Речь идет о диагностике, дающей полное представление о характере опухолевого поражения, позволяющей достаточно точно планировать специальное лечение и прогнозировать исход. Несертифицированные аппараты и низкоэффективные методы обследования в онкологии применяться не должны.
Существуют 2 основных маршрута онкологического больного до специализированной клиники (рис. 6.1): по обращаемости (обращение за медицинской помощью после появления симптомов заболевания) и при активном выявлении - скрининге (целенаправленное проведение осмотров населения с целью выявления опухоли).
 Рис. 6.1. Поликлиника онкологического дипансера
Рис. 6.1. Поликлиника онкологического дипансера
Случайное обнаружение опухолей при параллельном обследовании больного в медицинском учреждении по поводу другого заболевания также относится к выявлению новообразования по обращаемости.
Независимо от маршрута больного от медицинских работников на каждом этапе требуются полное внимание даже к малозначительным признакам, которые могут оказаться проявлением злокачественного новообразования, и правильное применение дополнительных методов обследования. При этом важно не столько использовать подряд все доступные методы, сколько обеспечить максимальную эффективность их применения. Принцип «от простого к сложному» в современном понимании изменен на «достижение конечной цели самым коротким путем».
Выявление рака в доклиническом периоде возможно, как уже говорилось выше, при активном скрининге или при случайном обнаружении. Отсутствие клинических симптомов не означает, что новообразование находится в ранней стадии развития, - возможно бессимптомное течение даже запущенного рака. Но шансы обнару-
нжить опухоль именно на ранней стадии значительно выше. Следует хорошо представлять себе разницу в этих понятиях:
• выявление новообразования в доклиническом периоде - обнаружение его до появления клинических признаков, свидетельствующих о наличии определенного заболевания;
• раннее выявление опухоли - соответствует такому моменту ее развития, когда еще нет распространения на соседние анатомические структуры, а появление местных и отдаленных метастазов маловероятно (T1-2N0M0);
• своевременное выявление - соответствует стадии развития опухоли, при которой выполнимо специальное радикальное лечение, но нет уверенности в отсутствии макро- и микрометастазирования (T1N1-2M0, T2N1-2M0);
• позднее выявление соответствует запущенной стадии развития опухоли, при которой радикальное лечение невыполнимо, а болезнь уже вошла в финальную фазу. Основные усилия врачей направляются на продление жизни больного на приемлемо качественном уровне (T3-4N0-2M0-1 или T1N3M0-1).
Скрининг может проводиться на постоянной основе в рамках ежегодной диспансеризации или как разовая акция с определенным контингентом обследуемых. Система скрининга может быть организована комплексно, с охватом различных органов и систем организма или по отдельным, наиболее вероятным локализациям новообразований. Широко известная и давно применяемая система осмотров, направленная на обнаружение патологических изменений в легких и средостении, - профилактическая флюорография. Для скрининга туберкулеза профилактическая флюорография оправданна и хорошо себя зарекомендовала, однако для скрининга рака легкого она неэффективна.
Оптимальной системой скрининга является работа с группами повышенного риска на постоянной основе. Существуют как стандартизированные программы такой работы, так и отдельные оригинальные проекты, учитывающие местные территориальные особенности.
Любое деление на группы повышенного риска по онкологическим заболеваниям обязательно учитывает:
• половозрастные характеристики (возрастной интервал с наибольшей заболеваемостью определенными опухолями у женщин или у мужчин);
• особенности жизни и труда (химические и другие виды производства, связанные с вредными выбросами, как место работы или близкого проживания);
• наличие вредных привычек (с учетом интенсивности и стажа злоупотребления табакокурением, алкоголем, токсическими веществами, наркотиками);
• наследственность (проявления онкологических заболеваний в 3-4 поколениях с учетом локализаций);
• результаты опроса, анкетирования или компьютерного тестирования, призванные выявить «сигналы тревоги».
Концентрация усилий на ограниченном контингенте обследуемых позволяет лучше распределять силы и средства профилактической медицины.
Жалобы и анамнез
Жалобы и анамнез болезни могут частично учитываться при автоматизированном скрининге по результатам анкетирования больших групп населения или подробно выясняться врачом во время индивидуального клинического обследования пациента.
Тщательность сбора жалоб и анамнеза при анкетировании зависит от удачного подбора понятных пациенту вопросов, при индивидуальном собеседовании - от подготовленности врача и его умения общаться с больным. Чтобы не пропустить какие-либо симптомы и выяснить состояние функций всех органов, расспрос больного ведется по определенной схеме. Выясняют изменения общего состояния (похудение, лихорадка, слабость, отеки, головная боль и др.), состояние дыхательной системы, ЖКТ, сердечно-сосудистой и нервной систем. Особое внимание уделяется «сигналам тревоги» и паранеопластическим синдромам.
При расспросе пациента о развитии самой болезни выясняют время наступления заболевания, характер появившихся симптомов в их хронологическом порядке, дальнейшее прогрессирование, результаты ранее выполненного обследования, эффективность проводимого лечения.
Важно выявить все клинические симптомы, указывающие на неблагополучие в каком-либо органе или в системе органов. Необходимо помнить, что игнорирование даже малозначительных признаков чревато гибелью больного вследствие отсутствия адекватного дообследования.
Применяемый в клинической практике термин «сигналы тревоги» характеризуется появлением у больного тех или иных симптомов, вызывающих у врача онкологическую настороженность.
К таким симптомам могут быть отнесены кровохарканье, желтуха, увеличение лимфатических узлов, микро- и макрогематурия, примесь крови в кале и др. При появлении «сигналов тревоги» необходимо проводить углубленное обследование больного с целью исключения диагноза онкологического заболевания.
Объективный осмотр
При объективном осмотре после оценки состояния сознания, положения больного, телосложения и общего строения тела, конституции, осанки и т.д. следует начать с самого простого - осмотра внешних кожных покровов и слизистой оболочки полости рта. Деформация конечности или другого участка тела может оказаться проявлением опухоли, растущей в мягких тканях. Под видом участков пигментации и разного вида язвочек и эрозий могут скрываться различные новообразования - меланома кожи, рак нижней губы, языка и др. Припухлости в местах расположения поверхностных лимфатических узлов (рис. 6.2) должны натолкнуть врача на мысль об их поражении.
Перкуссия и аускультация могут выявить косвенные признаки опухолей внутренних органов, пальпация помогает прощупать
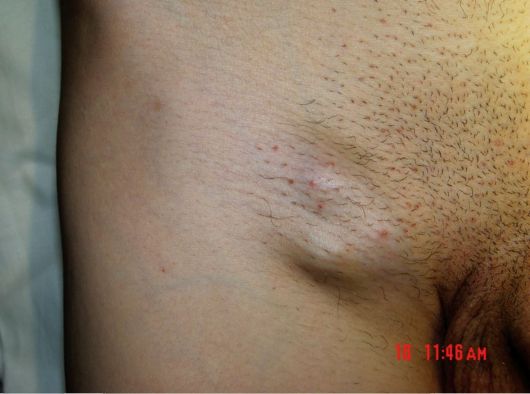 Рис. 6.2. Увеличенные паховые лимфатические узлы
Рис. 6.2. Увеличенные паховые лимфатические узлы
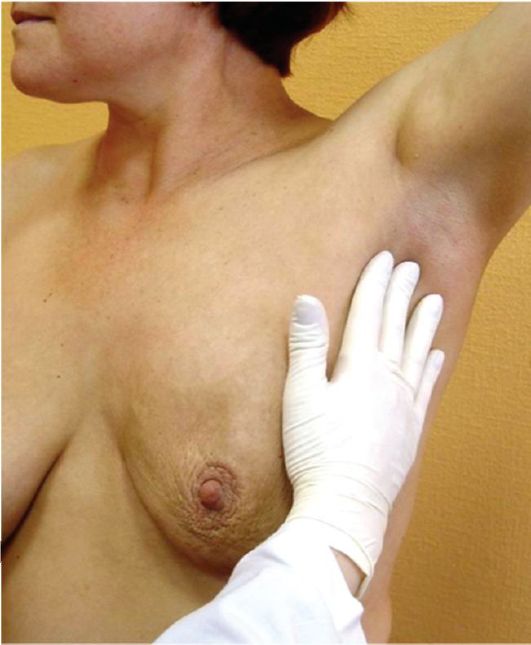 Рис. 6.3. Пальпация подмышечных лимфатических узлов
Рис. 6.3. Пальпация подмышечных лимфатических узлов
новообразования самых разных локализаций. В некоторых случаях, например при раке молочной железы, при поражении поверхностных лимфатических узлов, это самый простой и эффективный метод обследования (рис. 6.3).
Пальцевое исследование прямой кишки часто оказывается эффективным в диагностике рака этого органа и простаты. Вагинальное исследование нередко бывает весьма информативным в распознавании новообразований женской половой сферы и других органов малого таза.
Основные принципы и этапы обследования с применением методов визуализации
Основные принципы обследования продиктованы патолого-анатомическими особенностями распространения злокачественных новообразований. Общепринятая классификация злокачественных опухолей Международного противоракового союза - TNM - описывает 3 основных параметра распространения опухоли:
T - первичная опухоль;
N - регионарные лимфатические узлы;
M - отдаленные метастазы.
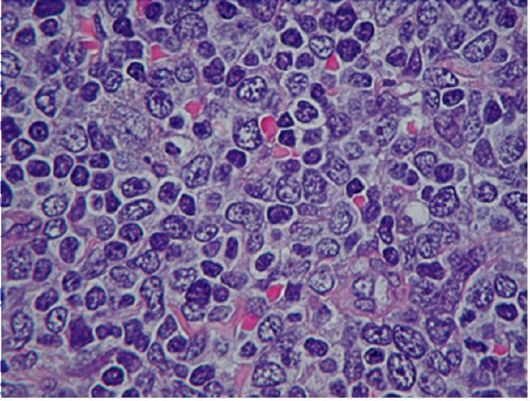 Рис. 6.4. Мантийная зона лимфатического узла. Микропрепарат
Рис. 6.4. Мантийная зона лимфатического узла. Микропрепарат
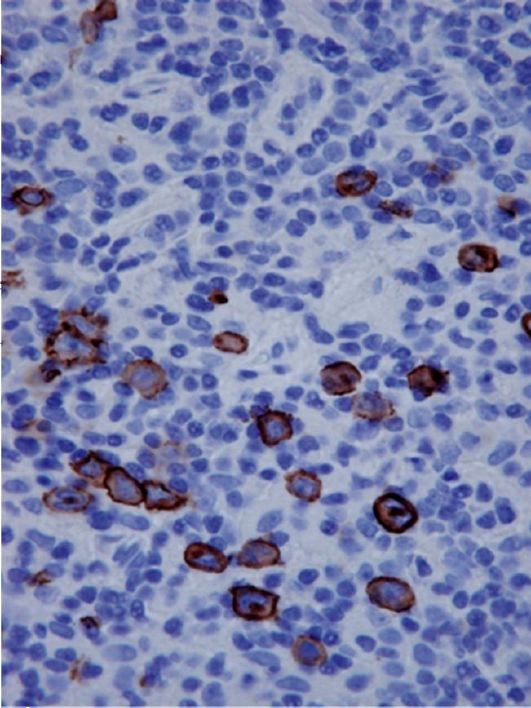 Рис. 6.5. Микропрепарат при иммуногистохимическом исследовании
Рис. 6.5. Микропрепарат при иммуногистохимическом исследовании
Для создания полного представления о распространенности новообразования необходимо получить сведения по каждой из указанных категорий.
Диагноз злокачественного или иного новообразования приобретает абсолютную точность и счи-
тается полностью доказанным только после морфологического подтверждения (верификации) с определением гистологического типа опухоли. При получении биопсийного материала в виде отпечатка или соскоба осуществляется цитологическое исследование - изучение клеток, которые могут иметь только отдельные черты злокачественности или полностью идентифицироваться по гистологическому типу опухоли (рис. 6.4 и 6.5). При получении кусочков тканей производится гистологическое исследование - изучение тканевых структур с идентификацией опухоли по ее внутреннему клеточному строению.
Для этого в реальных условиях практической медицины на каждое звено здравоохранения возлагается собственная задача:
• для общей лечебной сети - первичная диагностика, когда необходимо подтвердить или отвергнуть предположение о наличии у пациента злокачественного новообразования. При объективных затруднениях решение данной задачи осуществляется в специализированных учреждениях. Особую сложность представляют случаи, когда обнаруживаются метастазы без первичной опухоли;
• для специализированных онкологических учреждений - уточняющая диагностика, когда необходимо определить форму роста опухоли, морфологическую принадлежность последней и стадию заболевания.
Необходимо подчеркнуть, что существует только плановое целенаправленное обследование больных с подозрением на злокачественную опухоль. Экстренная диагностика не имеет такой направленности и рассчитана на обнаружение любой причины резкого ухудшения состояния больного - независимо от того, вызвано оно опухолью или другим заболеванием.
Условно в плановом обследовании больных с подозрением на злокачественную опухоль, в том числе выявленных во время скрининга, можно выделить 4 этапа.
Клинический этап - больной с обычными жалобами обращается за медицинской помощью. Как правило, онкологические заболевания не имеют патогномоничных симптомов и физикальное обследование дает лишь приблизительные данные о локализации патологического процесса - кроме «кричащих» случаев, когда явные признаки новообразования в буквальном смысле выходят наружу. Наблюдение за больным без использования необходимого обследования - это главная врачебная ошибка.
Базово-диагностический этап - применение рентгенотомографических и сонотомографических (УЗ) методов. Данный этап всегда предшествует эндоскопическому, так как применение этих методов исследования позволяет получить общее, целостное представление о состоянии пораженного органа и выделить зону диагностического интереса (ЗДИ). В большинстве случаев диагноз может считаться по меньшей мере предположительным. Последующие этапы рассчитаны на работу с ориентирами в ЗДИ, полученными при рентгенологическом или УЗ-обследовании. Завершение обследования на этом этапе допустимо при очевидных признаках запущенного рака.
Эндоскопический этап - его основу представляют визуальная диагностика, направленная на изучение внутренних органов с помощью специальных оптических приборов, и инструментальная диагностика, включающая механическое воздействие (дистанционная пальпация и раздувание воздухом) на пораженный опухолью орган изнутри и биопсию из новообразования. При отсутствии визуальных признаков опухоли биопсия производится
в ЗДИ по ориентирам, указанным рентгенологами или врачами УЗ-диагностики (УЗД). Только перед ирригоскопией сначала выполняется ректороманоскопия.
Дифференциально-тактический (аналитический) этап - завершение диагностического процесса в специализированном онкологическом учреждении с установлением окончательного диагноза и уточнением стадии заболевания; по мере необходимости для этого применяются обычные или более сложные методы исследования и дополнительные методики с сопоставлением всех полученных данных.
ПРИМЕНЕНИЕ СОВРЕМЕННЫХ МЕТОДОВ
ВИЗУАЛИЗАЦИИ ВНУТРЕННИХ ОРГАНОВ
Для визуализации, т.е. получения изображения внутренних органов, используются методы из арсенала лучевой диагностики или эндоскопии. Все они характеризуются разными показателями информативности (в %):
• точность - способность метода давать правильные заключения;
• чувствительность - способность метода давать положительный результат у лиц с конкретным заболеванием;
• специфичность - способность метода давать отрицательный ответ у лиц, не страдающих данным заболеванием.
Лучевая диагностика включает в себя методы, основанные на получении изображений, связанных с использованием различного излучения - проходящего через изучаемый объект, излучаемого им или отраженного от него.
Регистрация изображений может осуществляться в аналоговом режиме непосредственно (без компьютерной обработки) и в цифровом режиме (с так называемой цифровой компьютерной обработкой) на дисковых, бумажных и пленочных носителях.
К основным видам лучевой диагностики относятся:
• рентгенодиагностика:
- базовая;
- рентгеновская КТ (РКТ);
• МРТ:
• УКТ:
- радионуклидная диагностика.
Базовая рентгенодиагностика включает в себя рентгеноскопию (рентгенотелевизионное просвечивание на аппаратах, оснащенных усилителями рентгеновского изображения - УРИ), флюорографию, рентгенографию и линейную томографию, а также специальные приемы и методики.
Рентгенотелевизионное просвечивание применяется в двух основных областях: при контрастных исследованиях ЖКТ и с целью уточнения состояния дыхательной системы. Во время таких исследований врачом-рентгенологом за экраном рентгеновского аппарата могут выполняться рентгенограммы, называемые прицельными или обзорными - в зависимости от широты охвата изучаемого объекта. Любой вид рентгеноскопии проводится полипозиционно (с изменением положения больного и наклона стола рентгеновского аппарата) и полипроекционно (в разных проекциях прохождения рентгеновского луча через тело больного). Также под рентгенотелевизионным контролем производятся пункционные биопсии и рентгеноэндоскопические процедуры.
Рентгеноскопия верхних отделов пищеварительного тракта (глотки, пищевода, желудка и двенадцатиперстной кишки) до настоящего времени остается одним из основных методов диагностики злокачественных новообразований этих органов. В современной рентгенодиагностике все 4 перечисленных органа исследуются одновременно. Особое значение имеет возможность обнаружения опухолей с интрамуральным (внутри стенки) или экзоорганным (кнаружи от стенки органа) ростом, а также новообразований соседних органов, которые не видны при эндоскопическом исследовании.
Процедура проводится в 3 этапа: изучение рельефа слизистой оболочки, тугое наполнение и двойное контрастирование. Первая порция бариевой взвеси, принимаемая больным, дает тугое наполнение пищевода и изображение внутреннего рельефа желудка. Как только бариевая взвесь покидает пищевод, становится виден рельеф его слизистой оболочки (продольные складки) в условиях двойного контрастирования (воздух заглатывается физиологически) и потом - спавшегося органа (после прохождения воздуха). Далее врачрентгенолог добивается тугого заполнения полости желудка, для чего требуется 1-2 стакана сульфата бария. Двойное контрастирование желудка достигается приемом специальной газообразующей смеси (лимонная кислота и пищевая сода) или закачиванием воздуха по желудочному зонду. К этому моменту часть бариевой
взвеси через привратник достигает двенадцатиперстной кишки с получением фазы тугого наполнения. Для исследования рельефа слизистой оболочки выходного отдела желудка и двенадцатиперстной кишки используется так называемая дозированная компрессия специальным приспособлением (тубусом) на рентгеновском аппарате.
Пассаж бариевой взвеси по тонкой кишке - единственный метод в арсенале базовой рентгенодиагностики для изучения этого органа. Данная процедура может быть продолжением рентгеноскопии верхних отделов пищеварительного тракта или проводиться самостоятельно. Продвижение контрастной массы по кишке контролируется с помощью рентгеновского просвечивания и обзорной рентгенографии.
Ирригоскопия - контрастное исследование прямой и толстой кишок (ретроградная контрастная клизма). С помощью аппарата Боброва под контролем рентгеноскопии через прямую кишку вводят бариевую взвесь. По традиционной методике сначала получают тугое заполнение толстой кишки, для чего требуется до 4,5 л контрастной массы. После опорожнения кишечника на рентгенограммах виден рельеф слизистой оболочки. Для двойного контрастирования вновь устанавливают аппарат Боброва и вводят воздух для раздувания петель толстой кишки. На рентгенограммах видны контуры раздутого органа за счет контрастирования его стенок остатками бариевой взвеси. Существует также менее сложная процедура одномоментного двойного контрастирования толстой кишки, при которой попеременно отдельными порциями вводят бариевую взвесь и воздух. Газ, введенный в толстую кишку, расправляет ее петли и как бы прижимает бариевую взвесь к стенкам, за счет чего получается яркая картина внутреннего рельефа и всех анатомических особенностей. На одно исследование требуется до 1,5 л взвеси сульфата бария. Следует отметить, что ирригоскопии должны предшествовать пальцевое исследование прямой кишки и ректороманоскопия, осуществляемые врачом-проктологом. Злокачественное или иное новообразование может локализоваться именно в этом органе, который плохо виден при ирригоскопии. При нагнетании бариевой взвеси возможен разрыв прямой кишки со всеми вытекающими последствиями; важно, чтобы врач-рентгенолог не пропустил этот момент. Отдельного метода под названием «ирригография» не существует (иначе это означало бы заполнение толстой кишки вслепую, без рентгеноскопического
контроля), в то же время рентгенограммы толстой кишки по праву называются ирригограммами.
Выявляемые при контрастной рентгеноскопии полых органов ЖКТ основные симптомы рака одинаковы, а именно:
• органическое (стойкое) сужение просвета полого органа с его деформацией; это характерно для инфильтративной формы рака с циркулярным распространением;
• дефект наполнения любой формы (отсутствие части изображения органа в месте, занятом опухолью); такие изменения характерны для экзофитно растущих новообразований внутрь просвета органа;
• ригидность стенки на ограниченном участке (определяется при тугом наполнении и при двойном контрастировании); за таким признаком чаще всего скрывается инфильтративная форма рака, растущая в стенке органа и кнаружи от него.
Прочие симптомы хотя и имеют немаловажное значение, но доступны в основном специалистам с соответствующей подготовкой по рентгенологии. Такие признаки, как аперистальтическая зона, обрыв складок слизистой оболочки, конвергенция и дивергенция складок и другие, при отсутствии явных признаков опухолевого поражения нацеливают врача-рентгенолога на правильное заключение с привлечением особого внимания врачей-эндоскопистов к дополнительному изучению данной зоны. По косвенным рентгенологическим признакам можно предположить наличие опухоли смежного органа (сдавление извне). Классическим симптомом такого рода является развернутость подковы двенадцатиперстной кишки при раке головки поджелудочной железы за счет ее объемного увеличения в сочетании с любым из перечисленных прямых признаков, свидетельствующих о прорастании опухоли в стенку кишки.
Достоинствами рентгеноскопии являются:
• оценка функционального состояния органа;
• высокая информативность в выявлении эндофитных и экзоорганных опухолей и определении границ новообразований.
Рентгеноскопия органов грудной клетки в онкологической практике применяется как дополнительный метод исследования при дифференциальной диагностике.
Врачи-рентгенологи могут применять рентгеноскопию грудной клетки при периферических образованиях в легких, если таковые видны только на прямой рентгенограмме, но не определяются в дру-
гих проекциях, - для выбора оптимального среза линейной томографии.
Инвазивные исследования под рентгенотелевизионным контролем
проводятся в рентгенооперационных блоках или в рентгеновских кабинетах общего назначения при выполнении определенных условий по обеспечению правил асептики и антисептики, а также по оказанию экстренной помощи. Наиболее распространены различные виды пункционной биопсии из видимых при рентгеновском просвечивании областей - новообразований легких, плевры (трансторакальная пункционная биопсия) и костно-суставной системы. Процедура выполняется специально обученными врачами-рентгенологами или хирургами с помощью рентгенологов. Одним из вариантов такого врачебного сотрудничества является нанесение меток на кожу больного врачом-рентгенологом с последующей биопсией, выполняемой хирургом.
Флюорография является методом, основанным на фотографировании светящегося рентгеноскопического изображения. Термин «диагностическая флюорография» применяется в случае, если она используется взамен рентгенографии. На аналоговых аппаратах изображение фиксируется на пленку с шириной кадра 70, 100 или 110 мм. Мелкие детали на таких флюорограммах менее заметны, чем на рентгенограммах, однако общая оценка получаемой картины упрощена (например, при поиске вентиляционных расстройств в легких). На цифровых аппаратах изображение выводится на монитор, а выполнение их на пленке или на бумаге возможно с помощью принтера. Разрешающая способность цифровой флюорографии сопоставима с возможностями рентгенографии. Области применения (грудная клетка, кости черепа, шейный отдел позвоночника) любой флюорографии ограничены конструктивными особенностями аппаратов.
Рентгенография (наряду с диагностической флюорографией) широко используется в диагностике заболеваний органов грудной клетки (рис. 6.6) и костно-суставной системы. Фактически только после применения этих методов появляется предварительный диагноз злокачественного поражения.
Рентгенография выполняется рентгенолаборантом по указаниям врача-рентгенолога и может быть обзорной (охватывает весь объект) или парциальной (часть объекта). Данное исследование выполняется как минимум в двух перпендикулярных проекциях (прямой
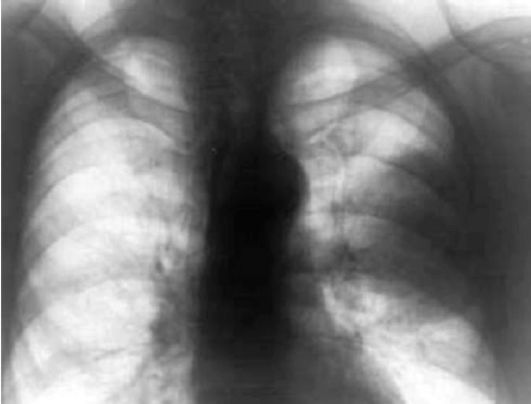 Рис. 6.6. Рак левого легкого. Рентгенограмма
Рис. 6.6. Рак левого легкого. Рентгенограмма
и боковой) в стандартных укладках (специально разработанные положения больного во время исследования для получения анатомически правильного снимка). Для выполнения этой процедуры используются горизонтальный рентгенографический стол и вертикальная (пристенная) стойка.
При изучении легочных патологических изменений выявляемые симптомы можно разделить на 5 групп:
• патологические изменения в легочной ткани: очаги и фокусы поражения - единичные или множественные (предполагают наличие периферического рака легкого или метастазов) или инфильтративные изменения (возможный признак обтурационной пневмонии, возникающей на фоне нарушения бронхиальной проходимости вследствие центрального рака легкого или параканкрозной пневмонии, окружающей периферический рак);
• вентиляционные расстройства - 3 последовательных фазы нарушения бронхиальной проходимости при центральном раке легкого и других внутрибронхиальных опухолях (гиповентиляция, клапанная эмфизема, ателектаз);
• патологические изменения корня легкого - его расширение с потерей структуры (один из признаков центрального рака легкого);
• расширение тени средостения - признак поражения медиастинальных лимфатических узлов при метастатическом поражении
или лимфопролиферативных заболеваниях, симптом опухоли средостения;
• наличие жидкости в плевральной полости и уплотнений на паракостальной или междолевой плевре - подразумевает наличие специфического метастатического плеврита или мезотелиомы плевры.
Любой из перечисленных симптомов требует уточнения при линейной томографии или при КТ и на эндоскопическом этапе обследования.
При изучении заболеваний опорно-двигательного аппарата возможно выявление следующих признаков злокачественного поражения:
• вздутие кости с ее деформацией - вероятный признак опухоли, растущей из толщи кости;
• деструкция - нарушение костной структуры губчатого или компактного вещества, разрушение кортикального слоя и нарушение непрерывности периоста - в виде очагов или сплошного поражения; данный симптом является одним из основных проявлений первичных или метастатических опухолей костей;
• остеопластические очаги или сплошная мраморная («сахарная») перестройка костной структуры - появляются, помимо мраморной болезни, при особом типе метастазирования в кости (остеобластические метастазы, напоминающие по виду остеосклероз).
Для обнаружения прочих признаков поражения костно-суставной системы требуется специальная подготовка врача-рентгенолога.
Линейная томография - доступный метод изучения тонких срезов внутренних органов при исследовании легких, средостения и костно-суставной системы. Большинство рентгеновских аппаратов оснащены томографической приставкой, смонтированной на горизонтальном рентгенографическом столе. Приставка представляет собой конструкцию, обеспечивающую согласованное движение источника излучения (рентгеновской трубки) и кассеты с рентгеновской пленкой. Геометрия аппарата позволяет выделять исследуемый слой толщиной 5-10 мм с четким изображением анатомических структур при одновременном «размазывании» выше- и нижележащей толщи объекта (эффект динамической нерезкости - как на неудачных фотографиях, сделанных при дрожащей руке фотографа).
Линейная томография применяется в диагностике:
• периферического рака легкого или опухолей плевры - для получения их четкого изображения (оценка контуров, структуры и взаимоотношений с окружающими тканями);
• центрального рака легкого - для получения изображения опухоли в корне легкого, долевого или сегментарного бронха, через который снабжается воздухом зона легкого с нарушенной вентиляцией (признаки частичной или полной обтурации бронха);
• корневой или медиастинальной лимфоаденопатии (поражение лимфатических узлов корня легкого или средостения при метастатическом поражении или лимфопролиферативном заболевании); в отличие от КТ, при линейной томографии нормальные лимфатические узлы не видны;
• опухолей костей и суставов для уточнения симптомов, обнаруженных при рентгенографии;
• опухолей гортани (наличие дополнительной ткани и деформация просвета органа).
Оптимальный томографический срез рассчитывается совместно врачом-рентгенологом и рентгенолаборантом по имеющимся рентгенограммам.
Специальные виды рентгенографии - холецистография, маммография (в том числе цисто- и дуктография), рентгенография в условиях искусственного пневмоторакса, пневмоперитонеума и пневморетроперитонеума, париетография, фистулография, некоторые рентгеноэндоскопические процедуры и др. являются прерогативой специализированных учреждений онкологического и иного профиля. Самой распространенной рентгеноэндоскопической процедурой является эндоскопическая ретроградная панкреатохолангиография (ЭРПХГ), при которой через большой дуоденальный сосок в холедох и вирсунгов проток вводят водорастворимое неионное рентгеноконтрастное вещество. Заполнение протоков контролируется при рентгенотелевизионном просвечивании. Итогом процедуры является рентгенография с получением холангиохолецистовирсунгограмм (опухолевый процесс проявляется неравномерным сужением или полным блоком пораженного протока).
Особым разделом специализированной рентгенодиагностики являются различные виды ангиографии. Эта технология основана на серийной съемке в момент прохождения введенного в сосуд водорастворимого контрастного вещества. По изменениям артерий
(артериальная фаза), контрастированию нормальных и опухолевых тканей (капиллярная фаза) и венозных сосудов (венозная фаза) судят об исходной локализации опухоли, ее размерах и распространении на окружающие ткани и магистральные сосуды. Для введения катетера в артерию по методике Сельдингера обычно используют трансфеморальный, реже - трансаксиальный и транслюмбальный доступы. Ангиографически исследуются сосуды головы и шеи, органов грудной и брюшной полости, конечностей и таза.
Прямая лимфография утратила диагностическое значение. Для исследования лимфатических узлов сегодня используются следующие методы: УЗ, изотопы, РКТ, МРТ, позитронная эмиссионная томография (ПЭТ) и прицельная пункция подозрительного лимфатического узла под УЗ-наведением.
Широко применяемым специальным видом рентгенографии является экскреторная урография: водорастворимое рентгеноконтрастное вещество вводят внутривенно (20-50 мл 60 или 76 % раствора - в зависимости от массы тела), далее у вертикальной стойки выполняют обзорные рентгенограммы мочевыводящей системы. В зависимости от выдержанного времени (от 5 мин до 1 ч) получают изображения полостной системы почек, мочеточников, мочевого пузыря.
Компьютерная томография (КТ), или рентгеновская компьютерная томография (РКТ) - рентгеновский метод исследования, основанный на компьютерной обработке данных о степени поглощения рентгеновского излучения в разных точках изучаемого пространства. КТ как бы отражает поверхностное строение атомов вещества (рентгеновскую или электронную плотность), так как поглощение рентгеновского излучения в значительной степени связано с переходом электронов с орбиты на орбиту: чем ярче выглядит ткань на КТ, тем она плотнее.
Основные части компьютерного томографа - гентри, стол, компьютер, консоль оператора (рис. 6.7). Гентри - основная считывающая информацию часть, в его отверстие (апертуру) помещается пациент. Внутри гентри имеется постоянно вращающееся кольцо большого диаметра, на котором закреплены рентгеновская трубка и одна или несколько (до 64) линеек рентгеночувствительных датчиков, которых может быть 256 и больше. Сигналы от датчиков поступают в основной компьютер, обрабатывающий информацию и создающий изображение. Стол, на котором располагается пациент, ступенчато или непрерывно втягивается в отверстие гентри. Ступенчатая подача
 Рис. 6.7. Аппараты для рентгеновской компьютерной томографии
Рис. 6.7. Аппараты для рентгеновской компьютерной томографии
необходима при пошаговом исследовании, когда задают толщину выделяемого среза и шаг томографа, а изображения выдаются с соответствующими паузами. Непрерывная подача стола происходит при спиральном (безостановочном) сканировании (вращении кольца при включенной рентгеновской трубке), когда основной компьютер стремительно обрабатывает информацию и выдает изображения в реальном режиме времени. Операторская консоль - основной пульт управления аппаратом, рабочее место рентгенолаборанта и врачарентгенолога. Современные компьютерные томографы являются одновременно спиральными (с непрерывной системой вращения), субсекундными (получение 1 среза менее чем за 1 с) и мультискановыми (оснащены несколькими линейками датчиков).
Распределение плотности черно-белого изображения на мониторе связано с поглотительными способностями различных тканей по шкале Хаунсфилда (от 0 единиц, соответствующих чистой воде, и до 1000 единиц, присущих воздуху; шкала продолжена в обе стороны, подобно шкале Цельсия на обычном термометре). Артефакты при КТ могут возникнуть на границе сред с большой разницей их плотности (металлические конструкции и естественные костные кольца - затылочное, верхняя апертура грудной клетки, позвоночный канал, малый таз и др.).
Получаемые изображения близки по анатомической сути пироговским топографическим срезам человеческого тела. В отличие от базовой рентгенодиагностики КТ позволяет визуализировать мягкие ткани и не требует искусственного контрастирования, для того чтобы увидеть внутренние органы. Но для обнаружения патологических изменений в органах и тканях, а также для корректной дифференциальной диагностики выявленных образований контрастирование является неотъемлемым техническим приемом.
Самым распространенным способом стандартного контрастирования при КТ является пероральный прием 3% водного раствора водорастворимого контрастного вещества для выделения изображений желудка и петель кишечника. Если не использовать этот прием при исследованиях органов брюшной полости и малого таза, то за опухоль можно принять обычное кишечное содержимое.
Целесообразность внутривенного контрастирования определяется клинической задачей или выясняется в процессе исследования. Как правило, внутривенное введение контрастного препарата необходимо для уточнения органопринадлежности, характера и распространенности патологического процесса. При этом особенности накопления и вымывания контрастного вещества опухолевыми массами в большинстве случаев позволяют с уверенностью говорить о злокачественном или доброкачественном характере образования, не прибегая к пункционной биопсии и другим инвазивным методам морфологической верификации. Несомненно, основное предназначение КТ - диагностика онкологических заболеваний.
Стремительно развивающиеся возможности спиральной КТ обусловили создание ряда приложений. КТ-кардиоангиография представляет собой 3-мерную визуализиацию сердца и кровеносного русла. Виртуальная КТ-эндоскопия позволяет изучать как бы изнутри трахеобронхиальное дерево, околоносовые пазухи, сосуды и толстую кишку. Не заменяя обычную эндоскопию, такая имитация продвижения по полым органам полезна в случаях, когда выполнить стандартную эндоскопию не представляется возможным. В отдельных случаях методика последующего переформатирования (Multiplanar reconstruction - MPR) изображения опухоли и прилежащих структур в интересующих специалиста плоскостях полезна при решении вопросов о тактике и объеме хирургического вмешательства.
Возможности КТ традиционно описываются по областям исследования - сверху вниз по телу человека.
Головной мозг, орбиты, кости основания и свода черепа. Для обнаружения первичных и метастатических опухолей головного мозга КТ обладает широкими возможностями. Для правильной оценки анатомических структур и выявления возможных аномалий необходимо хорошее пространственное разрешение, поэтому толщина срезов не должна превышать 5 мм. Критической зоной является стволовая часть головного мозга, замкнутая в костное кольцо и неизменно перекрываемая артефактами. Опухоли головного мозга характеризуются
патологической зоной измененной плотности определенной формы, с признаками объемного воздействия на окружающие структуры, со сдавлением прилежащих полостей и активным накоплением контрастного вещества при внутривенном контрастировании. Некоторым первичным опухолям, таким, как краниофарингиома, присуща кистозная структура. Следует отметить, что 2/3 краниофарингиом наблюдаются в первые 2 десятилетия жизни, имеют срединное расположение в хиазмально-селлярной области и составляются от 3 до 9 % всех первичных опухолей ЦНС. Тем не менее в большинстве случаев степень злокачественности выявленного новообразования удается оценить только при гистологическом исследовании после операции. Перифокальный отек, несомненно, является важным помощником в выявлении множественного метастатического поражения головного мозга, однако метастазы диаметром 0,5 см, как правило, вообще не имеют перифокального отека и могут выявляться только при внутривенном контрастировании.
В области глазниц могут встречаться невриномы зрительного нерва, опухоли ретробульбарного пространства. К сожалению, достоверными признаками злокачественности являются только разрушение костных стенок орбиты и распространение опухоли на окружающие анатомические структуры. Небольшое новообразование не может быть идентифицировано по степени злокачественности.
В костях основания и свода черепа можно обнаружить метастазы остеолитического, остеобластического или смешанного строения, имеющие те же признаки, что и в традиционной рентгенодиагностике.
Лицевой череп, придаточные пазухи носа, полость носа, носоглотка. В настоящее время КТ является ведущим методом в рентгенодиагностике новообразований носоглотки, гортани и челюстно-лицевой области. Во всех случаях исследование выполняется в двух проекциях (аксиальной и фронтальной), с толщиной томографического среза 2-3 мм, в нативном режиме и с внутривенным контрастированием в объеме 50-100 мл, при этом послойное исследование предпочтительнее спирального, так как обеспечивает более четкую визуализацию мелких костных структур. Данный метод позволяет получить ответ на вопрос, распространяется ли опухоль на лицевой скелет и основание черепа. Однако во всех этих областях нельзя с достаточной точностью отличить полип или аденоид от злокачественной опухоли даже при внутривенном контрастировании (особенно в носоглотке) до появления признаков инвазии окружающих тканей.
Шея, щитовидная железа. Хорошо визуализируются опухоли и кисты шеи, пораженные лимфатические узлы. Щитовидная железа часто перекрывается артефактами от костей верхнего плечевого пояса и редко демонстрирует свою тонкую структуру. Однако опухолевые узлы, особенно при достаточно больших размерах, видны без искажений. Легко можно проследить взаимоотношения опухоли с окружающими тканями и анатомическими зонами, в том числе с верхним средостением. В большинстве случаев требуется внутривенное контрастное усиление.
Гортаноглотка, гортань. Наиболее ценные сведения можно получить о степени экзоорганного распространения опухоли. Для уточнения границ новообразования и определения состояния крупных сосудов шеи целесообразно использовать внутривенное контрастирование. Тем не менее КТ не является методом первичной диагностики новообразований этой области, для этого достаточно фиброларингоскопии с биопсией.
Органы грудной клетки (средостение, легкие, плевра). Рентгеносемиотика заболеваний этих органов полностью совпадает с базовой рентгенодиагностикой при большей информативности КТ (те же признаки улавливаются более детально). Более точные сведения можно получить о прорастании новообразования из легкого в плевру или средостение, из плевры - в мягкие ткани и костный каркас грудной стенки, в грудные позвонки, из средостения - в обратном направлении. Кисты и опухоли данных органов визуализируются четко. При КТ видны даже неизмененные медиастинальные лимфатические узлы. Пораженные лимфатические узлы могут быть охарактеризованы по форме, размерам, плотности, склонности к конгломерации и агрессии по отношению к окружающим тканям. При этом затруднена дифференциальная диагностика гиперпластической и метастатической лимфаденопатии, отдельных видов лимфопролиферативных заболеваний и невозможна диагностика микрометастазов в лимфатических узлах. Для оценки состояния лимфатических узлов корней легких и связи опухоли с сосудами целесообразно использовать болюсное контрастное усиление по стандартным методикам. При установленном диагнозе рака пищевода КТ применяется для оценки степени распространения экзоорганного компонента опухоли в средостение. Для диагностики опухолей диафрагмы требуются дополнительные приемы (искусственный пневмоперитонеум). Кисты и опухоли перикарда доступны для КТ-диагностики; новообразования
миокарда могут диагностироваться этим методом при применении КТ-ангиографии (приоритет остается за УЗИ и МРТ).
Органы брюшной и забрюшинной локализации. Условно данная область исследования продолжается от куполов диафрагмы до гребней подвздошных костей (толщина среза 7-10 мм). Многообразие проявлений опухолевых и опухолевидных поражений печени обусловливает сложность их дифференциальной диагностики. Решающее значение в уточненной диагностике новообразований печени принадлежит 4-фаз- ному исследованию с болюсным внутривенным контрастированием.
Первичные и метастатические опухоли печени (рис. 6.8) имеют вид округло-овальных узловых образований пониженной плотности, как правило, хорошо накапливающих контрастное вещество. Причем диффузное гетерогенное контрастирование всего объема опухоли в артериальную фазу характерно для гепатоцеллюлярного рака, в то время как при фокальной нодулярной гиперплазии контрастное вещество накапливается гомогенно. Характерный для метастазов симптом «ободка» в большинстве случаев также наиболее отчетливо определяется в ранние фазы внутривенного контрастирования. Отдифференцировать гемангиомы от прочих новообразований печени можно по наличию «глыбчатого» усиления по периферии очага, медленно нарастающего и переходящего в почти полное контрастирование всего очага к отсроченной фазе. Липомы имеют отрицательные значения плотности; других предположений при этом нет.
Менее очевидна диагностика рака поджелудочной железы, так как этот вид опухоли имеет изоденсивную плотность и при внутривен-
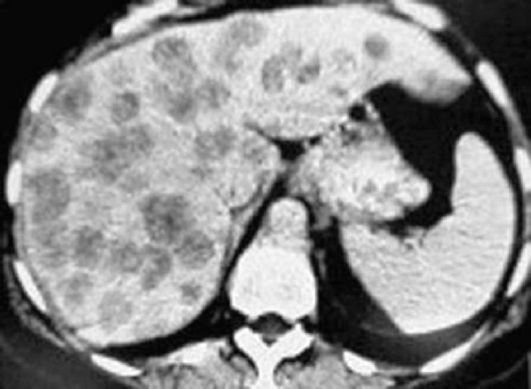 Рис. 6.8. Метастазы рака желудка в печень. Компьютерная томограмма
Рис. 6.8. Метастазы рака желудка в печень. Компьютерная томограмма
ном контрастировании меняет свои свойства одинаково с непораженной паренхимой органа. При раке головки поджелудочной железы обнаруживаются признаки механической желтухи в виде расширения внутри- и внепеченочных желчных протоков, застойного желчного пузыря, блока холедоха на уровне опухоли. Дополнительными симптомами опухоли в любой части железы являются ее объемное увеличение, отсутствие дифференциации с окружающими тканями, признаки прорастания в соседние органы.
Селезенка может быть патологически изменена при системных лимфопролиферативных заболеваниях, новообразованиях печени и некоторых других процессах, что проявляется в виде спленомегалии. Очаговые изменения округлой формы характерны для метастатического поражения. Первичные опухоли селезенки не имеют правильной округлой формы, значения плотности - гиподенсивные, структура - однородная.
Надпочечники в норме треугольной формы. Увеличение их размеров и округление формы при «мягкотканой» плотности >15 единиц по шкале Хаунсфилда указывают на опухолевую природу изменений - от аденомы до злокачественного поражения, без полной уверенности в дифференциальном диагнозе. Диагноз устанавливают после сопоставления данных УЗИ, КТ (структурные и денситометрические характеристики) и клинико-лабораторных показателей.
Опухоли паренхимы и полостной системы почек диагностируют с высокой достоверностью, особенно при оптимальном применении внутривенного «усиления». Обычно они оцениваются как объемное образование неправильной округлой формы с гиподенсивными значениями плотности, с признаками инвазивного роста. При контрастном усилении плотность опухоли быстро увеличивается из-за хорошей васкуляризации.
Для оценки состояния мочеточников, как правило, необходимо их антеградное и ретроградное контрастирование.
Малый таз. В диагностике новообразований малого таза КТ способна дать информацию о распространенности злокачественного процесса в случае уже установленного диагноза, но при первичной и дифференциальной диагностике возможности ее ограничены, особенно при раке шейки, вульвы, тела матки, яичников, простаты, прямой кишки в стадиях Т1-2 и в некоторых случаях - в стадии Т3. Хорошие результаты удается получить при оценке метастатического поражения тазовых лимфатических узлов. Приоритет в дифференциальной
диагностике новообразований этих органов принадлежит базовому и специализированному УЗИ и МРТ.
Костно-суставная система. КТ является эффективным методом оценки состояния крупных плоских и длинных трубчатых костей, превосходящим по возможностям базовую рентгенодиагностику. Оценка состояния суставов в целях онкологической диагностики с помощью КТ также эффективна, а для других целей, как правило, используется МРТ. Исследование мелких и тонких костей сопряжено с техническими трудностями и менее результативно.
При диагностике первичных костных опухолей КТ позволяет получить изображения не только эндооссального (внутрикостного) компонента и периоста, но и экзооссального (внекостного) мягкотканого компонента опухоли. В некоторых случаях обнаружение внешнего компонента имеет решающее значение при дифференциальной диагностике опухолевой, диспластической и воспалительной патологии. Проще, чем при базовой рентгенодиагностике, оценка остеолитических (результат деятельности клеток-остеокластов) и остеобластических (последствия работы остеобластов) изменений, особенно в случае их сочетания. В диагностике опухолей мягких тканей немаловажным преимуществом КТ является возможность определения их взаимоотношений с костями и суставами. В обоих случаях приобретается ценная информация о границах распространения опухоли и ее контакте с другими анатомическими структурами. При диагностике метастазов действуют те же принципы, что и при исследованиях первичных опухолей.
Магнитно-резонансная томография (МРТ) относится к неионизирующему (т.е. практически безвредному) методу лучевой диагностики, основанному на использовании физического явления, называемого ядерно-магнитным резонансом (ЯМР).
Физическая основа метода - регистрация радиоволн, излучаемых намагниченными атомами водорода после воздействия на них внешнего радиоволнового сигнала, и компьютерная обработка данных. Контрастность тканей на МРТ отражает особенности ядерных структур вещества. Одна и та же ткань может на одной МРТ получиться темной, на другой - светлой, что зависит от выбора формы облучающего сигнала или импульсной последовательности. Напряженность («мощность») магнитного поля, создаваемого тем или иным аппаратом, определяет его основные технико-диагностические возможности: чем выше напряженность, тем шире возмож-
ности. Наиболее распространены МР-томографы с напряженностью 0,23-0,5-1,0-1,5 Тл. В высокоспециализированных научных центрах встречаются установки с мощностью 1,5-3,0 Тл.
Основными компонентами любого МР-томографа (рис. 6.9) являются: магнит (постоянный, электрический резистивный или сверхпроводящий - создает постоянное магнитное поле, в которое помещают пациента); градиентные катушки (создают слабое переменное градиентное магнитное поле в центральной части постоянного поля - для выбора области исследования); радиочастотные катушки (передающие и приемные); компьютер (управление работой градиентных и радиочастотных катушек, регистрация сигналов, обработка данных, реконструкция томограмм).
Диагностические преимущества МРТ (по сравнению с другими методами получения изображения) основаны на возможности построения анатомических изображений с учетом нескольких физических параметров, в частности, протонной плотности, времени релаксации Т1 и Т2, что в сочетании с применением большого количества разнообразных импульсных последовательностей (протоколов исследования) почти всегда позволяет выявить различия в отображении нормальных и патологически измененных тканей, особенно если применяются методики внутривенного введения специальных, парамагнитных контрастных препаратов, изменяющих физические параметры исследуемых органов и тканей (время
 Рис. 6.9. Аппарат для магнитно-резонансной томографии
Рис. 6.9. Аппарат для магнитно-резонансной томографии
релаксации и магнитную восприимчивость). Все остальные базовые диагностические методы обеспечивают построение анатомических изображений на основе лишь одного физического параметра: при УЗИ - это эхогенность тканей, при рентгенографии и РКТ - коэффициент поглощения рентгеновских лучей, при радионуклидных исследованиях - интенсивность (энергия) гаммаизлучающих или позитронизлучающих радионуклидов.
Отдельный вид исследований - МР-спектроскопия; она используется только в крупных научно-исследовательских учреждениях с целью оценки концентрации различных веществ в органах и тканях.
С помощью МРТ в медицинских целях можно получить изображения органов и тканей, содержащих какое-либо количество воды (возбуждение атомов водорода). Образования, не содержащие воду или углерод, на МРТ не отображаются. Это следует иметь в виду при изучении изменений, которые сопровождаются образованием кальцинатов. Технические препятствия могут возникнуть при исследовании больных с кардиостимуляторами и металлическими протезами (в том числе зубными). В мощном магнитном поле возможно нагревание металлических предметов до критических температур. В настоящее время созданы специальные сплавы, не имеющие такого недостатка; качество металлических конструкций подтверждается специальным сертификатом.
Во время процедур могут возникать и другие артефакты: физиологические (связанные с поведением пациента или движением внутренних органов), системные (искажения по методам построения изображений) и аппаратные (связанные с измерительной аппаратурой).
Технически МРТ не связана с жесткой необходимостью выполнять исследование только в одной плоскости. Возможности метода позволяют выстраивать диагностическую картину в любой произвольно определяемой плоскости, что значительно повышает наглядность отображения патологических процессов в сложных анатомических областях и облегчает их топическую диагностику (например, в гепатопанкреатодуоденальной области).
Выработанный с годами алгоритм исследования предусматривает построение поперечных (аксиальных) срезов, как при КТ, с дополнительными изображениями во фронтальной, сагиттальной и косых плоскостях. В последние годы подобные возможности появились и у КТ - специальные программы обработки изображений
в режиме мультипланарной (многоплоскостной) и 3-мерной реконструкции. Однако дифференциация тканей (контрастное отображение каждого тканевого слоя) гораздо лучше видна при МРТ.
По ряду показателей (точность, чувствительность и специфичность) МРТ превышает информативности КТ в одних областях на 1-2 %, в других - на 40 % и более. Известны успехи применения МРТ в диагностике заболеваний ЦНС, сердечно-сосудистой и костно-суставной систем, органов малого таза. Почти равные возможности демонстрируют КТ и МРТ в оценке состояния паренхиматозных органов брюшной полости и забрюшинного пространства, больших плоских костей, лимфатических узлов таза, шеи, грудной полости. В исследованиях этих областей данные методы являются конкурентными. В то же время в изучении стволовой части головного и всего спинного мозга, сердца и сосудистых структур (в том числе головного мозга), конечностей (особенно суставов), органов малого таза преимущество принадлежит МРТ. Вполне объяснимо стремление ЛПУ иметь в своем арсенале оба аппарата.
Наиболее часто в онкологической практике МРТ необходима для дифференциальной диагностики первичных и вторичных опухолей ЦНС (ствол и спинной мозг), сердца и перикарда, позвоночника.
Ультразвуковая диагностика (УЗД, сонотомография) стала одним из ведущих методов лучевой диагностики. Физической основой данного метода является получение изображения от отраженного органами и тканями УЗ-сигнала. В УЗД используются продольные УЗ-волны, в которых направление смещения отдельных частиц среды параллельно направлению распространения волн. В УЗД-системах используется эхолокационный принцип получения информации об органах и структурах, при котором сначала излучаются акустические сигналы, а потом принимаются сигналы, отраженные от границы разных по акустической плотности структур. Принятые сигналы обрабатываются, и строится изображение. Излучателем и воспринимающей системой одновременно служат специальные датчики, работающие на разной частоте УЗ-сигнала. Диапазон частот ультразвука, используемых в медицинской диагностике, лежит в пределах от 1 до 30 МГц и выше. К одному аппарату (рис. 6.10) прилагается несколько датчиков разного назначения и частоты:
• для исследования органов и тканей живота таза (2,5-5 МГц);
• для поверхностно расположенных органов и тканей (5-12 МГц);
 Рис. 6.10. Аппарат для ультразвукового исследования
Рис. 6.10. Аппарат для ультразвукового исследования
• для исследования сердца с радиусом кривизны 10-20 мм (2,5- 5 МГц);
• внутриполостные, интраоперационные лапароскопические и торакоскопические датчики (5-7,5 МГц);
• эндоскопические чреспищеводные (5-10 МГц);
• внутрисосудистые (10-20 МГц),
• трансуретральные (до 30 МГц) и др.
В основе конструкции датчиков лежит пьезоэлектрический эффект: способность преобразовывать электрические сигналы в ультразвуковые при излучении сигналов и, наоборот, УЗ-сигналы в электрические при приеме сигналов.
С прохождением через ткани тела человека интенсивность передаваемого УЗ-сигнала постепенно уменьшается - эффект затухания УЗ-волн. К датчику поступает непоглощенная часть УЗ-сигнала, оставшаяся нерассеянной. Скорость прохождения УЗ в биологических тканях зависит от их сопротивления - импеданса. На границе мягких тканей и газа или мягких и костной тканей сигнал почти полностью отражается. Поэтому препятствием для УЗ служат раздутые газом петли кишечника, воздушная легочная ткань, костные структуры.
Основой допплеровских методов УЗД является эффект Допплера, который состоит в том, что частота колебаний звуковых волн, излучаемых источником (передатчиком) звука, и частота этих же звуковых волн, принимаемых приемником звука, отличаются, если приемник и передатчик движутся друг относительно друга (сближаются или удаляются). Тот же эффект наблюдается, если в приемник поступают сигналы источника звука после отражения движущимся отражателем. Это происходит при отражении УЗ-сигналов от движущихся биологических структур - элементов крови.
Современные УЗ-приборы обеспечивают следующие допплеровские режимы:
• цветовое допплеровское картирование (ЦДК);
• энергетическое допплеровское картирование (ЭДК);
• допплеровскую визуализацию тканей и 3-мерное ЦДК и ЭДК или 3-мерную ангиографию.
Эти режимы позволяют выявлять в патологическом образовании сосуды, их количество, характер кровотока (линейный, извитой), определять взаимосвязь патологического образования с магистральными сосудами (сдавление, инфильтрация, врастание) и измерять спектральные показатели - скорость кровотока, пульсационный индекс, индекс резистивности.
УЗ-методы принято делить на скрининговые, базовые и специальные. Скрининговые направлены на выявление патологических участков, базовые ограничиваются изучением состояния органов брюшной и забрюшинной локализации, щитовидной и молочных желез, лимфатических узлов; специализированные (интервенционные) методы - внутриполостные, внутрисосудистые, интраоперационные, лапароскопические, сопровождающие пункцию, дренирование, термоаблацию, брахитерапию.
УЗД используется при исследовании органов живота, малого таза, поверхностно расположенных органов и тканей (лимфатических
узлов, щитовидной, слюнных, молочных желез, мягких тканей). Сегодня УЗ-методу доступны: верхнее средостение, плевральная полость, легкое (субплевральные образования), кости (кортикальный слой и внекостный компонент опухоли).
Таким образом, УЗД все активнее используется в онкологии и призвана решать ряд задач:
- выявление новообразования;
- дифференциальная диагностика;
- определение распространения опухоли на соседние органы, ткани и магистральные сосуды;
- выявление отдаленных метастазов;
- динамический контроль за эффективностью лечения;
- выявление послеоперационных изменений и осложнений;
- сопровождение и контроль в реальном времени интервенционных вмешательств.
Радионуклидная диагностика (РНД) - группа методов, основанная на регистрации изображений от объектов, излучающих гамма-кванты. Чтобы человеческий организм стал источником гамма-излучения, в него вводят радиофармацевтические препараты (РФП), различные химические или биологические субстанции, меченные радионуклидами. Органотропные РФП распределяются преимущественно в пределах органов и систем, изображение которых необходимо получить. В онкологической практике особое место занимают туморотропные препараты, позволяющие с высокой специфичностью визуализировать очаги злокачественной опухолевой ткани во всем организме обследуемого пациента. С другой стороны, радионуклидный метод, обладая ограниченным пространственным разрешением, имеет сравнительно невысокую чувствительность при выявлении опухолевых очагов. Одно из основных предназначений РНД - оценка функции органов и систем.
Современной аппаратурой для РНД является эмиссионный компьютерный томограф (рис. 6.11), который позволяет проводить все виды радионуклидных исследований: функциональные (в том числе синхронизированные с ЭКГ), сканы «всего тела», томографию (однофотонная эмиссионная компьютерная томография - ОФЭКТ), прицельную планарную сцинтиграфию в любых проекциях. Для улучшения топической локализации выявляемых при ОФЭКТ патологических очагов в последние годы разработан и внедрен в клиническую практику эмиссионный томограф, совмещенный со спиральным
 Рис. 6.11. Гамма-камера
Рис. 6.11. Гамма-камера
рентгеновским томографом (ОФЭКТ-РКТ). Математическое наложение на одном срезе «функциональной» информации радионуклидного исследования на анатомо-топографическое изображение, полученное при рентгеновской томографии, значительно повышает эффективность лучевой диагностики.
К наиболее распространенным функциональным радионуклидным исследованиям в онкологии относятся динамическая реносцинтиграфия (оценка секреторно-экскреторной функции мочевыделительной системы), динамическая гепатография (оценка поглотительно-выделительной функции гепатобилиарной системы), равновесная вентрикулография, синхронизированная с ЭКГ (оценка насосной функции желудочков сердца).
Самым распространенным гамма-топографическим исследованием является сканирование скелета (рис. 6.12) с целью выявления метастазов в костную систему. Актуальными остаются исследования с такими органотропными РФП, как 99тТс-пертехнетат и 1231-натрия йодид (сцинтиграфия щитовидной железы), коллоиды, меченные 99тТс (лимфосцинтиграфия: лимфокартирование и поиск «сторожевого» лимфатического узла), меченный 99тТс макроагрегат альбумина человеческой сыворотки (исследование перфузии легких при диагностике тромбоэмболии легочной артерии), 99mTc-HMPAO (исследование перфузии головного мозга). К наиболее широко известным исследованиям с тумотропными РФП относятся
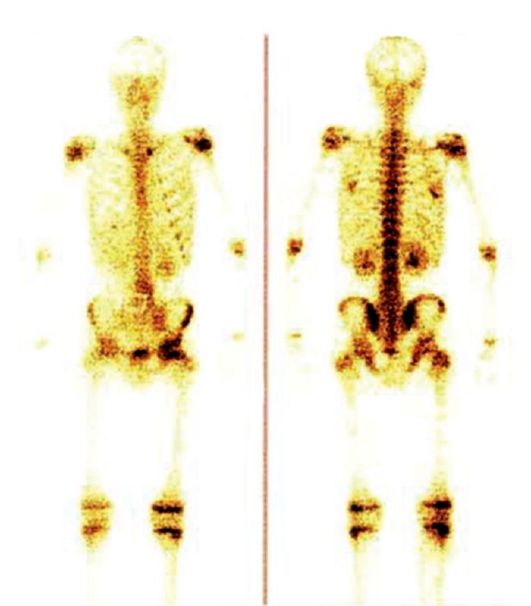 Рис. 6.12. Метастазы рака молочной железы в кости. Сканограмма
Рис. 6.12. Метастазы рака молочной железы в кости. Сканограмма
сцинтиграфия с 67ва-цитратом (диагностика злокачественных лимфом), с 1231-метайодбензилгуанидином (МИБГ) (диагностика нейробластомы, феохромоцитомы и параганглиомы), с 1111п-октреотидом (диагностика карциноидов, нейроэндокринных опухолей поджелудочной железы), с 99тТе-технетрилом (MIBI) (диагностика опухолей молочной железы, аденомы и рака паращитовидных желез).
Чрезвычайно перспективным направлением РНД является позитронная эмиссионная томография (ПЭТ). Соответствующие томографы основаны на использовании испускаемых радионуклидами позитронов (испускаемый протон сразу же реагирует с ближайшим электроном в реакции аннигиляции; излучаемые при том 2 гамма-фотона регистрируются двумя детекторами). Для производства радионуклидов на ПЭТ используются циклотроны. Данный вид томографии позволяет подробно изучать скрытые метаболические процессы.
Это - метод томографического исследования всего тела с использованием РФП, меченных позитронно-излучающими радионуклидами (18F, 11C, 13N, 15O). Исследования проводят на специальных ПЭТ, которые в современных моделях совмещены с РКТ. Из РФП для ПЭТ в настоящее время чаще всего применяется
18F-фтордеоксиглюкоза (^F-ФДГ), интенсивное накопление которой в опухолевых очагах (рис. 6.13) обусловлено их повышенной гликолитической активностью. ПЭТ с ^F-ФДГ наиболее эффективна при обследовании больных немелкоклеточным раком легкого, раком толстой кишки, со злокачественными лимфомами, меланомой, плоскоклеточным раком органов головы и шеи, а также раком пищевода, молочной железы, щитовидной железы и шейки матки. Для диагностики других злокачественных новообразований разрабатываются новые РФП: 11С-холин (рак предстательной железы), 11С-метионин (опухоли головного мозга), 18F-DOPA (меченый фенилаланин для диагностики нейроэндокринных опухолей).
Существует условное деление методов получения диагностических изображений на 3 уровня по рекомендациям ВОЗ (Серия технических докладов 795), позволяющее судить об оснащенности медицинских учреждений, но не об их специализированности.
Уровень I:
• стандартная рентгенография;
• УЗИ общего назначения;
• линейная томография;
• рентгенотелевизионное просвечивание.
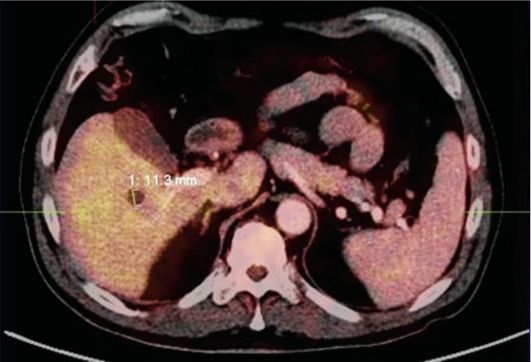 Рис. 6.13. Гемангиома печени. Позитронно-эмиссионная томограмма
Рис. 6.13. Гемангиома печени. Позитронно-эмиссионная томограмма
Уровень II:
• специальные методики рентгенографии;
• допплерография и другие специальные методики УЗИ;
• маммография;
• ангиография;
• КТ;
• радионуклидная сцинтиграфия. Уровень III:
• МРТ;
• ПЭТ;
• иммуносцинтиграфия.
С учетом возможностей эндоскопических методов обследования для уточнения диагноза злокачественного новообразования достаточно располагать средствами только I или I и II уровней. Большинство ЛПУ первичного звена здравоохранения имеют средства I уровня.
Эндоскопические методы визуализации прочно вошли в арсенал средств современной диагностики злокачественных новообразований. Возможности эндоскопии вышли далеко за границы только осмотра полых органов. При использовании сочетанных с эндоскопией лучевых методов диагностики, таких, как рентгенологический и ультразвуковой, стали доступны для исследования и проведения лечебных мероприятий органы и ткани, прилежащие к ЖКТ. Таким образом, современная эндоскопия основана на получении непосредственных изображений просвета полых внутренних органов: с помощью эндоскопического ультразвука - стенки и окружающих ЖКТ органов, с помощью рентгенологических методов - контрастирование трубчатых структур (протоки поджелудочной железы и печени).
Для эндоскопических исследований применяются видеоэндоскопы, с помощью которых возможно получение изображения с высоким разрешением; некоторые из них оснащены специальным оптическим устройством, благодаря которому возможно получение максимально увеличенного изображения. Изображение выводится на монитор и может быть оцифровано, после чего оно становится доступным для дополнительной компьютерной обработки и электронного архивирования.
Гибкий эндоскоп имеет специальные каналы для введения воздуха, орошения жидкостями, а также инструментальный канал. Для проведения лечебных мероприятий имеются специальные эндо-
скопы, оснащенные дополнительными рабочими каналами. Для получения эндоскопического УЗ-изображения на дистальном конце эндоскопа располагается датчик, который сканирует внутренние органы из просвета пищевода, желудка, двенадцатиперстной или толстой кишки.
Для подтверждения злокачественной природы выявленного новообразования необходимо морфологическое исследование ткани. В настоящее время имеется ряд способов получения материала для исследования: биопсия, браш-биопсия, тонкоигольная пункция.
Биопсия проводится с помощью специальных эндоскопических щипцов, она позволяет получать фрагменты опухолевой ткани при обычном эндоскопическом исследовании. При браш-биопсии специальная щеточка соскребает поверхностные слои с опухолевых масс. Особенно актуально это исследование, когда провести эндоскоп до необходимой области не представляется возможным. С помощью тонкоигольной пункции возможно получение материала из прилежащих к ЖКТ органов, например из новообразования и лимфатических узлов средостения, верхнего этажа брюшной полости, поджелудочной железы.
Применение жестких эндоскопов остается оправданным в проктологической практике (ректороманоскопия), в анестезиологии (ларингоскопия) и некоторых других «узких» областях.
Наиболее широко применяемый метод - эндоскопическое исследование верхних отделов (ЭВО) ЖКТ. Эндоскопическое исследование пищевода позволяет диагностировать большинство видов опухолей этого органа, получить косвенные признаки новообразований средостения и поражения лимфатических узлов, которые уточняют и детализируют при эндосонографии. В диагностике опухолей желудка обязательный прием - раздувание его воздухом для выявления ригидных участков; метод высокоэффективен в распознавании экзофитных опухолей. При эндосонографии стенки желудка, пораженной опухолью, возможно дооперационное стадирование по Т-критерию, что важно при прогнозировании течения заболевания. Те же закономерности действуют в диагностике рака двенадцатиперстной кишки и большого дуоденального соска. Хорошим подспорьем служат предварительные результаты рентгеноскопии желудка, четко указывающие на ригидные участки стенки пищевода, желудка или двенадцатиперстной кишки. Выполненная по таким ориентирам биопсия часто обеспечивает успешную верификацию процесса. ЭВО ЖКТ позволяет
получить косвенные признаки рака головки поджелудочной железы или явные признаки его прорастания в двенадцатиперстную кишку, что является показанием к проведению эндосонографии панкреатобилиарной зоны, во время которой можно выявить опухолевый очаг, измерить его, оценить распространение на окружающие органы и сосуды, что важно при выборе тактики лечения. Возможно выполнение тонкоигольной пункции с целью получения материала для цитологического исследования.
Видеобронхоскопия (ВБС) включает в себя общий осмотр трахеобронхиального дерева до субсегментарных бронхов, а также целенаправленное изучение патологически измененных бронхов. Один из обособленных видов такой процедуры - видеоларингоскопия (ВЛС), которую можно осуществлять специальным прибором - фиброларингоскопом или обычным фибробронхоскопом. В диагностике центрального эндобронхиального (экзофитного) рака легкого успех ВБС обеспечен даже при малых размерах опухоли. При перибронхиальном раке (узловом или разветвленном), характеризующемся подслизистым ростом, диагноз устанавливают по косвенным признакам с учетом рентгенологических данных. Косвенными симптомами проявляют себя опухоли и кисты средостения, пораженные лимфатические узлы.
Торакоскопия - широко применяется как вариант видеоторакоскопии. Через небольшой разрез в межреберном промежутке в грудную полость вводят эндоскоп для осмотра париетальной и висцеральной плевры (частично - парамедиастинальной), поверхности легкого. Метод позволяет обнаружить и верифицировать опухоли и даже мелкие метастатические узлы на плевре, выполнить краевую биопсию ткани легкого.
Медиастиноскопия предназначена для изучения средостенных лимфатических узлов. Исследование проводится под наркозом, через разрез над яремной вырезкой грудины или в парастернальной области между I-III ребрами, захватывает только переднее средостение. Метод применяется при отсутствии четких данных о состоянии лимфатических узлов средостения и иных проявлений заболевания в других органах и системах. Не имеет больших преимуществ перед диагностической торако- и медиастинотомией.
Лапароскопия (ЛПС) выполняется жестким лапароскопом по устаревшей методике или гибким аппаратом в современном варианте видеолапароскопии (рис. 6.14). Осмотру подлежат органы брюшной полости и малого таза, не требующие инвазивного внутреннего
 Рис. 6.14. Лапароскопия. Этап подготовки к обследованию
Рис. 6.14. Лапароскопия. Этап подготовки к обследованию
доступа через анатомические структуры (нижняя поверхность печени, париетальная и висцеральная брюшина, часть кишечника, часть женской половой сферы). Основное предназначение ЛПС - поиск отдаленных метастазов, брюшинных или других внеорганных опухолей с последующей биопсией. Может быть совмещена с лечебным пособием при резектабельных новообразованиях; как самостоятельный хирургический метод используется при раке желчного пузыря, для удаления яичников (овариэктомия), при раке почек, толстой кишки, молочной железы.
Эндоскопическое исследование нижних отделов (ЭНО) ЖКТ - надежный метод диагностики заболеваний толстой кишки, охватывающий ее на всем протяжении. Исследование позволяет обнаруживать органические стенозы, в том числе вызванные эндофитным раком, и экзофитные опухоли, производить их биопсию. Как правило, ЭНО ЖКТ применяется после ирригоскопии по полученным рентгенологическим ориентирам. Для облегчения осмотра петли кишки раздуваются воздухом. Могут быть обнаружены признаки сдавления кишки извне опухолью другого органа или лимфатическими узлами. В лечебных целях используется для полипэктомии.
Эндоскопическая ретроградная панкреатохолангиография (ЭРПХГ) - эндоскопический сочетанный с рентгенографией метод диагностики и лечения заболеваний органов панкреатобилиарной зоны, в основе которого лежит введение контрастного вещества в желчевыводящие и панкреатический протоки, а при наличии механической желтухи - проведение лечебных мероприятий для ее устранения.
Цистоскопия используется в диагностике опухолей мочевого пузыря; в комбинации с хирургической эндоскопической системой (видеорезектоскоп) позволяет производить малотравматические операции.
Отдельные патологические процессы могут изучаться с помощью других комбинированных процедур (исследование кишечника через колостому, осмотр широкого свищевого хода или введение в свищевой ход рентгеноконтрастного вещества с последующей рентгенографией и др.).
Таким образом, современная эндоскопия - это мощный диагностический и лечебный комплекс, который призван выявлять новообразования, получать материал для морфологического исследования, определять на дооперационном этапе стадию опухолевого процесса, эффективно проводить малоинвазивные лечебные вмешательства.
Обязательный клинический минимум обследования в амбулаторных условиях
На догоспитальном этапе обследования больных с новообразованиями различной локализации должны быть использованы все доступные методы исследования в соответствии с общепринятыми алгоритмами. Каждому больному должны быть выполнены анализы крови и мочи: общий или специальный - в зависимости от патологии. До направления пациента в специализированное учреждение производят ЭКГ, флюорографию или рентгенографию легких, УЗИ брюшной полости, забрюшинного пространства и малого таза - для исключения сопутствующих заболеваний. Женщин осматривает гинеколог. Пациенту выдают все снимки и копии протоколов проведенных исследований.
Диагностика опухолей трахеи, бронхов и легких - полипроекционная флюорография или рентгенография легких, рентгеноскопия (по показаниям), линейная томография патологического образования в паренхиме или в корне легкого, фибробронхоскопия с биопсией (при наличии кабинета).
Диагностика опухолей щитовидной железы - УЗИ органов шеи.
Диагностика опухолей пищевода, желудка и двенадцатиперстной кишки - рентгеноскопия данных органов (с прицельной рентгенографией), фиброгастроскопия (фиброэзофагоскопия, фибродуоденоскопия).
Диагностика опухолей молочной железы - маммография, УЗИ молочных желез.
Диагностика опухолей гепатопанкреатодуоденальной зоны - УЗИ данной области, рентгеноскопия желудка и двенадцатиперстной кишки, КТ (по возможности), холецистохолангиография (по показаниям), ЭРПХГ (по возможности, по показаниям), фиброгастродуоденоскопия.
Диагностика опухолей толстой кишки - пальцевое исследование прямой кишки, ректороманоскопия, ирригоскопия, фиброколоноскопия с биопсией (по возможности).
Диагностика опухолей тонкой кишки - пассаж бариевой взвеси по кишечнику, УЗИ брюшной полости.
Диагностика лимфопролиферативных (системных) заболеваний - рентгенография легких в 2-3 проекциях, линейная томография средостения с контрастированием пищевода, УЗИ брюшной полости, забрюшинного пространства и малого таза.
Диагностика опухолей костно-суставной системы - рентгенография костей и суставов в двух проекциях в соответствующей области. При исследовании костей рук и ног исследуют и здоровую сторону (для сравнения). Для исключения миеломной болезни выполняют обзорную рентгенографию ребер, рентгенографию черепа в двух проекциях, рентгенографию костей таза (прямую).
Диагностика опухолей мочевыводящей системы - УЗИ почек и органов малого таза, экскреторная урография (цистография), цистоскопия.
Диагностика опухолей малого таза у мужчин и у женщин - базовое УЗИ, трансректальное и трансвагинальное УЗИ (по возможности).
Лабораторные исследования: изменения
периферической крови, биохимические
и иммунологические тесты. Опухолевые маркеры
Лабораторные методы исследования в онкологии используются достаточно широко, но следует отметить, что на сегодняшний день отсутствуют тесты, позволяющие установить диагноз злокачественного новообразования.
Изменения периферической крови (рис. 6.15, 6.16) у онкологических больных являются неспецифичными: наблюдаются ускорение СОЭ >30 мм/ч, лейкопения или лейкоцитоз, лимфопения, тромбоцитопения или тромбоцитоз, анемия.
 Рис. 6.15. Взятие крови у пациента
Рис. 6.15. Взятие крови у пациента
 Рис. 6.16. Вакутайнеры для взятия крови
Рис. 6.16. Вакутайнеры для взятия крови
У больных со злокачественными новообразованиями формируются различные нарушения реологических свойств крови, выражающиеся в колебаниях ее вязкости, гиперагрегации эритроцитов, снижении их деформируемости. Эти нарушения сопровождаются гиперкоагуляцией, изменениями в системе эритрона и эндогенной
интоксикацией. Эритрон - совокупность всех эритроидных клеток костного мозга и крови - служит для транспорта кислорода из альвеолярного воздуха в ткани. Изменение структуры и функции эритрона - один из паранеопластических синдромов, который относится к числу наиболее закономерных и ранних гематологических нарушений при злокачественном росте. При этом возникают изменения рельефа поверхности эритроцитов периферической крови, увеличивается число деформированных клеток. Действие опухоли проявляется разрушением липидов мембраны эритроцитов, ослаблением скорости отдачи кислорода, эхиноцитозом. Так, при раке легкого изменяются состав и строение мембран эритроцитов, что приводит к нарушению формы клеток и утрате функциональных способностей. Кроме того, рак легкого сопровождается тромбоцитозом, склонностью к необратимому агрегатообразованию, анемией, ретикулоцитозом. Одной из особенностей гемореологических расстройств при раке желудка является наличие эхиноцитоза в периферической крови, который появляется уже на ранних стадиях заболевания.
Биохимические методы исследования дают полезную информацию при обследовании онкологических больных. Специфических биохимических изменений в организме больных со злокачественными новообразованиями не выявлено. Но очень важно, что опухолевые ткани отличаются от нормальных клеток организма по химическому составу. Так, еще в начале XX века Отто Варбургом было показано, что опухолевые клетки получают необходимую для своей жизнедеятельности энергию в результате анаэробного гликолиза, превращая глюкозу в молочную кислоту. Другое важное открытие, сделанное Варбургом, состояло в том, что опухолевые клетки потребляют в процессе жизнедеятельности меньше кислорода, чем нормальные. Опухоли как эмбриональные ткани содержат в своем составе больше воды и меньше сухого вещества, больше калия и кальция, но меньше натрия и цинка. В опухолях выше, чем в нормальных тканях, содержание аскорбиновой кислоты. Содержание альбуминов в опухолях уменьшается, а глобулинов - повышается. Из аминокислот в раковых клетках преобладают соединения, содержащие серу, - такие, как метионин, цистеин, глутатион, а также соединения основного характера - лизин, аргинин. В процессе роста опухоли в ее клетках преобладают катаболизм углеводов и анаболизм нуклеиновых кислот. В плазме крови онкологических больных более низкое содержание железа и относительно высокое -
меди. При злокачественных опухолях в сыворотке крови возрастает уровень отдельных липидов, в первую очередь нейтральных жиров, эфиров холестерина, триглицеридов.
При отдельных локализациях опухолей выявляются следующие биохимические сдвиги: при первичном раке печени наблюдается повышение уровня щелочной фосфатазы; при раке поджелудочной железы - липазы и амилазы, щелочной фосфатазы; при механической желтухе - выраженное повышение активности альдолазы и аминотрансфераз; при раке предстательной железы - высокий уровень кислой фосфатазы.
При раке молочной железы, почки, яичника, немелкоклеточном раке легкого и некоторых других локализациях наблюдается гиперкальциемия. Подобное состояние развивается в результате усиления резорбции костной ткани при остеолитических метастазах, а также из-за остеолиза, причиной которого является выделение опухолью паратгормоноподобного белка. Первый вариант развития гиперкальциемии наблюдается у больных раком молочной железы при костных метастазах. У больных раком легкого и раком почки при отсутствии костных метастазов происходят остеолиз и почечная реабсорбция кальция в результате продуцирования опухолью паратгормоноподобного белка. После удаления первичной опухоли содержание кальция в крови нормализуется. Гиперкальциемия проявляется обезвоживанием, слабостью, снижением массы тела, головной болью, спутанностью сознания, судорогами, диспепсическими явлениями, нарушениями со стороны сердечно-сосудистой системы в виде аритмии, брадикардии, асистолии. Клинические симптомы гиперкальциемии проявляются при содержании кальция в крови >3,0 ммоль/л. При отсутствии корригирующего лечения развивается коматозное состояние и может наступить остановка сердца.
Одним из серьезных побочных эффектов противоопухолевого цитостатического лечения является массивное поступление в кровеносное русло продуктов распада опухоли, в результате чего происходит сдвиг электролитного и кислотно-щелочного баланса и развиваются гиперкалиемия, гиперфосфатемия, гиперурикемия, гипокальциемия. Наиболее часто подобные состояния наблюдаются при лечении лимфопролиферативных заболеваний, быстро растущих солидных опухолей. Клиническими проявлениями нарушений электролитного и кислотно-щелочного равновесия являются
судорожный синдром, нарушения сознания, брадикардия, аритмия, кишечная непроходимость, почечная недостаточность.
Вследствие повышенного катаболизма и снижения детоксикационных возможностей при злокачественных новообразованиях происходит накопление в организме эндотоксинов, которые оказывают повреждающее действие на органы и системы. Нарушения метаболизма приводят к выбросу в кровь протеолитических ферментов, в результате чего образуются так называемые среднемолекулярные пептиды. Гиперферментемия и молекулы средней массы являются важнейшими факторами интоксикации. Под воздействием факторов эндогенной интоксикации у онкологических больных возникают гематологические сдвиги, среди которых на первый план выступает анемия. В патогенезе анемии при эндотоксикозе следует выделить не только угнетение эритропоэза в связи с действием эндотоксинов на эритроидный росток костного мозга. При эндотоксикозе происходит секвестрация эритроцитов в зонах медленной циркуляции крови и появляются дегенеративные формы эритроцитов, продолжительность жизни которых значительно сокращена. Существенна роль нейтрофильных лейкоцитов в патогенезе расстройств микроциркуляции, так как они активно продуцируют свободные радикалы, способствующие повышению проницаемости и разрушению мембран, угнетению аккумуляции ионов кальция.
В условиях нормальной жизнедеятельности организма наблюдается прооксидантно-антиоксидантное равновесие: радикалообразование и ПОЛ, с одной стороны, и активность биооксидантных систем, пополнение и реактивация их компонентов - с другой. При злокачественных новообразованиях это равновесие смещается в сторону активации ПОЛ. По мере роста опухоли в организме антиоксидантные резервы оказываются недостаточными для сохранения окислительного гомеостаза и возникает потребность в их пополнении с активацией нейрогуморальных механизмов регуляции, прежде всего симпатико-адреналомедуллярной и гипоталамогипофизокортикоадреналовой систем. Биохимические тесты при этом позволяют выявить различные эндокринные паранеопластические синдромы, при которых в крови повышено содержание тиреотропного (ТТГ), антидиуретического (АДГ), адренокортикотропного (АКТТ), фолликулостимулирующего (ФСГ), лютеотропного и некоторых других тропных гормонов, а также кортизола, адреналина, норадреналина, инсулина, глюкагона, гастрина,
серотонина и др. В дальнейшем, по мере роста опухоли и метастазирования, возникают истощение и срыв различных звеньев антиоксидантной системы. В результате накапливаются свободные радикалы и продукты ПОЛ, которые оказывают системное повреждающее действие на структуру и функции липидного матрикса клеточных мембран. Степень ненасыщенности липидов плазмы крови и эритроцитов у онкологических больных значительно выше, чем у здоровых людей. Установлена зависимость между степенью распространенности опухолевого процесса и ненасыщенностью липидов. Одной из важных причин усиления ПОЛ при злокачественных новообразованиях является дефицит в организме основного энергетического субстрата - глюкозы, вследствие чего усиливаются процессы глюконеогенеза и повышается использование других энергетических субстратов, в первую очередь - жирных кислот. Это обстоятельство наряду с тканевой гипоксией лежит в основе стимуляции ПОЛ.
Иммунологические тесты у онкологических больных выявляют угнетение иммунного ответа, особенно Т-клеточного звена. Уменьшается общее количество Т-лимфоцитов за счет сокращения числа Т-хелперов и цитотоксических Т-лимфоцитов. Наиболее значительное угнетение клеточного иммунитета наблюдается при поздних стадиях злокачественных новообразований. Угнетение иммунной системы у онкологических больных объясняется наличием опухоли, метастазированием, объемом операции и токсическим влиянием химио- и лучевой терапии.
Значительное снижение как относительного, так и абсолютного количества Т-лимфоцитов на фоне низких значений общего числа лимфоцитарных клеток периферической крови выявляется у онкологических больных еще до проведения специальных методов лечения. После оперативного вмешательства и (или) химиолучевой терапии происходит еще большее угнетение иммунной системы.
При изучении реакций подавления прилипания лейкоцитов и подавления их миграции установлено, что это чаще наблюдается при 1и11 стадиях рака, что позволяет использовать данные тесты для прогнозирования течения заболевания.
При злокачественных опухолях нарушения иммунной системы приобретают большое значение в связи с тем, что в опухолевой ткани появляются антигены, специфичные для других нормальных органов (дивергенция), а также антигены эмбрионального периода жизни
(антигенная реверсия) или накапливаются в значительных количествах антигены, свойственные нормальной ткани.
На сегодняшний день доступного и единственного теста, позволяющего установить наличие злокачественной опухоли в организме человека, не существует. Имеются лабораторные тесты, которые указывают на факт наличия опухоли в организме и позволяют контролировать динамику лечения. Эти тесты основаны на выявлении опухолевых маркеров и дают возможность провести дифференциальную диагностику между доброкачественной и злокачественной опухолью, установить диагноз злокачественного новообразования, оценить распространенность опухолевого процесса, выявить рецидивы и метастазы опухоли, оценить эффективность методов специального лечения.
К маркерам злокачественного роста относят вещества различной природы: антигены, гормоны, ферменты, гликопротеины, белки, метаболиты. Концентрация маркеров коррелирует с массой опухоли, ее пролиферативной активностью, в ряде случаев - со степенью злокачественности. Одним из главных механизмов продукции маркеров опухолевыми клетками является аномальная экспрессия генома, что обусловливает синтез эмбриональных, плацентарных, эктопических белков, ферментов, антигенов, гормонов и др.
Из наиболее часто используемых онкомаркеров отметим: опухолеассоциированные антигены, к которым относятся СА-125 (используется с целью диагностики, дифференциальной диагностики и контроля эффективности лечения рака яичников), СА-19-9 (применяется с целью выявления и контроля эффективности лечения рака поджелудочной железы и толстой кишки), простатоспецифический антиген - ПСА (применяется для диагностики и оценки эффективности лечения рака предстательной железы); к онкофетальным антигенам относятся α-фетопротеин (применяется с целью диагностики и эффективности лечения первичного рака печени и рака яичек), раково-эмбриональный, или карциноэмбриональный (СЕА), антиген (используется для оценки эффективности лечения рака толстой кишки, желудка, молочной железы).
Определенный уровень концентрации онкомаркеров в крови позволяет судить о радикальности проведенного лечения, о возможном рецидиве опухоли, что позволяет применять их в динамическом наблюдении за онкологическими больными в процессе лечения и после его завершения.
Значение профилактических осмотров и ежегодной диспансеризации для раннего распознавания рака. Формирование групп повышенного риска
Злокачественные новообразования представляют собой проблему высокой социальной значимости, так как приводят к утрате трудоспособности и инвалидизации значительной части населения. Предотвращение возникновения злокачественных новообразований заключается в комплексе мер по их первичной и вторичной профилактике. Первичная профилактика направлена на устранение или ослабление воздействия канцерогенных агентов на организм человека и повышение специфической и неспецифической сопротивляемости организма. Вторичная профилактика включает в себя комплекс мероприятий по оздоровлению групп повышенного риска и раннюю диагностику опухолей.
Периодические профилактические осмотры всего населения при больших финансовых затратах позволяют выявить лишь незначительный процент больных со злокачественными новообразованиями. Из методов скрининга злокачественных новообразований наиболее распространены маммография у женщин старше 45 лет, взятие цитологических мазков с шейки матки, определение ПСА и пальцевое исследование простаты через прямую кишку у мужчин старше 50 лет, анализ кала на скрытую кровь. Флюорография органов грудной клетки как метод скрининга оказалась неэффективной.
Более оправданы целевые профилактические осмотры, которые проводятся с целью ранней диагностики опухолей в группах повышенного риска по возникновению злокачественных новообразований. Формирование групп повышенного риска проводится в участковых поликлиниках или цеховых врачебных участках. В такие группы входят больные с фоновыми и предраковыми заболеваниями, а также лица, находящиеся в постоянном контакте с канцерогенными веществами на производстве. Периодичность профилактических осмотров и объем диагностических мероприятий у данных категорий обследованных определяются нормативными документами МЗ РФ.
Вопросы для самоконтроля
1. Дайте определение понятия «сигналы тревоги» у онкологических больных.
2. Дайте определение понятий «скрининг» и «мониторинг».
3. Какие факторы учитываются при формировании групп риска?
4. Изложите особенности сбора анамнеза и объективного осмотра у онкологических больных.
5. Назовите основные этапы обследования больных с подозрением на злокачественное новообразование.
6. Укажите основные методы базовой рентгенодиагностики онкологических заболеваний.
7. Перечислите рентгеноскопические симптомы рака полых органов ЖКТ.
8. Какие инвазивные исследования, выполняемые под рентгенотелевизионным контролем, вы знаете?
9. Перечислите рентгенологические симптомы злокачественных заболеваний легких и средостения.
10. Назовите рентгенологические симптомы злокачественных опухолей костно-суставной системы.
11. Укажите цели и области использования линейной томографии.
12. Назовите специальные виды рентгенографии.
13. Дайте краткую характеристику метода КТ.
14. Укажите области применения КТ.
15. Охарактеризуйте диагностические возможности МРТ.
16. Перечислите виды УЗИ с их предназначением.
17. Назовите виды радионуклидных исследований.
18. Какие уровни получения медицинских изображений вы знаете?
19. Какими достоинствами обладают эндоскопические исследования?
20. Перечислите основные виды эндоскопических исследований и области их применения.
21. Какие существуют особенности изменений периферической крови, биохимических и иммунологических тестов у онкологических больных?
22. Дайте определение опухолевых маркеров.
23. Как проводится выявление рака в доклиническом периоде?
24. Как проводится формирование групп повышенного риска?
25. Каково значение профилактических осмотров и ежегодной диспансеризации населения для раннего выявления рака?