Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев. 2010. - 920 с.
|
|
|
|
ГЛАВА 35 РАК ТЕЛА МАТКИ
ЭПИДЕМИОЛОГИЯ И ЭТИОЛОГИЯ
Ежегодно в мире раком тела матки заболевают более 160 тыс. женщин. В России ежегодно регистрируется более 16 тыс. новых случаев рака тела матки. В 2007 г. в России зарегистрированы 18 302 женщины с впервые в жизни установленным диагнозом. Заболеваемость в РФ в 1997 г была 12,13 на 100 тыс. женского населения, в 2007 г. - 24,0. Рак тела матки занимает 1-е место в структуре онкогинекологической заболеваемости в странах Европы и, как и РМЖ, может быть отнесен к «болезням цивилизации». Заболевание преимущественно диагностируется у женщин в постменопаузальном периоде (старше 60 лет), но в 25 % случаев в пременопаузальном периоде, а у некоторых женщин в молодом возрасте (в 30-35 лет). В большинстве случаев (85-90 %) заболевание выявляется на стадии локализованного процесса (I-II стадии), что объясняется особенностями клинической картины, заставляющими больных рано обращаться к врачу. Столь благоприятная диагностическая ситуация создает предпосылки для высоких результатов лечения.
Факторами риска являются раннее менархе и поздняя менопауза, ановуляторные кровотечения, эндокринное бесплодие, синдром склерокистозных яичников, ожирение, сахарный диабет, прием экзогенных «не защищенных прогестинами» эстрогенов в заместительной гормонотерапии и антиэстрогенов в лечении РМЖ.
ПАТОГЕНЕЗ
Биологическое своеобразие эндометрия состоит в том, что эта гормоночувствительная ткань обладает способностью не только к циклическому обновлению почти всего клеточного состава, но и к определенному реагированию на все изменения гормонального статуса на уровне целостного организма. Эндометрий как ткань-мишень, испытывающая на себе влияние половых гормонов,
чрезвычайно чувствительна к действию эстрогенов, оказывающих специфическое воздействие на его структуру и функцию. Эстрогены - основной фактор, вызывающий пролиферацию эндометрия, которая при отсутствии достаточного влияния прогестерона прогрессирует в гиперпластические процессы: от простой гиперплазии до атипической (предрака) и рака эндометрия. Большая часть эндометриальных карцином экспрессирует эстрогенные и прогестероновые рецепторы.
Рак тела матки развивается на фоне гормонально-метаболических нарушений: относительной гиперэстрогении, углеводного и липидного дисбаланса. Отечественным онкогинекологом Я.В. Бохманом в 1972 г. предложено выделять 2 патогенетических варианта течения заболевания
При 1-м патогенетическом варианте (гормональнозависимом), который отмечается у 60-70 % больных, четко выраженные нарушения овуляции (ановуляторные маточные кровотечения, бесплодие, позднее наступление менопаузы) сочетаются с нарушением метаболизма жиров и углеводов (различной степени ожирение, сахарный диабет, гипертоническая болезнь). Опухоль возникает на фоне гиперпластического процесса эндометрия и стромы яичников, часто сочетается с другими гормональнозависимыми опухолями (РМЖ, феминизирующие опухоли яичников), синдромом Штейна-Левенталя (у 60 % больных выявляются склерокистозные яичники). Опухоль матки у таких больных растет медленно, обладает высокой степенью дифференцировки, чувствительна к прогестагенам. Течение заболевания относительно благоприятное.
При 2-м патогенетическом варианте (автономном) нарушение овуляции и стероидного гомеостаза выражены нечетко или вовсе отсутствуют. Опухоль возникает чаще в постменопаузе на фоне атрофии эндометрия; отмечается фиброз стромы яичников. Отсутствие гормональной зависимости влечет за собой нарастание признаков автономности и прогрессии. В этих случаях опухоль низкодифференцированная, склонна к инвазивному росту и лимфогенному метастазированию, малочувствительна к прогестагенам. Течение заболевания менее благоприятно.
Морфологическое строение. Рак тела матки или рак эндометрия локализуется в полости тела матки и исходит из эндометрия. Рак эндометрия чаще имеет железистое строение (аденокарциномы). Атипическую гиперплазию эндометрия рассматривают как
предрак. В морфологической классификации ВОЗ (2003) выделяют эндометриодные (75-80 %) и неэндометриоидные формы рака тела матки. К эндометриоидным формам отнесены цилиарная, секреторная, папиллярная или виллогландулярная аденокарциномы, а также аденокарциномы с плоскоклеточной дифференцировкой: аденоакантома и аденосквамозная карцинома. Неэндометриоидные формы включают серозно-папиллярный рак (<10 %), муцинозный (1 %), светлоклеточный (4 %), плоскоклеточный (<1 %), смешанный (10 %) и недифференцированный рак.
Метастазирование зависит от дифференцировки опухоли и инвазии в миометрий. Высокодифференцированные эндометриоидные опухоли с поверхностной инвазией редко метастазируют лимфогенно и имплантационно. Высокий уровень эстрогенных и прогестероновых рецепторов в опухоли имеет благоприятное прогностическое значение, в отличие от высокой экспрессии онкогена HER2/neu. Зоной регионарного лимфогенного метастазирования являются подвздошные и парааортальные лимфатические узлы. При высокодифференцированном раке без инвазии в миометрий частота лимфогенного метастазирования составляет <5 %. При умеренно- и низкодифференцированных аденокарциномах с инвазией менее 50 % толщи миометрия в 5-10 % случаев метастазирование происходит в тазовые узлы и в 4 % - в парааортальные; при глубокой инвазии, низкодифференцированном раке и неэндометриоидных карциномах, а также при интраперитонеальном распространении - от 20 до 60 % в тазовые и 10-30 % в парааортальные лимфатические узлы.
Отдаленные метастазы могут быть в легкие, паховые и надключичные лимфатические узлы, в печень, кости, влагалище.
КЛИНИЧЕСКАЯ КЛАССИФИКАЦИЯ ПО СИСТЕМЕ TNM (2002) И МЕЖДУНАРОДНОЙ ФЕДЕРАЦИИ АКУШЕРОВ И ГИНЕКОЛОГОВ (FIGO, 2001)
При раке тела матки критерии выделения категорий Т, N и М соответствуют стадиям FIGO. Ниже для сравнения приведены обе классификации (табл. 35.1).
Классификация FIGO основана на морфологическом стадировании заболевания. Стадии ТNМ имеют как клинический, так и патоморфологический вариант.
Правила классификации
Представленная ниже классификация применима только для рака и злокачественных смешанных мезодермальных опухолей тела матки. В каждом случае необходимы гистологическое подтверждение диагноза, определение гистологического типа опухоли и степени ее дифференцировки. Диагноз основан на результатах микроскопического исследования биопсии эндометрия.
FIGO не советует применять эту классификацию в случае смешанных мезодермальных опухолей.
FIGO рекомендует настоящую классификацию для опухолей I стадии на фоне начавшейся лучевой терапии:
I - опухоль ограничена в пределах тела матки, включая перешеек;
ГА - длина полости матки до 8 см;
? - длина полости матки более 8 см.
Анатомические области
1. Перешеек матки.
2. Дно матки.
Регионарные лимфатические узлы
К регионарным лимфатическим узлам относят:
1. Тазовые лимфатические узлы:
- внутренние подвздошные (включая запирательные);
- общие подвздошные;
- внешние подвздошные;
- лимфатические узлы параметрия;
- крестцовые (предкрестцовые, боковые крестцовые).
2. Парааортальные лимфатические узлы, включая паракавальные и интераортокавальные узлы.
Клиническая классификация TNM
Т - первичная опухоль
Таблица 35.1. Классификация рака тела матки TNM и Международной
федерации акушеров и гинекологов (FIGO)
TNM | FIGO | Описание |
Тх | - | Оценка первичной опухоли невозможна |
Т0 | - | Первичная опухоль не обнаружена |
Окончание табл. 35.1
 Обратите внимание!
Обратите внимание!
* Буллезный отек слизистой оболочки не позволяет отнести опухоль к группе Т4. Указанное поражение следует подтверждать с помощью биопсии.
N - регионарные лимфатические узлы
? - состояние регионарных лимфатических узлов оценить невозможно.
N0 - метастазов в регионарных лимфатических узлах нет. N1 - метастазы в регионарных лимфатических узлах имеются.
М - отдаленные метастазы
Mх - недостаточно данных для определения отдаленных метастазов.
M0 - нет признаков отдаленных метастазов. М1 - имеются отдаленные метастазы.
Патоморфологическая классификация pTNM
Критерии выделения категорий рТ, рN и рМ соответствуют таковым для категорий Т, N и M.
С целью патоморфологической оценки показателя N проводят удаление десяти тазовых лимфатических узлов или более. В настоящее время принято, что отсутствие характерных изменений ткани при патоморфологическом исследовании биоптатов меньшего количества лимфатических узлов позволяет подтвердить стадию
G - гистопатологическая дифференцировка
Gх - степень дифференцировки не может быть установлена.
G1 - высокая степень дифференцировки.
G2 - средняя степень дифференцировки.
G3 - низкая степень дифференцировки или недифференцированные опухоли.
ДИАГНОСТИКА
Основной симптом рака тела матки - маточные кровотечения на фоне постменопаузы или ациклические кровотечения у женщин репродуктивного возраста. Боли возникают в случае гематометры или диссеминации опухоли в малом тазу и брюшной полости. У большинства больных заболевание выявляется на стадии локализованного процесса (стадия I). Обследование включает УЗИ малого таза и брюшной полости. Толщина эндометрия (М-эхо) у женщин
постменопаузального возраста в норме не должна превышать 3-4 мм. Вторым этапом выполняется гистероскопия с прицельной биопсией эндометрия и взятием аспирата из полости матки с последующими морфологическими исследованиями. КТ брюшной полости и малого таза позволяет выявить метастазы в органы брюшной полости и метастазы (более 1 см) в забрюшинных лимфатических узлах. Рентгенография легких входит в стандарт обследования больных.
На сегодняшний день скрининга для рака тела матки нет. Предлагается селективный скрининг (УЗИ малого таза с морфологическим исследованием эндометрия при М-эхо более 4 мм) в группах риска развития рака тела матки.
ЛЕЧЕНИЕ
В лечении рака тела матки используются хирургический, лучевой и лекарственный методы, а также их комбинации.
Хирургический метод традиционно является основой лечения больных раком тела матки. Хирургические вмешательства выполняют как на ранних, так и на поздних стадиях заболевания (рис. 35.1, 35.2). Высокая частота рака тела матки стадий служит объяснением тому, что хирургическое лечение проводится преобладающему большинству больных с этой злокачественной опухолью. По мере совершенствования хирургической техники, анестезии, предоперационной подготовки и послеоперационного ведения становится все меньше больных раком тела матки, которым операция противопоказана из-за сопутствующих заболеваний. Среди больных раком тела матки при ранних стадиях не подвергаются операции из-за тяжелых сопутствующих заболеваний только 10 %. Экстрафасциальная экстирпация матки с придатками выполняется большинству больных раком тела матки. В случае глубокой инвазии в миометрий или низкой дифференцировки при неэндометриоидном гистотипе опухоли дополнительно
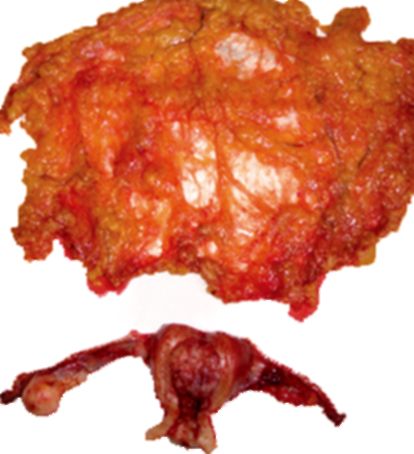 Рис. 35.1. Рак тела матки. Макропрепарат после ампутации матки с придатками и резекцией большого сальника
Рис. 35.1. Рак тела матки. Макропрепарат после ампутации матки с придатками и резекцией большого сальника
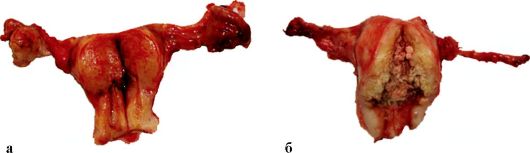 Рис. 35.2. Рак тела матки. Макропрепарат после ампутации матки с придатками (а, б)
Рис. 35.2. Рак тела матки. Макропрепарат после ампутации матки с придатками (а, б)
удаляются тазовые лимфатические узлы. Радикальная экстирпация матки II типа показана при II стадии заболевания (переход на шейку матки).
Лучевая терапия как самостоятельный метод лечения осуществляется крайне редко, так как по эффективности значительно уступает хирургическому методу и проводится только при аргументированном отказе от операции из-за тяжелых сопутствующих заболеваний. Лучевая терапия преимущественно используется в комбинированном лечении и назначается после операции больным с неблагоприятными прогностическими факторами (глубокая инвазии опухоли, переход на цервикальный канал, метастазы в регионарных лимфатических узлах, низкодифференцированные и неэндометриоидные формы).
Лекарственная терапия может применяться при лечении рака эндометрия, преимущественно при его диссеминированных и метастатических формах. Консервативное лечение рака эндометрия прогестинами показано у молодых пациенток, желающих в дальнейшем восстановить репродуктивную функцию. Прогестинотерапия успешно используется уже несколько десятилетий в лечении диссеминированного рака эндометрия. Гормональная терапия прогестинами основывается на их физиологическом ингибировании эндометриальной стимуляции, индуцированной эстрогенами. Роль прогестинов в лечении метастатического рака эндометрия впервые была продемонстрирована R. Kelley и W. Baker в 1961 г. Частота объективного ответа на гормонотерапию у больных диссеминированным или рецидивирующим раком эндометрия составляет около 25 %; средняя продолжительность ремиссии - до 9 мес. В клинической практике предпочтение должно быть отдано прогестинам,
особенно если опухоль хорошо дифференцирована и экспрессирует прогестероновые рецепторы. Оптимальным режимом является ежедневный пероральный прием 200-400 мг медроксипрогестерона ацетата (Провера) или 160 мг мегестрола ацетата (Мегейс). Эффект прогестинотерапии начинает реализовываться не ранее чем через 8-12 нед от начала приема препарата.
С адъювантной целью после хирургического лечения больным раком эндометрия I, II стадии прогестинотерапия не рекомендуется из-за ее низкой эффективности и неблагоприятных побочных проявлений.
Консервативное лечение прогестинами рекомендуется молодым больным не только в случае предрака эндометрия, но и при высокодифференцированном раке эндометрия с восстановлением фертильности. Такого рода терапия проводится строго индивидуально и требует тщательного наблюдения за больными.
Лекарственная терапия включает в себя и химиотерапию, которую назначают с паллиативной целью больным диссеминированными и рецидивирующими опухолями эндометрия, особенно с прогестинорезистентным профилем (опухоли рецепторнегативные, низкой дифференцировки, неэндометриоидные). Используются цитостатики антрациклинового ряда, производные платины, таксаны. С адъювантной целью химиотерапию не назначают.
Лечебная тактика в зависимости от стадии заболевания
• I стадия - при высоко- и умеренно дифференцированных опухолях, занимающих менее половины полости матки, с глубиной инвазии менее половины миометрия и отрицательной перитонеальной цитологией выполняют тотальную гистерэктомию с аднексэктомией. Послеоперационное эндовагинальное облучение рекомендуется при глубокой инвазии в миометрий.
Во всех остальных случаях и при других гистологических типах опухолей (низкодифференцированный рак, неэндометриоидные формы), помимо тотальной гистерэктомии с аднексэктомией, показана тазовая лимфаденэктомия, в некоторых случаях - с селективной парааортальной лимфодиссекцией.
После операции назначают сочетанную лучевую терапию. Адъювантная прогестинотерапия при I стадии заболевания не показана.
При противопоказаниях к хирургическому лечению больным назначают лучевую терапию, уступающую по эффективности хирургическому лечению.
• II стадия: при IIA стадии - комбинированное лечение, как при I стадии с неблагоприятными прогностическими факторами; при ПВ стадии - комбинированное лечение, как при I стадии с неблагоприятными прогностическими факторами, с выполнением операции в объеме радикальной гистерэктомии II типа с лимфаденэктомией.
• III стадия - большинство больных подвергаются хирургическому лечению с последующей лучевой терапией. В нерезектабельных случаях (опухолевая инфильтрация до стенок таза) проводится сочетанная лучевая терапия.
При противопоказаниях к хирургическому и лучевому лечению назначают прогестинотерапию у больных с гормоночувствительными опухолями (высоко- и умеренно дифференцированные аденокарциномы, рецепторположительные опухоли). Гормонотерапия осуществляется медроксипрогестерона ацетатом по 500 мг ежедневно в таблетированной форме или мегестрола ацетатом по 160 мг ежедневно. При других гистологических формах рекомендуется комбинированная химиотерапия по схеме AP (доксорубицин - 60 мг/м2 и цисплатин - 50 мг/м2) или АТ (доксорубицин - 60 мг/м2 и паклитаксел - 150 мг/м2).
IV стадия - гормонотерапия медроксипрогестерона ацетатом - по 500 мг ежедневно в таблетированной форме или мегестрола ацетатом - по 160 мг ежедневно при гематогенных метастазах гормоночувствительных опухолей.
В этой стадии показана комбинированная химиотерапия по схеме AP (доксорубицин 60 мг/м2 и цисплатин 50 мг/м2) или АТ (доксорубицин 60 мг/м2 и паклитаксел 150 мг/м2).
РЕЦИДИВЫ
При локализованных рецидивах в малом тазу назначают паллиативную лучевую терапию.
Гормонотерапия медроксипрогестерона ацетатом (по 500 мг в таблетках ежедневно) или мегестрола ацетатом (по 160 мг ежедневно) показана при гематогенных метастазах гормоночувствительных опухолей.
Комбинированная химиотерапия по схеме AP (доксорубицин - 60 мг/м2 и цисплатин - 50 мг/м2) или АТ (доксорубицин - 60 мг/м2 и паклитаксел - 150 мг/м2) также показана у больных этой категории.
Отдаленные результаты: средние показатели 5-летней выживаемости составляют 75-80 %. При 1-м патогенетическом варианте рака тела матки (гормонозависимом) показатели общей 5-летней выживаемости составляют 85-90 %. При 2-м патогенетическом варианте (автономном) показатели 5-летней выживаемости составляют
60-70 %.
Вопросы для самоконтроля
1. Приведите данные об эпидемиологии рака тела матки.
2. Какие факторы повышают риск возникновения рака тела матки?
3. Охарактеризуйте патогенетические варианты рака тела матки.
4. Какие выделяют морфологические варианты рака тела матки?
5. Какими путями происходит метастазирование рака тела матки?
6. Приведите клиническую классификацию рака тела матки по системе TNM и Международную классификацию федерации акушеров и гинекологов.
7. Какие методы применяются в диагностике рака тела матки?
8. Какие методы лечения рака тела матки используются на современном этапе?
9. Как меняется лечебная тактика в зависимости от стадии заболевания?
10. Как проводится лечение рецидивов?
11. Каков прогноз при раке тела матки?