Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев. 2010. - 920 с.
|
|
|
|
ГЛАВА 19 РАК ЖЕЛУДКА
ЭПИДЕМИОЛОГИЯ
Рак желудка (РЖ) остается одной из самых распространенных форм злокачественных опухолей человека: ежегодно в мире РЖ заболевают более 1 млн человек. Значительные различия в заболеваемости раком данной локализации в разных странах и регионах мира свидетельствуют о влиянии климатогеографических, бытовых, пищевых и других факторов на его возникновение. Максимально высокая заболеваемость РЖ отмечена у мужчин в Японии (114,7 на 100 тыс. населения), а минимальная - у белых женщин в США (3,1 на 100 тыс.); высокий показатель заболеваемости зарегистрирован в Китае, Белоруссии, России, Эстонии, Латвии, Новой Зеландии (маори).
РЖ продолжает занимать 2-е место в структуре заболеваемости россиян. Число больных с впервые в жизни установленным диагнозом РЖ в 2007 г. в РФ составило 41 941 человек: 23 810 мужчин и 18 131 женщина. Заболеваемость РЖ в 2007 г. была 29,5 на 100 тыс. населения. Максимальной она оказалась в 2005 г. в Тыве (56,8 на 100 тыс. мужчин и 20,5 на 100 тыс. женщин); среди мужчин - в Ивановской (44,9) и Тверской (39,9) областях, а также в Бурятии (42,4); среди женщин - в Томской (18,8), Мурманской (17,5) и Вологодской (17) областях, а также в Мордовии (17,1). Относительно низкая заболеваемость РЖ отмечена в Калмыкии (21,5 на 100 тыс. мужчин и 5,6 на 100 тыс. женщин), Адыгее (соответственно 17,8 и 9,1), Карачаево-Черкесии (18,8 и 6,7), Северной Осетии (17,8 и 9,6) и Кабардино-Балкарии (16,1 и 8,0). Заболеваемость РЖ продолжает снижаться: с 1990 по 2005 г. в России его доля в структуре заболеваемости уменьшилась у мужчин на 5,3 %, у женщин - на 5,8 %.
Большинство больных РЖ приходится на возраст от 50 до 60 лет и до 25 % - на возраст от 40 до 50 лет. Мужчины болеют в 2 раза чаще, чем женщины.
Несмотря на неуклонное снижение заболеваемости раком антрального отдела и тела желудка в большинстве стран мира, в последние годы наблюдается рост частоты аденокарциномы зон кардии и пищеводно-желудочного перехода. Рост заболеваемости в этой группе за последние 2 десятилетия XX века составил более 350 % (выше, чем других онкологических заболеваний). Так, в США частота аденокарциномы проксимального отдела желудка и зоны пищеводножелудочного перехода в 1960 г. составляла лишь 16 %, к началу 80-х - 44 %, а к концу 90-х годов - более 60 % от всех заболевших РЖ. Однако в целом, несмотря на увеличивающуюся частоту, суммарные показатели (аденокарцинома пищеводно-желудочного соединения и кардии) остаются намного ниже, чем в «некардиальном» отделе желудка.
СПОСОБСТВУЮЩИЕ ФАКТОРЫ. ЗНАЧЕНИЕ ЭКЗОГЕННЫХ И ЭНДОГЕННЫХ КАНЦЕРОГЕНОВ
Факторы, определяющие заболеваемость РЖ, связаны с социально-экономическим уровнем жизни. РЖ намного чаще встречается среди бедных слоев населения и реже - среди обеспеченных. Для развития РЖ особое значение имеют характер питания и образ жизни в первые 2 десятилетия жизни.
К экзогенным факторам риска развития РЖ относится прежде всего диета с избытком поваренной соли (соленая рыба, мясо, овощи, морепродукты), вызывающая осмотическое повреждение эпителия и способствующая заселению слизистой оболочки желудка бактериями Н. pylori (рис. 19.1). Риск развития РЖ увеличивается при преобладании в пище углеводов, недостатке витаминов, микроэлементов.
Большое значение в возникновении РЖ имеет химический состав почвы и воды в районе обитания человека, что прежде всего связано с содержанием нитритов и нитратов, которые в желудке с участием микроорганизмов превращаются в нитрозамины, являющиеся сильными канцерогенами. К существенному возрастанию риска развития РЖ ведет и курение. Определенную роль также может играть употребление алкоголя, особенно суррогатных спиртоводочных изделий.
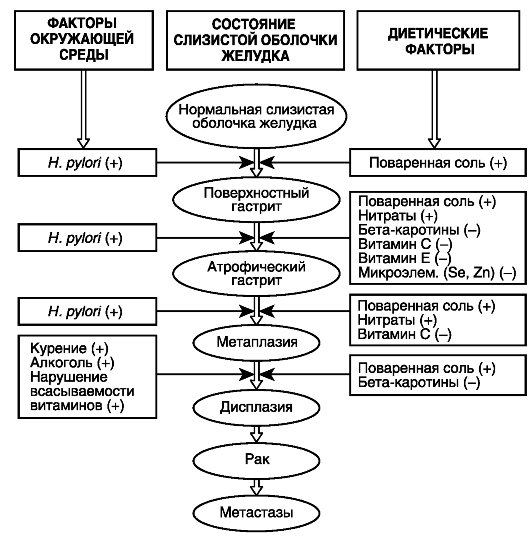 Рис. 19.1. Влияние факторов окружающей среды на формирование рака желудка (по T. Wadstrom, 1995): «+» - промоторы; (-) - ингибиторы
Рис. 19.1. Влияние факторов окружающей среды на формирование рака желудка (по T. Wadstrom, 1995): «+» - промоторы; (-) - ингибиторы
К эндогенным факторам, способствующим развитию РЖ, относят: дуоденогастральный рефлюкс, внутрижелудочное формирование эндогенных субстанций типа нитрозосоединений, нарушение всасываемости и повышенная утилизация витаминов и микроэлементов, генетические и иммунологические факторы, которые при условии сохраненного защитного слизистого барьера в желудке не проявляют канцерогенных свойств.
Инициирующими факторами канцерогенеза в желудке являются продукты реакций свободнорадикального окисления, которые образуются при воспалении: радикалы кислорода, соединения азота. Антиоксиданты (витамины А, С, Е, B6, β-каротины, фолиевая кислота, микроэлементы: селен, цинк) предотвращают образование свободных радикалов, ингибируют нитрозирование и потому обладают защитными свойствами (предотвращают развитие рака). Употребление большого количества свежих фруктов, овощей, витамина Е, зеленого чая снижает риск развития РЖ.
В настоящее время доказана роль наследственной восприимчивости к канцерогенным влияниям в развитии РЖ. На генетическую составляющую приходится до 1/3 случаев заболеваемости РЖ. Наследственные факторы ассоциируются преимущественно с диффузным типом данной патологии: у прямых родственников таких больных риск заболеть возрастает в 6 раз. Диффузный тип РЖ чаще ассоциируется с группой крови A(II), в некоторых регионах - с группой 0(1).
Особую роль в желудочном канцерогенезе играет H. pylori (рис. 19.2). Эпидемиологические исследования указывают на закономерную связь между инфицированием H. pylori и РЖ. Так, в странах с высокой заболеваемостью РЖ инфицированность H. pylori намного выше, чем в регионах с низкой заболеваемостью. В 1994 г. Международное агентство по исследованию рака при ВОЗ отнесло H. pylori к канцерогенам первого класса и определило ее как причину развития РЖ у человека.
В отличие от этиологических факторов, участвующих в канцерогенезе тела желудка и антрального его отдела, при кардиоэзофагеальном раке желудка какой-либо связи с избытком употребления поваренной соли с пищей и дефицитом витаминов не выявлено. Заболеваемость раком проксимального отдела желудка увеличивается синхронно с нарастанием частоты пищеводно-желудочного рефлюкса, который вызывает хроническую воспалительную реакцию, приводящую к предраковым поражениям. В отличие от «некардиального» РЖ, инфицирование H. pylori не играет прямой роли в патогенезе рака данной локализации и даже в какой-то мере способствует защите пищевода и кардиоэзофагеального соединения от развития рака, предотвращая возникновения рефлюкс-эзофагита и пищевода Барретта.
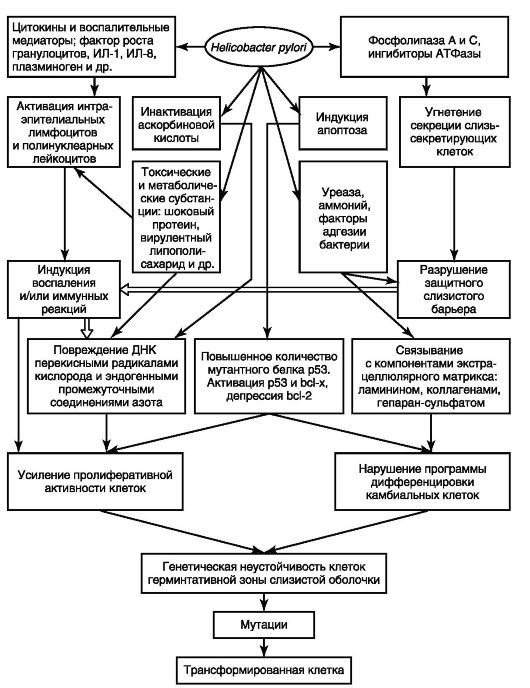 Рис. 19.2. Патогенез инициирующего влияния H. pylori на слизистую оболочку желудка
Рис. 19.2. Патогенез инициирующего влияния H. pylori на слизистую оболочку желудка
ПРЕДРАКОВЫЕ ЗАБОЛЕВАНИЯ ЖЕЛУДКА. ГРУППА РИСКА
Общепризнано, что РЖ закономерно предшествует ряд заболеваний, которые характеризуются как предрак. В 1978 г. комитет экспертов ВОЗ по изучению предрака желудка рекомендовал выделять предраковые состояния (факультативный предрак) и предраковые изменения - дисплазия (облигатный предрак). В настоящее время вместо термина «дисплазия слизистой оболочки желудка» используется термин «желудочная интраэпителиальная неинвазивная неоплазия».
К предраковым состояниям относятся:
• хронический гастрит различной этиологии, в том числе аутоиммунный гастрит типа А, сопровождающийся пернициозной анемией;
• аденоматозные полипы желудка;
• хроническая язва желудка;
• резецированный по поводу доброкачественных заболеваний желудок;
• болезнь Менетрие.
Хронический гастрит (некоторые исследователи его рассматривают как гастропатию, так как атрофические и пролиферативные процессы превалируют над воспалительными) предшествует возникновению рака желудка в 73,5-85 % случаев.
В желудке выделяют 2 основных типа полипов: аденоматозные и гиперпластические. Гиперплазиогенные и гиперпластические полипы в желудке встречаются примерно в 18-20 раз чаще, чем аденоматозные, и представляют собой отграниченные разрастания слизистой оболочки, выстланные перезрелым покровно-ямочным эпителием. У гиперпластических полипов часто имеются ножки, и они редко достигают размеров более 2 см. Гиперпластические полипы - не истинные опухоли, они возникают в результате нарушения репаративной регенерации слизистой оболочки (на отдельном ее участке) в ответ на постоянное раздражение повреждающими факторами. Предраковый потенциал таких полипов невелик.
Аденоматозные полипы (аденомы) представляют собой аналог аденом толстой кишки. Эти новообразования имеют вид узла на широком основании. Микроскопически представляют собой тубулярные и тубулопапиллярные хаотические эпителиальные разрастания, выстланные высоким базофильным цилиндрическим эпителием,
с вытянутыми и расположенными на различных уровнях ядрами и высоким ядерно-цитоплазматическим отношением. Частота малигнизации аденом чрезвычайно высока и колеблется, по данным большинства исследователей, в пределах 30-40 %.
Роль хронической язвы желудка в возникновении рака желудка остается спорной. Одни авторы полностью (и не без оснований) отрицают всякую возможность озлокачествления хронической язвы желудка, считая, что РЖ возникает сразу, а язвенные проявления - это не что иное, как недиагностируемый рак на ранних стадиях. По мнению других исследователей, частота озлокачествления хронических язв достигает 65-80 %, а язву они считают неотъемлемым промежуточным звеном морфогенеза РЖ.
Риск возникновения рака в культе желудка у больных, оперированных по поводу доброкачественных заболеваний, через 15-20 лет после резекции, особенно по Бильрот II, возрастает по сравнению с общей популяцией в 3-4 раза. Развитие рака в культе связывают с прогрессированием гастрита, в генезе которого важную роль отводят кишечно-желудочному рефлюксу; при этом наиболее выраженные изменения, а также наиболее частое развитие раковых опухолей определяются в зоне гастроэнтероанастомоза.
Болезнь Менетрие - редкое заболевание с неизвестными этиологией и патогенезом, морфологически соответствующее картине гипертрофического гастрита. Риск развития РЖ при этом заболевании составляет 6-8 %.
Интраэпителиальная неоплазия (дисплазия) и РЖ
Для обозначения предраковой эпителиальной пролиферации слизистой оболочки желудка, предраковых поражений, промежуточных между гиперплазией и раком, предложен термин «желудочная интраэпителиальная неинвазивная неоплазия» (синоним «дисплазия»). По определению экспертов ВОЗ, дисплазия эпителия слизистой оболочки желудка характеризуется тремя основными признаками:
1) клеточной атипией;
2) нарушением дифференцировки клеток;
3) дезорганизацией структуры слизистой оболочки. Основным проявлением желудочной интраэпителиальной нео-
плазии служит клеточная атипия, которая характеризуется:
1) увеличением размеров ядер, вследствие чего увеличивается ядерно-цитоплазматическое отношение;
2) полиморфизмом и гиперхромией ядер;
3) расположением ядер на различных уровнях (псевдостратификация);
4) нарастанием базофилии цитоплазмы клетки.
С учетом выраженности предложены различные градации интраэпителиальной неоплазии, ведущая роль в этом отводится клеточной атипии. В гистологической классификации опухолей желудка ВОЗ (2000) выделены 2 степени выраженности интраэпителиальной неоплазии: слабая (low-grade) и тяжелая (high-grade). Слабо выраженную интраэпителиальную неинвазивную неоплазию очень трудно отличить от регенерирующего эпителия. Появление высокой степени интраэпителиальной неоплазии - маркер повышенного риска развития и этапа морфогенеза РЖ. Последнее поражение рассматриваются как внутрислизистая неинвазивная карцинома, которая может выглядеть как плоское (дисплазия) или возвышающееся (аденома) поражение.
Желудочная интраэпителиальная неоплазия (дисплазия) - достаточно динамичный процесс; возможны как ее прогрессирование, так и регресс. Считается, что чем более выражены неопластические изменения в эпителии, тем выше вероятность перехода в рак.
Следует отметить, что у пациентов с кишечной метаплазией в зоне пищеводно-желудочного перехода и в пищеводе риск развития рака существенно выше, чем у пациентов с кишечной метаплазией в «некардиальном» отделе желудка.
ПРОФИЛАКТИКА. ЗНАЧЕНИЕ ДИСПАНСЕРНОГО
НАБЛЮДЕНИЯ ЗА БОЛЬНЫМИ С ПРЕДРАКОВЫМИ
СОСТОЯНИЯМИ ЖЕЛУДКА
Улучшение результатов лечения РЖ связывают главным образом не с совершенствованием оперативной техники, а с диагностикой и лечением ранних стадий заболевания. Процесс опухолевой трансформации клеток до первых клинических проявлений РЖ длительный, многоэтапный. Продолжительность «естественной эволюции» РЖ составляет 15-25 лет, что обусловливает возможность его диагностики на ранней стадии, которая может продолжаться с момента обнаружения заболевания от 6 мес до 10 лет и более. Отсюда очевидна реальная возможность диагностики опухоли на ранней стадии, когда РЖ еще не проявляет такой высокой степени злокачественности, как при распространенных формах.
Поскольку ранние формы РЖ характеризуются отсутствием патогномоничных симптомов, необходимы активные мероприятия для выявления лиц с высоким риском заболевания и систематическое обследование больных с предраковыми процессами. Выявление ранних форм РЖ возможно только в случае необходимой онкологической настороженности врачей; при малейшем подозрении на возможность развития рака у пациента его нужно направлять на более углубленное исследование.
В группу риска развития РЖ следует отнести лиц, с детского возраста имеющих высокие показатели обсемененности слизистой оболочки H. pylori или страдающих заболеваниями, ассоциированными с хеликобактериозом; пациентов, в течение значительного времени страдающих хроническим гастритом (как с пониженной, так и с нормальной или повышенной кислотностью), аденомами (аденоматозными полипами), язвенной болезнью желудка, пернициозной анемией, с резецированным желудком, болезнью Менетрие, а также в случае семейной предрасположенности к РЖ.
Лица с высокой степенью риска заболевания РЖ, у которых морфологически была диагностирована тяжелая интраэпителиальная неоплазия (дисплазия) эпителия, подлежат динамическому наблюдению с обязательным проведением рентгеноскопии и гастроскопии не менее чем 2 раза в год.
Эпидемиологические исследования показывают, что заболеваемость РЖ зависит от благосостояния населения и санитарного просвещения. В первую очередь она связана с качественным составом пищи. Резкое ограничение употребления поваренной соли, мучной и богатой углеводами пищи, употребление доброкачественных неконсервированных продуктов, наличие в рационе достаточного количества растительной пищи и фруктов, животных и растительных белков существенно снижают риск возникновения РЖ. Примером может служить ситуация в США, где многолетняя пропаганда рационального питания способствовала многократному снижению заболеваемости населения РЖ.
Следует отметить фармакологическую активность антиоксидантов и экстрактов пахучих овощей - лука, чеснока, редьки, способных тормозить канцерогенез в пищеварительном тракте. При регулярном употреблении свежего лука, чеснока значительно снижается обсемененность слизистой оболочки желудка H. руЬп и усиливаются защитные механизмы, предотвращающие развитие рака. Наличие
в рационе различных салатов и винегретов, в состав которых входят свежие овощи и зелень (капуста, укроп, петрушка, томаты и морковь) в сочетании с растительными жирами, содержащими ненасыщенные жирные кислоты, употребление томатного и фруктовых соков служит мерой профилактики не только РЖ, но и злокачественных новообразований других локализаций.
ПАТОМОРФОЛОГИЯ. ФОРМЫ РОСТА
Диффузный и интестинальный типы опухоли
РЖ подразделяют на 2 основные категории: ранний (early carcinoma) и распространенный (advanced carcinoma). На практике для морфологической характеристики распространенного РЖ применяется ставшая классической классификация, предложенная в 1926 г. R. Borrmann (рис. 19.3). В этой классификации определены критерии четырех анатомических типов роста распространенного рака:
• тип I - полиповидный (polipoid) тип, обладающий экзофитным ростом в просвет желудка;
• тип II - экзофитный изъязвленный (/ungating) тип опухоли, характеризующийся изъязвлением с приподнятыми краями и четкими границами - так называемый блюдцеобразный рак;
• тип III - язвенно-инфильтративный (ulctrating) тип, имеющий вид изъязвления, без четких границ с окружающей слизистой оболочкой желудка и с интрамуральной инфильтрацией желудочной стенки;
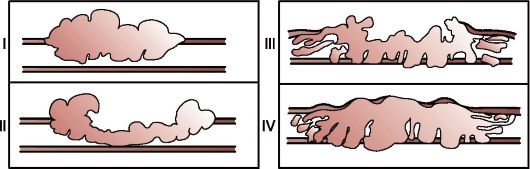 Рис. 19.3. Типы
роста распространенного рака желудка по R. Borrmann (1926): I -
полиповидный; II - экзофитный изъязвленный; III -
язвенно-инфильтративный; IV - диффузно-инфильтративный
Рис. 19.3. Типы
роста распространенного рака желудка по R. Borrmann (1926): I -
полиповидный; II - экзофитный изъязвленный; III -
язвенно-инфильтративный; IV - диффузно-инфильтративный
• тип IV - диффузно-инфильтративный (infiltrative) тип, распространяющийся поверхностно в слизистой и подслизистой оболочке с образованием плоских поражений с наличием мелких изъязвлений или без них. В распространенной стадии образуется диффузное циркулярное утолщение стенки желудка на значительном протяжении по типу пластического линита (linitis plastica) или «кожаной бутылки», зачастую с минимальными изменениями в слизистой оболочке.
Наиболее часто встречающиеся формы РЖ - изъязвленные типы II или III.
В классификации Японской ассоциации рака желудка (ЯАРЖ, 1998) выделен неклассифицируемый тип, сочетающий в себе элементы всех перечисленных типов роста опухоли.
Гистологическое строение РЖ отличается многообразием; для унификации гистологических заключений РЖ предложена Международная классификация ВОЗ (2000).
Международная гистологическая классификация опухолей желудка ВОЗ (2000)
Эпителиальные опухоли
Интраэпителиальная неоплазия - аденома
Карцинома
• Аденокарцинома:
- кишечный (интестинальный) тип;
- диффузный тип;
- папиллярная;
- тубулярная;
- муцинозная;
- перстневидно-клеточная.
• Железисто-плоскоклеточный рак
• Плоскоклеточный рак
• Мелкоклеточный рак
• Недифференцированный рак
• Другие
• Карциноид (хорошо дифференцированная эндокринная опухоль).
Аденокарцинома подразделяется по степени дифференцировки на высокодифференцированную, при которой эпителиальные опу-
холевые комплексы состоят из высокого цилиндрического эпителия; умеренно дифференцированную - образованную более уплощенными кубическими клетками или солидными сливающимися друг с другом клеточными пластами; к малодифференцированной аденокарциноме отнесены опухоли, в которых с трудом можно определить железистоподобные комплексы.
Муцинозная или коллоидная аденокарцинома представлена обширными озерами слизи, в которой обнаруживаются комплексы раковых клеток, формирующие тубулярные структуры, или разрозненных клеток, часто напоминающих перстневидные. По биологическому поведению не отличается от других типов аденокарциномы. Макроскопически муцинозные аденокарциномы имеют ослизневшний, пористый вид с блестящей поверхностью разреза.
Перстневидно-клеточный рак представлен крупными, не связанными или слабо связанными между собой пузырьковидными опухолевыми клетками, напоминающими своеобразные перстни (signet ring), содержащие в цитоплазме большое количество слизи; по составу последняя может быть «желудочной», «кишечной» или смешанной.
К недифференцированному раку относится опухоль, клетки которой имеют «рассыпной» характер роста и не формирующая железистоподобные структуры. Недифференцированный рак, как и аденокарцинома, происходит из камбиальных эпителиальных клеток слизистой оболочки желудка. В литературе, в основном японской, этот тип рака желудка обозначается также термином carcinoma simplex.
В группу недифференцированного рака следует отнести и неклассифицируемый тип, который гистологически может напоминать злокачественную лимфому или саркому. Эпителиальное происхождение этой опухоли определяется лишь иммунологическим фенотипом (экспрессия цитокератинов). Дальнейший анализ этой группы с использованием иммуногистохимических методов позволит в будущем разделить эту группу на другие типы.
Во многих случаях обнаруживаются сочетания различных гистологических форм РЖ. По мере инвазии карциномы в глубь стенки желудка комплексы опухолевых клеток зачастую утрачивают дифференцировку и предстают в виде мелких лимфоцитоподобных клеток, образуя тяжи и мелкие трубчатые структуры.
Другие очень редко встречающиеся опухоли в желудке включают смешанную аденокарциному-карциноид (экзокриново-эндокринная
карцинома), мелкоклеточный рак, париетально-клеточную карциному, хорионэпителиому, опухоль эндодермального синуса, эмбриональную карциному, аденокарциному, богатую клетками Панета, и гепатоидную аденокарциному.
Рак пищеводно-желудочного соединения, который, несомненно, следует выделить в отдельную нозологическую группу, имеет строение аденокарциномы. При этом муцинозная, перстневидно-клеточная карциномы в зоне пищеводно-желудочного перехода встречаются намного реже, чем тубулярная. Хорошо дифференцированные тубулярные аденокарциномы, особенно карцинома пилокардиального типа, могут быть очень трудны для морфологической диагностики. Аденокарцинома пилокардиального типа очень напоминает нормальные пилорические железы и состоит из высоких цилиндрических клеток со светлой цитоплазмой, базально или центрально расположенными ядрами, с небольшими признаками клеточной атипии.
В области пищеводно-желудочного соединения изредка может выявляться железисто-плоскоклеточная карцинома. В биоптатах плоскоклеточно-цилиндрического эпителиального соединения у пациентов с пищеводом Барретта выделена специфического типа гибридная клетка, имеющая на поверхности микроворсинки (признак цилиндрических клеток) и межклеточные мостики (признак клеток многослойного плоского эпителия), идентифицированная как клетка-предшественник данного типа рака. Чисто плоскоклеточный рак в желудке развивается крайне редко.
Особняком стоит казуистически редко встречающийся в зоне пищеводно-желудочного перехода мелкоклеточный анапластический рак, имеющий черты нейроэндокринной дифференцировки. По своим свойствам этот тип рака соответствует мелкоклеточному раку легкого и характеризуется крайне агрессивным и бурным течением.
В гистологической классификации ВОЗ (2000) приводится прогностическая морфологическая классификация РЖ, предложенная в 1965 P. Lauren, в которой все формы заболевания делятся на 2 типа: интестинальный (кишечный) и диффузный рак. Данная классификация основывается на способности клеток опухоли формировать железистоподобные комплексы.
Клетки рака интестинального типа представлены дифференцированными аденокарциномами и образуют тубулярные и сосочковые структуры. Опухоль, как правило, имеет четкие границы. Часто
в строме отмечается внеклеточная секреция слизи со скоплениями в виде озер. Крайний вариант такого рака - муцинозная карцинома - напоминает слизистую массу, в которой с трудом можно выявить опухолевые клетки.
Диффузный тип рака состоит из разбросанных среди грубой стромы изолированных клеток или мелких их групп, иногда образующих солидные структуры. Этот тип рака представлен недифференцированным и перстневидно-клеточным раком и малодифференцированными аденокарциномами. В цитоплазме некоторых клеток определяется секреция слизи (мукоида или муцина). Рак желудка диффузного типа не имеет четких границ. Для раннего рака диффузного типа характерен стелющийся инфильтрирующий рост в слизистой оболочке на большом протяжении.
Опухоли, которые содержат приблизительно равные количества интестинального и диффузного компонентов, называют «смешанными» карциномами, а новообразования, которые невозможно идентифицировать с категорией «интестинальный» или «диффузный» типы, относят в «неопределенную» группу.
Очень близка к классификации P. Lauren классификация S.Ch. Ming (1977). В ней предложено с учетом характера роста новообразований выделять экспансивный и инфильтративный типы рака. Экспансивный тип представлен четко отграниченными, экзофитными опухолевыми узлами и соответствует интестинальному типу. Для инфильтративной же карциномы характерны отсутствие четких границ и инвазивный рост. Эта форма рака характеризуется разрозненным распространением опухолевых клеток и слабой их связью, соответствуя диффузному типу. Примерно в30 % случаев инфильтративного типа рака в поверхностных отделах могут наблюдаться тубулярные и папиллярные структуры аденокарциномы, поэтому указанная патобиологическая классификация может быть применима и к группе неклассифицируемых опухолей, которые в ряде случаев не удается отнести к интестинальному или диффузному типу.
Сравнение гистотипа рака желудка и степени злокачественности показало, что относительно низкий уровень злокачественности присущ «интестинальному» типу рака, а более высокий - диффузному. Это связано с тем, что раковые клетки последнего типа слабо связаны между собой и легче распространяются по лимфатическим протокам и межтканевым пространствам.
Классификация P. Lauren получила очень широкое распространение и оказалась полезной при эпидемиологических исследованиях - при оценке морфогенеза и течения РЖ, взаимосвязи с экологическими факторами, частотными трендами (тенденциями). Интестинальный и диффузный типы имеют особенности клинического течения и биологического поведения, отличаются прогностически. Считается, что интестинальный тип РЖ возникает главным образом под действием экзогенных канцерогенных факторов, а диффузный в значительной мере связан с индивидуальными, генетическими особенностями организма (Correa P., Shiao Y., 1994). Диффузный тип РЖ наблюдается у лиц более молодого возраста, он чаще, чем интестинальный, поражает тело желудка. Эпидемиологические исследования, проведенные на основании классификации Lauren, показали, что рак интестинального типа является показателем, характеризующим эпидемиологическую ситуацию по раку желудка в географическом регионе в целом. Так, в районах с высокой частотой заболеваемости РЖ преобладает именно рак интестинального типа, и наоборот.
Различия в клиническом течении двух основных типов рака желудка объясняются морфологическими особенностями опухолей. Высокая пролиферативная активность клеток «кишечного» рака определяет высокую скорость их роста. Быстрое клиническое течение рака интестинального типа определяет его ранние клинические проявления, а тесная связь клеток ведет к меньшей инвазивности, чем обеспечивается возможность радикальной операции. Диффузный тип рака обладает более низкой пролиферативной активностью, что определяет длительность латентного течения таких опухолей. Слабая связь клеток друг с другом ведет к высокой инвазивности диффузного рака, что определяет больший объем радикального оперативного вмешательства и объясняет более низкий процент 5-летней выживаемости.
Интестинальный тип рака развивается преимущественно на фоне атрофии слизистой оболочки желудка, вызванной финальными проявлениями гастрита. При диффузном раке в основном наблюдаются неатрофические формы хронического гастрита или гипертрофия слизистой оболочки (гипертрофический гастрит).
ПОНЯТИЕ О РАННЕМ РАКЕ ЖЕЛУДКА
РЖ обладает высокоинвазивными свойствами, и прогноз его течения во многом определяется глубиной инвазии стенки желудка. При поражении раком слизистой оболочки или подслизистого
слоя 5-летняя выживаемость находится в пределах 90-100 %, прорастание опухоли в мышечный и особенно серозный слои стенки желудка характеризуется значительным ухудшением прогноза. В связи с этим в настоящее время в отдельную группу выделяется ранний РЖ, что определяется относительно благоприятным прогнозом и возможностями дифференцированного подхода к тактике лечения (рис. 19.4). Тактика лечения и прогноз раннего РЖ определяются: формой роста опухоли, глубиной инвазии стенки желудка (слизистый или подслизистый слой), а также возможным наличием лимфогенных метастазов. Очевидно, что достоверный диагноз раннего РЖ может быть установлен лишь на основании гистологического исследования удаленного препарата после эндоскопической мукозэктомии (удаление опухоли в пределах слизистой оболочки) или резекции пораженного органа.
Большинство исследователей к раннему относят рак, поражающий слизистую оболочку желудка или подслизистый слой, независимо от наличия или отсутствия метастазов в лимфатических узлах, которые можно диагностировать лишь гистологически.
Макроскопически ранний РЖ выглядит как сосочковое, гребневидное или полипозное образование над поверхностью слизистой оболочки в виде ее отграниченного утолщения с поверхностным изъязвлением или имеет вид плоской язвы с несколько утолщенными краями.
Согласно классификации Японского эндоскопического общества (1962), по макроскопическим характеристикам выделяется 3 основных типа раннего РЖ:
• тип I - выбухающий или приподнятый (protruded); соответствует грибовидному или полиповидному раку, выступает над уровнем слизистой оболочки более чем на 0,5 мм; составляет около 13 % раннего рака желудка;
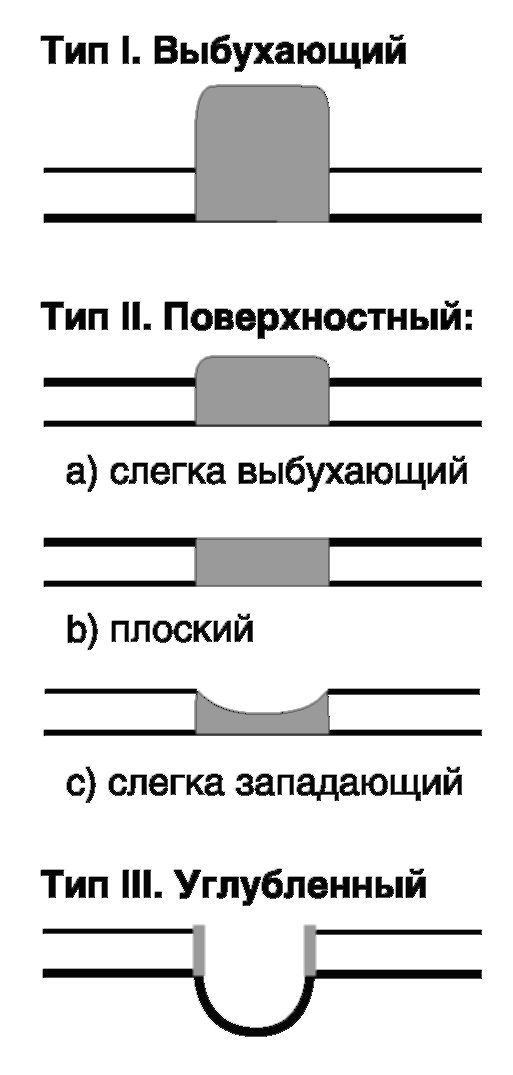 Рис. 19.4. Классификация раннего РЖ
Рис. 19.4. Классификация раннего РЖ
• тип II - поверхностный рак (superficial); его, в свою очередь, подразделяют на 3 подтипа:
- подтип а: слегка выбухающий, бляшковидный (elevated), возвышающийся над слизистой оболочкой менее чем на 0,5 мм; составляет около 16 % ранних форм рака;
- подтип b; плоский (flat); составляет около 2 %;
- подтип с; слегка западающий, эрозивный рак (depressed); характеризуется поверхностными изъязвлениями слизистой оболочки желудка, углублен не более чем на 0,5 мм ниже уровня слизистой оболочки, составляет около 59 %;
• тип III - подрытый, язвенный (excavated); с деструкцией стенки глубиной более 0,5 мм, встречается примерно в 10 % случаев раннего РЖ.
Наиболее частой формой раннего РЖ является подтип Пс. Вместе с типом III он составляет около 80 % всех случаев раннего РЖ и часто сопровождается язвенным синдромом. Наиболее трудно распознается ранний РЖ типа IIb и Пс. Зачастую ранний рак бывает первично-множественным.
Примечательно, что при сравнении полиповидного (тип I) и западающего типов РЖ (IIc и III) оказалось, что они имеют почти одинаковую пролиферативную активность, но апоптозная активность при западающем типе существенно выше (Okuyama S. et al., 1995); возможно, это и определяет характерный вид эрозии или язвы.
5-летняя выживаемость при раннем раке, прорастающем в подслизистый слой и с метастазами в лимфатические узлы, составляет около 80 %, а при внутрислизистом поражении без инвазии подслизистого слоя - до 100%. Поэтому выделение поражения раком подслизистого слоя чрезвычайно важно при выборе эндоскопического лечения РЖ (радикальная мукозэктомия).
При раке, поражающем лишь слизистую оболочку желудка, возможно эндоскопическое удаление опухоли - мукозэктомия в сочетании с перитуморальным лечением. Для проведения такого лечения необходимо соответствующее диагностическое оборудование и прежде всего наличие высокоразрешающего эндоскопического УЗ-томографа, который позволяет отчетливо визуализировать все слои стенки желудка и определять глубину инвазии опухоли, а также наличие перигастральных лимфатических узлов с признаками метастатического поражения.
При противопоказаниях к радикальной операции (например, при наличии сопутствующих тяжелых соматических заболеваний и пожилом возрасте пациента) диагностика раннего внутрислизистого РЖ позволяет произвести эндоскопическую мукозэктомию с последующим гистологическим исследованием либо лазерную фотокоагуляцию опухоли в пределах неизмененной слизистой оболочки; последнее обстоятельство является менее оправданным, так как отсутствует возможность контроля радикальности процедуры. Дополнительное антибактериальное лечение хронического гастрита, направленное на эрадикацию H. pylori, позволяет избежать инициирующего их влияния и предотвращает возможный рецидив опухолевого роста (Uemura N. et al., 1997).
Метастазирование. Стадии рака желудка
Рак желудка метастазирует тремя путями:
1) лимфогенно;
2) гематогенно;
3) имплантационно по брюшине.
Кроме того, могут встречаться различные комбинации перечисленных путей метастазирования.
Гематогенно наиболее часто РЖ метастазирует в печень. Частота выявления метастазов в печени составляет 38-54 %, реже метастазы могут наблюдаться в легких (2-22 %); надпочечниках (5-15 %), и крайне редко - в костях, подкожной клетчатке и др.
Имплантационные метастазы формируются при контактном переносе опухолевых клеток; в случае вовлечения брюшины появляются множественные опухолевые отсевы в виде мелкобугристых высыпаний, зачастую сопровождающиеся асцитом. Частота поражения брюшины при РЖ, по разным данным, отмечается в 17-24 % случаях; сальника - в 13-21 %, брыжейки поперечной ободочной и тонкой кишки - в 9 %, поджелудочной железы в 7-29 %.
Наиболее часто РЖ метастазирует лимфогенным путем. Чаще отмечается следующая последовательность метастазирования: вначале поражаются регионарные лимфатические барьеры (лимфатические узлы, расположенные в связках желудка), затем - лимфатические узлы 2-го этапа метастазирования, расположенные по ходу магистральных артерий чревного ствола. Третьим этапом лимфогенного метастазирования являются забрюшинные лимфатические коллекторы в ретропанкреатодуоденальной области, корне брыжейки тонкой
и толстой кишки, а также в области брюшной аорты (от уровня аортального отверстия диафрагмы до нижней брыжеечной артерии).
В отечественной литературе принято выделять 4 бассейна лимфогенного пути метастазирования рака из различных отделов желудка (по Мельникову А.В., 1960), что также характеризует этапность процесса:
• 1-й бассейн - отток лимфы происходит из большой кривизны пилорического отдела, а также прилегающих передней и задней стенок. Коллекторы лимфооттока: желудочно-ободочная связка ретропилорические узлы брыжейка начальной части тонкой кишки - забрюшинные лимфатические узлы (парааортальные);
• 2-й бассейн - лимфоотток из малой кривизны пилорического отдела и прилегающих передней и задней стенок. Коллекторы: по малой кривизне - по ходу правой желудочной артерии - ворота печени - внутри печени;
• 3-й бассейн - отток лимфы из тела желудка, кардиального отдела малой кривизны, медиальной части свода желудка. Коллекторы: малый сальник - желудочно-поджелудочная связка - забрюшинные надпанкреатические и парааортальные лимфатические узлы - средостение - параэзофагеальные узлы выше диафрагмы;
• 4-й бассейн - отток лимфы из вертикального отдела большой кривизны, прилегающих передней и задней стенок, значительной части свода желудка. Коллекторы: желудочно-ободочная связка - желудочно-селезеночная связка - ворота селезенки - селезенка.
С учетом интрамурального (внутриорганного) распространения для РЖ характерно распространение вверх по току лимфы в сторону малой кривизны и проксимального отдела желудка, а также желудочно-поджелудочной связки, где расположен главный коллектор лимфооттока желудка - лимфатические узлы по ходу левой желудочной артерии в сторону чревного ствола.
Однако сложившиеся представления о последовательности, этапности лимфооттока и метастазирования не всегда оправдываются. Примерно в 25 % случаев отмечаются «нарушения» этапности лимфогенного метастазирования - появление прыгающих метастазов. Все это диктует необходимость проведения при лечении РЖ расширенных радикальных операций с лимфодиссекциями.
КЛАССИФИКАЦИЯ
Классификация TNM Международного противоракового союза - МПС (2002)
В классификации МПС стадирование выполняется на всех этапах лечебного процесса, что отражается в индексе, располагающемся перед установлением стадии болезни: клиническое - cTNM, хирургическое - sTNM, патоморфологическое - pTNM, окончательное - fTNM и не меняется после первичного определения.
Клиническая классификация - cTNM. Определяет выбор лечения и основана на результатах исследования до начала основного лечения. Обследование больного включает физикальный осмотр, проведение лабораторных исследований, лучевых методов диагностики, эндоскопии и биопсии, дополнительной информации, полученной позднее. Является окончательной лишь в том случае, если принято решение не проводить лечение больного.
Патоморфологическая классификация, или постхирургическая патогистологическая классификация - pTNM - основана на клинических данных и результатах морфологического исследования удаленных после хирургического лечения тканей. Позволяет наиболее точно оценить прогноз заболевания. Гистологическое исследование лимфатических узлов после иссечения включает оценку общего их количества, а также числа пораженных лимфатических узлов. Метастатические очаги в жировой клетчатке, прилежащей к пораженной области желудка, расценивают как метастазы в регионарные лимфатические узлы даже при отсутствии остатков нормальной лимфоидной ткани. Вместе с тем поражение брюшины относят к отдаленным метастазам.
Классификация рецидивирующей опухоли - rTNM - используется при планировании повторного лечения (например, химиотерапии). Стадию рецидивирующей опухоли (rTNM) определяют на основании информации, полученной в результате повторной диагностики и лечения.
Классификация по данным аутопсии - aTNM - проводится после смерти больного в случае, если при жизни опухоль не была диагностирована. Классификация aTNM включает всю информацию, полученную в процессе патоморфологического исследования трупного материала.
Клинической стадией руководствуются в процессе выбора первичного метода лечения, а патоморфологическое стадирование необходимо для оценки правильности определения адъювантной терапии, прогноза и исхода заболевания. Классификация рTNM является
наиболее значимой, но не заменяет клиническую: обе указываются в истории болезни. При сомнении в выборе индекса показателей T, N или M нужно указывать наименьший индекс. Тот же принцип используют и в отношении стадии рака.
Категория Т- первичная опухоль
Tх - оценка первичной опухоли невозможна. T0 - первичная опухоль не обнаружена.
Tis - преинвазивная карцинома*: интраэпителиальная опухоль без инвазии собственной пластинки слизистой оболочки (carcinoma in situ).
T1 - опухоль, ограниченная слизистой оболочкой желудка и подслизистым слоем.
T2 - опухоль проникает в мышечную пластинку слизистой оболочки или субсерозную оболочку**:
T2a - опухоль прорастает в мышечную пластинку слизистой оболочки;
T2b - опухоль поражает субсерозную оболочку.
T3 - опухоль прорастает серозную оболочку (висцеральную брюшину) без инвазии в соседние органы***, ****.
T4 - опухоль распространяется на соседние органы и ткани.
Обратить внимание!
* Данная категория распространенности РЖ почти не применяется, будучи по сути проявлением желудочной интраэпителиальной неоплазии тяжелой степени.
** Опухоль способна проникать в мышечную пластинку слизистой оболочки с поражением желудочно-ободочной или желудочно-печеночной связок либо большого и малого сальника без прорастания висцеральной брюшины, покрывающей указанные структуры. В этих случаях опухоль расценивают как T2. При наличии прорастания серозной оболочки, покрывающей связки желудка или сальник, опухоль оценивают как T3.
*** Органы и ткани, прилегающие к желудку, включают селезенку, поперечную ободочную кишку, печень, диафрагму, поджелудочную железу, стенки брюшной полости, надпочечники, почки, тонкую кишку и забрюшинное пространство.
**** Инвазию опухоли в стенку пищевода, желудка или двенадцатиперстной кишки оценивают по глубине максимального проникновения.
Категория N - поражение регионарных лимфатических узлов
N - разрешается отмечать только после гистологического исследования удаленного препарата. Nx - недостаточно данных для оценки регионарных лимфатических узлов.
N0 - нет признаков метастатического поражения регионарных лимфатических узлов.
N1 - имеются метастазы в 1-6 регионарных лимфатических узлах.
N2 - имеются метастазы в 7-15 регионарных лимфатических узлах.
N3 - имеются метастазы более чем в 15 регионарных лимфатических узлах.
Обратить внимание!
Стадию pN0 ставят в том случае, если все исследованные лимфатические узлы не имели очагов метастазирования. Общее количество удаленных и исследованных лимфатических узлов может быть <15.
Категория М - отдаленные метастазы
• Мх - недостаточно данных для определения отдаленных метастазов.
• МО - нет признаков отдаленных метастазов.
• М1 - имеются клинические, рентгенологические или операционные данные о наличии отдаленных метастазов, включая лимфатические узлы, кроме регионарных.
Категория М1 дополняется конкретными указаниями на проявления отдаленных метастазов: pul - легкое, per - брюшная полость, mar - костный мозг, bra - головной мозг, oss - кости, ski - кожа, per - брюшина, ple - плевра, lym - лимфатические узлы, пер - печень, oth - другие локализации.
Например, М1(пер) или M1(pul2) - 1 метастаз в печени или 2 в легких; М^пер^фиО) - одновременно: 1 метастаз в печени и 2 в легких.
Группировка по стадиям
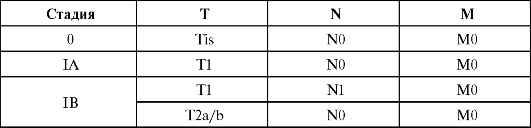 Окончание табл.
Окончание табл.
 Дополнительно в классификации TNM отмечается степень злокачественности опухоли.
Дополнительно в классификации TNM отмечается степень злокачественности опухоли.
Степень злокачественности (G-grade)
Ох - оценка степени дифференцировки невозможна.
G1 - низкая злокачественность.
G2 - умеренная злокачественность.
G3 - высокая злокачественность.
G4 - недифференцированная опухоль.
Классификация Японской ассоциации по раку желудка (ЯАРЖ, 1998)
В настоящее время в практической онкологии применяется также классификация РЖ, разработанная ЯАРЖ (1998). При одинаковом подходе при оценке основных характеристик опухолевого процесса между этой классификацией и МПС существуют различия, связанные в первую очередь с подходами к философии лечения, и заключаются в степени агрессивности хирургического подхода.
В классификации ЯАРЖ дается более детальное описание самой опухоли, включая морфологическую характеристику, локализацию, форму роста, глубину инвазии, в сочетании с топографическим подходом при выделении регионарных лимфатических коллекторов. При этом тактику лечения определяют данные морфологических исследований, выполняемых на всех этапах лечения (особенно пред- и интраоперационные).
Описание первичной опухоли
В связи со значительным возрастанием частоты выявления раннего РЖ, увеличением возможностей эндоскопического лечения, а также расширением показаний к выполнению лапароскопических вмешательств обязательным является дополнение индекса Т сведениями о глубине прорастания: в пределах слизистой - m (mucosa), в пределах подслизистого слоя - sm (submucosa), до мышечной оболочки - mp (muscularis propria), субсерозно - ss (subserosa), с выходом на серозную оболочку - se (serosa exposed) и врастанием в окружающие структуры - si (serosa infiltrating).
Первичная локализация опухоли при поражении верхней трети стенки желудка шифруется индексом - U (upper third), средней трети - М (middle third), тела желудка и нижней трети (пилороантральный отдел) - L (lower third). Уточняется локализация опухоли в зависимости от расположения по окружностям стенки желудка: на передней (ant) или задней (post) стенке, малой (less) или большой (gre) кривизне. При циркулярном поражении стенки органа указывается индекс Circ (circumferencial inviolvement).
В классификации есть дополнительное разделение раннего РЖ (Т1) с прорастанием подслизистого слоя по глубине инвазии: sm1 - глубиной менее 0,5 мм от мышечной пластинки слизистой оболочки; sm2 - глубиной более 0,5 мм. Эти данные играют решающую роль при выборе показаний к выполнению эндоскопических (эндоскопическая мукозэктомия) и открытых операций на желудке после эндоскопической мукозэктомии (которая при этом рассматривается как тотальная биопсия опухоли, а не как радикальное лечение). Необходимость проведения радикальной открытой операции определяет глубина опухолевой инвазии, превышающая 0,5 мм (sm2). Во всех случаях после мукозэктомии при морфологическом исследовании изучают границы резецированного фрагмента для выявления опухолевых клеток: указываются латеральные (Lateral margins - LM) и вертикальные (Vertical margin - VM) границы.
Клиническая классификация рака оперированного желудка ЯАРЖ включает 3 основные пункта, описывающие анамнез и характер поражения культи желудка:
• причину предшествующей операции на желудке (доброкачественная, злокачественная, неизвестно);
• время, прошедшее после вмешательства, год;
• локализацию опухоли: анастомоз (A), линия механического шва (S), другая локализация в культе (O), тотальное поражение (T), а также переход на пищевод (E), тощую кишку (J) или дуоденум (D).
Лимфогенные метастазы
В зависимости от локализации первичной опухоли в желудке и расположения метастатически измененного лимфатического коллектора в классификации ЯАРЖ лимфатические коллекторы разделяются на 4 подгруппы: N0^N1^N2^N3; причем в основе разделения по «этапам метастазирования» лежат данные анатомо-морфологических исследований по лимфодинамике желудка в норме и при патологии и соответствие с данными о выживаемости больных РЖ. Именно этот принцип позволяет рассматривать данную классификацию как «анатомическую», в противоположность «количественному» принципу, лежащему в основе классификации МПС.
При этом разделение зон лимфогенного метастазирования по топографическому принципу, лежащее в основе Японской классификации, более достоверно отражает распространенность процесса и, следовательно, прогноз заболевания. Эти данные находят подтверждение в корреляции результатов выживаемости, локализации первичной опухоли и отдаленности пораженного коллектора. Согласно данным Y. Noguchi и соавт. (1998), при поражении коллекторов N0^N1^N2^N3 отмечается прогрессирующее снижение частоты 5-летней выживаемости соответственно до 85, 60, 25 и 11%.
В классификации ЯАРЖ большое значение придается прыгающим метастазам в виде поражения более отдаленных лимфатических коллекторов при отсутствии метастазов в более проксимально расположенных лимфатических узлах. Причем даже один прыгающий метастаз может кардинальным образом изменить стадию заболевания и прогноз. Прыгающие метастазы также играют очень важную роль в таком явлении, как феномен миграции стадии.
При характеристике лимфогенного метастазирования в ЯАРЖ определяется процентное соотношение метастатически измененных с общим количеством удаленных лимфатических узлов. Данный показатель является интегральным и отражает, с одной стороны, лимфогенную распространенность процесса, а с другой - адекватность выполненной лимфодиссекции.
Классификация отдаленных метастазов
Наиболее частыми зонами отдаленного метастазирования при РЖ являются печень и брюшина, что определило необходимость разработки новых направлений комбинированного лечения диссеминированного РЖ: комбинированных вмешательств с резекцией печени и последующей внутриартериальной химиотерапией с применением гипертермической интраоперационной интраперитонеальной химиотерапии, определивших необходимость выделения данных зон метастазирования в отдельные группы с собственным индексным обозначением. Так, наличие метастазов в печень обозначается в виде трех градаций: Н1-Н3 (в зависимости от количества и локализации метастазов); наличие отсевов по брюшине классифицируется как Р1-Р3.
В классификации МПС (2002) такой характер метастатического поражения стандартно описывается соответственно как M1(Hep) или M1(Per), причем распространенность поражения не указывается, что не позволяет однозначно трактовать характер поражения, а следовательно, планировать возможность комбинированного лечения.
К отдаленным, помимо выявляемых при обследовании органных метастазов (печень, легкие, кости, почки, надпочечники, головной мозг), относятся также следующие зоны возможного поражения, специфически характерные для РЖ:
• опухолевые отсевы по брюшине, выявляемые при лапароскопическом исследовании;
• метастаз Вирхова (Вирховская железа) - метастаз в левые надключичные лимфатические узлы, расположенные между ножек грудиноключично-сосцевидной мышцы. Увеличенные размеры, форма и специфическая консистенция лимфатических узлов данной группы являются показанием к выполнению УЗИ шейнонадключичной зоны с последующей пункционной биопсией;
• метастазы Шницлера - метастазы в параректальную клетчатку. Данное поражение выявляется при исследовании пациента per rectum. В случае возникновения подозрения на наличие метастазов Шницлера необходимо трансректальное УЗИ с последующей пункционной верификацией;
• метастазы Крукенберга - метастазы в яичники; наиболее часто выявляются при УЗИ брюшной полости. При обнаружении увеличенных яичников либо прямом подозрении на их поражение пациенткам выполняют лапароскопическое исследование с визуальной и морфологической оценкой характера процесса. На
сегодняшний день метастазы Крукенберга рассматриваются не как гематогенные или имплантационные, а как лимфогенные, косвенно свидетельствующие о широком поражении парааортального лимфатического коллектора. Этим обусловлено и обязательное в данном случае двустороннее поражение яичников. С учетом такого механизма поражения метастазы Крукенберга не рассматриваются как противопоказание к хирургическому лечению. Однако у таких больных изначально необходимо планировать выполнение расширенной парааортальной лимфодиссекции D3 с двусторонней овариэктомией.
Регионарные висцеральные лимфатические узлы желудка
Наиболее точно регионарные зоны лимфооттока и метастазирования определены в классификации ЯАРЖ, что определяет выбор объема лимфодиссекции при радикальных операциях. В классификации выделяется 3 этапа регионарного метастазирования лимфатических узлов желудка.
К лимфатическим узлам первого этапа метастазирования (N1) относятся перигастральные узлы, расположенные в поверхностных связках желудка. В зависимости от локализации эти лимфатические узлы разделяются на 6 групп:
1) правые паракардиальные лимфатические узлы;
2) левые паракардиальные лимфатические узлы;
3) лимфатические узлы малой кривизны желудка;
4) лимфатические узлы большой кривизны желудка:
4s (левая группа) - лимфатические узлы вдоль левой желудоч-
но-сальниковой артерии и коротких артерий желудка;
4d (правая группа) - вдоль правой желудочно-сальниковой
артерии;
5) надпривратниковые лимфатические узлы;
6) подпривратниковые лимфатические узлы.
К лимфатическим узлам второго этапа метастазирования (N2) относятся узлы, расположенные по ходу чревного ствола и его ветвей: левой желудочной, общей печеночной и селезеночной артерии, а также в воротах селезенки. Некоторые лимфатические узлы из этих групп разделяются на подгруппы, в зависимости от их локализации по отношению к поверхности сосуда или к его сегменту:
1) лимфатические узлы вдоль левой желудочной артерии;
2) лимфатические узлы вдоль общей печеночной артерии;
3) лимфатические узлы вокруг чревного ствола;
4) лимфатические узлы ворот селезенки;
5) лимфатические узлы вдоль селезеночной артерии.
К лимфатическим узлам третьего этапа метастазирования (N3) относятся глубокие лимфатические коллекторы ретропанкреатодуоденального пространства, в области корня брыжейки тонкой и толстой кишки, а также в парааортальной области:
1) лимфатические узлы печеночно-двенадцатиперстной связки;
2) ретропанкреатические лимфатические узлы;
3) лимфатические узлы корня брыжейки;
4) лимфатические узлы вокруг средней ободочной артерии;
5) парааортальные лимфатические узлы;
6) нижние параэзофагеальные лимфатические узлы;
7) диафрагмальные лимфатические узлы.
С учетом исследований по результатам выживаемости вовлечение лимфатических коллекторов N1-N2 рассматривается как регионарное метастазирование, тогда как вовлечение лимфатических узлов N3 - как распространенность, соответствующая IV стадии заболевания (Sasako М. et al., 1995; Aiko T. et al., 1998).
Последний вариант классификации ЯАРЖ (1998) является результатом эволюции взглядов онкологов на проблему лечения РЖ и применения современного арсенала соответствующих методов. Эта классификация является надежным инструментом, который не только механистически определяет стадию заболевания, но и позволяет выбирать оптимальную тактику лечения, прогнозируя последующее течение заболевания. Анализ выживаемости больных с учетом стадий РЖ показал большую достоверность классификации ЯАРЖ, чем МПС (редакция 1987 и 1997 гг.) (de Manzoni et al., 1999). Однако при всех преимуществах классификации ЯАРЖ пока не получила такого широкого распространения, как классификация МПС.
Классификация рака проксимального отдела желудка
Рак проксимального отдела желудка с переходом на пищевод (синонимы: кардиоэзофагеальный рак, рак кардиоэзофагеального перехода и рак желудочно-пищеводного соединения) имеет своеобразное клиническое течение и биологические свойства, что определяет самостоятельную тактику его лечения. Однако в настоящее время данная локализация рака еще не выделена в отдельную нозологическую группу.
В группу кардиоэзофагеального РЖ включены аденокарциномы, которые пересекают пищеводно-желудочное соединение, независимо от того, где находится большая часть опухоли, и рак проксимальной части желудка с поражением кардии. Аденокарциномы, расположенные полностью выше пищеводно-желудочного перехода, рассматриваются как первичный рак пищевода. Плоскоклеточный рак, локализующийся на стыке пищевода и желудка, даже если пересекает пищеводно-желудочное соединение, рассматривается как карцинома дистального отдела пищевода.
Внешним ориентиром пищеводно-желудочного перехода является условная анатомическая линия, расположенная на 0,5 см выше кардиальной вырезки (incisura cardialis). Со стороны слизистой оболочки кардиальному отверстию соответствует Z-линия, сформированная на стыке многослойного плоского и цилиндрического эпителия. Гистологически Z-линия может локализоваться на уровне пищеводно-желудочного соединения или несколько выше, редко расширяясь более чем на 2-3 мм над анатомической линией. При эндоскопическом исследовании граница пищеводно-желудочного перехода определяется как розетка кардии - проксимальная граница желудочных складок, которая соответствует месту перехода пищевода в расширение, образованное желудком.
К пищеводу непосредственно примыкает желудочная кардия - область желудка шириной около 2 см. От пищеводно-желудочного эпителиального соединения берет начало кардиальный отдел желудка, но его дистальная распространенность не имеет отчетливых границ. Желудочная кардия включает в себя сфинктер, препятствующий рефлюксу желудочного содержимого в пищевод.
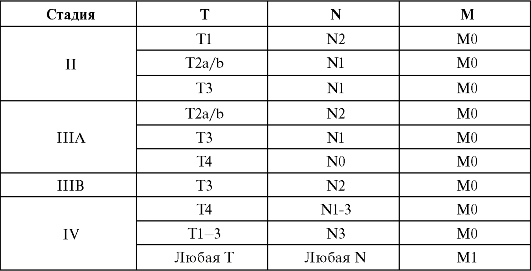
J. Siewert и соавт. (1996) предложена универсальная классификация аденокарциномы зоны пищеводно-желудочного перехода, которая объединяет: рак дистальной трети пищевода, рак проксимального отдела желудка с переходом на пищевод (истинный кардиоэзофагеальный рак) и рак субкардии. Данная классификация аденокарцином пищеводно-желудочного перехода, обладая высокой прогностической значимостью, очень удобна для стандартизации и, соответственно, выбора лечения.
Опорным критерием классификации J. Siewert является определение локализации эпицентра опухоли относительно пищеводно-желудочного перехода и анатомической зоны кардии (рис. 19.5). Анатомический центр опухоли идентифицируется на основании
 Рис. 19.5. Классификация аденокарциномы кардиоэзофагеального перехода по J. Siewert (1998)
Рис. 19.5. Классификация аденокарциномы кардиоэзофагеального перехода по J. Siewert (1998)
рентгеноконтрастного исследования, фиброгастроскопии и данных, полученных при интраоперационном исследовании. С учетом локализации центра новообразования выделено 3 типа опухоли.
Тип I - аденокарцинома дистального отдела пищевода, эпицентр которой расположен в пределах от 1 до 5 см выше зоны пищеводножелудочного перехода (Z-линии) с возможностью распространения через последнюю в сторону желудка. Данный тип составляет около 80 % случаев кардиоэзофагеального рака, развивается из метаплазированного эпителия пищевода (пищевод Барретта) и в основном соответствует «интестинальной» форме опухоли по классификации Lauren. При этом типе опухоли удельный вес опухолей с выходом на серозную оболочку относительно невысокий.
Тип II - представлен истинной аденокарциномой зоны пищеводно-желудочного перехода (истинный рак кардии); эпицентр ее расположен в пределах 1 см проксимальнее (орально) и 2 см дистальнее (аборально) от Z-линии. Этот тип рака развивается из эпителия кардиального отдела желудка, значительно реже - из метаплазированного цилиндрического эпителия пищевода. Частота пищевода Барретта при II типе составляет около 10 %. При этом типе преобладает диффузная форма опухоли по классификации Lauren и наиболее низок удельный вес опухолей с инвазией серозной оболочки (29 %).
Тип III - наиболее неблагоприятный в прогностическом плане. Основной массив опухоли локализуется в субкардиальном отделе желудка (от 2 до 5 см аборально от Z-линии). Возможен переход рака в дистальный отдел пищевода. Частота пищевода Барретта при этом типе рака составляет лишь 2 %. При этом типе наиболее высок удельный вес недифференцированных и диффузных форм рака (по Lauren), инвазии серозной оболочки, лимфогенных и отдаленных метастазов. Основной причиной запущенных стадий кардиоэзофагеального рака III типа (около 70 %) является позднее к моменту диагностики появление клинической симптоматики - дисфагии.
На основании результатов лечения более чем 1600 пациентов (за период с 1982 по 2003 г.) J. Siewert и соавт. (2006) установили, что наилучшим прогнозом характеризуется I тип кардиоэзофагеального рака, возникший на фоне пищевода Барретта. Хуже прогноз при II типе, который по характеристикам более сходен с типом III, чем с типом I. При III типе кардиоэзофагельного рака отмечаются наихудшие результаты, что обусловлено преобладанием опухолей диффузного типа с более высокой частотой вовлечения серозной оболочки и наличием лимфогенных метастазов.
Распространенность и стадирование рака проксимального отдела желудка
Общий показатель частоты лимфогенного метастазирования рака проксимального отдела желудка составляет 65,5 %, что свидетельствует о его высоком злокачественном потенциале. При различной локализации опухоли относительно пищеводно-желудочного перехода отмечается разная направленность лимфооттока, что определяет выбор соответствующего алгоритма хирургического лечения (Siewert J. et al., 1998; Holscher A.H., 2002). Частота лимфогенного метастазирования увеличивается по мере вовлечения в опухолевый процесс пищевода. При локализации опухоли лишь в проксимальном отделе желудка, без перехода на пищевод, частота лимфогенного метастазирования составляет 41,4 %, при инфильтрации розетки кардии она возрастает до 56,7 %, а при переходе на пищевод - 68,0 %. Сказанное определяет необходимость повышенного радикализма хирургического вмешательства при кардиоэзофагеальном раке с выполнением абдоминальной и медиастинальной лимфодиссекции с целью иссечения макро- и микрометастазов в лимфатических узлах.
Аденокарциномы пищеводно-желудочного перехода склонны к восходящему распространению по лимфатическим сосудам, главным
образом по подслизистому слою пищевода. Поэтому во время операции рекомендуется проводить интраоперационное исследование проксимальной линии резекции удаленного макропрепарата в замороженных срезах. Восходящее лимфогенное метастазирование может быть направлено в сторону средостенных лимфатических узлов, на значительное расстояние от первичной опухоли.
При раке желудочно-пищеводного перехода с поражением нижнегрудного отдела пищевода лимфоотток направлен как в оральном направлении, в сторону лимфоколлекторов средостения, так и в сторону лимфоколлекторов брюшной полости и забрюшинного пространства. При раке кардии и субкардии основной вектор лимфооттока направлен в лимфатические узлы вдоль пищеводно-желудочных углов и левой желудочной артерии, в околочревные и верхние парааортальные лимфатические узлы.
Согласно рекомендациям классификации TNM, предложенной МПС, участок рака пищеводно-желудочного соединения, который находится главным образом на желудочной стороне, классифицируется аналогично желудочным опухолям, в то время как участок, преобладающий на пищеводной стороне, должен стадироваться согласно TNM для рака пищевода.
Учитывая принципиальные различия в характере лимфооттока и, соответственно, основных направлениях лимфогенного метастазирования рака дистальной трети пищевода и рака кардиального отдела желудка, R. Korst и соавт. (1998) считают необходимым пересмотреть параметры категории N аденокарциномы пищеводно-желудочного соединения. По мнению авторов, при аденокарциноме дистальной трети пищевода регионарными являются бифуркационные, заднемедиастинальные, паракардиальные и лимфатические узлы по ходу левой желудочной артерии. При раке кардиального отдела желудка регионарными являются перигастральные и забрюшинные лимфатические узлы чревного ствола и его ветвей, а также нижние параэзофагеальные лимфатические узлы.
ОСЛОЖНЕНИЯ
РЖ даже в операбельной стадии может вызывать ряд тяжелых осложнений. В.А. Самсонов (1989) выделяет 2 группы осложнений РЖ: 1-ю составляют осложнения болезни, 2-ю - послеоперационные осложнения и осложнения специфических методов лечения. В зави-
симости от преобладающих этиологических и патогенетических механизмов выделены следующие подгруппы осложнений:
1) обусловленные стенозирующим действием первичной опухоли;
2) вызванные распадом и изъязвлением первичной опухоли;
3) преимущественно токсического происхождения;
4) связанные с местным воздействием метастазов опухоли;
5) инфекционные;
6) тромбоэмболические;
7) смешанная группа.
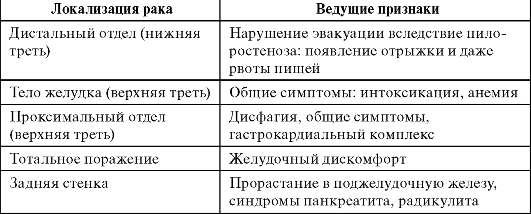
Из осложнений, обусловленных стенозирующим действием первичной опухоли, наиболее часто возникает стеноз привратника. При этом наблюдается нарушение эвакуаторной функции желудка, приводящее к расстройствам водно-солевого обмена. При карциноме проксимального отдела желудка присоединяется дисфагия.
Среди осложнений, вызванных распадом и изъязвлением раковой опухоли желудка, чаще всего отмечаются желудочное кровотечение и перфорация опухоли. Кровотечение при раке желудка выявляется довольно часто, однако массивное профузное кровотечение встречается редко и наблюдается преимущественно при раке малой кривизны, прорастающем в крупные сосуды, печень, селезенку.
Перфоративный РЖ составляет до 4 % всех случаев рака этого органа. Чаще перфорация происходит в свободную брюшную полость. Часто диагностику перфорации при РЖ затрудняют атипичность и стертость клинических проявлений, особенно при сочетании с кровотечением, прикрытии перфорационного отверстия соседними органами, наличии асцита, а также при перфорации в полые органы.
Распад опухоли способствует ее инфицированию, возникновению флегмон и абсцессов, что может проявиться повышением температуры тела и местными симптомами со стороны брюшной полости и других органов, в которых развился гнойный процесс.
Метастазы РЖ оказывают как общее действие на организм (интоксикация продуктами метаболизма опухоли), так и местное. Метастазы РЖ во внутренние органы вызывают нарушение функции последних. Среди этих нарушений следует отметить печеночную и дыхательную недостаточность, развитие обтурационной кишечной непроходимости, межкишечных свищей, панмиелофтиза при множественных метастазах в костный мозг.
Из группы токсических осложнений чаще всего наблюдается истощение. Его развитие может быть обусловлено общим токсическим
воздействием продуктов распада опухоли, интоксикацией при возникновении инфекционных процессов, неполноценным питанием при наличии анорексии (отсутствие аппетита) и стеноза входного или выходного отделов желудка. У больных со стенозирующим раком развиваются нарушения азотистого и электролитного обмена, гипокалиемия, дефицит белка с гипоальбунемией, задержка натрия и хлора в организме. Общая анемия, часто сопровождающая РЖ, может быть обусловлена всеми вышеперечисленными факторами.
Токсическое воздействие при опухолевом распаде может влиять на сердечную мышцу, вызывая в ней дистрофические изменения и осложняя течение сопутствующей сердечной патологии (например, ишемической болезни сердца). Клиническим проявлением этих изменений может быть сердечно-сосудистая недостаточность. Оперативное вмешательство у ряда больных усугубляет скрытую сердечно-сосудистую недостаточность, которая начинает проявляться как осложнение послеоперационного периода. Это же можно отнести к некоторым случаям острой почечной и печеночной недостаточности.
Из инфекционных осложнений при РЖ преобладает очаговая пневмония. При этом у значительной части оперированных больных она развивается как осложнение вмешательства и послеоперационного периода, и в большинстве случаев ее следует рассматривать как проявление аутоинфекционного процесса в бронхах и легких. В патогенезе данного осложнения, кроме нарушений дренажной функции бронхиального дерева и кровообращения, большое значение имеют иммуннодепрессия и нарушение нервной регуляции функции дыхательной системы. Все перечисленные нарушения могут усугубляться вследствие травматизации нервных стволов (например, при перерезке блуждающих нервов, особенно при гастрэктомиях и проксимальных резекциях желудка).
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая симптоматика РЖ отличается многообразием и отсутствием ярких патогномоничных симптомов. Все многообразие жалоб, с которыми больные обращаются к врачу, можно разделить на 2 группы:
1) изменения общего состояния;
2) гастритические жалобы (характерные для хронического гастрита), которые предъявляют 2/3 больных РЖ.
По характеру течения различают 3 основных клинических варианта РЖ:
1) латентный;
2) безболевой;
3) с болевым синдромом.
При латентной форме РЖ протекает бессимптомно, первые признаки заболевания проявляются в виде пальпируемой опухоли, дефекта наполнения желудка, выявляемого во время рентгенологического исследования, массивного кровотечения, отдаленных метастазов или симптомов, вызванных прорастанием опухоли в близлежащие органы. Чаще наблюдаются безболевые формы рака желудка, а болевой синдром присоединяется в терминальном периоде болезни.
Большие трудности вызывает диагностика РЖ на ранних стадиях, и важно использовать диагностические критерии, которые позволили бы заподозрить наличие опухолевого процесса в желудке, чтобы направить пациента на рентгенологическое исследование и гастроскопию. А.И. Савицкий (1951) объединил начальные клинические проявления РЖ в синдром «малых признаков», подчеркнув при этом, что очень важно выделять не отдельные подозрительные симптомы, а весь симптомокомплекс. Синдром «малых признаков» включает следующую симптоматику:
1) немотивированная общая слабость, снижение трудоспособности, быстрая утомляемость;
2) анорексия - немотивированное стойкое снижение аппетита вплоть до отвращения к пище, преимущественно мясной;
3) явления «желудочного дискомфорта» - ощущение переполнения желудка, чувство давления, тяжести и болезненности в эпигастрии. Больные ограничивают количество принимаемой пищи, становятся разборчивыми, «капризными» в ее выборе;
4) беспричинное похудение;
5) психическая депрессия, апатия, некоторая отчужденность, потеря интереса к окружающему, к тому, что раньше вызывало интерес.
При опухолях кардиальной части желудка к перечисленным симптомам могут присоединиться дисфагия разной степени выраженности, боль за грудиной, напоминающая стенокардическую, боль при глотании пищи (одинофагия), избыточное слюноотделение.
Чаще всего рак желудка проявляется общими симптомами, к которым постепенно присоединяются явления «желудочного дискомфорта», затем - болевого синдрома, а при наличии осложнений -
кровотечения из ракового изъязвления, перфорация опухоли, непроходимость пищи.
Больные жалуются на боли в эпигастральной области, которые могут иррадиировать в поясницу и быть связанными с приемом пищи. Боль при РЖ возникает вскоре после еды и локализуется в подложечной области. Нередко она продолжается длительное время, иногда весь день; может усиливаться при движении больного. При РЖ боли не носят закономерного характера и напоминают боли при гастрите с секреторной недостаточностью. Они не стихают после приема пищи, нет «голодных» болей или их сезонности. Однако при гастрите, в отличие от рака, боли нестойкие и сравнительно легко поддаются терапевтическому лечению.
В некоторых случаях при распространенных формах РЖ боли могут быть достаточно интенсивными. При прорастании опухолью забрюшинной клетчатки возможны жалобы на боли в спине; такие пациенты обычно лечатся по поводу радикулита, невралгии. Одним из признаков рака кардиального отдела желудка является боль в левой половине грудной клетки.
Примерно у4% больных РЖ могут наблюдаться кровотечения, проявляющиеся кровавой рвотой (иногда повторной) или дегтеобразным стулом. Однако наличие кровотечения не всегда служит критерием запущенности процесса.
Кроме перечисленных проявлений при распространенных типах РЖ могут наблюдаться рвота, анорексия, повышение температуры тела, что связано с распадом и инфицированием опухоли, кишечные расстройства.
В.Х. Василенко (1959) выделил атипичные формы клинического течения - так называемые клинические маски РЖ.
1. Лихорадочная форма. Основным симптомом заболевания является лихорадка. Температура, как правило, субфебрильная с периодическими подъемами до 39-40 °С.
2. Гипогликемическая (коматозная) форма. Характеризуется спонтанной гипогликемией и развитием коматозного состояния, что характерно для опухолей, прорастающих в хвост поджелудочной железы.
3. Желтушная форма. Желтуха возникает за счет усиленного гемолиза или токсического гепатоза в результате действия продуктов распада опухоли.
4. Тетаническая форма. Наблюдается при раке пилорической части желудка, протекающем со стенозом привратника. Нарушение пассажа
пищи, сопровождающееся рвотой, способствует развитию электролитных нарушений и проявляется тетаническими сокращениями мышц.
5. Кахектическая форма. Протекает малосимптомно, сопровождается выраженной кахексией, чаще возникает у больных пожилого возраста.
6. Диспепсическая форма. Протекает с нарушениями пищеварения в виде различных видов диспепсий (понижение аппетита, анорексия, быстрое насыщение и т.д.).
Клиническая диагностика РЖ основывается на выявлении симптоматики рака желудка: жалоб, анамнеза, осмотра, данных физикальных методов обследования: пальпации, перкуссии, аускультации и др.
Жалобы
Большинство больных РЖ предъявляют те или иные гастритические жалобы - на ощущение тяжести, полноты в желудке, понос, отрыжку и рвоту. Наиболее настораживающими жалобами являются снижение аппетита, боли, похудение, снижение работоспособности, депрессия, входящие в симптомокомплекс синдрома «малых признаков».
При клиническом распознавании РЖ наибольшие трудности вызывает болевой синдром, часто наблюдающийся и при язвенной болезни. При язве боли в основном отмечаются через 1,5-2 ч после приема пищи и сопровождаются изжогой, отрыжкой кислым желудочным содержимым, тошнотой, рвотой, кишечными расстройствами, кровотечениями, проявляющимися кровавой рвотой или дегтеобразным стулом. Боли язвенного генеза часто стихают после рвоты, поэтому больные нередко вызывают рвоту, чтобы облегчить свое состояние.
Отличительная черта «язвенных» болей - строгая их локализация на участке, равном окружности конца пальца. Локализация боли по всей эпигастральной области без точной локализации более характерна для рака желудка. Для язвенной болезни характерна иррадиация болей. Если язва расположена в желудке, особенно в его кардиальном отделе, боли могут иррадиировать в область сердца и напоминать коронарные. При язве пилородуоденального отдела боли чаще иррадиируют в спину и область правого подреберья.
При РЖ болевой анамнез значительно короче, чем при язвенной болезни (несколько недель или месяцев), не содержит указаний на характерную для язвенной болезни периодичность. Боли при начальных формах РЖ нерезкие и не носят закономерного характера, не
стихают после приема пищи, не имеют характера «голодных» болей и не связаны с сезонностью.
Боли при РЖ напоминают боли при гастрите с секреторной недостаточностью. Однако при гастрите боли нестойкие и сравнительно легко поддаются терапевтическому лечению. Более чем у половины больных РЖ боль отсутствует.
Больные РЖ могут жаловаться на похудение. В основном для РЖ характерно медленное похудение, однако при развитии пилоростеноза возможна и быстрая потеря массы тела, нередко до 15 кг в течение 3-6 мес.
При дифференциальной диагностике РЖ и хронического гастрита следует учитывать, что у больных с неосложненной формой хронического гастрита общее состояние обычно не нарушается. Возможно снижение массы тела, но значительное похудение нехарактерно.
Особое внимание следует обратить на такие симптомы, как беспричинное снижение аппетита и его потеря и особенно - на отвращение к мясу. Последний симптом в сочетании с беспричинной слабостью и похудением должен всегда настораживать врача относительно РЖ.
РЖ может протекать с преобладанием кишечной симптоматики. При этом больные чаще всего жалуются на запор, реже отмечается понос. Могут быть также жалобы на метеоризм, урчание, симптом «переливания жидкости» в животе.
Анамнез
Большое значение при диагностике РЖ имеет тщательно собранный анамнез. Длительность желудочного анамнеза у пациентов с РЖ может быть различной: очень короткой - от 1 до 3 мес или, наоборот, очень большой продолжительности - от 4-6 до 20-25 лет.
Общая слабость, быстрая утомляемость, повышенная раздражительность, психическая депрессия, похудение, постоянные ноющие боли в эпигастральной области, иногда усиливающиеся после приема пищи, чувство быстрого насыщения, отрыжка тухлым могут наблюдаться при язвенной болезни, хроническом гастрите и других патологических состояниях. При подробном расспросе пациента важно проследить динамику развития этих симптомов; изменение привычной для больного симптоматики должно насторожить врача. При внимательном анализе анамнеза и объективных данных можно заподозрить РЖ и направить больного на дообследование.
Объективное исследование
Процесс обследования (осмотр, перкуссия, аускультапия, пальпация) должен быть целенаправленным, с учетом анамнестических данных.
Осмотр. При осмотре следует обратить внимание на питание пациента, цвет кожных покровов и видимых слизистых оболочек. Больные, страдающие РЖ, могут быть истощены, бледны. Кожа может принимать землистый оттенок, терять нормальный тургор, становиться сухой, приобретать желтушность. Лицо может быть несколько осунувшимся, взгляд тусклым. При далеко зашедшей стадии РЖ у больного появляются вялость, неуверенная походка. Однако общий вид пациента не всегда соответствует степени поражения желудка.
Пальпация. Пальпация - достаточно сложная манипуляция, что часто связано с рефлекторным напряжением брюшной стенки. Пальпация органов брюшной полости производится в положении пациента лежа, с несколько согнутыми ногами и на правом боку для обследования левого подреберья, что важно при локализации опухоли в верхнем отделе желудка. При ощупывании наиболее часто отмечается болезненность в эпигастральной области, при этом лишь в редких случаях удается пальпировать опухоль. При расположении опухоли на задней стенке желудка или высоко в подреберье ее зачастую не удается определить.
Обоснованное подозрение на обширное распространение заболевания возможно уже на основании тщательного клинического обследования пациента. Зонами обязательного обследования являются левая надключичная область (метастаз Вирхова в левые надключичные лимфатические узлы) и область пупка (метастаз сест-
ры Джозеф в пупок - рис. 19.6). У женщин можно обнаружить отдаленные метастазы при вагинальном исследовании (метастаз в яичники Крукенберга). Пальцевое исследование через прямую кишку позволяет диагностировать метастазы в малом тазу (метастаз Шницлера).
Клинические проявления зависят от локализации опухоли в желудке (табл. 19.1), стадии
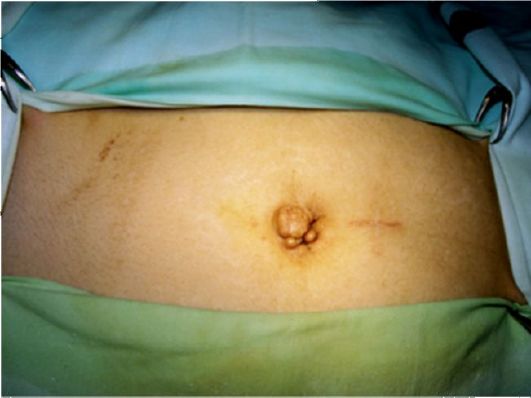 Рис. 19.6. Метастаз в пупок
Рис. 19.6. Метастаз в пупок
заболевания, анатомического типа роста опухоли, предшествующих и сопутствующих заболеваний, осложнений, распространения процесса на соседние органы.
Рак пилороантрального отдела или нижней трети желудка характеризуется разнообразием симптоматики, нередко не отличающейся от симптоматики рака других локализаций; преимущественно это зависит от стадии и анатомической формы роста опухоли. Для распространенного экзофитного рака характерны признаки стеноза привратника, сопровождающиеся нарушением эвакуаторной функции желудка (ощущение полноты, тяжести в желудке, отрыжка тухлым, срыгивание принятой пищей). При сопутствующем воспалении и распаде опухоли могут наблюдаться болевой синдром, лихорадочное состояние, анемия. При эндофитной форме рака этой же локализации симптоматика выражена гораздо слабее.
Особенности клинического течения рака желудка разной локализации
Таблица 19.1. Ведущие клинические симптомы в зависимости от локализации распространенного РЖ
 Рак средней трети желудка длительно протекает бессимптомно, и даже распространенные формы не вызывают симптомов стеноза. Рак малой кривизны может проявиться лишь дисфагией, рвотой, отрыжкой, но без нарушения эвакуаторной функции желудка. И лишь наличие дисфагии, которая развивается при запущенной стадии этой локализации рака, может привести пациента к врачу.
Рак средней трети желудка длительно протекает бессимптомно, и даже распространенные формы не вызывают симптомов стеноза. Рак малой кривизны может проявиться лишь дисфагией, рвотой, отрыжкой, но без нарушения эвакуаторной функции желудка. И лишь наличие дисфагии, которая развивается при запущенной стадии этой локализации рака, может привести пациента к врачу.
Аденокарцинома задней или передней стенки тела желудка на ранней стадии протекает бессимптомно и относится к немым формам
рака. Первыми проявлениями рака этой локализации являются общие нарушения: слабость, вялость, снижение массы тела, отеки, психическая депрессия, гипертермия. Боль и диспепсические явления возникают редко. Довольно часто наблюдается кровотечение, иногда профузное, что обусловливает анемию.
Рак дна желудка также относится к немому раку и на ранней стадии почти не диагностируется. Он выявляется лишь при наличии болевого синдрома, зачастую связанного с прорастанием купола диафрагмы. Такие боли ошибочно могут быть приняты за проявление стенокардии или патологию легких и плевры.
Наиболее частыми симптомами аденокарциномы пищеводно-желудочного соединения являются дисфагия, снижение массы тела и боли в эпигастрии. Развернутая клиническая симптоматика обычно наблюдается при распространенной форме заболевания. Ранний рак, диспластические и метапластические поражения обычно протекают бессимптомно.
Различные анатомические формы РЖ могут сопровождаться различной симптоматикой. В целом экспансивный тип РЖ вследствие склонности к распаду, инфицированию может сопровождаться лихорадкой, интоксикацией. Клинические проявления эндофитных опухолей характеризуются гастритическими жалобами и часто имеют симптоматику язвенной болезни. Первично-изъязвленный РЖ клинически не отличается от пептической язвы и характеризуется стойкостью язвенной симптоматики, неэффективностью консервативной терапии, быстрой эпителизацией и повторными изъязвлениями. Диффузно-инфильтративный рак типа скирра характеризуется длительным латентным периодом и иногда проявляется беспричинным поносом.
РЖ возникает на фоне хронического гастрита, поэтому гастритические признаки на начальных его стадиях могут выступать на 1-е место, затушевывая картину более грозного заболевания.
Большое влияние на клинические проявления РЖ оказывают заболевания других органов и систем, особенно органов брюшной полости. Достаточно часто РЖ, в основном кардиоэзофагеальный, сочетается со скользящей грыжей пищеводного отверстия диафрагмы. У значительного количества больных РЖ может наблюдаться сочетанная патология толстой кишки и гепатопанкреатодуоденальной зоны. Нередки сочетания РЖ и калькулезного холецистита, РЖ и индуративного панкреатита и др.
Примерно 2 % больных РЖ составляют пациенты с первичномножественными опухолями желудка. Опухоли могут развиваться синхронно и метахронно, причем интервал между выявлением последующих новообразований составляет от 0,5 до 20 лет. РЖ чаще всего сочетается с раком толстой кишки, значительно реже 2-я опухоль может наблюдаться в пищеводе, молочной железе, матке. У больных, оперированных по поводу РЖ, целесообразно ежегодно проводить исследование толстой кишки, а у пациентов, оперированных по поводу рака толстой кишки, - исследовать желудок.
ДИАГНОСТИКА РАКА ЖЕЛУДКА И ДРУГИХ ЗАБОЛЕВАНИЙ ЖЕЛУДКА
Чаще всего РЖ приходится дифференцировать с язвенной болезнью желудка, гастритом, полипозом. По клиническому течению РЖ может напоминать пернициозную анемию. Реже дифференциальную диагностику приходится проводить с неэпителиальными опухолями и редкими для желудка неопухолевыми заболеваниями - сифилисом и туберкулезом желудка и др.
Неэпителиальные опухоли желудка встречаются довольно редко и составляют 0,5-5 % всех его новообразований. Среди опухолей желудка неэпителиального происхождения наиболее часто встречаются злокачественные лимфомы, гастроинтестинальные стромальные опухоли, лейомиомы и лейомиосаркомы, карциноиды и др. Диагностика этих заболеваний очень трудна, и даже при гастроскопии патологический процесс в желудке может быть не определен, а правильный диагноз в ряде случаев устанавливают лишь после гистологического исследования удаленного препарата.
Желудок - один из наиболее часто поражаемых злокачественной лимфомой органов. Лимфома может возникнуть в разном возрасте, но преимущественно встречается у больных 40-50 лет, чаще у женщин. Первичная лимфома может иметь вид отграниченных инфильтратов, быть множественной, с тенденцией к тотальному поражению стенки органа, или представлена в виде множественных сливающихся поверхностных язв, достигающих значительных размеров. В опухолевый процесс преимущественно вовлекаются антральный отдел и малая кривизна. По рентгенологической картине или при фиброгастроскопии лимфому желудка нельзя отличить от РЖ. Как и при раке, выяв-
ляются дефект наполнения или общее уменьшение объема желудка. Окончательный диагноз злокачественной лимфомы устанавливают только на основании гистологического заключения.
Микроскопически лимфомы желудка бывают мелкоклеточными - типа MALT (лимфома, ассоциированная со слизистыми оболочками) и крупноклеточными. Мелкоклеточную лимфому в биоптатах очень трудно дифференцировать с воспалительным инфильтратом, а крупноклеточную - с раком, и только иммуноморфологическое исследование позволяет надежно отличать эти заболевания.
Ранняя MALT-лимфома, локализующаяся в пределах слизистой оболочки, является антигензависимой. Массированная антихеликобактерная антибиотикотерапия может привести к полному излечению этой опухоли. Распространенные крупноклеточные лимфомы обладают разной чувствительностью к химио- и рентгенотерапии. После резекции желудка рецидив такой лимфомы может возникнуть в течение 2 лет, чаще опухолевый процесс локализуется во внебрюшинных органах, в периферических лимфатических узлах.
Лимфогранулематоз, в отличие от первичных неходжкинских лимфом, в желудке практически не встречается. Чаще наблюдается поражение желудка при генерализованных формах, указывающее на терминальную стадию заболевания.
Опухоли гладкомышечного происхождения - лейомиомы и лейомиосаркомы - в желудке встречаются редко. Средний возраст больных - 40-50 лет и старше. Клинические проявления этих опухолей обусловлены их локализацией и эндогастральным ростом. В большинстве случаев лейомиома растет в виде одиночного узла овальной формы, тесно связанного со стенкой желудка. Встречаются опухоли из нескольких узлов. Они могут располагаться в подслизистом слое, мышечной оболочке или субсерозном слое. Описаны случаи полиповидных лейомиом на ножке. Слизистая оболочка над опухолью обычно не изменена.
Лейомиомы имеют плотноэластическую консистенцию и гладкую поверхность, на разрезе - серовато-белого цвета, волокнистого строения. Опухоль состоит из пучков однородных эозинофильных (розоватых), веретенообразной формы клеток, с удлиненными ядрами и закругленными концами. Фигуры митоза отсутствуют или редки.
Злокачественный вариант лейомиомы - лейомиосаркома - 2-я по частоте злокачественная неэпителиальная опухоль желудка.
Редко в желудке встречается карциноидная опухоль - новообразование диффузной нейроэндокринной системы (АПУД-системы);
рассматривается как потенциально злокачественная опухоль. Локализация в органе может быть любой. Клетки карциноида вырабатывают серотонин. Опухоль может быть гормональноактивной, но чаще ее гормональная активность незначительна. При гормональной активности может развиться «карциноидный синдром»: ощущение жара, прилива крови, слабость, головокружение, ощущение голода при снижении уровня сахара крови, аллергические высыпания на коже, астматические приступы, понос и др.
Крайне редко в желудке встречаются опухоли из оболочек нервов - нейрофиброма и невролеммома, а также сосудистые опухоли: гем- и лимфангиома, гемангиоэндотелиома, гемангиоперицитома, зернисто-клеточная опухоль, липома и др.
В ряде случаев РЖ приходится дифференцировать с неопухолевыми поражениями: сифилисом, туберкулезом, актиномикозом, безоарами. Сифилис желудка - очень редкое заболевание, так как желудок является неблагоприятной средой для Treponema pallidum. В настоящее время частота сифилитического поражения желудка возросла. Поражение желудка всегда сопровождается положительными результатами серологических проб.
Наиболее часто сифилитические поражения имеют вид плоского инфильтрата, который образует бляшковидное утолщение стенки желудка. Инфильтрат может быть распространенным, с выраженной гиперемией стенки желудка, с большим количеством увеличенных, отечных лимфатических узлов. Сифилитические язвы бывают множественными, часто больших размеров, неправильной формы, с основанием, расположенным выше окружающей слизистой оболочки. Обычно язвы бывают неглубокими, больших размеров, диаметром 5-8 см, неправильной формы (эллипсовидные, четырехугольные и др.). Микроскопические изменения неспецифичны и имеют вид хронического неспецифического воспаления. В зоне поражения могут наблюдаться облитерирующий васкулит и поверхностное изъязвление.
Туберкулез желудка - одна из редчайших локализаций этого заболевания. Преимущественно встречается язвенная форма поражения в виде поверхностного дефекта с неровными (бахромчатыми) краями, «грязным» дном, в котором могут располагаться видимые туберкулезные бугорки. Возможно утолщение стенки желудка за счет специфической инфильтрации. Туберкулезные бугорки в большинстве случаев микроскопически выявляются в мышечной пластинке слизистой оболочки.
Первичный актиномикоз желудка и другие грибковые заболевания желудка встречаются крайне редко и могут симулировать опухоль. Неблагоприятным исходом первичного актиномикоза желудка являются метастатические абсцессы печени.
Клинически и рентгенологически РЖ могут симулировать безоары, которые относятся к казуистическим образованиям желудка. Безоаровой, или каменной, болезнью ЖКТ называют состояния, при которых пищевые вещества под действием различных факторов формируют эндогенные «камни». Такие образования в просвете ЖКТ могут состоять из разных веществ: минеральных солей, органических веществ, медикаментов. Различают фитобезоары (из растительной пищи и углеводов); себолитиаз (из сала и других жиров); анимальлитиаз (из пищи животного происхождения, белков); трихобезоары (волосяные клубки).
ДИАГНОСТИКА
Лабораторные, рентгенологические и эндоскопические исследования
Дифференциально-диагностическая роль лабораторных исследований при РЖ невелика. РЖ на ранних стадиях развития обычно не проявляется какими-либо отклонениями лабораторных показателей. Нарушения различных видов обмена в основном связаны с предраковыми состояниями, которые предшествуют раковому новообразованию или сопровождают его (атрофический гастрит, ахилия, анемия Аддисона-Бирмера и др.).
Желудочное содержимое. В большинстве случаев РЖ сопровождается понижением секреции соляной кислоты и пепсина. Гипо- и анацидное состояние у больных РЖ наблюдается примерно в 70 % случаев. У 20-25 % больных кислотообразующая функция сохраняется, а у 5-7 % пациентов возможна гиперхлоргидрия (Бутов Ю.Л., 1979). При брожении в желудке могут наблюдаться молочная кислота и высокое содержание белка в желудочном соке.
У больных РЖ возможны явные и скрытые кровотечения. Если в кале содержится незначительное количество крови (так называемые микрокровотечения), его окраска и консистенция не меняются, и наличие крови можно выявить только постановкой бензидиновой пробы Грегерсена. Постоянное выявление крови в кале - важный признак злокачественного новообразования желудка или кишечника, однако отрицательные результаты исследования не исключают наличие РЖ.
Исследование крови. При ранней неосложненной форме РЖ изменений в крови обычно не наблюдается. При РЖ может отмечаться анемия, которая, как правило, развивается вторично. Обычно содержание гемоглобина при РЖ понижено, а число эритроцитов колеблется от 24012/л до 3-1012/л. Количество лейкоцитов и соотношение разных форм лейкоцитов у больных РЖ обычно бывают в пределах нормы. При распаде опухоли СОЭ может быть повышена, но при диффузной форме рака она длительно может оставаться нормальной. При распространенных формах рака наблюдается стойкий лейкоцитоз, сопровождающийся сдвигом формулы влево. При метастазах в костный мозг лейкоцитоз может достигнуть значительного уровня.
В целом у больных РЖ система свертывания крови характеризуется тенденцией к гиперкоагуляции, что нередко сопровождается повышением активности прокоагулянтов. Наряду с этим активируется система фибринолиза, увеличивается количество антитромбопластина и антитромбина.
В сыворотке крови больных РЖ часто снижено содержание общего белка, понижена альбуминовая и повышена глобулиновая фракция, особенно α- и γ-глобулинов; в более позднем периоде развивается диспротеинемия с выраженной тенденцией к гипопротеинемии.
Решающую роль в диагностике РЖ играют рентгенологическое и фиброгастроскопическое исследование с изучением биоптатов. Эти исследования позволяют диагностировать новообразования различной локализации и венчают весь процесс клинического исследования.
Основные рентгенологические симптомы РЖ: дефект наполнения, наличие аперистальтических зон, атипичный рельеф слизистой оболочки при инфильтрации мышечного слоя (рис. 19.7; 19.8). Дефект наполнения характерен для экзофитно растущих
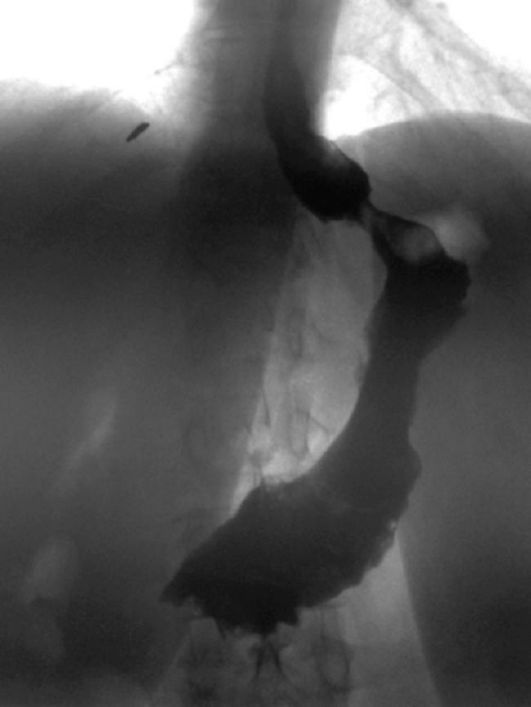 Рис. 19.7. Рак тела желудка. Рентгенограмма
Рис. 19.7. Рак тела желудка. Рентгенограмма
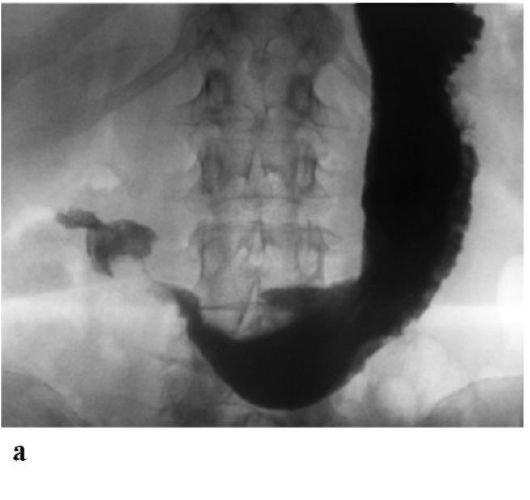
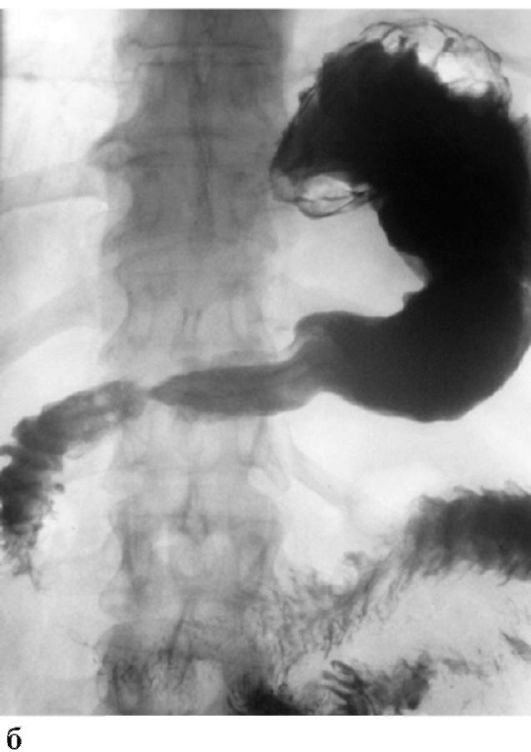 Рис. 19.8. Рак пилорического отдела желудка. Рентгенограмма (а, б)
Рис. 19.8. Рак пилорического отдела желудка. Рентгенограмма (а, б)
опухолей. В зависимости от формы и поверхности опухоли дефект наполнения имеет неровную дольчатую или грибовидную форму. В центре опухоли обычно возникает некротический распад, который обусловливает картину раковой ниши. Опухолевый вал обычно шире язвенного, а ниши больших размеров.
Первым рентгенологическим симптомом РЖ обычно является локальное утолщение или обрыв складок слизистой оболочки. На границе с этим участком рельеф нормальной слизистой оболочки как бы подчеркнут. Чаще такие изменения обнаруживают при инфильтрирующей форме опухоли. Первично-язвенный и плоский изъязвленный рак обычно имеют вид плоских ниш, вытянутых вдоль желудка.
Ранний рак может проявляться поверхностной инфильтрацией слизистой оболочки желудка или небольшой эрозией при первично-язвенной форме. Обычно зона инфильтрации плоская или несколько углубленная, имеет неровные края и почти не отграничена от нормальной слизистой оболочки. Складки слизистой оболочки желудка обрываются у краев поражения, а в ряде случаев конвергируют к этому участку.
Рак кардиального отдела рентгенологически характеризуется симптомом обтекания. Симптом разбрызгивания, или «симптом шприца», характерен для локализации опухоли вблизи входа в желудок. При
переходе опухоли на пищевод определяются задержка контрастного вещества над входом в желудок, изъеденность контуров абдоминального отдела пищевода, наличие изменений по малой кривизне в субкардиальном отделе. При поражениях этого отдела основные симптомы злокачественного новообразования (дефект наполнения, аперистальтическая зона, изменение рельефа слизистой оболочки) в значительной мере теряют свое значение.
Для рака тела желудка характерно нарушение рельефа слизистой оболочки дефект наполнения по задней, передней стенкам или по малой кривизне, а при инфильтративном процессе - сужение просвета. При локализации рака в пилороантральном отделе появляются небольшие дефекты, нарушение рельефа слизистой оболочки, сужение выходного отдела желудка вплоть до полного стеноза с нарушением эвакуации из желудка.
Чрезвычайно трудно, а порой просто невозможно отличить изъязвленную опухоль от доброкачественной язвы. Чаще рентгенологическими признаками озлокачествленной язвы являются асимметрия инфильтративного вала, изменение формы кратера, исчезновение складок слизистой оболочки непосредственно у изъязвления. При изъязвившемся раке, как правило, длинник язвенного кратера параллелен длиннику оси желудка, при доброкачественной язве длинник оси перпендикулярен к длиннику желудка. Следует помнить, что на фоне язв, расположенных в кардиальном, препилорическом и пилорическом отделах, чаще всего существует опасность развития рака с последующим его изъязвлением.
Распространенные формы РЖ инфильтративного типа приводят к циркулярному сужению просвета желудка; на большом протяжении выпадает перистальтика, стенки желудка при этом теряют свою эластичность, просвет уменьшается, контуры могут оставаться ровными. Характерно постоянство формы желудка на протяжении всего исследования. Тотальное поражение желудка диффузно-инфильтративным раком приводит к резкому уменьшению размеров органа, укорочению малой кривизны, а иногда к зиянию привратника.
Использование прицельных снимков, томографии на фоне ретропневмоперитонеума, применение аппаратов с электронно-оптическими преобразователями позволяют в 80-85 % наблюдений рентгенологически выявить РЖ на ранних стадиях. При необходимости используются следующие приемы: рентгенография желудка в прямой и косых проекциях в горизонтальном и вертикальном положении
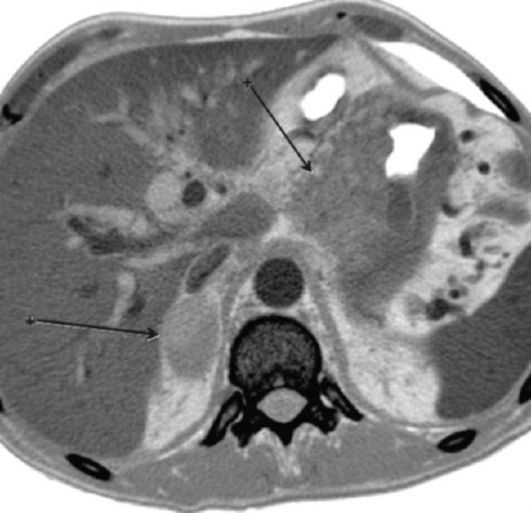 Рис. 19.9. Рак желудка. Стрелками указаны метастазы в надпочечник
Рис. 19.9. Рак желудка. Стрелками указаны метастазы в надпочечник
больного, в положении лежа на спине, на животе, а иногда в положении Тренделенбурга; с двойным и тройным контрастированием газового пузыря желудка, что позволяет определить поражение дна желудка при инфильтративной форме роста опухоли с утолщением желудочной стенки. При применении методики двойного контрастирования особенно хорошо видны границы новообразования, что позволяет изучить обе кривизны желудка и кардиальную область.
Для уточнения регионарного метастазирования и выявления отдаленных метастазов в лимфатические узлы (внутригрудные, брюшной полости и забрюшинные) применяется КТ (рис. 19.9).
В настоящее время фиброгастроскопические исследования являются ведущими при диагностике РЖ (рис. 19.10). Они позволяют: выполнять биопсию опухоли с дальнейшим гистологическим и цитологическим исследованием с целью морфологической верификации новообразования и диагностики ранних форм рака; проводить диагностику неэпителиальных новообразований и неопухолевых процессов; осуществлять лечебные манипуляции: коагуляцию ножки полипа с его удалением при небольших размерах (до 2 см), остановку кровотечения, проведение зонда для кормления и т.д. Применение современных технологий эндоскопической хирургии делает возможным лечение ранних форм рака без вскрытия просвета органа. Эндоскопическая ультрасонография точно идентифицирует глубину инвазии опухоли, метастатическое поражение регионарных лимфатических узлов.
При дооперационном обследовании больных РЖ следует производить лапароскопическое исследование. Этот метод позволяет визуально осмотреть поверхности печени с целью выявления метастазов, передней стенки желудка, париетальной и висцеральной брюшины с проведением биопсии, установить видимое прорастание опухоли в соседние органы и ткани с целью уточнения степени распространенности опухоли. Данная процедура позволяет избежать необоснованной лапаротомии.
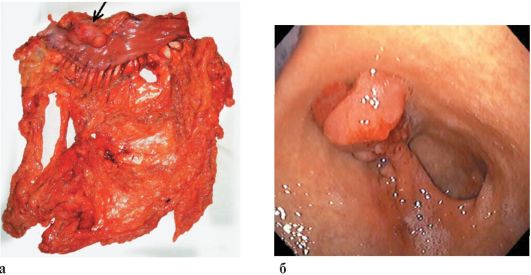 Рис. 19.10:
Рис. 19.10:
а - макропрепарат рака желудка с большим сальником. Стрелкой показан конгломерат лимфатических узлов на кривизне желудка; б - эндоскопическая картина. Экзотифитная опухоль желудка, расположившаяся на малой кривизне в области антрального отдела
Сканирование печени и ангиография выявляют наличие отдаленных метастазов. Лимфография позволяет уточнить наличие метастазов в лимфатических коллекторах. Диагностическая лапаротомия в ряде случаев используется для определения возможности оперативного лечения, уточняя распространенность процесса: выход опухоли за пределы желудочной стенки, наличие отдаленных метастазов в печень или отдаленные группы лимфатических узлов, обсеменение по брюшине.
ЛЕЧЕНИЕ
Основными методами лечения РЖ, применяемыми в онкологической практике как самостоятельные, так и в комбинации с другими, являются:
• хирургический;
• лучевой;
• химиотерапия.
Выбор наиболее оптимального метода лечения РЖ определяется: распространенностью процесса на момент диагностики, функциональным состоянием пациента и методическими подходами той или иной клиники.
Хирургическое лечение
Радикальные и паллиативные операции
Несмотря на некоторые успехи комбинированных методов, как и десятилетия назад, основным методом лечения РЖ остается хирургический, рассматриваемый как «золотой стандарт» при радикальном лечении, позволяющий надеяться на полное выздоровление. От того, насколько полноценно, с учетом особенностей роста и метастазирования, выполнено хирургическое лечение, зависит последующий прогноз течения заболевания. В то же время именно адекватное удаление желудка с зонами регионарного лимфогенного метастазирования позволяет выполнять достоверное стадирование распространенности процесса и на основании этого назначать оптимальное лечение. Пациент является кандидатом на радикальное хирургическое лечение, если у него в процессе обследования выявляется локализованный характер заболевания.
Показаниями к радикальному хирургическому вмешательству служат:
1) возможность полного удаления первичной опухоли;
2) отсутствие отдаленных метастазов и диссеминации процесса по брюшине;
3) функциональная переносимость вмешательства.
У больных с диссеминированными формами РЖ большинство онкологов сегодня придерживаются консервативной тактики, а хирургический метод используется лишь как средство экстренной помощи при возникновении осложнений - перфорации опухоли с развитием разлитого перитонита, полной дисфагии, декомпенсированном стенозе выходного отдела желудка и профузном желудочном кровотечении. Однако накопление опыта и отдаленные результаты лечения диссеминированных форм РЖ свидетельствуют о том, что активная тактика с проведением хирургического компонента комбинированного лечения может улучшить результаты лечения. Даже при наличии признаков местного распространения процесса в виде вовлечения окружающих структур или широкого лимфогенного метастазирования возможно хирургическое лечение в комбинации с:
- неоадъювантной химиотерапией;
- адъювантной химиотерапией;
- периоперационной химиотерапией*;
- адъювантной химиолучевой терапией;
- гипертермической интраоперационной интраперитонеальной химиотерапией (ГИИХ)** или ранней послеоперационной интраперитонеальной химиотерапией.
Обратите внимание!
* Периоперационная химиотерапия проводится у пациентов с выраженным эффектом при предоперационной ПХТ и доказанным патоморфозом в опухоли в удаленном препарате при морфологическом исследовании.
** ГИИХ является вариантом комбинированного лечения, когда химиотерапия проводится интраоперационно на фоне гипертермии. Может дополняться проведением ранней послеоперационной интраперитонеальной химиотерапией.
Тактика хирургического лечения
РЖ характеризуется широким и ранним лимфогенным метастазированием. Так, при прорастании РЖ подслизистого слоя метастазы в регионарных лимфатических узлах могут выявляться более чем в 15 % случаев. Поэтому современный подход к хирургическому лечению РЖ характеризуется повышенным радикализмом с обязательным моноблочным удалением регионарных лимфатических узлов и путей лимфооттока.
Впервые концепция агрессивной тактики в хирургии РЖ была сформулирована американским хирургом O. Wangesteen. Анализируя результаты выживаемости в клинике Миннесотского университета в 30-40-х годах ХХ века, автор отметил отсутствие пациентов, переживших 5-летний рубеж после хирургического лечения. Причем наиболее часто заболевание рецидивировало в локорегионарных лимфатических коллекторах, в зоне операции. Эти данные послужили стимулом к активизации тактики хирургического лечения с обязательным удалением регионарных лимфатических узлов. Столь агрессивная тактика, предлагаемая автором, стала основой улучшения отдаленных результатов: 5-летняя выживаемость в клинике возросла до 17 %.
Оперативные вмешательства, выполняемые с удалением зон регионарного метастазирования, обозначаются термином «лимфодиссекция», который более емок и точен, чем «лимфаденэктомия». Лимфодиссекция включает моноблочное удаление не только лимфатических узлов, но и всего внутри- и экстраорганного лимфатического
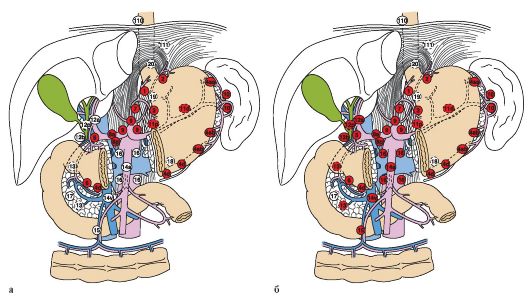 аппарата (лимфатических сосудов и окружающей жировой клетчаткой) в пределах фасциальных футляров.
аппарата (лимфатических сосудов и окружающей жировой клетчаткой) в пределах фасциальных футляров.
Именно это положение, обоснованное временем и опытом, является теоретической предпосылкой возможности выполнения радикальной операции при РЖ путем удаления первичного очага с зонами возможного регионарного лимфогенного метастазирования. Причем улучшение локального контроля со снижением возможности местного рецидива заключает в себе и другую предпосылку - возможность определения распространенности процесса.
На основании рекомендаций ЯАРЖ детально описаны группы регионарных лимфатических узлов, формирующих 3 последовательных этапа метастазирования (N1-N3) из различных отделов желудка:
• 1-й этап - перигастральные лимфатические коллекторы, расположенные в связочном аппарате желудка (? 1-6);
• 2-й этап - забрюшинные лимфатические узлы, расположенные по ходу ветвей чревного ствола (лимфатические узлы по ходу левой желудочной артерии (? 7), общей печеночной артерии (? 8 a + p), чревного ствола (? 9), в воротах селезенки (? 10), по ходу селезеночной артерии (? 11 p + d);
• 3-й этап - лимфатические узлы гепатодуоденальной связки (? 12 a + p + b), ретропанкреатодуоденальные (? 13), лимфатические узлы по ходу верхней брыжеечной артерии (? 14 a + v), в корне брыжейки поперечной ободочной кишки по ходу средней ободочной артерии (? 15), парааортальные лимфатические узлы, расположенные на разном уровне брюшной аорты (? 16 a1-a2, b1-b2), а также хиатальные и заднемедиастинальные лимфатические коллекторы для рака проксимального отдела желудка с переходом на пищевод.
Различные варианты лимфодиссекции нашли свое отражение в классификации объема вмешательства, в которой вариант лимфодиссекции классифицируется на основании последнего удаляемого этапа метастазирования (табл. 19.2).
На сегодняшний день данная классификация степени радикальности по уровню выполняемой лимфодиссекции полностью применима лишь в японских и нескольких специализированных европейских и американских клиниках. Тем не менее накопленный в большинстве специализированных клиник опыт хирургического
лечения РЖ (со значительным улучшением отдаленных результатов и при удовлетворительных непосредственных результатах) позволяет считать объем лимфодиссекции D2 стандартным.
Таблица 19.2. Объем хирургического вмешательства с учетом уровня лимфодиссекции
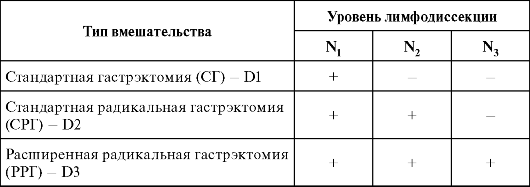 Основные принципы выбора метода резекции
Основные принципы выбора метода резекции
Основной целью радикального вмешательства при РЖ является полное удаление опухоли и лимфогенных путей распространения опухолевых клеток. Успех хирургического лечения связан с адекватным выбором объема резекции желудка и уровня лимфодиссекции, а также тщательной интраоперационной ревизией брюшной полости и сальниковой сумки. В соответствии с указанной целью осуществляется выбор всех составляющих хирургической операции:
• оптимальности хирургического доступа с учетом его травматичности, а также характеристик возможности полноценного выполнения резекционного и реконструктивного этапов;
• объема резекции с учетом распространенности процесса по органу и в удаляемых тканях;
• выбора метода последующей реконструкции, который определяет послеоперационное восстановление энтерального питания, а также возможность выполнения повторной операции в случае местного рецидива.
Основная цель хирургического лечения РЖ может быть достигнута при адекватном предоперационном обследовании пациента с учетом всех доступных методов, что возможно лишь в клиниках с развитой инфраструктурой в виде специализированных диагностических подразделений.
Радикальные операции
Выбор объема хирургического вмешательства зависит от двух взаимосвязанных факторов:
1) распространенности и формы роста первичной опухоли (включая наличие подслизистой инфильтрации и перехода на дистальную треть тела желудка);
2) распространенности лимфогенного метастазирования.
В каждом конкретном случае выбор производится индивидуально. Несмотря на кажущуюся простоту алгоритма оценки составляющих, в каждом случае возможно несколько вариантов, от сочетания которых зависит выбор тактики и объема операции. Стандартные объемы операции при различной распространенности и локализации РЖ приведены в табл. 19.3.
Таблица 19.3. Хирургическое лечение РЖ в зависимости от локализации и формы роста
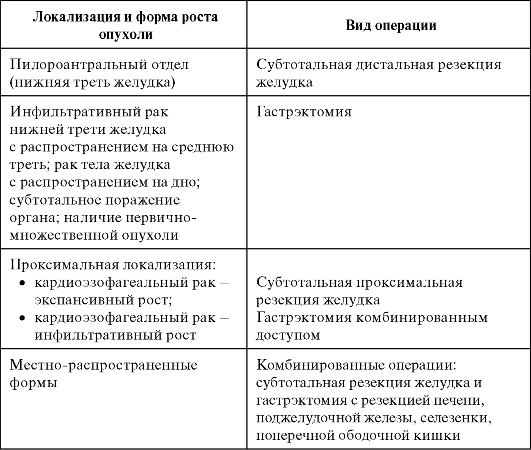 Окончание табл. 19.3
Окончание табл. 19.3
 Субтотальная дистальная резекция
Субтотальная дистальная резекция
В онкологии при раке дистальной трети желудка наиболее часто выполняется дистальная субтотальная резекция желудка. Несмотря на то что данный объем оперативного вмешательства является более функциональным, чем гастрэктомия, он имеет строгие показания и не должен применяться в ущерб онкологической радикальности.
В онкохирургии радикальной субтотальной резекцией желудка может считаться лишь удаление 4/5 желудочной стенки со всей малой кривизной до уровня пищеводно-желудочного перехода. По большой кривизне граница резекции проходит до отхождения коротких желудочных артерий, за счет которых осуществляется питание оставшейся культи желудка. Мобилизуют петлю тощей кишки, которую перемещают в верхний этаж брюшной полости впереди ободочной кишки. Далее накладывают желудочнокишечный анастомоз, чаще по типу конец в бок (рис. 19.12).
• Показаниями к выполнению дистальной субтотальной резекции желудка являются: преимущественно экзофитные опухоли нижней трети желудка,
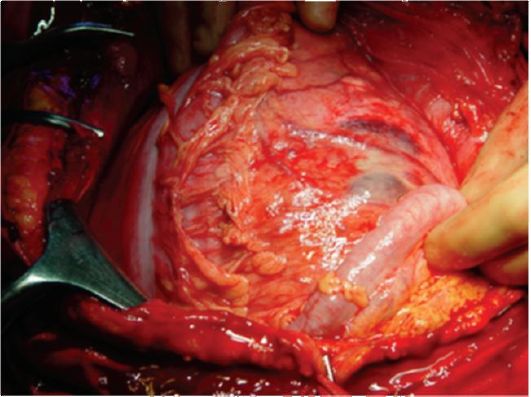 Рис. 19.12. Реконструкция после дистальной субтотальной резекции желудка на впередиободочной петле по Бальфору
Рис. 19.12. Реконструкция после дистальной субтотальной резекции желудка на впередиободочной петле по Бальфору
без рентгенологических и эндоскопических признаков инфильтративного роста (по R. Borrmann - I, II типы);
• отсутствие перехода опухоли на угол желудка (нижняя треть тела);
• отсутствие прорастания РЖ на серозную оболочку желудка;
• отсутствие мультицентрических очагов опухолевого роста в желудке;
• отсутствие интраоперационно выявляемых метастатических лимфатических узлов в паракардиальной области, забрюшинном пространстве, особенно по ходу селезеночной артерии, в области чревного ствола, а также в воротах селезенки.
С учетом исследований, проведенных в рамках программы ЯАРЖ по путям интрамурального и лимфогенного распространения РЖ, было показано, что при экзофитных локализованных формах роста опухоли желудка (по R. Borrmann - I, II типы) с целью достижения надежной радикальности необходимо отступать от видимого края опухоли минимум на 3 см в проксимальном направлении, а при инфильтративных (по R. Borrmann - III, IV типы) - отступать от определяемой границы в проксимальном направлении минимум на 5 см.
Операция Бильрот I с наложением прямого анастомоза между культей желудка и двенадцатиперстной кишкой в настоящее время в онкологии не рекомендована.
Гастрэктомия - полное удаление желудка
При гастрэктомии производится полное удаление всего желудка с сальниками и связочным аппаратом со всеми зонами регионарного метастазирования. После удаления препарата проводится восстановление непрерывности кишечной трубки с соответствующей пластикой. Гастрэктомия выполняется чрезбрюшинным или чресплевральным доступом.
При проведении радикальной операции выполняется расширенная лимфодиссекция в объеме D2. Производится моноблочное удаление лимфатических узлов, расположенных вдоль печеночной артерии, паракардиальной клетчатки, клетчатки, расположенной вдоль чревного ствола, с лимфатическими узлами, панкреатолиенальных лимфатических узлов с забрюшинной клетчаткой между верхним краем поджелудочной железы, аортой и левой ножкой диафрагмы. В результате расширенной лимфаденэктомии полностью удаляется клетчатка с лимфатическими узлами от ворот печени до ворот селезенки.
Выполнение гастрэктомии обязательно во всех случаях инфильтративных опухолей, а также при локализованных экзофитных опухолях дистальной трети с переходом на тело желудка. Учитывая, что опухоли средней и верхней трети желудка составляют около 50 %, а среди опухолей дистальной трети более половины являются эндофитными и около 10 % переходят на угол желудка, доля выполняемых гастрэктомий при РЖ должна составлять около 80 % хирургических вмешательств.
Другим, не менее важным фактором при выборе объема операции, чем интрамуральная распространенность, является вовлечение в опухолевый процесс регионарных лимфатических коллекторов. Наличие пальпаторно определяемых при ревизии в связочном аппарате желудка метастатических узлов, особенно в паракардиальной области с обеих сторон при опухолях антрального отдела, даже с учетом небольшого размера экзофитной неинфильтративной опухоли, должно склонять чашу весов в пользу выполнения гастрэктомии. Другим определяющим фактором является наличие явных метастазов в бассейне по ходу селезеночной артерии (? 11), а также в воротах селезенки (? 10). И если при расширенной гастрэктомии сегодня стандартным является выполнение комбинированной спленэктомии, то массивное поражение цепочки лимфатических узлов по ходу селезеночной артерии (часто сопровождающееся перинодальным ростом опухолевой ткани с вовлечением селезеночной артерии) является показанием к выполнению комбинированной резекции поджелудочной железы различного объема, вплоть до субтотальной резекции 95 % паренхимы (рис. 19.13).
В связи с отсутствием серозного покрова на пищеводе, рыхлости его мышечного слоя и плохого кровоснабжения большое значение при гастрэктомии имеет создание надежного пищеводно-кишечного анастомоза. При мобилизации максимально сохраняется кровоснабжение пищевода; следует избегать натяжения швов анастомоза. Анастомоз дополнительно укрывают местными тканями и петлей кишки.
Субтотальная проксимальная резекция желудка. Тактика хирургического лечения рака желудочно-пищеводного перехода
Субтотальная проксимальная резекция желудка выполняется при раке кардиального и субкардиального отделов желудка I и II стадий без выхода процесса на серозную оболочку и при отсутствии данных,
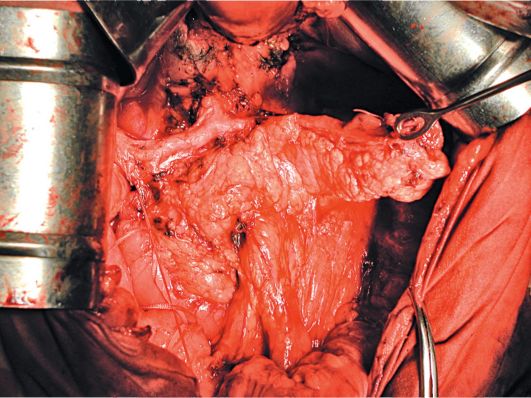 Рис. 19.13. Окончательный вид операционного поля после выполнения комбинированной гастрэктомии и лимфодиссекции D2
Рис. 19.13. Окончательный вид операционного поля после выполнения комбинированной гастрэктомии и лимфодиссекции D2
подтверждающих метастатическое поражение лимфатических узлов правых отделов большой кривизны, а также супра- и субпилорических. Исследования рака проксимального отдела желудка, проведенные в Национальном институте рака (Токио), показали, что проксимальная субтотальная резекция желудка может быть выполнена лишь при небольших размерах опухоли (до 4 см в наибольшем измерении), локализующейся в проксимальном отделе, без распространения на верхнюю треть тела желудка. Причем обязательной является резекция неизмененной визуально и пальпаторно стенки желудка на 2 см дистальнее определяемой границы опухоли при поверхностно стелющемся росте, на 3 см - при экзофитном и на 5 см и более - при эндофитном и смешанном типах роста. При этом полностью удаляется вся малая кривизна желудка с малым сальником и параэзофагеальными лимфатическими узлами и частью большого сальника. В удаленном блоке тканей находятся околокардиальные лимфатические сосуды и узлы, расположенные в толще малого сальника по ходу правой
желудочной артерии, желудочно-поджелудочная связка вместе с группой регионарных лимфатических узлов. Между пищеводом и оставшейся частью желудка накладывают анастомоз.
При опухолях кардиоэзофагеальной зоны I и II стадий, распространяющихся выше ножек диафрагмы, выполняют резекцию нижней трети пищевода. При этом формируется инвагинационный пищеводно-желудочный анастомоз, который располагают в заднем средостении (операция Гарлока).
Противопоказанием к выполнению проксимальной субтотальной резекции желудка являются метастазы в лимфатические узлы, расположенные вдоль верхней трети большой кривизны желудка, а также супра- и субпилорические. Эти группы лимфатических коллекторов следует рассматривать как 2-й этап лимфогенного метастазирования, следовательно, они подлежат удалению. Поэтому при пальпаторном обнаружении увеличенных лимфатических узлов этих групп в ходе интраоперационной ревизии требуется выполнение расширенной гастрэктомии с моноблочным удалением всего связочного аппарата желудка.
При раке проксимального отдела желудка III стадии при выходе процесса на серозную оболочку желудка или диффузно-инфильтративных формах производится комбинированная гастрэктомия со спленэктомией с обязательным выполнением лимфодиссекции на уровне D2. Однако в случае распространенного опухолевого процесса при выполнении заведомо паллиативного вмешательства с функциональных позиций более оправданным следует считать выполнение проксимальной резекции желудка как более щадящей.
В зависимости от типа опухоли J. Siewert и соавт. (2007) предлагают независимо от типа кардиоэзофагеального рака проводить минимально необходимый объем абдоминальной лимфодиссекции на лимфатических коллекторах брюшной полости на уровне D2. Выбор же объема медиастинальной лимфодиссекции в значительной степени определяется типом опухоли.
При типе I выполняется проксимальная резекция желудка с субтотальной резекцией пищевода и формированием пищеводно-желудочного соустья в куполе правой плевральной полости из правостороннего трансторакального доступа. С учетом высокой частоты поражения лимфатических узлов не только нижнего, но и верхнего средостения рекомендуется выполнение билатеральной медиастинальной расширенной двухзональной лимфодиссекции.
При II и III типах опухоли необходимым объемом вмешательства по J. Siewert является чрезбрюшинная гастроэктомия с лимфодиссекцией D2 и трансхиатальной резекцией вовлеченных отделов пищевода с лимфодиссекцией заднего средостения. При этих типах рака метастазирование в лимфатические узлы верхнего средостения нехарактерно, а объем медиастинальной лимфодиссекции, как правило, ограничивается иссечением наддиафрагмальных, нижних параэзофагеальных и бифуркационных лимфатических узлов.
Сравнительный анализ результатов хирургического лечения II типа опухоли по J. Siewert при выполнении гастрэктомии с лимфодиссекцией D2 и субтотальной резекцией пищевода с проксимальной резекцией желудка (операция типа Льюиса) показал улучшение выживаемости после 1-го типа вмешательства.
Комбинированные расширенные операции по поводу местно-распространенного и осложненного рака желудка
РЖ на ограниченном участке может прорастать в поджелудочную железу, поперечную ободочную кишку, печень, селезенку, левый надпочечник. При распространении опухоли на соседние органы одной из составляющих комбинированного лечения являются расширенные комбинированные резекции и гастрэктомия, при этом наряду с субтотальным или полным удалением желудка резецируют участок соседнего органа.
Наиболее часто производят комбинированную гастрэктомию или субтотальную проксимальную резекцию желудка с удалением селезенки и дистальной половины поджелудочной железы с лимфатическими узлами - расширенная гастрэктомия (спленопанкреатогастрэктомия) или гастрэктомия с резекцией брыжейки поперечной ободочной кишки. При диссеминированных формах наиболее адекватные результаты в ходе комбинированного лечения могут быть получены в случае выполнения расширенных D3-вмешательств у пациентов с метастазами в забрюшинные парааортальные лимфатические узлы; комбинированной резекции печени при наличии солитарных или единичных метастазов в одну ее долю; комбинированной надвлагалищной ампутации матки с придатками при метастазах РЖ в яичники (метастазы Крукенберга).
Особую сложность представляет оперативное лечение рака культи желудка, что связано с наличием спаечного процесса в брюшной полости после предыдущей операции и прорастанием опухоли
в соседние органы. Все это увеличивает травматичность операции и требует применения комбинированных резекций. На практике выполняют экстирпацию культи желудка с лимфодиссекцией на уровне D2 с наложением эзофагоеюноанастомоза.
Достаточно трудным является оперативное лечение перфоративного РЖ. Методом выбора при хирургическом лечении осложненного рака является резекция желудка. Противопоказаниями к одномоментной операции служат тяжелое общее состояние больного, преклонный возраст, перитонит, высокое расположение опухоли, прорастание опухоли в соседние органы. При наличии противопоказаний показана двухэтапная тактика, когда на 1-м этапе производится ушивание перфорационного отверстия и в кратчайшее время после этого выполняется отсроченная резекция желудка (2-й этап).
Радикальность хирургических вмешательств
Основные причины послеоперационных рецидивов РЖ: недостаточность объема резекции с оставлением опухолевых клеток в лимфатических сосудах желудка, пораженных лимфатических узлах и окружающей клетчатке при неполном удалении большого и малого сальников, над- и подпривратниковых и лимфатических узлов вдоль магистральных сосудов желудка, непроизведенная перевязка сосудов, оставление и низкое пересечение желудка со стороны малой кривизны.
В прошлом радикальность операции определялась совокупностью «визуальных» данных во время хирургического вмешательства о полноте удаления первичной опухоли и оценке метастатического поражения регионарных лимфатических узлов в сочетании с отсутствием опухолевых клеток по линиям резекции, определяемым при морфологическом исследовании. В настоящее время характер выполненного вмешательства определяется морфологическими характеристиками первичной опухоли и распространенностью и характеристиками лимфогенного метастазирования, определяемого при морфологическом исследовании регионарных лимфатических узлов. По степени радикальности оперативного вмешательства (curability type) выделяются:
• радикальные операции (тип А) - отсутствие резидуальной опухоли с высокой вероятностью полного излечения;
• условно-радикальные операции (тип В) - отсутствие резидуальной опухоли, но при вероятности наличия субклинических опухолевых очагов;
• паллиативные операции (тип С) - наличие резидуальной опухоли.
Характеристики хирургических вмешательств с учетом характера первичной опухоли, распространенности лимфогенного метастазирования в сочетании с объемом лимфодиссекции приведены в табл. 19.4.
Таблица 19.4. Определение радикальности вмешательства при РЖ
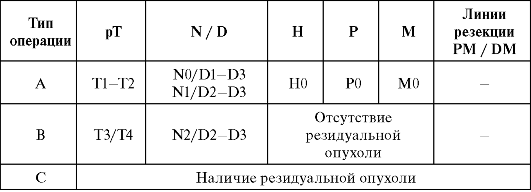 Примечание.
Индексы соответствуют классификации ЯАРЖ (1998): рТ - глубина инвазии
опухоли; N - порядковый номер лимфатического коллектора; D - уровень
лимфодиссекции; Н - метастазы в печень; Р - обсемененность брюшины; РМ -
наличие опухолевых клеток по периметру удаленного лоскута слизистой
оболочки; DM - глубина инвазии в макропрепарате.
Примечание.
Индексы соответствуют классификации ЯАРЖ (1998): рТ - глубина инвазии
опухоли; N - порядковый номер лимфатического коллектора; D - уровень
лимфодиссекции; Н - метастазы в печень; Р - обсемененность брюшины; РМ -
наличие опухолевых клеток по периметру удаленного лоскута слизистой
оболочки; DM - глубина инвазии в макропрепарате.
Методы реконструкции кишечной трубки после гастрэктомии
Крайне актуальной, наряду с совершенствованием вариантов расширенных вмешательств, является разработка физиологических методов восстановления непрерывности кишечной трубки - ведь при планировании радикального лечения и, следовательно, улучшении отдаленных результатов лечения фактор функциональной адаптации играет ключевую роль.
В настоящее время, после длительного этапа отработки, в клинической практике рекомендуется использовать 3 основные методики реконструкции после гастрэктомии (схема 19.1):
• петлевую пластику, зачастую сочетающуюся с формированием кишечного резервуара (типа Hunt-Lawrence-Rodino);
• формирование эзофагоэнтероанастомоза на отключенной петле по методу Ру (Roux-en-Y reconstruction);
• включение в пищеварительный тракт сегментов тонкой или толстой кишки (интерпозиция) на сосудистой ножке с восстановлением естественного пассажа пищи по двенадцатиперстной кишке либо с созданием тонкокишечного резервуара.
 Схема 19.1. Методики, применяемые при реконструкции после гастроэктомии
Схема 19.1. Методики, применяемые при реконструкции после гастроэктомии
Выбор метода пластической реконструкции зависит от радикальности выполненного вмешательства, индивидуальных особенностей строения брыжейки кишки у каждого пациента и зачастую от личных предпочтений хирурга.
Основными положениями, которым необходимо следовать, являются возможность наиболее физиологического восстановления кишечной трубки либо минимизация такого фактора, как рефлюксэзофагит. Однако эти факторы не могут приниматься во внимание в ущерб безопасности пациента. Нами предложены следующие варианты постгастрэктомической пластики:
• при соблюдении всех требований радикальности и отсутствии признаков диссеминации возможно выполнение реконструкции с интерпозицией сегментов кишки на ножке с включением двенадцатиперстной кишки либо формированием тонкокишечного резервуара;
• в качестве условно-радикальной операции с учетом распространенности заболевания возможно выполнение реконструкции по Ру либо петлевой пластики;
• при паллиативном вмешательстве единственно оправданным с точки зрения безопасности и прогнозируемого периода жизни является выполнение петлевой впередиободочной пластики.
Паллиативные операции
В терминальных стадиях РЖ из-за распространенности процесса у многих больных произвести радикальную операцию не представляется возможным. Однако у большинства из этих пациентов течение болезни может осложняться пилоростенозом, дисфагией, могут развиться желудочное кровотечение, прободение опухоли. Для облегчения общего состояния больного, восстановления проходимости пищи, устранения распадающейся кровоточащей опухоли прибегают к симптоматическим, паллиативным операциям.
При РЖ выполняют 2 типа паллиативных операций. При 1-м типе вмешательств операция, не устраняя очага поражения, направлена на улучшение питания и общего состояния больного. Такими операциями являются обходной анастомоз между желудком и тонкой кишкой - гастроэнтероанастомоз, гастро- и еюностомия. При 2-м типе операций удаляется первичный очаг опухоли или метастазы; к таким операциям относятся паллиативные резекции, паллиативная гастрэктомия и удаление метастазов.
Гастроэнтеростомия (наложение гастроэнтеростомоза)
Желудочно-кишечный анастомоз накладывают при иноперабельном раке выходного отдела желудка, и эта операция является наиболее частым паллиативным вмешательством. Смысл операции заключается в создании соустья между желудком и тощей кишкой. В настоящее время выполняют заднюю - позадиободочную, реже переднюю - впередиободочную гастроэнтеростомию. В 1-м случае через отверстие в брыжейке поперечной ободочной кишки выводят заднюю стенку желудка и соединяют анастомозом с петлей тонкой кишки. При 2-м варианте петлю кишки проводят впереди от поперечной ободочной кишки, прикладывают к передней стенке желудка и соединяют с ним соустьем. В 8-10 см ниже гастроэнтероанастомоза обычно накладывают межкишечный брауновский анастомоз.
Гастростомия
Операцию применяют при неоперабельном раке проксимального отдела желудка и пищевода, сопровождающемся нарушением проходимости пищи. Предложено более 100 модификаций этой операции; наибольшее распространение получила гастростомия по Кадеру и Витцелю.
Энтеростомия
Кишечный свищ или энтеростому накладывают для обеспечения питания больного при РЖ и создания проходимости пищеварительного тракта. Операция также производится при обширном поражении желудка с нарушением проходимости и если невозможно наложить гастростому. Подобная операция является единственным средством помочь неоперабельному больному раком резецированного желудка. Чаще искусственный свищ создается в начальном отделе кишечника (еюностомия).
Однако еюностомия не пользуется популярностью среди хирургов. Это связано с тем, что введение зонда, значительно суживающего просвет кишки, вызывает застой и создает условия для вытекания кишечного содержимого.
Паллиативные резекции желудка при раке желудка
Ко 2-му типу паллиативных операций относятся паллиативные резекции. Эти операции выполняются в основном при невозможности полного удаления метастазов в лимфатических узлах или в органах при удалимости первичной опухоли. Паллиативную или циторедуктивную резекцию желудка производят главным образом с целью уменьшения общего количества опухолевых клеток, что ведет к увеличению эффективности последующей лучевой и химиотерапии.
Противопоказаниями к проведению паллиативной резекции являются: метастазы в брюшину, брыжейку, сальник, асцит; отдаленные метастазы в кости, головной мозг, легкие и т.д., тяжелое общее состояние больного.
Паллиативное удаление первичного очага позволяет уменьшить массу опухоли и тем самым уменьшить ее токсическое влияние на организм, устранить источник непроходимости и кровотечения, что позволяет больному жить некоторое время с метастазами. В основном паллиативные резекции выполняют с целью дальнейшего проведения химио- и лучевой терапии. Обходные анастомозы, гастро- и еюностомы также облегчают проведение лекарственного лечения, поскольку ослабленный голодом больной не в состоянии выдержать лечение. Улучшение состояния пациента после начала питания через стому в дальнейшем позволит применить химиотерапию. Техника таких операций такая же, как и обычной резекции желудка, но без удаления лимфатических узлов или метастазов.
Химиотерапия диссеминированного рака желудка
В большинстве случаев РЖ слабочувствителен к большинству применяемых химиопрепаратов, что связано с гиперэкспрессией мембранных онкобелков, особой конформации белково-липидных молекул мембраны клеток, ограничивающих проникновение в опухолевую клетку химиопрепаратов (феномен множественной лекарственной устойчивости). В настоящее время многие онкологи, особенно общей лечебной сети, высказывают определенный скептицизм при проведении консервативной лекарственной терапии у больных диссеминированным раком желудка. Однако рандомизированные исследования, в которых сравнивали результаты химиотерапии и симптоматической терапии, убедительно продемонстрировали, что лекарственная терапия увеличивает продолжительность жизни у больных с метастатическим процессом с 3-5 мес до 10-12 мес (табл. 19.5). На основании результатов этих исследований сегодня считается неэтичным отказывать больному диссеминированным РЖ в проведении химиотерапии.
До недавнего времени основным препаратом для лечения РЖ считался 5-фторурацил. Однако со временем в практику все больше входят препараты платины (цисплатин), митомицин-С, доксорубицин, кармустин и таксаны, особенно в сочетании с различными методиками введения 5-фторурацила. Наиболее часто применяемые схемы полихимиотерапии: FAM, FAMtx, EAP, ELF. Эффективность химиотерапии увеличивает дополнительное использование модификаторов: лейковорина, левамизола, интерферона, церулоплазмина, амфотерицина, циметидина, дрожжевых полисахаридов, антиоксидантных комплексов и др. В процессе химиотерапии осуществляется мониторинг показателей гемо-, иммунограмм, при необходимости требуется соответствующая лекарственная «терапия сопровождения». Таблица 19.5. Сравнение эффективности химиотерапии и симптоматической
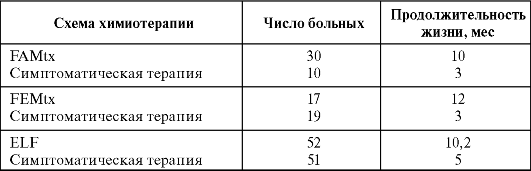 В
конце 1990-х годов все чаще стали использоваться комбинации с
включением платины. Одним из таких режимов является комбинация PF, в
которой после введения цисплатина предусмотрена пролонгированная инфузия
5-фторурацила (5-ФУ) в течение 5 сут.
В
конце 1990-х годов все чаще стали использоваться комбинации с
включением платины. Одним из таких режимов является комбинация PF, в
которой после введения цисплатина предусмотрена пролонгированная инфузия
5-фторурацила (5-ФУ) в течение 5 сут.
Необходимо отметить, что в настоящее время отсутствуют стандарты лекарственного лечения больных метастатическим РЖ. В США, Корее и Японии стандартной считается схема PF, в то время как в Европе чаще используется схема PEF. Многие, считая комбинации с включением цисплатина слишком токсичными, предпочитают использовать «бесплатиновые» режимы (ELF или FAMtx). По непосредственной эффективности платиновые комбинации имеют некоторые преимущества, которые, однако, не влияют существенным образом на продолжительность жизни больных диссеминированным РЖ.
В последние годы возрос интерес к применению таксанов и иринотекана для лечения больных РЖ (табл. 19.6). При монотерапии эффективность этих препаратов составила 21-23 %.
Таблица 19.6. Эффективность различных противоопухолевых препаратов
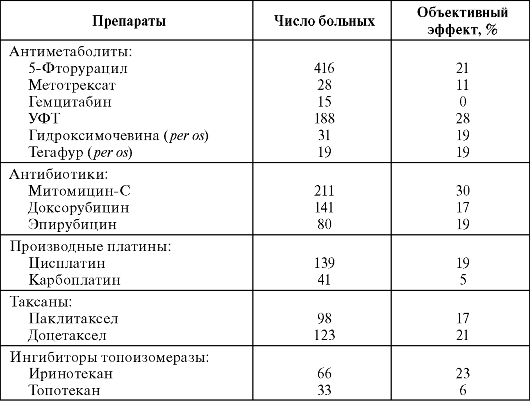 Изучается
также возможность применения в составе комбинированной химиотерапии
новых представителей фторпиримидинов (капецитабина, УФТ), которые при
пероральном приеме по своим фармакокинетическим параметрам имитируют
длительные внутривенные инфузии 5-фторурацила. Показано, что капецитабин
(в дозе 1000 мг/м2 дважды в день) в комбинации с цисплатином (в дозе 60 мг/м2 в день) и эпирубицином (в дозе 50 мг/м2
каждые 3 нед) обладает удовлетворительной переносимостью и эффективен у
39 % больных аденокарциномой желудка. Анализ фармакокинетики показал,
что капецитабин хорошо усваивается даже у больных, перенесших ранее
резекцию желудка, при этом концентрация препарата в крови аналогична
отмечаемой при проведении длительных внутривенных инфузий 5-фторурацила.
Изучается
также возможность применения в составе комбинированной химиотерапии
новых представителей фторпиримидинов (капецитабина, УФТ), которые при
пероральном приеме по своим фармакокинетическим параметрам имитируют
длительные внутривенные инфузии 5-фторурацила. Показано, что капецитабин
(в дозе 1000 мг/м2 дважды в день) в комбинации с цисплатином (в дозе 60 мг/м2 в день) и эпирубицином (в дозе 50 мг/м2
каждые 3 нед) обладает удовлетворительной переносимостью и эффективен у
39 % больных аденокарциномой желудка. Анализ фармакокинетики показал,
что капецитабин хорошо усваивается даже у больных, перенесших ранее
резекцию желудка, при этом концентрация препарата в крови аналогична
отмечаемой при проведении длительных внутривенных инфузий 5-фторурацила.
При химиотерапии (эффективна эндоскопическая интра- и паратуморальная химиотерапия) осуществляется непосредственное введение препарата в опухоль и вокруг нее при выполнении фиброгастроскопии. Чувствительность клеток РЖ также повышается при предварительном нагревании химиопрепаратов или локальном прогревании опухоли (СВЧ-гипертермия). Весьма перспективна внутрибрюшинная химиотерапия, которая увеличивает концентрацию препаратов в зонах потенциального метастазирования (по сравнению с внутривенным введением) в десятки раз.
Наиболее адекватным анатомическим путем доставки химиопрепаратов в РЖ является селективное введение в сосуды, питающие опухоль. Для этого осуществляется катетеризация правой желудочносальниковой или левой желудочной артерии (в зависимости от локализации). Внутриартериальная неоадъювантная полихимиотерапия может выполняться на предоперационном этапе лечения и у иноперабельных пациентов. Обычно используют цисплатин, фторурацил и (или) антракциклины или режим ECF (эпирубицин - 50 мг/м2, цисплатин - 60 мг/м2 и непрерывная инфузия 5-ФУ - 200 мг/м2 в день).
Лучевая терапия
Примение лучевой терапии предпочтительно при локально контролируемых формах: кардиальном и кардиоэзофагеальном РЖ. При планировании лучевой терапии учитываются: распространенность РЖ, анатомическая локализация и размеры опухоли, общий соматический статус больного, возраст пациента, особенности его конституции.
Применение лучевой терапии при РЖ во многом ограничено вариабельным положением желудка, ограничением лучевых полей, наличием лимитирующих дозу органов в верхнем этаже брюшной полости (желудок, тонкая кишка, почки, печень, спинной мозг).
При проведении лучевой терапии необходимо учитывать, что лучевое поле должно захватывать весь желудок, поэтому, принимая во внимание дорсальное отклонение проксимальных отделов, в практике обычно используют облучение с двух полей: переднего и заднего. Это положение также отвечает задачам подведения максимальной лучевой дозы к регионарным лимфатическим узлам забрюшинного пространства (области чревного ствола и его ветвей). В то же время при раке проксимального отдела желудка с переходом на пищевод, при отсутствии вовлечения окружающих структур, с целью уменьшения лучевого воздействия на критические органы (в первую очередь сердце, особенно у пожилых больных) лучевая терапия может проводиться и с латеральных полей.
Основным лимитирующим органом, как правило, всегда попадающим в лучевое поле, являются почки. Вот почему многие исследователи ограничивают подводимую дозу 30 Гр. При подведении больших доз рекомендуется исключить 2/3 или 3/4 одной из почек, что эффективно для профилактики лучевого нефрита.
Наиболее часто лучевая терапия проводится в дозе от 40 до 50 Гр за 4-5 нед (по 2 Гр 5 дней в неделю). Эта доза обусловлена переносимостью лучевой терапии самим желудком, а также кишечником. Превышение данной дозы с высокой частотой может вызывать развитие фатальных осложнений: острой перфоративной язвы желудка или двенадцатиперстной кишки, а также профузного кровотечения.
При лучевой терапии на желудок, особенно при подведении доз, превышающих 1,8 Гр, перед лучевой терапией рекомендуется назначить антиэметики (противорвотные препараты).
Пациенты, перенесшие субтотальную проксимальную или дистальную резекцию желудка, легче переносят лучевую терапию. Причем следует учитывать, что у больных с неудаленной первичной опухолью диспепсические симптомы, а также анорексия более выражены, поэтому зачастую на фоне проведения лучевой терапии они уменьшают ежедневный пищевой рацион. У этих пациентов крайне важны дробное диетическое питание, а при снижении массы тела на 10 % от исходного на фоне лучевой терапии - гипералиментация
(дополнительное высококалорийное питание). Контроль массы тела проводится еженедельно.
При раке проксимального отдела желудка с переходом на пищевод, особенно при подозрении на полное прорастание желудочной стенки, в лучевое поле обязательно включают левый купол диафрагмы. С целью профилактики лучевой кардиотоксичности, в частности при планировании конкурентной или последовательной химиотерапии (особенно с включением доксорубицина), обязательно используют защитные свинцовые блоки.
Как самостоятельный метод лучевая терапия наиболее часто проводится в случае локорегионарного рецидива РЖ после хирургического лечения либо как дополнительное лечение при наличии резидуальной опухоли в виде опухолевых клеток или инфильтрации по линии резекции. В этих случаях суммарная очаговая доза может быть повышена, а лучевая терапия - проводиться с нескольких полей.
Интраоперационная лучевая терапия операбельного рака желудка
Теоретическим обоснованием предоперационной лучевой терапии является снижение биологического потенциала опухолевых клеток и тем самым повышение абластичности хирургического вмешательства, а также возможное воздействие на субклинические метастазы. В связи с относительной радиорезистентностью аденокарциномы желудка и низкой толерантностью окружающих желудок органов подведение достаточных для подавления опухолевого роста доз ионизирующего излучения к органам верхнего этажа брюшной полости традиционными методами лучевой терапии не представляется возможным. Для преодоления этого ограничения предложена методика интраоперационной лучевой терапии - ИОЛТ (Abe M. et al., 1971). Методика заключается в однократном облучении во время оперативного вмешательства пучком ускоренных электронов ложа опухоли и зоны регионарного лимфогенного метастазирования. По мнению авторов, преимуществами ИОЛТ являются возможность прецизионного облучения мишени, а также исключения интактных радиочувствительных структур: культи пищевода/желудка и двенадцатиперстной кишки; тонкой и поперечной ободочной кишок; общего желчного протока. Это позволяет резко уменьшить вероятность развития лучевых осложнений.
Обычно доза ИОЛТ составляет 20 Гр. Энергия пучка ускоренных электронов варьирует от 8 до 15 МэВ; диаметр поля облучения -
от 6 до 10 см. Границы поля при ИОЛТ включают расположенные забрюшинно ткани с кровеносными и лимфатическими сосудами и узлами от ворот печени слева до дистальной части селезеночной артерии справа, от области пищеводного отверстия диафрагмы вверху до средней трети тела поджелудочной железы внизу - с включением парааортальной области (рис. 19.14).
В связи с технической и методической сложностью проведения ИОЛТ до настоящего времени не существует стандартизованных подходов к ее выполнению.
Адъювантная лучевая терапия. В связи с высокой радиорезистентностью РЖ, превышающей уровень подводимых доз (в связи с наличием дозолимитирующих органов), в самостоятельном варианте метод не нашел широкого клинического применения.
Конкурентная химиолучевая терапия операбельного рака желудка
С целью локального и системного воздействия на субклинические очаги опухоли используется химиолучевая терапия в комбинации с расширенными операциями (как при нерезектабельном, так и при резектабельном РЖ). Конкурентное проведение терапии позволяет
 Рис. 19.14. Границы поля при ИОЛТ
Рис. 19.14. Границы поля при ИОЛТ
потенцировать один из методов - лучевую терапию на фоне ведения химиопрепаратов, а при удовлетворительной переносимости - уменьшить время от начального радикального хирургического лечения до проведения комплексного воздействия на субклинические очаги опухоли (как локальные, в зоне операции, так и системные). Особенно эффективной считается комбинация продленной инфузии 5-фторурацила в биохимической модуляции с фолиевой кислотой (лейковорин) в виде 5-суточного введения невысоких доз (500 мг/м2 в сут), с применением на этом фоне лучевой терапии с динамическим фракционированием дозы.
Комбинированное химиолучевое лечение может проводиться при местно-распространенных формах РЖ в самостоятельном варианте.
Комбинированное лечение местно-распространенного рака желудка
При лечении местно-распространенного РЖ (стадия III: T3-4; N+) показано комбинированное лечение, включающее хирургический этап в сочетании с химиолучевой терапией.
Сегодня, несмотря на увеличение агрессивности хирургического лечения РЖ с применением расширенных и расширенно-комбинированных вмешательств, крайне остро стоит проблема лечения локорегионарных рецидивов. Хирургическое лечение, даже выполненное по радикальной программе, в большинстве случаев не является таковым в связи с субклинической диссеминацией процесса, что связано с высокими инвазивными свойствами РЖ. В этой ситуации большие надежды возлагаются на комбинацию хирургического метода с различными видами консервативной противоопухолевой терапии.
В целом эффективность лечения РЖ определяет хирургический метод, а другие методы лечения являются дополнительными, которые выполняются до или после хирургического этапа и обозначаются в зависимости от их последовательности. Так, консервативное лечение, проводимое до хирургического этапа, называется неоадъювантным, а осуществляемое после операции - адъювантным.
Неоадъювантная химиотерапия в комбинированном лечении местно-распространенного рака желудка
При операбельном РЖ с вовлечением окружающих структур (cT4) или метастазами в забрюшинные лимфатические коллекторы 2-го этапа метастазирования предложено проводить предоперационную
(неоадъювантную) химиотерапию. По мнению исследователей, применение эффективной схемы химиотерапии улучшает условия оперирования и уменьшает вероятность интраоперационного метастазирования при механическом воздействии на опухоль. С другой стороны, такой подход оправдан в плане воздействия на субклинические микрометастазы заболевания, что может привести к снижению стадии и увеличению частоты резектабельности РЖ.
Однако на практике, по данным многоцентровых рандомизированных исследований, эффект неоадъювантной терапии оказался ниже ожидавшегося, что связано с достаточно низкой эффективностью применяемых химиопрепаратов. Внедрение в практику новых их комбинаций должно повысить эффективность неоадъювантной терапии у больных местно-распространенным раком желудка. Важно также определить факторы, которые помогут предсказывать эффективность планируемой химиотерапии у конкретного больного. Одним из факторов ранней оценки химиорезистентности опухоли, а значит, неэффективности комбинированного лечения и возможности прогрессирования на фоне длительной предоперационной терапии является динамическая ПЭТ - метод, рассматриваемый как прижизненная биопсия опухоли, и морфологическое определение в исследованном материале прогностических маркеров, например, активности тимидилфосфорилазы, определяющей чувствительность опухоли к 5-фторурацилу.
Адъювантная химиотерапия у больных операбельным раком желудка
Место адъювантной химиотерапии в лечении местно-распространенного рака желудка продолжает обсуждаться. Проведение адъювантной химиотерапии предпочтительно в случае выполнения условно-радикальных вмешательств R0 (по классификации ЯАРЖ). Комбинированное лечение с проведением послеоперационной терапии является стандартом лечения пациентов со II и III стадиями РЖ в Японии и широко используется в США, Корее, некоторых странах Европы. В группе комбинированного лечения местно-распространенного РЖ после проведения адъювантной химиотерапии получено хоть и скромное, но статистически значимое улучшение отдаленных результатов (Sakuromoto S., 2007).
К условно-радикальным вмешательствам относятся операции, во время которых производится полное удаление визуально определяемой опухоли с отсутствием клеток по линиям резекции - R0
(отсутствие резидуальной опухоли). В этом случае послеоперационная химиотерапия носит название адъювантной. При удалении диссеминированной опухоли (например, удаление метастазов в печень) даже при отсутствии определяемой доступными методами исследования опухоли операции носят паллиативный характер, а послеоперационная химиотерапия называется дополнительной.
Однако попытки улучшить безрецидивную и общую выживаемость путем комбинации хирургического лечения и послеоперационной адъювантной химиотерапии не принесли ожидаемого эффекта. Это подтолкнуло онкологов к попытке провести дополнительное локальное и системное воздействие на субклинические очаги опухоли путем комбинации лучевого и химиотерапевтического методов.
Так, в одном из лучших онкологических центров мира - Memorial Sloan-Kettering Cancer Center (Нью-Йорк) - лечение операбельного рака желудка в обязательном порядке включает 2 основных компонента:
• радикальное хирургическое лечение с обязательным удаленим регионарных лимфатических коллекторов 2-го этапа метастазирования (N2), т.е. лимфодиссекция D2;
• системное воздействие на субклинические отсевы опухоли с возможным дополнительным локальным воздействием на зону хирургического вмешательства в виде комбинации химио- и лучевой терапии в конкурентном режиме (совместное применение химиопрепаратов и проведение лучевой терапии). Химиотерапия включает 5-фторурацил как наиболее эффективный в монорежиме препарат, который в достаточной дозировке помимо воздействия на опухолевые клетки потенцирует эффект лучевого воздействия. 5-фторурацил вводят в виде 5-суточной инфузии на фоне биологического модулятора - лейковорина. На фоне проведения лучевой терапии проводится 2 курса химиотерапии с последующим проведением двух дополнительных курсов химиотерапии.
При комбинированном лечении РЖ наиболее целесообразно применение неоадъювантной и адъювантной химиотерапии в сочетании с интраоперационной химиотерапией. Например, на дооперационном этапе - 5-фторурацил, 600-800 мг/м2, суточная инфузия; интраоперационно - 800 мг/м2, капельная инфузия в портальную вену в течение всей операции; послеоперационный этап - продолжение интрапортальной инфузии: 800 мг/м2 в сутки - до суммарной курсовой дозы 5000-7000 мг.
ПРОГНОЗ
И ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ
Отдаленные результаты лечения РЖ зависят от стадии заболевания к моменту его диагностики, гистологической структуры опухоли и своевременности начатого лечения. Прогноз у больных операбельным РЖ определяется в первую очередь стадией заболевания. Значимыми факторами прогноза являются также возраст пациента, гистологический подтип (кишечный или диффузный), локализация опухоли - дистальная или проксимальная часть желудка.
При начальных формах рака желудка 5-летняя выживаемость в среднем составляет при I стадии - 87-100 %, при II стадии - 70-80 %, при III стадии - около 20 %. После радикальных операций при раке типа T1-2N0M0 выздоравливают более 80% больных. Наличие метастазов или прорастание серозной оболочки желудка в 2-3 раза ухудшает результаты. При прорастании в серозную оболочку (pT3) показатель 5-летней выживаемости падает до 50 %, а при наличии метастазов в регионарные лимфатические узлы составляет не более 20 %.
После гастрэктомии и проксимальной резекции 5 лет живут 20-25 % радикально оперированных пациентов, после комбинированных операций, а также операций по поводу рака культи желудка - 20-30 % пациентов. Средняя продолжительность жизни после радикальной операции по поводу РЖ, осложненного перфорацией и кровотечением, составляет около 30 мес. В целом при экспансивном раке 5-летняя выживаемость достигает 40-45 %, при инфильтративном - 3-5 %. 5-летняя выживаемость больных при раке проксимального отдела желудка составляет 10-15 %, а дистального - 50 %.
Однако более половины больных РЖ поступают на лечение в запущенном состоянии, когда радикальная операция возможна лишь у 30-40 % из них. Большинство больных с распространенным РЖ умирают в течение первых двух лет от рецидивов и метастазов.
Нами проанализированы основные «опухользависимые» и «лечениезависимые» прогностические факторы, оказывающие значимое влияние на отдаленные результаты при РЖ. Было установлено, что такие факторы, как гистологическая структура и степень дифференцировки опухоли, не влияют на отдаленные результаты лечения. Существенную значимость имеет лимфогенная распространенность: количество пораженных лимфатических узлов и уровень поражения
лимфатических коллекторов, глубина прорастания опухоли в стенку желудка, стадия процесса, тип роста по R. Borrmann (1926), а для рака проксимального отдела желудка - тип опухоли по J. Siewert (1996). К значимым факторам прогноза, рассматриваемым как «лечениезависимые», относятся радикальность выполненного вмешательства, уровень лимфодиссекции по классификации ЯАРЖ (1998) и наличие послеоперационных осложнений.
К относительно благоприятным факторам прогноза при РЖ относятся:
• глубина опухолевой инвазии на уровне слизисто-подслизистого слоя (рТ1);
• индекс лимфогенного метастазирования N0 или N1;
• отсутствие лимфогенных метастазов либо поражение лимфатических узлов;
• 1-й этап метастазирования по классификации ЯАРЖ (1998);
• отсутствие резидуальной опухоли (R0);
• 1-й и 2-й типы роста опухоли по R. Borrmann;
• 2-й тип аденокарциномы зоны пищеводно-желудочного перехода по классификации J. Siewert при кардиоэзофагеальном раке;
• радикальный или условно-радикальный характер выполненного вмешательства (Curability-type А, В);
• отсутствие поражения либо поражение до шести лимфатических узлов по классификации МПС (2002);
• отсутствие перинодальной (в клетчатку вокруг лимфатического узла) опухолевой инвазии;
• отсутствие инвазии лимфатических и кровеносных сосудов;
• отсутствие отдаленных метастазов;
• стадия РЖ I-IIIa.
Вопросы для самоконтроля
1. Перечислите основные факторы желудочного канцерогенеза.
2. Какие диетические факторы снижают риск развития РЖ?
3. Какие выделяют основные типы РЖ, исходя из эпидемиологии и патогенеза?
4. Какой тип рака желудка - кишечный или диффузный - связан с наследственными факторами?
5. Какие заболевания желудка следует отнести к предраковым состояниям?
6. Какая группа больных с предраковыми состояниями имеет особенно высокий риск развития РЖ и подлежит постоянному динамическому наблюдению?
7. Какие гистологические формы рака выделяют, согласно Международной гистологической классификации опухолей желудка ВОЗ?
8. Каковы основополагающие принципы стадирования РЖ по классификации TNM МПС и ЯАРЖ?
9. Приведите классификацию рака проксимального отдела желудка.
10. По какому преимущественно типу происходит метастазирование РЖ - лимфогенному, гематогенному или контактному?
11. Где локализуется метастаз Вирхова?
12. Назовите группы осложнений РЖ.
13. Какие основные типы жалоб могут предъявлять больные РЖ?
14. Какие выделяются варианты клинического течения РЖ?
15. Какие жалобы больных наиболее настораживают в отношении РЖ?
16. Перечислите заболевания, с которыми наиболее часто приходится дифференцировать РЖ.
17. Какие методы применяются в диагностике РЖ?
18. Назовите радикальные и паллиативные операции при РЖ.
19. Перечислите показания к радикальному хирургическому вмешательству при РЖ.
20. Каков объем хирургического вмешательства, производимого с учетом уровня лимфодиссекции?
21. Назовите основные принципы выбора метода резекции при РЖ.
22. Перечислите радикальные операции при РЖ.
23. Каковы особенности хирургического лечения РЖ в зависимости от локализации и формы роста?
24. Охарактеризуйте тактику хирургического лечения рака желудочно-пищеводного перехода.
25. Определите место комбинированных расширенных операций по поводу местно-распространенного и осложненного РЖ.
26. В чем заключается радикальность хирургических вмешательств
при РЖ?
27. Какие методы реконструкции кишечной трубки после гастрэктомии используются на современном этапе?
28. Перечислите паллиативные операции при РЖ.
29. В каких случаях выполняется гастроэнтеростомия (наложение гастроэнтеростомоза)?
30. Какова роль химиотерапии диссеминированного РЖ?
31. Назовите принципы лучевой терапии при РЖ.
32. В каких случаях показана интраоперационная лучевая терапия операбельного РЖ?
33. Определите место конкурентной химиолучевой терапии операбельного РЖ.
34. В чем заключается комбинированное лечение местно-распространенного РЖ?
35. Определите роль неоадъювантной химиотерапии в комбинированном лечении местно-распространенного РЖ.
36. Каковы возможности адъювантной химиотерапии у больных операбельным РЖ?
37. Каковы прогноз РЖ и отдаленные результаты лечения?