Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев. 2010. - 920 с.
|
|
|
|
ГЛАВА 18 РАК ПИЩЕВОДА
ЭПИДЕМИОЛОГИЯ
Рак - наиболее часто встречающееся (70-90 %) заболевание пищевода. В структуре заболеваемости злокачественными новообразованиями человека рак пищевода занимает в мире 6-е место. В России рак пищевода, составляя 2,5 % всех злокачественных новообразований у мужчин и 0,68 % - у женщин, занимает соответственно 11-е и 18-е места в структуре заболеваемости, а в структуре смертности - 7-е место.
Заболеваемость раком пищевода в России имеет тенденцию к снижению, так, с 2000 по 2005 г. у мужчин она снизилась на 4,3 %. Наиболее высокая заболеваемость раком пищевода у мужчин была в Республике Саха, Бурятии, на Алтае и в Чеченской Республике (15,4-19,8 на 100 тыс. населения), у женщин - в Чукотском автономном округе (16,4). Относительно низкая заболеваемость отмечалась в республиках Адыгея (3,1 на 100 тыс. мужчин и 0,1 на 100 тыс. женщин), Хакасия (соответственно 2,7 и 0,3) и в Курганской области (0,2 на 100 тыс. женщин).
В 2007 г. в РФ заболеваемость раком пищевода в среднем была 5,0 на 100 тыс. населения, в том числе среди мужчин - 8,4, среди женщин - 2,1. Рак пищевода у мужчин встречается чаще, чем у женщин, в 2-3 раза. В основном заболевают люди пожилого возраста, - на лиц старше 60 лет приходится до 80 % всех заболевших раком указанной локализации. В возрасте до 30 лет рак пищевода встречается в виде единичных наблюдений.
Отмечается значительная неравномерность в географическом распределении заболевания. Так, в государствах Средней Азии она в 3-5 раз превышает средний уровень и в 10-12 раз выше заболеваемости, наблюдаемой на юго-западе и западе СНГ. В Молдове, Украине, Белоруссии заболеваемость раком пищевода колеблется в пределах 1,7-2,6 на 100 тыс. населения, в Казахстане и Туркменистане достигает 23,7-28,3. За пределами России наиболее часто рак пищевода
встречается в Иране, Швейцарии, Панаме, Бразилии, Японии. Редко болеют раком пищевода на Кубе, в Мексике, южных штатах США, Нигерии. В северных районах Ирана заболеваемость составляет 115 на 100 тыс. населения, а выше всего она в Северном Китае и Корее - 140 на 100 тыс. населения.
СПОСОБСТВУЮЩИЕ ФАКТОРЫ
К факторам, способствующим возникновению рака пищевода, относят систематический прием горячей, обжигающей, грубой, плохо пережеванной пищи, потребление крепких алкогольных напитков и курение. Эти факторы вызывают хронические воспалительные процессы, которые при длительном существовании приводят к развитию злокачественных новообразований. Здесь же следует отметить процессы, влекущие за собой развитие рубцов, хронических воспалительных изменений, - послеожоговые стриктуры, эзофагит на почве грыжи пищеводного отверстия диафрагмы, «короткого» пищевода и др. Наряду с этим рак пищевода носит и профессиональный характер - чаще болеют механизаторы: трактористы, шоферы, комбайнеры.
Развитию рака пищевода способствуют также дивертикулы, в которых поддерживаются хронические воспалительные процессы. Большую роль в развитии рака пищевода отводят лейкоплакии, которую большинство исследователей считают облигатным предраком. Отмечена связь между раком пищевода и сидеропеническим синдромом, возникающим вследствие понижения содержания железа в плазме крови (сидеропения). Сидеропенический синдром (сидеропеническая дисфагия, синдром Пламмера-Винсона) характеризуется дисфагией, ахилией, хроническим глосситом и хейлитом, ранним выпадением волос и потерей зубов, выраженной гипохромной анемией. Определенное значение в развитии рака пищевода имеют полипы и доброкачественные опухоли. Однако сами по себе эти заболевания встречаются относительно редко, а при развившемся раке не всегда удается установить следы существовавшего ранее патологического процесса.
Патологическая анатомия и метастазирование
Частота поражения опухолями различных анатомических частей пищевода различна. По литературным данным, рак шейной и верхнегрудной частей пищевода составляет 10 %, среднегрудной - 60 %, нижнегрудной и брюшной частей - 30 %.
Различают 3 формы рака пищевода:
1) язвенный (блюдцеобразный, кратерообразный) - растет экзофитно в просвет пищевода преимущественно по длине;
2) узловой (грибовидный, папилломатозный) - имеет вид цветной капусты, обтурирует просвет пищевода, при распаде может напоминать язвенный рак;
3) инфильтрирующий (скирр, стенозирующий) - развивается в подслизистом слое, циркулярно охватывает пищевод, проявляется в виде белесоватой плотной слизистой, на фоне которой могут возникать изъязвления; стенозирующий циркулярный рост преобладает над ростом по длине органа.
По гистологическому строению в 97-99 % случаев рак пищевода является плоскоклеточным различной степени зрелости: с ороговением и без него.
В 1-3 % случаев обнаруживают железистые формы, развивающиеся из желез слизистой оболочки пищевода или из дистопированного эпителия. В редких случаях обнаруживается низкодифференцированный рак.
Метастазирование рака пищевода зависит от гистологического строения опухоли и своеобразно развитой сети лимфатических сосудов. Поскольку в подслизистой основе пищевода имеется мощное сплетение лимфатических сосудов, для рака характерно внутристеночное распространение опухолевых метастазов по лимфатическим путям на расстоянии 4-5, а иногда и 10 см от видимого края опухоли. Нередко наблюдаются так называемые пылевые метастазы на слизистой оболочке гораздо дальше (обычно выше) определяемого микроскопически края опухоли.
Вторым этапом метастазирования является распространение опухоли в лимфатические узлы. Каждый отдел пищевода имеет свои пути лимфооттока. Так, метастазирование рака шейного отдела пищевода происходит в глубокие шейные лимфатические узлы, верхнегрудного и среднегрудного отделов - в параэзофагеальные, трахеобронхиальные и задние средостенные, а нижнегрудного и брюшного отделов - в лимфатические узлы, находящиеся под диафрагмой (параэзофагеальные, паракардиальные), и узлы, расположенные вдоль малой кривизны желудка и левой желудочной артерии. Часть лимфатических сосудов пищевода впадает непосредственно в грудной проток.
Нередки случаи обнаружения метастазов рака в лимфатических узлах малого сальника, вдоль левой желудочной артерии
при поражении верхнегрудной части пищевода, в шейных и надключичных лимфатических узлах при раке нижнегрудной части пищевода. Отдаленные лимфо- и лимфогематогенные метастазы рака пищевода наблюдаются в печени, легких, реже - в костной системе.
КЛАССИФИКАЦИЯ
Для правильной оценки распространенности процесса, выбора метода лечения и достоверной оценки отдаленных результатов лечения пользуются классификацией рака пищевода по стадиям.
I стадия - небольшая опухоль, поражающая слизистую оболочку и подслизистую основу стенки пищевода, без прорастания его мышечной оболочки. Сужения просвета пищевода нет. Метастазов нет.
II стадия - опухоль поражает и мышечную оболочку пищевода, но не выходит за пределы стенки органа. Имеется сужение просвета пищевода. Обнаруживаются единичные метастазы в регионарных лимфатических узлах.
III стадия - опухоль прорастает все слои стенки пищевода, переходит на околопищеводную клетчатку или серозную оболочку. Прорастания в соседние органы нет. Сужение пищевода. Множественные метастазы в регионарных лимфатических узлах.
IV стадия - опухоль прорастает все слои стенки пищевода, околопищеводную клетчатку, распространяется на прилежащие органы. Могут иметься пищеводно-трахеальный или пищеводно-бронхиальный свищ, множественные метастазы в регионарные и отдаленные лимфатические узлы (классификация принята Министерством здравоохранения СССР в 1956 г.).
МЕЖДУНАРОДНАЯ КЛАССИФИКАЦИЯ ПО СИСТЕМЕ TNM (2002)
Правила классификации
Представленная ниже классификация применима только для рака. В каждом случае необходимы гистологическое подтверждение диагноза и выделение гистологического типа опухоли.
Анатомические области
Шейный отдел пищевода
Шейный отдел пищевода берет начало от уровня нижней границы щитовидного хряща и заканчивается у яремной вырезки (на расстоянии 18 см от верхних резцов).
Грудной отдел пищевода
I. Верхнегрудная часть берет начало у яремной вырезки и заканчивается на уровне бифуркации трахеи (на расстоянии 24 см от верхних резцов).
II. Среднегрудная часть занимает область между бифуркацией трахеи и плоскостью, расположенной чуть выше пищеводно-желудочного перехода (на расстоянии 32 см от верхних резцов).
III. Нижнегрудная часть и брюшной отдел пищевода занимают в длину около 8 см и включают пищеводно-желудочный переход, расположенный на расстоянии 40 см от верхних резцов).
Регионарные лимфатические узлы
Ниже перечислены основные группы регионарных лимфатических узлов.
Шейный отдел пищевода:
- предлестничные лимфатические узлы;
- внутренние яремные лимфатические узлы;
- верхние и нижние шейные лимфатические узлы;
- околопищеводные лимфатические узлы;
- надключичные лимфатические узлы. Грудной отдел пищевода:
- верхние околопищеводные лимфатические узлы (расположены выше непарной вены);
- трахеобронхиальные лимфатические узлы;
- нижние околопищеводные лимфатические узлы (расположены ниже непарной вены);
- лимфатические узлы средостения;
- перигастральные лимфатические узлы (за исключением чревных лимфоузлов).
Клиническая классификация TNM
Т - первичная опухоль
Тх - оценка первичной опухоли невозможна. Т0 - первичная опухоль не обнаружена. Tis - преинвазивная карцинома (carcinoma in situ). T1 - опухоль поражает собственную пластинку слизистой оболочки и подслизистый слой. Т2 - опухоль проникает в мышечный слой. Т3 - опухоль проникает в соединительнотканную пластинку. Т4 - опухоль проникает в прилегающие органы и ткани.
N - регионарные лимфатические узлы
? - состояние регионарных лимфатических узлов оценить невозможно.
N0 - метастазов в регионарных лимфатических узлах нет. N1 - метастазы в регионарные лимфатические узлы имеются.
М - отдаленные метастазы
Мх - наличие отдаленных метастазов оценить невозможно.
М0 - отдаленных метастазов нет.
M1 - наличие отдаленных метастазов.
Опухоли нижнегрудной части пищевода:
М1а - метастазы в чревные лимфатические узлы.
М1Ь - иные отдаленные метастазы. Опухоли верхнегрудной части пищевода:
М1а - метастазы в шейные лимфатические узлы.
М1Ь - иные отдаленные метастазы. Опухоли среднегрудной части пищевода:
М1а - стадия не используется.
М1Ь - поражение отдаленных лимфатических узлов и (или) иных органов.
Патоморфологическая классификация рTNM
Критерии выделения категорий рТ, pN и рМ соответствуют таковым для категорий Т, N и М.
С целью патоморфологической оценки показателя N проводят удаление шести лимфатических узлов средостения или более. В настоящее время принято, что отсутствие характерных изменений ткани при патоморфологическом исследовании биоптатов меньшего количества лимфатических узлов позволяет подтвердить стадию
Группировка по стадиям
 Новые
понятия в классификации касаются прежде всего сторожевого
лимфатического узла, который находится ближе всего к первичной опухоли.
Индикация сторожевого лимфатического узла проводится путем лимфографии
или радиоизотопного исследования.
Новые
понятия в классификации касаются прежде всего сторожевого
лимфатического узла, который находится ближе всего к первичной опухоли.
Индикация сторожевого лимфатического узла проводится путем лимфографии
или радиоизотопного исследования.
Классификация сторожевого лимфатического узла:
pNx (sn) - сторожевой лимфатический узел не оценивался. pN0 (sn) - отсутствие метастазов в сторожевом лимфатическом узле.
pN1 (sn) - наличие метастазов в сторожевом лимфатическом узле.
Изолированные опухолевые клетки в лимфатических узлах и отдаленных органах - это отдельные опухолевые клетки или группы клеток размером не более 0,2 мм. Индикация изолированных опухолевых клеток проводится путем стандартной микроскопии иммуногистохимическими и молекулярными методами исследования.
Изолированные опухолевые клетки не обладают метастатической активностью, не инвазируют стенки кровеносных и лимфатических сосудов. Наличие изолированных опухолевых клеток классифицируется как N0 или М0:
pN0 - гистологически верифицированные лимфогенные метастазы отсутствуют, гистологических тестов на наличие изолированных опухолевых клеток не проводилось;
pN0 (i-) - гистологически верифицированные лимфогенные метастазы отсутствуют, гистологические тесты на наличие изолированных опухолевых клеток отрицательные;
pN0 - гистологически верифицированные лимфогенные метастазы отсутствуют, гистологические тесты на наличие изолированных опухолевых клеток положительные;
pN0 (mol-) - гистологически верифицированные лимфогенные метастазы отсутствуют, иммуногистохимические и молекулярные тесты на наличие изолированных опухолевых клеток отрицательные;
pN0 (mol+) - гистологически верифицированные лимфогенные метастазы отсутствуют, иммуногистохимические и молекулярные тесты на наличие изолированных опухолевых клеток положительные.
При исследовании сторожевых лимфатических узлов на наличие изолированных опухолевых клеток используется следующая классификация:
pN0 (i-)(sn) - гистологически верифицированные метастазы в сторожевом лимфатическом узле отсутствуют, гистологические тесты на наличие изолированных опухолевых клеток отрицательные;
pN0 (i+)(sn) - гистологически верифицированные метастазы в сторожевом лимфатическом узле отсутствуют, гистологические тесты на наличие изолированных опухолевых клеток положительные;
pN0 (mol-)(sn) - гистологически верифицированные метастазы в сторожевом лимфатическом узле отсутствуют, иммуногистохимические и молекулярные тесты на наличие изолированных опухолевых клеток отрицательные;
pN0 (mol+)(sn) - гистологически верифицированные метастазы в сторожевом лимфатическом узле отсутствуют, иммуногистохимические и молекулярные тесты на наличие изолированных опухолевых клеток положительные.
КЛИНИЧЕСКАЯ КАРТИНА
К ранним признакам рака пищевода следует отнести прогрессирующее ухудшение общего состояния больных, снижение аппетита, нарастание общей слабости, снижение работоспособности, потерю массы тела. Нарастая исподволь, постепенно, эти явления длительное время остаются не замеченными самими больными.
Первым, но, к сожалению, отнюдь не ранним симптомом рака пищевода является дисфагия - нарушение глотания пищи. Этот симптом
наблюдается более чем у75 % больных раком пищевода. Примерно у 2 % пациентов задержка прохождения пищи по пищеводу происходит незаметно; вернее, они не фиксируют на этом внимания, хотя и отказываются от приема грубой и сухой пищи. Больные лучше проглатывают пищу, прием которой вызывает обильное слюноотделение (жареное мясо, колбаса, селедка), и хуже - черный хлеб, вареный картофель, вареное мясо. Вначале, тщательно пережевывая пищу и запивая ее водой, удается снять тягостные явления дисфагии, что позволяет больным питаться без ограничений. В этих случаях дисфагия носит периодический характер и наблюдается лишь в случае поспешного приема пищи, проглатывания больших, плохо разжеванных кусков. По мере прогрессирования заболевания дисфагия становится постоянной.
У некоторых больных первым симптомом заболевания является обильное слюнотечение. Обычно оно появляется при резких степенях сужения пищевода. По классификации дисфагии по А.И. Савицкому принято различать 4 степени ее выраженности:
• I степень - затруднение при прохождении твердой пищи по пищеводу (хлеб, мясо);
• II степень - затруднения, возникающие при приеме кашицеобразной и полужидкой пищи (каши, пюре);
• III степень - затруднения при глотании жидкостей;
• IV степень - полная непроходимость пищевода.
Примерно в 17-20 % случаев заболевание проявляется болью за грудиной или в надчревной области, в спине. Больные чаще отмечают тупую, тянущую боль за грудиной, реже - ощущение сдавления или сжатия в области сердца, распространяющиеся вверх на шею. Боль может возникать в момент глотания и исчезать через некоторое время после того, как пищевод освободится от пищи. Реже боль бывает постоянно и усиливается при прохождении пищи по пищеводу. Боль при раке пищевода может ощущаться при раздражении нервных окончаний в изъязвившейся и распадающейся опухоли проходящими пищевыми массами. В таких случаях больные чувствуют, как пищевой комок, проходя через определенное место пищевода, «царапает», «обжигает» его. Боль может возникать при усиленных спастических сокращениях пищевода, направленных на проталкивание пищевого комка через суженный участок пищевода, а также при прорастании опухоли в окружающие пищевод ткани и органы со сдавлением сосудов и нервов средостения. В таком случае она не связана с актом глотания и носит постоянный характер.
Важно отметить, что больные раком пищевода зачастую неточно характеризуют уровень задержки пищи и уровень возникновения боли. Примерно 5 % больных до развития стойкой дисфагии отмечают лишь неопределенного характера неприятные ощущения за грудиной не только при глотании пищи, но и вне его. Все это затрудняет клиническую трактовку первых признаков рака пищевода.
При рассмотрении клинических проявлений распространенного рака пищевода следует особое внимание обратить на общее состояние больного. Как правило, у больных раком пищевода отмечается дефицит массы тела, что прежде всего связано с ограниченным поступлением в организм пищи, а не с токсическим влиянием распространенного опухолевого процесса. Особенно значительная потеря массы тела наблюдается при крайних степенях дисфагии, когда больной не может принимать даже жидкость, вследствие чего его общее состояние резко ухудшается от обезвоживания организма. Поэтому при раке пищевода следует различать общее тяжелое состояние больного, возникшее вследствие интоксикации при далеко зашедшем опухолевом процессе (раковая интоксикация и кахексия), алиментарную дистрофию и обезвоживание организма.
Запах изо рта, неприятный вкус во рту, обложенный язык, тошнота, срыгивание - все эти признаки, обычно мало выраженные в ранних стадиях рака пищевода, более четко проявляются при распространенных формах заболевания и могут быть объяснены не только сужением пищевода, но и нарушением обмена веществ, качественной неполноценностью окислительных процессов, усиленным распадом белков; все это приводит к накоплению в организме недоокисленных продуктов и избытку молочной кислоты.
При распространенном раке пищевода может появиться осиплость голоса, как следствие сдавления метастазами или прорастания опухолью возвратного нерва. При распространенном раке шейной части пищевода, а также при опухоли грудной его части нередко возникают поперхивание и кашель при глотании жидкой пищи из-за нарушения функции замыкающего аппарата гортани или образования пищеводно-трахеального или пищеводно-бронхиального свища. У таких больных развиваются признаки аспирационной пневмонии.
Дифференциальная диагностика рака пищевода должна проводиться со следующими группами заболеваний пищевода.
1. Аномалии пищевода (врожденное сужение пищевода).
2. Дивертикулы (дивертикулиты) пищевода.
3. Функциональные расстройства пищевода (гиперкинезия и гипокинезия).
4. Ахалазия кардии.
5. Грыжи пищеводного отверстия диафрагмы.
6. Эзофагиты и язвы пищевода.
7. Аллергические и специфические поражения пищевода.
8. Травмы (ожоги) пищевода и их последствия.
9. Болезни оперированного пищевода.
ДИАГНОСТИКА
Жалобы больного на наличие дисфагии, анамнез, подтверждающий систематичность и прогрессирование симптомов, служат достаточным основанием для того, чтобы заподозрить рак пищевода. Осмотр больного редко может дать какие-либо убедительные данные в пользу диагноза рака пищевода. Больные с выраженной дисфагией и нарушением питания, как правило, истощены.
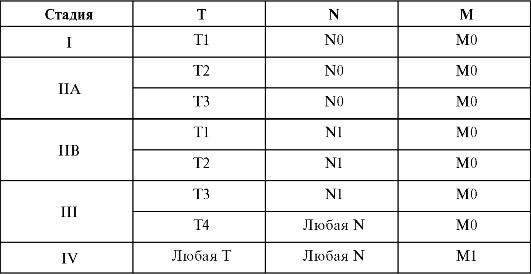
Основной метод диагностики рака пищевода - рентгенологический (рис. 18.1). Он позволяет определить форму роста опухоли, локализацию, протяженность, наличие ряда осложнений. Важными ориен-
тирами являются скелетотопические характеристики различных отделов пищевода. Наиболее постоянными рентгенологическими симптомами рака пищевода являются: отсутствие перистальтики стенки пищевода на участке расположения опухоли, нарушение рельефа слизистой оболочки стенки пищевода, дефект наполнения, сужение просвета или инфильтрации стенки органа.
При распространенном процессе рентгенологически отмечается сужение просвета пищевода до образования узкой ригидной трубки с неровными, бугристыми краями вплоть до полного стеноза пищевода с развитием
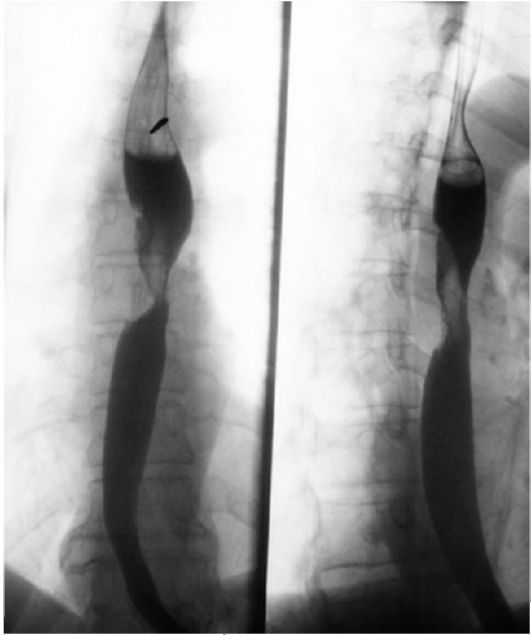 Рис. 18.1. Рак пищевода. Рентгенограмма
Рис. 18.1. Рак пищевода. Рентгенограмма
супрастенотического расширения органа. При прорастании опухоли в средостение и ее распаде удается проследить нишу, нередко выходящую за пределы стенки пищевода. При образовании пищеводнотрахеального или пищеводно-бронхиального свища контрастный препарат при глотании попадает в дыхательные пути и контрастирует их.
Для уточнения границ внепищеводного распространения опухоли прибегают к рентгенографии и томографии в условиях пневмомедиастинума, что позволяет рентгенологически определить наружные контуры пищевода, более отчетливо контрастировать тень опухоли. Известную ценность представляют некоторые ангиографические исследования - азигография.
Применение КТ во многом избавляет от инвазивных методов исследования при решении вопроса о проникновении опухоли за пределы пищевода (Т4) (рис. 18.2). КТ используется и при диагностике метастатического поражения печени, лимфатических узлов брюшной полости. Эзофагосонография (ЭСГ) - в настоящее время практически единственный метод, позволяющий корректно оценить глубину инвазии первичной опухоли (Т-стадирование).
Эзофагоскопия является обязательным методом исследования при подозрении на рак пищевода (рис. 18.3). Метод призван уточнить локализацию опухоли, протяженность поражения, выявить наличие множественности поражения слизистой оболочки и определить
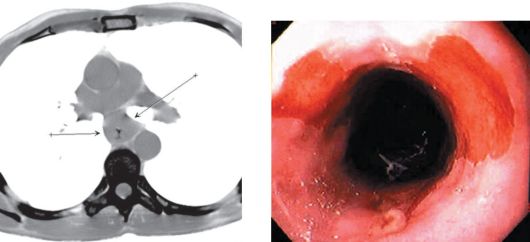 Рис. 18.2. Рак пищевода (стрелки). Рис. 18.3. Пищевод Барретта. ЭндоКомпьютерная томограмма скопическое исследование
Рис. 18.2. Рак пищевода (стрелки). Рис. 18.3. Пищевод Барретта. ЭндоКомпьютерная томограмма скопическое исследование
фоновое состояние последней. Существуют признанные ориентиры в определении уровня поражения пищевода: верхняя треть пищевода расположена в 18-24 см от края верхних резцов, средняя треть - в 24-32 см и нижняя - в 32-40 см. Однако эзофагоскопии должно предшествовать рентгенологическое исследование. Во время эндоскопического исследования практически во всех случаях удается выполнить биопсию опухоли или взять материал для цитологического исследования. Положительные результаты морфологического исследования (обнаружение в материале раковых клеток) делают диагноз несомненным. Сравнительная простота взятия материала для морфологического исследования во время эзофагоскопии позволяет добиться морфологического подтверждения диагноза в 85-92 % случаев.
Трахеобронхоскопия выполняется с целью выявления первичной множественности опухолевого процесса (поражение бронхиального дерева синхронными опухолями) либо прорастания опухоли пищевода в бронх; при прорастании бронха опухолью обязательна биопсия для морфологической верификации процесса.
Лапароскопически возможно осуществить морфологическое подтверждение метастатического поражения печени, лимфатических узлов, выявить канцероматоз брюшины, наличие асцита.
УЗИ выполняют с целью обнаружения метастатических поражений печени, увеличенных лимфатических узлов в регионарных зонах ниже диафрагмы и доступных зонах средостения, забрюшинной клетчатке, оценки внутристеночного распространения опухоли (в случаях, когда удается провести за зону сужения пищевода транспищеводный УЗ-датчик).
УЗИ шеи, надключичных зон способствует выявлению метастатических лимфатических узлов. Чувствительность и точность УЗИ шейно-надключичных зон при оценке лимфогенных метастазов, по данным литературы, составляют соответственно 80 и 90 %. Однако обнаружить микрометастазы в лимфатических узлах нормального размера и формы это исследование не позволяет. При наличии непальпируемых, но подозрительных в отношении метастазов шейно-надключичных лимфатических узлов проводится их УЗ-контролируемая диагностическая пункция.
Метастатическое поражение медиастинальных лимфатических узлов труднодоступно для морфологической верификации. Считают, что размер лимфатического узла более 1 см указывает на его метастатическое поражение. Однако нередко метастатическое поражение
лимфатического узла не коррелирует с его размерами: увеличенные узлы могут быть не поражены, а узлы нормального размера - оказаться метастатическими. В специализированных лечебных учреждениях применяют комплекс обследований, позволяющий оценить не только размеры, но и структуру медиастинальных и забрюшинных лимфатических узлов: КТ, ЭСГ и по возможности ПЭТ. Морфологическая верификация метастатического поражения забрюшинных, медиастинальных лимфатических узлов при необходимости может быть получена с помощью торакоскопии, лапароскопии или тонкоигольной пункции под контролем ЭСГ. Необходимость в этих процедурах может возникнуть при планировании неоадъювантного лечения, для оценки проведенного лечения и т.п.
В план обследования больного раком пищевода необходимо включить КТ брюшной полости и грудной клетки. Известно, что при первичном выявлении рака пищевода более чем у 50 % больных имеются отдаленные метастазы. Чаще выявляют метастазы в печени (35 %), легких (20 %), костях (9 %), надпочечниках (2 %), головном мозгу (2 %), реже - в плевре, поджелудочной железе, селезенке. КТ позволяет обнаружить большую часть отдаленных метастазов при раке пищевода, а УЗИ и МРТ - отдифференцировать метастазы в печени от кист и гемангиом. Объемные образования надпочечников хорошо выявляются при КТ, однако, как правило, требуются чрескожная пункция и морфологическая верификация. Солитарный метастаз рака пищевода в легких очень редок: в большинстве случаев метастазы бывают множественными, поэтому при выявлении солитарного узла в легком следует исключить синхронный РЛ или доброкачественный характер новообразования.
Таким образом, комплексное использование рентгенологического исследования, эзофагоскопии, КТ, ЭСГ, данных морфологического исследования материала позволяет в большинстве случаев правильно распознать заболевание. Иногда возникает необходимость дифференцировать рак пищевода с такими заболеваниями, как кардиоспазм, рубцовые стриктуры пищевода, дивертикулы, доброкачественные опухоли и язвы пищевода. Перечисленные заболевания отличаются длительным течением, имеют характерную рентгенологическую картину. Решающее значение в исключении злокачественного процесса (самостоятельного или развивающегося на фоне указанных изменений) имеют отрицательные результаты морфологического исследования биопсийного материала из пищевода.
Важное место в диагностическом процессе занимают клинические и функциональные исследования. Клинические и биохимические анализы крови, оценка коагуляционной системы, степени электролитных, белковых расстройств помогают осуществить предоперационную коррекцию имеющихся нарушений. Проведение ЭКГ, при наличии показаний - ЭхоКГ в сочетании со спирографией выявляет степень нарушения функций дыхательной и сердечно-сосудистой систем, что является решающим в выборе способа лечения больного.
ЛЕЧЕНИЕ
Лечение рака пищевода - одна из сложнейших проблем торакальной онкологии. Ведущим методом лечения рака этой локализации считается хирургический (рис. 18.4). Он складывается из двух компонентов: резекционного и реконструктивного. Резекционный этап является лечебным - от него зависит прогноз жизни больного. Важен
выбор оптимального оперативного доступа; правильный доступ позволяет в адекватных условиях выполнять резекционный и пластический этапы вмешательства.
На согласительной конференции ISDE (1995) было установлено, что трансхиатальную резекцию выполняют в основном хирурги общего профиля, а трансторакальную - онкохирурги. Трансторакальный доступ возможен в двух вариантах: справа (в сочетании со срединной лапаротомией) или слева (в виде тораколапаротомии в шестом межреберье по Осаве- Гарлоку).
Оптимальным и соответствующим требованиям абластики при раке грудного отдела пищевода следует признать комбинированный лапаротомный и правосторонний торакотомный доступы по Льюису, которые при необходимости можно дополнить шейным разрезом. Доступ позволяет: 1) осуществить широкий обзор операционного поля;
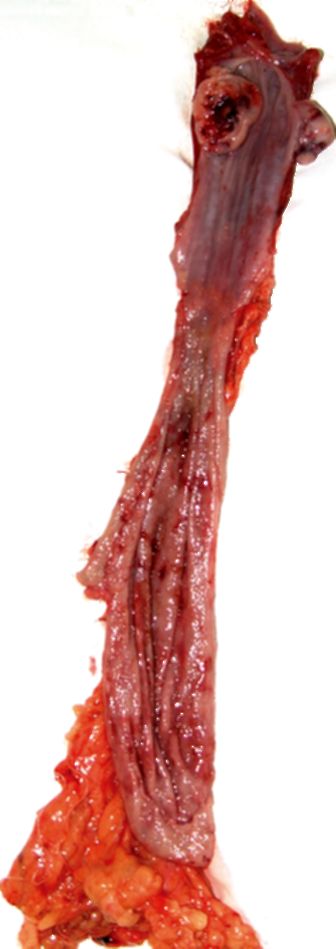 Рис. 18.4. Макропрепарат экстерпированного пищевода
Рис. 18.4. Макропрепарат экстерпированного пищевода
2) мобилизовать грудной отдел пищевода на всем протяжении, при этом выполнить лимфодиссекцию в любом объеме и в случае необходимости произвести резекцию смежных органов, сохранить легочные ветви блуждающего нерва (что важно для профилактики послеоперационных дыхательных нарушений);
3) надежно сформировать пищеводный анастомоз в верхней апертуре грудной клетки, где имеются хорошие условия для нормального функционирования соустья, а также соблюсти при раке средне- и нижнегрудного отделов положенную границу проксимальной резекции - минимум 8 см выше уровня опухоли.
Реконструктивная часть операции призвана скорректировать анатомо-физиологические нарушения, вызванные резекцией.
Опыт хирургического лечения больных раком пищевода показывает, что причины частых локальных рецидивов в зоне операции - высокий потенциал раннего лимфогенного метастазирования и неадекватность объема лимфодиссекции. Следствием этого является оставление пораженных регионарных лимфатических коллекторов как в средостении, так и в шейно-надключичной зоне.
Высокая частота местно-распространенных опухолей пищевода нередко вынуждает хирургов выполнять комбинированные операции с резекцией смежных органов и тканей: легкого, воздухоносных путей, перикарда, аорты, непарной вены, печени, диафрагмы и др. В этих случаях комбинированная операция не повышает радикализма вмешательства, но переводит опухолевый процесс из нерезектабельного в резектабельный. Комбинированные резекции пищевода выполняют также по принципиальным соображениям.
Основные способы замещения пищевода после его экстирпации или субтотальной резекции следующие:
1) пластика широким стеблем желудка;
2) анти- и изоперистальтическая пластика стеблем из большой кривизны желудка;
3) тонкокишечная пластика по Ру-Герцену;
4) анти- и изоперистальтическая пластика толстой кишкой. Методика эзофагопластики должна соответствовать двум основным требованиям - безопасности и функциональности.
Пластика пищевода широким желудочным стеблем отвечает этим требованиям по нескольким пунктам:
• при правильной мобилизации фундальная часть желудка служит прекрасным пластическим материалом, позволяющим
формировать надежное двухрядное пищеводно-желудочное соустье в куполе правого гемиторакса;
• располагаясь в ложе удаленного пищевода, желудочный трансплантат принимает форму трубки, по которой проходит пищевой комок, а также служит ограниченным по объему резервуаром благодаря сохранению функции пилорического жома;
• формирование одного анастомоза без использования дополнительных технических средств определяет преимущество в сокращении времени операции.
Пластика тонкой кишкой возможна в трех вариантах:
1) непересеченной петлей;
2) Roux-en-Y-петлей;
3) интерпозицией мобилизованной петли на сосудистой ножке. Тонкокишечный трансплантат в настоящее время применяется
в основном для замещения дистальной трети пищевода по поводу кардиоэзофагеального рака. Сторонники тонкокишечной эзофагопластики отмечают следующие ее преимущества: простоту выполнения, возможность применения без специальной предоперационной подготовки, низкую частоту послеоперационной летальности и осложнений; кроме того, Roux-en-Y-петля обладает прекрасными антирефлюксными свойствами.
Преимущества толстокишечной пластики перед желудочной - это сохранение желудочной фазы пищеварения и антирефлюксные свойства.
Толстокишечную пластику применяют при раке пищевода в основном при невозможности выполнить пластику желудком вследствие распространения опухоли на проксимальный его отдел.
Одним из принципиальных моментов пластики пищевода является выбор пути проведения трансплантата для соединения с оральным концом пищевода или с глоткой. Как известно, на первых этапах развития эзофагопластики практически единственным было подкожное размещение трансплантата. В последующем был предложен внутриплевральный путь проведения анастомозируемого органа, а затем - загрудинный. Описанные варианты проведения трансплантата можно представить следующим образом:
• подкожная (антеторакальная, предгрудинная) пластика;
• загрудинная пластика;
• внутриплевральная пластика - проведение трансплантата в заднее средостение или плевральную полость с внутриплевральным
• пищеводным анастомозом (некоторые авторы называют данный вариант чресплевральным); трансмедиастинальное проведение трансплантата с пищеводным
анастомозом на шее. Радикализм оперативного вмешательства требует резекции пищевода не менее чем на 5-8 см выше проксимальной границы опухоли.
Внутриплевральная пластика пищевода желудком (или толстой кишкой) с внутриплевральным анастомозом обеспечивает лучшие функциональные результаты и лучшее качество жизни пациента в ранние и отдаленные сроки после операции. Субтотальная же резекция пищевода с анастомозом в куполе плевральной плоскости является онкологически радикальной операцией при раке пищевода, локализующемся в аортальном сегменте или ниже.
Основные требования, предъявляемые к пищеводному анастомозу:
1) максимальная безопасность (высокая физическая и биологическая надежность при условии технически правильного выполнения);
2) функциональность (противорефлюксные и антистриктурные свойства);
3) возможность универсального применения независимо от уровня пересечения пищевода при наличии супрастенотического расширения его стенки с гипертрофией слоев;
4) техническая простота и быстрота исполнения.
В настоящее время лучшие результаты получены при использовании погружного пищеводно-желудочного анастомоза.
Это соустье формируется по типу конец пищевода в переднюю стенку желудка с применением минимального количества узловых швов (14-15), что способствует надежному заживлению анастомоза и служит профилактикой развития рубцовых стриктур. Для этого перед резекцией мышечную оболочку пищевода пересекают ножницами до подслизистого слоя. Проксимальнее линии пересеченной мышечной оболочки на 1,5 см пищевод фиксируют зажимом Федорова, защелкнув на 1 кремальеру. Слизистую оболочку пересекают, отступя от края мышечной оболочки. На переднюю стенку желудочного стебля на расстоянии 2-3 см от апикального края на боковые и заднюю стенки пищевода накладывают 3 отдельных серозно-мышечных узловых шва. При этом вкол и выкол иглы через мышечный слой задней стенки пищевода выполняют в косом направлении по отношению к оси пищевода на 0,5 см выше. После прошивания желудка и пищевода тремя отдельными нитями последние
умеренно натягивают и подводят переднюю стенку желудка к задней стенке пищевода. Затем поочередно завязывают каждую нить, концы их отсекают. С помощью электрокоагулятора на передней стенке желудка вдоль края пищевода в поперечном направлении проводят коагуляционную борозду глубиной до подслизистой оболочки. Затем ножницами в зоне коагуляционной борозды рассекают слизистую оболочку желудка на ширину диаметра пищевода. Приступают к формированию задней внутренней губы пищеводно-желудочного соустья. Для этого, не снимая зажима Федорова, отдельными нитями через все слои на расстоянии 0,5 см от краев прокалывают стенку желудка и заднюю стенку пищевода. Всего между желудком и пищеводом накладывают 5 швов. Затем нити умеренно натягивают и снимают зажим с пищевода. Нити поочередно завязывают, концы их отсекают. Задняя губа анастомоза сформирована. Первый ряд швов передней губы анастомоза формируют с помощью 3-4 отдельных серозно-мышечных швов. При формировании передней губы прошивают серозный, мышечный и подслизистый слои желудочной стенки. Слизистую оболочку пищевода не прокалывают, концом иглы подхватывают только ее край и погружают под мышечный слой с прошиванием последнего на расстоянии около 1 см от линии резекции. Тем самым достигаются лучшие условия адаптации анастомозируемых органов при отсутствии интерпозиции слизистой оболочки пищевода и желудка. Через сформированное соустье в желудок проводят толстый желудочный зонд, на котором затем тремя швами формируют 2-й ряд швов (серозномышечных) передней губы анастомоза, как бы наворачивая переднюю стенку желудка на переднюю стенку пищевода и тем самым формируя искусственный клапан, препятствующий возникновению рефлюкс-эзофагита в отдаленном послеоперационном периоде.
В хирургии пищевода сохраняется высокий процент паллиативных и симптоматических операций. К симптоматическим хирургическим пособиям следует относить вмешательства, направленные исключительно на разрешение дисфагии, а не на удаление опухоли. При нерезектабельном раке почти всегда отмечается выраженная дисфагия. Консервативная противоопухолевая терапия в этой ситуации малоэффективна, и больные практически обречены. Основной задачей является восстановление энтерального питания, что дает шанс провести некоторым больным химиолучевое лечение.
Реканализация просвета пищевода посредством электроили лазерокоагуляции опухоли, транстуморальная эндоскопическая интубация пищевода, установка различных стентов под контролем рентгенотелевидения, гастролибо еюностомия - вот перечень
наиболее часто применяемых в клинической практике процедур. Ни один из названных методов не может претендовать на универсальность, и для каждого есть свои показания. Установка саморасправляющихся стентов - достаточно эффективный метод купирования дисфагии. Гастростомия и еюностомия, в свою очередь, обладают существенными косметическими недостатками и не дают перспективы социальной адаптации. Несмотря на значительный прогресс хирургии в целом, показания к гастростомии все еще существуют.
Вместе с тем сравнительный статистический анализ результатов операций показал, что шунтирующие операции по сравнению с пробными вмешательствами приводят к большему увеличению продолжительности жизни больных (в 2-2,5 раза).
В торакальных клиниках с большим опытом пищеводной хирургии выполняют операции пищеводного шунтирования как альтернативу гастростомии. Данное вмешательство купирует основной симптом рака пищевода и делает возможным энтеральное питание до последних дней жизни больного. Простейший метод восстановления пассажа пищи по стенозированному пищеводу - бужирование. Другую группу составляют методы, в основе которых лежит принцип разрушения внутрипросветного компонента стенозирующей опухоли (механическим, электрохирургическим, лазерным и плазменным способами, ФДТ).
В настоящее время для лечения больных раком пищевода широко используется химиотерапия. Наиболее эффективными препаратами для лечения рака этой локализации признаны цисплатин, 5-фто- рурацил, блеомицин, митомицин-С, этопозид и винкаалкалоиды. За последние годы только таксаны (паклитаксел и доцетаксел) продемонстрировали клинически значимую активность при лечении этого заболевания. Вместе с тем следует отметить, что продолжительность объективного действия при назначении монохимиотерапии составляет в среднем 2-4 мес, сопровождается лишь незначительным паллиативным эффектом и не продлевает жизнь больных.
В связи с этим чаще используется комбинация противоопухолевых препаратов. Первоначально в состав комбинаций входил цисплатин в сочетании с блеомицином, метотрексатом или винкаалкалоидами. D. Kelsen и D. Ilson предложили использовать комбинацию цисплатина, блеомицина и виндезина; при этом частота объективных эффектов при лечении рецидивов и метастазов продолжительностью до 6 мес составила 30-35 %, а медиана выживаемости - 6-8 мес.
В конце 1980-х гг. при лечении больных раком пищевода популярной стала комбинация цисплатина и 5-фторурацила. Цисплатин назначали однократно в дозе 100 или 20 мг/м2 в течение 5 дней, 5-фто- рурацил в суточной дозе 1000 мг/м2 вводили в виде внутривенной инфузии в течение 5 сут (120 ч). Частота объективных эффектов при использовании этой комбинации составила 23-65 % при медиане продолжительности жизни 6-11 мес.
Таксаны, продемонстрировавшие эффективность у больных раком пищевода, были включены в комбинации с цисплатином или цисплатином и 5-фторурацилом. Частота объективного эффекта составила 40 % при медиане продолжительности жизни 7-11 мес, что не позволяет говорить о безоговорочном преимуществе новых комбинаций перед стандартной комбинацией цисплатина и 5-фторурацила.
Результаты терапии при операбельном раке остаются неудовлетворительными. Даже в лучших клиниках показатель резектабельности редко превышает 50 %, а 5-летняя выживаемость после резекции пищевода не превышает 20 %. Уже на ранних стадиях отмечается диссеминация опухолевых клеток с поражением лимфатических коллекторов и развитием отдаленных метастазов, что делает оправданным проведение адъювантной химиотерапии. Значительное по протяженности поражение пищевода, быстрое прорастание опухолью всех его слоев с вовлечением окружающих тканей и органов затрудняет проведение оперативного вмешательства и требует индукционной химиотерапии - изолированно или в сочетании с лучевой. Сегодня комбинированные методы лечения становятся основными у больных раком пищевода.
Адъювантной химиотерапией называется системная лекарственная терапия у больных, перенесших радикальную (R0) резекцию, с целью уничтожения микрометастазов и увеличения безрецидивной выживаемости.
Целью предоперационной химиотерапии у операбельного больного являются уменьшение размера опухоли и создание более выгодных условий для хирургического вмешательства, а также воздействие на первичный очаг и микрометастазы для улучшения прогноза. Частота объективного эффекта при использовании различных комбинаций на основе цисплатина составляет около 40 %, при этом частота полной резорбции опухоли, подтвержденная морфологически, редко превышает 10 %. Больные с объективным эффектом при проведении предоперационной химиотерапии живут дольше, чем больные после изолированного хирургического лечения. С другой стороны, у пациентов,
не ответивших на предоперационную химиотерапию, прогноз гораздо хуже, чем у оперированных больных.
Цель химиолучевой терапии - увеличение частоты противоопухолевого эффекта путем воздействия на первичную опухоль и локорегионарные метастазы лучевой терапией, а также уничтожение отдаленных метастазов с помощью системной химиотерапии. Наличие полной морфологически подтвержденной резорбции опухоли после химиолучевого лечения сопровождается увеличением безрецидивной выживаемости, однако рано или поздно у преобладающего большинства больных отмечается прогрессирование заболевания за счет рецидива в зоне удаленной опухоли или отдаленных метастазов. Совместное назначение химио- и лучевой терапии существенно увеличивает частоту послеоперационных осложнений и летальность по сравнению с показателями при предоперационной химиотерапии. Вследствие низкой эффективности химиолучевой терапии и прогрессирования заболевания на ее фоне значительная часть больных становятся неоперабельными. Токсичность при проведении химиолучевого лечения обусловливает ухудшение общего состояния и как следствие делает невозможным последующее хирургическое вмешательство. Проведение химиолучевой предоперационной терапии уменьшает частоту рецидивов в зоне операции, но не влияет существенно на частоту отдаленного метастазирования.
Химиотерапия у больных местно-распространенным раком пищевода имеет свои особенности. Проведение системной терапии у заведомо неоперабельных или условно операбельных больных (а местнораспространенный рак пищевода следует отнести именно к этим группам) преследует цель индуцировать регрессию опухоли для последующего успешного локального лечения (хирургического или лучевого). При этом возможность локального лечения будет определяться эффектом химиотерапии, которая в данном случае носит название индукционной. Химиолучевая терапия наиболее часто используется при лечении больных местно-распространенным раком пищевода.
Химиолучевая терапия приводит к уменьшению размеров опухоли и понижению стадии заболевания по данным ЭСГ у 60 % больных. В результате резекция опухоли становится возможной у 11 % больных, радикальная резекция (R0) - примерно у 2/3 оперированных, при этом полная морфологически подтвержденная резорбция опухоли определяется в среднем у 25 % пациентов. Химиолучевое лечение осложняет проведение оперативного вмешательства и является
причиной высокой послеоперационной летальности. Гистологическое строение опухоли не влияет на результаты химиолучевой терапии. Она существенно уменьшает частоту рецидивов после оперативного вмешательства. Большинство таких больных погибают от развития отдаленных метастазов.
У больных местно-распространенным раком пищевода в удовлетворительном состоянии химиолучевая терапия позволяет в дальнейшем успешно выполнить радикальную операцию. В этом случае примерно 30 % больных имеют шанс прожить 3 года и более. Следует отметить, что от индукционной химиолучевой терапии выигрывают лишь те больные, которые ответили на лечение и которым была выполнена радикальная резекция пищевода.
Современные технические средства и методики облучения при самостоятельной лучевой терапии рака пищевода позволяют достичь удовлетворительных непосредственных результатов, хотя отдаленные результаты все еще неутешительны: медиана выживаемости составляет 9 мес, 2-летняя выживаемость - около 10 %, 5-летняя - около 5 %.
Обусловлены такие результаты тем, что лучевая терапия при этой высокозлокачественной опухоли применяется в основном при местно-распространенных и неоперабельных формах. Основными причинами смерти больных раком пищевода, перенесших в прошлом лучевое лечение, являются продолженный рост опухоли, локальные рецидивы и метастазы в регионарных лимфатических узлах.
При ранних (T1-T2) стадиях рака пищевода результаты лучевой терапии в отдельных случаях сопоставимы с таковыми при хирургическом лечении. Изучение результатов ДЛТ (СОД 65,5 Гр) при ранних стадиях рака пищевода, проводившееся в девяти радиотерапевтических клиниках Японии, показало, что 5-летний срок пережили 45 % больных.
Поиск возможностей повышения противоопухолевой эффективности ионизирующего излучения при раке пищевода, являющимся относительно радиорезистентным и высокозлокачественным новообразованием, идет в нескольких направлениях: изучение режимов нетрадиционного фракционирования дозы радиации, комбинация лучевого и лекарственного методов лечения, применение радиомодифицирующих агентов, увеличение физической дозы радиации за счет внутриполостной лучевой терапии, усовершенствование технологии лучевой терапии - использование 3D-планирования.
Применение нетрадиционных режимов фракционирования дозы излучения и радиомодифицирующих агентов - один из важных
факторов повышения радиочувствительности опухоли и радиопротекции нормальных тканей, тесно связанных с кинетикой клеточных популяций во время облучения и кислородным эффектом. В основу построения схем нетрадиционного фракционирования дозы излучения положена информация о различиях в скорости и полноте восстановления лучевых повреждений опухоли и нормальных тканей и степени их реоксигенации (Ярмоненко С.П., 1976; Холин В.В., 1979).
Режимы динамического, немонотонного фракционирования, а также расщепленные курсы облучения предполагают реоксигенацию опухолевых клеток. Вследствие реоксигенации, происходящей из-за уменьшения массы опухоли, количество гипоксических клеточных популяций уменьшается.
Расщепленный курс облучения с интервалом 2 нед после подведения очаговой дозы 30-35 Гр имеет достаточно много сторонников. За время перерыва нормальные ткани благодаря выраженной репарационной способности восстанавливаются после лучевых повреждений, а в опухоли частичная резорбция паренхимы приводит к реоксигенации гипо- и аноксических зон, что увеличивает ее радиочувствительность.
Клинические данные об эффективности расщепленного курса лучевой терапии показывают уменьшение частоты ранних и поздних лучевых повреждений. Однако при этом не происходит увеличения средней продолжительности жизни больных, а в ряде исследований отмечено ее уменьшение, по-видимому, за счет репопуляции клоногенных опухолевых клеток, особенно в исследованиях, в которых перерыв превышал 10-14 дней. Следовательно, сплит-курс следует считать вынужденным мероприятием при появлении выраженных ранних лучевых повреждений для подведения к опухоли запланированной дозы облучения. Исходя из того, что новообразования пищевода отличаются высокой пролиферативной активностью, перерыв в курсе радиотерапии не должен превышать 2 нед, а суммарную дозу радиации следует перерассчитать и компенсировать с учетом длительности перерыва в лучевом лечении.
К настоящему времени установлено, что большинство новообразований пищевода обладают высокой пролиферативной активностью. Время удвоения этих опухолей составляет от 15 до 49 дней. Поэтому при раке пищевода в связи с ускоренной регенерацией и репопуляцией клоногенных клеток наиболее целесообразно использовать методики непрерывного гиперфракционированного ускоренного
лучевого воздействия CHART (Continuous Hyperfractionated Accelerated Radiotherapy). Ежедневная доза при этом превышает таковую при конвенциальном лучевом лечении. Увеличивается биологическая доза на опухоль при снижении длительности курса радиотерапии без значительного усиления выраженности и частоты ранних и поздних лучевых повреждений нормальных тканей.
Увеличение физической дозы излучения, подводимой к опухолевому очагу, и уменьшение дозы на верхние дыхательные пути, легочную ткань, сердце, спинной мозг повышают частоту достижения полного местного эффекта и снижают риск осложнений лучевого и химиолучевого лечения.
Эффективность лучевой терапии значительно выше у больных с благоприятными прогностическими факторами - такими, как ранняя стадия заболевания, локализация опухоли в среднегрудном отделе пищевода, экзофитная форма роста и высокая степень регрессии опухоли к окончанию курса облучения, возраст до 60 лет, женский пол.
Вероятность полной регрессии опухоли напрямую зависит от дозы, которую удается подвести к ней. Возможности подведения высокой очаговой дозы при лечении рака пищевода ограничены пределами толерантности нормальных органов и тканей, находящихся в непосредственной близости от пищевода (спинного мозга, верхних дыхательных путей, легких, органов средостения). Одним из путей увеличения физической дозы радиации для усиления разрушающего воздействия ионизирующего излучения на опухоль с одновременным уменьшением объема облучения окружающих опухоль нормальных тканей является использование контактной или внутриполостной лучевой терапии как одной из составных частей сочетанного лучевого воздействия.
После разработки и внедрения в клиническую практику аппаратов нового поколения, таких, как «АГАТ-ВУ», Selectron, MicroSelectron, Gammamed и др., внутриполостная и сочетанная лучевая терапия рака пищевода получила новый импульс. Уменьшение до нескольких миллиметров диаметра источников излучения, компьютеризация процесса планирования и проведения облучения, усовершенствование эндостатов сделали возможным внутриполостное и сочетанное лучевое лечение при использовании высоких мощностей поглощенных доз. Применение источников небольшого диаметра, разной степени активности (137Cs, 192Ir), планирующих систем значительно упростило и индивидуализировало процесс лечения.
Самостоятельно внутриполостная лучевая терапия (ВПЛТ) используется в основном с паллиативной целью у больных с распространенным опухолевым процессом для ликвидации или уменьшения симптомов дисфагии, в отдельных случаях с куративной целью - у пациентов с небольшими по протяженности новообразованиями, не выходящими за пределы слизистой оболочки пищевода.
Применение только ВПЛТ у пациентов с ранним и особенно местно-распространенным раком пищевода с глубокой опухолевой инвазией и наличием регионарных метастазов не может считаться адекватным методом лечения.
Наиболее часто в настоящее время при неоадъювантном, адъювантном или самостоятельном консервативном лечении рака пищевода, особенно при местно-распространенных или низкодифференцированных формах опухоли, используется комбинация лучевой и лекарственной терапии. Лучевая терапия, являясь локальным методом лечения, может прежде всего улучшить результаты локального контроля. Сочетание же лучевой и лекарственной терапии способствует не только улучшению местного эффекта, но и снижению частоты развития отдаленных метастазов вследствие девитализации опухолевых клеток, находящихся вне зоны облучения.
При выборе химиотерапевтических препаратов для сочетания с лучевой терапией ориентируются на биологические параметры опухоли, определяющие ее устойчивость к излучению, и на механизм действия препарата, позволяющего в той или иной степени преодолеть эту резистентность. Например, митомицин-С повышает эффективность химиолучевого лечения за счет цитотоксического эффекта в отношении гипоксических или аноксических клеток, представляющих самую радиорезистентную их фракцию. Как синхронизаторы клеточного цикла используются винкаалкалоиды, таксаны, 5-фторурацил и некоторые другие средства. Многие препараты с разным механизмом действия тормозят процессы восстановления сублетальных лучевых повреждений, оказывая потенцирующий эффект (помимо прямого противоопухолевого действия). Особую роль в ингибировании процессов репарации опухолевых клеток в пострадиационный период в современной химиолучевой терапии отводят препаратам платины. Подобными свойствами (но в меньшей степени) обладают и алкилирующие препараты, антиметаболиты, противоопухолевые антибиотики.
Химиолучевая терапия в настоящее время является стандартом лечения неоперабельных больных раком пищевода. Однако высокая
токсичность и риск опасных для жизни осложнений не позволяют применить данный вид лечения у ослабленных больных раком пищевода с наличием выраженных сопутствующих заболеваний. Наиболее часто используются различные комбинации лучевой терапии с препаратами платины, 5-фторурацилом, митомицином-С.
Лучевая терапия в комбинации с операцией у больных раком пищевода может применяться до, во время операции и после нее. На протяжении последних десятилетий остается дискутабельным вопрос о целесообразности пред- и (или) послеоперационной лучевой либо химиолучевой терапии. Сомнению в основном подвергается целесообразность предоперационной лучевой терапии у пациентов с первоначально резектабельными новообразованиями.
Лучевая терапия показана в послеоперационном периоде больным раком пищевода, если операция носила паллиативный характер (позитивный край, метастазы в регионарные лимфатические узлы и др.).
В последние годы среди первично операбельных больных раком пищевода выделяют группу пациентов с полной регрессией опухоли или микроскопической остаточной опухолью. У этих пациентов мультимодальная терапия (предоперационная химиолучевая терапия и операция) обеспечивает достоверное улучшение результатов по сравнению с таковыми только при оперативном вмешательстве.
После комбинированного лечения 5-летняя выживаемость больных достигает 56,6 % при радикальных оперативных вмешательствах и 7,0 % - при паллиативных. При комплексном лечении после паллиативных операций выживаемость достигает 30,8 % (Мамонтов А.С.,
2003).
Нелеченый рак имеет плохой прогноз. Средняя продолжительность жизни таких больных не превышает 5-8 мес с момента появления признаков болезни. Правда, при ранней диагностике зарегистрированы случаи продолжительности жизни до 6 лет без какоголибо лечения.
Прогноз заболевания при лучевой терапии зависит от формы роста опухоли. Наихудшими являются результаты при эндофитной форме ее роста. 3-летняя выживаемость при этой форме роста составляет 6,0 %, тогда как при экзофитной форме - 27 %.
Применение лучевой терапии по паллиативной программе дает возможность 7-10 % больных прожить более одного года. Повышение эффективности лучевого лечения связывают с совершенствованием методик облучения, увеличением чувствительности
опухоли к облучению за счет использования радиосенсибилизирующих препаратов и сочетанием с химиотерапией и иммуностимулирующими воздействиями.
ПРОГНОЗ
Продолжительность жизни после радикальных операций по поводу рака пищевода является основным и наиболее важным показателем эффективности хирургического и комбинированного лечения. При хирургическом лечении среди перенесших радикальные операции 5-летний срок выживания зависит от различных обстоятельств, но основным является распространенность опухолевого процесса. При размерах опухоли Т1 данный показатель составляет 46,9 %, при Т2 - 42,9 %, при Т3 - 33,7 %, при Т4 - 25 %. Наличие метастазов в лимфатические узлы - неблагоприятный фактор, который значительно сокращает 5-летнюю выживаемость. При III стадии процесса комбинированное лечение (предоперационная лучевая терапия и операция) позволяет увеличить 5-летнюю выживаемость с 10,5 до 25,4 % (Тазиев Р.М., 2001).
Вопросы для самоконтроля
1. Какова эпидемиология рака пищевода?
2. Перечислите способствующие факторы рака пищевода.
3. Каковы основные формы роста рака пищевода?
4. Назовите особенности гистологической структуры рака пищевода.
5. Как происходит метастазирование при раке пищевода?
6. Укажите принципы деления рака пищевода на стадии.
7. Каковы особенности клинической картины при раке пищевода?
8. Сколько различают степеней дисфагии и в чем принцип их разделения?
9. С какими группами заболеваний необходимо проводить дифференциальную диагностику при раке пищевода?
10. Перечислите основные методы диагностики рака пищевода.
11. Каковы принципы подхода в выборе тактики лечения больных раком пищевода?
12. Чем определяются непосредственные и отдаленные результаты лечения больных раком пищевода?