Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев. 2010. - 920 с.
|
|
|
|
ГЛАВА 17 РАК ЛЕГКОГО
ЭПИДЕМИОЛОГИЯ
Рак легкого (РЛ) - широко распространенное заболевание, занимающее в структуре заболеваемости злокачественными новообразованиями в России 1-е место. Показатель заболеваемости РЛ населения России в 1997 г. был 44,69 на 100 тыс. населения, в 2007 г. - 40,2. В 2007 г. абсолютное число впервые заболевших составило 57 175 человек. Мужчины заболевают в 5-8 раз чаще женщин. Наиболее часто заболевание регистрируется в возрасте 50 лет и старше. Смертность от РЛ в России имеет тенденцию к снижению. В 2000 г. этот показатель составил 60,1 для мужчин на 100 тыс. населения, в 2005 г. - 54,9 среди женщин - соответственно 5,9 и 5,8. Летальность больных в течение 1-го года с момента установления диагноза с 56,8 в 1997 г. сократилась
в 2007 г. до 55,3 %.
СПОСОБСТВУЮЩИЕ ФАКТОРЫ
Причин возникновения РЛ много, они могут быть как экзогенного, так и эндогенного характера, однако решающее значение имеют экзогенные факторы: курение табака, загрязнение окружающего воздушного бассейна канцерогенными веществами и радиоактивными изотопами (при радиоактивном заражении и за счет естественного природного изотопа - газа радона).
Урбанизация, рост числа промышленных предприятий приводят к загрязнению канцерогенными веществами (3,4-бензпирен, бензантрацен и т.д.) почвы, воды, атмосферного воздуха.
Курение табака опасно тем, что в результате высокой температуры зажженной сигареты происходит образование канцерогенных веществ (в частности, бензпирена и бензантрацена), а также частиц копоти (до 1 млн от одной сигареты), которые действуют на реснитчатый
эпителий слизистой оболочки бронхиального дерева, приводя к его гибели. Большую роль в мутагенном эффекте ДНК и РНК, хромосомного аппарата клеток играет радиоактивный изотоп - полоний-210 с длительным периодом полураспада, который при курении табака переходит в дым и надолго задерживается в организме. Синергизм действия бензпирена и полония-210 быстрее приводит к раковому перерождению клеток. Отмечена корреляция между заболеваемостью РЛ и курением табака.
Наиболее изучен патогенез плоскоклеточного РЛ: в результате указанных выше отрицательных воздействий и хронического воспаления происходят атрофия эпителия бронхов с уменьшением количества бокаловидных клеток, замещение железистых компонентов слизистой оболочки фиброзной тканью. Цилиндрический эпителий постепенно превращается в многослойный плоский. Возникают очаги метаплазии (дисплазии) слабой, средней и выраженной степени, которые переходят сначала в преинвазивный, а далее - в инвазивный рак.
Патогенез других гистологических форм изучен мало. Так, известно, что мелкоклеточный РЛ (МРЛ) развивается из клеток Кульчицкого и нейросекреторных клеток, происходящих из нейроэктодермального зачатка. Установлено, что основным действующим моментом в развитии МРЛ является воздействие диэтилнитрозоамина и дибутилнитрозоамина на эти клетки. МРЛ относят к опухолям АПУД-системы с некоторыми особенностями клинического течения вследствие выделения ими биологически активных веществ (соматотропина, инсулина, кальцитонина, АКТГ и др.).
При аденокарциноме большое значение придают эндогенным, преимущественно гормональным факторам, а также генетической предрасположенности и, в частности, способности к метаболической активации канцерогенов внутри организма.
В свете современных данных становление опухолей легкого - канцерогенез - рассматривается на генетическом уровне. Установлено, что это сложный, многоступенчатый процесс накопления мутаций и других генетических изменений, приводящих к нарушениям регуляции основных клеточных функций: пролиферации, дифференцировки, естественной гибели клеток (апоптоза) и наследственной информации ДНК клетки.
К предраковым заболеваниям легких относят хронический бронхит, пневмосклероз, хронические нагноительные процессы в легких, некоторые формы хронического туберкулеза, аденому бронхов, кисты,
поликистоз, доброкачественные опухоли легких. Н.П. Напалков и соавт. (1982), Р.И. Вагнер и соавт. (1986) не согласны со столь широким толкованием «предрака легкого». Они считают такие состояния фоновыми, способствующими возникновению РЛ и предшествующими ему. Эти заболевания приводят к постепенным (в течение 15-20 лет) морфологическим изменениям слизистой оболочки бронхиального дерева. Поэтому люди старше 45 лет, страдающие хроническими легочными заболеваниями, особенно курильщики со стажем 20 лет и более, а также имеющие контакт с канцерогенами на производстве, составляют группу повышенного риска по заболеванию РЛ и требуют особого внимания при обследовании - именно у них чаще всего и возникает РЛ.
Патолого-анатомическая характеристика
Наиболее часто раковая опухоль располагается в правом легком - 52 % наблюдений (Трахтенберг А.Х., 1987), реже в левом - 48 %. Злокачественные опухоли преимущественно локализуются в верхних долях легкого (60 % случаев), в нижних и средних долях они встречаются значительно реже (соответственно в 30 и 10 % случаев).
Объяснить этот факт можно более мощной аэрацией верхних долей, особенно правого легкого, где, как известно, главный бронх является продолжением трахеи, а левый, наоборот, отходит от трахеи под острым углом. Поэтому инородные тела, канцерогенные вещества, частицы дыма и др. устремляются в аэрируемые зоны и при их большей экспозиции вызывают в конечном счете опухолевый рост.
Понятие о центральном и периферическом раке
Различают центральный РЛ, возникающий из крупных бронхов - главного, долевого, сегментарного (встречается в 70 % случаев), и периферический, исходящий из субсегментарных бронхов, их ветвей, бронхиол и альвеол (встречается в 30 % случаев).
В отечественной литературе принята клинико-анатомическая классификация, предложенная А.И. Савицким (1957):
1. Центральный рак легкого (ЦРЛ):
а) эндобронхиальный;
б) перибронхиальный узловой;
в) перибронхиальный разветвленный.
2. Периферический рак легкого (ПРЛ):
а) круглая опухоль, или шаровидный рак;
б)пневмониеподобный рак; в) рак верхушки легкого (опухоль Пенкоста). 3. Атипичные формы:
а) медиастинальная;
б) костная;
в) мозговая;
г) печеночная;
д) милиарный карциноз и т.д.
Необходимо отметить, что выделение атипичных форм РЛ условно. По месту возникновения они являются или центральными, или периферическими, но имеют особенности клинического течения.
Международная гистологическая классификация опухолей легких (ВОЗ, 1981)
I. Плоскоклеточный (эпидермоидный) рак:
а) веретено-клеточный (плоскоклеточный) рак.
II. Мелкоклеточный рак:
а) овсяно-клеточный;
б) промежуточно-клеточный рак;
в) комбинированный овсяно-клеточный рак.
III. Аденокарцинома:
а) ацинарная;
б) папиллярная;
в) бронхиолоальвеолярный рак;
г) солидный рак с образованием муцина.
IV. Крупноклеточный рак:
а) гигантоклеточный;
б) светлоклеточный.
V. Железисто-плоскоклеточный рак.
VI. Рак бронхиальных желез:
а) аденокистозный;
б) мукоэпидермоидный;
в) другие виды.
VII.Прочие злокачественные опухоли.
Наиболее часто встречается плоскоклеточный рак (до 70 % всех случаев); аденокарцинома наблюдается реже (до 10 %). Остальные 20 % приходятся на недифференцированные формы.
В последние годы несколько увеличивается число больных с недифференцированными формами РЛ.
Как видно из приведенной классификации, в разделе «аденокарцинома» выделяется бронхиолоальвеолярный рак, который наблюдается крайне редко, диагностируется также крайне неудовлетворительно. Кстати, в повседневной практике его называют бронхоальвеолярным раком.
Исследованиями (Кузнецов Е.В., 1999; Fraire et al., 1987) показано, что опухоли, как правило, неоднородны по клеточному составу. С ростом опухоли происходят не только количественные, но и качественные изменения. Выживают наиболее агрессивные, жизнеспособные популяции клеток. При гистологических исследованиях опухоли в одном препарате выявляют большое количество неоднородных клеточных популяций. Морфологические различия отмечаются не только в степени дифференцировки, но и в сочетании различных гистологических типов. Это явление носит название гетерогении. Патоморфологические заключения по ряду причин ограничиваются только одним гистологическим типом опухоли.
Анализ отдаленных результатов показал, что существенной разницы в продолжительности жизни больных сравниваемых групп не было. Однако продолжительность жизни больных гетерогенным раком значительно короче, чем при однородном (разница статистически достоверна). Оказалось, что гетерогенный рак обладает большей потенцией к метастазированию.
Закономерности метастазирования
Распространение РЛ осуществляется тремя путями: лимфогенным, гематогенным и имплантационным.
Поскольку легкое - это орган, наполненный лимфой и постоянно находящийся в состоянии дыхательных движений, наиболее существенным вариантом генерализации рака является лимфатический путь.
Как известно, лимфатическая система легкого состоит из поверхностной сети, расположенной под висцеральной плеврой и переходящей в глубокую сеть, сопровождающую сосуды, бронхи и прерывающуюся в лимфатических узлах. Пульмональные лимфатические узлы расположены в самой легочной ткани, в местах деления сегментарных бронхов; бронхопульмональные - в воротах легких, в местах вступления в легкое крупных бронхов; бифуркационные и трахеобронхиальные - соответственно в местах деления трахеи на главные бронхи; паратрахеальные лимфатические узлы расположены вдоль
боковых стенок трахеи, имеют тесную связь с околопищеводными лимфатическими узлами, при этом метастазирование РЛ возможно в параэзофагеальные лимфатические узлы, обусловливая клиническую симптоматику дисфагии, как при раке пищевода. Последнее надо учитывать при дифференциальной диагностике и определении распространенности процесса, чему помогает рентгенография контрастированного пищевода.
Иногда, чаще при локализации опухоли в нижних долях легкого, метастазирование может пойти через цепочку лимфатических узлов легочно-диафрагмальной связки и далее в печень. Из этих узлов лимфа поступает в правый и левый грудные лимфатические протоки, впадающие, соответственно, в правый и левый венозные углы (места слияния яремных и подключичных вен). Необходимо отметить, что возможно контралатеральное метастазирование (в лимфатические узлы средостения с другой стороны и также надключичной области).
Гематогенное метастазирование становится возможным при прорастании опухоли в кровеносные сосуды. Не исключено, что лимфатические сосуды впадают в систему верхней полой вены (ВПВ), минуя регионарные лимфатические узлы. При этом метастазы в печень обнаруживаются у 42 % пациентов, погибших от РЛ, в легкие - у 24 %, почки - у 16 %, кости - у 13-15 %, надпочечники - у 12-15 % и т.д. В эпоху докомпьютерных и УЗ-технологий нередко падение АД у больных в послеоперационном периоде объяснялось просто - метастазами в надпочечники.
Наконец, имплантационный путь метастазирования РЛ проявляется при прорастании плевры и контактном переносе раковых клеток по плевре (этим объясняются канцероматоз плевры, раковый плеврит).
Деление на стадии
Существует ряд классификаций РЛ по стадиям. Отечественная классификация РЛ (1956) выглядит так:
I стадия - опухоль до 3 см в наибольшем измерении, расположенная в одном сегменте (ПРЛ) или в пределах сегментарного бронха (ЦРЛ) без признаков метастазирования.
II стадия - опухоль до 6 см, расположенная в пределах 1 доли (ПРЛ) или долевого бронха (ЦРЛ). В пульмональных и бронхопульмональных лимфатических узлах - единичные метастазы.
III стадия - опухоль больше 6 см, переходит на соседнюю долю (доли) (ПРЛ) или с переходом с одного долевого бронха на другой или главный бронх (ЦРЛ). Метастазы в бифуркационных, трахеобронхиальных, паратрахеальных лимфатических узлах.
IV стадия - как при центральной, так и при периферической формах опухоль выходит за пределы легкого, распространяется на соседние органы (грудную стенку, диафрагму, средостение, перикард) с обширными регионарными и отдаленными метастазами. Раковый плеврит.
МЕЖДУНАРОДНАЯ КЛАССИФИКАЦИЯ ПО СИСТЕМЕ TNM (2002)
Правила классификации
Представленная ниже классификация применима только для рака. В каждом случае необходимы гистологическое подтверждение диагноза и выделение гистологического типа опухоли.
Анатомические области
1. Главный бронх.
2. Верхняя доля бронхов или легкого.
3. Средняя доля.
4. Нижняя доля.
Регионарные лимфатические узлы
К регионарным лимфатическим узлам для опухолей легких относят внутригрудные, предлестничные и надключичные узлы.
Клиническая классификация TNM Т - первичная опухоль
Тх - оценка первичной опухоли невозможна либо при цитологическом исследовании мокроты или промывных вод бронхов обнаружены опухолевые клетки, а с помощью рентгенографии или бронхоскопии первичная опухоль не определяется.
Т0 - первичная опухоль не обнаружена.
Tis - преинвазивная карцинома (earcinoma in situ).
Т1 - опухоль размером до 3 см в наибольшем измерении, окруженная легочной паренхимой или висцеральной плеврой.
По данным бронхоскопии - поражение проксимальнее долевых бронхов отсутствует (иными словами, главные бронхи не поражены)*.
Т2 - опухоль, которая имеет следующие характеристики:
- размеры опухоли более 3 см в наибольшем измерении;
- поражен главный бронх на расстоянии 2 см или дистальнее от карины;
- поражена висцеральная плевра;
- опухоль с ателектазом, простирающимся до корня легкого, но не затрагивающим всего легкого.
Т3 - опухоль любого размера, распространяющаяся на грудную стенку (включая опухоль Панкоста), диафрагму, средостенную плевру, париетальный листок перикарда, либо опухоль главного бронха на расстоянии менее 2 см от карины, но без ее поражения. Кроме того, возможен ателектаз всего легкого.
Т4 - опухоль любого размера, распространяющаяся на средостение, сердце, крупные сосуды, трахею, пищевод, тела позвонков, карину. Кроме того, возможны опухолевые очаги в отдельной доле либо опухоль с наличием плеврального выпота**.
Обратите внимание!
* Поверхностные опухоли любых размеров, которые ограничены в пределах стенки бронха и распространяются проксимально (к главному бронху), тоже относятся к группе Т1.
** В большинстве случаев плевральный выпот у больного раком легкого обусловлен злокачественным новообразованием. Вместе с тем у некоторых лиц множественные исследования плеврального выпота не позволяют выявить опухолевых клеток: такая жидкость обычно не содержит эритроцитов и является по сути транссудатом. Указанным больным для верификации диагноза показана торакоскопия с прямой биопсией плевры. В случае отрицательного результата торакоскопии плевральный выпот исключают из классификации рака, а опухоль относят к стадиям Т1, Т2, Т3.
N - регионарные лимфатические узлы
? - состояние регионарных лимфатических узлов оценить невозможно.
N0 - метастазов в регионарных лимфатических узлах нет. N1 - метастазы в ипсилатеральные перибронхиальные и (или) ипсилатеральные прикорневые лимфатические узлы. Возможно
поражение внутрилегочных лимфатических узлов в процессе распространения первичной опухоли.
N2 - метастазы в ипсилатеральные узлы средостения и (или) нижние трахеобронхиальные лимфатические узлы.
N3 - метастазы в контралатеральные средостенные и прикорневые лимфатические узлы; ипсилатеральные или контралатеральные предлестничные, надключичные лимфатические узлы.
М - отдаленные метастазы
Мх - наличие отдаленных метастазов оценить невозможно. МО - отдаленных метастазов нет.
М1 - наличие отдаленных метастазов, включая отдельные узлы в различных ипсилатеральных или контралатеральных долях.
Группировка по стадиям
Стадия | Т | N | M |
0 | Tis | N0 | М0 |
IA | Т1 | N0 | М0 |
Т2 | N0 | М0 | |
IIA | Т1 | N1 | М0 |
ИВ | Т2 | N1 | М0 |
Т3 | N0 | М0 | |
IIIA | Т1 | N2 | М0 |
IIIA | Т2 | N2 | М0 |
IIIA | Т3 | N1, N2 | М0 |
ШВ | Т4 | Любая N | М0 |
ШВ | Любая Т | N3 | М0 |
IV | Любая Т | Любая N | М1 |
Патоморфологическая классификация pTNM
Критерии выделения категорий рТ, pN и рМ соответствуют таковым для категорий Т, N и М.
С целью патоморфологической оценки показателя N проводят удаление шести регионарных лимфатических узлов или более.
В настоящее время принято, что отсутствие характерных изменений ткани при патоморфологическом исследовании биоптатов меньшего количества лимфатических узлов позволяет подтвердить стадию pN0. В отчете следует указать число резецированных лимфатических узлов.
КЛИНИЧЕСКАЯ КАРТИНА
Обращаем внимание на 2 положения:
1) РЛ развивается только из эпителия бронхиального дерева и его желез;
2) легочная ткань не имеет болевых окончаний, поэтому боль как симптом болезни появится тогда, когда в процесс будут вовлечены плевра или нервные стволы.
В течении РЛ выделяют 2 периода: доклинический и клинический. Доклинический период отличается скудностью симптоматики, может продолжаться несколько лет, обнаруженная опухоль может оказаться случайной находкой.
Учитывая многообразие клинических форм и стадий РЛ, врачуклиницисту следует знать, что и клинические проявления болезни будут разнообразными - от скудных симптомов фоновых заболеваний до ярких и многочисленных, порой даже не говорящих о легочной патологии. Иногда симптомы РЛ «тонут» в проявлениях фоновых и сопутствующих заболеваний, так что выявление РЛ при патологоанатомическом вскрытии становится неприятной неожиданностью для лечащего врача. В свете данных последних лет МРЛ следует рассматривать как апудому, из особенностей которой - способность вырабатывать биологически активные вещества, выделять их в кровь и тем самым менять обычное клиническое течение РЛ.
Семиотика
Клиническую картину РЛ можно представить следующим образом.
При ЦРЛ опухолевый узел, увеличиваясь, вызывает раздражение слизистой оболочки бронха, нарушение бронхиальной проходимости и вентиляции сегмента, доли или всего легкого в виде гиповентиляции и ателектаза, со смещением или без смещения средостения. Прорастая нервные стволы, плевру, опухоль вызывает болевой синдром и нарушение иннервации соответствующего нерва (диафрагмального, возвратного или блуждающего), а также картину вовлечения плевры в неопластический процесс. Метастазирование приводит к появлению вторичных симптомов со стороны пораженных органов и систем.
ПРЛ в начальных стадиях протекает бессимптомно, так как паренхима легкого не имеет болевых окончаний. Увеличиваясь, опухоль прорастает плевру, соседние анатомические структуры, крупные бронхи и становится клинически похожей на ЦРЛ. В центре опухоли могут возникнуть распад и кровотечение.
Aтипичные формы РЛ чаще всего манифестируют своими отдаленными метастазами или симптомами, очень схожими с таковыми при других заболеваниях.
Таким образом, клинические проявления РЛ зависят от формы роста, стадии опухоли, степени нарушения бронхиальной проходимости, других осложнений основного процесса (распад, кровотечение, параканкрозная пневмония, метастазирование в лимфатические узлы и отдаленные органы).
Общепринято деление симптомов опухолевого процесса на общие, местные и симптомы, связанные с отдаленным метастазированием и осложнениями.
При РЛ наблюдаются следующие местные симптомы: кашель, кровохарканье, выделение мокроты, осиплость голоса, сдавление ВПВ, симптомы, связанные с прорастанием в соседние органы и нарушением бронхиальной проходимости. К местным симптомам можно также отнести смещение средостения и связанные с ним перегибы сосудов сердца, бронхов, нарушения ритма работы сердца и легких. При экссудативном плеврите нарушается также вентиляция легких из-за сдавления паренхимы жидкостью.
Общие симптомы - интоксикация и паранеопластический синдром, одышка, слабость, повышение температуры тела, потеря массы тела. Слабость, недомогание, небольшое повышение температуры тела - нередко единственные симптомы болезни. С другой стороны, больные РЛ не всегда успевают похудеть на этапе диагностических мероприятий. Наоборот, при «толковом» лечении - снятии интоксикации, проведении антибиотикотерапии - больным становится лучше, у них появляется аппетит, они даже несколько прибавляют в массе тела. В таких случаях диагноз РЛ может быть необоснованно отвергнут. При РЛ паранеопластический синдром выражается в нарушении обмена кальция в костях скелета (синдром Пьера Мари-Бамбергера), появлении кожной сыпи, дерматита, изменении концов пальцев по типу «барабанных палочек», что свидетельствует об эндогенной, гормональной этиологии и регуляции указанных изменений.
Симптомы, связанные с метастазированием и осложнениями РЛ, тесно переплетаются с общими и местными. Но прежде всего это метастазы в жизненно важные органы и ткани - печень, кости, головной мозг и связанные с ними проявления, вплоть до патологического перелома, полиорганной недостаточности. Осложнения РЛ в основном связаны с нарушением бронхиальной проходимости, ателектазом, распадом легочной ткани и развитием тяжелых профузных легочных кровотечений.
Клинические варианты ЦРЛ и ПРЛ
Особенности ЦРЛ с эндобронхиальной формой роста следующие: в ответ на появление опухоли в слизистой оболочке бронха возникает кашель, вначале сухой, затем - светлая мокрота, иногда с прожилками крови; это обусловлено не столько распадом самой опухоли, сколько разрывом мелких кровеносных сосудов - капилляров. С ростом опухоли нарушается дренажная функция бронха - возникает гиповентиляция соответствующего сегмента или доли легкого, а в последующем - ателектаз. Мокрота приобретает гнойный характер. Этот этап болезни сопровождается повышением температуры тела, общим недомоганием, слабостью, одышкой. Повышение температуры тела объясняется активизацией эндобронхиальной микрофлоры, слабость и недомогание - явлениями интоксикации. Одышка обусловлена двумя причинами: во-первых, уменьшается дыхательная поверхность легочной ткани, во-вторых - через ателектазированную часть легкого продолжается, пусть и в уменьшенном количестве, легочный кровоток. Но в этом месте не происходит газообмена, поэтому кровь возвращается в большой круг кровообращения такой же неоксигенированной, какой и поступила. В свою очередь, хеморецепторы, расположенные в дуге аорты, ее бифуркации, каротидном клубочке, улавливают химизм крови и через подкорковые механизмы регуляции функций жизненно важных органов заставляют больного дышать чаще и глубже. Развивается обтурационная пневмония или раковый пневмонит. Обычно этот процесс проявляется в период осенних и весенних эпидемий респираторных инфекций. Тогда же больных направляют на рентгенологическое исследование, и у них выявляют РЛ или определяется пневмония. После кратковременного противовоспалительного лечения (обычно 5-7 дней) наступают восстановление бронхиальной проходимости, уменьшение воспалительного
компонента, снижение СОЭ и числа лейкоцитов в периферической крови, самочувствие больного улучшается. Рентгенологически также уменьшается зона затемнения легочной ткани. Ошибочно принимая картину ракового пневмонита за пневмонию с хорошим терапевтическим эффектом, клиницисты совершают ошибку - не проводят больному бронхологическое исследование, контрольное рентгенологическое исследование в динамике - и тем самым не устанавливают диагноз РЛ. Раковый пневмонит может привести к вовлечению в воспалительный процесс плевры. Это может выразиться появлением болевого синдрома (сухой плеврит) и даже экссудативного плеврита. На начальных этапах болезни плевральная жидкость серозная, в ней нет раковых клеток.
Затем рост опухоли приводит к вовлечению в процесс расположенных рядом анатомических структур. Так, прорастание опухолью возвратной ветви блуждающего нерва влечет за собой паралич мышц, натягивающих голосовые связки, и появляется осиплость голоса. Отметим, что осиплость голоса чаще проявляется при локализации рака в левом легком, так как именно слева возвратный нерв отходит от блуждающего на уровне нижнего края дуги аорты. Справа этот симптом наблюдается реже, так как возвратный нерв отходит на уровне нижнего края правой подключичной артерии.
Прорастание основного ствола блуждающего нерва влечет за собой прежде всего изменения со стороны сердечно-сосудистой системы. Поскольку в какой-то мере устраняется действие парасимпатической иннервации сердца и начинает преобладать симпатическая нервная система, то возникает тахикардия, а со стороны ЖКТ наблюдаются метеоризм и усиленная перистальтика кишечника.
Поражение диафрагмального нерва ведет к параличу диафрагмы и, соответственно, релаксации соответствующего купола. Прорастание опухолью непосредственно перикарда может привести к болевому симптому со стороны сердца. Это обусловливает ошибочную госпитализацию больных в кардиологический стационар.
Метастазирование или прорастание опухолью области расположения ВПВ ведет к нарушению оттока крови и лимфы от верхней половины туловища, верхних конечностей, головы и шеи. Лицо больного становится одутловатым, с цианотичным оттенком, набухают вены на шее, руках, грудной клетке. Если попросить пациента наклонить туловище, при возврате в вертикальное положение отток крови от верхней половины будет значительно замедлен. Больные с трудом
могут спать лежа, принимают вынужденное полусидячее или вертикальное положение. Этот симптомокомплекс носит название синдрома сдавления ВПВ. Он нередко сопровождает опухоли средостения, легочно-средостенную форму лимфогранулематоза, неходжкинские лимфомы, а также тромбоз ВПВ. Наблюдая подобных больных РЛ, следует отметить, что злокачественный процесс успевает к этому времени значительно распространиться, в средостении (часто с обеих сторон) определяются конгломераты лимфатических узлов, могут быть жидкость в плевральных полостях, метастазы в надключичных лимфатических узлах. В этой ситуации трудно сразу решить, с какой стороны располагается первичный очаг.
Нелишне напомнить, что атипичные формы РЛ в конечном итоге относятся к центральной или периферической формам.
При распространении РЛ на плевру возможны имплантационное метастазирование по плевре и возникновение плеврита. В этом случае при цитологическом исследовании плеврального содержимого в нем можно обнаружить раковые клетки. Возможен геморрагический характер жидкости; этому предшествует распад метастатических очагов. Гематогенное метастазирование может привести к тому, что вначале проявляются клинические симптомы со стороны метастазов.
Одним из условий задержки роста опухолевой клетки или комплекса метастатических клеток и последующего развития из них дочерней опухоли является замедление скорости кровотока. Так, диаметр воротной вены печени составляет 1,5-2 см, а сложенных вместе печеночных капилляров - 400 м. Резкое замедление кровотока в печени приводит к множественным метастазам в этом органе. При этом определенное значение имеют и другие факторы метастазирования - такие, как выделение раковыми клетками протеолитических ферментов, их склонность к перемещению, возможность амебовидных движений и др.
При перибронхиальной узловой форме ЦРЛ нарушение дренажной функции бронха проявляется в последнюю очередь, и поэтому симптоматика менее выражена. Считается, что эта форма опухоли также начинается из слизистой оболочки бронхиального дерева, но прободает стенку бронха (как запонка на рубашке) и развивается в виде узла вокруг бронха. Опухоль будет сдавливать стенку бронха, но этот процесс развивается медленнее, чем было бы со стороны просвета бронха. Однако кашель беспокоит этих больных сильнее, он
становится надсадным, особенно при метастазировании в лимфатические узлы и сдавлении ими бронха.
Aналогичная картина наблюдается при перибронхиально-разветвленной форме ЦРЛ - она соответствует длительно протекающей прикорневой пневмонии. Этот вид ЦРЛ труднее всего верифицировать, так как при бронхоскопии могут быть только косвенные признаки опухоли при отсутствии эндоскопически определяемой экзофитной ее части в просвете бронха.
При раке Пенкоста опухоль располагается в 1-м сегменте легкого, быстро прорастает купол плевры, головки первых трех ребер, межреберные нервы и элементы плечевого сплетения, что может вызвать боли по ходу нервных стволов, в плечевом суставе и т.д. Больных при этом часто госпитализируют в неврологические отделения с диагнозом плексита, плечелопаточного артрита. При вовлечении в процесс пограничного симпатического ствола и особенно звездчатого ганглия возникает симптом Клода Бернара-Горнера (птоз, миоз, энофтальм). Кроме того, может нарушиться симпатическая иннервация сосудов кожи соответствующей половины туловища. Сосудистая сеть при этом расширена, выражена потливость.
Круглая опухоль, или шаровидный рак, вначале всегда бессимптомна. Чаще это случайная находка при профилактических флюорографических исследованиях. При этом нарушений бронхиальной проходимости в виде гиповентиляции и ателектаза не наблюдается, что, по-видимому, связано с наличием обширной коллатеральной сети аэрации дистальных отделов легочной паренхимы. Опытный клиницист на основании жалоб и анамнеза пациента может выявить легкое недомогание, снижение трудоспособности, утомляемость и периодическое повышение температуры тела до субфебрильной. Опухоль возникает из бронхов 4-7-го порядка и, увеличиваясь, захватывает более крупные бронхи, становясь похожей на ЦРЛ. Прорастание висцеральной плевры ведет к появлению болевого синдрома. При периферической форме нередко возникает воспаление легочной паренхимы; это - параканкрозная пневмония. При проведении противовоспалительной терапии инфильтрация легочной паренхимы уменьшается, и на ее фоне рентгенологически можно обнаружить округлую опухоль с некоторой лучистостью по контуру, обусловленной раковым лимфангитом. Отсюда следует, что у этой категории больных необходимы контрольные рентгенологические исследования. В дальнейшем шаровидный РЛ почти
повторяет клинику ЦРЛ - точнее, его смешанную форму роста. Он также метастазирует. В центре опухоли из-за недостатка кровоснабжения и питания начинается некроз опухолевых клеток. Пациент может выкашлять некротизированную массу, при этом есть вероятность образования полости - это так называемая полостная форма РЛ. В отличие от кисты или абсцесса толщина стенки бывает неоднородной.
При пневмониеподобной форме ПРЛ опухолевый процесс распространяется по доле легкого из одного или нескольких первичных опухолевых очагов в легочной паренхиме, затем происходит их слияние в единый опухолевый конгломерат - инфильтрат. Чаще это аденокарцинома или, точнее, бронхиолоальвеолярная форма РЛ. Кашель вначале бывает сухой, затем появляется мокрота - скудная, вязкая, позже переходящая в жидкую, обильную, пенистую. С присоединением инфекции клиническое течение опухоли приобретает сходство с хронической рецидивирующей пневмонией, сопровождающейся повышением температуры, болями в груди, кашлем с обильным количеством мокроты, одышкой и выраженной интоксикацией. Эти формы РЛ требуют особого внимания клинициста, так как диагноз труден (возможна двусторонняя локализация), требуется морфологическая его верификация, что в данном случае сделать непросто.
Особенности атипичных форм РЛ (медиастинальной, костной, мозговой, плевральной и т.д.) связаны прежде всего с метастазированием в средостение, головной мозг, кости и другие органы или с прорастанием в перикард, генерализацией по плевре, плевритом и др.
Так, при медиастинальной форме РЛ метастазы в средостенные лимфатические узлы приводят к сдавлению ВПВ и нарушению оттока крови и лимфы из верхней половины туловища, конечностей, головы и шеи. При этом лицо больного становится одутловатым, вены шеи индулируют, а вены рук и верхней половины туловища выражены более отчетливо и не спадаются.
При костной форме РЛ первые симптомы болезни клинически проявляются со стороны костей. При этом наблюдаются боли в костях, рентгенологически - симптомы деструкции, лизиса. Вначале может быть патологический перелом кости, и только потом выявляется первичный очаг в легком.
При «мозговой» форме РЛ первые признаки болезни выражаются в клиническом проявлении метастаза в головной мозг. При
этом больные отмечают головную боль, головокружение, слабость, тошноту, это объясняется повышением внутричерепного давления, нарушением функции отдельных участков головного мозга.
При других атипичных формах РЛ начальные признаки заболевания, с которыми обращаются больные, могут быть ошибочно приняты за стенокардию, гепатит, острый холецистит, плеврит и т.д.
В последние годы нередко наблюдаются недифференцированные формы РЛ - МРЛ, крупноклеточный, овсяно-клеточный, светлоклеточный, полиморфно-клеточный. Эти формы чаще всего отличаются агрессивным течением, быстрым метастазированием, особенно гематогенным. Нередко наблюдаются метастазы в головной мозг и кости свода черепа. МРЛ относится к гормонсекретирующим опухолям. Период жизни больных МРЛ с момента установления диагноза до смерти определяется в 7-8, максимум - 10 мес.
Считают, что период удвоения клеточной массы при РЛ составляет от 30 до 150 дней, однако есть наблюдения (A.K Панков), в которых этот период составлял 5,5 года. Продолжительность жизни больных РЛ без лечения с момента установления диагноза определяется в несколько лет. По данным T.A. Ефимова и соавт., продолжительность жизни 90-95 % нелеченых больных составляет 2 года, но 3-4 % больных даже без лечения живут до пяти лет.
ДИАГНОСТИКА
Несмотря на появление в последние десятилетия совершенных диагностических аппаратов, инструментов, диагностических центров, у основного количества больных РЛ выявляется в III и IV стадиях.
По данным В.М. Мерабишвили (2000), у 34,2 % больных РЛ обнаруживают в IV стадии, когда выполнение радикальной операции уже невозможно, а современная лучевая терапия или химиотерапия носят лишь паллиативный характер, поэтому ранняя и своевременная диагностика РЛ имеет решающее значение в судьбе заболевших.
Общие принципы первичного обследования больных с подозрением на РЛ не отличаются от диагностики других бронхолегочных заболеваний, так как этот диагноз устанавливают только после его полного подтверждения. Aбсолютным считается диагноз при его морфологическом (цитологическом или гистологическом) подтверждении. До этого момента (кроме очевидных признаков
запущенного РЛ) невозможно точно определить, какая именно патология имеется у пациента.
Возможны 2 основных варианта выявления РЛ: при скрининге (активное выявление) и по обращаемости.
Наиболее распространенным видом скрининга является профилактическая флюорография. В ее задачу входит обнаружение патологического синдрома (симптомокомплекса), природа которого уточняется при дальнейшем дообследовании. Как правило, такие пациенты сначала завершают рентгенологическое обследование и только после этого попадают на прием к врачу-клиницисту.
При обращении пациентов с легочными жалобами в поликлинику или другое ЛПУ их обследование начинается с врачебного приема. На этом этапе применяются общеклинические методы исследования: сбор жалоб, изучение анамнеза, общий осмотр и физикальное обследование. При первом контакте с больным необходимо обратить внимание на «сигналы тревоги» - первые, а возможно, и единственные признаки заболевания легких. Необходимо отметить, что патогномоничных клинических симптомов РЛ не существует.
Из жалоб больных следует отметить кашель. Это первичная реакция организма на опухоль, возникшую из слизистой оболочки бронхиального дерева. В начале заболевания больной пытается «откашлять» опухоль, но это не удается. Кашель на этом этапе сухой, без мокроты. В последующем он становится более интенсивным, надсадным, особенно по ночам. Это приводит к разрыву мелких кровеносных сосудов - капилляров. В мокроте появляется примесь эритроцитов. Кровохарканье вначале обнаруживается только при целенаправленном микроскопическом исследовании мокроты, затем больной сам может определить прожилки крови в мокроте. В запущенных случаях мокрота становится цвета «малинового желе». Надо сказать, что обильных легочных кровотечений врачи больниц и поликлиник не видят, так как это происходит в поздние периоды болезни, когда пациент практически не выходит из дома.
При общем осмотре и обследовании особое внимание следует уделять пальпации периферических лимфатических узлов. Надключичные и прескаленные лимфатические узлы на стороне поражения являются регионарными для РЛ и наиболее часто поражаются метастазами. При перкуссии и аускультации обнаруживают признаки нарушения вентиляции определенной части легкого (ЦРЛ) или симптомы пневмонии (обтурационная пневмония при ЦРЛ или
параканкрозная - при ПРЛ). Соответственно дыхательные движения грудной клетки на стороне поражения могут отставать от экскурсий на здоровой стороне. Нередко в патологический процесс вовлекается плевра и появляются признаки сухого или экссудативного плеврита. Изменения в формуле крови соответствуют воспалительному процессу, часто значительно увеличена СОЭ.
Выявив бронхолегочную симптоматику, больного следует направить на дополнительное плановое обследование. При этом совершенно не имеет значения, какой предварительный диагноз был поставлен - бронхит, пневмония, туберкулез и т.п.
Дополнительное обследование проводится по алгоритму, состоящему из следующих 4 этапов.
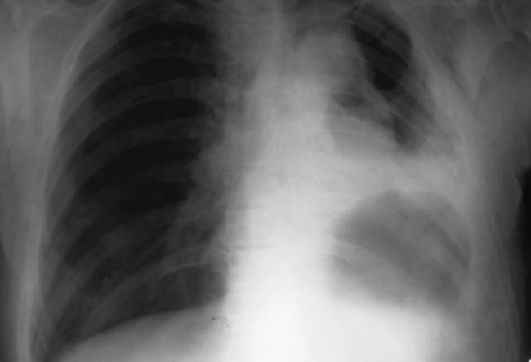
Предварительный этап - обзорная (диагностическая) флюорография или рентгенография органов грудной клетки (рис. 17.1). В направлении указывается метод исследования и выбранные проекции, например: «Флюорография органов грудной клетки, прямо и правым боком». Исследование выполняется не менее чем в двух проекциях из-за особенностей рентгенологического изображения органов грудной клетки. В задачу врача-рентгенолога входят выделение рентгенологического синдрома (симптомокомплекса) и выбор оптимального среза для линейной томографии.
Напомним, что непременным условием правильной интерпретации рентгенологических данных
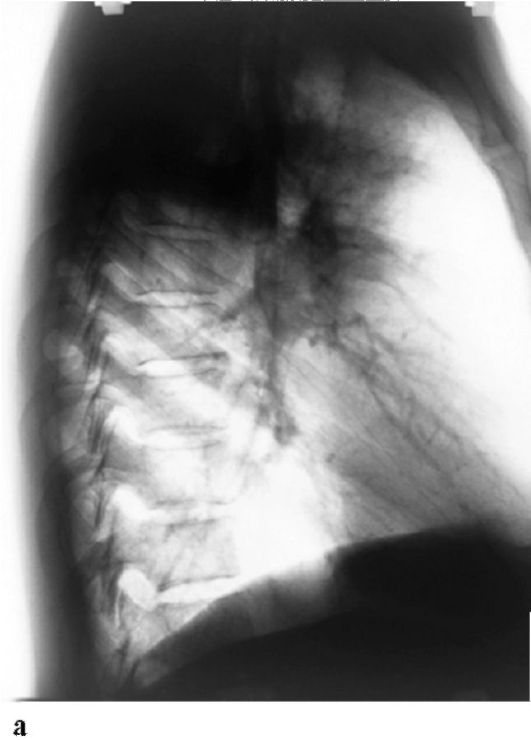
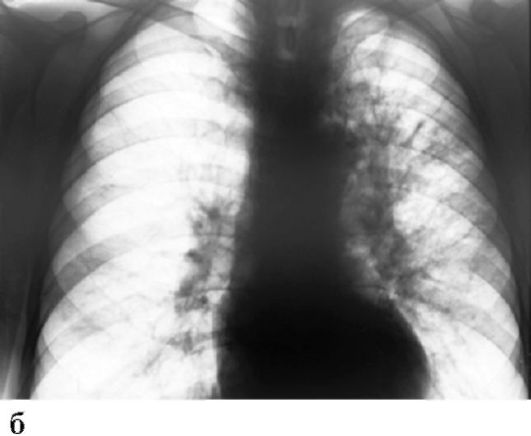 Рис. 17.1. Рак правого легкого. Рентгенограмма (а, б)
Рис. 17.1. Рак правого легкого. Рентгенограмма (а, б)
является получение качественно выполненных рентгенограмм. Это означает, что кроме обязательного выполнения рентгенограмм в двух проекциях должны быть обеспечены правильная установка больного и жесткость снимка. При правильной установке больного в прямой проекции медиальные концы ключиц находятся на одинаковом расстоянии от средней линии позвоночника, на которую указывают остистые отростки позвонков; 2/3 сердечной тени должны располагаться слева от средней линии позвоночника и 1/3 - справа. У сердечной тени слева прослеживаются 4 дуги: аорты, легочного ствола, ушка левого предсердия и дуга левого желудочка, а справа 2 дуги - снизу от сердечно-диафрагмального синуса выступает дуга правого предсердия, выше нее - дуга восходящей аорты (это при условии, что у больного не декстрапозиция).
Правый купол диафрагмы в норме выше левого. Под правым куполом диафрагмы располагается плотная ткань печени, под левым в положении больного стоя определяется газовый пузырь желудка. Необходимо, чтобы рентгенограмма включала сверху купол плевры, а внизу - реберно-диафрагмальные синусы. Напомним, что наличие жидкости (экссудат, транссудат, кровь) <300 мл может и не определяться, если в плевральной полости нет воздуха. Если воздух есть, он обязательно придаст жидкости горизонтальный уровень. Но положение больного должно быть вертикальным. Без воздуха жидкость будет располагаться по линии Домуазо, которая, начинаясь от угла, образованного позвоночником и диафрагмой, поднимается вверх к задней подмышечной линии и опускается вниз к передней подмышечной линии. Если снимок сделан в положении пациента лежа на больном боку («латерограмма»), то жидкость расположится вдоль ребер вплоть до купола плевры, если в плевральной полости нет сплошных спаек. Еще одно необходимое условие: во время рентгенографии надо привести локти больного к экрану или кассете, иначе тени лопаток будут прикрывать легочные поля и создавать условия для диагностических ошибок.
По рентгенограмме (см. рис. 17.1, а) можно судить о поражении долей и отметить сегментарную локализацию опухоли. Иногда надпись на пленке может быть проставлена на обратной стороне снимка, ориентироваться можно по верхнему куполу диафрагмы. Если под верхним куполом диафрагмы находится газовый пузырь желудка - это левограмма; если под верхним куполом диафрагмы расположена плотная ткань печени - это правограмма. Боковая
рентгенограмма помогает не только в установлении диагноза, но и в дифференциальной диагностике. Если мысленно провести 2 вертикальные линии впереди и позади корня легкого, а также 2 горизонтальные - над и под корнем легкого в боковой проекции (по Твайнингу), средостение разделяется на 9 отделов. Зная, какие органы располагаются в том или ином отделе, можно предварительно поставить диагноз. Например, в переднем средостении располагаются вилочковая железа, клетчатка, перикард, поэтому и источником образования, возможно, будет какой-либо из этих органов, например, может развиться тимома. Если опухоль расположена в верхнем переднем отделе - это, скорее всего, загрудинный зоб.
Таким образом, зная рентгенологическую норму грудной клетки и легких, все отклонения от нормы можно рассматривать как патологию и принимать все меры к тому, чтобы их объяснить.
Признаки ателектаза
Рентгенологическая картина ателектаза обусловлена нарушением проходимости бронха. Развитие ателектаза - это финал последовательного процесса нарушений бронхиальной проходимости. Рассмотрим стадии нарушения проходимости бронха на примере сегментарных бронхов.
Рост опухоли приводит к сужению бронха и нарушению вентиляции соответствующего сегмента легкого, что может косвенно свидетельствовать о наличии опухоли. Рентгенологически опухоль на данном этапе не определяется. Развивается гиповентиляция сегмента, соответствующая I стадии нарушения бронхиальной проходимости. Сужение просвета бронха приводит к недостаточному поступлению воздуха в соответствующий сегмент легкого, прозрачность которого снижается; происходят усиление легочного рисунка, сближение сосудов в сегменте.
При дальнейшем росте опухоли во II стадии нарушения бронхиальной проходимости тень опухоли еще не видна, рентгенологически определяется клапанная эмфизема, которая обусловлена сужением просвета бронха II степени. Клинические признаки рака отсутствуют или слабо выражены. Рентгенологическим проявлением этой стадии служит вздутие сегмента легкого. Это происходит вследствие того, что в фазе выдоха просвет бронха сужается и отмечается накопление остаточного объема воздуха в сегменте. В пораженном сегменте наблюдается обеднение сосудистого рисунка.
По мере роста опухоли просвет бронха полностью перекрывается, что приводит к возникновению ателектаза. При полной обтурации бронха воздух в альвеолах рассасывается, и сегмент спадается. Рентгенологически ателектаз сегмента проявляется участком интенсивного гомогенного затемнения, соответствующим расположению сегмента, треугольной формы, с четкими и ровными границами. Ателектаз доли выглядит как участок интенсивного гомогенного затемнения; доля уменьшена в размерах, нижний край ее вогнут, границы четкие и ровные. При ателектазе легкого тень его гомогенна, легкое уменьшено в объеме, органы средостения смещены в сторону затемнения.
Томографический этап - линейную томографию назначает врачрентгенолог, который определяет плоскость (фронтальная, сагиттальная) и срез (глубина залегания выделяемого слоя определяется от поверхности стола) для ее выполнения. А.Х. Трахтенберг рекомендует полипозиционную томографию.
КТ в диагностике РЛ применяется после завершения всего обследования для решения сложных дифференциально-диагностических задач (оценка распространенности опухоли, выявление рентгенонегативных метастазов и др.) или вместо линейной томографии (рис. 17.2-17.4).
При ЦРЛ выполняется томография корня легкого на стороне поражения для получения изображения опухоли и бронхов. При эндобронхиальной форме ЦРЛ обнаруживается стеноз или полная обтурация просвета бронха мягкотканым образованием. При пери-
бронхиальной форме ЦРЛ выявляется экзобронхиальное мягкотканое образование в виде опухолевого узла (перибронхиальная узловая форма) или муфтообразных уплотнений по ходу бронхов (перибронхиальная разветвленная форма) в сочетании с сужением просвета бронха. При смешанной форме ЦРЛ встречаются все перечисленные признаки. Перибронхиальные опухоли размером <1,5 см при линейной томографии и КТ неотличимы от лимфатических узлов.
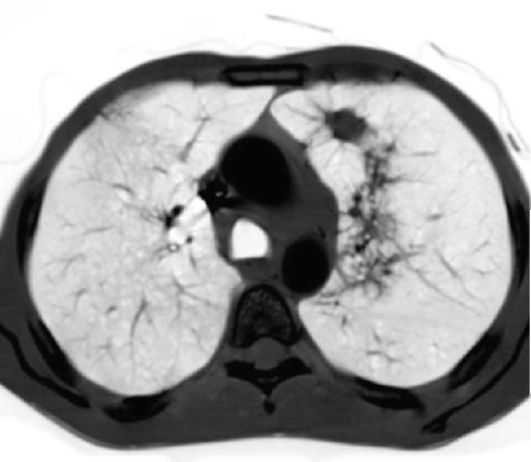 Рис. 17.2. Периферический рак верхней доли левого легкого. Компьютерная томограмма
Рис. 17.2. Периферический рак верхней доли левого легкого. Компьютерная томограмма
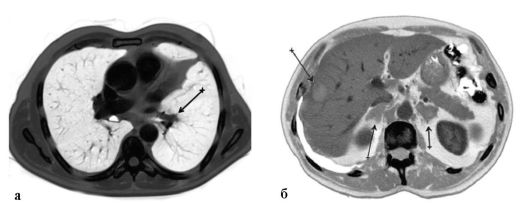 Рис. 17.3. Центральный рак левого легкого, метастаз в печень, надпочечник. Стрелками указана опухоль. Компьютерная томограмма (а, б)
Рис. 17.3. Центральный рак левого легкого, метастаз в печень, надпочечник. Стрелками указана опухоль. Компьютерная томограмма (а, б)
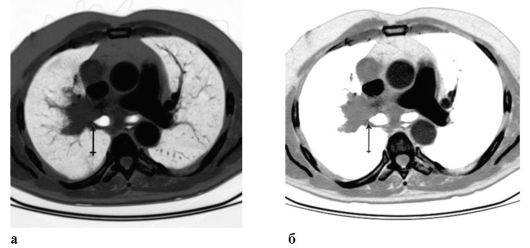
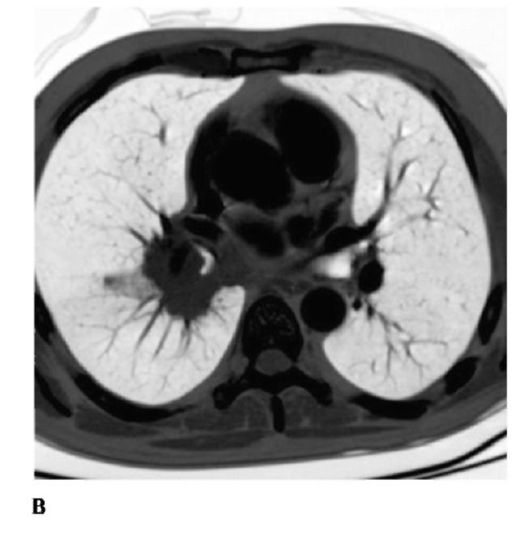 Рис. 17.4. Центральный рак правого легкого. Стрелками указана опухоль. Компьютерная томограмма (а-в)
Рис. 17.4. Центральный рак правого легкого. Стрелками указана опухоль. Компьютерная томограмма (а-в)
При ПРЛ томография проводится на уровне опухоли и используется для получения четкого ее изображения, как правило имеющего вид узловатого образования округло-овальной формы.
Во II-IV стадиях РЛ обнаруживаются признаки увеличения бронхопульмональных или различных групп медиастинальных лимфатических узлов. При этом определяют контур v. azygos, который прослеживается над правым главным бронхом в виде округлого образования, находящегося рядом с правым контуром трахеи. В процессе эмбриогенеза v. azygos располагается в области купола плевры и в последующем опускается по правой стенке трахеи до правого главного бронха, где впадает в ВПВ. В исключительных случаях v. azygos проходит через легочную ткань и отшнуровывает часть легочной ткани в виде маленькой дольки lobus v. azygos. При метастазах в лимфатические узлы правой трахеобронхиальной группы контур указанной вены не визуализируется, а вместо этого выявляется увеличенный лимфатический узел. При размерах лимфатических узлов <1,5 см метастатическую лимфоаденопатию невозможно отличить от неспецифической гиперплазии. Линейная томография не позволяет визуализировать нормальные лимфатические узлы, а также пораженные лимфатические узлы превенозной группы справа, преаортокаротидной, аортопульмональной и трахеобронхиальной групп слева, а также бифуркационной, подключичной и висцеральных групп. КТ визуализирует нормальные и патологически измененные лимфатические узлы практически всех групп.
Бронхологический этап. На данном этапе рекомендуется цитологическое исследование мокроты с правильным ее получением (берут утреннюю мокроту натощак, 4-5-кратно, после тщательного ополаскивания рта водой; материал направляется в лабораторию не позднее чем через 1-1,5 ч). Этот метод позволяет получить верификацию ЦРЛ у 39-69 % больных в I стадии.
Показаниями к фибробронхоскопии (ФБС) служат сомнительные или однозначные рентгенологические данные в пользу ЦРЛ, положительные или сомнительные результаты цитологического исследования мокроты (рис. 17.5, 17.6), а также тревожные клинические симптомы (кровохарканье любой степени выраженности, отсутствие эффекта от специфической терапии при лечении от хронических неспецифических заболеваний легких (ХНЗЛ), пневмонии и бронхита в течение 2-3 нед, надсадный кашель).
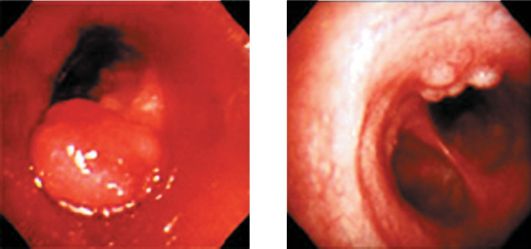 Рис. 17.5. Рак бронха. Эндоскопиче- Рис. 17.6. Рак трахеи. Эндоскопическое исследование ское исследование
Рис. 17.5. Рак бронха. Эндоскопиче- Рис. 17.6. Рак трахеи. Эндоскопическое исследование ское исследование
ФБС проводится по общепринятым правилам и включает общий осмотр всего трахеобронхиального дерева (ТБД), а также частный - патологически измененных бронхов. Важно вести поиск патологии не только по чисто эндоскопическим ориентирам, но и по рентгенологическим: указанные рентгенологом патологически измененные бронхи (или бронхи, соответствующие пораженным сегментам) должны тщательно осматриваться с применением инструментальной пальпации.
Во время исследования могут быть выявлены явные и (или) косвенные признаки бронхогенного рака.
К числу явных признаков относятся:
• опухоль или бесформенные опухолевые разрастания в просвете бронха, а также симптомы пре- и микроинвазивного рака;
• опухолевая инфильтрация стенки бронха. Косвенные бронхоскопические признаки ЦРЛ:
• синдром «мертвого устья» (отсутствие смещения в устье сегментарного или субсегментарного бронха, капелек секрета и респираторной подвижности);
• ригидность стенки бронха, определяемая инструментальной пальпацией;
• респираторная неподвижность бронха;
• локальная гиперемия слизистой оболочки бронха в ограниченной зоне;
• стертость рисунка хрящевых колец;
• конвергенция складок слизистой оболочки бронха к месту поражения;
• застойный или обедненный сосудистый рисунок в локальной части ТБД;
• повышенная кровоточивость слизистой оболочки бронха;
• рыхлость слизистой оболочки бронха;
• перибронхиальный стеноз бронха.
Неотъемлемой частью ФБС является бронхоскопическая биопсия:
1) промывные воды бронха (малоэффективный и неинформативный метод, который применяется при отсутствии другого инструментария или в сочетании с другими видами биопсии, позволяет найти отдельные раковые клетки);
2) браш-биопсия (мазок капроновой щеткой) - используется при стенозе долевого, сегментарного и субсегментарного бронха без полной обтурации просвета, а также если щипцевая биопсия невыполнима или в сочетании с ней; материал размазывается по предметному стеклу и направляется на цитологическое исследование;
3) щипцевая биопсия (откусывание кусочка опухоли или слизистой оболочки бронха специальными щипцами) - наиболее эффективный вид биопсии при эндобронхиальном и смешанном раке, мазок-отпечаток на предметном стекле направляется на цитологическое исследование, а сам кусочек в пробирке - на гистологическое исследование.
Выбор биопсийной техники целиком определяется врачом-эндоскопистом. Обязательным является выполнение самой биопсии, причем не менее чем с 2-кратным взятием материала.
Дифференциально-тактический этап - сложная дифференциальная диагностика патологических процессов, схожих с РЛ, оценка стадии этого заболевания, выполнение инвазивных процедур.
В арсенале, как правило, имеются:
1) рентгеноскопия;
2) трансторакальная пункционная (аспирационная) биопсия;
3) бронхография;
4) КТ;
5) ФБС и ригидная бронхоскопия (РБС);
6) ангиография;
7) торакоскопия;
8) медиастиноскопия;
9) МРТ;
10) искусственный пневмоторакс;
11) диагностическая торакотомия.
Прочие упоминаемые в научной литературе методы (медиастиноскопия по Карленсу, парастернальная медиастинотомия, прескаленная биопсия) осуществимы в ограниченном числе специализированных учреждений. Обязательно учитываются клинические и лабораторные данные.
Рентгеноскопия (рентгенотелевизионное просвечивание) применяется для исключения сосудистой патологии корня легкого, так как нередко расширение и уплотнение корня вызываются не опухолью или увеличенными лимфатическими узлами, а аневризматически измененными легочными сосудами. Использовать данный метод до ФБС нецелесообразно, так как даже при обнаружении сосудистой патологии рентгеноскопия не позволяет полностью исключить ЦРЛ.
Трансторакальная пункционная биопсия (трансторакальная пункция - ТТП) производится в рентгенокабинете, оснащенном аппаратом с усилителем рентгеновского изображения. Применяется для верификации шаровидных образований легких, в том числе ПРЛ и солитарных метастазов. Общие правила выполнения такие же, как для плевральной пункции. Под визуальным рентгенотелевизионным контролем после местной анестезии длинную тонкую иглу с мандреном проводят до края патологического образования в паренхиме легкого. Мандрен извлекают, после чего производят аспирацию материала. Биоптат распределяют по предметному стеклу и направляют на цитологическое исследование. Возможные осложнения: пневмоторакс вследствие засасывания атмосферного воздуха или разрыва легочной буллы при эмфиземе легких; при неверной оценке противопоказаний и нарушении методики возможно ранение крупного сосуда или сердца. Метод применяется и в амбулаторных условиях.
Бронхография - метод искусственного контрастирования бронхиального дерева. Применяется после получения сомнительных рентгенотомографических и бронхоскопических данных для диагностики различных ХОЗЛ (доказательство «от обратного»: обнаружение на бронхограммах признаков деформирующего бронхита или бронхоэктатической болезни исключает ЦРЛ). До ФБС использование бронхографии нецелесообразно, так как в зоне нарушения легочной вентиляции при ЦРЛ развиваются хроническое воспаление и бронхоэктазии. При ПРЛ бронхография может быть использована в случае
отрицательного результата ТТП для получения картины стеноза или симптома «ампутации» бронха в опухоли, но окончательный диагноз устанавливают при торакотомии.
РБС применяется для чрезбронхиальной биопсии - пункция опухоли при перибронхиальном раке, а также пункция медиастинальных лимфатических узлов, когда необходимо установить гистологический вариант. Это более сложный метод, чем ФБС; выполнение РБС возможно только в стационарных условиях под наркозом.
Ангиография - контрастное исследование легочных сосудов - позволяет обнаружить такие же симптомы изменения сосудов, как бронхография: признаки поражения бронхов (неровность контуров, сужение просвета, полная обтурация за счет прорастания опухоли). Применяется в стационарных условиях и относительно редко; поскольку нужна ангиографическая приставка. Кроме того, с полной уверенностью дать заключение о злокачественности процесса по данным ангиографии нельзя.
Торакоскопия - эндоскопический метод, предназначенный для визуального изучения грудной полости. Если опухоль еще не достигает висцеральной плевры или уже прорастает париетальную плевру, применение торакоскопии бесполезно из-за недостижимости опухоли. Достоинством метода является возможность щипцевой биопсии плевры и легочной ткани, что чаще всего необходимо при диссеминированном очаговом поражении легких неясной природы (канцероматоз, множественные метастазы, милиарный туберкулез). Осложнения при торакоскопии те же, что и при ТТП. Этот метод исследования чаще используется в госпитальных условиях.
Медиастиноскопия - травматичный метод, приводящий к редким, но самым опасным осложнениям; по технической сложности сравним с хирургическим вмешательством. Используется для тотальной биопсии отдельных групп медиастинальных лимфатических узлов. Производится под наркозом, в стационаре.
МРТ по своим характеристикам незначительно (недостоверно) превосходит КТ и является методом выбора при наличии в медицинском учреждении компьютерного томографа или методом решения аналогичных дифференциально-диагностических задач при отсутствии указанной аппаратуры.
Диагностическая пункция плевральной полости: проводится при наличии выпота в плевральной полости, для определения его характера.
Искусственный пневмоторакс накладывают, если необходимо отличить патологическое образование грудной стенки от опухоли легкого. Картина изучается при рентгенографии легких, рентгенотелевизионном просвечивании или КТ.
Диагностическую торакотомию выполняют после применения всех методов исследования при негативных результатах обследования; она является окончательным диагностическим этапом.
Окончательный диагноз больного РЛ должен состоять из 3 частей:
1) основной диагноз, включающий форму, локализацию, морфоструктуру и стадию рака;
2) осложнения основного заболевания;
3) сопутствующие заболевания.
ДИАГНОСТИКА
Существуют 2 взаимосвязанных понятия: дифференциальная и интегративная (интегральная) диагностика.
Дифференциальная диагностика означает выбор одного диагноза из нескольких при схожих друг с другом заболеваниях - по наиболее характерным симптомам.
Дифференциальную диагностику ЦРЛ следует проводить с такими заболеваниями, как инфильтративный туберкулез, фибрознокавернозный туберкулез, пневмония, плеврит и эмпиема плевры, абсцесс легкого, бронхоэктатическая болезнь, поликистоз легких, инородные тела бронхов и бронхолитиаз, аденомы и карциноид бронхов, редкие доброкачественные опухоли бронхов; опухоли и кисты средостения - загрудинный зоб, невринома, лимфогранулематоз, в том числе легочно-средостенные формы, лимфомы, саркоидоз Бенье-Бека-Шауманна, туберкулезный бронхоаденит, злокачественные тимомы, кисты вилочковой железы, бронхогенные и энтерогенные кисты, целомическая киста перикарда, аневризма аорты и крупных ее стволов, аортосклероз, грыжи треугольников Ларрея и Бохдалека, липомы средостения, в том числе грудобрюшинные, опухоли органов (рак пищевода, трахеи и др.).
При ПРЛ, кроме перечисленного, необходимо помнить о метастазировании в легкое рака из других органов - молочной или предстательной желез, а также меланомы кожи и кишечника, сарком костей и мягких тканей, опухолей надпочечников, ЖКТ, хорионэпителиомы, семиномы яичка. Кроме того, важно помнить об опухолях
самой легочной ткани и ее аномалиях - аденоме, саркоме, невриноме, фиброме, гамартомах (хондроматозных, фиброматозных и сосудистых), туберкуломе, в том числе множественной, паразитарных кистах (эхинококк), ретенционных кистах, буллезной перестройке, гипоплазии легкого, артериовенозных свищах, lobus v. аzygos, лейомиоме пищевода и др.
Приходится дифференцировать ПРЛ с опухолями грудной стенки (как мягких тканей, так и ребер), добавочного XIII ребра, патологией диафрагмы, мезотелиомой плевры и другими заболеваниями, имитирующими атипичные формы РЛ.
Интегративная диагностика появилась в тот момент, когда количество широкодоступных методов исследований вышло за рамки 1-2 врачебных специальностей и возникла необходимость в комплексной оценке всех диагностических данных. Стало важным не только сплошное применение различных методов исследований каждому больному, но и определение рациональной последовательности их использования для получения адекватного результата всего обследования. Интегративная диагностика позволяет настолько углубиться в изучение патологических изменений, что в большинстве случаев ее результатом становится однозначный диагноз. На практике это означает последовательное накопление полезной диагностической информации - от исходного синдрома до достоверного диагноза. Этому способствует современное состояние рентгенологии, перешедшей от абстрактных понятий («тень», «затемнение») к конкретным рентгеноморфологическим описаниям («инфильтрация», «гиповентиляция», «патологическое образование» и др.), благодаря широкому использованию томографии.
Оба вида диагностики имеют общую основу и строятся на использовании лучевых и эндоскопических методов исследования при обязательном учете клинических данных.
ЛЕЧЕНИЕ
Лечение РЛ представляет собой сложную задачу. При РЛ применяются хирургический, лучевой, лекарственный методы и их комбинации.
Хирургический метод лечения РЛ наиболее радикальный и имеет почти 100-летнюю историю. В настоящее время хирургическую помощь больным РЛ может оказывать лишь лечебное учреждение с высоким уровнем предоперационной рентгенологической, эндо-
скопической, морфологической, лабораторной диагностики, а также имеющее возможности для проведения интенсивной терапии в послеоперационном периоде. Высокое техническое мастерство оперирующих хирургов, выполнение анестезиологического пособия, ведение послеоперационного периода требуют знания фундаментальных дисциплин - топографической анатомии, физиологии, трансфузиологии, фармакологии, биохимии и т.д.
Существует ряд противопоказаний к применению хирургического метода. Их можно подразделить на онкологические и соматические. Это - распространенность процесса на соседние органы и ткани, которые делают опухоль неудалимой; метастазы в отдаленные органы - печень, кости, головной мозг, в связи с чем операция становится нецелесообразной; низкие функциональные возможности сердечно-сосудистой и дыхательных систем, тяжелые сопутствующие заболевания внутренних органов, которые делают оперативное вмешательство непереносимым; отказ больных от оперативного вмешательства.
Возраст больных как таковой не является противопоказанием к операции, но в пожилом возрасте предпочтительнее экономная резекция легких; необходимо также тщательно готовить пациента к операции: корригировать изменения белкового, электролитного состава крови, сердечно-сосудистой и дыхательной систем. В послеоперационном периоде необходимо проводить профилактику пневмонии, тромбоэмболии и т.д. Переход опухоли на смежные органы некоторые хирурги рассматривают неоднозначно, подходя к лечению индивидуально. Так, при поражении возвратного нерва опухолевым процессом некоторые хирурги производят его иссечение. Прорастание в перикард, реберную стенку, диафрагму, полые вены, пищевод, аорту является показанием для комбинированных операций. И даже переход процесса по сосудам на предсердие - для опытного хирурга преодолимая преграда.
Выделяют операции радикальные, условно-радикальные и паллиативные. Радикальной считается такая операция, при которой в удаляемый комплекс входят все проявления опухолевого процесса - первичный очаг в пределах здоровых тканей, регионарные лимфатические узлы и клетчатка с путями метастазирования. Этот объем может быть выполнен при Т2г>Г0М0-Т3г>Г0М0. К условнорадикальной относят операции при стадии Т3?М0. Такие операции следует сопровождать дополнительной лучевой или лекарственной
 терапией.
Наконец, при паллиативной операции не все проявления опухоли могут быть
удалены. При удалении доли легкого метастатически измененные
лимфатические узлы могут остаться неудаленными в случае угрозы
кровотечения или наличия распада в ателектазе. Оперировать принято
больных с дифференцированными формами РЛ. В последнее время на ранних
стадиях МРЛ также проводится хирургическое лечение, которое достоверно
увеличивает продолжительность жизни больных.
терапией.
Наконец, при паллиативной операции не все проявления опухоли могут быть
удалены. При удалении доли легкого метастатически измененные
лимфатические узлы могут остаться неудаленными в случае угрозы
кровотечения или наличия распада в ателектазе. Оперировать принято
больных с дифференцированными формами РЛ. В последнее время на ранних
стадиях МРЛ также проводится хирургическое лечение, которое достоверно
увеличивает продолжительность жизни больных.
Объем оперативных вмешательств при РЛ разнообразен. Это пневмонэктомия - типичная, расширенная, комбинированная, лоббилобэктомия, лобэктомия (рис. 17.7) с циркулярной или клиновидной резекцией главного и промежуточного бронхов, сегментарная резекция при малом периферическом раке у пожилых больных.
Здесь необходимо остановиться на понятиях «операбельность» и «резектабельность». Операбельность - это состояние больных, когда имеется возможность выполнить оперативное вмешательство (не более 13-15 % от всех выявленных больных). Еще Б.Е. Петерсон указывал, что оперативному лечению может быть подвергнуто не более 9-12 % первично выявленных больных. Резектабельность - это такая хирургическая ситуация, когда можно выполнить радикальную операцию без причинения ущерба здоровью больного. Процент резектабельности редко превышает 80-90 %, но этот показатель зависит от отбора больных на операцию. Примерно у 25 % больных (от числа оперированных) выполняют пробную торакотомию. Опыт работы пульмонологических комиссий показал, что за счет активно выявленных больных с патологией легких операбельность можно повысить до 30-36 %.
Отдельной темой в резекции части легкого являются бронхопластические операции, при которых реализуется принцип либо циркулярной резекции бронха, либо клиновидной резекции практически к любой доле легкого, что позволяет выполнить частичную резекцию в случаях, когда классический способ оперирования ведет к неизбежной пневмонэктомии (рис. 17.8). Кроме того, пневмонэктомия с резекцией бифуркации трахеи, основанная на принципе бронхопластических операций, позволяет оперировать РЛ, ранее
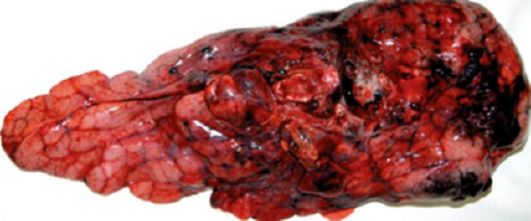
Рис. 17.7. Рак верхней доли левого легкого. Макропрепарат
 недоступный
хирургическому методу. Наряду с пластикой бронха возможны элементы
сосудистой пластики в виде циркулярной или клиновидной резекции легочной
артерии. Количество бронхопластических операций в крупнейших
хирургических клиниках России достигает 40 %
недоступный
хирургическому методу. Наряду с пластикой бронха возможны элементы
сосудистой пластики в виде циркулярной или клиновидной резекции легочной
артерии. Количество бронхопластических операций в крупнейших
хирургических клиниках России достигает 40 %
(Харченко В.П., 2002). Несмотря
Рис. 17.8. Состояние после пульмо-
на большую техническую слож-
J J ноэктомии слева. Рентгенограмма
ность этих операций, разработка
рациональных методов ведения послеоперационного периода (в частности, внедрение в практику эндоскопического мониторинга) позволила уменьшить число послеоперационных осложнений до уровня после обычных резекций легкого.
В настоящее время, по мнению некоторых авторов, при любой стадии РЛ необходимо максимально расширять объем резекции и сопровождать операцию тотальной медиастинальной лимфодиссекцией, так как приблизительно в 40 % лимфатических узлов, макроскопически не пораженных метастазами, выявляется метастатическое поражение (Давыдов М.И., 2002). Такой объем операции позволяет наиболее радикально удалить опухоль со всеми возможными регионарными метастазами, что, в свою очередь, увеличивает продолжительность жизни больного, особенно безрецидивную выживаемость, а также позволяет наиболее полно и точно стадировать опухолевый процесс для определения последующей тактики лечения.
Отдаленные результаты хирургического лечения РЛ целиком зависят от стадии рака. Весьма удовлетворительные результаты получены при операциях в I стадии процесса - более 5 лет живут почти 70 % больных. Причем гистологический тип рака не влияет на продолжительность жизни. При немелкоклеточном раке легкого (НМРЛ) II стадии 5-летняя выживаемость составляет 40 %, а при 1а стадии (без поражения метастазами удаленных лимфатических узлов) - 20 %. Комбинированное лечение при IIIB стадии существенно повышает 5-летнюю выживаемость.
Лучевое лечение больных РЛ применяется при неоперабельных формах, отказе пациента от операции, наличии абсолютных противопоказаний к оперативному вмешательству и дает лучший эффект
при недифференцированном и плоскоклеточном раке. Лучевая терапия может проводиться как радикальное или как паллиативное лечение - для снятия определенного симптома (например, боли, сдавления ВПВ и т.д). Радикальное лучевое лечение осуществляется с двух противоположных полей и включает опухоль и пути метастазирования, т.е. средостение. СОД составляет 60-70 Гр. Дозу подводят при условии ее обычного фракционирования (2 Гр в день, 5 дней в неделю); продолжительность курса - 6-7 нед. Возможно проведение курса в 2 этапа с 2-недельным перерывом (методика расщепленного курса), с СОД 30 Гр за каждый этап.
Химиотерапия РЛ
И сегодня РЛ относят к злокачественным опухолям с низкой чувствительностью к цитостатикам. Химиотерапия у больных РЛ применяется при III-IV стадии НМРЛ и является основным методом лечения больных МРЛ.
Химиотерапия НМРЛ
В настоящее время стандартом химиотерапии при НМРЛ считается применение комбинаций цитостатиков (этопозид, винорельбин, паклитаксел, доцетаксел, гемцитабин) с препаратами платины (цисплатин и карбоплатин).
IIIA стадия (T3N1M0, T1-2N2M0) и IIIB стадия (T4N1-2M0, T1-3N3M0) (операбельная). У операбельных больных с учетом плохого прогноза в отношении выживаемости возможно применение неоадъювантной химиотерапии. Данный метод лечения позволяет воздействовать на микрометастазы опухоли и улучшает отдаленные результаты лечения, а также при уменьшении первичной опухоли и лимфатических узлов, пораженных метастазами, повышает вероятность выполнения радикальной операции (R0). Некоторые исследования, проводившиеся для определения эффективности неоадъювантной химиотерапии в комбинированном лечении НМРЛ, не показали статистически значимого улучшения отдаленных результатов лечения. В них применялись такие схемы, как: СЕР (циклофосфамид, этопозид, цисплатин); PIM (MIP; цисплатин, ифосфамид, митомицин-С); в более поздних исследованиях использовались такие комбинации, как TC (карбоплатин, паклитаксел, циклофосфамид); PD (цисплатин, доцетаксел); GTP (гемцитабин, паклитаксел, цисплатин). В результате было показано улучшение отдаленных результатов
лечения и увеличение вероятности выполнения хирургического лечения в объеме R0 без статистически значимого увеличения частоты послеоперационных осложнений. Но некоторые авторы отмечают недостаточное в этих исследованиях количество пациентов для объективной оценки результатов неоадъювантной химиотерапии. Тем не менее, по сложившемуся мнению многих онкологов, неоадъювантная химиотерапия у операбельных больных НМРЛ целесообразна в случаях, когда возможность операции в объеме R0 под сомнением, или при наличии сопутствующей патологии, которая требует лечения, и по этой причине хирургическое вмешательство может быть отложено на время. При проведении предоперационной химиотерапии предпочтение следует отдавать более эффективным схемам, таким, как: цисплатин + гемцитабин, цисплатин + доцетаксел (2-3 курса).
Стадия IIIA (T3N1M0, T1-2N2M0) и стадия IIIB (T4N1-2M0, T1-3N3M0) (неоперабельная). У больных данной группы, которым не показана операция в связи с декомпенсированной сопутствующей патологией или по основному заболеванию (злокачественный плеврит, массивное двустороннее метастатическое поражение паратрахеальных и надключичных лимфатических узлов или прорастание в структуры средостения - пищевод, полые вены, аорту), химиотерапия может применяться как самостоятельный метод лечения и в качестве компонента комбинированной терапии в сочетании с лучевой. По данным рандомизированных исследований, отдаленные результаты комбинированного лечения (химиотерапия + лучевая терапия) статистически значимо лучше, чем только лучевого лечения. Применяются такие комбинации, как: цисплатин + этопозид, цисплатин (карбоплатин) + паклитаксел или доцетаксел, цисплатин + винорельбин, цисплатин + гемцитабин. В монорежиме могут применяться также гемцитабин, паклитаксел, доцетаксел, винорельбин.
IV стадия (любая T, любая N, M1). Химиотерапия у больных НМРЛ данной стадии является основным и единственным методом лечения, который достоверно позволяет увеличить продолжительность жизни и улучшить ее качество. В 1-й линии химиотерапии применяются комбинации на основе препаратов платины (цисплатин, карбоплатин) и этопозида, винорельбина, паклитаксела, гемцитабина. Данные схемы лечения показали большую эффективность, чем монотерапия, и меньшую, чем схемы, включающие 3 цитостатика и более (табл. 17.1). Химиотерапию у больных с распространенным
Таблица 17.1. Схемы химиотерапии НМРЛ
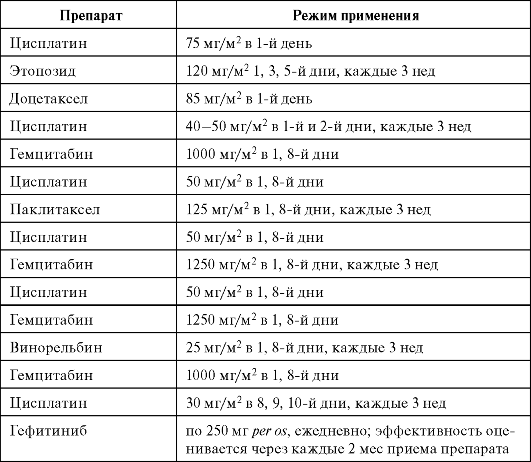 НМРЛ
следует начинать как можно раньше; длительность ее зависит от
результатов лечения и переносимости. Согласно практическим рекомендациям
ASCO, для лечения неоперабельных больных НМРЛ не следует проводить
более 8 курсов химиотерапии. Больные в хорошем состоянии, обладающие
первичной резистентностью к 1-й линии химиотерапии, могут достичь
частичной регрессии при проведении 2-й линии. Большие шансы на успешное
лечение у пациентов с объективным улучшением и длительным периодом до
прогрессирования. При неэффективности комбинаций на основе препаратов
платины возможно применение во 2-й линии химиотерапии доцетаксела в
монорежиме или ингибиторов рецептора эпидермального фактора роста
(EGFR). В настоящее время в России зарегистрированы 2 препарата из этой
группы: гефитиниб (иресса) и эрлотиниб (тарцева).
НМРЛ
следует начинать как можно раньше; длительность ее зависит от
результатов лечения и переносимости. Согласно практическим рекомендациям
ASCO, для лечения неоперабельных больных НМРЛ не следует проводить
более 8 курсов химиотерапии. Больные в хорошем состоянии, обладающие
первичной резистентностью к 1-й линии химиотерапии, могут достичь
частичной регрессии при проведении 2-й линии. Большие шансы на успешное
лечение у пациентов с объективным улучшением и длительным периодом до
прогрессирования. При неэффективности комбинаций на основе препаратов
платины возможно применение во 2-й линии химиотерапии доцетаксела в
монорежиме или ингибиторов рецептора эпидермального фактора роста
(EGFR). В настоящее время в России зарегистрированы 2 препарата из этой
группы: гефитиниб (иресса) и эрлотиниб (тарцева).
По данным проведенных рандомизированных исследований, таргетная терапия РЛ особенно эффективна у больных с аденокарциномой или бронхеолоальвеолярным раком, у никогда не куривших больных, у женщин и у представителей азиатской расы. Следует отметить, что ингибиторы рецептора EGFR не применяются у японцев, поскольку приводят к развитию у них неспецифического пневмонита. Гефитиниб во 2-й линии химиотерапии РЛ по эффективности соответствует доцетакселу, но его прием более удобен для пациента, так как имеет иной спектр токсичности и выпускается в таблетках для перорального ежедневного приема.
Эффективность проводимой химиотерапии оценивается по критериям RECIST перед каждым нечетным циклом химиотерапии (1, 3, 5, 7-й и т.д.); при прогрессировании заболевания проводят смену препаратов.
Химиотерапия МРЛ
Среди активных препаратов при МРЛ следует отметить такие, как циклофосфамид, доксорубицин, винкристин, цисплатин, карбоплатин, паклитаксел и доцетаксел, топотекан, иринотекан, этопозид. Их активность в монотерапии колеблется от 30 до 50 %. При комбинированной химиотерапии объективный эффект удается получить у 80-90 % пациентов, при этом полная ремиссия отмечается у 30-40 % больных.
Химиотерапия локализованного МРЛ
При локализованном МРЛ химиотерапию применяют в сочетании с дистанционной лучевой терапией. Используется схема ЕР, которая по сравнению с CAV характеризуется большим удобством при применении совместно с лучевой терапией, меньшей гематологической токсичностью и большим потенцирующим эффектом на облучение. Лучевую терапию начинают либо с 1-м курсом ПХТ (ранняя лучевая терапия) или с 3-4-м курсом (поздняя лучевая терапия).
Несмотря на высокую чувствительность к химиотерапии и лучевой терапии МРЛ, это заболевание часто рецидивирует; в таких случаях выбор препаратов для химиотерапии 2-й линии зависит от варианта ответа на 1-ю линию лечения, длительности безрецидивного промежутка и локализации метастатических очагов. Различают больных с «чувствительным» рецидивом МРЛ, т.е. имевших полный
или частичный эффект от 1-й линии химиотерапии в анамнезе и наличие прогрессирования не менее чем через 3 мес после окончания индукционной химиотерапии, а также пациентов с рефрактерным рецидивом, т.е. если прогрессирование заболевания отмечается в процессе 1-й линии химиотерапии или менее чем через 3 мес после ее окончания. Прогноз при заболевании особенно неблагоприятен для пациентов с рефрактерным рецидивом МРЛ; в этом случае медиана выживаемости после диагностики рецидива не превышает 3-4 мес. При «чувствительном» рецидиве можно повторно использовать схему лечения, на фоне которой выявлен эффект. При наличии рефрактерного рецидива целесообразно применение ранее не использовавшихся цитостатиков и (или) их комбинаций.
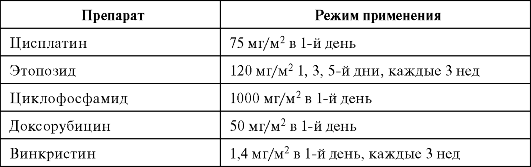
Химиотерапия распространенного МРЛ
Химиотерапия при распространенном МРЛ является основным методом лечения (табл. 17.2). Лучевая терапия проводится, как правило, на отдельные очаги поражения с симптоматической целью. В качестве 1-й линии химиотерапии применяется комбинация ЕР, 2-й - схема CAV. По данным ESMO (европейское общество медицинской онкологии), целесообразно проводить не более восьми курсов ПХТ каждой линии, дальнейшее увеличение количества курсов не продлевает жизнь, но при этом существенно возрастают количество и тяжесть гематологических осложнений. Аналогична позиция в отношении поддерживающей химиотерапии при МРЛ. Изучаются и новые схемы химиотерапии при МРЛ: доцетаксел + цисплатин, иринотекан + цисплатин, нимустин + этопозид + цисплатин, араноза + доксорубицин + винкристин, которые показывают более высокую терапевтическую активность при МРЛ.
Таблица 17.2. Схемы химиотерапии МРЛ
 Комбинированное
лечение РЛ увеличивает продолжительность жизни оперированных. Так, если
после хирургического лечения 5-летняя выживаемость больных составляет
25-27 % от числа оперированных, то при комбинации его с лучевым лечением
или химиотерапией этот показатель повышается до 35-37 %.
Комбинированное
лечение РЛ увеличивает продолжительность жизни оперированных. Так, если
после хирургического лечения 5-летняя выживаемость больных составляет
25-27 % от числа оперированных, то при комбинации его с лучевым лечением
или химиотерапией этот показатель повышается до 35-37 %.
Вариантов комбинаций много: предоперационная лучевая терапия и операция; химиотерапия и операция; операция с последующей лучевой или лекарственной терапией и т.д. (Чиссов В.И., 1989). Единого мнения о наиболее эффективном варианте комбинации нет, многое зависит от распространенности опухоли, ее гистологической формы, состояния больного и т.д. Так, комбинированное лечение РЛ с предоперационной лучевой терапией (режим среднего фракционирования дозы - 4 Гр за 5 дней) с последующей операцией (в первые 10 дней) имело статистически достоверное преимущество только перед хирургическим лечением при плоскоклеточном раке с метастазами в лимфатические узлы корня легкого и средостения (данные кооперированного исследования, 1986). При I-II стадиях этого преимущества не выявлено. Поиск вариантов комбинированного лечения РЛ продолжается (М.И. Давыдов, А.Х. Трахтенберг, В.П. Харченко, В.А. Порханов и др.).
Симптоматическое лечение. Применение симптоматического лечения ограничивается снятием какого-либо мучительного симптома: боли, кашля, высокой температуры, одышки, кровохарканья. Противоболевая терапия (анальгетики, блокады, наркотики, паллиативная лучевая терапия) становится особенно востребованной в условиях хосписов или кабинетов противоболевой терапии. Возможна также реканализация стенозированного просвета бронха.
ПРОФИЛАКТИКА
Профилактика онкологических заболеваний, и РЛ в частности, остается чрезвычайно актуальной проблемой.
Одним из важнейших элементов в профилактике онкологических заболеваний является рационально организованная среди населения противораковая пропаганда. От того, насколько широко и качественно она проводится, во многом зависят как ранняя диагностика, так и успех в лечении.
Противораковая пропаганда - это долг и служебная обязанность не только онколога, но и врача любой специальности. Ведущая роль
в организации противораковой пропаганды принадлежит онкологической службе, которая совместно с санитарно-просветительскими службами должна осуществлять организационно-методическое руководство этой работой в ЛПУ (как с населением обслуживаемой территории, так и с посетителями поликлиник, амбулаторий, стационарными больными).
Основной целью этой пропаганды являются повышение уровня знаний населения о злокачественных новообразованиях и мерах борьбы с ними, привитие соответствующих гигиенических навыков и привлечение к активному участию в противораковых мероприятиях.
Основные направления противораковой борьбы - профилактика, раннее выявление злокачественных опухолей, их эффективное лечение.
Профилактика онкологических заболеваний осуществляется путем лечения предопухолевых заболеваний (клиническая профилактика) и предупреждения воздействия на человека канцерогенных факторов (гигиеническая профилактика).
Гигиеническая профилактика (борьба с загрязнением окружающей среды канцерогенами, с вредными привычками) - предупреждение так называемых предопухолевых заболеваний, прогрессирование которых приводит к возникновению злокачественных новообразований. Сейчас уже не вызывает сомнения роль канцерогенных веществ в образовании опухолей. Известно, что злокачественные новообразования, как правило, не возникают в абсолютно здоровых тканях, этому предшествуют различные предопухолевые состояния, хронические процессы. От своевременного выявления и адекватного лечения предопухолевых процессов во многом зависит успех активной профилактики рака.
Многие предопухолевые заболевания у человека развиваются не только в результате длительного воздействия на организм канцерогенов (производственного происхождения, химических веществ, загрязняющих окружающую среду), но и при систематическом нарушении правил гигиены, под воздействием таких вредных для здоровья факторов (связанных с образом жизни, привычками людей), как длительное нарушение питания, пристрастие к алкоголю, курение и др.
Профилактика РЛ, являющегося наиболее частой локализацией злокачественных новообразований, может быть как личной (индивидуальной - отказ от курения табака), так и общественно-гигиенической (всеобщая борьба за чистоту атмосферного воздуха, окружающей
среды). Она также предусматривает создание условий, улучшающих гигиену дыхания, особенно при вредных факторах производства (асбестовая промышленность, запыленность рабочих мест и т.д.), оздоровление атмосферного воздуха загрязняющими его предприятиями.
Если попытаться расставить все вредные привычки по степени их коварства, «пальма первенства» останется за курением. Клиническая практика подтверждает, что из 100 больных РЛ более 90 были злостными курильщиками.
Исходя из того, что табакокурение приводит к преждевременной гибели каждого 4-го жителя РФ, профилактика распространения этой вредной привычки может строиться на следующих основных принципах:
• приоритетность предупредительных мер, направленных на предотвращение распространения и воздействия табакокурения в детском, подростковом возрасте и среди молодежи;
• политическая и финансовая поддержка деятельности структур и мероприятий, выполняющих миссию предотвращения распространения табакокурения;
• обеспечение государственного контроля за исполнением законодательных актов и совершенствованием правового регулирования в отношениях между курильщиками и остальной частью населения, между производителями и потребителями табачных изделий, торговыми организациями и населением;
• обеспечение лечебно-профилактической помощью всех желающих бросить курить;
• широкая информированность населения о вреде табакокурения как необходимое условие для социальной поддержки всеми слоями населения борьбы с табакокурением;
• межведомственное (межсекторальное) сотрудничество с учетом опыта международных организаций (ВОЗ, Международный противораковый союз и др.).
Важнейшим разделом профилактики являются формирование здорового образа жизни, воспитание у населения правильного (адекватного) отношения к своему здоровью.
Здоровый образ жизни - это форма жизнедеятельности, и не только здорового человека, но и больного. Профилактика онкологических заболеваний зависит прежде всего от мер, осуществляемых и соблюдаемых самим больным, от гигиенических знаний и своевременного
лечения заболеваний, длительное прогрессирование которых может привести к развитию злокачественной опухоли.
В борьбе за преодоление вредных привычек и против систематического невыполнения правил гигиены большая роль отводится санитарно-просветительной работе.
В пропаганде гигиенических знаний в области профилактики предопухолевых заболеваний могут быть использованы самые различные средства: популярная литература, лекции врачей и беседы средних медицинских работников, санитарные бюллетени, выступления врачей по радио и телевидению, радиожурналы, устные журналы, занятия в школах здоровья и др.
В системе производственно-технического обучения на промышленных предприятиях должны проводиться систематическая гигиеническая подготовка и воспитание рабочих и инженерно-технических работников, контактирующих с канцерогенными веществами.
ПРОГНОЗ
Судьба нелеченых больных РЛ всегда трагична: до 90 % погибают в первые 2 года с момента установления диагноза. Хирургическое лечение (некомбинированное) дает до 30 % 5-летнего выживания. При I стадии 5-летняя выживаемость составляет до 80 %, при II стадии - до 45 %, при III стадии - до 20 %. Лучевое или лекарственное лечение дает до 10 % 5-летнего выживания. Комбинированное лечение увеличивает 5-летнюю выживаемость до 40 %. Прогноз ухудшается при выявлении метастазов в регионарные лимфатические узлы. По данным American Cancer Society, общая 5-летняя выживаемость при раке легкого за период с 1996 по 2002 г. составила 16 %.
Вопросы для самоконтроля
1. Приведите показатели заболеваемости и смертности при РЛ.
2. Перечислите основные факторы, способствующие развитию РЛ.
3. Какие основные принципы профилактики РЛ?
4. Назовите основные патолого-анатомические признаки РЛ.
5. Перечислите основные пути метастазирования при РЛ.
6. Какие принципы положены в основу деления РЛ на стадии?
7. Какие признаки доминируют в клинической картине РЛ?
8. Назовите особенности клинического течения ЦРЛ и ПРЛ.
9. С какими заболеваниями необходимо проводить дифференциальную диагностику РЛ?
10. Дайте характеристику методов диагностики РЛ.
11. Перечислите основные рентгенологические признаки РЛ.
12. Оцените диагностические возможности КТ, бронхографии, трансторакальной пункции.
13. Охарактеризуйте возможности флюорографии в ранней диагностике РЛ.
14. Перечислите принципы лечения РЛ.
15. Как осуществляется выбор метода лечения РЛ в зависимости от локализации, стадии и гистологического строения опухоли?
16. Приведите схемы химиотерапии МРЛ и НМРЛ.
17. В чем заключаются принципы комбинированного и комплексного лечения РЛ?
18. Каков прогноз при РЛ?