Руководство по кардиологии : Учебное пособие в 3 т. / Под ред. Г.И. Сторожакова, А.А. Горбаченкова. - 2008. - Т. 1. - 672 с. : ил.
|
|
|
|
ГЛАВА 16 ОСТРЫЙ КОРОНАРНЫЙ СИНДРОМ БЕЗ ПОДЪЕМОВ СЕГМЕНТА ST НА ЭКГ
Острый коронарный синдром (ОКС) - общее обозначение для инфаркта миокарда (ИМ) с зубцом Q (крупноочагового), ИМ без зубца Q (мелкоочагового), нестабильной стенокардии. Основания для объе-динения этих состояний - общий патогенетический механизм - тромбоз (тромботическая окклюзия) коронарной артерии. Общий термин потребовался, когда выяснилось, что решение о характере лечебного вмешательства необходимо принимать тогда, когда еще невозможно определить конкретную форму обострения коронарной болезни сердца. Выбор терапии осуществляется на основании состояния сегмента ST на ЭКГ - при ОКС с подъемами ST показано применение экстренного лечения, направленного на реканализации коронарной артерии, при ОКС без подъемов сегмента ST оно не показано. Риск смерти или развития крупноочагового ИМ у больных, состояние которых отвечает критериям ОКС без подъемов ST, может быть различным и наиболее высок у больных с повышенными уровнями маркеров некроза миокарда (сердечных тропонинов Т или I), т.е. у больных с ИМ без подъемов сегмента ST. Кроме определения уровней маркеров некроза, для характеристики риска используются обычные клинические и демографические показатели (возраст, наличие депрессий ST на ЭКГ, наличие повторных приступов ишемии, признаков сердечной недостаточности, аритмий и т.д.). Антитромботическая терапия ОКС обязательно должна включать в себя антитромбоцитарный агент (аспирин) и гепарин (нефракционированный - НФГ - в виде внутривенной инфузии под контролем определения активированного частичного тромбопластинового времени или низкомолекулярный - НМГ - подкожно). Длительность терапии гепарином у конкретного больного зависит от риска смерти или ИМ: при низком риске этих событий она может быть прекращена через 8-12 ч, при высоком - должна продолжаться до 5 (НФГ) или 8 (НМГ) суток. При непереносимости аспирина необходимо применить антитромбоцитарный препарат из группы тиенопиридинов - клопидогрель. У больных высокого риска следует использовать комбинацию клопидогреля и аспи-
рина. После стабилизации состояния больных целесообразно выполнение ангиографии коронарных артерий с последующей процедуройреваскуляризации миокарда - или чрескожным вмешательством (баллонная ангиопластика, имплантация стента) или операции коронарного шунтирования. Если у больного высокого риска не удается стабилизировать состояние медикаментозными средствами, желательно выполнение экстренного чрескожного вмешательства на фоне многокомпонентной антитромботической терапии (аспирин + клопидогрель + ингибитор гликопротеинов IIb/IIIa + препарат гепарина). В период госпитализации по поводу ОКС следует начать меры вторичной профилактики, в частности применение статинов. Прием аспирина должен продолжаться неопределенно долго, клопидогреля - в зависимости от риска осложнений и характера инвазивной процедуры (если она была выполнена).
Ключевые слова: лечение; коронарная болезнь сердца; острый коронарный синдром; нестабильная стенокардия; аспирин, гепарин нефракционированный; вторичная профилактика.
понятие острый коронарный синдром и некоторые определения
Коронарная болезнь сердца (КБС), как и всякое хроническое заболевание, протекает с периодами стабильного течения и обострений. Период обострения КБС обозначают как острый коронарный синдром. Этим термином объединяют такие клинические состояния, как ИМ (включая инфаркт без зубца Q, мелкоочаговый, микро- и т.д.) и нестабильную стенокардию. Нестабильная стенокардия и ИМ являются разными клиническими проявлениями единого пато-
физиологического процесса, а именно тромбоза различной степени выраженности над надрывом атеросклеротической бляшки или реже на эрозии эндотелия коронарной артерии, и последующих дистальных тромбоэмболий.
Эксперты Всероссийского научного общества кардиологов (ВНОК) дали следующие определения острого коронарного синдрома и нестабильной стенокардии (2001 г.). Острый коронарный синдром (ОКС) - термин, обозначающий любую группу клинических признаков или симптомов, позволяющих подозревать острый инфаркт миокарда (ОИМ) или нестабильную стенокардию. Включает в себя понятия ОИМ, инфаркт миокарда с подъемами ST (ИМП ST), инфаркт миокарда без подъемов ST (ИМБП ST), инфаркт миокарда, диагностированный по изменениям ферментов, по биомаркерам, по поздним ЭКГ признакам, и нестабильную стенокардию (НС). Нестабильная стенокардия - острый процесс ишемии миокарда, тяжесть и продолжительность которого недостаточны для развития некроза миокарда. Обычно на ЭКГ нет подъемов ST. Отсутствует выброс в кровоток биомаркеров некроза миокарда в количествах, достаточных для диагноза ИМ.
Термин ОКС был введен в клиническую практику, когда выяснилось, что вопрос о применении некоторых активных методов лечения, в частности тромболитической терапии, должен решаться быстро до окончательного диагноза наличия или отсутствия крупноочагового инфаркта миокарда. Кроме того, установлено, что характер необходимого экстренного вмешательства определяется положением сегмента ST относительно изоэлектрической линии на ЭКГ - при смещениях сегмента ST вверх (подъемах ST) эффективна и, соответственно, показана тромболитическая терапия. При отсутствии подъемов сегмента ST эта терапия неэффективна. Данные, на основании которых были сделаны эти заключения, представлены на рис. 16.1 и 16.2. Терминология, которая используется при ОКС, представлена на рис. 16.3.
Подъемы сегмента ST - как правило, следствие трансмуральной ишемии миокарда и возникают при наличии полной тромботической окклюзии (закупорки, блокады) одной из магистральных коронарных артерий. Другие изменения конечной части желудочкового комплекса (депрессии ST, изменения зубца Т) обычно наблюдаются при неполной окклюзии коронарной артерии пристеночным тромбом.
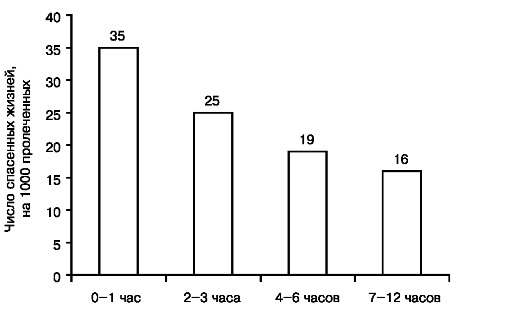 Рис. 16.1. Обоснование
целесообразности применения термина ОКС. Результаты тромболитической
терапии ОИМ в зависимости от времени начала приступа
Рис. 16.1. Обоснование
целесообразности применения термина ОКС. Результаты тромболитической
терапии ОИМ в зависимости от времени начала приступа
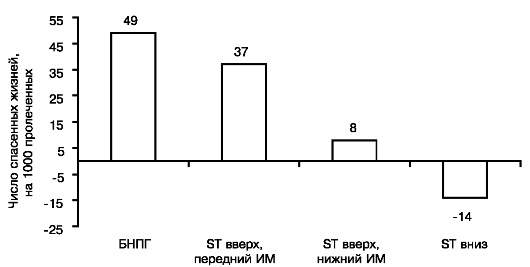 Рис. 16.2. Обоснование
целесообразности применения термина ОКС. Результаты тромболитической
терапии ОИМ в зависимости от направления смещений ST на исходной ЭКГ
Рис. 16.2. Обоснование
целесообразности применения термина ОКС. Результаты тромболитической
терапии ОИМ в зависимости от направления смещений ST на исходной ЭКГ
У больных без подъемов сегмента ST не полностью окклюзирующий тромб может быть источником эмболий в дистальное сосудистое русло мышцы сердца. Эмболизация микрососудов миокарда приводит к образованию мелких очагов некроза, возникновение которых сопровождается появлением в крови так называемых маркеров некроза (или повышением их уровней, если вещество в низ-
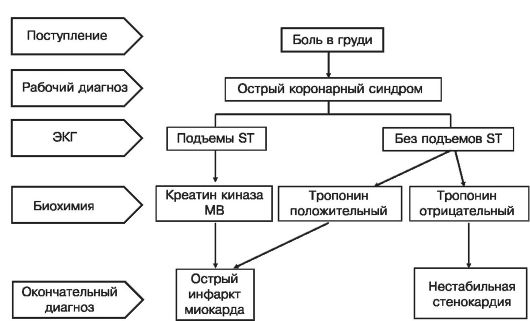 Рис. 16.3. Терминология при острых коронарных синдромах Коронарная артерия, пораженная атеросклерозом
Рис. 16.3. Терминология при острых коронарных синдромах Коронарная артерия, пораженная атеросклерозом
Воспаление
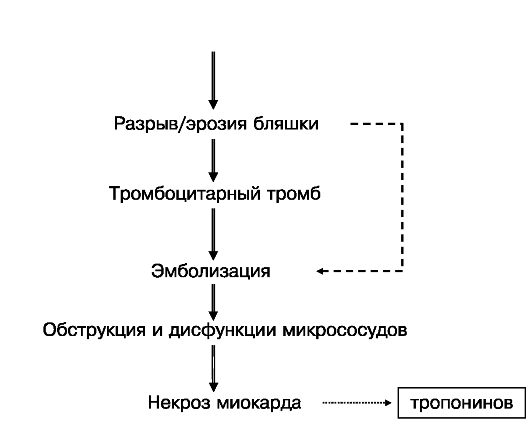 Рис. 16.4. Схема патогенеза острых коронарных синдромов, подчеркивающая важность дистальных эмболий
Рис. 16.4. Схема патогенеза острых коронарных синдромов, подчеркивающая важность дистальных эмболий
ких концентрациях обнаруживается у здорового человека) (рис. 16.4). Согласно современным представлениям, любой диагностируемый некроз сердечной мышцы обозначается как инфаркт миокарда. Соответственно, развившееся состояние обозначается как инфаркт миокарда без подъемов ST, которое следующим образом определено экспертами ВНОК: инфаркт миокарда без подъемов сегмента ST (ИМБП ST) - острый процесс ишемии миокарда достаточной тяжести и продолжительности, чтобы вызвать некроз миокарда; на начальной (ных) ЭКГ нет подъемов ST. У большинства больных, у которых болезнь начинается как ИМБП ST, не появляются зубцы Q и в конце концов диагностируется ИМ без Q. ИМБП STотличается от НС наличием (повышением уровней) маркеров некроза миокарда.
Выделение ИМБП ST стало возможным в связи с широким внедрением в клиническую практику определения сердечных тропонинов. Больные с ОКС без подъемов ST с повышенным уровнем сердечных тропонинов (т.е. больные с ИМБП ST) имеют худший прогноз (более высокий риск) и требуют более активных лечения и наблюдения. Термин ИМБП ST используется для «маркировки» больного на протяжении непродолжительного времени, пока не выяснится окончательно, не развился ли у него крупноочаговый инфаркт миокарда или процесс ограничился возникновением инфаркта миокарда без зубца Q. Выделение ИМБП ST без определения тропонинов на основании других, менее чувствительных маркеров, в частности МВ КФК, возможно, но приводит к выявлению только части больных с очагами некроза в миокарде и, следовательно, высоким риском. Так как для быстрого разграничения внутри ОКС без подъемов ST инфаркта миокарда БП ST и нестабильной стенокардии требуется определение уровней сердечных тропонинов, условия для широкого внедрения в клиническую практику понятия ИМБП ST еще отсутствуют. Поэтому вследствие сложившейся традиции термины «острый коронарный синдром без подъемов ST» и «нестабильная стенокардия» могут употребляться как взаимозаменяемые.
Острый коронарный синдром - термин, обозначающий группу клинических признаков или симптомов, позволяющих подозревать острый ИМ или нестабильную стенокардию.
острый коронарный синдром с подъемами и без подъемов сегмента ST
Так как у больного с явным обострением КБС от наличия или отсутствия подъемов сегмента ST зависит выбор основного метода лечения, то с практической точки зрения стало целесообразным при первом контакте врача с больным, у которого имеется подозрение на развитие острого коронарного синдрома, применение следующих диагностических маркировок (выделение следующих форм острого коронарного синдрома): «острый коронарный синдром с подъемами сегмента ST» и «острый коронарный синдром без подъемов сегмента ST». В рекомендациях Всероссийского научного общества кардиологов (2001 г.) по лечению больных острым коронарным синдромом без подъемов сегмента ST содержатся следующие определения (характеристики) этих форм (вариантов) острого коронарного синдрома.
Острый коронарный синдром с подъемами сегмента ST. Это больные с наличием боли или других неприятных ощущений (дискомфорта) в грудной клетке и стойкими подъемами сегмента ST или «новой» (впервые возникшей или предположительно впервые возникшей) блокадой левой ножки пучка Гиса на ЭКГ. Стойкие подъемы сегмента ST отражают наличие острой полной окклюзии коронарной артерии. Целью лечения в данной ситуации является быстрое и стойкое восстановление просвета сосуда. Для этого используются тромболитические агенты (при отсутствии противопоказаний) или прямая ангиопластика (при наличии технических возможностей).
Острый коронарный синдром без подъемов сегмента ST. Больные с наличием боли в грудной клетке и изменениями на ЭКГ, свидетельствующими об острой ишемии миокарда, но без подъемов сегмента ST. У этих больных могут отмечаться стойкие или преходящие депрессии ST, инверсия, сглаженность или псевдонормализация зубца Т. ЭКГ при поступлении бывает и нормальной. Стратегия ведения таких больных заключается в устранении ишемии и симптомов, наблюдении с повторными (серийными) регистрациями электрокардиограмм и определением маркеров некроза миокарда (сердечных тропонинов и/или МВ-КФК). В лечении таких больных тромболитические агенты неэффективны и не используются. Лечебная тактика зависит от степени риска (тяжести состояния) больного.
Подъемы сегмента ST, как правило, являются следствием трансмуральной ишемии миокарда и возникают при полной тромботической окклюзии одной из магистральных коронарных артерий. Другие измененеия конечной части желудочкового комплекса (депрессия ST, изменения зубца Т) обычно наблюдаются при неполной коронарной окклюзии пристеночным тромбом.
О соотношении диагностических терминов «инфаркт миокарда», «нестабильная стенокардия» и термина «острый коронарный синдром»
Термин «острый коронарный синдром» используется в момент принятия решения о методе лечения экстренно поступившего больного, когда диагностическая информация еще недостаточна для окончательного суждения о наличии или отсутствии очагов некроза в миокарде. У больного с клинической картиной, заставляющей подозревать развитие острого коронарного синдрома, лечебная тактика зависит от обнаруженных изменений ЭКГ - при смещениях ST вверх от изоэлектрической линии показано введение тромболитических средств (или экстренное ЧКВ). Соответственно, острый коронарный синдром - это рабочий диагноз в первые часы и сутки заболевания, а привычные понятия ИМ и нестабильная стенокардия сохраняются для использования при формулировании окончательного диагноза. Причем ИМ в зависимости от ЭКГ картины, пиковой активности ферментов и/или данных методов, регистрирующих движения стенки сердца, может быть крупноочаговым, мелкоочаговым, c Q, без Q и т.д. Когда и какой термин следует использовать, поясняет схема на рис. 16.3 (по C.W. Hamm, M. Bertrand и E. Braunwald).
этиопатогенез острого коронарного синдрома
Дефекты поверхности, разрывы бляшек, тромбоз - обязательные атрибуты острого коронарного синдрома.
Результаты посмертного исследования коронарных сосудов, прижизненной ангиографии через разные промежутки времени после возникновения острого состояния, изучения биоптатов, полученных при направленной атеректомии, и особенно данные ангиоскопии
показали, что при остром коронарном синдроме БП ST практически всегда имеется тромбоз коронарной артерии. Этот факт наряду с результатами противотромботической терапии позволяет считать, что тромбоз - основной фактор, ведущий к развитию синдрома.
В патоморфологических исследованиях людей, умерших от инфаркта миокарда или при явлениях нестабильной стенокардии, продемонстрировано, что тромб коронарной артерии, как правило (хотя есть и значительная доля исключений), располагается над разрывом (трещиной, дефектом) атеросклеротической бляшки различной глубины. Во многих случаях он проникает в разрыв, внутрь бляшки, приводя к увеличению ее размеров.
Поверхность непрочного тромбоцитарного тромба является источником микроэмболий. В мелких сосудах мышцы сердца у людей, умерших после периода нестабильной стенокардии, но не от крупноочагового инфаркта миокарда, обнаруживаются тромбоцитарные агрегаты - эмболы, и в соответствующих участках сердечной мышцы находят очаги некроза. Таким образом, при ОКС БП ST в миокарде часто имеется некроз, что и объясняет повышение в крови уровней его чувствительных биомаркеров - сердечных тропонинов Т и I.
Очевидно, процессы, способствующие разрывам, и являются причинными факторами острых коронарных синдромов.
Надрывы, дефекты поверхности бляшки - почти обязательное (необходимое), хотя и недостаточное условие развития тромбоза, вызывающего симптомы острой коронарной недостаточности.
Некоторые сведения о строении атеросклеротической бляшки
Атеросклеротическая бляшка обычно состоит из богатого липидами ядра, расположенного в центре эксцентрично утолщенной интимы. Липидное ядро ограничено фиброзной капсулой. Часть бляшки, обращенную к просвету сосуда, называют покрышкой; обращенную к стенке сосуда - основанием. Края покрышки бляшки, граничащие со «здоровой» стенкой сосуда, принято называть плечевой областью. Плечевые области - обычно самая тонкая часть оболочки бляшки. Кроме того, именно здесь бляшка подвергается наибольшей нагрузке при сжатии и растяжении стенки во время изменений диаметра сосуда - например, при колебаниях объема кровотока, спазме.
Ядро бляшки содержит липиды - свободный внеклеточный холестерин (в виде кристаллов) и его эфиры. В нем находятся также и пенистые клетки - наполненные липидами макрофаги, производные лимфоцитов крови - которые расположены по периферии ядра. Макрофаги постоянно разрушаются, и содержащиеся в них жиры, а также остатки клеток добавляются к липидному ядру бляшки, своеобразной массе - кашице (gruel), напоминающей зубную пасту. Находят в ядре и продукты распада внеклеточного матрикса (коллагена).
Содержимое ядра бляшки чрезвычайно тромбогенно. Пенистые клетки способны выделять большие количества тканевого фактора - мощного прокоагулянта, который при контакте с кровью стимулирует тромбообразование. Кроме того, тромбогенны и находящиеся в ядре фрагменты коллагена.
Стабильность атеросклеротической бляшки, ее прочность, устойчивость к внешним и внутренним воздействиям, определяется состоянием (целостностью) фиброзной капсулы, отделяющей богатое липидами тромбогенное ядро от крови, т.е. покрышки бляшки. Устойчивость покрышки, в свою очередь, зависит от состояния ее внеклеточного матрикса (соединительной ткани). Основные белковые составляющие (макромолекулы) этого внеклеточного матрикса, ответственные за устойчивость покрышки к разрыву, - коллагены и эластин. Наибольшее значение имеет коллаген. Указанные макромолекулы синтезируются сосудистыми гладкомышечными клетками. Таким образом, гладкомышечные клетки во многом ответственны за стабильность капсулы бляшки.
«Ранимые» бляшки
Бляшки, по своим свойствам более предрасположенные к разрыву, принято называть «ранимыми». Они отличаются относительно большим липидным ядром и тонкой покрышкой. Основная причина «ранимости» бляшек по P. Libby [П. Либби] - то, что «в их капсуле (наружной покрышке) снижен синтез коллагена и повышено его разрушение».
Наряду с преобладанием липидного ядра, истончением капсулы и изменением количества в ней коллагена, к факторам, от которых зависит подверженность бляшки разрыву, относят механическую «усталость» ее фиброзной оболочки. «Усталость» (fatigue) - резуль-
тат длительного циклического напряжения. Под влиянием огромного числа периодов растяжения и сжатия (сгибания - разгибания у мест разветвлений или изгибов сосуда) структуры бляшки ослабевают и могут разорваться в любой момент без какого-либо стимулатриггера» (Г.В.З. Борн).
Еще одним фактором, ослабляющим капсулу, является воспаление внутри бляшки, сопровождающееся инфильтрацией ее покрышки макрофагами.
Воспаление бляшки и ее роль в происхождении нестабильной стенокардии
Воспалительная реакция признается одним из наиболее вероятных механизмов, способствующих ослаблению капсулы бляшки и последующему ее разрыву. Основанием для такого положения явились данные патоморфологических исследований, согласно которым фиброзная покрышка (наружная оболочка) атеросклеротических бляшек с разрывом и тромбом (как правило, присутствующими у больных, погибших от острых коронарных синдромов) обычно инфильтрирована макрофагальными пенистыми клетками. Гистологическое изучение бляшек, ответственных за развитие ОИМ, обнаружило преобладание Т-лимфоцитов и макрофагов именно в местах поверхностных эрозий и разрывов бляшек, причем активированные макрофаги располагались непосредственно под тромбом [К. ван дер Валь и соавт.].
То, что инфильтрация воспалительными клетками (макрофагами) является отличительной чертой атеросклеротических бляшек, находящихся в стенозах-«виновниках» (стенозах, ответственных за обострение) больных острыми коронарными синдромами, продемонстрировано на материале, полученном при направленной атеректомии (С.Л. Шарма и соавт.). Изучение биоптатов, взятых из разных бляшек у одного и того же больного, показало, что бляшки-«виновники» характеризовались большим содержанием воспалительных и пенистых клеток, холестерина и наличием тромбоза. Продемонстрирована и зависимость между присутствием в биоптате макрофагов и наличием в нем тромба, причем наиболее тесной эта связь была у больных с приступами стенокардии покоя и постинфарктной стенокардией. Тесная связь отмечена и между наличием воспалительной реакции и содержанием жиров в бляшке.
Наиболее очевидный стимул к активации макрофагов и Т-лимфоцитов в атеросклеротической бляшке - измененные, окисленные формы липопротеинов низкой плотности (А.М. Фогельман). Косвенные подтверждения этому были получены также при анализе атеректомических биоптатов. У больных с рефрактерной нестабильной, по сравнению с больными со стабильной, стенокардией количество Т-клеток на 1 мм2 было достоверно большим (более чем в 2 раза). Значительно большим было у них и число проб, в которых Т-клетки образовывали скопления-кластеры вокруг участков накопления цероидного пигмента - конечного продукта окисления липидов.
Хронически активированные Т-клетки, находящиеся внутри атеросклеротической бляшки, продуцируют цитокины, в частности γ-интерферон. Этот воспалительный цитокин уменьшает способность гладкомышечных клеток человека к экспрессии гена коллагена. Таким образом, через γ-интерферон воспалительные клетки способны угнетать синтез коллагена в ранимых областях фиброзной покрышки (капсулы) бляшки. Кроме торможения экспрессии гена коллагена гладкомышечными клетками, гамма интерферон подавляет и их пролиферацию. Согласно П. Либби, «Ингибирование пролиферации гладких мышц сосудов у больных может оказывать действие, дестабилизирующее потенциально ранимые области атеросклеротических бляшек».
Не все полученные к настоящему времени данные укладываются в наиболее популярную сейчас схему: богатая липидами бляшка - воспаление - обедненная гладкомышечными клетками тонкая покрышка - разрыв капсулы - тромбоз. В некоторых исследованиях основным отличием бляшек, вероятно ответственных за развитие нестабильной стенокардии, была гиперплазия интимы. Очевидно, по крайней мере у части больных, причиной развития острого коронарного синдрома может быть пролиферация гладкомышечных клеток, приводящая к увеличению степени стенозирования коронарной артерии.
Ферменты, разрушающие покрышку бляшки
Кроме нарушенного синтеза коллагена, к ослаблению фиброзной капсулы ведет повышенное разрушение коллагена и других компонентов матрикса (соединительной ткани). Существуют ферменты металлопротеиназы (коллагеназа, желатиназы, стромелизин), участ-
вующие в катаболизме - растворении, разрушении соединительной ткани. Считается, что они способствуют миграции клеток через матрикс, что важно для нормального заживления ран. В обычных условиях активность этих ферментов тормозится специальными ингибиторами, в комплексе с которыми существуют металлопротеиназы.
Выработку гладкомышечными клетками интерстициальной коллагеназы (желатиназы В) и стромелизина индуцируют воспалительные цитокины (интерлейкин-1, фактор некроза опухолей). Продукция же ингибиторов металлопротеиназ при этом не меняется, и, таким образом, баланс смещается в сторону веществ, разрушающих составляющие экстрацеллюлярного матрикса артерии.
В областях бляшки, подверженных разрыву, гладкомышечных клеток обычно мало, но много макрофагов и Т-лимфоцитов. В бляшках и эти клетки способны выделять (экспрессировать) ферменты, разрушающие соединительную ткань.
Таким образом, в атеросклеротических бляшках повышена активность ферментов, способных разрушать элементы их капсулы, и наиболее очевидным источником этих ферментов являются макрофаги.
Общие (системные) признаки воспаления
У больных острыми коронарными синдромами, в частности нестабильной стенокардией, в системном кровотоке обнаружены признаки воспаления - повышение уровней так называемых маркеров воспаления или реактантов острой фазы - С-реактивного протеина, амилоида А, фибриногена. Причем повышение уровня С-реактивного белка не может быть объяснено наличием некроза миокарда, так как наблюдалось у больных с нормальным содержанием в крови креатинкиназы и тропонина Т.
При острой нестабильной стенокардии обнаруживаются признаки системной активации лимфоцитов и моноцитов, которые отсутствуют у больных стабильной стенокардией, а у больных нестабильной стенокардией уже не определяются при повторном обследовании через 8-12 недель. Кроме того, выявлен параллелизм между активацией лимфоцитов и моноцитов (оцененной по их способности к экспрессии активности, подобной активности тканевого фактора) и активацией свертывающей системы крови по данным определения фибринопептида А (маркера тромбинемии). Предполагается, что повышенное образование тромбина при нестабильной стенокардии
как раз и обусловлено экспрессией тканевого фактора моноцитами (Г.Г. Нери-Сернери и соавт.).
Механизмы запуска (триггеры) системной воспалительной реакции при острых коронарых синдромах неизвестны. Неясно, действует ли стимул к активации лимфоцитов системно (в системном кровотоке) или только на лимфоциты в бляшке. В самой бляшке провоспалительным действием обладают, как это уже было отмечено, окисленные липопротеины низкой плотности. Предполагается, что инициаторами воспалительной реакции могут быть вирусная или бактериальная инфекция или аутоиммунный процесс, но, с другой стороны, не исключено, что она являются только следствием тромбоза и атеросклероза.
Следствия разрыва бляшки
Самого по себе разрыва бляшки недостаточно для возникновения острого коронарного синдрома. Напротив, большинство разрывов бессимптомно, и при обследовании погибших от некардиальных причин обычно обнаруживается несколько бляшек с нарушенной капсулой-покрышкой. Образуется ли тромб, существенно ограничивающий кровоток по артерии и обусловливающий клинику нестабильной стенокардии, зависит от многих факторов - скорости кровотока по сосуду, соотношения в момент разрыва между активностью систем свертывания и фибринолиза, состояния тромбоцитов.
После нарушения целостности эндотелия и разрыва оболочки бляшки происходит контакт субэндотелиальных структур (в частности, коллагена) и содержимого бляшки с протекающей кровью. Наиболее вероятным компонентом, ответственным за высокую тромбогенность содержимого бляшки, является тканевой фактор. Тканевой фактор синтезируется нагруженными липидами пенистыми макрофагами и освобождается после их разрушения.
К дефекту эндотелия (области надрыва бляшки) тотчас же прилипают тромбоциты. Это происходит благодаря взаимодействию гликопротеинов мембраны тромбоцитов (Ib) с адгезивными белками, имеющимися в субэндотелиальных структурах (см. ниже). После прилипания к стенке сосуда (адгезии) тромбоцит активируется и освобождает (выделяет) содержимое своих гранул, в частности аденозин дифосфат (АДФ). Кроме того, тромбоциты образуют тромбоксан А2 и способствуют образованию тромбина.
Гиперкоагуляция - повышенная продукция тромбина
Чтобы в момент разрыва бляшки образовался тромб, существенно нарушающий кровоток (в степени, достаточной для возникновения клинических проявлений острого коронарного синдрома), требуется второе условие - состояние гиперкоагуляции - повышение свертывающего потенциала крови наряду с активацией тромбоцитов. Косвенные признаки повышения активности системы свертывания крови при нестабильной стенокардии - увеличение содержания в крови фибринопептида А, комплексов тромбин-антитромбин и продуктов распада фибрина-фибриногена продемонстрированы довольно давно. Все эти показатели характеризуют активность тромбина и, как считается, отражают наличие текущего коронарного тромбоза.
У больных нестабильной стенокардией, хотя и не у всех, значительно повышено содержание в плазме крови фибринопептида А и фрагмента протромбина 1+2. Фибринопептид А - пептид, отщепляющийся от фибриногена во время его превращения в фибрин под влиянием тромбина; фрагмент протромбина 1+2 (F1+2) - полипептид, отщепляющийся от протромбина во время его превращения в тромбин, F1+2 отражает активность фактора Х и характеризует процесс образования тромбина. Через 6 мес у стабилизированных больных содержание в плазме крови фрагмента протромбина 1+2 остается на том же уровне, что и в остром периоде, тогда как содержание фибринопептида А нормализуется (П.А. Мерлини и соавт.). Таким образом, у больных сохраняется повышенное образование тромбина, но этого недостаточно для возникновения тромбоза при восстановившейся поверхности сосуда. Можно предполагать, что такой же ситуация была и непосредственно перед началом периода нестабильности (перед разрывом бляшки).
Ключевую роль тромбина в образовании артериального тромба обычно демонстрируют при помощи следующего факта (Дж.Х. Чизборо и соавт.). На модели артериального тромбоза, вызываемого глубоким повреждением бедренной артерии, специфические ингибиторы тромбина (гирудин, аргатробан), не оказывающие влияния на медиаторы агрегации тромбоцитов (тромбоксан, серотонин, АДФ или коллаген), полностью предупреждали образование пристеночного тромба и значительно уменьшали отложения тромбоцитов (до одного слоя или меньше). Антитромбоцитарные агенты - специфические ингибиторы рецепторов к тромбоксану А2 и серотонину - на
образование артериального тромба в этой же модели не оказывали значимого влияния.
Тромбоксан, серотонин, АДФ синтезируются и секретируются тромбоцитом уже после его первичной активации тромбином и/или коллагеном. Тромбин наиболее активный из известных агонистов агрегации тромбоцитов.
Существует точка зрения, согласно которой системная тромбинемия не может быть объяснена только наличием сравнительно небольшого тромба в коронарной артерии. При остром коронарном синдроме уровень тромбинемии по косвенным признакам, например по содержанию комплекса тромбин-антитромбин, повышен в такой же степени, как при массивном венозном тромбозе (Л.М. Биазуччи и соавт.). Одно из объяснений повышенного образования тромбина при острых коронарных синдромах (предшествующего их развитию) приведено ранее - системная активация нейтрофилов и моноцитов, которые способны генерировать тканевой фактор в связи с воспалением.
Реакция тромбоцитов на повреждение поверхности атеросклеротической бляшки
Сведения о механизмах реакции тромбоцитов здесь излагаются в основном по Б.С. Коллер.
Повреждение поверхности атеросклеротической бляшки как нормальной стенки сосуда, приводит к обнажению адгезивных белков - гликопротеинов, таких, как фактор фон Виллебранда, коллаген, фибронектин и ламинин. В мембранах тромбоцитов имеются гликопротеины-рецепторы, которые способны взаимодействовать с протеинами субэндотелия. Большинство этих рецепторных белков относятся к группе интегринов - семейству рецепторов, имеющих близкую структуру и ответственных за взаимодействия межклеточные и между клетками и белками. В частности, интегрином является гликопротеин (ГП) Ia/IIa, связывающийся с коллагеном. Основной субэндотелиальный белок, благодаря которому осуществляется прилипание (адгезия) тромбоцитов, - фактор фон Виллебранда. Рецептор тромбоцитов, взаимодействующий с этим фактором - ГП1Ь, к группе интегринов не относится.
Рецепторы тромбоцитов, способные взаимодействовать с фактором фон Виллебранда и коллагеном, постоянно находятся в
активном состоянии, поэтому обнажение гликопротеинов приводит к немедленной адгезии тромбоцитов (прилипанию их к стенке сосуда). Адгезия тромбоцитов, таким образом, «контролируется нормальным слоем эндотелия, который прячет адгезивные гликопротеины от циркулирующих тромбоцитов» (Б.С. Колер). Благодаря взаимодействию адгезивных молекул с гликопротеиновыми рецепторами GPIa/IIa и особенно с GPIb, образуется монослой тромбоцитов на поверхности бляшки.
После адгезии тромбоцит претерпевает процесс активации, во время которого в его мембране происходит конформационное изменение гликопротеина IIb/IIIa (GP IIb/IIIa-рецептора), и он приобретает высокую способность связывать фибриноген, фактор фон Виллебранда и, возможно, другие гликопротеины. Так как и фибриноген, и фактор фон Виллебранда являются мультивалентными молекулами, они могут взаимодействовать (связываться) одновременно с рецепторами двух тромбоцитов. Таким образом, происходит процесс агрегации тромбоцитов, причем основная роль в связи тромбоцитов между собой принадлежит фибриногену.
Агрегация тромбоцитов - механизм быстрого реагирования на кровотечение. Считается, что именно этим объясняются высокие концентрация фибриногена в крови и плотность гликопротеина IIb/IIIa на поверхности тромбоцитов. Если бы в состоянии «покоя» рецептор обладал высоким сродством (аффинностью) к фибриногену и фактору фон Виллебранда, то тромбоцитарные тромбы образовывались бы постоянно. Но в здоровом сосуде этого не происходит, так как для образования тромбоцитарного тромба (агрегата) необходимо присутствие одного или нескольких агентов, активирующих тромбоциты. Большинство этих агентов синтезируется или выделяется только в местах повреждения сосудистой стенки. Активированные же тромбоциты сами синтезируют или освобождают активаторы - тромбоксан А2, АДФ и серотонин. Кроме того, они способствуют образованию тромбина.
Сигналы с мембраны тромбоцита, вызванные как перечисленными, так и другими агонистами, передаются несколькими механизмами, включающими обмен арахидоновой кислоты и активирование протеинкиназы С (предполагается, что существуют и иные механизмы). Аспирин блокирует только обмен арахидоновой кислоты и поэтому является частичным ингибитором агрегации тромбоцитов.
Таким образом, окончательным общим механизмом, ведущим к агрегации тромбоцитов, является конформационное изменение гликопротеина IIb/IIIa, приводящее к резкому повышению аффинности этого рецептора к его адгезивным лигандам, прежде всего к фибриногену. Взаимодействие тромбоцитов между собой, опосредованное гликопротеинами ГIIb/IIIa (ГIIb/IIIa рецепторами) - заключительный этап на пути к образованию тромбоцитарного агрегата при воздействии практически любого активатора. Поэтому блокада этого рецептора должна предупреждать (и действительно предупреждает) агрегацию тромбоцитов, независимо от агониста. И соответственно, антиагрегационный эффект антагонистов GPIIb/IIIa-рецептора тромбоцитов должен превосходить эффект лекарственных средств, препятствующих действию только одного или группы агонистов.
Следствием повреждения поверхности атеросклеротической бляшки является адгезия тромбоцитов к месту повреждения, их активация с выделением содержимого гранул (АДФ и др.), аггрегация тромбоцитов (с участием гликопротеина Пв/Ша на поверхности тромбоцитов), образование тромбоцитарного тромба.
Вазоспазм
Дисфункция эндотелия сопровождает атеросклероз, возможно, являясь одним из первичных звеньев его развития. Безусловно важную роль играет она и в происхождении острых коронарных синдромов, способствуя возникновению спазма коронарного сосуда. Однако указаний на присущую больным нестабильной стенокардией повышенную констрикторную активность в области «ответственного за обострение» стеноза, сравнительно немного. Сотрудники А.Мазери с помощью количественной ангиографии оценили реакцию стенозов коронарных артерий на физическую нагрузку и холодовой тест у больных стабильной и нестабильной стенокардией (впрочем, достаточно стабилизированных, чтобы перенести такой тест). Диаметр стеноза при нестабильной стенокардии в ответ на физическую нагрузку суживался, при стабильной стенокардии - не изменялся. Сужения диаметра не стенозированных участков коронарных артерий в ответ на те же стимулы у больных нестабильной стенокардией не происходило.
Как и в случае других патогенетических факторов, нет ответа на вопрос о том, относится ли повышенная спастическая активность
к причинным факторам нарушения целостности капсулы бляшки, или к вторичным феноменам и обусловлена выделяющимися вазоактивными веществами. Возможно, спазм в области «ранимой» бляшки способен быть триггером ее разрыва. Однако, не исключено, что разрыв бляшки и связанное с ним выделение вазоактивных агентов провоцирует констрикцию артерии.
Ниже представлена схема патогенеза острых коронарных синдромов (рис. 16.5).
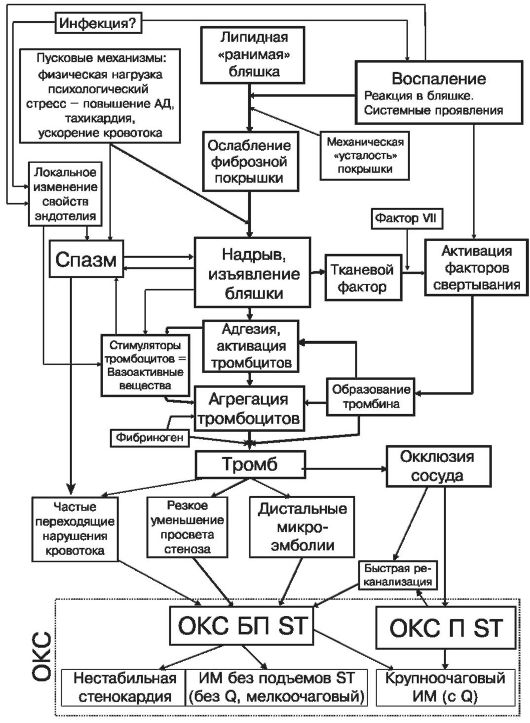 Рис. 16.5. Схема патогенеза острых коронарных синдромов
Рис. 16.5. Схема патогенеза острых коронарных синдромов
клинические признаки острого коронарного синдрома без подъемов ST на экг и оценка риска его основных осложнений
Клинические признаки
Ниже перечислены клинические признаки, при наличии которых следует подозревать развитие острого коронарного синдрома без подъемов сегмента ST.
Затяжной (>15 мин) приступ ангинозной боли в покое. Такое состояние обычно является основанием для вызова скорой помощи или экстренного обращения в лечебное учреждение по какому-то другому пути.
Впервые возникшая (в предшествовавшие 28-30 дней) тяжелая стенокардия (III или IV класса по Канадской классификации, определение см. следующий пункт).
Дестабилизация («утяжеление») ранее существовавшей стабильной стенокардии с появлением характеристик, присущих, по крайней мере, III классу стенокардии по классификации Канадского сердечно-сосудистого общества, и/или приступов боли в покое (прогрессирующая стенокардия, стенокардия кресчендо). Тяжесть стенокардии по классификации Канадского сердечно-сосудистого общества: класс III - выраженное ограничение обычной, привычной для человека физической активности, стенокардия появляется при ходьбе по ровной местности уже через 1-2 квартала и подъеме на 1 пролет лестницы с нормальной, обычной для человека скоростью; класс IV - любая физическая активность вызывает стенокардию (дискомфорт), стенокардия может возникать и в покое.
Острый коронарный синдром может проявляться длительными приступами стенокардии покоя, впервые возникшей тяжелой или утяжелением ранее существовавшей стабильной стенокардии.
Электрокардиограмма
ЭКГ-признаки обострения КБС - смещения сегмента ST и изменения зубца T. Особенно велика вероятность наличия ОКС при сочетании соответствующей клинической картины с депрессиями сегмента ST, превышающими 1 мм в двух или более смежных отведе-
ниях, а также инверсией зубца Т >1 мм в отведениях с преобладающим зубцом R. Глубокие симметричные инверсии зубца Т в передних грудных отведениях свидетельствуют о выраженном проксимальном стенозе передней нисходящей ветви левой коронарной артерии.
Полностью нормальная ЭКГ у больных с симптомами, заставляющими подозревать ОКС, не исключает его наличия. Однако, если во время сильной боли регистрируется нормальная ЭКГ, следует упорнее искать другие возможные причины жалоб больного.
Преходящий подъем сегмента ST может быть отмечен при стенокардии Принцметала (вазоспастической стенокардии).
ЭКГ-признаки обострения КБС - смещение сегмента ST и изменения зубца Т.
Биохимические маркеры повреждения миокарда
При ОКС без подъемов сегмента ST могут быть повышенными уровни биохимических маркеров некроза миокарда. В этих случаях, как было отмечено выше, речь идет об инфаркте миокарда без подъемов ST.
Использование в качестве маркера некроза миокарда сердечных тропонинов Т и I, из-за их большей специфичности и надежности предпочтительнее креатинфосфокиназы (КФК) и ее МВ формы. Определение тропонинов позволяет обнаружить повреждение миокарда примерно у трети больных, не имеющих повышения МВ КФК. Если у больного с подозрением на ОКС уровни тропонинов не повышены в первые 6 ч после начала приступа боли, для выявления или исключения повреждения миокарда необходимы повторные взятия крови и измерения в течение 6-12 ч после поступления. Кроме того, определения следует повторять после любого повторного эпизода сильной боли в грудной клетке. При этом следует учитывать, что уровни тропонинов могут оставаться повышенными в течение однойдвух недель, что затрудняет диагностику повторного некроза у больных с недавним ИМ.
Специфическими маркерами некроза миокарда являются повышенные уровни тропонинов Т и I, а также КФК и ее МВ формы.
Оценка риска крупноочагового инфаркта миокарда и смерти
У всех больных с подозрением на развитие ОКС повышен риск развития крупноочагового инфаркта миокарда и смерти. Однако
у части больных он недостаточно высок, чтобы оправдать экстренные дорогостоящие вмешательства, тогда как у других риск осложнений делает такие вмешательства необходимыми. Правильная оценка риска (т.е. прогноза) может определить характер и срочность диагностических и лечебных вмешательств. Характеристика риска помогает выбрать место наблюдения и лечения больного (блок интенсивной терапии, обычное кардиологическое отделение, поликлиника), тип и экстренность лечебного вмешательства, а во время этого вмешательства - целесообразность его продолжения или прекращения. Для оценки риска используются данные расспроса, физического обследования, ЭКГ, определения биохимических маркеров некроза, реже эхокардиографии.
ВНОК рекомендует использовать для оценки риска больных при поступлении балльную систему TIMI (табл. 16.1). К больным высокого риска следует отнести тех, у кого сумма баллов превышает 4.
Таблица 16.1
Оценка риска неблагоприятных событий - смерти, (ре)инфаркта миокарда, повторяющейся тяжелой ишемии, требующей инвазивного вмешательства, у больных ОКС БП ST - система TIMI. Основана на данных исследования TIMI 11B
Возраст старше 65 лет | 1 |
Больше 3-х коронарных факторов риска | 1 |
Стеноз(ы) коронарных артерий на выполненной ранее ангиограмме | 1 |
Наличие смещений сегмента ST | 1 |
Более 2-х приступов стенокардии в предшествующие 24 ч | 1 |
Применение аспирина в предшествующие 7 дней | 1 |
Повышение уровня(ей) «сердечных маркеров» | 1 |
Максимальное число баллов | 7 |
В таблице 16.2 представлены признаки, по которым рекомендуется оценивать ближайший риск смерти и крупноочагового инфаркта миокарда в Руководстве АКК/ААС по ведению (лечению) больных нестабильной стенокардией и инфарктом миокарда без подъемов сегмента ST на ЭКГ.
Таблица 16.2
Краткосрочный риск смерти или инфаркта миокарда у больных нестабильной стенокардией
Высокий риск Достаточно одного из признаков | Промежуточный риск Нет признаков высокого риска, но есть хотя бы один из перечисленных | Низкий риск Нет признаков высокого или промежуточного рисков, но есть один из перечисленных | |
Анамнез | Нарастающий темп симптомов ишемии в предшествующие 48 ч | Предшествующие ИМ, заболевание периферических или мозговых сосудов, операция КШ, применение аспирина | |
Характер боли | Длительная (>20 мин)стенокардия в покое, продолжающаяся в момент осмотра (оценки риска) | Длительная (>20 мин) стенокардия в покое, прекратившаяся к моменту осмотра, с умеренной или высокой вероятностью наличия КБС. Стенокардия покоя, продолжавшаяся <20 мин или прекратившаяся после приема нитроглицерина под язык | Впервые появившаяся или прогрессирующая стенокардия III или IV класса по Канадской классификации в предшествующие 2 нед без длительных (>20 мин) приступов с умеренной или высокой вероятностью наличия КБС |
Клинические проявления (симптомы) | Отек легких, вероятно, как следствие ишемии. Новый или усиливающийся шум митральной регургитации. | Возраст >70 лет |
Продолжение табл. 16.2
Третий тон или вновь появившиеся или нарастающие влажные хрипы в легких. Гипотония, брадикардия, тахикардия. Возраст >75 лет | |||
Изменения ЭКГ | Стенокардия покоя с преходящими изменениями сегмента ST >0,05 мВ. Блокада ножки пучка Гиса, «новая» или предположительно «новая». Устойчивая желудочковая тахикардия | Инверсии зубца Т >0,2 мВ. Патологические зубцы Q | Нормальная ЭКГ или отсутствие ее изменений во время приступа боли (дискомфорта) в грудной клетке |
Маркеры некроза | Повышены (например, Тн Т или I >0,1 нг/мл) | Незначительно повышены (например, Тн Т >0,01, но <0,01 нг/мл) | Нормальные |
Дальнейшее наблюдение в лечебном учреждении позволяет более точно оценить риск смерти и развития крупноочагового инфаркта миокарда. Соответствующие характеристики высокого и низкого риска даны в Рекомендациях ВНОК по лечению ОКС БП ST.
К категории высокого непосредственного риска смерти или развития инфаркта миокарда относятся больные, у которых в период наблюдения (8-12 ч) выявлено следующее.
• Повторные эпизоды ишемии миокарда (повторяющаяся боль, динамика сегмента ST, особенно депрессии или преходящие подъемы сегмента ST).
• Повышение содержания тропонинов (I или T) или МВ КФК1 в крови.
• Развитие гемодинамической нестабильности (гипотензия, признаки застойной сердечной недостаточности) за период наблюдения.
• Серьезные нарушения ритма (повторные эпизоды желудочковой тахикардии, фибрилляция желудочков).
• Ранняя постинфарктная стенокардия.
• Изменения ЭКГ, которые не позволяют оценить (выявить) отклонения сегмента ST.
• Сахарный диабет.
К категории низкого риска смерти или развития инфаркта миокарда в ближайшее время относятся больные, у которых нет:
• повторных болей в грудной клетке за период наблюдения;
• повышения уровня тропонинов или других биохимических маркеров некроза миокарда;
• депрессий или подъемов сегмента ST на ЭКГ, но с наличием инверсии зубца Т, сглаженного зубца Тили нормальной ЭКГ.
лечение острого коронарного синдрома без подъемов ST на экг
Принципы лечения ОКС БП ST. На чем основаны рекомендации по лечению этого синдрома
Направления лечения нестабильной стенокардии определяются ее основными патогенетическими механизмами - разрывом атеросклеротической бляшки, тромбозом (артериальный тромб - преимущественно тромбоцитарный) магистральной коронарной артерии, тромбоэмболиями в дистальное сосудистое русло миокарда. Основная цель - быстрое восстановление полноценной перфузии миокарда. Характер вмешательств, целью которых является профилактика повторных обострений КБС, определяется механизмами ослабления покрышки бляшек - накоплением в бляшках липидов
1 Использование МВ КФК при невозможности определения тропонинов приводит к недооценке риска у многих больных.
и их окисленных форм, воспалением - и тем, что следствием нарушения целостности бляшки или возникновения эрозии эндотелия является тромбоз. Кроме того, необходимо предупреждать события - триггеры разрыва.
Острые коронарные синдромы - область, в которой на практике могут быть воплощены принципы «медицины, основанной на доказательствах». Почти все методы терапии, для применения которых имеются серьезные теоретические предпосылки, прошли испытания в крупных многоцентровых рандомизированных сравнительных исследованиях. В связи с этим изложение вопросов лечения может быть основано преимущественно на данных крупных многоцентровых рандомизированных исследований различных методов терапии.
Антиишемическая (симптоматическая) терапия
Изложение методов лечения острого коронарного синдрома традиционно начинается с симтоматической терапии, в чем, безусловно, есть смысл, так как именно быстрого устранения симптомов ожидает больной от медицинского работника.
Морфин
У больных с сильной болью и возбуждением, и в случаях, когда боль не прекращается быстро, несмотря на применение нитратов и β-адреноблокаторов (см. ниже), рекомендуется внутривенное введение морфина (1-5 мг).
Антиишемические средства
Антиишемические средства уменьшают потребление кислорода миокардом (снижая ЧСС, АД, подавляя сократимость левого желудочка) или вызывают вазодилатацию. Считается, что эти эффекты способны привести к уменьшению вероятности возникновения событий - триггеров разрыва бляшки.
β-адреноблокаторы
β-блокаторы рекомендуется применять у всех больных с ОКС при отсутствии противопоказаний; причем у больных с высоким риском развития неблагоприятных событий сначала необходимо внутривенное введение. Нет доказательств того, что применение какого-то
конкретного β-адреноблокатора предпочтительнее. Поэтому целесообразно использовать агенты, эффективность которых при этом состоянии достаточно убедительно документирована, а именно: пропранолол, атенолол или метопролол. Ориентир адекватного дозирования этих средств - частота сердечных сокращений, которую следует поддерживать в пределах 50-60 в минуту.
При наличии сопутствующих заболеваний, например, патологии легких, или дисфункции ЛЖ, следует начинать лечение с коротко действующих препаратов. Парентеральное введение β-адреноблокаторов требует контроля АД, желательно и непрерывное мониторирование ЭКГ. Не следует использовать β-адреноблокаторы больным с выраженными нарушениями предсердно-желудочковой проводимости (предсердно-желудочковая блокада I степени с PQ >0,24 с, II или III степени) без работающего искусственного водителя ритма, бронхиальной астмой в анамнезе, тяжелой острой дисфункцией ЛЖ с признаками сердечной недостаточности. Особую осторожность следует соблюдать у больных с хроническими обструктивными заболеваниями легких, начиная лечение с относительно коротко действующего кардиоселективного β-адреноблокатора (например, метопролола) в уменьшенных дозах.
Нитраты
Применение нитратов при нестабильной стенокардии основывается на патофизиологических предпосылках и клиническом опыте. Данные контролируемых исследований, которые обосновывали бы оптимальные дозировки и длительность применения, отсутствуют.
У больных, с сохраняющимися эпизодами ишемии миокарда (и/или коронарной боли) целесообразно применение нитратов внутривенно. Дозу следует постепенно увеличивать («титровать») до исчезновения симптомов или появления побочных эффектов (головной боли или гипотензии). Выраженное снижение АД при внутривенной терапии нитратами опасно, так как может способствовать углублению ишемии и прогрессированию тромбоза. Следует помнить о том, что длительное применение нитратов может привести к привыканию. По мере достижения контроля над симптомами внутривенное введение нитратов следует заменить на непарентеральные формы, обеспечивая при этом некоторый безнитратный интервал.
Антагонисты кальция
Недигидропиридиновые препараты (дилтиазем и верапамил) можно применять как симптоматическое вмешательство в лечении больных, имеющих противопоказания к β-адреноблокаторам, и у больных с вариантной стенокардией. Антагонисты кальция дигидропиридинового ряда могут способствовать устранению симптомов у больных, уже получающих β-адреноблокаторы и нитраты. Использовать дигидропиридины без сопутствующей терапии β-адреноблокаторами не следует. Антагонисты кальция противопоказаны больным с значительными нарушениями сократительной функции ЛЖ или атриовентрикулярного проведения.
Симптоматическая терапия при остром коронарном синдроме включает устранение боли (вплоть до в/в введения морфия) и использование антиишемических препаратов (нитраты, антагонисты кальция, β-адреноблокаторы).
Антитромботическое лечение
Основой лечения ОКС без подъемов сегмента ST является активная антитромботическая терапия, заключающаяся в применении антитромбоцитарного агента аспирина (лучше в сочетании с клопидогрелем) и препарата из групы антитромбинов - нефракционированного или низкомолекулярного гепарина1.
Аспирин
Применение аспирина у больных нестабильной стенокардией снижает число развивающихся ИМ более чем на 50% по сравнению с применением плацебо. При продолжении приема аспирина после стабилизации состояния больных достигается отдаленный положительный профилактический эффект. Поэтому лечение аспирином рекомендуется всем больным с подозрением на острый коронарный синдром при отсутствии явных противопоказаний. В исследованиях, в которых было продемонстрировано положительное действие аспирина при ОКС, использовались «простые» (не кишечно-растворимые) формы препарата.
1 Не исключено, что к моменту опубликования этого текста в России будет доступен препарат с близкими свойствами - фондапаринукс (см. ниже), результаты сравнения которого с одним из низкомолекулярных гепаринов эноксапарином продемонстрировали даже несколько большие эффективность и безопасность.
Аспирин ингибирует фермент простагландин G/H синтетазу, что приводит в конечном счете к длительному и необратимому подавлению активности циклооксигеназы-1. В результате уменьшается образование эйкосаноидов, в том числе и тромбоксана А2. Этот мощный агонист агрегации тромбоцитов и вазоконстриктор опосредует действие многих индукторов агрегации (катехоламинов, тромбина, АДФ и т.д.).
Аспирин быстро всасывается из желудка. Значительный его уровень в плазме после приема 160-325 мг достигается примерно за 20 мин и влияние на тромбоциты проявляется уже в течение часа. Действие аспирина необратимо и его эффект сохраняется на протяжении времени жизни тромбоцита - 9-10 дней.
Ограничения и недостатки терапии аспирином. Существуют реакции активации поверхностных рецепторов тромбоцитов к адгезивным молекулам (гликопротеинов IIb/IIIa) этими же индукторами, в которых тромбоксан не участвует и, соответственно, на которые не влияет аспирин (рис. 16.6). Кроме того, подавление активности циклооксигеназы в эндотелиальных клетках может способствовать уменьшению образования антитромботических и вазодилататорных
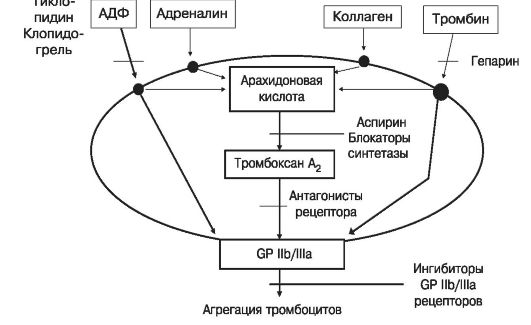 Рис. 16.6. Пути, ведущие к агрегации тромбоцитов и точки приложения действия дезагрегантов
Рис. 16.6. Пути, ведущие к агрегации тромбоцитов и точки приложения действия дезагрегантов
простагландинов, прежде всего простациклина. Даже в малых дозах аспирин способен раздражать желудочно-кишечный тракт и вызывать бронхоспазм у больных, имеющих аллергию к салицилатам.
К аспирину имеется ряд противопоказаний, а также редких побочных эффектов, включающих аллергию, активную пептическую язву, местное кровотечение или геморрагические диатезы.
Дозы аспирина. Способность аспирина подавлять синтез простациклина в сосудистой стенке, с одной стороны, и его раздражающее действие на слизистую желудочно-кишечного тракта, с другой, заставляют стремиться к снижению доз этого средства. В исследованиях, выявивших положительное действие аспирина при нестабильной стенокардии, использовались суточные дозы от 75 до 1300 мг. Согласно метаанализу основных исследований антитромбоцитарной терапии (не только при обострениях КБС) клиническая эффективность аспирина в дозах - 160 (150) - 75 мг/сут не уступала эффективности более высоких доз1. Согласно этому же метаанализу при использовании аспирина в дозах менее 75 мг его эффективность падала и достоверно не отличалась от эффективности плацебо. С другой стороны, данные испытания CURE показали, что при продолжительном приеме аспирина в дозах, превышающих 100 мг в сут, возрастала опасность кровотечений (как при комбинировании препарата с клопидогрелем, так и при изолированном применении). Поэтому предпочтительными для длительного лечения следует считать дозы аспирина в диапазоне от 75 до 100 мг/сут.
Однако данных, указывающих на нецелесообразность использования доз от 150 до 325 мг/сут в остром периоде болезни, в частности во время госпитализации или в связи с инвазивными процедурами, нет.
Таким образом, в отношении применения аспирина у больных с ОКС БП ST может быть дана следующая рекомендация: начинать лечение с приема внутрь 250-325 мг (первая доза - разжевать таблетку, не покрытую оболочкой); затем продолжать по 75-100 мг 1 раз в сут ежедневно в течение неопределенно длительного времени.
1 Antithrombotic Trialists' Collaboration. Collaborative metaanalysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002; 324: 71-86.
«Резистентность» к аспирину
У части людей аспирин не оказывает ожидаемого влияния на результаты лабораторных тестов, характеризующих агрегацию тромбоцитов in vitro, или/и на время кровотечения. Это явление обозначают как «резистентность к аспирину». По данным ряда небольших исследований, аспирин практически не влияет на агрегацию тромбоцитов у 5-8% больных. Однако согласно некоторым сообщениям, доля таких людей в различных выборках оказывалась значительной (до 40%), что противоречит положительным клиническим результатам применения аспирина. Расхождения объясняют несовершенством методов оценки агрегации ex vivo и трудностями стандартизации определения времени кровотечения.
С другой стороны, о «резистентности» к аспирину говорят и при возникновении тромботических осложнений у больных, получающих это средство. Предполагается, что во многих таких случаях истинной резистентности нет, а отсутствие антитромботического эффекта обусловлено недостаточной приверженностью к лечению (non-compliance), влиянием одновременно принимаемых лекарств (например, нестероидных противовоспалительных средств). Несмотря на сделанные оговорки, следует иметь в виду, что какая-то доля (очевидно, небольшая) больных ОКС, получающих только аспирин, в действительности лишена антитромбоцитарного вмешательства. Пригодные для применения в клинической практике лабораторные методы быстрого выявления таких больных еще не определены. Поэтому сведения о возможности устойчивости к аспирину у части больных в настоящее время следует рассматривать как дополнительное основание для включения в комплекс антитромботической терапии при ОКС БП ST наряду с аспирином других антитромбоцитарных агентов - тиенопиридина клопидогреля, а у больных высокого риска - и антагонистов гликопротеинов IIb/IIIa тромбоцитов (см. ниже).
Нефракционированный гепарин
Тромбин играет ключевую роль в возникновении, поддержании существования и прогрессировании тромба при нарушении целостности атеросклеротической бляшки. Гепарин связывается с антитромбином III крови, и образующийся комплекс способен инактивировать ряд ферментов системы (каскада) свертывания крови, включая тромбин (фактор IIa), факторы Ха, XIIa, XIa, и IXa, причем наибольшим сродством гепарин обладает к тромбину.
На уровень гепарина в крови влияют многие факторы. Гепарин вступает во взаимодействие с белками плазмы. Кроме того, он захватывается эндотелиальными клетками и макрофагами. Тромбоциты выделяют фактор IV, нейтрализующий гепарин, и связывают фактор Xa, защищая его от действия гепарина. У разных больных эти процессы выражены в неодинаковой степени, поэтому трудно предсказать реакцию на одну и ту же дозу гепарина у разных людей, и у одного и того же человека в разное время. Соответственно, трудно использовать фиксированные дозы гепарина. Отсюда вытекает необходимость тщательного лабораторного контроля за его применением.
Для контроля безопасности и эффективности терапии НФГ следует определять активированное частичное тромбопластиновое время (АЧТВ). Признано, что при введении НФГ необходимо добиваться удлинения АЧТВ в 1,5-2,5 раза по сравнению с так называемым контрольным (нормальным) временем. Соответственно, целью является быстрое достижение такого терапевтического уровня АЧТВ и стабильное удержанию показателя в желаемом диапазоне. Способствовать этому призваны алгоритмы (номограммы), содержащие указания на начальные дозировки НФГ и на их изменения, которые должны быть произведены в зависимости от изменений величины АЧТВ. В некоторых из них в качестве целевых (терапевтических) приведены абсолютные значения АЧТВ (например, от 60 до 85 с1), в других - относительные (по отношению к контрольному АЧТВ конкретной лаборатории, принятому за 1). Контрольное значение АЧТВ может существенно варьировать у разных лабораторий. Поэтому необходимым условием применения НФГ является регулярное определение контрольного АЧТВ в собственной лаборатории лечебного учреждения.
Для точного дозирования препарата желательно использование специальных дозирующих устройств.
Диапазон доз, рекомендуемых для струйного (болюсного) введения препарата, с которого должно начинаться лечение, довольно широк (от 60 до 80 Ед/кг). Дозы, превышающие 70 Ед/кг (т.е. 4000- 5000 Ед), в крупных исследованиях у больных ОКС не применялись. Рекомендуемые скорости инфузии НФГ после струйного введения (болюса) также разнообразны (от 12 до 18 Ед/кг/час). Однако эффективность дозировок, близких к верхнему пределу этого диапазона,
1 Hirsh J., Fuster V. Guide to Anticoagulant Therapy. Part !: Heparin. Circulation 1994; 89: 1449-1468.
изучалась преимущественно у больных с венозными тромбоэмболиями, а при ОКС они не превышали 15 Ед/кг/час.
На рис. 16.7 и 16.8 представлены основные положения Рекомендаций Всероссийского научного общества кардиологов, касающиеся применения НФГ, а на рис 16.9 - номограмма-алгоритм дозирования НФГ, содержащаяся в руководстве Американской коллегии врачейспециалистов по заболеваниям грудной клетки (2000 г.). Упрощенный алгоритм дозирования гепарина представлен на рис. 16.10.
 Рис. 16.7. Рекомендации ВНОК (2001 г.) «Лечение ОКС БП ST» Контроль применения гепарина (НФГ) (1)
Рис. 16.7. Рекомендации ВНОК (2001 г.) «Лечение ОКС БП ST» Контроль применения гепарина (НФГ) (1)

Рис. 16.8. Рекомендации ВНОК (2001 г.) «Лечение ОКС БП ST» Контроль применения гепарина (НФГ) (2)
Начальная доза | 80 ед/кг болюс**, затем 18 Ед/кг/час |
АЧТВ <1.2 контрольной величины | 80 ед/кг болюс, затем 4 Ед/кг/час |
АЧТВ < 1.2-1.5 контрольной величины | 40 ед/кг болюс, затем 2 Ед/кг/час |
АЧТВ < 1.5-2.3 контрольной величины | Без изменений |
АЧТВ <2.3-3 контрольной величины | Уменьшить скорость инфузии на 2 Ед/кг/час |
АЧТВ >3 контрольной величины | Остановить введение на 1 час, затем продолжить ее, уменьшив скорость введения на 3 Ед/кг/час |
* The eth (2000) АССР Guidelines for Antithrombotic Therapy for Prevention and Treatment of Thrombosis ** Согласно настоящим Рекомендациям не следует превышать дозы 5000 Ед (при болюсном введении) и 1250 Бд/час ~ при внутривенной инфузии.
Рис. 16.9. Номограмма дозирования гепарина (НФГ) с использованием относительных изменений АЧТВ (по отношению к контрольной величине конкретной лаборатории)
Болюс 5000 ЕД затем инфузия 1200 ЕД/ч (вес >60 кг) или 1000 ЕД/час (вес <60 кг)
АЧТВ, с | Повт. болюс ЕД | Прекратить инфузию, мин | Изменить скорость инфузии | Следующее измерение АЧТВ |
<60 | 0 | 0 | +20% | 6-8 ч. |
60-100 | 0 | 0 | нет | 24 ч. |
>100 | 0 | 0 | -20% | 6-8 ч. |
Если при двух последовательных снижениях скорости инфузии АЧТВ >100 сек, введение гепарина прекращается
Рис. 16.10. Номограмма дозирования гепарина (НФГ) Упрощенный алгоритм (система исследований OASIS)
После окончания внутривенной инфузии НФГ возможен переход на его подкожное введение (12 500 ЕД 2 раза в день) на 1-3 дня для избежания феномена отмены.
Недостатки гепарина
Кроме сложностей, связанных с необходимостью контроля и длительного внутривенного введения, терапия гепарином обладает еще и следующими недостатками. Гепарин не способен реагировать с тромбином, связанным с фибрином, субэндотелиальными структурами и, как уже было отмечено, не действует на фактор Ха, находящийся на поверхности тромбоцита в составе комплекса протромбиназы (факторы Xa, V, ионы кальция). При нестабильной стенокардии тромб над надорванной атеросклеротической бляшкой содержит фибрин и, следовательно, тромбин, недоступный гепарину.
Гепарин не обладает последействием, условия для образования тромба восстанавливаются после окончания его применения, и прекращение инфузии может даже приводить к активации тромботического процесса, клинически выражающейся в увеличении числа эпизодов ишемии миокарда и развитии инфаркта миокарда.
Вызываемая гепарином тромбоцитопения
Одно из осложнений, которое может возникнуть после нескольких дней применения гепарина, - иммунная тромбоцитопения с парадоксальной повышенной опасностью тромбозов. Связана с появлением антител к гепарину и другим макромолекулярным комплексам, в частности к белкам мембраны тромбоцитов. Иммунные комплексы из антител, белков тромбоцитов и гепарина активируют тромбоциты и клетки эндотелия. Образуются большие количества тромбина и возникает распространенный тромбоз. Тромбоцитопения - следствие потребления тромбоцитов в образующихся тромбах. Тромбы возникают в сосудах кожи, что может приводить к ее некрозам. Возможны и тромбозы сосудов конечностей.
Основная мера - срочное прекращение применения гепарина. Если потребность в антикоагулянтной терапии продолжает сохраняться, то агентами, с помощью которых эта терапия может быть продолжена, являются прямые антитромбины (гирудин) или низкомолекулярные гепарины.
Комбинация гепарин + аспирин
Метаанализ рандомизированных исследований, в которых сравнивалась комбинация гепарина и аспирина с одним аспирином показал, что при использовании сочетания гепарина с аспирином риск смерти и развития инфаркта миокарда в период инфузии был на 33% ниже, чем при применении одного аспирина. Однако после прекращения введения гепарина выраженность снижения риска быстро уменьшалась.
В настоящее время при остром коронарном синдроме БП ST обычно рекомендуется применять одновременно аспирин и внутривенную инфузию НФГ (или подкожное введение низкомолекулярного гепарина, см ниже). После прекращения введения гепарина необходимо продолжать применение аспирина.
Низкомолекулярные гепарины
Гепарин (нефракционированный) - сложное вещество, представляющее собой сумму фракций - полисахаридов разного молекулярного веса. Низкомолекулярные компоненты (фракции) гепарина участвуют в ингибировании («потенцируют ингибирование») активированного фактора X. Лекарственные препараты этих компонентов (низкомолекулярные гепарины - НМГ) имеют ряд характеристик, отличающих их от нефракционированного («обычного») гепарина.
После подкожной инъекции гепарина абсорбируются только его низкомолекулярные фракции. Поэтому при этом методе введения биодоступность специальных препаратов низкомолекулярного гепарина значительно превышает биодоступность нефракционированного гепарина. Низкомолекулярные фракции в значительно меньшей степени, чем другие составляющие НФГ, связываются белками и клетками эндотелия. Поэтому препараты низкомолекулярного гепарина характеризуются более предсказуемой антикоагулирующей реакцией на введенную дозу и, соответственно, при их применении требуется меньший (или не требуется вообще) лабораторный контроль. Равномерный эффект может быть достигнут при подкожном введении фиксированной дозы НМГ один или два раза в день. Кроме того, низкомолекулярные гепарины в значительно меньшей степени, чем нефракционированный гепарин, влияют на тромбоциты.
Следующие отличия НМГ от НФГ обеспечивают возможность двукратного подкожного введения их препаратов и более тесную связь между введенной дозой и антитромботическим эффектом:
• больший период полувыведения; высокая биодоступность при подкожном введении;
• меньшая чувствительность к нейтрализующему действию фактора 4 тромбоцитов;
• меньшее связывание белками плазмы и клетками эндотелия. Хорошее отношение доза - эффект позволяет отказаться от определения АЧТВ для контроля терапии НМГ, тем более что они и не должны существенно изменять этот показатель.
Еще в 1996 году (испытание FRISC) выяснилось, что действие одного из НМГ, дальтепарина, на клинические конечные точки (случаи смерти, инфарктов миокарда и реваскуляризации) достоверно и существенно превосходит влияние плацебо. Потенциальные достоинства НМГ стали основанием для организации крупных многоцентровых рандомизированных исследований, в которых их эффективность (действие на клинические конечные точки) сравнивалась с эффективностью внутривенной инфузии НФГ. В некоторых из этих исследований изучались дальтепарин (FRIC и FRISC-II) и надропарин (FRAXIS), однако наиболее тщательно сравнивались с результатами применения НФГ эффективность и безопасность эноксапарина (рис. 16.11, 16.12, 16.13).
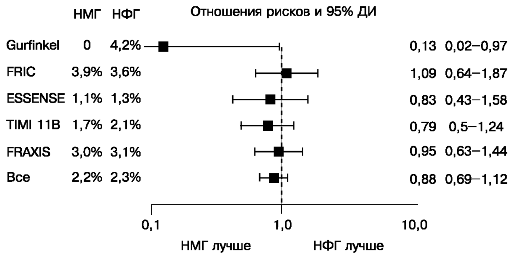
Рис. 16.11. Смерти и ИМ в рандомизированных исследованиях кратковременного применения НМГ и НФГ при ОКС без подъемов ST
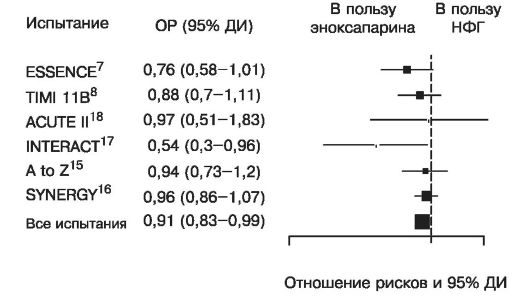
Рис. 16.12. Сравнительные испытания эффективности НМГ (эноксапарина) и НФГ при ОКС БП ST. Смерти или инфаркты миокарда за 30 дней. Анализ «по намерению лечить»
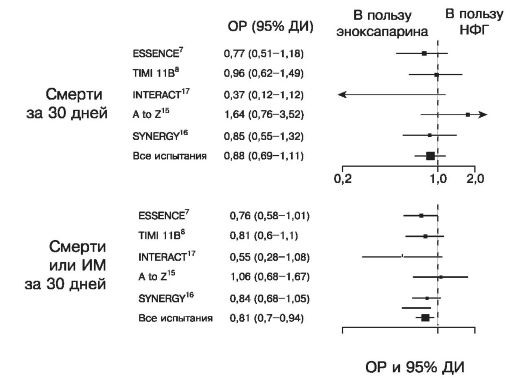
Рис. 16.13. Сравнительные испытания эффективности НМГ (эноксапарина) и НФГ при ОКС БП ST. Больные, не получавшие гепарин до рандомизации
Полученные данные отличались несущественно, ни в одном из испытаний, взятых в отдельности, не было выявлено достоверных преимуществ НМГ по сравнению с НФГ в отношении предупреждения случаев смерти или ИМ, и основным их итогом явилось установление факта равной эффективности двух типов гепаринов при ОКС без подъемов ST (рис. 16.11, 16.12). Учитывая простоту терапии НМГ, этого вполне достаточно для обоснования широкого использования препаратов этой группы. При анализе подгрупп одного из крупных испытаний (SYNERGY) получены указания на нежелательность в процессе лечения перехода с НФГ на НМГ. Данные метаанализа крупных испытаний эноксапарина показали, что применение этого НМГ по сравнению с НФГ дало лучшие результаты у больных, у которых такой переход не осуществлялся (рис. 16.13).
Сравнительных испытаний наиболее широко распространенных НМГ при ОКС БП ST не проводилось.
В Рекомендациях ВНОК по лечению ОКС БП ST содержится положение о том, что у больного с клинической картиной ОКС при отсутствии смещения сегмента ST вверх, можно (в условиях скорой помощи) или нужно (в лечебном учреждении) начать внутривенное введение НФГ или подкожное - НМГ без указания конкретного препарата. Таким образом, подразумевается, что следует использовать любой имеющийся в наличии из разрешенных к клиническому применению в России препаратов НМГ (дальтепарин, надропарин или эноксапарин).
Простота применения НМГ делает возможным их длительное применение. Однако крупные испытания НМГ показали, что продолжение введения НМГ после 8 суток, в среднем (т.е. у всех больных без учета конкретной клинической ситуации, риска осложнений и перспектив инвазивного лечения) не приводит к повышению эффективности лечения ОКС без подъемов ST, но может быть связано с некоторым увеличением риска крупных кровотечений.
Фондапаринукс и прогностическое значение кровотечений
Фондапаринукс - антитромботическое средство, которое избирательно ингибирует фактор Ха, играющий центральную роль в образовании тромбина. Действие фондапаринукса было сравнено с эноксапарином в крупнейшем испытании при ОКС БП ST OASIS-5. По влиянию на первичную конечную точку испытания (смерть от любой причины, инфаркт миокарда, рефрактерная ишемия за 9 дней)
эффективность обоих лекарств оказалась одинаковой, но применение фондапаринукса сопровождалось меньшим числом крупных кровотечений за тот же период времени. В первые 30 дней в группе больных, получавших фондапаринукс, оказалось достоверно меньшим число случаев смерти и за 180 дней - случаев смерти, суммы случаев смерти и инфарктов миокарда, суммы случаев смерти, инфарктов миокарда и инсультов. Исследователи связывают такой результат с неблагоприятными последствиями кровотечений у леченных эноксапарином.
Данные OASIS-5 позволяют рассматривать применение фондапаринукса как потенциально предпочтительное антитромботическое вмешательство при ОКС БП ST. С другой стороны, они явились стимулом к более серьезному отношению к кровотечениям. Вероятность возникновения этого, как выяснилось в OASIS-5, прогностически неблагоприятного осложнения, при ОКС БП ST постоянно возрастает в связи с все большей активностью антитромботической терапии и все более широким внедрением инвазивного лечения, которое требует агрессивного антитромботического сопровождения.
Антитромботическое лечение острого коронарного синдрома обычно включает применение аспирина и гепарина (нефракционированного или низкомолекулярного) с возможным добавлением клопидогреля.
Тиенопиридины
На путь активации тромбоцитов, на который слабо влияет аспирин, - ответ на стимуляцию аденозиндифосфатом - действуют тиенопиридины тиклопидин и клопидогрель (рис. 16.6). Тиенопиридины не изменяют обмен арахидоновой кислоты и, соответственно, не могут нарушить образование простациклина в сосудистой стенке. Интерес к применению первого из них возродился в связи с успехами комбинации тиклопидин-аспирин в предупреждении тромботических осложнений после имплантации коронарных стентов, а в отношении второго проявился после крупного многоцентрового исследования CAPRIE, в котором у больных различными атеросклеротическим заболеваниями сосудов клопидогрель, по крайней мере, не уступал аспирину по эффективности.
Основной недостаток тиенопиридинов - эффект при его применении наблюдается через какое-то время. Что касается тиклопидина, то этот недостаток даже в большей степени препятствует его использованию при ОКС, чем незначительная (но вполне реальная)
вероятность возникновения цитопений. Цитопении (нейтропения и тромбоцитопения) развиваются хотя и относительно редко, но могут протекать очень тяжело, поэтому терапия тиклопидином требует соответствующего контроля: обязательно строгое наблюдение за числом лейкоцитов и тромбоцитов (рекомендуется выполнять клинический анализ крови с подсчетом тромбоцитов и лейкоцитарной формулы через каждые 2 недели на протяжении первых 3 мес лечения). При применении тиклопидина возможны также различные желудочно-кишечные расстройства, они возникают чаще нейтропений, но, безусловно, менее опасны. Опасные побочные эффекты тиклопидина не характерны для клопидогреля. В CAPRIE, в котором 19 185 больных были рандомизированы к приему клопидогреля или плацебо, в период наблюдения не менее 1 года (до 3 лет) частота цитопений была одинаковой в обеих группах. В настоящее время признается, что побочных эффектов у клопидогреля гораздо меньше, чем у тиклопидина, и постепенно клопидогрель вытесняет тиклопидин из клинической практики.
Ускорить наступление действия тиенопиридинов можно, начиная лечение с высокой однократной («нагрузочной») дозы препаратов.
Оба тиенопиридина (клопидогрель предпочтителен из-за меньшей вероятности возникновения серьезных осложнений), безусловно, могут быть рекомендованы для неотложного и длительного лечения больных, которым по каким-то причинам нельзя дать аспирин (обычно это повышенная чувствительность или проблемы с желудочно-кишечным трактом).
Механизмы антитромбоцитарного действия тиенопиридинов и аспирина различны, поэтому возможно комбинирование этих средств. Недавно в крупном рандомизированном контролированном исследовании CURE получены указания на большую эффективность длительного применения (до 1 года) сочетания клопидогреля и аспирина, начатого в первые 24 ч ОКС, по сравнению с приемом одного аспирина в отношении предупреждения осложнений КБС (случаи сердечно-сосудистой смерти, инфаркты миокарда, инсульты). В этом исследовании преимущества комбинации аспирин + клопидогрель при ОКС проявились уже на протяжении первых суток применения. Поэтому целесообразно использовать сочетание аспирина и клопидогреля с самого начала лечения больного с ОКС в случаях, когда не предполагается срочная операция обходного шунтирования коронарных артерий (в связи с потенциальной опас-
ностью повышенной кровоточивости в CURE применение клопидогреля прекращалось за 5 сут до этой операции и реальная опасность использования препарата непосредственно перед ней просто не оценена). В CURE использовалась следующая схема применения клопидогреля: первая («нагрузочная, ударная») доза - 300 мг, последующие - 75 мг 1 раз в сут. Эта же схема рекомендуется в настоящее время для практического применения.
В связи с тем, что при применении комбинации аспирин и клопидогрель «по схеме CURE» все еще возникает довольно большое число коронарных событий (смерти от КБС, инфаркты миокарда), продолжается изучение более активной антитромбоцитарной терапии. В частности, показано, что большее угнетение агрегации тромбоцитов при меньшей доле не реагирующих на клопидогрель больных, достигается при использовании нагрузочных доз 600 и 900 мг. Однако практическое внедрение таких доз (преимущественно 600 мг) пока ограничено «фармакологическим сопровождением» чрескожных коронарных вмешательств. Достоверных данных, свидетельствующих о большей эффективности в лечении больных ОКС БП ST нагрузочных доз клопидогреля, превышающих 300 мг, нет. Соответственно не изучена и безопасность этих доз (вне связи с ЧКВ).
Существуют экспериментальные указания на большую по сравнению с клопидогрелем антитромбоцитарную активность некоторых новых агентов (как дигидропиридинов, так и имеющих другой механизм действия). В настоящее время они находятся в стадии интенсивного клинического изучения.
Тиенопиридины, предпочтительно клопидогрель, могут применяться при лечении острого коронарного синдрома самостотельно (при непереносимости аспирина) или в комбинации с аспирином
Антагонисты гликопротеинов IIb/IIIa (гликопротеиновых IIb/IIIa рецепторов) тромбоцитов
Окончательный общий механизм образования тромбоцитарного агрегата - конформационное изменение (переход в активное состояние) гликопротеина (ГП) IIb/IIIa, приводящее к резкому повышению аффинности этого рецептора к его лигандам, прежде всего к фибриногену. Молекулы фибриногена связываются с рецепторами разных тромбоцитов, образуют между ними мостики и таким образом формируют тромбоцитарные агрегаты. Взаимодействие тромбоцитов
между собой, опосредованное гликопротеинами (ГП)Пb/Ша (ГППb/ IIIa рецепторами) - заключительный этап на пути к их агрегации при воздействии практически любого активатора. Поэтому блокада этого рецептора предупреждает агрегацию тромбоцитов, независимо от агониста (включая тромбин). Соответственно, антиагрегационный эффект антагонистов ГП IIb/IIIa-рецептора тромбоцитов превосходит эффект лекарственных средств, препятствующих действию только одного или группы агонистов.
Первым антагонистом ГП IIb/IIIa рецепторов тромбоцитов, созданным для применения у человека, стал абциксимаб - химера человеческого и мышиного моноклонального антитела с высокой степенью сродства (аффиностью) к IIb/IIIa рецептору и длительным действием на него, но с очень коротким периодом полужизни в плазме. Угнетение функции тромбоцита сохраняется в течение 24-48 ч после прекращения введения этих антител. Абциксимаб способен взаимодействовать и с другими интегринами (ГП IIb/IIIa относится к этой группе рецепторов) - рецепторами к адгезивным молекулам на клетках эндотелия (рецепторы к витронектину alphaVbeta3) и лейкоцитах (MAC-1 или alphaMbeta2). Последнее свойство отличает абциксимаб от синтетических IIb/IIIa ингибиторов, которые высоко специфичны для этого рецептора. Предполагается, что благодаря эффектам, не связанным с воздействием на ГПIIb/IIIa, абциксимаб может обладать противовоспалительным и антипролиферативным действием и влиять на миграцию клеток ? Б.С. Коллер').
К этой группе принадлежат и несколько синтетических лекарств, которые способны взаимодействовать с ГП IIb/IIIa рецепторами, так как они содержат некоторые последовательности аминокислот, такие же, как и в молекуле фибриногена. В крупных рандомизированных исследованиях при ОКС БП ST изучено действие эптифибатида (пептидный миметик) и тирофибана (непептидный миметик). Синтетические антагонисты ГПIIb/IIIa отличаются от моноклональных антител (абциксимаба) более коротким периодом полувыведения.
У больных с ОКС без подъемов ST добавление лекарств из группы антагонистов ГП IIb/IIIa к аспирину оказалось чрезвычайно эффективным при применении в сочетании с инвазивными вмешательствами (баллонная дилатация, стентирование коронарных артерий). Именно на фоне применения одного из ингибиторов ГП IIb/IIIa (тиро-
фибана) в исследовании TACTICS раннее инвазивное лечение наконец оказалось эффективнее так называемого консервативного (т.е. с выполнением процедур реваскуляризации только по строгим показаниям) в отношении предупреждения случаев инфаркта миокарда.
Применение эптифибатида и тирофибана в комбинации с НФГ в испытаниях, в которых использование чрескожных коронарных вмешательств (ЧКВ) не было обязательным, дало несколько лучшие результаты, чем применение одного НФГ. Однако и в них частота выполнения ЧКВ в острой стадии заболевания была достаточно высокой, и полученные данные во многом объясняются улучшением исходов ЧКВ при одновременном введении IIb/IIIa блокаторов. У больных же, у которых раннее инвазивное лечение не применяется, препараты этой группы, очевидно, ничего не добавляют к эффекту аспирина. Наиболее ярко это было продемонстрировано в исследовании GUSTO IV.
В это многоцентровое рандомизированное двойное слепое плацебо контролируемое исследование, в которое включались больные ОКС БП ST в первые 24 ч после приступа стенокардии покоя, абциксимаб использовался как чисто медикаментозное вмешательство, не связанное с инвазивной процедурой. Рандомизация осуществлялась в 3 группы - плацебо и двух режимов внутривенного введения абциксимаба (в течение 24 и 48 ч). Только 1,6% больных в пределах первых 48 ч были подвергнуты ЧКВ. Число первичных конечных точек (смерти и нефатальные ИМ) за 30 дней после рандомизации оказалось практически одинаковым во всех группах. Таким образом, указаний на благоприятное действие добавления абциксимаба к обычной терапии получено не было.
Недостатком испытаний эффективности антагонистов ГПIIb/IIa при ОКС БП ST является то, что они были выполнены до широкого внедрения клопидогреля как в практику выполнения ЧКВ, так и вообще лечения этого заболевания. Существуют только указания из небольших испытаний, что при ИМ БП ST введение абциксимаба в комплекс фармакологического сопровождения ЧКВ, включающего применение 600 мг клопидогреля, улучшает клинические результаты без увеличения риска крупных кровотечений.
Эксперты - авторы Рекомендаций ВНОК по лечению ОКС БП ST признали безусловную целесообразность применения одного из антагонистов ГПIIb/IIIa при экстренных ЧКВ, выполняемых в связи с невозможностью стабилизировать состояние больного лекарствен-
ной терапией, и желательность их применения - при проведении ЧКВ у стабилизированных больных.
Антагонисты ГП IIb/IIIa рецепторов тромбоцитов для приема внутрь
Больше оснований было ожидать положительного эффекта от длительного применения ингибиторов ГП IIb/IIIa рецепторов тромбоцитов для приема внутрь. Однако все испытания пероральных препаратов закончились неудачей (в группах больных, получавших средства этой группы, смертность оказалась более высокой). Такой результат явился свидетельством опасности грубейшего вмешательства в систему гемостаза (блокаторы ГП IIb/IIIa рецепторов способны полностью подавить агрегацию тромбоцитов, сохраняя их в то же время в активированном состоянии).
Антагонисты тромбоцитарных рецепторов Пв/Ша (абциксимаб, тирофибан, эптифибатид) рекомендуется использовать при проведении у больных с острым коронарным синдромом высокого риска чрескожных коронарных вмешательств.
Инвазивное лечение
Методы инвазивного лечения коронарной болезни сердца - чрескожные коронарные вмешательства и операции шунтирования коронарных артерий постоянно совершенствуются и стали широко доступными во многих странах (в том числе и круглосуточно). Соответственно, появилась возможность применять их очень быстро после госпитализации по поводу ОКС. Естественно, инвазивному лечению должно предшествовать ангиографическое исследование коронарных артерий. Стратегия лечения больных ОКС БП ST, при которой выполнение ангиографического исследования предполагается практически сразу после диагностики состояния в стационаре и при которой при обнаружении соответствующей «коронарной анатомии» сразу предполагается немедленное выполнение ЧКВ или КШ, обозначается как «ранняя инвазивная». Любая другая стратегия обозначается как «ранняя консервативная». Однако во многих странах лечение ОКС БП ST включает в себя инвазивное лечение при отсутствии успеха от медикаментозного лечения, а после стабилизации состояния больных перед выпиской (обычно достаточно ранней) инвазивная стратегия применяется при обнаружении ишемии миокарда во время стресс-тестов. Соответственно, в новейших сравни-
тельных испытаниях ранней инвазивной и ранней консервативной стратегий лечения ОКС БП ST в действительности сравнивались 2 инвазивные стратегии - одна практически для всех и сразу, другая - сразу при возникновении показаний (т.е. для России это тоже «ранняя инвазивная» стратегия).
Убедительных данных, оправдывающих агрессивное инвазивное (применение ЧКВ или КШ) лечение ОКС без подъемов ST не удавалось получить на протяжении длительного времени. Положение во многом изменилось после появления результатов выполненного в близких к российским условиям испытания FRISC-II. В нем больные группы инвазивного лечения сначала получали только антитромботические средства - аспирин и, как правило, с момента поступления НМГ - дальтепарин. После стабилизации состояния они направлялись на инвазивное вмешательство (ЧКВ или КШ), причем во многих случаях - в другой центр. До проведения инвазивных вмешательств (которые выполнялись в течение не более 7 дней от начала применения НМГ) продолжалось открытое введение дальтепарина. Группа больных, с которой сравнивались результаты инвазивного лечения, была условно «неинвазивной». В ней ангиографию и операцию реваскуляризации выполняли по довольно строгим (но очевидным) показаниям. Через 6 мес суммарный показатель частоты случаев смерти и ИМ в группе инвазивного вмешательства оказался статистически значимо (р = 0,031) меньшим (на 22%, ОР = 0,78 при
95% ДИ от 0,62 до 0,98%).
Такой результат (тактика с «острыми» инвазивными процедурами после некоторой стабилизации состояния, выполняемыми часто в другом центре, эффективнее консервативного лечения в остром периоде с инвазивными вмешательствами по строгим показаниям) имеет определенное практическое значение для России, где уже существуют центры, в которых имеется возможность выполнять относительно экстренные ЧКВ или операции КШ в более или менее широких масштабах. Однако при внедрении опыта FRISC-II в России следует учитывать, что стоимость лечения по схеме, принятой в этом исследовании, очень велика, особенно если принять во внимание высокую частоту имплантации стентов (61%).
На протяжении длительного времени не удавалось продемонстрировать какие-либо преимущества действительно раннего (т.е. без попыток предварительной стабилизации состояния больных) инвазивного лечения ОКС БП ST. Исследовании FRISC-II не ставило
своей целью изучение эффективности ранней инвазивной стратегии и, соответственно, ответа на вопрос о ее предпочтительности дать не могло. Впервые ответ был получен в испытании TACTICS, в которое были включены 2220 больных в первые 24 ч после появления признаков НС/ИМБП ST. Ранняя инвазивная стратегия заключалась в рутинной ангиографии и при необходимости - реваскуляризации в пределах 4-48 ч, консервативная (селективно инвазивная) - в выполнении ангиографии только при спонтанных признаках повторной ишемии миокарда или положительном нагрузочном тесте. Все больные в TACTICS должны были получать аспирин, внутривенно НФГ и ингибитор ГПИЬ/Ша тирофибан. Введение тирофибана должно было продолжаться 48 ч или до процедуры реваскуляризации миокарда и затем еще не менее 12 ч после ЧКВ. В ранней инвазивной стратегии таких вмешательств было больше и выполнялись они раньше. Результаты исследования, свидетельствующие о явных преимуществах ранней инвазивной стратегии у больных, получавших тирофибан, представлены на рис. 16.14. Практический вывод из TACTICS заключается в том, что успех ранней инвазивной тактики возможен на фоне предварительного и одновременного с ЧКВ введения ингибитора ГПИЬ/Ша.Необходимо учитывать, что
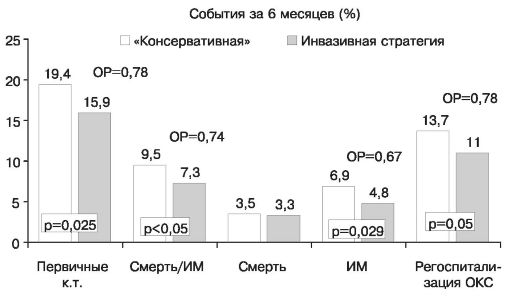 Рис. 16.14. TACTICS-TIMI
18. Сравнение инвазивной и консервативной стратегии лечения у больных
нестабильной стенокардией и ИМ без подъемов ST, получавших тирофибан
(48-108 ч)
Рис. 16.14. TACTICS-TIMI
18. Сравнение инвазивной и консервативной стратегии лечения у больных
нестабильной стенокардией и ИМ без подъемов ST, получавших тирофибан
(48-108 ч)
данные о преимуществах инвазивного лечения ОКС БП ST как после стабилизации состояния больных (FRISC-II), так и при раннем его применении на фоне введения антагониста IIb/IIIa рецепторов тромбоцитов (TACTICS) получены в лечебных учреждениях с большим объемом выполняемых вмешательств. В существующих зарубежных рекомендациях содержатся следующие требования как к учреждениям, претендующим на проведение экстренных процедур, так и непосредственно к операторам: чтобы учреждение могло иметь право применять срочные вмешательства, в нем за год должно выполняться не менее 200 ЧКВ, а оператор, допускаемый к таким процедурам, должен за то же время выполнять не менее 75 ЧКВ.
Близкими к российским были условия выполнения рандомизированного многоцентрового сравнительного испытания консервативной и инвазивной стратегий лечения ОКС БП ST RITA-3. В большинстве центров отсутствовали возможности для выполнения инвазивных вмешательств, и больные переводились в учреждения, в которых такие возможности имелись (при экстраполяции на Россию следует учесть состояние дорог, на Москву - скорость уличного движения). В RITA-3 включено 1810 больных (895 в группу ранней инва-
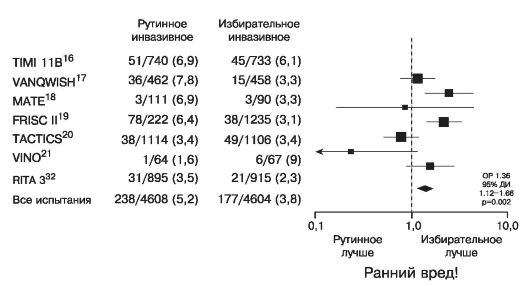 Рис. 16.15. Рутинное или селективное инвазивное лечение (ведение) больных ОКС Смерти или инфаркты. Рандомизация - выписка
Рис. 16.15. Рутинное или селективное инвазивное лечение (ведение) больных ОКС Смерти или инфаркты. Рандомизация - выписка
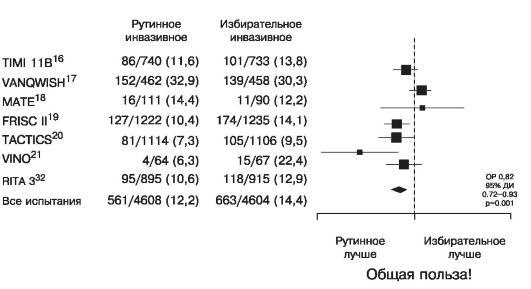
Рис. 16.16. Рутинное или селективное инвазивное лечение (ведение) больных ОКС Смерти/ИМ. Рандомизация - конец наблюдения. А
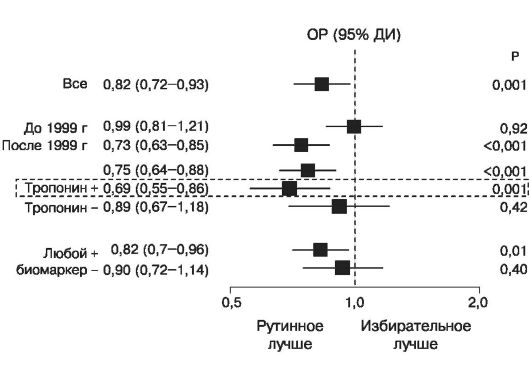 Рис. 16.17. Рутинное или селективное инвазивное лечение (ведение) больных ОКС БПST Смерти/ИМ. Рандомизация - конец наблюдения. Б
Рис. 16.17. Рутинное или селективное инвазивное лечение (ведение) больных ОКС БПST Смерти/ИМ. Рандомизация - конец наблюдения. Б
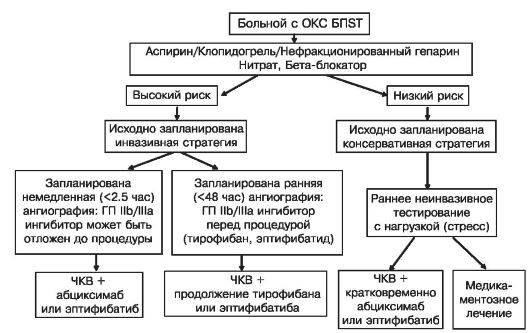 Рис. 16.18. Планирование коронарной ангиографии и ЧКВ в зависимости от группы риска
Рис. 16.18. Планирование коронарной ангиографии и ЧКВ в зависимости от группы риска
 Рис. 16.19. Некоторые действия при высоком риске. Инвазивное лечение ОКСБПST
Рис. 16.19. Некоторые действия при высоком риске. Инвазивное лечение ОКСБПST
зивной - ангиография/ЧКВ/КШ; 915 - в группу консервативной стратегии). Медикаментозное лечение больных обеих групп включало аспирин и НМГ эноксапарин (1 мг/кг 2 р/сут на протяжении 2-8 дней). При необходимости и при наличии возможности использовались ингибиторы ГП IIb/IIIa. К моменту выписки коронарная ангиография
 Рис. 16.20. Тактика в лечебном учреждении (блок интенсивной терапии) по инвазивному вмешательству
Рис. 16.20. Тактика в лечебном учреждении (блок интенсивной терапии) по инвазивному вмешательству
была выполнена у 97 и 16% больных групп инвазивного и консервативного лечения соответственно. К концу года число ангиографических исследований в «консервативной» группе достигло 49%. Инвазивные вмешательства (ЧКВ или КШ) к концу года были выполнены у 57,6% больных, рандомизированных к ранней инвазивной стратегии лечения, и у 28,3% - рандомизированных к консервативному лечению. Стенты использовались в 88% процедур ЧКВ.
Ранняя инвазивная стратегия в RITA-3 оказала явное симптоматическое действие, не влияя на риск смерти и развития ИМ. Основным результатом такого как в RITA-3 «раннего инвазивного» подхода к лечению больных ОКС БП ST было уменьшение числа случаев рефрактерной стенокардии. Под это определение подходит и необходимость в реваскуляризации миокарда.
В 2005 г. был опубликован метаанализ выполненных к этому времени сравнительных испытаний стратегий лечения ОКС БП ST разной степени инвазивности. Согласно его результатам, ранняя инвазивная стратегия дает несколько худшие непосредственные результаты, однако при длительном наблюдении выявляется ее явное преимущество (рис. 16.15 и 16.16). Наиболее явным это преимущество оказалось у больных высокого риска с повышенным уровнем сердечных тропонинов (рис. 16.17).
На рис. 16.18 представлена стратегия лечения ОКС БП ST, содержащаяся в последних рекомендациях по ЧКВ Европейского кардиологическо-
го общества (2005). В них выделено состояние очень высокого риска, при котором целесообразно срочное применение инвазивной стратегии.
В документе ВНОК содержится рекомендация использовать инвазивную стратегию при неудаче комбинированного, чисто фармакологического лечения ОКС БП ST. В них учитывается, что стратегия лечения определяется возможностями лечебного учреждения. Согласно рекомендациям ВНОК, в учреждениях, удовлетворяющих соответствующим требованиям, возможно и применение ранней инвазивной стратегии (рис. 16.19, 16.20).
Инвазивная стратегия вмешательства на коронарных сосудах у стабилизированных медикаментозными средствами больных с острым коронарным синдромом может иметь преимущество по сравнению с консервативной.
ДРУГИЕ МЕТОДЫ ТЕРАПИИ
Статины
С момента поступления больного ОКС без подъемов ST в лечебное учреждение следует принимать меры вторичной профилактики. Прежде всего это относится к применению статинов. Сейчас уже установлено, что начало терапии статинами в период госпитализации по поводу обострения КБС значительно увеличивает вероятность длительного их применения больным после выписки из стационара. Причем в качестве ориентира для подбора дозы препаратов могут быть использованы данные о содержании липидов крови в момент поступления, полученные до острофазового снижения их уровня, наблюдающегося в первые недели обострения КБС. Целевым, соответствующим Российским рекомендациям, признается уровень холестерина липопротеинов низкой плотности (ХСЛНП) 2,6 ммоль/л или 100 мг/дл. Некоторые группы экспертов, в частности эксперты Национальной образовательной программы по холестерину (НОПХ) США, считают целесообразным еще большее снижение уровня ХСЛНП (до ммоль/л или мг/дл, табл. 16.3).
Включение статинов в терапевтический комплекс имеет большое значение для снижения риска повторных обострений заболевания. Однако не исключено, что определенную роль оно играет и в стабилизации состояния больного непосредственно после ОКС. Это пред-
Таблица 16.3
Целевые уровни ХСЛНП и их модификация на основании данных недавних клинических испытаний [2]
Категория риска | Целевой ХС ЛНП | Уровень ХС ЛНП для начала терапевтических изменений образа жизни | Стартовый уровень ХС ЛНП для применения лекарств |
Высокий риск: КБС или ее эквиваленты (10-летний риск >20%) | <100 (2.6) Альтернативная цель: <70 (1,81)* | >100 (2,6) | >100 (2,6) [<100 (2,6): лекарства возможны] |
Умеренно высокий риск: 2 фактора риска или более** (10-лет- ний риск 10-20%) | <130 (3,36) | >130 (3,36) | >130 [100-129(2,6-3,34): лекарства воз- можны] |
Умеренно высокий риск: 2 фактора риска или более (10-летний риск <10%) | <130 (3,36) | >130 (3,36) | >160 (4,14) |
Меньший риск: 0-1 факторов риска | <160 (4,14) | >160 (4,14) | >190 (4,9) (160-189: лекарства возможны) |
Примечание: Величины приведены в мг/дл и ммолях/л как в оригинале. Расчет риска инфаркта и смерти от КБС осуществляется на основании данных Фремингемского исследования (по Фремингемской модели), соответствующий калькулятор может быть взят на сайте www.nhlbi.nih.gov/ guidelines/cholesterol.
* У больных с повышенными триглицеридами используется целевой уровень не ЛВП ХС 100 мг/дл.
** Факторы риска включают курение сигарет, гипертонию (АД >140/90 мм рт. ст. или применение антигипертензивных лекарств) низкий ХС липопротеинов высокой плотности (<40 мг/дл), случаи преждевременной коронарной болезни сердца в семье (у родственников первого поколения мужчин в возрасте <55 лет, женщин <65 лет), и возраст >45 лет для мужчин и >55 лет для женщин.
*** См. заглавие табл., стр.
положение основано прежде всего на результатах проспективного, рандомизированного, многоцентрового, двойного слепого исследования MIRACL (уменьшение ишемии миокарда агрессивным снижением холестерина). В нем изучались эффекты применения одного из активных статинов аторвастатина в дозе 80 мг/сут с первых дней госпитализации (в пределах 96 ч) по поводу ОКС без подъемов ST. Аторвастатин или плацебо добавлялись к стандартной терапии на 16 недель. В процессе исследования в контрольной группе уровни ХС и ХС ЛНП не изменились, тогда как в группе аторвастатина произошло их выраженное снижение - до 3,8 и 1,86 ммоль/л (средние величины) соответственно. Это сопровождалось уменьшением частоты возникновения первичной комбинированной конечной точки (смерти от всех причин, нефатальные инфаркты миокарда, эпизоды остановки сердца с оживлением, эпизоды повторной ИМ с ее объективными признаками, требующие срочной регоспитализации через 4 мес) на 16%. Наибольшее действие аторвастатин оказал на частоту случаев ухудшения стенокардии, сопровождавшейся объективными признаками ишемии миокарда. Относительный риск такого события в группе аторвастатина по отношению к группе плацебо составил 0,74 (р = 0,02). Впоследствии данные MIRACL были подтверждены результатами крупного испытания PROVE-it, в котором была продемонстрирована большая эффективность более выраженного снижения уровня ХСЛНП, достигнутого с помощью максимальной дозы аторвастатина по сравнению со снижением его до «старых» целевых значений при применении стандартной дозы другого статина - правастатина.
Применение аторвастатина в MIRACL и PROVE-it (т.е. в высокой дозе, независимо от исходного уровня ХС ЛНП и при довольно низком его среднем исходном уровне) оказалось достаточно безопасным. Повышение печеночных трансаминаз (>3 верхних границ нормы в 2 анализах) в MIRACLе отмечено у 2,5 и 0,6% больных групп аторвастатина и плацебо соответственно. Признаков миозита, сопровождавшихся выраженным повышением уровня КФК (>10 верхних границ нормы в 2 анализах) не отмечено ни в одном случае. Установленная в проведенных испытаниях безопасность активного гиполипидемического вмешательства при ОКС БП ST и неповышенном исходном ХС ЛНП сама по себе имеет очень большое значение. Как известно, только небольшая часть больных КБС, которым показан прием статина, действительно принимает один из препаратов этой группы.
Эффективность же статинов при длительном применении настолько велика, что больной, не принимающий эти средства, лишает себя реального шанса снизить вероятность наступления не только осложнения КБС, но и преждевременной смерти от любой причины. С другой стороны, как уже отмечено выше, назначение лекарства в период госпитализации по поводу обострения заболевания значительно повышает приверженность к нему (compliance) больного.
Данные опубликованных недавно (2006 г.) метаанализов показали, что влияние препаратов, примененных вскоре после развития ОКС (в первые 14 дней), может сказаться на вероятности возникновения таких событий, как сердечно-сосудистая смерть и инфаркт миокарда не ранее чем после 4 мес приема. Соответственно, нет необходимости стремиться к использованию статина в первые дни обострения ОКС, важно только начать его в период госпитализации.
У больных с острым коронарным синдромом уже в стационаре целесообразно начать лечение статинами для уменьшения риска смерти и осложнений КБС.
Ингибиторы ангиотензин-превращающего фермента
Есть основания считать, что определенную роль во вторичной профилактике ОКС могут играть ингибиторы АПФ. Данные исследований HOPE и EUROPA, в которых применялись, соответственно, рамиприл и периндоприл в высоких дозах, показывают, что при относительно длительном применении эти средства могут уменьшать риск возникновения основных коронарных событий (сердечно-сосудистая смерть, ИМ, остановка сердца) и у больных КБС без признаков недостаточности кровообращения. Следует однако учитывать, что эти исследования не планировались для изучения действия ингибиторов АПФ непосредственно после ОКС БП ST, а в EUROPA таких больных вообще не было.
Необходимость внедрения методов быстрой оценки риска
Применение многих методов лечения оправдано у больных с высоким риском развития осложнений - именно у них эти методы способны оказать положительное действие. Среди методов оценки риска одно из первых мест занимает определение сердечных тропонинов. Такие антитромботические вмешательства, как НМГ и антагонисты ГП IIb/IIIa тромбоцитов, эффективны именно у больных с повышенными
уровнями тропонинов (это не относится к применению клопидогреля, который улучшил результаты использования только аспирина как при повышении содержании тропонинов в крови, так и без него). Именно у больных с повышенными уровнями тропонинов (т.е. у больных ИМ БП ST) более эффективна ранняя инвазивная стратегия. Определение уровней тропонинов, таким образом, позволяет выявить больных, которым действительно требуется активное дорогостоящее вмешательство. В повседневной практике врачам часто приходится ограничиваться общеклиническими маркерами риска, такими, как возраст, длительность болевого приступа, эффект антиангинальной терапии, характер изменений ЭКГ, наличие признаков сердечной недостаточности и/или аритмий и т.д. Однако правильная оценка и
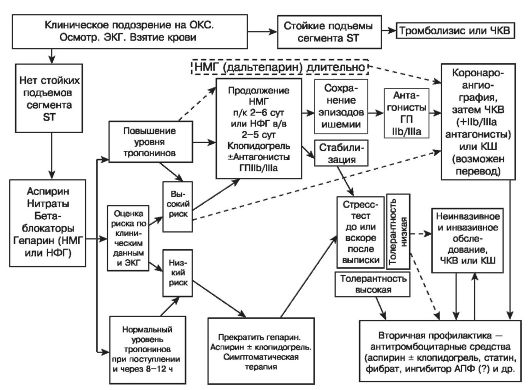 Рис. 16.21. Последовательность лечебных и диагностических действий у больных с подозрением на развитие ОКС
Рис. 16.21. Последовательность лечебных и диагностических действий у больных с подозрением на развитие ОКС
этих данных позволяет определить показания к активному вмешательству, которое, как правило, оказывает лучшее действие именно у больных с повышенным риском развития осложнений.
заключение
Антитромботическая терапия больных ОКС БП ST с реальным риском развития коронарных осложнений (крупноочаговый инфаркт миокарда, смерть) должна включать в себя аспирин, клопидогрель и гепарин (НФГ или НМГ). Сведения о равной с НФГ эффективности препаратов НМГ являются основанием для того, чтобы в клинической практике оказать предпочтение этим, несомненно, более удобным для применения, средствам. Потенциальные возможности НФГ по-прежнему велики, но для полного их использования врачи должны прилагать значительные усилия и осваивать способы правильного дозирования препарата. Данные о некотором превосходстве фондапаринукса по сравнению с НМГ эноксапарином позволяют предполагать, что вскоре это средство займет место в первом ряду антитромботических вмешательств при ОКС БП ST.
Область применения антагонистов ГППЬ/Ша ограничена. Очевидно, целесообразно включение препаратов этой группы в комплекс антитромботического сопровождения ЧКВ у больных высокого риска. Кроме того, в различных действующих руководствах по лечению ОКС БП ST сохраняется рекомендация применять препаратыантагонисты ГППЬ/Ша при неэффективности двойной антитромбоцитарной терапии (аспирин + клопидогрель), т.е. при сохраняющихся эпизодах ишемии миокарда и вне инвазивных вмешательств.
Инвазивные методы лечения (ЧКВ или КШ) предпочтительно применять у больных, стабилизированных медикаментозными средствами. Экстренные (в первые 12-48 ч) инвазивные вмешательства в случаях, когда стабилизация не достигается максимальной медикаментозной терапией или при очень высоком риске, оправданы в учреждениях с достаточным объемом плановых процедур.
В период госпитализации больных с ОКС без подъемов ST целесообразно начать применение одного из хорошо изученных препаратов группы статинов (аторвастатин, правастатин, симвастатин).
Последовательность лечебных и диагностических мероприятий у больных с подозрением на развитие острого коронарного синдрома показана на рис. 16.21, на котором представлен алгоритм из Рекомендаций Всероссийского научного общества кардиологов
(2004 г.).